

















Preview text:
CHUYÊN ĐỀ: NGUYÊN TỐ NHÓM IA A. TÓM TẮT LÝ THUYẾT
I. Đơn chất kim loại nhóm IA
1. Vị trí, cấu tạo của nguyên tố IA.
Nhóm IA bao gồm các kim loại: lithium (Li), sodium (Na), potassium (K), rubidium
(Rb), caesium (Cs) và francium (Fr). Những kim loại này còn được gọi là kim loại kiềm.
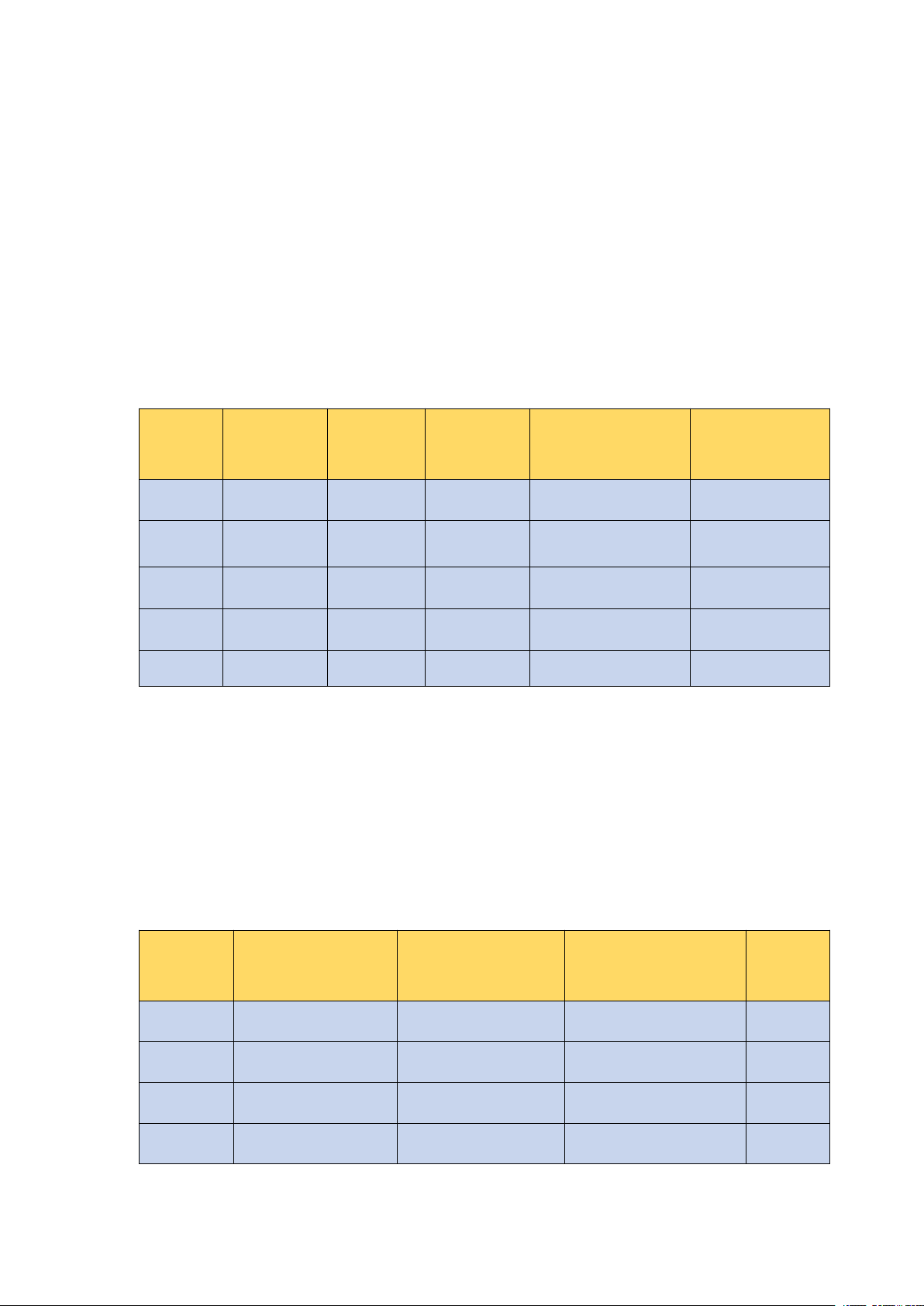
Cấu hình electron lớp ngoài cùng là ns1 Nguyên Số hiệu Cấu hình Bán kính Thế điện cực Tên gọi tử nguyên tử electron nguyên tử (pm) chuẩn (V) Li 3 Lithium [He]2s1 152 -3,040 Na 11 Sodium [Ne]3s1 186 -2,713 K 19 Potassium [Ar]4s1 227 -2,924 Rb 37 Rubidium [Kr]5s1 248 -2,924 Cs 55 Caesium [Xe]6s1 265 -2,923
2. Trạng thái tự nhiên
Kim loại nhóm IA trong tự nhiên chỉ tồn tại ở dạng hợp chất.
Sodium thường gặp dưới dạng NaCl (muối ăn trong nước biển, mỏ muối, khoáng vật
halite), Na2CO3.10H2O (soda), NaNO3 (diêm tiêu).
Potassium thường gặp ở dạng khoáng vật: KCl.NaCl (sylvinite), KCl.MgCl2.6H2O (carnallite
3. Tính chất vật lí (Dữ liệu được lấy ở bảng 17.1 SGK Cánh diều trang 114) Nhiệt độ nóng Khối lượng riêng
Nhiệt độ sôi (°C) Kim loại chảy (°C) (g/ cm3) Độ cứng Li 180 1330 0,53 0,6 Na 98 890 0,97 0,5 K 64 774 0,86 0,4 Rb 39 688 1,53 0,3 Cs 29 690 1,90 0,2
3.1. Nhiệt độ nóng chảy và nhiệt độ sôi
Trong nhóm IA, nhiệt độ nóng chảy và nhiệt độ sôi của các kim loại có xu hướng
giảm dần từ Li đến Cs.
Các kim loại nhóm IA đều dễ nóng chảy và có nhiệt độ nóng chảy thấp hơn so với các kim loại nhóm khác. 3.2. Khối lượng riêng
Các kim loại nhóm IA có khối lượng riêng nhỏ (đều là kim loại nhẹ) do có bán kính
nguyên tử lớn và cấu trúc mạng tinh thế kém đặc khít. 3.3. Độ cứng
Do có liên kết kim loại yếu nên các kim loại nhóm IA có độ cứng thấp (đều mềm, có thể cắt bằng dao, kéo). Chú ý:
Ở điều kiện thường, tất cả các kim loại kiềm đều có cùng kiểu mạng tinh thể lập phương tâm khối. 4. Tính chất hóa học
Do kim loại kiềm có giá trị E0M+/M rất nhỏ nên chúng có tính khử mạnh M → M+ + e
Trong nhóm IA, tính khử các kim loại kiềm tăng từ lithium đến caesium (Li đến Cs)
4. 1. Tác dụng với oxygen
Khi đốt nóng trong không khí, kim loại Li cháy với ngọn lửa màu đỏ tía; Na cháy với
ngọn lửa màu vàng; K cháy với ngọn lửa màu tím nhạt.
Ví dụ: Sodium tác dụng với oxygen trong không khí, có thể tạo ra sodium oxide. 4Na + O2 → 2Na2O
Phản ứng xảy ra mãnh liệt hơn trong bình chứa khí oxygen, mức độ phản ứng tăng dần từ Li đến
4.2. Tác dụng với halogen
Kim loại nhóm IA phản ứng với chlorine ở điều kiện thường tạo thành muối chloride. 2M + Cl2 → 2MCl
Kim loại Li cần đun nhẹ, Na và K bốc cháy mạnh trong khí chlorine. 2K + Cl2 → 2KCl
Mức độ mãnh liệt của phản ứng tăng dẩn từ Li đến K.
4. 3. Tác dụng với nước
Khi tác dụng với nước, Li nổi trên mặt nước, Na nóng chảy thành hạt cầu và chạy trên
mặt nước, K tự bùng cháy. Khả năng phản ứng của kim loại nhóm IA với nước tăng dần từ Li đến Cs
Thế điện cực chuẩn của kim loại nhóm IA rất nhỏ. Kim loại nhóm IA tác dụng mạnh
với nước tạo thành dung dịch kiểm và giải phóng khí hydrogen:
2M(s) + 2H2O(l) → 2MOH(aq) + H2(g)∆rH°98 < 0
Chú ý bảo quản kim loại nhóm IA
Kim loại nhóm IA dễ tác dụng với nước, với oxygen trong không khí nên trong
phòng thí nghiệm Na và K thường được bảo quản trong dầu hoả. Li, Rb và Cs
thường được bảo quản trong các ống thuỷ tinh kín hoặc môi trường khí hiếm (như argon).
II. HỢP CHẤT CỦA KIM LOẠI NHÓM IA 1. Đặc điểm chung
Các hợp chất của kim loại nhóm IA thường dễ tan trong nước và tạo thành dung
dịch chất điện li mạnh.
Ở nhiệt độ thường, các ion kim loại nhóm IA đều không có màu. Tuy nhiên, đốt
nóng kim loại nhóm IA hoặc các hợp chất của chúng trên ngọn lửa không màu làm
ngọn lửa có màu đặc trưng.
Do vậy, có thể nhận biết hợp chất của kim loại nhóm IA bằng màu ngọn lửa.
2. Một số hợp chất quan trọng 2.1. Sodium chloride a) Ứng dụng:
Trong đời sống: gia vị, bảo quản và chế biến thực phẩm,. .
Trong y học: nước muối sinh lí, chất điện giải,. .
Trong công nghiệp hoá chất: sản xuất chlorine - nhóm IA, nước Javel, soda,. .
b) Điện phân dung dịch sodium chloride:
Trong công nghiệp chlorine - nhóm IA, quá trình điện phân dung dịch NaCl bão hoà
có màng ngăn điện cực được ứng dụng để sản xuất xút công nghiệp (NaOH), khí chlorine (Cl2).
Điện phân dung dịch NaCI bão hoà không có màng ngăn điện cực được ứng dụng để
sản xuất nước Javel (chứa NaClO).
+ Ở cực âm (cathode) xảy ra quá trình khử: 2H2O + 2e → H2 + 2OH-
+ Ở cực dương (anode) xảy ra quá trình oxi hoá: 2Cl- → Cl2 + 2e
Phương trình hoá học của phản ứng điện phân:
2NaCl + 2H2O đpddcómàngngăn
2NaOH + H2 + Cl2
Màng ngăn để ngăn cực âm với cực dương, do vậy không xảy ra phản ứng giữa Cl2 và NaOH.
Các sản phẩm của công nghiệp chlorine - kiềm có nhiều ứng dụng:
Sodium hydroxide: Được dùng trong chế biến dầu mỏ, sản xuất nhôm,
giấy,xà phòng và nhiều hoá chất khác.
Chlorine: Được dùng để sản xuất chất tẩy trẳng và sát trùng; sản xuất
hydrochloric acid, potassium chlorate,. .
Hydrogen: Được dùng đề sản xuất hydrochloric acid, ammonia,. .
2.2. Sodium hydrogencarbonate (NaHCO3)
Sodium hydrogencarbonate (hay sodium bicarbonate, NaHCO3) còn được gọi là
baking soda, là chất rắn màu trắng, bền ở nhiệt độ thường, bị phân huỷ khi đun nóng. 2NaHCO o t 3 Na2CO3 + CO2 + H2O
NaHCO3 có thể tác dụng được với dung dịch acid và dung dịch kiềm:
NaHCO3 + HCl → NaCl + H2O + CO2 NaHCO3 + NaOH → Na2CO3 + H2O Ứng dụng:
Trong y học, NaHCO3 được sử dụng để làm giảm chứng đau dạ dày do dư acid,
điều trị các triệu chứng viêm loét dạ dày hoặc tá tràng
Trong kĩ thuật xử lí nước, NaHCO3 được sử dụng để điều chỉnh pH khi nước dư acid (H+).
NaHCO3 được sử dụng trong chế biến thực phẩm, trong sản xuất thuỷ tinh
2.3. Sodium carbonate (Na2CO3)
Sodium carbonate (Na2CO3) được gọi là soda, là chất rắn màu trắng, dễ tan trong nước.
Na2CO3, bị thuỷ phân trong dung dịch cho môi trường kiềm: Na2CO3 → 2Na+ + CO32− CO32− + H2O OH- + HCO3- Ứng dụng:
Soda được sử dụng để tẩy rửa dầu, mỡ bám trên các dụng cụ, thiết bị.
Soda thường được dùng để làm mềm nước cứng.
Soda nguyên liệu quan trọng trong sản xuất thuỷ tinh, giấy và nhiều hoá chất khác.
Soda còn được sử dụng thay cho soidum hydroxide trong sản xuất xà phòng từ chất béo. 2.4. Phương pháp Solvay
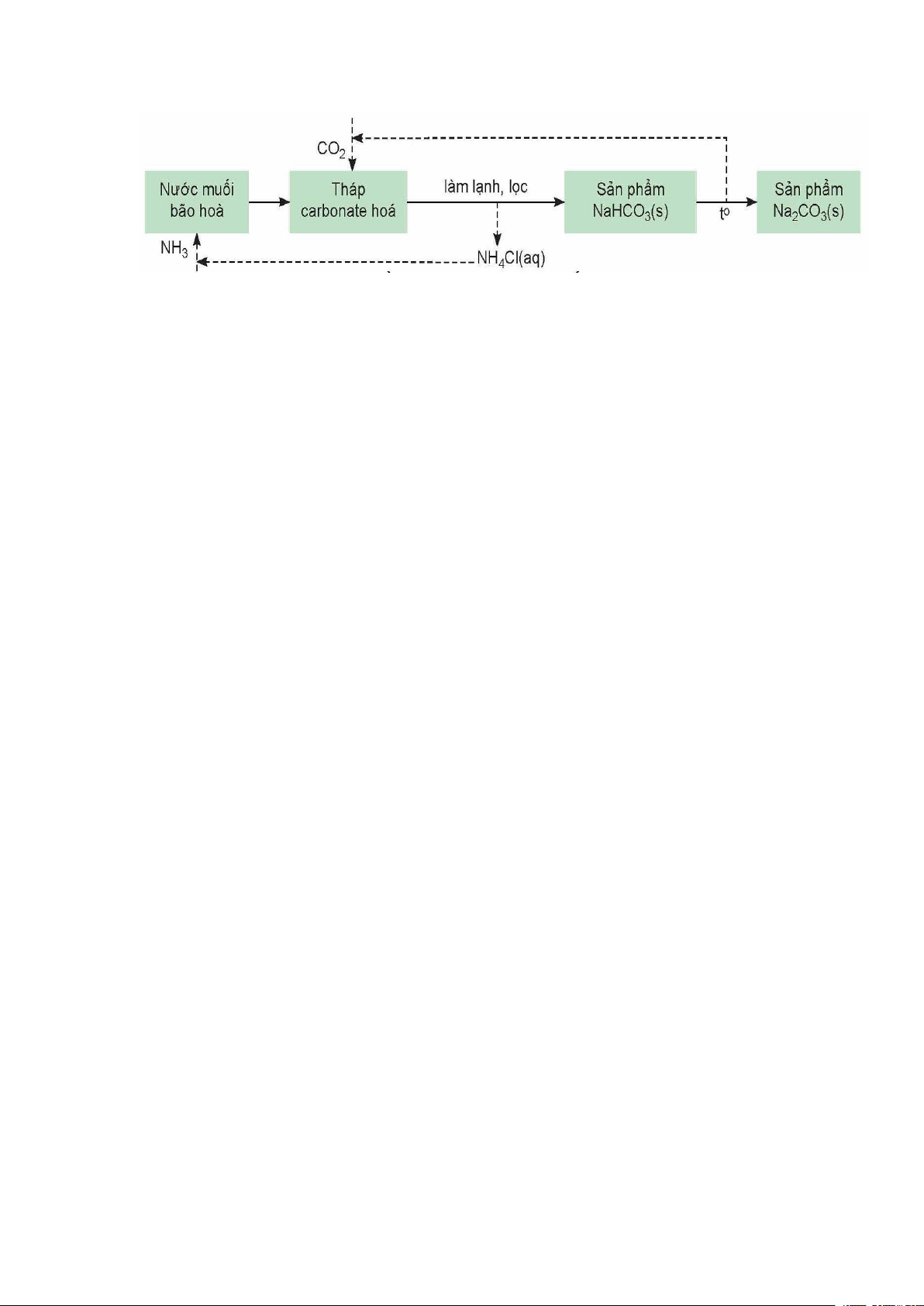
Phương pháp Solvay (mang tên nhà hoá học Ernest Solvay) sử dụng nguồn nguyên
liệu dễ tìm trong tự nhiên là muối ăn (NaCl), đá vôi (CaCO3) và ammonia (NH3). Quá trình cụ thể:
(1) Hoà tan NaCl vào dung dịch NH3 đặc đến bão hoà.
(2) Nung CaCO3 rồi dẫn khí thoát ra vào dung dịch bão hoà của NaCl trong NH3: CaCO o t 3 CaO + CO2
NaCl + NH3 + CO2 + H2O →NaHCO3 + NH4Cl
(3) Do NaHCO3 ít tan hơn các muối khác nên kết tinh trước. Tách NaHCO3 khỏi
dung dịch, nung ở nhiệt độ cao, thu được soda: 2NaHCO o t Na2CO3 + CO2 + H2O
(4) Sản phẩm NH4Cl được chế hoá với vôi tôi, thu khí NH3:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
Các khí CO2, NH3 được đưa vào sử dụng lại. NH3 được tuần hoàn trong quá trình sản
xuất, phương pháp này còn gọi là phương pháp tuần hoàn ammonia.
Phương pháp Solvay theo sơ đồ sau B. CÂU HỎI BÀI TẬP
I. CÂU HỎI TRẮC NGHIỆM KHÁCH QUAN A, B, C, D.
Câu 1. Công thức chung của oxide kim loại thuộc nhóm IA là A. X2O3. B. XO2. C. X2O. D. XO.
Câu 2. Để bảo quản kim loại Na trong phòng thí nghiệm, người ta bảo quản bằng
cách ngâm trong chất lỏng nào sau đây? A. Nước. B. Dầu hỏa. C. Giấm ăn. D. Cồn.
Câu 3. Trong hợp chất, các kim loại nhóm IA có số oxi hóa là A. +1. B. +2. C. +4. D. +3.
Câu 4. Sodium phản ứng với chlorine sinh ra sản phẩm nào sau đây? A. KCl. B. NaCl. C. NaClO. D. NaOH.
Câu 5. Chất nào sau đây tác dụng với dung dịch KHCO3 sinh ra khí CO2? A. HCl. B. NaNO3. C. KNO3. D. NaCl.
Câu 6. Dung dịch Na2CO3 tác dụng được với dung dịch nào sau đây? A. Na2SO4. B. KNO3. C. KOH. D. CaCl2.
Câu 7. Na2CO3 là hóa chất quan trọng trong công nghiệp sản xuất thủy tinh, bột
giặt, phẩm nhuộm, giấy, sợi. Tên của Na2CO3 là A. sodium carbonate. B. sodium carbide. C. sodium carbon.
D. sodium hydrogencarbonate.
Câu 8. Chất nào sau đây không tác dụng với dung dịch KOH? A. FeCl2. B. CuSO4. C. MgCl2. D. NaNO3.
Câu 9. Các kim loại nhóm IA ở trạng thái cơ bản có số electron ở lớp ngoài cùng là A. 2. B. 1. C. 3. D. 4.
Câu 10. Tro thực vật được sử dụng như một loại phân bón cung cấp nguyên tố
potassium cho cây trồng do chứa muối potassium carbonate. Công thức của potassium carbonate là A. KCl. B. KOH. C. NaCl D. K2CO3.
Câu 11. Sodium chloride được dùng để làm gia vị thức ăn, điều chế sodium, xút,
nước Ja-ven. Công thức của sodium chloride là A. Na2CO3. B. NaCl. C. NaHCO3. D. KCl.
Câu 12. Sodium hydroxide (hay xút ăn da) là chất rắn, không màu, dễ nóng chảy,
hút ẩm mạnh, tan nhiều trong nước và tỏa ra một lượng nhiệt lớn. Công thức của sodium hydroxide là A. NaOH. B. Ca(OH)2. C. NaHCO3. D. Na2CO3.
Câu 13. Chất nào sau đây không phản ứng với dung dịch NaOH? A. Cl2. B. Al. C. CO2. D. CuO.
Câu 14 . Kim loại nào sau đây tác dụng với H2O (dư) tạo thành dung dịch kiềm? A. Hg. B. Fe. C. Na. D. Cu.
Câu 15. Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy? A. Na. B. Cu. C. Ag. D. Fe.
Câu 16. Nhận biết hợp chất của sodium bằng phương pháp :
A. tạo ra hợp chất kết tủa. B. tạo ra bọt khí.
C. dựa vào sự thay đổi màu sắc của các chất.
D. thử màu ngọn lửa.
Câu 17. Khi cho một mẫu sodium có hình dạng bất kì vào chậu nước có pha thêm
vài giọt quỳ tím. Hiện tượng nào không xảy ra trong thí nghiệm này?
A. Mẫu sodium trở nên có dạng hình cầu.
B. Dung dịch thu được làm quỳ tím hoá hồng.
C. Trong quá trình phản ứng, mẫu sodium chạy trên mặt nước.
D. Viên natri bị nóng chảy và nổi trên mặt nước.
Câu 18. Cho potassium tác dụng với chlorine, tạo thành chất nào sau đây? A. NaCl. B. KOH. C. NaOH. D. KCl
Câu 19. Kim loại nào sau đây tan trong nước ở điều kiện thường? A. Cu. B. Ag. C. K. D. Mg.
Câu 20. Kim loại potassium tác dụng với nước, tạo ra khí H2 và chất nào sau đây? A. KO2. B. KOH. C. K2O2. D. KH.
Câu 21. Sodium hydrocarbonate được dùng làm bột nở, thuốc giảm đau dạ dày do
thừa acid. Công thức của sodium hydrocarbonate là: A. NaHCO3 B. Na2CO3. C. CaCO3. D. NaNO3.
Câu 22. Chọn thứ tự giảm dần độ hoạt động hóa học của các kim loại kiềm.
A. Na - K- Cs - Rb - Li.
B. Li – Na - K – Rb - Cs.
C. K - Li - Na - Rb – Cs
D. Cs – Rb - K - Na - Li.
Câu 23. Khi nói về kim loại kiềm, phát biểu nào sau đây là sai?
A. Các kim loại kiềm có màu trắng bạc và có ánh kim.
B. Trong tự nhiên, các kim loại kiềm chỉ tồn tại ở dạng hợp chất.
C. Từ Li đến Cs khả năng phản ứng với nước giảm dần.
D. Kim loại kiềm có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Câu 24. Phát biểu nào sau đây là sai khi nói về 2 muối NaHCO3 và Na2CO3?
A. Cả 2 muối đều dễ bị nhiệt phân.
B. Cả 2 muối đều tác dụng với axit mạnh giải phóng khí CO2.
D. Cả 2 muối đểu có thể tác dụng với dung dịch Ca(OH)2 tạo kết tủa.
Câu 25. Đặc điểm nào sau đây không là đặc điểm chung cho các kim loại nhóm IA?
A. Số electron lớp ngoài cùng là 1.
B. Số oxi hóa trong hợp chất là + 1.
C. Các kim loại kiềm có màu trắng bạc và có ánh kim.
D. Từ Li đến Cs khả năng phản ứng với nước giảm dần.
Câu 26. Cho các hydroxide: KOH, Cu(OH)2, Fe(OH)3, Al(OH)3. Hydroxide có tính base mạnh nhất là A. Al(OH)3. B. KOH. C. Cu(OH)2. D. Fe(OH)3.
Câu 27. Cấu hình electron của nguyên tố R là 1s22s22p63s23p64s1. Vậy R có đặc điểm:
A. Là nguyên tố thuộc chu kì 4, nhóm IA. B. Là nguyên tố cuối cùng của chu kì 4.
C. Là một kim loại có tính khử yếu.
D. Là nguyên tố có nhiều trong tự nhiên.
Câu 28. Chất nào sau đây gọi là xút ăn da? A. NaOH B. NaNO3. C. NaHCO3. D. Na2CO3.
Câu 29. Phản ứng nhiệt phân không đúng là A. 2KNO o t o t 3 2KNO2 + O2.
B. NH4NO2 N2 + 2H2O. C. NH o t 4Cl o t NH3 + HCl.
D. NaHCO3 NaOH + CO2.
Câu 30. Dung dịch Na2CO3 tác dụng được với dung dịch nào sau đây? A. Na2SO4. B. CaCl2. C. ΚΝΟ3. D. КОН.
Câu 31. Cho dãy các chất sau: Fe, Al, KNO3, FeCl3. Số chất trong dãy tác dụng được với dung dịch NaOH là A. 1. B. 2. C. 4. D. 3.
Câu 32. Dẫn hỗn hợp khí gồm CO2, O2, N2 và H2 qua dung dịch NaOH. Khí bị hấp thụ là A. CO2. B. O2. C. H2. D. N2.
Câu 33. Sản lượng NaOH hàng năm trên thế giới đạt khoảng 31.000.000 tấn. Trong
công nghiệp, người ta điều chế NaOH bằng cách điện phân dung dịch muối ăn bão
hòa, giữa 2 điện cực có vách ngăn xốp. Sản phẩm khí của quá trình điện phân là A. H2. B. H2, Cl2. C. O2. D. Cl2.
Câu 34. NaHCO3 là hợp chất kém bền nhiệt, nó bắt đầu bị phân hủy ở khoảng 1200.
Trong thực tế dùng NaHCO3 làm bột nở trong chế biến thực phẩm. Sản phẩm quá
trình nhiệt phân NaHCO3 là A. Na2CO3, CO2, H2O. B. Na2O, Na2CO3, H2. C. Na, CO2, H2. D. Na2CO3, C, H2.
Câu 35. Khí SO2 sinh ra từ việc đốt các nhiên liệu hóa thạch, các quặng sulfide; là
một trong các chất gây ô nhiễm môi trường và gây mưa acid. Trong phòng thí nghiệm,
để hạn chế việc thất thoát SO2 ra ngoài môi trường, người ta dùng bông tẩm dung
dịch chất nào sau đây để nút miệng ống nghiệm? A. NaCl. B. KCl. C. H2SO4. D. NaOH.
Câu 36. Cho 3,36 gam hỗn hợp gồm K và một kim loại kiềm A vào nước thấy thì
thu được 1,9832 lít H2 (đkc). Thành phần phần trăm về khối lượng của A trong hỗn hợp là: A. 18,75 %. B. 10,09 %. C. 13,13 %. D. 55,33 %. Hướng dẫn trả lời
nH2 = 1,9832 : 24,79 = 0,08 mol
Gọi công thức chung của 2 kim loại đó là X Ta có: 2X + 2H2O 2XOH + H2 0,16 0,08 (mol) MX = 3,35:0,16 = 21 gam/mol
Li (M = 7) < 21 < K (M = 39) ⇒ Kim loại cần tìm là Li
Gọi x, y lần lượt là số mol của Li và K trong hỗn hợp
x y 0,16 x 0,09 7x 39y 3,36 y 0,07 0,09.7 %m Li .100% 18,75% 3,36
Câu 37: Trong y học, dược phẩm Nabica (NaHCO3) thường được chỉ định cho người
đau dạ dày nhằm mục đích giảm bớt lượng hydrochloric acid dư thừa trong dạ dày.
Tính thể tích dung dịch hydrochloric acid 0,035 M (nồng độ acid trong dạ dày) được
trung hòa sinh ra khi uống 0,336 gam NaHCO3. A. 0,057 . B. 0,043. C. 0,2286. D. 0,1143. Hướng dẫn trả lời nNaHCO3 = 0,004 mol Phương trình phản ứng
NaHCO3 + HCl NaCl + CO2 + H2O 0,004 0,004 (mol)
VHCl 0,035M = 0,004 : 0,035 = 0,1143 L
Câu 38: Làm muối là nghề phổ biến tại nhiều vùng ven biển ở Việt Nam. Một hộ gia
đình tiến hành làm muối trên ruộng chứa 200 000 L nước biển. Giả thiết 1 L nước
biển có chứa 30 gam NaCl và hiệu suất quá trình làm muối thành phẩm đạt 60%. Khối
lượng muối hộ gia đình thu được là: A. 1200 kg. B. 3600 kg. C. 6000 kg. D. 10000 kg. Hướng dẫn giải
Khối lượng muối 1 hộ gia đình thu được là:
mNaCl = 20000 .30.60% = 3 600 000 gam = 3 600 kg
Câu 39. Hoà tan hoàn toàn 6,645 gam hỗn hợp muối chlorinerua của hai kim loại
kiềm thuộc hai chu kì kế tiếp nhau vào nước được dung dịch X. Cho toàn bộ dung
dịch X tác dụng hoàn toàn với dung dịch AgNO3 (dư), thu được 18,655 gam kết tủa.
Hai kim loại kiềm trên là: A. Na và K. B. Rb và Cs. C. Li và Na. D. K và Rb Hướng dẫn giải
Đặt công thức chung của hỗn hợp muối chlorinerua của 2 kim loại kiềm là MCl Số mol của AgCl = 0,13 mol
Phương trình phản ứng tổng quát MCl + AgNO3 AgCl + MNO3 0,13 0,13 (mol) Theo đề bài ta có:
M + 35,5 = 6,645:0,13 M = 15,62 gam/mol
Vậy ta có Li (M = 7) < 15,62 < Na (M = 23) ⇒ Kim loại cần tìm là Li và Na
CÂU HỎI TRẮC NGHIỆM SBT
Câu 41. [CTST - SGK] Phương pháp điều chế NaOH trong công nghiệp là?
A. Cho kim loại Na tác dụng với nước.
B. Cho Na2O tác dụng với nước.
C. Điện phân dung dịch NaCl bão hoà có màng ngăn.
D. Điện phân dung dịch NaCl bão hoà, không có màng ngăn.
Câu 42. [CTST - SBT] Nguyên tử của các nguyên tố nhóm IA khác nhau về
A. số electron lớp ngoài cùng của nguyên tử
B. cấu hình electron nguyên tử
C. số oxi hóa của nguyên tử trong hợp chất
D. kiểu mạng tinh thể của đơn chất
Câu 43. [CTST - SBT] Theo chiều tăng dần của điện tích hạt nhân nguyên tử, sự biến
đổi tính chất của các nguyên tố nhóm IA nào sau đây đúng?
A. Bán kính nguyên tử giảm dần.
B. Nhiệt độ nóng chảy tăng dần.
C. Độ cứng giảm dần.
D. Khối lượng riêng của đơn chất giảm dần.
Câu 44. [CTST - SBT] Công thức chung của oxide kim loại nguyên tố nhóm IA là A. R2O3 B. RO2 C. R2O D. RO
Câu 45. [CTST - SBT] Cation M+ có cấu hình electron lớp ngoài cùng là 2s22p6. Biết
Li (Z=7); Na (Z=11); K (Z=19). Cation M+ là A. Rb+ B. Na+ C. Li+ D. K+
Câu 46. [CTST - SBT] Cho các dãy kim loại sau: Fe, Na, K, Cu và Li. Số kim
loại trong dãy tác dụng được với nước ở nhiệt độ thường là A. 1 B. 2 C. 3 D. 4
Câu 47. [CTST - SBT] Nước Javen là sản phẩm của quá trình
A. sục khí chlorine vào vôi sữa
B. cho dung dịch NaOH loãng tác dụng với khí chlorine
C. điện phân dung dịch NaOH có màng ngăn giữa hai điện cực
D. điện phân nóng chảy NaOH không có màng ngăn
Câu 48. [CTST - SBT] Phương pháp điều chế NaOH trong công nghiệp là
A. Cho kim loại Na tác dụng với nước: 2Na + 2H2O → 2NaOH + H2↑
B. Cho Na2O tác dụng với nước: Na2O + H2O → 2NaOH
C. Điện phân dung dịch NaCl bão hòa có màng ngăn: 2NaCl + 2H dpdd màngngan 2O / 2NaO + H2 + Cl2
D. Điện phân dung dịch NaCl 20% không có màng ngăn: 2NaCl + 2H2O đpdd 2NaOH + H2↑ + Cl2↑
Câu 49. [CTST - SBT] Cho sơ đồ phản ứng: NaCl → X → NaHCO3 → Y → NaNO3
Chất X và Y phù hợp có thể là A. NaOH và Na2CO3 B. NaOH và NaClO C. Na2CO3 và NaClO D. NaClO3 và Na2CO3 Hướng dẫn trả lời
Chất X, Y phù hợp tương ứng là NaOH và Na2CO3 2NaCl + 2H dpdd màngngan 2O /
2NaOH + H2 + Cl2 NaOH + CO2 → NaHCO3 NaHCO3 + NaOH → Na2CO3 + H2O
Na2CO3 + Ca(NO3)2 → 2NaNO3 + CaCO3
Câu 50. [CTST - SBT] Cho a mol CO2 vào dung dịch chứa b mol NaOH, dung
dịch thu được chứa muối Na2CO3 và NaHCO3. Giá trị của a và b trong trường hợp nào sau đây là đúng? A. a > b B. a < b < 2a C. b > 2a D. a = b Hướng dẫn trả lời
Phương trình hóa học của phản ứng: CO2 + NaOH → NaHCO3 (1)
CO2 + 2NaOH → Na2CO3 + H2O (2)
Theo phương trình (1), khi số mol CO2 bằng mol NaOH, tạo muối NaHCO3
Theo phương trình (2), khi số mol CO2 bằng 1/2 mol NaOH, tạo muối Na2CO3
Để dung dịch thu được cả 2 muối Na2CO3 và NaHCO3 thì a < b < 2a.
Câu 51. [CTST - SBT] Cho 0,53 gam muối carbonate của kim loại nhóm IA tác
dụng với dung dịch HCl, thu được 1223,95 mL khí CO2 (đkc). Công thức của muối là A. Na2CO3 B. NaHCO3 C. KHCO3 D. K2CO3 Hướng dẫn trả lời
Phương trình hóa học:
M2CO3 + 2HCl → 2MCl + CO2 + H2O Ta có 0,12395 n mol CO 0,005 2 24,79
→ Dựa vào phương trình ta có nCO2 = nM2CO3 = 0,05 mol
→ MM2CO3 = 0,53 : 0,005 = 106 gam/mol → M = 23
Côn thức của muối là Na2CO3
Câu 52. [CTST - SBT] Cho dãy các kim loại: Li, Na, Al, Ca, K và Rb. Số kim loại kiềm trong dãy là A. 1. B. 2. C. 3. D. 4.
Câu 53. [CTST - SBT] Cách nào sau đây không thu được NaOH sau phản ứng?
A. Điện phân dung dịch NaCl không có màng ngăn xốp.
B. Cho kim loại Na tác dụng với nước.
C. Điện phân dung dịch NaCl có màng ngăn xốp, điện cực trơ.
D. Cho dung dịch Ca(OH)2 tác dụng với dung dịch Na2CO3.
Câu 54. [CTST - SBT] Kim loại không phản ứng với nước ở nhiệt độ thường là A. Be. B. Ca. C. Li. D. K.
Câu 55. [CTST - SBT] Trong các kim loại sau, kim loại nào có tính khử mạnh nhất? A. K. B. Al. C. Mg. D. Na.
Câu 56. [KNTT – SBT] Ở trạng thái cơ bản nguyên tử ca có cấu hình electron là
[Ar]4s1. Trong bảng tuần hoàn, nguyên tố K thuộc nhóm. A. IIIA. B. IA. C. IVA. D. IIA.
Câu 57. [KNTT – SBT] Khi tham gia phản ứng hóa học, mỗi nguyên tử kim loại
nhóm IA đều thể hiện khuynh hướng
A. Nhường 2 electron. B. Nhận 2 electron. C. Nhận 1 electron.
D. Nhường 1 electron.
Câu 58. [KNTT – SBT] Ở điều kiện thường các tinh thể kim loại nhóm IA đều có kiểu cấu trúc.
A. Lập phương tâm khối.
B. Lập phương tâm mặt. C. Lục phương.
D. Lập phương đơn giản
Câu 59. [KNTT – SBT] Nhiệt độ nóng chảy của các kim loại nhóm IA từ Li đến
Cs biến đổi như thế nào? A. Tăng dần. B. Không đổi.
C. Không có quy luật. D. Giảm dần.
Câu 60. [KNTT – SBT] Ở điều kiện thường kim loại có khối lượng riêng, nhỏ nhất là. A. K. B. Rb. C. Li. D. Na.
Câu 61. [KNTT – SBT] Hợp hợp kim nào sau đây có nhiệt độ nóng chảy thấp
(~70oC), dễ hóa lỏng nên được dùng làm chất dẫn nhiệt trong một số lò phản ứng hạt nhân? A. Fe – C. B. Na – K. C. Al – Mg. D. Au – Ag.
Câu 62. [KNTT – SBT] Nhận định nào sau đây về kim loại nhóm IA không đúng? A. Độ cứng thấp. B. Dễ nóng chảy.
C. Khối lượng riêng lớn. D. Dẫn điện tốt.
Câu 63. [KNTT – SBT] Ở một số quốc gia, khoáng vật trona là nguyên liệu chính để
sản xuất soda. Thành phần hóa học chính của trona là. A. 3NaF.AlF3. B. NaCl.KCl. C. Na2CO3.NaHCO3.2H2O. D. NaNO3.
Câu 64. [KNTT – SBT] Tính khử của các kim loại nhóm IA từ Li đến Cs biến đổi như thế nào? A. Tăng dần. B. Không đổi.
C. Không có quy luật. D. Giảm dần.
Câu 65. [KNTT – SBT] Dãy nào sau đây sắp xếp các kim loại nhóm một a theo mức
độ phản ứng với nước tăng dần? A. K, Na, Li. B. Na, K, Li. C. Li, Na, K. D. K, Li, Na.
Câu 66. [KNTT – SBT] Kim loại nhóm một a có tính khử mạnh nhất trong các nhóm
kim loại. Giá trị thế điện cực chuẩn nào sau đây thuộc về một kim loại. Trong nhóm IA. A. -0,44 V. B. -2,93 V. C. 0 V. D. 1,52 V.
Câu 67. [KNTT – SBT] Khi đốt nóng tinh thể LiCl trong ngọn lửa đèn khí không
màu thì tạo ra ngọn lửa có màu A. Da cam. B. Tím nhạt. C. Vàng. D. Đỏ tía.
Câu 68. [KNTT – SBT] Các kim loại kiềm đều hoạt động hóa học mạnh. Vì vậy, để
bảo quản lâu dài, chúng thường được ngâm trong A. Dầu hỏa. B. Nước máy. C. Ethyl alcohol D. Giấm ăn.
Câu 69. [KNTT – SBT] Hợp chất nào sau đây vừa tác dụng được với dung dịch HCl,
vừa tác dụng được với dung dịch NaOH? A. NaHCO3 B. NaCl. C. Ba(OH)2. D. Na2CO3.
Câu 70. [KNTT – SBT] Trong công nghiệp, quá trình điện phân dung dịch NaCl bảo
hòa (điệ cực trơ màng, ngăn xốp) để sản xuất các hóa chất nào sau đây? A. Na và Cl2. B. Na, H2 và Cl2. C. NaOH, H2 và Cl2. D. NaOH, O2 và Cl2.
Câu 71. [KNTT – SBT] Nhỏ vài giọt dung dịch phenolphtalein vào dung dịch
Na2CO3 thì dùng dịch chuyển sang màu. A. Tím. B. Vàng. C. Xanh. D. Hồng.
Câu 72. [KNTT – SBT] Ở các nước ôn đới, để làm giảm nhiệt độ đóng băng của
nước, làm tuyết tan, khoáng chất được rải lên tuyết là A. Muối mỏ. B. Than đá. C. Đá vôi. D. Thạch cao
Câu 73. [KNTT – SBT] Diêm tiêu kali được dùng để chế tạo thuốc nổ đen (làm mìn
pha đá), làm phân bón (cung cấp nguyên tố N và K cho cây trồng) có công thức hóa học là. A. KNO3. B. K2CO3. C. KCl. D. K2SO4.
Câu 74. [KNTT – SBT] Quá trình sản xuất soda bằng phương pháp Solvay không sử
dụng nguyên liệu nào sau đây? A. Carbon dioxide. B. Muối ăn. C. Xút ăn da. D. Ammonia.
Câu 75. [KNTT – SBT] Khi đốt cháy kim loại Na trong bình chứa oxygen tạo thành sản phẩm là. A. NaO. B. Na2O2. C. Na2O. D. NaO2.
Câu 76. [KNTT – SBT] Trong dãy kim loại nhóm IA từ Li đến Cs. Nhiệt độ nóng
chảy giảm dần là do nguyên nhân nào sau đây?
A. Độ bền liên kết kim loại giảm dần.
B. Số electron hóa trị tăng dần.
C. Khối lượng nguyên tử tăng dần.
D. Độ âm điện giảm dần.
Câu 77. [KNTT – SBT] Trong dãy kim loại nhóm IA. Từ Li đến Cs, số electron hóa
trị trên một đơn vị thể tích biến đổi như thế nào? A. Giảm dần. B. Tăng dần. C. Không đổi.
D. Không có quy luật.
Câu 78. [KNTT – SBT] Khi so sánh nhóm IA với các nguyên tố khác trong cùng chu
kỳ, nhận định nào sau đây không đúng?
A. Có tính khử mạnh nhất. B. Có thế đến cực chuẩn âm nhất.
C. Có bán kính nguyên tử lớn nhất.
D. Có liên kết kim loại mạnh nhất.
Câu 79. [KNTT – SBT] Trong quá trình điện phân dung dịch NaCl với điện cực trơ
có màng ngăn xốp, phân tử hay ion nào sau đây di chuyển được từ anode sang cathode qua màng ngăn xốp? A. Cl-. B. Na+. C. OH-. D. Cl2.
Câu 80. [KNTT – SBT] Một gia đình pha 1kg nước muối sinh lí 0,9% để làm nước
súc miệng. Khối lượng muối ăn cần dùng là A. 9 g. B. 27 g. C. 18 g. D. 36 g
Câu 81. [KNTT – SBT] X, Y, Z là các hợp chất vô cơ của sodium, biết rằng: a) X + Z → Y + H2O; b) X o t Y + CO2 + H2O. A. Na2CO3, NaHCO3. B. NaHCO3, NaOH C. NaOH, Na2CO3. D. NaHCO3, Na2CO3.
Câu 82. [KNTT – SBT] Xét phản ứng nhiệt phân NaHCO3 thành Na2CO3 trong quá
trình Solvay: 2NaHCO3 (s) → Na2CO3 (s) + CO2 (g) + H2O (g) ΔHo=+135,6Kj
Nhiệt lượng cần cung cấp để nhiệt phân 1kg NaHCO3 theo phản ứng trên là A. 807,1 kJ. B. 1 614,3 kJ C. 1 210,7 kJ. D. 403,6 kJ.
Câu 83. [KNTT – SBT] Trong một giai đoạn của quá trình Solvay có tồn tại cân bằng
giữa các muối trong dung dịch: NaCl + NH4HCO3 ⇄ NaHCO3 + NH4Cl
Dựa trên tính chất nào của NaHCO3 để kết tinh muối này từ dung dịch hỗn hợp? A. Độ tan thấp.
B. Tính lưỡng tính.
C. Độ bền nhiệt thấp. D. Tính acid Bronsted
Câu 84. [KNTT – SBT] Đun nóng tinh thể muối halide nào sau đây với dung dịch
sulfuric acid đặc sẽ xảy ra phản ứng oxi hóa – khử? A. NaCl. B. NaF. C. KCl. D. KBr.
Câu 85. [KNTT – SBT] Dãy nào sau đây sắp xếp các dung dịch (có nồng độ 0,1M)
theo thứ tự pH tăng dần? A. LiOH, Na2CO3, KCl. B. Na2CO3, KCl, LiOH. C. KCl, Na2CO3, LiOH. D. Na2CO3, LiOH, KCl.
Câu 86. [KNTT – SBT] Cho 1,9 gam hỗn hợp gồm muối carbonate và
hydrocarbonate của một kim loại kiềm. Tác dụng với dung dịch HCl dư thu được
0,496 lít khí (đkc). Kim loại kiềm là A. K. B. Li. C. Na. D. Rb.
Hướng dẫn trả lời
Đặt công thức muối carbonate là M2CO3 có số mol x, muối hydrocarbonate là MHCO3 có số mol y mol
M2CO3+ 2HCl → 2MCl + CO2+ H2O x x mol MHCO3+ HCl→ MCl + CO2+ H2O y y mol Ta có
nCO2 = x + y = 0,496 /24,79 = 0,02 mol = nhỗn hợp 2 muối
Mhỗn hợp = 1,9 : 0,02 = 95 gam/mol
→ M + 61< 95 < 2M + 60 → 17,5< M <34 → Chỉ có Na thỏa mãn
Câu 87. [KNTT – SBT] Hòa tan hoàn toàn hỗn hợp K và Na vào nước, thu được
dung dịch X và a mol khí H2. Trung hòa X cần 200 mL dung dịch H2SO4 0,1 M. Giá trị của a là A. 0,04. B. 0,02. C. 0,005. D. 0,01. Hướng dẫn trả lời Ta có K + H2O → KOH + 1 H 2 2 Na + H2O → NaOH + 1 H 2 2 OH- + H+ → H2O
nH2SO4 = 0,02 mol nên nH+ = 0,04 mol → nOH- = 0,04 mol
Theo phương trình thì nOH = 2nH2 nH2 = 0,02 mol
Câu 88. [KNTT – SBT] Độ hòa tan của NaHCO3 ở 20oC và 60oC lần lượt là 9,6 và
16,5 g/100 g H2O. Để 1 tấn dung dịch NaHCO3 bão hòa ở 60oC làm nguội về 20oC
(giả thiết không có sự bay hơi của nước), thu được dung dịch X và a kg chất rắn khan. Giá trị của a là A. 59,23. B. 69,00. C. 54,04. D. 96,00. Hướng dẫn trả lời
Ở 60oC NaHCO3 tan được 16,5 gam trong 100 gam H2O mdd=16,5+100=116,5gam
Ở 20oC NaHCO3 tan được 9,6 gam trong 100 gam H2O tương đương với thoát ra chất rắn không tan NaHCO3 là:
mkết tinh = 6,5−9,6=6,9 gam
1 tấn dung dịch NaHCO3 ở 60oC khi hạ nhiệt độ xuống 20oC sẽ kết tinh được
m = (1 000 000.6,9):116,5 = 59227,5gam = 59,2275kg
Câu 89. [KNTT-SGK] Khi so sánh kim loại nhóm IA với các kim loại khác trong
cùng chu kì, nhận định nào sau đây không đúng?
A. Có tính khử mạnh nhất.
B. Có thế điện cực chuẩn âm nhất.
C. Có bán kính nguyên tử lớn nhất.
D. Có nhiều electron hoá trị nhất.
Câu 90. [KNTT-SGK] Trong quá trình Solvay, ở giai đoạn tạo thành NaHCO3 tồn tại cân bằng sau:
NaCl+ NH3 + CO2 + H2O ⮀ NaHCO3 + NH4Cl
Khi làm lạnh dung dịch trên, muối bị tách ra khỏi dung dịch là A. NaHCO3. B. NH4Cl. C. NaCl. D. NH4HCO3.
Câu 91 [KNTT-SBT] Khi đốt nóng tinh thể NaCl trong ngọn lửa đèn khí không
màu thì tạo ra ngọn lửa có màu A. đỏ cam. B. tím nhạt. C. vàng. D. đỏ tía. Hướng dẫn trả lời
Các ion kim loại nhóm IA cho ngọn lửa màu đặc trưng: ion Li+ màu đỏ tía, ion Na+
màu vàng, ion K+ màu tím nhạt
Câu 92 [KNTT-SBT] Kim loại Na ở chu kì 3, nhóm IA trong bảng tuần hoàn, cấu
hình electron lớp ngoài cùng của nguyên tử Na ở trạng thái cơ bản là A. 3s23p5. B. 3s2. C. 3s1. D. 3s23p1.
Câu 93 [KNTT-SBT] Kim loại nhóm IA nào sau đây dễ mất electron hoá trị nhất,
được dùng sản xuất tế bào quang điện? A. Cs. B. Li. C. Na. D. K.
Câu 94 [KNTT-SBT] Trong các kim loại nhóm IA từ Li đến Cs, nhiệt độ nóng
chảy và độ cứng biến đổi như thế nào? A. Không đổi. B. Giảm dần. C. Tăng dần.
D. Không có quy luật.
Câu 95. [CD - SBT] Trong tự nhiên, các nguyên tố nhóm IA chỉ tồn tại ở dạng hợp chất là do
A. các nguyên tố nhóm IA chỉ có thể tìm được trong nước ngầm, nước biển
B. các nguyên tốt nhóm IA đều là những kim loại hoạt động hóa học mạnh nên
không tồn tại dạng đơn chất.
C. các nguyên tố nhóm IA thường kết hợp với nhau dể tạo thành các hợp kim bền.
D. các nguyên tố nhóm IA có độ âm điện lớn nên dễ dàng kết hợp với các nguyên tố khác.
Câu 96. [CD - SBT] Các kim loại kiềm có khối lượng riêng nhỏ và độ cứng thấp
hơn nhiều so với các kim loại khác. Nguyên nhân là do:
(1) Tinh thể có kiểm mạng lập phương tâm khối.
(2) Khối lượng nguyên tử nhỏ hơn các kim loại khác.
(3) Có lực liên kết kim loại yếu. A. (1), (2) và (3). B. (2) và (3). C. (1) và (3). D. (1) và (3).
Câu 97. [CD - SBT] Dãy nào sau đây sấp xếp đúng các kim loại theo chiều tăng
dần nhiệt độ nóng chảy?
A. Hg, Cs, K, Na, Fe, W.
B. Hg, Na, K, Cs, W, Fe.
C. Cs, K, Na, Hg, Fe, W.
D. Hg, Cs, Na, K, Fe, W.
Câu 98. [CD - SBT] Trong các phản ứng sau đây, phản ứng nào diễn ra mãnh liệt nhất? A. Lithium và bromine.
B. Potassium và chlorine
C. Lithium và chlorine. D. Sodium và bromine.
Câu 99. [CD - SBT] Nhúng queo platinum sạch vào dung dịch chất X, sau đó đưa
lên ngọn lửa đèn khí, đèn khí cháy với ngọn lửa màu vàng. Mặt khác, thêm vài giọt
dung dịch chất X vào dung dịch silver nitrate thất xuất hiện kết tủa vàng. X có thể là chất nào sau đây?
(1) Potassium iodide. (2) Sodium iodide.
(3) Sodium phosphate. (4) Potassium phosphate. A. (1) hoặc (4). B. (2) hoặc (3). C. (2). D. (3) hoặc (4).




