













Preview text:
NGUYÊN TỐ NHÓM IIA
A. TÓM TẮT LÝ THUYẾT I. ĐƠN CHẤT
1. Vị trí cấu tạo và trạng thái tự nhiên
Các nguyên tố nhóm IIA gồm, beryllium (Be), magnesium (Mg), calcium (Ca),
strontium (Sr), barium (Ba) và radium (Ra).
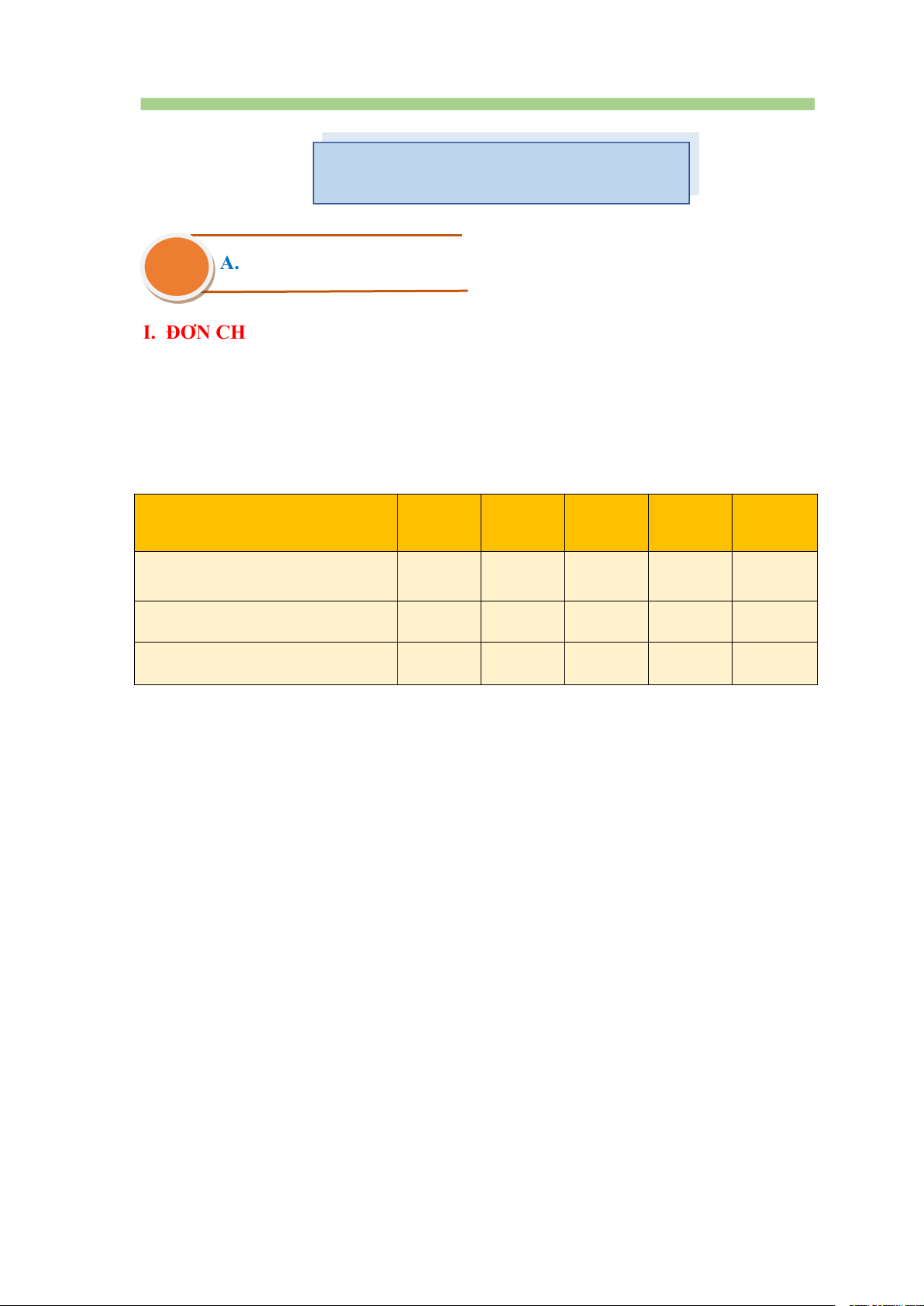
Một số đại lượng đặc trưng của các kim loại nhóm IIA Nguyên tố 4Be 12Mg 20Ca 38Sr 56Ba
Cấu hình electron nguyên tử
[He]2s2 [Ne]3s2 [Ar]4s2 [Kr]5s2 [Xe]6s2 Bán kính nguyên tử (pm) 112 160 197 215 222
Thế điện cực chuẩn (V ) -1,85 -2,37 -2,87 -2,89 -2,90
Kim loại nhóm IIA là các nguyên tố hoạt động hoá học mạnh và không tìm thấy ở
dạng đơn chất trong tự nhiên.
Trong vỏ Trái Đất, các nguyên tố nhóm IIA chủ yếu tồn tại ở dạng muối
carbonate, sulfate và silicate, tạo nên nhiều loại khoáng vật ít tan.
Trong nước mặt, nước ngầm,. ., các nguyên tố nhóm IIA tồn tại ở dạng
cation M2+, phổ biến nhất là Mg2+ và Ca2+.
Trong cơ thể sinh vật, magnesium và calcium tồn tại ở cả dạng hợp chất ít
tan và dạng cation Mg2+, Ca2+.
Một số quặng của nguyên tố kim loại nhóm IIA:
Magnesium tồn tại trong quặng dolomite (CaCO3.MgCO3).
Calcium có trong đá vôi (CaCO3), dolomite, thạch cao (CaSO4).
Cấu hình electron lớp ngoài cùng của kim loại nhóm IIA là ns2. Kim loại nhóm
IIA tồn tại trong tự nhiên ở dạng hợp chất.
2. Tính chất vật lí
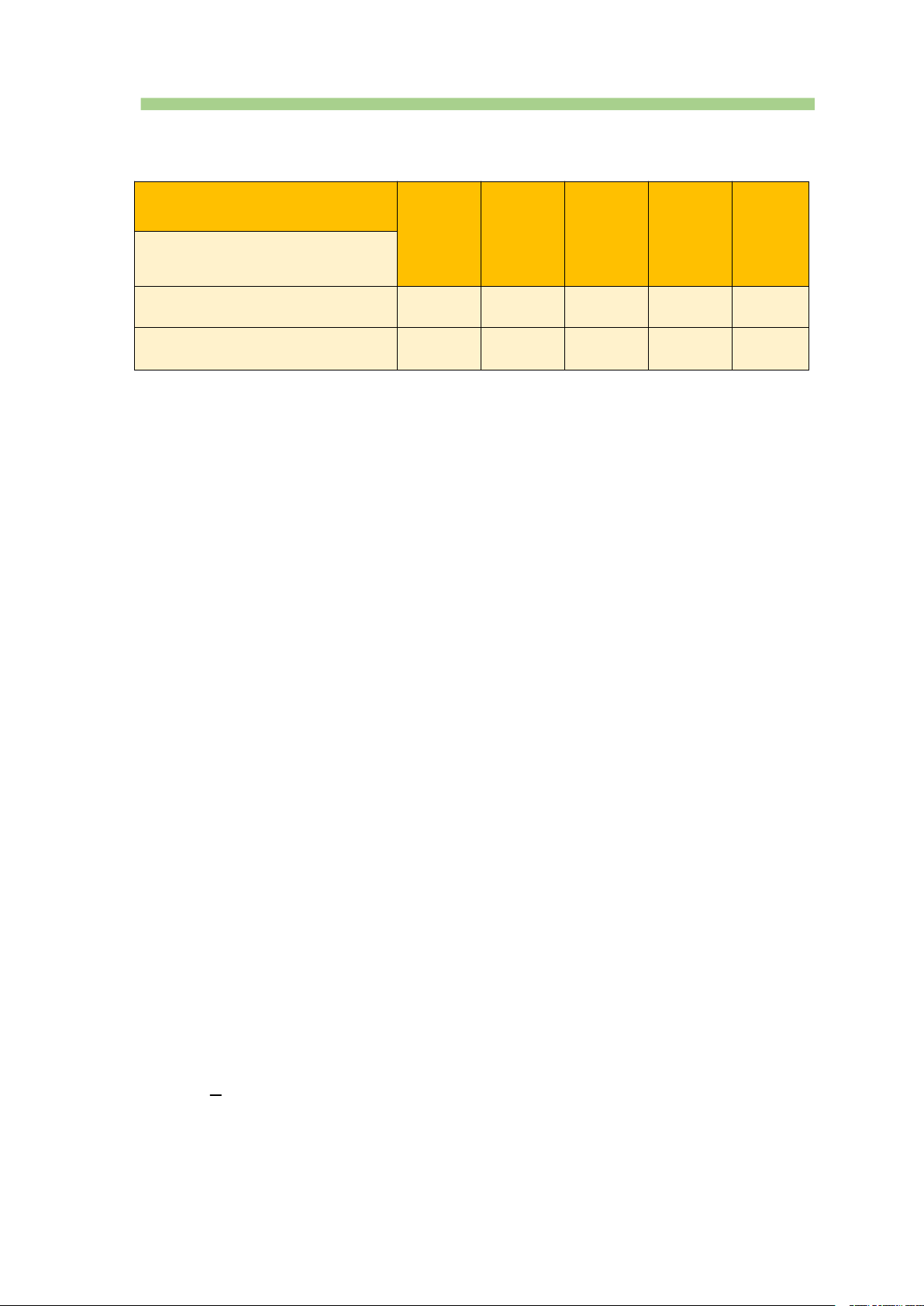
Thông số vật lí của kim loại nhóm IIA Nguyên tố Be Mg Ca Sr Ba Tính chất
Nhiệt độ nóng chảy (oC) 1280 650 838 770 714
Khối lượng riêng (g/cm3 ) 1,86 1,74 1,55 2,6 4,5
(Số liệu lấy theo SGK Hóa 10 Chân trời sáng tạo)
Sự biến đổi nhiệt độ nóng chảy của kim loại nhóm IIA không theo quy luật do
cấu trúc mạng tinh thể của kim loại nhóm IIA khác nhau.
Nhiệt độ nóng chảy, khối lượng riêng và độ cứng của kim loại nhóm IIA cao hơn
so với kim loại nhóm IA cùng chu kì. Kim loại nhóm IIA là những kim loại nhẹ (D < 5g/ cm3). 3. Tính chất hóa học
Kim loại nhóm IIA có tính khử mạnh, tính khử tăng dấn từ Be đến Ba. M M2+ + 2e
Từ Be đến Ba, điện tích hạt nhân tăng, bán kính nguyên tử tăng nhanh, vì vậy tính kim loại tăng.
Trạng thái oxi hoá phổ biến trong các hợp chất của kim loại nhóm IIA là +2.
3.1 Phản ứng với oxygen
Khi đốt nóng trong oxygen hoặc trong không khí, các kim loại nhóm IIA đều bốc
cháy, tạo ra oxide theo phương trình hoá học tổng quát sau: 2M(s) + O2(g) 2MO(s)
Khi cháy, các kim loại nhóm IIA cho ngọn lửa có màu đặc trưng.
Mg cháy phát ra ánh sáng chói, giàu tia tử ngoại nên được ứng dụng làm pháo sáng. Mg s 1
O g MgO s 0 H 610kJ/mol 2 298 2 r
Có thể nhận biết đơn chất và các hợp chất của Ca2+, Sr2+, Ba2+ bằng phương pháp thử màu ngọn lửa.
Đơn chất và hợp chất của Ca2+ cháy cho ngọn lửa màu đỏ cam.
Đơn chất và hợp chất của Sr2+ cháy cho ngọn lửa màu đỏ son.
Đơn chất và hợp chất của Ba2+ cháy cho ngọn lửa màu lục.
Màu ngọn lửa khi đốt muối kim loại nhóm IIA
2. Phản ứng với nước
Berrylium không tác dụng với nước và hơi nước do có màng oxide bền bảo vệ bề
mặt. - Các kim loại Ca, Sr, Ba khử H2O ở nhiệt độ thường. M + 2H2O M(OH)2 + H2 (Với M là Ca, Sr hoặc Ba)
Magnesium phản ứng chậm với nước ở nhiệt độ thường và phản ứng nhanh hơn khi đun nóng.
Mg 2H O Mg OH H 2 2 2
Độ tan của các hydroxide trong nước tăng theo thứ tự:
BeOH Mg OH Ca OH Sr OH Ba OH 2 2 2 2 2
Từ berrylium đến barium, tính kim loại tăng dần, mức độ phản ứng của kim loại
nhóm IIA với oxygen và với nước tăng dần.
Độ tan của các hydroxide kim loại nhóm IIA tăng dần từ Be(OH)2 đến Ba(OH)2.
II. HỢP CHẤT CỦA CÁC NGUYÊN TỐ NHÓM IIA
1. Tính chất của muối carbonate, nitrate
1.1. Tương tác của muối carbonate với dung dịch acid loãng, với nước khi có mặt CO2
Muối carbonate tác dụng với dung dịch acid loãng, phản ứng với H₂O khi có mặt CO2:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
CaCO3 + CO2 + H2O → Ca(HCO3)2
1.2. Sự phân hủy nhiệt của muối carbonate và muối nitrate
Dưới tác dụng của nhiệt, muối carbonate của kim loại nhóm IIA bị phân huỷ tạo thành oxide.
MCO s tMO s CO g 0 H r 0 3 2 298
Khi đun nóng, muối nitrate của kim loại nhóm IIA phân huỷ thành oxide.
M NO s tMO s NO g 1 2 O g 0 H r 0 3 2 2 2 298 2
Độ bền nhiệt của muối carbonate, muối nitrate của kim loại nhóm IIA có xu hướng
tăng dần từ muối của Mg2+ đến muối của Ba2+.
2. Tính tan của các muối carbonate, sulfate, nitrate
Các muối nitrate đều tan.
Trừ BeCO3, các muối carbonate khác không tan trong nước.
Các muối BeSO4, MgSO4 tan; SrSO4 và CaSO4 ít tan; BaSO4 không ta
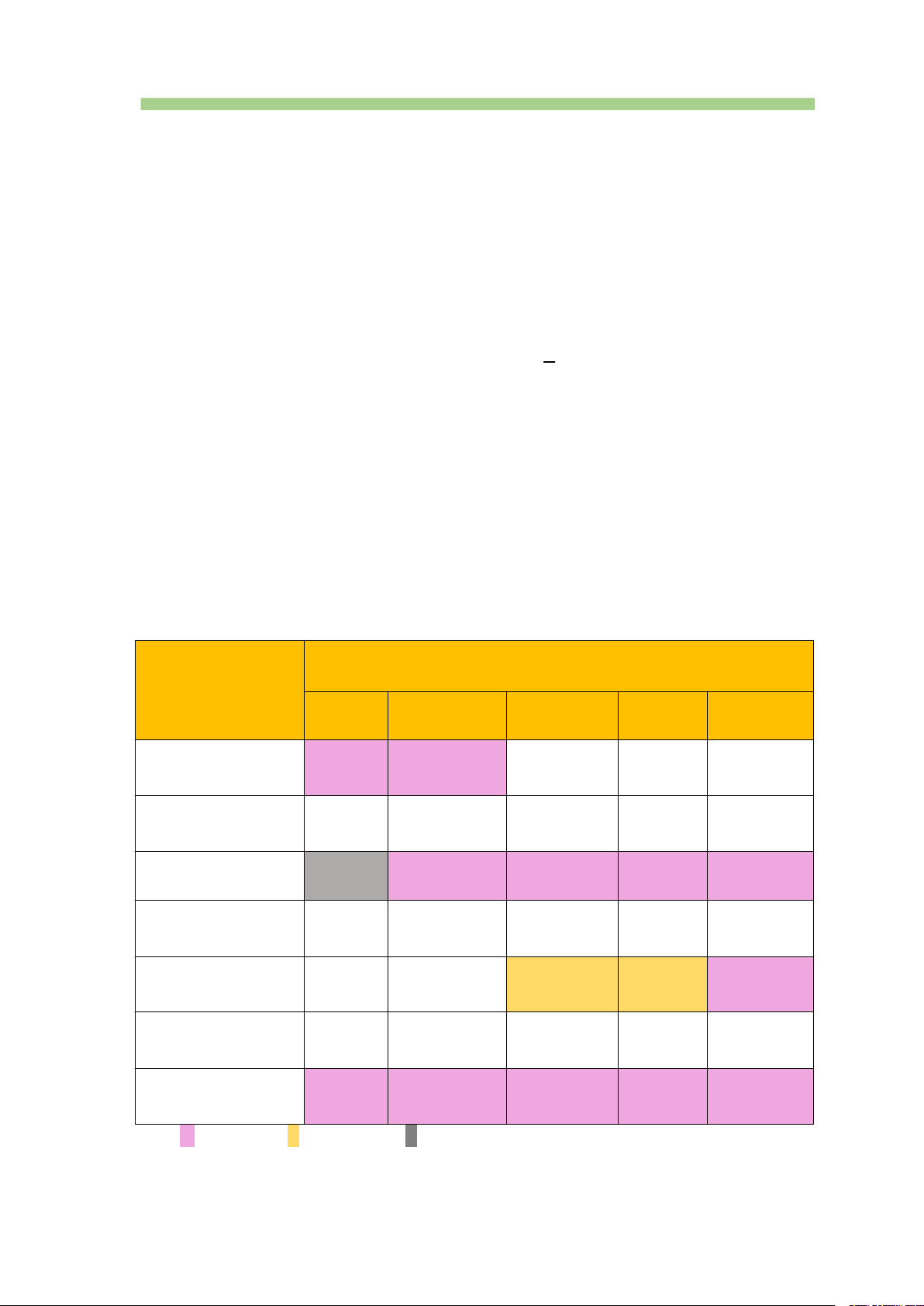
Bảng tính tan một số hợp chất của kim loại nhóm IIA ở 20oC Nhóm hydroxide CÁC ION KIM LOẠI và gốc acid Be2+ Mg2+ Ca2+ Sr2+ Ba2+ OH– K K I T T Cl– T T T T T CO32– – K K K K HCO3– T T T T T SO42– T T I I K NO3– T T T T T PO43– K K K K K
Với: K không tan, I ít tan; T tan; - không xác định được
Chú ý: CaSO4 có độ tan lớn hơn BaSO4.
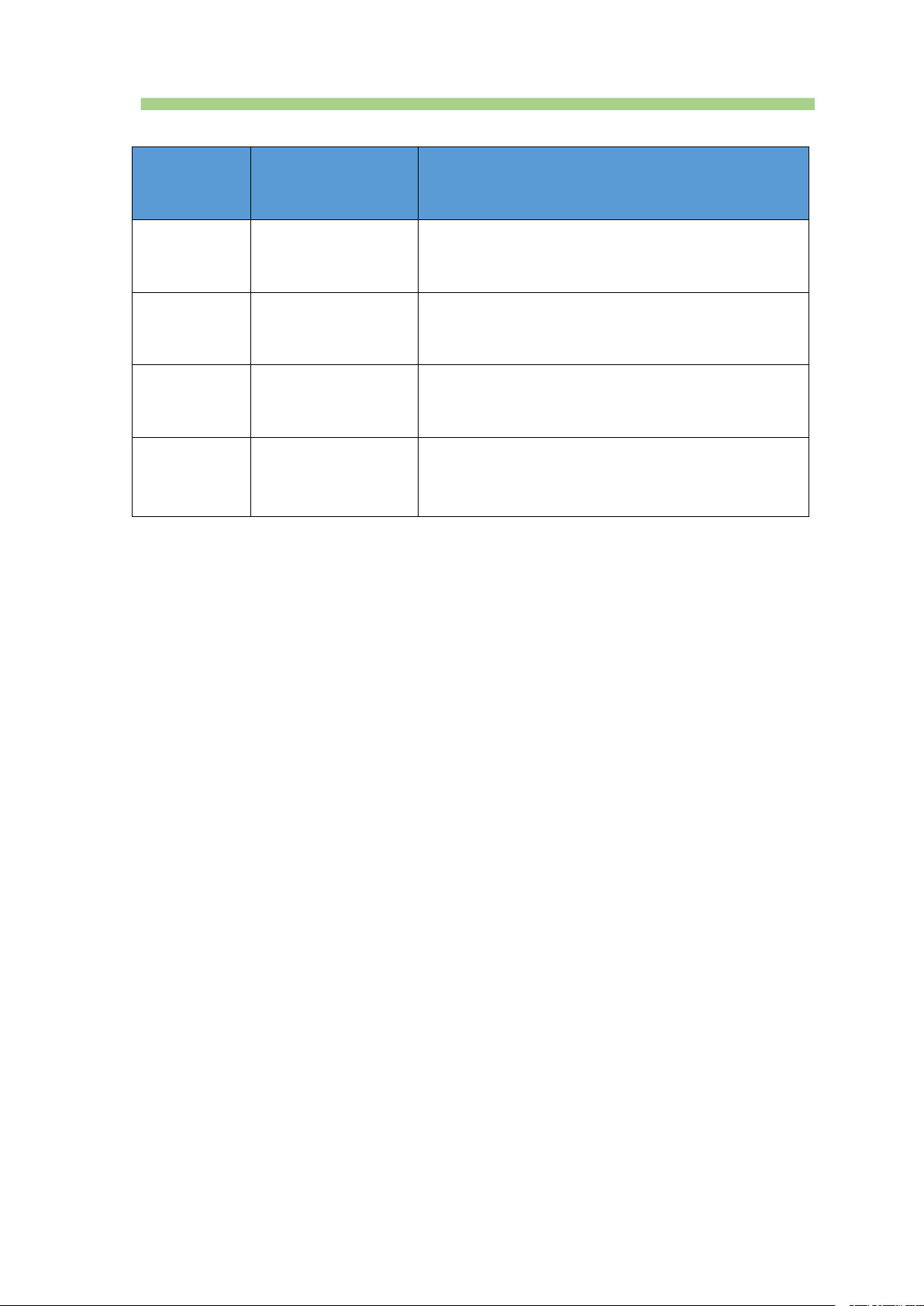
Nhận biết các ion Ca2+; Ba2+, SO42-, CO32- Ion Thuốc thử Hiện tượng Ca2+ Dung dịch CO32–
Kết tủa trắng, tan trong dung dịch acid Ba2+ Dung dich SO42–
Kết tủa trắng, không tan trong dung dịch acid SO42– Dung dịch Ba2+
Kết tủa trắng, không tan trong dung dịch acid CO32– Dung dịch H+ Khí không màu, không mùi III. ỨNG DỤNG
Magnesium: Mg nhẹ hơn so với Al, vì vậy hợp kim của Mg được sử dụng trong
chế tạo máy bay, ô tô,. .
Đá vôi có thành phần chính là calcium carbonate, được dùng để sản xuất vôi, xi
măng, làm vật liệu xây dựng, . .
Vôi sống (calcium oxide) làm vật liệu xây dựng, tẩy uế, sát trùng.Nước vôi
(calcium hydroxide) được dùng trong xử lí nước, giảm tính cứng của nước.
Thạch cao có thành phần chính là calcium sulfate (CaSO4.nH2O), được sử dụng
làm vách, trần thạch cao để tăng tính thẩm mĩ trong xây dựng. Trong lĩnh vực y tế,
thạch cao thường được ứng dụng trong kĩ thuật bó bột định hình xương
Khoáng vật apatite chứa calcium, công thức Ca5(PO4)3F, Ca5(PO4)3OH và
Ca5(PO4)3Cl, được dùng chế tạo phân bón cho nông nghiệp, làm nguyên liệu sản xuất phân lân.
Vai trò một số hợp chất của calcium trong cơ thể con người: Calcium là thành
phần chính của xương và răng; ion calcium có trong muối phosphate phức tạp,
hydroxyapatite, Ca5(PO4)3OH. Ion Ca2+ trong cơ thể người có chức năng kích
hoạt quá trình trao đổi chất, đóng vai trò quan trọng trong hoạt động của tim, đông
máu, co cơ và truyền xung thần kinh.
IV. NƯỚC CỨNG VÀ CÁCH LÀM MỀM NƯỚC CỨNG
1. Phân loại nước cứng
Nước cứng là loại nước có chứa ion Ca2+ và Mg2+ với hàm lượng vượt quá mức cho phép
Nước có tính cứng tạm thời là nước cứng chứa ion HCO3−, (muối Ca(HCO3)2; Mg(HCO3)2).
Nước có tính cứng vĩnh cửu là nước cứng chứa các ion SO42−, Cl−(muối MgCl2, CaCl2, MgSO4, CaSO4).
Nước có tính cứng toàn phần là loại nước cứng bao gồm cả tính cứng tạm thời và tính cứng vĩnh cửu.
2. Tác hại của nước cứng
Trong đời sống hàng ngày: Nước cứng làm giảm khả năng tạo bọt của xà
phòng,giảm tác dụng giặt rửa, làm các dụng cụ đun nấu dễ bị đóng cặn, tiêu hao
năng lượng. Nếu sử dụng nước cứng để nấu ăn sẽ làm thực phẩm lâu chín và giảm mùi vị.
Trong bảo vệ sức khoẻ: Dùng nước cứng tắm gội hàng ngày sẽ gây khô da, khô
tóc hay mẩn ngứa, gây hại sức khoẻ.
Trong công nghiệp: Trong các nồi áp suất của tua bin hơi nước ở nhiều nhà máy,
nước cứng tạo cặn là CaCO3, cản trở quá trình dẫn nhiệt. Các mảng bám còn tăng
nguy cơ tắc ống, tắc lỗ van an toàn gây nguy hiểm.
Một đoạn ống nước bị đóng cặn
3. Phương pháp làm mềm nước cứng
Nguyên tắc làm mềm nước cứng là làm giảm nồng độ các ion Ca2+ và Mg2+ trong nước cứng.
3.1. Phương pháp kết tủa
Bằng cách chuyển ion Ca2+ và ion Mg2+ thành dạng kết tủa, thường là CaCO3, MgCO3, Ca3(PO4)2, Mg3(PO4)2.
a. Đối với nước có tính cứng tạm thời:
Đun sôi nước, ion Ca2+ và Mg2+ sẽ tách ra dưới dạng kết tủa. Ca(HCO o t 3)2 CaCO3↓ + CO2↑ + H2O Mg(HCO o t 3)2 MgCO3↓ + CO2↑ + H2O
Dùng lượng vừa đủ dung dịch Ca(OH)2 để phản ứng với muối Ca(HCO3)2; Mg(HCO3)2. Ca(HCO o t 3)2 + Ca(OH)2 CaCO3↓ + 2H2O
b. Đối với nước có tính cứng vĩnh cửu
Cho phản ứng với dung dịch chứa ion CO32− hoặc PO43−: Na2CO3 + CaSO4 Na2SO4↓ + CaCO3 ↓
3MgCl2 + 2Na3PO4 → 6NaCl + Mg3(PO4)2↓
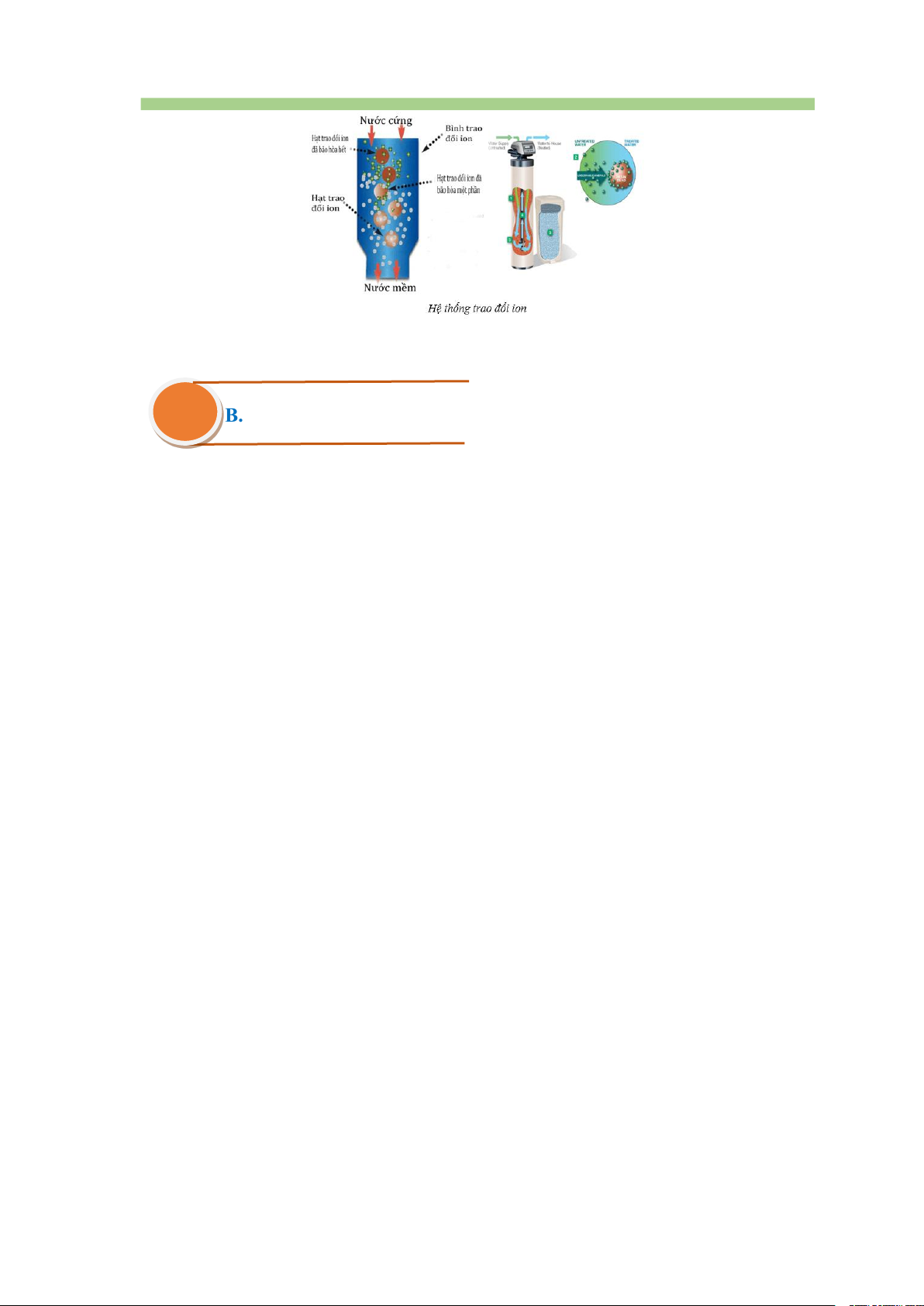
3.2. Phương pháp trao đổi ion
Cơ sở của phương pháp này là thay thế cation Ca2+ và Mg2+ trong nước bằng
cation khác ít gây tác hại hơn.
Phương pháp này được thực hiện bằng cách cho nước cứng đi qua lớp vật liệu hay
màng vật liệu trao đổi ion. Các vật liệu này có chứa cation kim loại, như Na+. Khi
cho nước cứng đi qua vật liệu, các cation Ca2+ và Mg2+ đẩy cation Na+ ra khỏi vật
liệu. Các cation Ca2+, Mg2+ bị giữ lại trên vật liệu.
Phương pháp trao đổi ion làm giảm được cả tính cứng tạm thời và tính cứng vĩnh cửu.
Hạn chế cơ bản của phương pháp này là sau thời gian sử dụng, khả năng giữ các
cation Ca2+ và Mg2+ của vật liệu sẽ giảm, khi đó, vật liệu cần được tái chế hoặc thay mới.
B. CÂU HỎI LUYỆN TẬP
PHẦN I. CÂU HỎI TRẮC NGHIỆM KHÁCH QUAN
Câu 1. Ở trạng thái cơ bản, nguyên tử kim loại kiềm thổ có số electron hoá trị là A. 1e. B. 2e. C. 3e. D. 4e.
Câu 2. Trong hợp chất, các kim loại kiềm thổ có số oxi hóa là A. +1. B. +3. C. +2. D. +4.
Câu 3. Công thức hóa học của thạch cao nung là A. CaSO4.H2O B. CaSO4. C. CaSO4.2H2O D. CaCO3.H2O
Câu 4. Calcium chloride là phụ gia thực phẩm được phép sử dụng tại Liên minh
châu Âu để làm phụ gia cô lập và chất làm chắc. Hóa chất này ở dạng khan được
dùng như một phụ gia hỗ trợ đóng gói để đảm bảo độ khô. Với vị cực mặn đặc
trưng, nó được sử dụng như chất điện giải, sử dụng trong các loại đồ uống cho
người tập luyện thể thao và đồ uống nước đóng chai, … Công thức phân tử của calcium chloride là A. CaCO3. B. CaBr2. C. CaO. D. CaCl2.
Câu 5. Chất vô cơ X là một hợp chất của barium. X tồn tại dạng tinh thể màu
trắng không mùi và không tan trong nước. Chất X được sử dụng rộng rãi như một
tác nhân gây đục phóng xạ hoặc chất cản quang tia X để chẩn đoán các tình
trạng bệnh lý đường tiêu hóa. Chất X là A. BaCl2. B. BaCO3. C. BaSO4. D. BaSO3.
Câu 6. Trước khi thi đấu các môn thể thao, các vận động viên thường xoa một ít
muối magnesium carbonate dưới dạng bột màu trắng làm tăng ma sát và hút ẩm.
Công thức của magnesium carbonate là A. MgCO3. B. CaCO3. C. CaSO4. D. MgSO3.
Câu 7. Từ berilium đến barium, tính khử của các kim loại kiềm thổ thay đổi như thế nào? A. Giảm rồi tăng.
B. Không thay đổi. C. Giảm dần. D. Tăng dần.
Câu 8. Nguyên nhân chính khiến cho tính chất vật lí của các kim loại nhóm IIA
không biến đổi theo một quy luật nhất định là các kim loại nhóm IIA:
A. có bán kính nguyên tử lớn.
B. có kiểu mạng tinh thể không giống nhau.
C. có điện tích hạt nhân nhỏ.
D. có ít electron hóa trị.
Câu 9. Xếp các kim loại nhóm IIA theo chiều tăng dần của điện tích hạt nhân, thì
A. bán kính nguyên tử giảm dần.
B. năng lượng ion hoá giảm dần.
C. tính khử giảm dần.
D. khả năng tác dụng với nước giảm dần.
Câu 10. Ở điều kiện thường, kim loại nào sau đây phản ứng mạnh với nước? A. Be. B. Mg. C. Ba. D. Cu.
Câu 11. Kim loại nào sau đây là kim loại kiềm thổ? A. Al. B. Ca. C. K. D. Cu.
Câu 12. Cho một mẩu calcium oxide vào nước dư thu được dung dịch chứa chất tan nào sau đây? A. CaO. B. CaH2. C. CaOH. D. Ca(OH)2.
Câu 13. Ở điều kiện thường, kim loại nào sau đây không phản ứng với nước? A. Be. B. Ba. C. Na. D. Ca
Câu 14. Quặng dolomite là một khoáng sản hiếm tập trung chủ yếu ở các tỉnh
như Hà Nam, Ninh Bình, Nghệ An, Thanh Hoá,… Công thức hoá học của quặng dolomite là A. MgCO3.BaCO3. B. CaSO4.2H2O. C. Al2O3.nH2O. D. MgCO3.CaCO3.
Câu 15. Đốt nóng hợp chất CaCl2 thu được ngọn lửa có màu A. Xanh lam. B. Đỏ son. C. Đỏ cam. D. Xanh lục.
Câu 16. Chất nào sau đây là chất không tan? A. NaCl. B. Ba(NO3)2. C. Na2CO3. D. BaCO3.
Câu 17. Muối nào sau đây dễ bị phân huỷ khi đun nóng? A. Ca(HCO3)2. B. Na2SO4. C. BaCl2. D. Na2CO3.
Câu 18. Nước cứng là nước chứa nhiều các ion A. HCO3- ,Cl-. B. Ca2+, Ba2+. C. Ca2+, Mg2+. D.Cl-,SO42-.
Câu 19. Để khử chua cho đất người ta thường sử dụng chất nào sau đây? A. Vôi sống. B. Phèn chua. C. Muối ăn. D. Thạch cao.
Câu 20. Đun nước lâu ngày thấy xuất hiện lớp cặn bám vào ấm đun nước. Thành
phần chính của lớp cặn đó là A. CaO. B. NaCl. C. Ba(OH)2. D. CaCO3.
Câu 21. Đun nước lâu ngày thấy xuất hiện lớp cặn bám vào ấm đun nước. Để loại
bỏ lớp cặn có thể dùng dung dịch nào sau đây? A. Cồn. B. Giấm ăn. C. Nước vôi. D. Muối ăn.
Câu 22. Loại nước cứng khi đun sôi thì mất tính cứng, trong loại nước cứng
này có hoà tan những hợp chất nào sau đây? A. CaSO4, MgCl2. B. Ca(HCO3)2, MgCl2.
C. Ca(HCO3)2, Mg(HCO3)2.
D. Mg(HCO3)2, Ba(HCO3)2.
Câu 23. Chất nào sau đây làm mềm được nước cứng có tính vĩnh cửu? A. NaCl. B. Na2CO3. C. NaNO3. D. Na2SO4.
Câu 24. Câu tục ngữ “Nước chảy đá mòn” có bản chất hóa học dựa trên phản ứng
nào sau đây (xảy ra trong thời gian dài)?
A. CaCO3 + CO2 + H2O Ca(HCO3)2. B. CaCO3 + 2HCl CaCl2 + CO2 + H2O. C. Ca(HCO3)2 CaCO3 + CO2 + H2O. D. CaCO3 CaO + CO2.
Câu 25. Dung dịch nào sau đây dùng để phân biệt dung dịch KCl và dung dịch K2SO4? A. NaOH. B. KCl. C. KOH. D. BaCl2.
Câu 26. Sản phẩm tạo thành có chất kết tủa khi dung dịch Ba(HCO3)2 tác dụng với dung dịch A. HNO3. B. NaCl. C. Na2CO3. D. NaNO3.
Câu 27. Cho dãy các kim loại: Fe, Na, K, Mg, Be, Ca, Ba, Ag. Số kim loại trong
dãy tác dụng nhanh với nước ở điều kiện thường là A. 1. B. 2. C. 3. D. 4.
Câu 28. Cho dung dịch K2CO3 vào dung dịch Ca(HCO3)2 thấy
A. Có kết tủa trắng.
B. Có bọt khí thoát ra.
C. Có kết tủa trắng và bọt khí.
D. Không hiện tượng.
Câu 29. X là hợp chất của calcium có nhiều ở dạng đá vôi, đá hoa, … Hợp chất Y
có trong thành phần không khí và thường dùng để chữa cháy. Biết Y được sinh ra
khi cho X phản ứng với dung dịch acid HCl. Phản ứng tạo Y từ X là
A. CaSO3 + 2HCl → CaCl2 + SO2 + H2O B. Ca(HCO o t 3)2 CaCO3 + CO2 + H2O.
C. Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O.
D. CaCO3 + 2HCl → CaCl2 + CO2 + H2O Hướng dẫn trả lời
X là hợp chất của calcium có nhiều ở dạng đá vôi, đá hoa,. . nên X là CaCO3.
Vì Y có trong thành phần không khí và thường dùng để chữa cháy và khi cho
CaCO3 phản ứng với dung dịch acid mạnh thu được Y nên Y là CO2.
CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
Câu 30. Khi có sự gia tăng nồng độ của carbon dioxide trong nước biển thì các rạn
san hô và núi đá vôi có thể bị phá hủy, xói mòn. Phản ứng hóa học nào sau đây
xảy ra trong quá trình trên?
A. Ca(OH)2 + 2CO2 → Ca(HCO3)2.
B. Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O.
C. CaCO3 + CO2 + H2O → Ca(HCO3)2.
D. Ca(OH)2 + CO2 → CaCO3 + H2O Hướng dẫn trả lời
Các rạn san hô và núi đá vôi có thể bị phá hủy xói mòn theo phương trình:
CaCO3 + CO2 + H2O → Ca(HCO3)2
Câu 31. [CTST – SBT] Nhận định nào không đúng về cấu tạo và tính chất của các kim loại nhóm IIA?
A. Khối lượng riêng tương đối nhỏ, là những kim loại nhẹ hơn nhôm (trừ Ba).
B. Độ cứng cao hơn kim loại nhóm IA, nhưng mềm hơn kim loại nhôm.
C. Mạng tinh thể của chúng đều có kiểu lập phương tâm khối.
D. Nhiệt độ nóng chảy và nhiệt độ sôi tương đối thấp ( trừ Be). Hướng dẫn trả lời
Vì Be, Mg là kiểu lục phương; Ca, Sr là kiểu lập phương tâm diện; Ba là kiểu lập phương tâm khối.
Câu 32. [CTST – SBT] Phương trình hóa học của phản ứng nào sau đây không đúng?
A. Ca + 2H2O → Ca(OH)2 + H2
B. BeO + H2O → Be(OH)2
C. Mg + H2SO4 → MgSO4+ H2
D. Be + 2NaOH → Na2BeO2+ H2 Hướng dẫn trả lời
Vì Be và BeO không tác dụng với nước ở bất kì điều kiện nào.
Câu 33. [CTST – SBT] Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ
thường, tạo ra dung dịch có môi trường kiềm là A. Na, Ba, K. B. Na, Fe, K. C. Be, Na, Ca. D. Na, Cr, K.
Câu 34. [CTST – SBT] Cho phương trình hóa học của phản ứng nhiệt phân sau 4M(NO o t 3)x 2M2Ox + 4xNO2 + xO2
M là kim loại nào sau đây? A. Ca B. Mg C. K D. Ag Hướng dẫn trả lời
Vì muối nitrate của kim loại từ Mg đến Cu khi nhiệt phân tạo ra basic oxide, NO2 và O2. 2Mg(NO o t 3)2 2MgO + 4NO2 + O2
Câu 35. [CTST – SBT] Cho 400ml dung dịch Ba(OH)2 0,1 M vào 600ml dung
dịch NaHCO3 0,1 M. Sau phản ứng thu được m gam kết tủa . Giá trị của m là A. 5,91 B. 3,94 C. 7,88 D. 4,00
Hướng dẫn trả lời
nBa(OH)2 = 0,1×0,4 = 0,04 (mol);
nNaHCO3 = 0,1×0,6 = 0,06 (mol)
Ba(OH)2 + 2NaHCO3 → BaCO3 + Na2CO3 + 2H2O 0,03 0,06 0,03 0,03 mol
Ba(OH)2 + Na2CO3 → BaCO3 + 2NaOH 0,02 0,01 0,01 0,02 mol
Từ PTHH ta có nBaCO3= 0,03 + 0,01 = 0,04 (mol).
Suy ra mBaCO3 = 0,04×197 = 7,88 (gam)
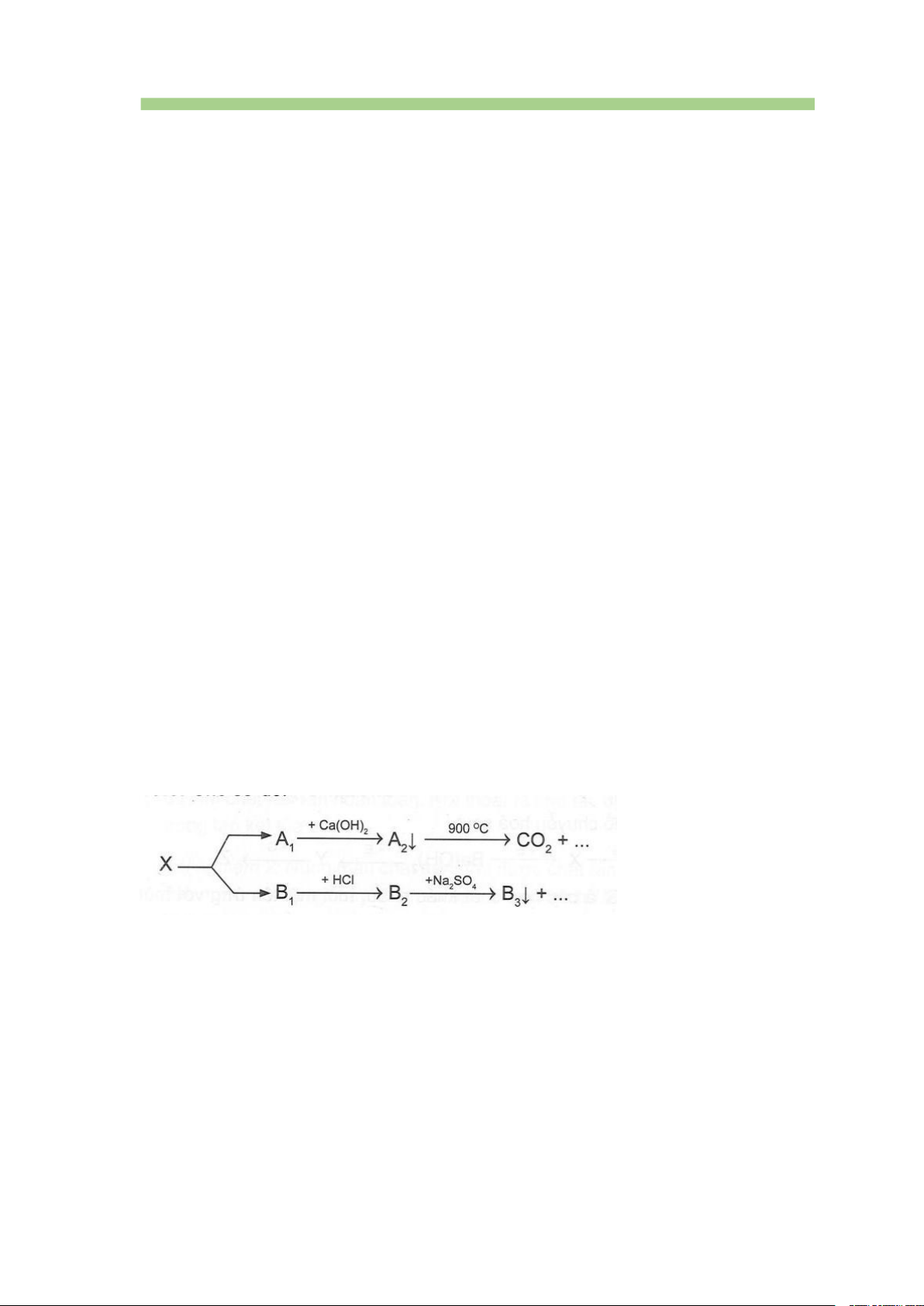
Câu 36. [CTST – SBT] Cho sơ đồ:
Chất X trong sơ đồ trên có thể là A. BaCO3 B. CaCO3 C. BaSO3 D. MgCO3
Hướng dẫn trả lời BaCO o t 3 BaO + CO2 CO2 + Ca(OH)2 → CaCO3 + H2O CaCO o t 3 CO2 + CaO BaO + 2HCl → BaCl2 + H2O
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Câu 37. [CTST – SBT] Trong các mẫu nước cứng sau đây, nước cứng tạm thời là
A. dung dịch Ca(HCO3)2 B. dung dịch MgSO4 C. dung dịch CaCl2 D. dung dịch Mg(NO3)2
Câu 38. [CTST – SBT] Trong cốc nước chưa 0,01 mol Na+; 0,02 mol Ca2+; 0,01
mol Mg2+; 0,05 mol HCO3- và 0,02 mol Cl-. Đun sôi cốc nước hồi lâu, nước thu được là
A. Nước cứng tạm thời. B. Nước mềm.
C. Nước cứng vĩnh cửu.
D. Nước cứng toàn phần. Hướng dẫn trả lời
Các phương trình hóa học của phản ứng: 2HCO3- o t H2O + CO2 + CO32- 0,05 0,025 mol CO32- + Ca2+ → CaCO3 0,02 0,02 mol CO32- + Mg2+ → MgCO3 0,005 0,005mol
Sau khi đun, trong cốc nước còn lại 0,01 mol Na+; 0,005 mol Mg2+ và 0,02 mol Cl.
Do còn muối MgCl2 nên nước cứng thu được là nước cứng vĩnh cửu.
Câu 39. [CTST – SBT] Hai chất nào sau đây được dùng để làm mềm nước có tính cứng vĩnh cửu? A. NaCl và Ca(OH)2 B. Na2CO3 và Na3PO4 C. Na2CO3 và Ca(OH)2 D. Na2CO3 và HCl
Câu 40. [CTST – SBT] Phản ứng giải thích sự hình thành thạch nhũ các hang động núi đá vôi là:
A. CaCO3 + CO2 + H2O → Ca(HCO3)2
B. CaCO3 + 2HCl → CaCl2 + CO2 C. CaCO3 → CaO + O2
D. Ca(HCO3)2 → CaCO3 + CO2 + H2O
Câu 41. [CTST – SBT] Hợp chất Y của Canxi là thành phần chính của vỏ các
loại ốc,sò. . Ngoài ra Y được sử dụng rộng rãi trong sản xuất vôi , xi măng , thủy
tinh , chất phụ gia trong công nghiêp thực phẩm, Hợp chất Y là A. CaO. B. CaCO3. C. Ca(OH)2. D. Ca3(PO4)2.
Câu 42. [CTST – SBT] Cho sơ đồ chyển hóa sau:
Biết X, Y, Z, E, G là các hợp chất khác nhau, mỗi mũi tên ứng với một phương
trình hóa học của phản ứng xảy ra giữa hai chất tương ứng. Các chất E,G trong sơ đồ trên lần lượt là A. Na2SO4, NaOH. B. NaHCO3, BaCl2. C. CO2, NaHSO4. D. Na2CO3, HCl. Hướng dẫn trả lời
Phương trình hóa học của các phản ứng trong sơ đồ: Ba(OH)2 + 2CO2 → Ba(HCO3)2
BaCO3 + NaHSO4 → BaSO4 + NaHCO3 Ba(OH)2 + CO2 → BaCO3 + H2O
Ba(HCO3 )2+ 2NaHSO4 → BaSO4 + 2CO2 + Na2SO4 + 2H2O
Câu 43. [CTST – SBT] Nước thải công nghiệp thường chứa các ion kim loại năng
như Hg2+, Pb2+, Fe3+. Để xử lí toàn bộ và làm giảm nồng độ của các ion kim loại
nặng với chi phí thấp, người ta sử dụng dung dịch chất nào sau đây? A. HCl B. NaCl C. Ca(OH)2 D. K2SO4
Câu 44. [CTST - SBT] Cho các phát biểu sau:
a) Tất cả các kim loại kiềm thổ đều tan trong nước
b) Các kim loại kiềm có thể đẩy được kim loại yếu hơn ra khỏi dung dịch muối của chúng
c) Các ion Na+, Mg2+, Al3+, có cùng cấu hình electron ở trạng thái cơ bản và đều có tính oxi hóa yếu.
d) Các kim loại kiềm K, Rb, Cs tự bốc cháy khi tiếp xúc với nước.
e) Kim loại magnesium có cấu trúc mạng tinh thể lục phương.
Trong các phát biểu trên số phát biểu đúng là A. 2. B. 3. C. 4. D. 5. Hướng dẫn trả lời
a) Sai vì Be không tan trong nước kể cả khi đun nóng
b) Sai vì Cho Na phản ứng với dung dịch muối CuSO4
Ban đầu, Na sẽ tác dụng với nước trước tạo NaOH và sủi bọt khí, sau đó có kết tủa xanh và không tan Phương trình hóa học 2Na + 2H2O → 2NaOH + H2
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2
Câu 45. [CTST - SBT] Cho dãy chuyển hóa sau: C 2 O H2O NaOH
X Y X Công thức của Y có A. CaO. B. Ca(OH)2. C. CaCO3. D. Ca(HCO3)2.
Câu 46. [CTST - SBT] Để xử lí chất thải có tính acid người ta thường dùng A. nước vôi. B. phèn chua. C. giấm ăn. D. muối ăn.
Câu 47. [CTST - SBT] Hợp chất của calcium nào sau đây không gặp trong tự nhiên? A. CaCO3. B. CaSO4. C. Ca(HCO3)2. D. CaO.
Câu 48. [CTST - SBT] Phát biểu nào sau đây không đúng?
A. Đun sôi nước cứng chỉ làm mềm nước cứng tạm thời.
B. Dung dịch Na2CO3 làm mềm nước cứng tạm thời, nước cứng vĩnh cửu.
C. Dung dịch NH4Cl làm mềm nước cứng.
D. Cho dung dịch Ca(OH)2 vừa đủ làm mềm nước cứng tạm thời.
Câu 49. [CTST - SBT] Cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 sẽ
A. có kết tủa trắng
B. có bọt khí thoát ra.
C. có kết tủa trắng và có bọt khí.
D. không có hiện tượng gì.
Câu 50. [CTST - SBT] Nguyên tắc làm mềm nước cứng là làm giảm nồng độ của A. ion Ca2+, Mg2+. B. ion HCO -3. C. ion Cl-, SO42-. D. ion Ca2+.
Câu 51. [CTST - SBT] Chất nào sau đây không bị phân huỷ khi đun nóng? A. Mg(NO3)2. B. CaCO3. C. NaNO3. D. Mg(OH)2.
Câu 52. [CTST - SBT] Trường hợp nào không xảy ra phản ứng đối với dung dịch Ca(HCO3)2 khi A. đun nóng.
B. trộn với dung dịch Ca(OH)2
C. trộn với dung dịch HCl. D. cho NaCl vào.
Hướng dẫn trả lời A. Ca(HCO o t 3)2 CaCO3 + CO2 + H2O
B. Ca(OH)2 + Ca(HCO3)2 → 2CaCO3 + 2H2O
C. 2HCl + Ca(HCO3)2 → CaCl2 + 2CO2 + 2H2O D. không phản ứng
Câu 53. [CTST - SBT] Kim loại nhóm IIA có nhiệt độ nóng chảy, nhiệt độ sôi,
khối lượng riêng biến đổi không theo quy luật như kim loại kiềm, do các kim loại nhóm IIA có
A. điện tích hạt nhân khác nhau.
B. cấu hình electron khác nhau.
C. bán kính nguyên tử khác nhau.
D. kiểu mạng tinh thể khác nhau.
Câu 54. [KNTT - SBT] Ở trạng thái cớ bản, cấu hình electron lớp ngoài cùng của
các kim loại nhóm IIA có dạng chung là A. ns1. B. ns2. C. ns2np3. D. ns2 np5.
Câu 55. [KNTT - SBT] Nguyên tố calcium đóng vai trò thiết yếu cho việc phát
triển xương, góp phần duy trì hoạt động của cơ bắp, truyền dẫn thần kinh, tăng
cường khả năng miễn dịch. Trong cơ thể người, phần lớn calcium tập trung ở A. xương. B. răng. C. cơ. D. Móng
Câu 56. [KNTT - SBT] Trong cơ thể người, ion Mg2+ (Z = 12) tham gia cấu trúc
tế bào, tổng hợp protein và tổng hợp chất sinh năng lượng ATP. Tổng số hạt
proton và electron của ion Mg2+ là A. 26. B. 24. C. 22. D. 20. Hướng dẫn trả lời Ion Mg2+ có: Số proton: 12 Số electron: 10
Tổng số hạt proton và electron của ion Mg2+ là: 12 + 10 = 22.
Câu 57. [KNTT - SBT] Vôi đen (quặng dolomite nghiền nhỏ) được sử dụng chủ
yếu trong luyện kim, phân bón và nuôi trồng thuỷ sản. Thành phần chính của vôi đen là A. 3Ca3(PO4)2.CaF2. B. CaSO4.2H2O.
C. CaCO3.MgCO3. D. CaO.
Câu 58. [KNTT - SBT] Ở nơi tồn ứ rác thải, chất nào sau đây được các công nhân
vệ sinh môi trường dùng để xử lí tạm thời nhằm sát trùng, diệt khuẩn, phòng chống dịch bệnh? A. Cát vàng. B. Than đá. C. Đá vôi. D. Vôi bột.
Câu 59. [KNTT - SBT] Khi đun nóng đến 60°C, thạch cao sống mất một phần
nước trở thành thạch cao nung, được dùng để đúc khuôn trong điêu khắc, bó bột
trong y học. Thàn phần chính của thạch cao nung là A. CaSO4.0,5H2O. B. Ca(H2PO4)2. C. CaCO3. D. Ca(OH)2.
Câu 60. [KNTT - SBT] Trong tự nhiên, calcium sulfate tồn tại dưới dạng muối
ngậm nước (CaSO4.2H2O) được gọi là A. vôi sống. B. vôi tôi.
C. thạch cao sống. D. đá vôi.
Câu 61. [KNTT - SBT] Hợp chất nào của calcium là thành phần hoá học chính
của quặng apatite và phosphorite, được dùng trong công nghiệp sản xuất phân bón superphosphate? A. CaCO3. B. Ca3(PO4)2. C. Ca3P2. D. Ca(OH)2.
Câu 62. [KNTT - SBT] Trong nông nghiệp, trộn urea hoặc phân đạm ammonium
với chất nào sau đây thì sẽ làm giảm đáng kể tác dụng của phân đạm? A. KNO3. B. Ca(H2PO4)2. C. Ca(OH)2. D.CaCl2. Hướng dẫn trả lời
Trong nông nghiệp, trộn urea hoặc phân đạm ammonium với Ca(OH)2 sẽ làm
giảm đáng kể tác dụng của phân đạm do làm thất thoát nitrogen. OH- + NH4+ → NH3 + H2O
Câu 63. [KNTT - SBT] Hiện tượng “nước chảy đá mòn” và hiện tượng “xâm
thực” của nước mưa vào các phiến đá vôi là do trong nước có hoà tan khí nào sau đây? A. O2. B. N2. C. CH4. D. CO2.
Câu 64. [KNTT - SBT] Kim loại nào sau đây cháy trong khí oxygen tạo thành sản phẩm là peroxide? A. Be. B. Mg. C. Ca. D. Ba.
Câu 65. [KNTT - SBT] Ở nhiệt độ thường, kim loại nào sau đây phản ứng chậm với nước? A. Mg. B. Ca. C. Sr. D. Ba.
Câu 66. [KNTT - SBT] Có thể nhận biết dung dịch BaCl2 bằng dung dịch chất nào sau đây? A. NaOH. B. Na2CO3. C. NaCl. D. NaNO3.
Câu 67. [KNTT - SBT] Muối nào sau đây chỉ tồn tại trong dung dịch và bị phân huỷ khi đun nóng? A. Ca(NO3)2. B. Ca(HCO3)2. C. CaCl2. D. CaSO4.
Câu 68. [KNTT - SBT] Nước cứng gây nhiều tác hại trong đời sống và sản xuất
như đóng cặn đường ống dẫn nước, làm cho xà phòng có ít bọt khi giặt quần áo,
làm giảm mùi vị thực phẩm khi nấu ăn.
Nước cứng là nước có chứa nhiều các ion A. Ca2+ và Mg2+. B. Cl- và SO 2-. - 4 C. HCO3 và Cl-. D. Na+ và K+.
Câu 69. [KNTT - SBT] Phản ứng nào sau đây được gọi là phản ứng tôi vôi? A. CaCO3 → CaO + CO2.
B. Ca + 2H2O → Ca(OH)2 + H2
C. CaO + H2O → Ca(OH)2. D. 2Ca + O2 → 2CaO.
Câu 70. [KNTT - SBT] Khi đốt nóng tinh thể BaCl2 trong ngọn lửa đèn khí không
màu thì tạo ra ngọn lửa có màu A. tím nhạt. B. Đỏ son. C. Đỏ cam. D. Lục vàng.
Câu 71. [KNTT - SBT] Trong công nghiệp, kim loại kiềm thổ thường được điều
chế bằng phương pháp điện phân nóng chảy muối chloride. Quá trình khử xảy ra tại cathode là A. M → M+ + 1e. B. M+ + 1e → M. C. M → M2+ + 2e. D. M2+ + 2e → M.
Câu 72. [KNTT - SBT] Nhận định nào sau đây về nước cứng tạm thời là không đúng?
A. Chứa nhiều ion Ca2+ và Mg2+.
B. Chứa nhiều ion HCO -3.
C. Chứa nhiều ion Cl- và SO 2- 4
D. Đun sôi để trở thành nước mềm.
Câu 73. [KNTT - SBT] Độ tan trong dãy muối sulfate từ MgSO4 đến BaSO4 biến đổi như thế nào? A. Tăng dần. B. Giảm dần.
C. Không có quy luật. D. Không đổi. Hướng dẫn trả lời
Độ tan trong dãy muối sulfate từ MgSO4 đến BaSO4 giảm dần: + MgSO4 tan trong nước;
+ CaSO4, SrSO4 ít tan trong nước;
+ BaSO4 không tan trong nước.
Câu 74. [KNTT - SBT] Độ bền nhiệt trong dãy muối carbonate từ MgCO3 đến
BaCO3 biến đổi như thế nào? A. Tăng dần. B. Giảm dần.
C. Không có quy luật. D. Không đổi.
Câu 75. [KNTT - SBT] Ở nhiệt độ phòng, hydroxide nào sau đây có độ tan lớn nhất?




