










Preview text:
lOMoAR cPSD| 47207367
ÔN TẬP HÓA ĐẠI CƯƠNG - HỮU CƠ
I) ÔN TẬP ĐẠI CƯƠNG VỀ HÓA HỌC HỮU CƠ (đã học ở THPT) 1) Đặc điểm chung Thành phần
Bắt buộc có C, nhiều thứ nhì là H, ngoài ra là N, O, P, S, halogen,.... Cấu tạo
Là các liên kết cộng hóa trị (liên kết đơn hoặc liên kết bội). Tính chất vật lý
Kém bền nhiệt, dễ cháy, nhiều chất khó tan trong nước.
Tính chất hóa học
Phản ứng xảy ra khá chậm, nhiều hướng, ra nhiều sản phẩm.
- Định nghĩa : Hóa học hữu cơ là học thuyết hóa học và là 1 ngành của hóa học chuyên nghiên cứu về các
hydrocarbon và dẫn xuất của chúng.
2) Ph â n loại
- Dựa theo mạch C (có vòng, không vòng)
- Dựa theo thành phần phân tử (hydrocarbon, dẫn xuất hydrocarbon) Danh ph áp
- Danh pháp thông thường : formol, menthol, acetone,..... - Danh pháp IUPAC :
+ Chọn mạch chính là mạch có tổng số C lớn nhất và là mạch dài nhất.
+ Đánh số 1 cho C rơi vào 1 trong số các trường hợp sau :
✓ C là C đầu mạch chứa nhóm chức chính (nhóm thế) hay liên kết bội.
✓ C là C gần nhất với C chứa nhóm chức chính (nhóm thế), liên kết bội hoặc phân nhánh đầu tiên.
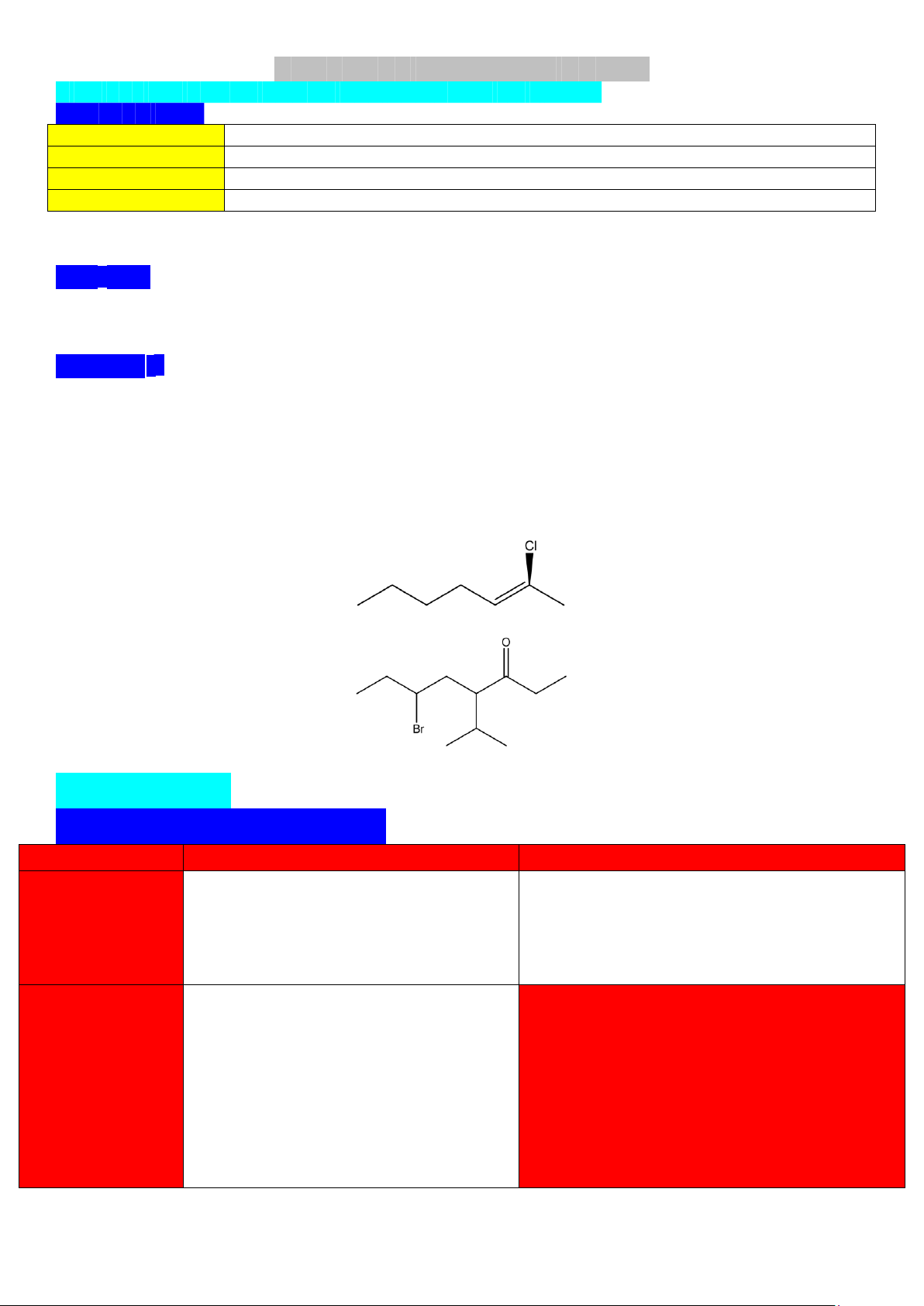
+ Mức độ ưu tiên nhóm chức tuân theo thứ tự : -COOH > -COO- > -CHO > -OH > -NH2 > -O-. 2-chlorohepta-2-ene.
6-bromo-4-isopropyloctan-3-one. II) HYDROCARBON
1) Alkane - cycloalkane (hydrocarbon no) Chất Alkane Cycloalkane Cấu tạo mạch và -
Tất cả alkane đều mạch hở, chỉ chứa -
Các vòng 3, 4 cạnh kém bền do sức căng tính bền
liên kết đơn trong phân tử. Baeyer. - Khá bền vững. -
Các vòng cạnh 5, 6 bền hơn. -
Dạng vòng 6 cạnh tồn tại 2 dạng : dạng ghế và
dạng thuyền (bền hơn). -
Tồn tại ở cả 3 dạng : + C1 - C4 : khí. + C5 - C19 : lỏng. + C20 trở lên : rắn Tính chất vật lý -
Nhẹ hơn nước, ít tan trong nước nhưng
tan trong các dung môi hữu cơ. -
Nhiệt độ sôi và nóng chảy tăng khi
mạch C càng dài, nhưng khi có nhánh thì lại giảm. 1 lOMoAR cPSD| 47207367
A) Phản ứng đặc trưng cho cả 2 là phản ứng thế gốc tự do (SR - radical substitution) Gồm 3 bước :
+ Initiation (Khơi mào): Phân cắt đồng ly tạo gốc tự do tạo 2 gốc tự do giống nhau.
+ Propagation (Truyền đi): Các gốc tự do được tạo ra liên tục để liên tục tạo ra các sản phẩm.
+ Termination (Kết thúc) : Các gốc tự do dư kết hợp với nhau. 2 lOMoAR cPSD| 47207367
Tính chất hóa học Ví dụ :
+ Khi trong phân tử có các C với nhiều bậc khác nhau thì sản phẩm chính sẽ rơi vào sản phẩm thế vào C bậc cao nhất.
+ Các vòng kém bền như cyclopropane hay cyclobutane lại cho phản ứng cộng mở vòng
B) Phản ứng cracking Xúc tác : Mn2+
- Phương pháp cracking từ C4H10 thành CH3COOH được áp dụng cho các alkane đối xứng tương ứng.
C) Phản ứng oxi hóa
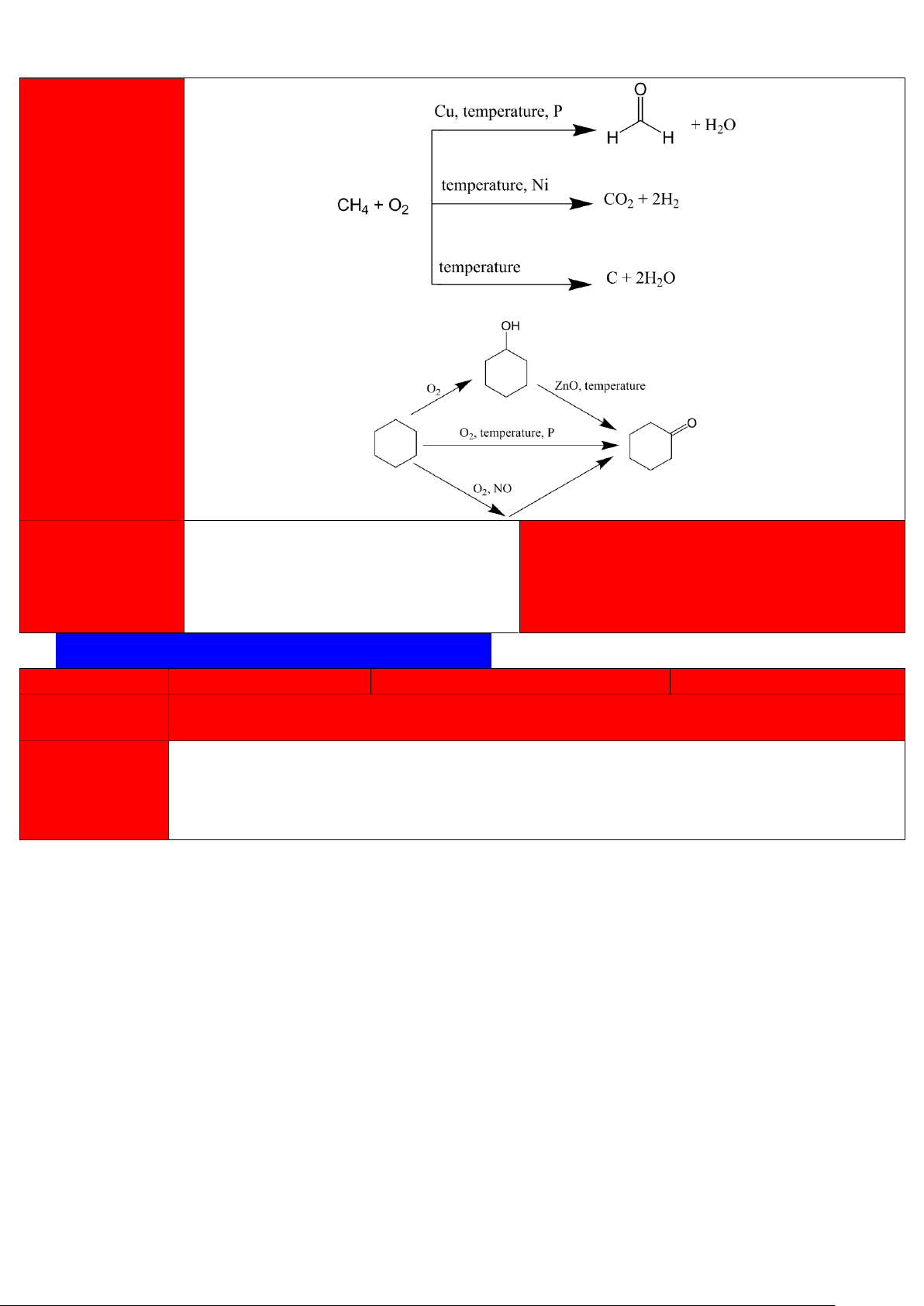
- Oxi hóa hoàn toàn : Tỏa nhiệt mạnh 3 CH4 + O2 → CO2 + 2H2O ΔH = -880 kJ/mol 2
- Oxi hóa không hoàn toàn : 3 lOMoAR cPSD| 47207367
- Oxi hóa cyclohexane :
CH4 : khí thiên nhiên, nhiên liệu.
Vaseline : là hỗn hợp các alkane C12 - C15 dùng
làm tá dược thuốc mỡ.
Parafin : hỗn hợp alkane C19 - C35rắn mềm, làm Ứng dụng tá dược, bao gói.
2) Alkene - alkadiene - alkyne (hydrocarbon không no) Chất Alkene Alkadiene Alkyne Cấu tạo và tính
Đã học ở bậc trung học phổ thông chất cơ bản Tính chất vật lý -
Các alk-1-ene và alk-1-yne đều có nhiệt độ sôi thấp hơn alkane tương ứng. -
Liên kết bội càng ở giữa phân tử thì nhiệt độ nóng chảy và nhiệt độ sôi càng tăng. -
Đồng phân trans có nhiệt độ sôi thấp hơn và nhiệt độ nóng chảy cao hơn so với đồng phân cis. 4 lOMoAR cPSD| 47207367
Tính chất hóa học - Phản ứng đặc trưng của các hydrocarbon không no là phản ứng cộng electrophile (AE).
+ Đối với alkene :
+ Đối với alkadiene : 5 lOMoAR cPSD| 47207367
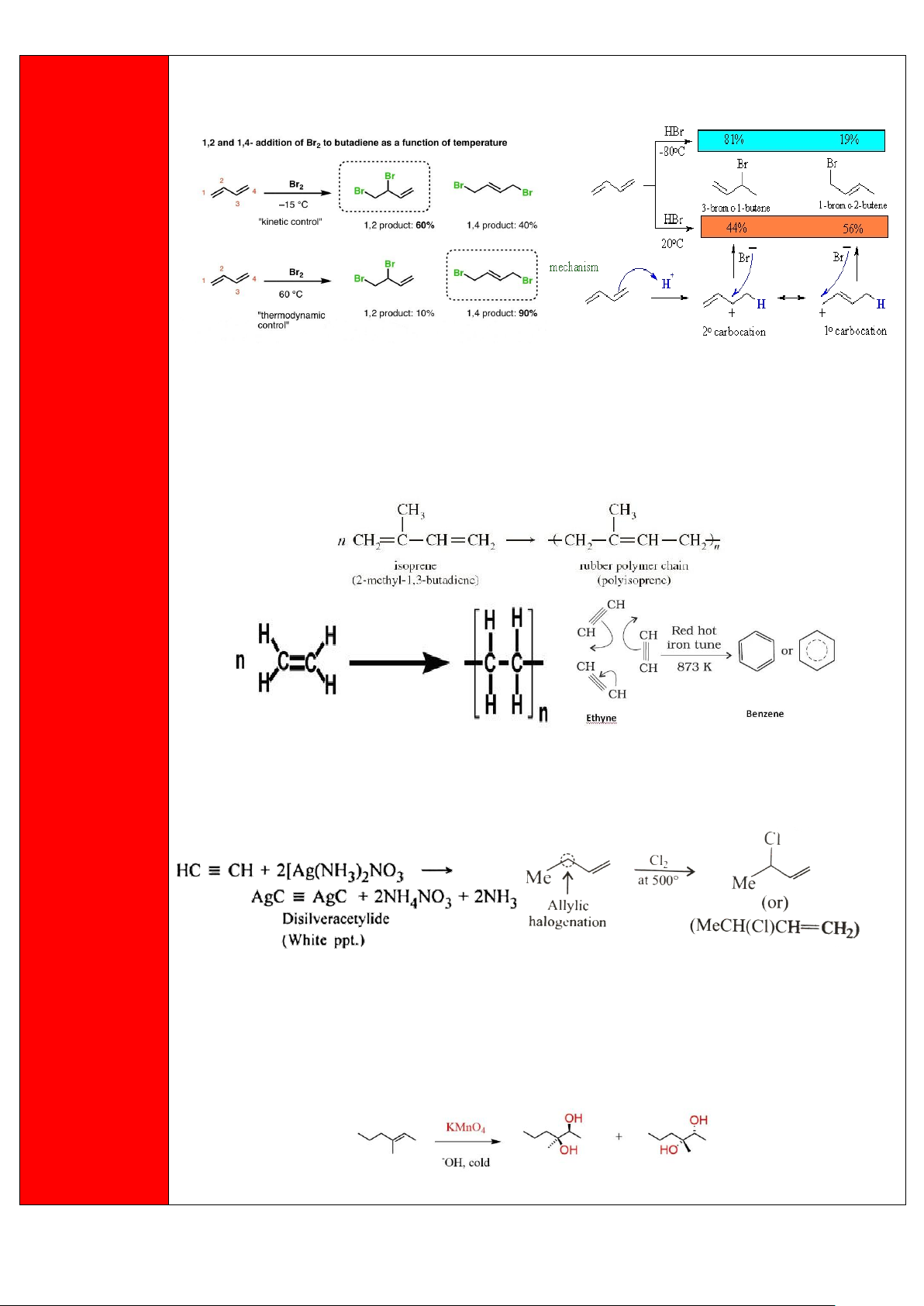
Các quá trình cộng Br2 và HBr vào buta-1,3-diene và tỷ lệ các sản phẩm khác nhau theo nhiệt độ
+ Các alkyne cũng có phản ứng tương tự
Riêng đối với phản ứng cộng H2 thì Pd/BaSO4/quinoline cho sản phẩm cis-alkene, còn Na/NH3
lỏng sẽ cho sản phẩm trans-alkene.
+ Phản ứng trùng hợp (polymer hóa) :
Theo chiều kim đồng hồ : isoprene, acethylene và ethylene
+ Phản ứng thế H linh động (H-alpha) : Do chịu ảnh hưởng từ hiệu ứng -C hoặc -I của liên kết
bội nên H ở vị trí alpha so với liên kết bội mang tính acid.
Hình trái : Sự thế H ở acetylene bằng Ag Hình phải :
Sự halogen hóa ở vị trí allyl ở but-1-ene.
+ Phản ứng oxi hóa : ✓
Đốt cháy hoàn toàn : tỏa nhiều nhiệt. ✓
Oxi hóa không hoàn toàn : + Alkene : + Alkyne : 6 lOMoAR cPSD| 47207367
3) Benzene và d ẫ n xuất chứa v ò ng benzene. 7 lOMoAR cPSD| 47207367 A) Phân loại
- Benzene và đồng đẳng : Benzene, toluene, o-xylene,....
- Nhiều vòng thơm rời rạc : Diphenyl, diphenylmethane,...
- Nhiều vòng thơm ngưng tụ : Naphthalene, anthracene,... B) Lý tính : Là chất lỏng hoặc rắn, không tan trong
nước, tan nhiều trong dung môi hữu cơ. C) Hóa tính
- Vòng benzene có đặc điểm là dễ thế, khó cộng.
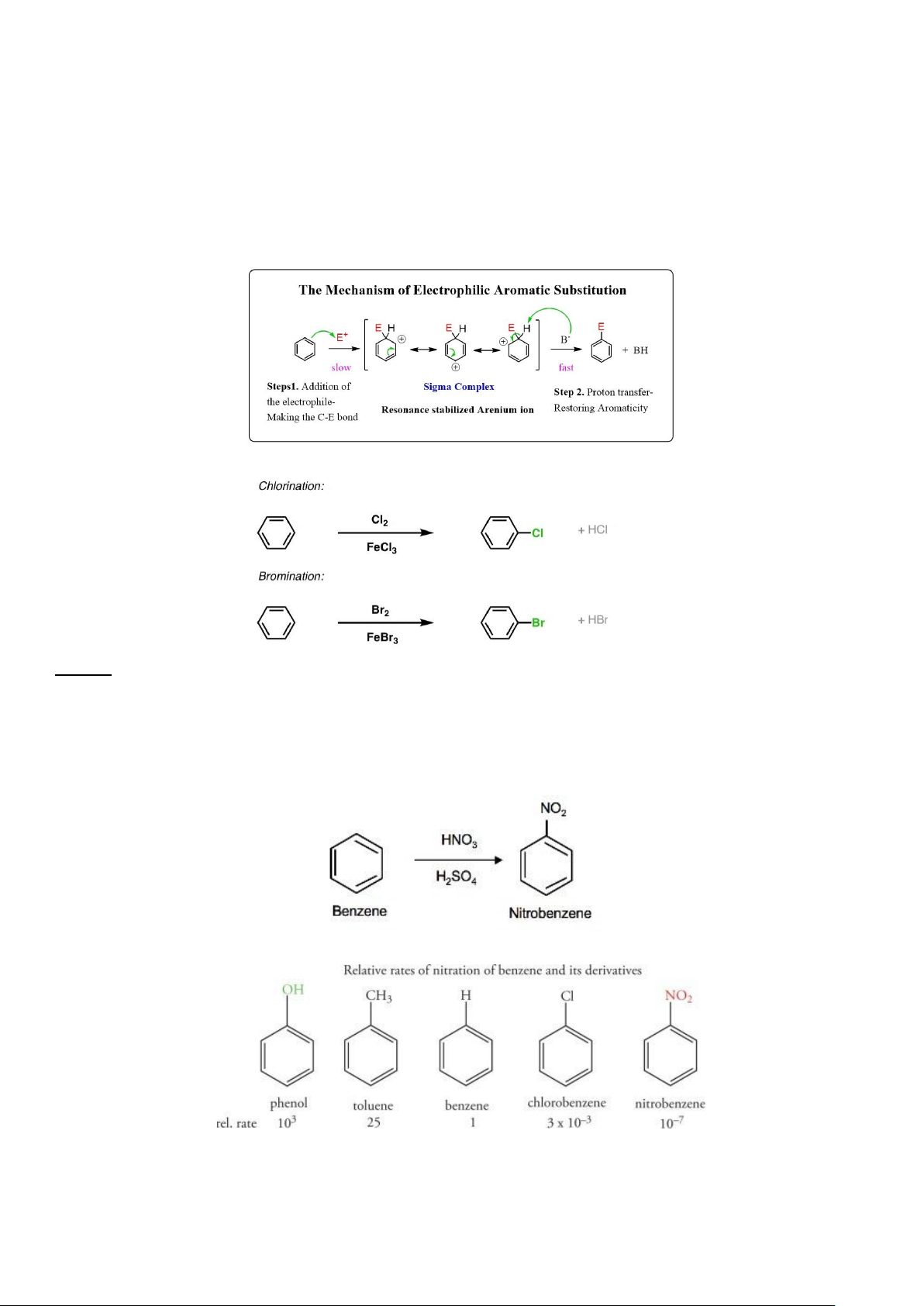
- Phản ứng đặc trưng cho các hợp chất chứa vòng benzene là phản ứng thế electrophile vòng thơm (SEAr). + Cơ chế :
+ Phản ứng thế halogene : LƯU Ý :
- Có thể ghi X2 / FeX3 hoặc X2 / Fe (với X = Cl, Br)
- FeX3 cũng có thể được thay thế bằng AlX3, do cả FeX3 và AlX3 đều là các Lewis acid, lấy X-, còn phần tử X+ tự do
tham gia thế vào vòng theo cơ chế SEAr.
+ Phản ứng thế nitro (-NO2) :
+ Đối với quá trình thế theo cơ chế SEAr cho các hợp chất vòng benzene có gắn nhóm chức khác :
Ảnh hưởng tốc độ tham gia phản ứng thế nitro vào vòng benzene đối với các nhóm chức khác nhau
(tốc độ càng lớn thì sự thế càng dễ) 8 lOMoAR cPSD| 47207367
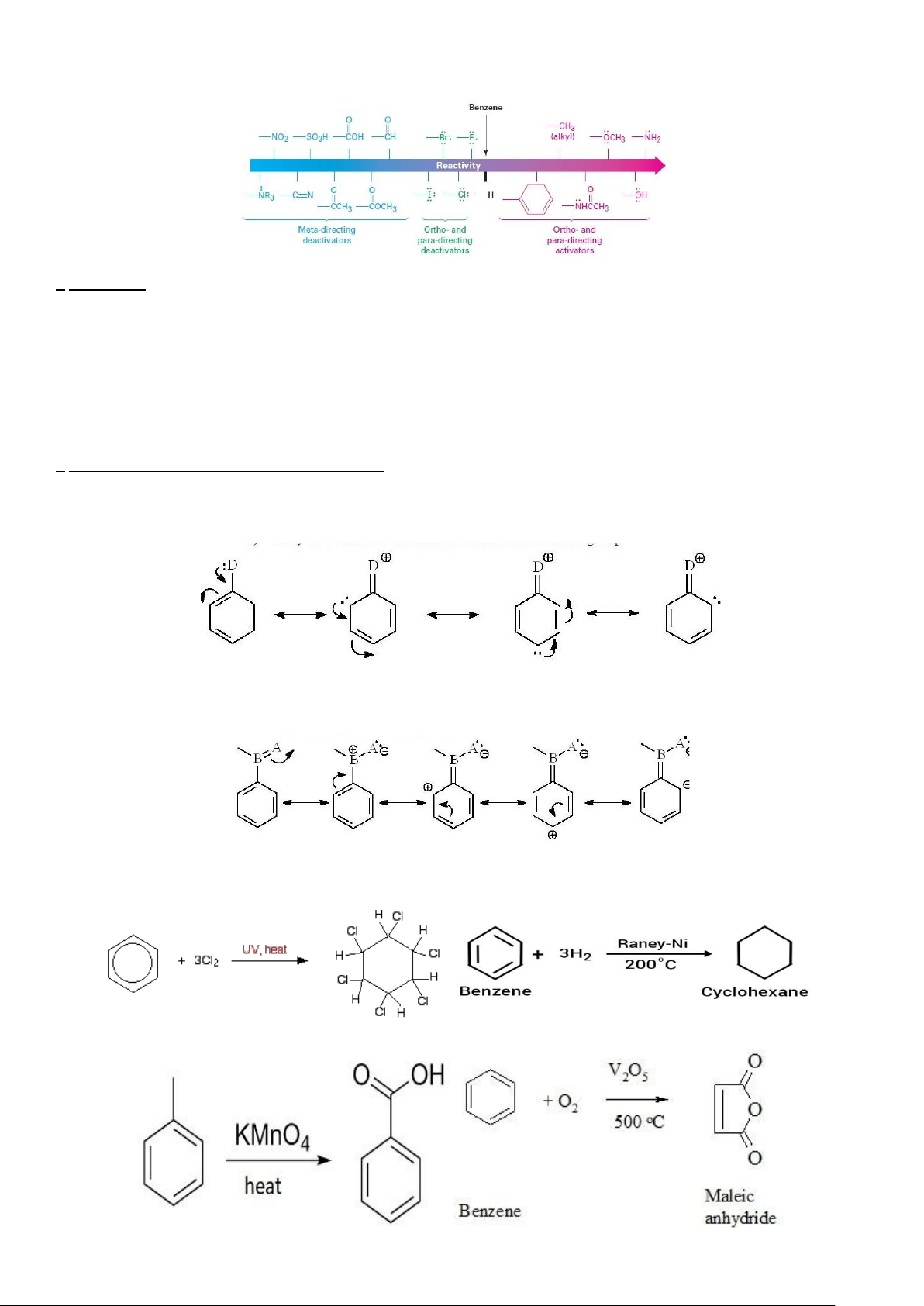
✓ Ta thấy có 1 mối quan hệ giữa các nhóm chức và khả năng thế vào vòng benzene.
✓ Mối quan hệ đó được tóm tắt bằng sơ đồ sau : * Diễn giải :
+ Đối với các nhóm chức có chứa liên kết bội (như -COOR, CH=O, -SO +
3H, -NO2,....) hoặc điện tích dương (-NR3 ,...)
thì sẽ phản hoạt hóa vòng benzene, đồng thời định hướng meta- cho nhóm thế sau.
+ Đối với các nhóm chức có chứa nhiều electron (như -NH2, -OH, -OCH3,...) hoặc điện tích âm thì sẽ hoạt hóa vòng
benzene, đồng thời định hướng ortho- hoặc para- cho nhóm thế sau.
+ Đối với nhóm halogen (-Cl, -Br,...) thì tuy phản hoạt hóa vòng thơm nhưng lại định hướng ortho- hoặc para- cho nhóm thế sau.
* Giải thích nguyên nhân (đọc tham khảo):
+ Ở các nhóm hoạt hóa vòng thơm hay thế vào vị trí o-, p- sẽ xảy ra các hiệu ứng +C (với vòng benzene,...); +H (với
nhóm -CH3,..); +I (-OH, alkyl, -NH2, halogene...) đẩy electron vào vòng benzene và xảy ra quá trình cộng hưởng như sau :
+ Ở các nhóm phản hoạt hóa vòng thơm hay thế vào vị trí m- sẽ xảy ra các hiệu ứng -C (với các nhóm chức chứa liên
kết bội); -H (các -CX3 như -CCl3, -CF3,...); -I (các nhóm chức có hiệu ứng -C, -H cũng sẽ có hiệu ứng -I), hút electron
khỏi vòng benzene và xảy ra quá trình cộng hưởng như sau : - Phản ứng cộng.
- Phản ứng oxi hóa : 9 lOMoAR cPSD| 47207367
- Benzene không tác dụng với KMnO4 nóng nhưng đồng đẳng của benzene có thể tác dụng được, xảy ra
quá trình phân cắt mạch tạo ra benzoic acid (ví dụ hình trái là toluene tác dụng với KMnO4 nóng).
D) Ứng dụng cơ bản : được dùng làm dung môi hoặc nguyên liệu tổng hợp trong hữu cơ (benzene), naphthalene
có mùi băng phiến, các hợp chất chứa vòng benzene thường độc và gây ung thư. 10 lOMoAR cPSD| 47207367 11 lOMoAR cPSD| 47207367 12 lOMoAR cPSD| 47207367
Tính chất hóa học -
Chỉ xảy ra trong môi trường base mạnh. -
Do tạo ra alkoxide ion là 1 anion nên sự tách sẽ chịu ảnh hưởng của nhóm thế, càng nhiều
nhóm thế đẩy electron thì anion này càng kém bền.
=> Sự tách ra này xảy ra dễ dàng theo sự giảm bậc alcohol : bậc 3 < bậc 2 < bậc 1.
* Tính acid - base của alcohol -
Alcohol là các acid yếu hơn H2O, gần như không tác dụng với dung dịch kiềm. -
Theo thuyết acid-base Brønsted - Lowry nên có thể suy ra rằng các base liên hợp của các
alcohol là các alkoxide đều là các base rất mạnh và mạnh hơn kiềm. -
Tính acid giảm dần theo bậc alcohol luôn kéo theo sự tăng tính base của các alkoxide tương ứng.
Ví dụ : (CH3)3CO- > (CH3)2CHO- > CH3CH2O- > CH3O- > OH-. -
Alcohol khan dễ dàng tác dụng với Na, Li và các kim loại kiềm,.....hoặc hỗn hợp kim loại
kiềm với NH3 lỏng (amide vô cơ - NaNH2, KNH2,...).
B) 1 số ph ả n ứng khác
1) Phản ứng tạo ether
- Phản ứng có thể ưu tiên xảy ra theo cơ chế thế nucleophile đơn phân tử SN1 (đối với các alcohol
chiếm nhiều không gian như alcohol bậc 3,...) hoặc thế nucleophile lưỡng phân tử SN2 (đối với
các alcohol không chiếm nhiều không gian như alcohol bậc 1,..). * Danh pháp ether :
- Thông thường sẽ theo cú pháp : tên gốc hydrocarbon + ether.
Ví dụ : CH3CH2-O-CH2CH3 : diethyl ether
CH2=CH-CH2-O-CH3 : allyl methyl ether.
- Các ether phức tạp thì có thể coi nhóm ether là alkoxy. 3-methoxyhexane.
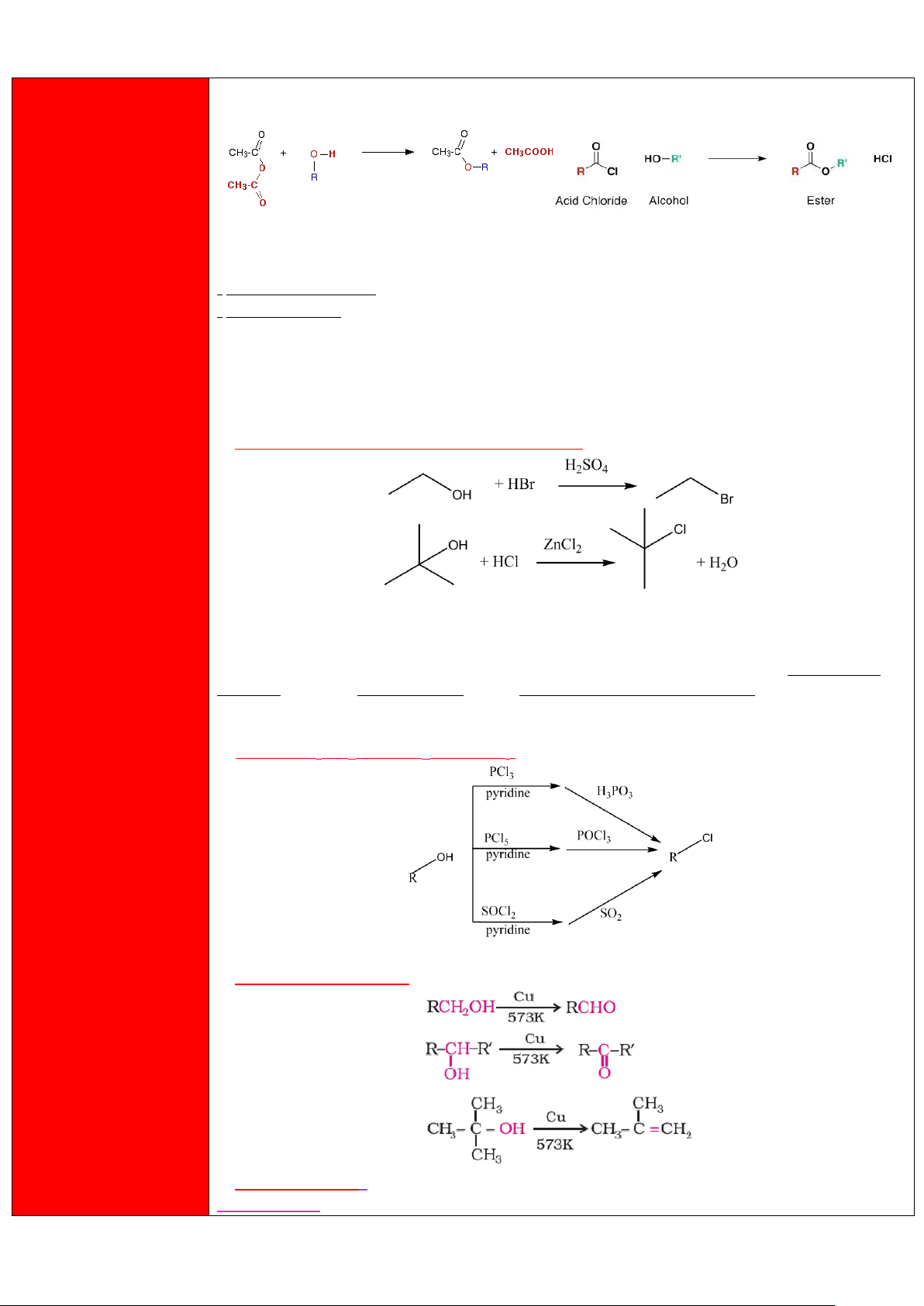
2) Phản ứng tạo ester (phản ứng acyl hóa - cơ chế thế acyl nucleophile SNAc) 13 lOMoAR cPSD| 47207367 14 lOMoAR cPSD| 47207367
Theo chiều kim đồng hồ : Ester hóa bằng carboxylic acid (Phản ứng ester hóa Fischer)
Ester hóa bằng acid anhydride
Ester hóa bằng acyl chloride
- Khả năng phản ứng : RCOCl (không cần xúc tác) > (RCO)2O (không cần xúc tác) > RCOOH.
- Đối với alcohol :
Do cơ chế có nét giống với cơ chế SN2 nên phản ứng sẽ thuận lợi với các alcohol không chiếm
nhiều không gian, do đó tốc độ phản ứng sẽ giảm dần theo chiều tăng của bậc => Bậc 1 > bậc 2 > bậc 3.
3) Phản ứng thế -OH bằng halogen
a) Sử dụng HX (phản ứng xảy ra theo cơ chế thế SN) -
Trong 2 phản ứng trên, phản ứng trên xảy ra theo cơ chế SN2, phản ứng dưới xảy ra theo cơ chế SN1. -
Khả năng phản ứng : HI > HBr > HCl > HF. -
HCl khó phản ứng nên cần có ZnCl2 là Lewis acid hỗ trợ cắt đứt liên kết C-O, do đó hỗn hợp conc-
HCl/ZnCl2 được gọi là thuốc thử Lucas dùng để phân biệt các bậc alcohol khác nhau.
Trong đó : bậc 3 > bậc 2 > bậc 1.
b) Sử dụng PX3, PX5 hoặc SOX2 (cơ chế SN2)
4) Phản ứng khử H2O và oxi hóa
a) Phản ứng dehydrate hóa b) Phản ứng oxi hóa * Alcohol bậc 1 : 15 lOMoAR cPSD| 47207367
- Phản ứng dừng lại ở bước (1) - aldehyde khi sử dụng các tác chất như PCC (pyridinium
chlorochromate) / DCM, PDC (pyridinium dichromate), Ag, Cu, Zn,.... 16 lOMoAR cPSD| 47207367
Pyridinium chlorochromate (PCC) Pyridinium dichromate (PDC) -
Phản ứng dừng lại ở bước (2) - carboxylic acid khi sử dụng các tác chất như
K2Cr2O7/H3O+, KMnO4/H3O+, tác chất Jones (CrO3/conc-H2SO4),..... * Alcohol bậc 2 :
Phản ứng này luôn xảy ra dù sử dụng bất cứ tác chất oxi hóa nào, sản phẩm là ketone * Alcohol bậc 3 :
Có 2 trường phái : -
Trường phái 1 : Không phản ứng (phần lớn các tài liệu nước ngoài đều công
nhận). - Trường phái 2 : Xảy ra trường hợp dehydrate hóa sau đó oxi hóa với ví dụ như sau : 1)
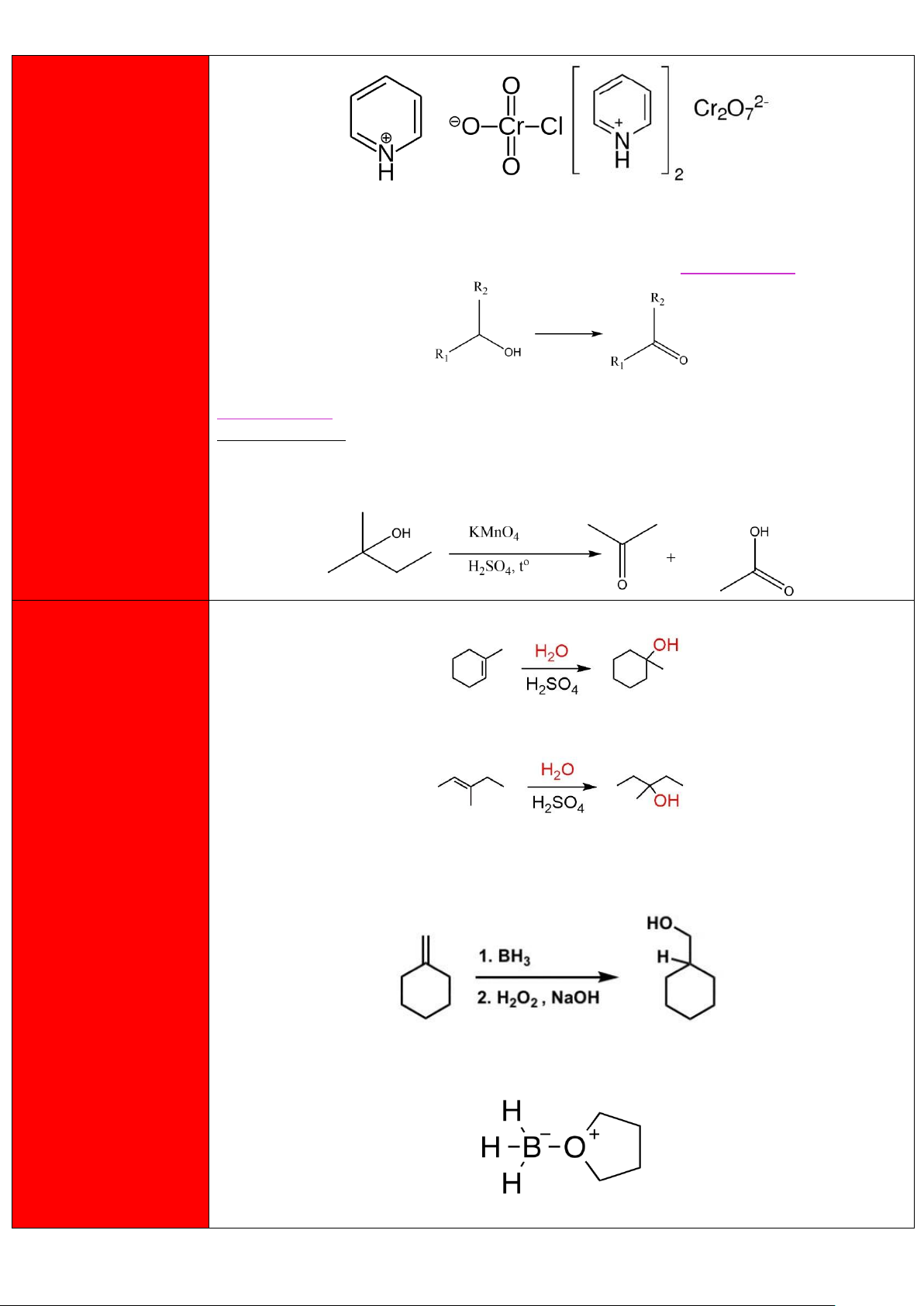
Cộng hợp nước vào alkene
Phản ứng xảy ra theo cơ chế cộng electrophile - AE và tuân theo quy tắc Markovnikov. 2)
Cộng tạo sản phẩm ngược Markovnikov
Do BH3 tương đối nguy hiểm khi dự trữ nên để an toàn thì thường sẽ sử dụng dạng dimer
B2H6 hoặc là dạng phức BH3-THF (THF là tetrahydrofuran), có cấu tạo như hình dưới. 17 lOMoAR cPSD| 47207367 3)
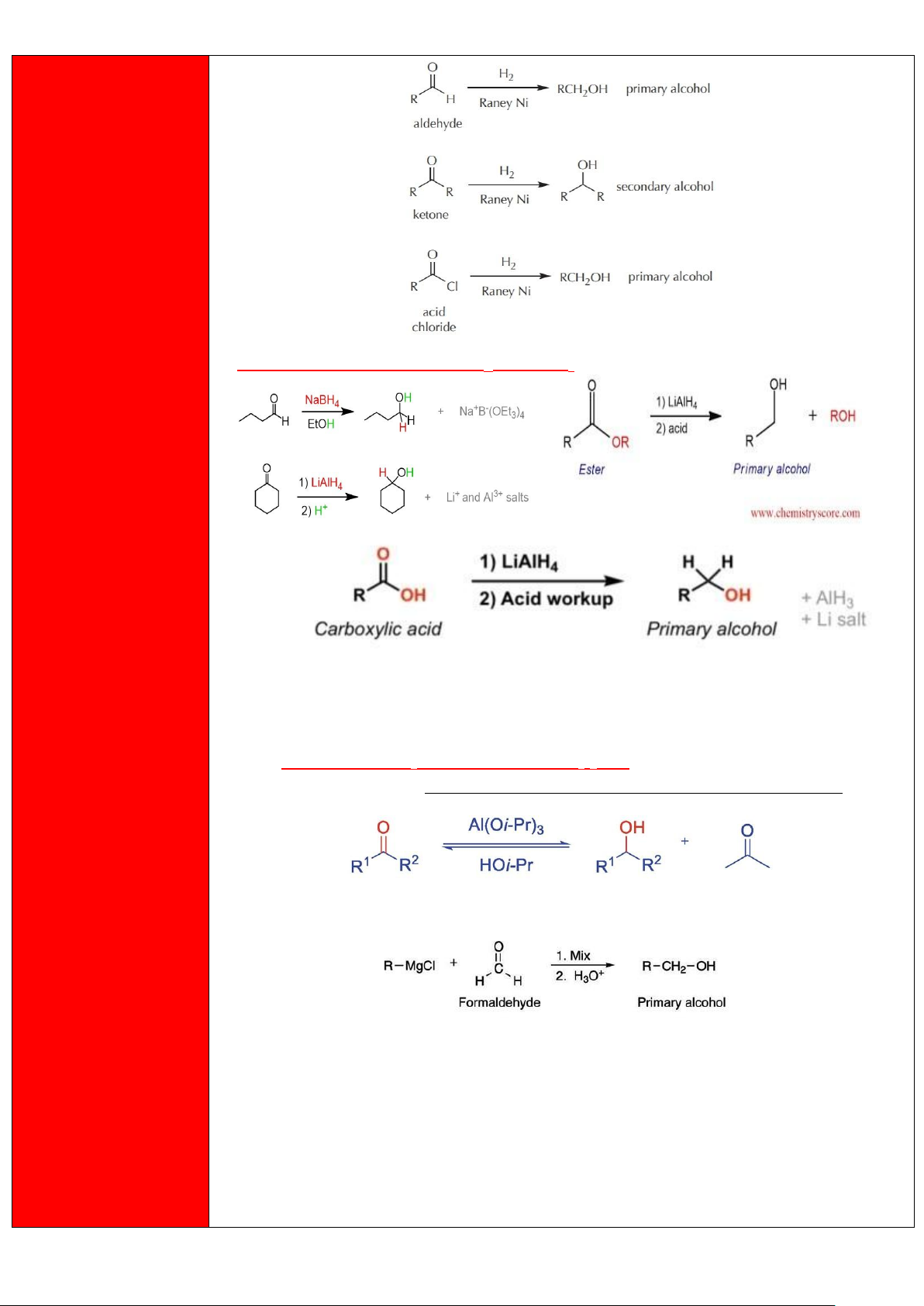
Khử hóa các hợp chất carbonyl và dẫn xuất a) Khử bằng H2 18 lOMoAR cPSD| 47207367
Phương pháp điều chế
b) Khử bằng các hydride như LiAlH4 hay NaBH4 -
LiAlH4 có thể phản ứng với bất kỳ hợp chất carbonyl nào (ester, aldehyde,
ketone, carboxylic acid). -
NaBH4 chỉ phản ứng với aldehyde hoặc ketone, không phản ứng với acid hay
ester. c) Khử bằng (i-PrO)3Al/ i-PrOH (i-Pr = (CH3)2CH-)
Phản ứng này còn có tên là phản ứng khử Meerwein - Ponndorf - Verley hay MPV.
4) Từ hợp chất Grignard (phản ứng theo cơ chế cộng nucleophile - AN) 19 lOMoAR cPSD| 47207367 20




