

Preview text:
3. Một số phản ứng cộng thân hạch.
3.1 Cộng với Cyanide.
Hydrogen Cyanide cộng vào liên kết đôi carbon-oxygen (C=O) trong aldehydes và
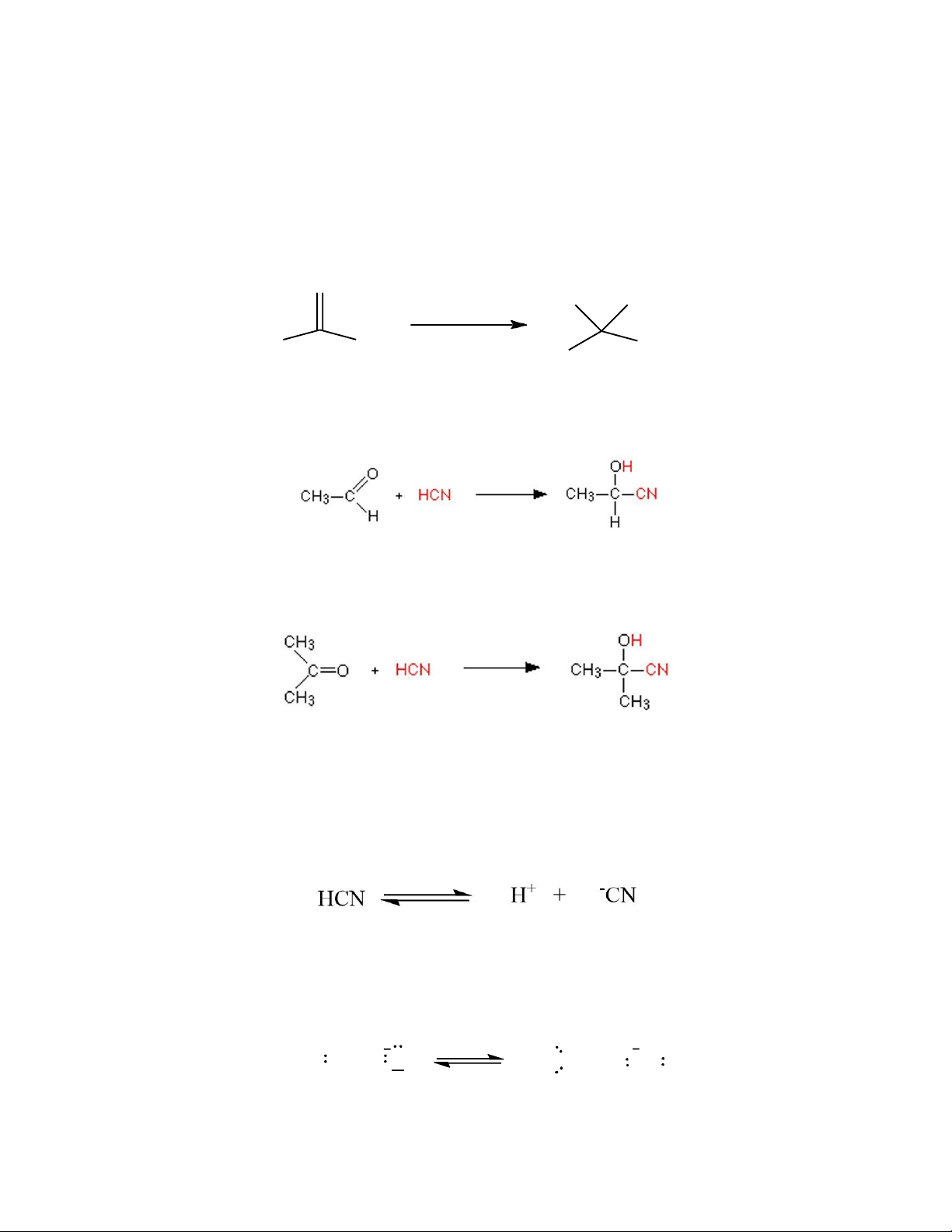
ketones để tạo ra các hợp chất được gọi là cyanohydrin (hydroxynitriles). O NaCN, HCl HO CN R H(R') H(R') R
Ví dụ: Hydrogen cyanide phản ứng với ethanal (một aldehyde) cho ra sản phẩm là 2- hydroxypropanenitrile.
Với propanone (một ketone), sản phẩm là 2-hydroxy-2-methylpropanenitrile.
Hydrogen Cyanide (HCN) là một loại khí cực độc và âm thầm vì chỉ phát hiện mùi của
nó ở nồng độ gây tử vong nên thường không sử dụng trực tiếp để tham gia phản ứng. Bên
cạnh đó, HCN là một acid yếu (pKa = 9.21), khó phân ly tạo ion cyanide (-CN), nồng độ
ion cyanide trong hỗn hợp phản ứng thấp nên khả năng tấn công thân hạch khó xảy ra.
Để cộng hợp thành công cần phải có phản ứng kiềm nhẹ như dung dịch đệm NaCN/KCN
– HCN. Trong dung dịch kiềm, nồng độ ion cyanua tăng lên và tấn công nucleophile vào
nhóm carbonyl, quá trình phản ứng có thể mô tả như sau: HCN + OH H2O + CN R R N C + C O N C C O R' R' R R N C C O + H C N N C C OH + C N R' R' Cơ chế gồm 2 bước:
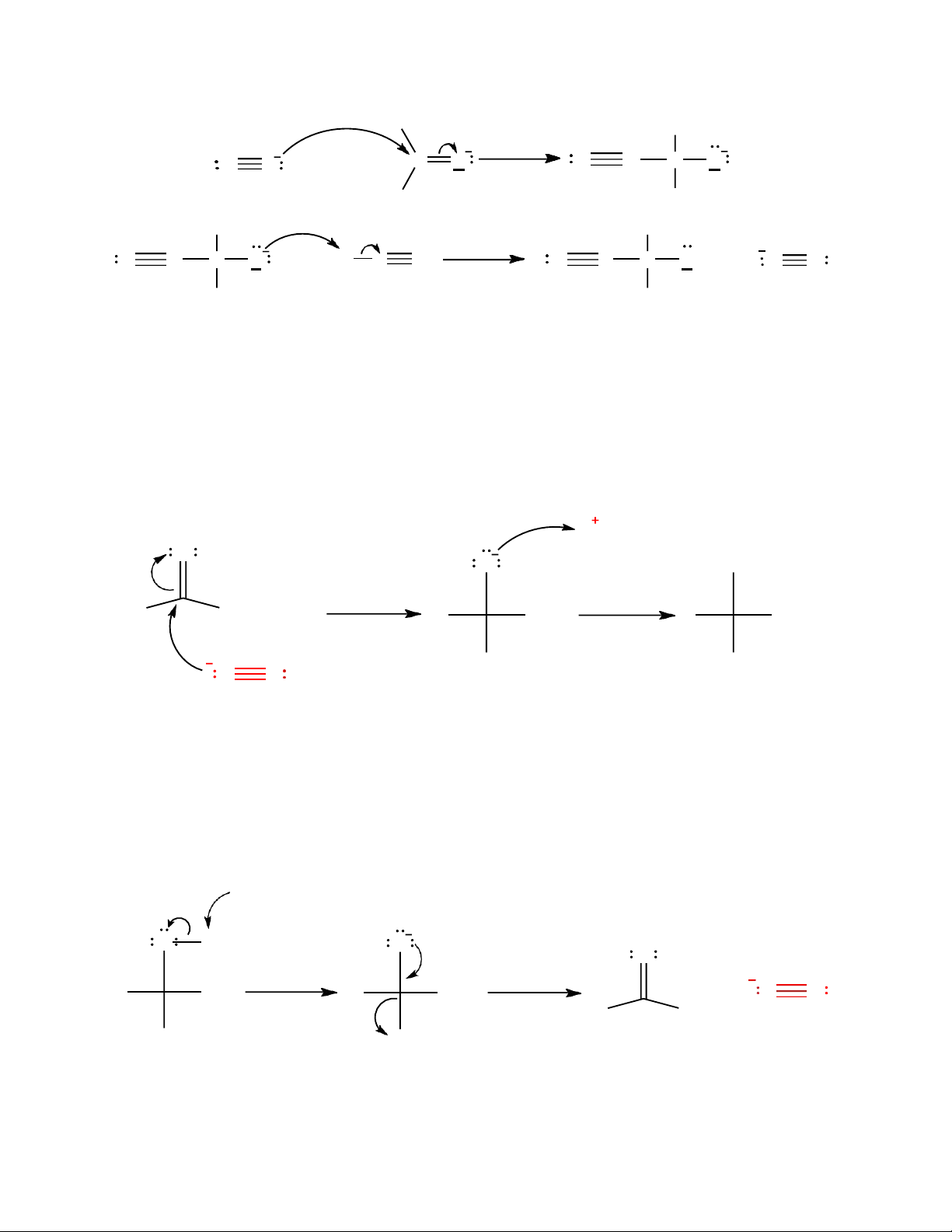
Bước 1: Ion CN- hoạt động như một nucleophile tấn công vào nguyên tử C của nhóm
carbonyl (C=O). Ở bước này một liên kết C – C mới được hình thành đồng thời liên kết
C=O cũng bị phá vỡ tạo thành anion cyanohydrin
Bước 2: Anion cyanohydrin nhận một proton H+ từ môi trường acid để tạo ra sản phẩm cuối cùng là cyanohydrin. H O O OH [1] [2] R H(R') R H(R') R H(R') CN CN C N ion cyanohydrin cyanohydrin
Từ cơ chế trên ta thấy rằng, môi trường acid cung cấp proton H+ để tạo ra sản phẩm
cyanohydrin. Vậy nên nếu không có môi trường acid, phản ứng sẽ không xảy ra.
Phản ứng tạo thành cyanohydrin là phản ứng thuận nghịch. Vì cyanide là một nhóm xuất
tốt nên cyanohydrin dễ dàng tham gia phản ứng thủy phân trong môi trường nước hoặc
base (cung cấp OH-) cho trở lại aldehyde hay ketone ban đầu. OH O H O O [1] [2] R H(R') R H(R') + C N R H(R') CN CN + H2O
Xét về cấu trúc, aldehyde ít có cản trở lập thể hơn ketone. Vậy nên aldehyde hoạt động
mạnh hơn ketone trong phản ứng cộng thân hạch
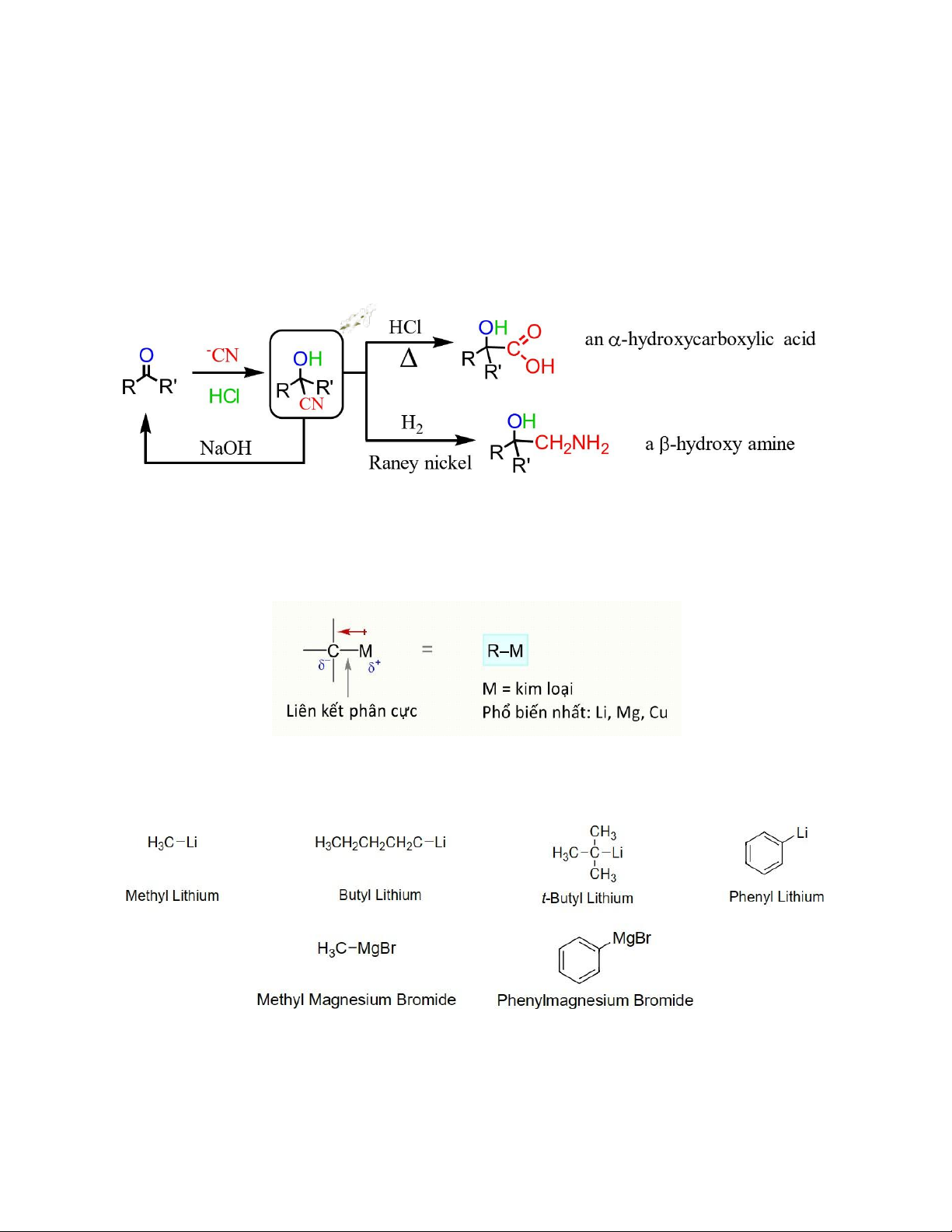
Phản ứng cộng cyanide vào aldehyde và ketone có ý nghĩa về mặt tổng hợp do sản phẩn
cyanohydrin là sản phẩn trung gian để tạo ra các hợp chất khác. Ví dụ khi thủy giải
cyanohydrin trong môi trường acid sẽ thu được sản phẩm là α-hydroxycarboxylic acid.
Ngoài ra, hydrogen hóa cyanohydrin xúc tác kim loại chuyển tiếp tạo thành anime mang
nhóm -OH tại vị trí carbon β.
3.2 Cộng với hợp chất cơ kim:
Hợp chất cơ – kim (hữu cơ – kim loại; organometallic) là hợp chất có chứa liên kết
carbon – kim loại có tính phân cực về phía carbon.
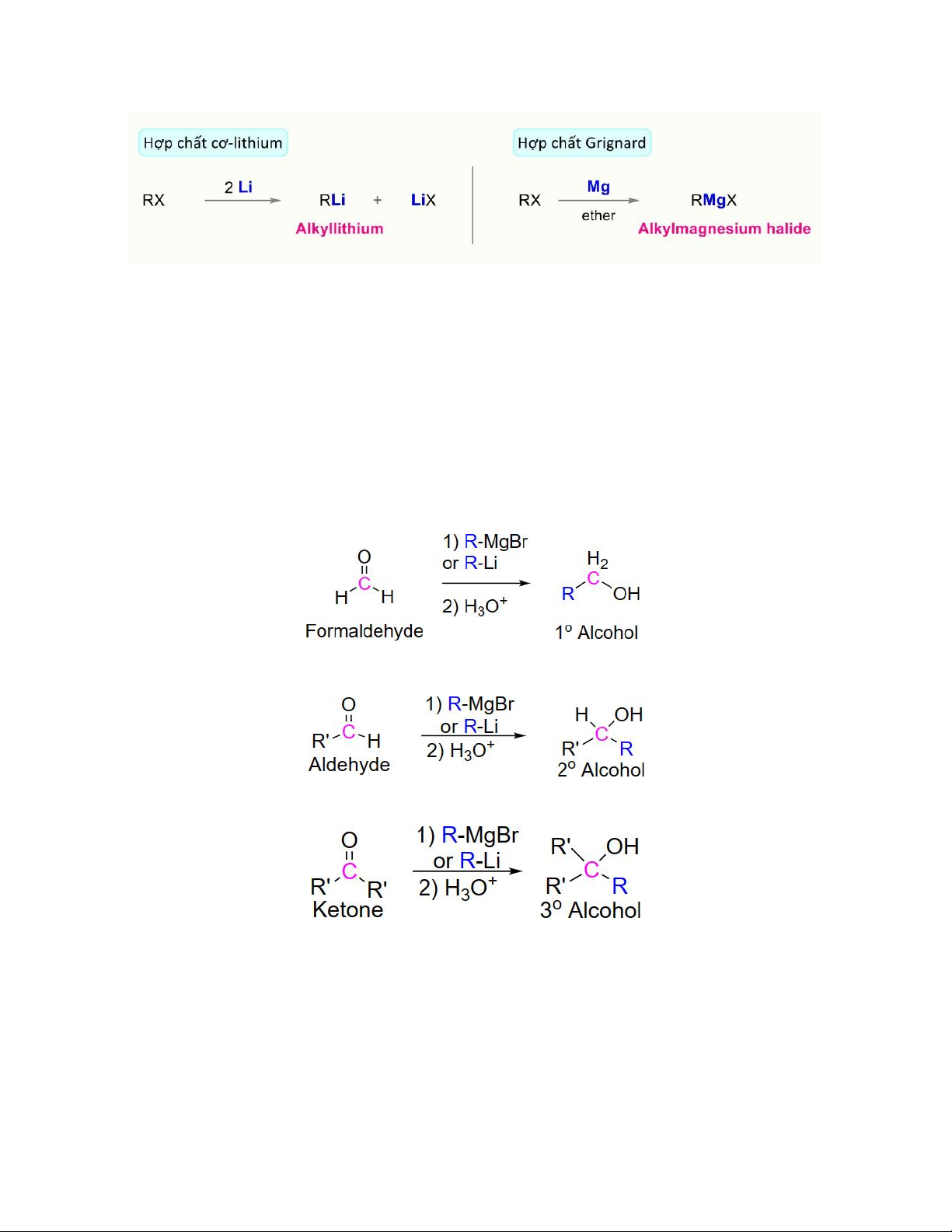
Các tác nhân phổ biến bao gồm cơ – lithium (tác nhân organolithium), cơ – magnessium
(tác nhân Grignard) , cơ – copper. Một số tác nhân organometallic phổ biến:
Tác nhân organolithium và Grignard được điều chế từ alkyl halide với kim loại tương ứng (Li và Mg)
Lithium và magnessium có độ âm điện khá nhỏ (1,0 và 1,2) so với carbon (2,5) nên liên
kết C – Li và C – Mg rất phân cực về phía carbon. Vì vậy RLi và RMgX là nguồn
carbanion (R-) có tính thân hạch mạnh. Aldehydes và ketones sẽ trải qua phản ứng cộng
thân hạch với các nucleophile của tác nhân organolithium và Grignard. Cacbon
nucleophile trong các tác nhân organometallic hình thành một liên kết sigma với cacbon
carbonyl dễ bị tấn công (C=O). Một gốc ion alkoxide được hình thành, sau đó trở thành
rượu khi proton hóa với một axit, bậc sản phẩm dựa vào tác chất ban đầu:
Cơ chế của phản ứng tương tự như phản ứng cộng cyanide, gồm 2 bước: gốc R- tấn công
thân hạch rồi proton hóa.
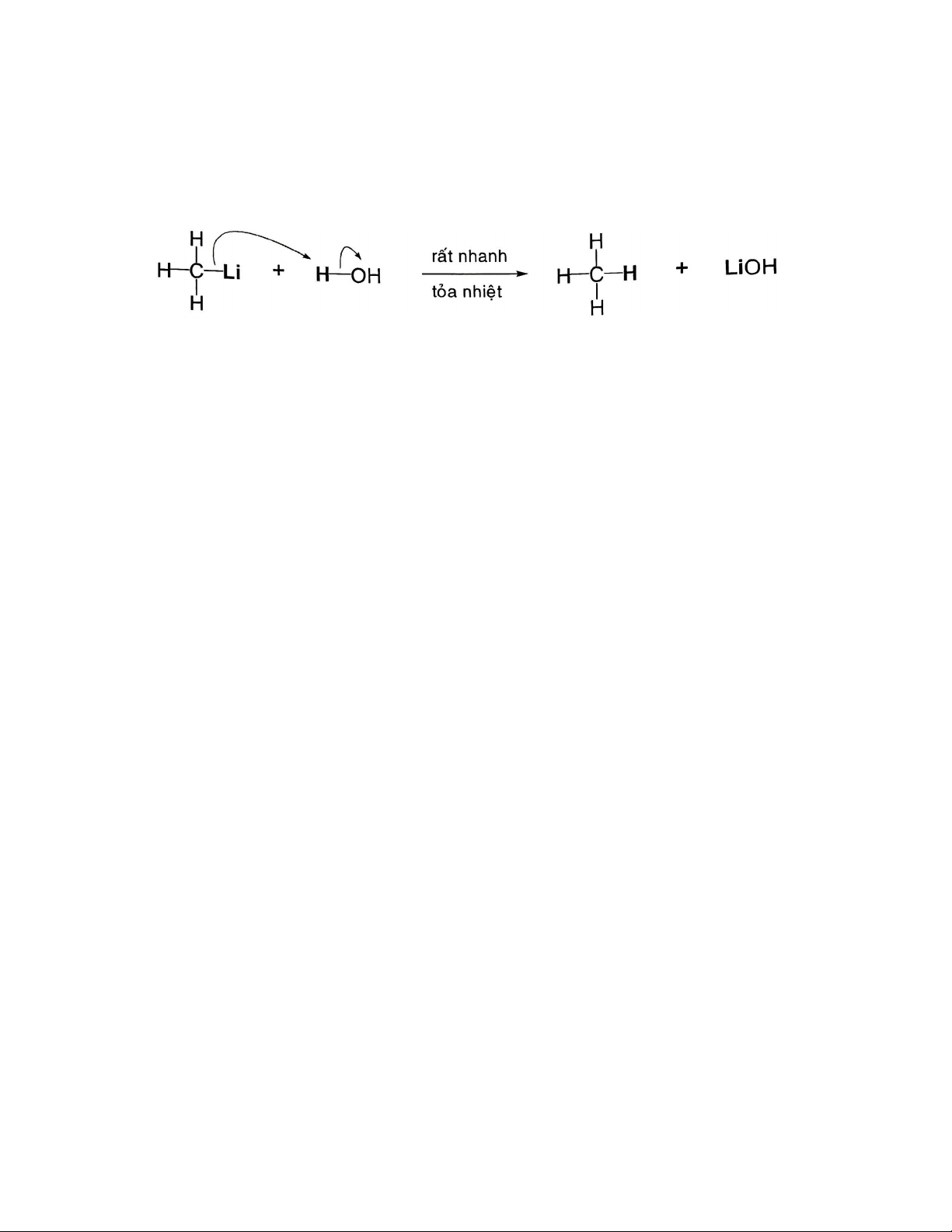
Phản ứng của hợp chất cơ – lithium và cơ – magnessium thường được thực hiện trong
dung môi không proton như ether, THF, … ở -78˚C do các tác nhân này có tính thân hạch
và tính base rất mạnh nên dễ dàng phản ứng với các loại dung môi có proton như nước, alcohol.
Ví dụ: CH3Li dễ dàng phản ứng với nước cho ra methane
Cơ – lithium dễ dàng bốc cháy khi tiếp xúc với oxy, cả cơ – lithium và cơ – magnessium
đều phản ứng với CO2 nên khi dùng tác nhân này cần thực hiện trong môi trường khí trơ (N2 hay Ar).
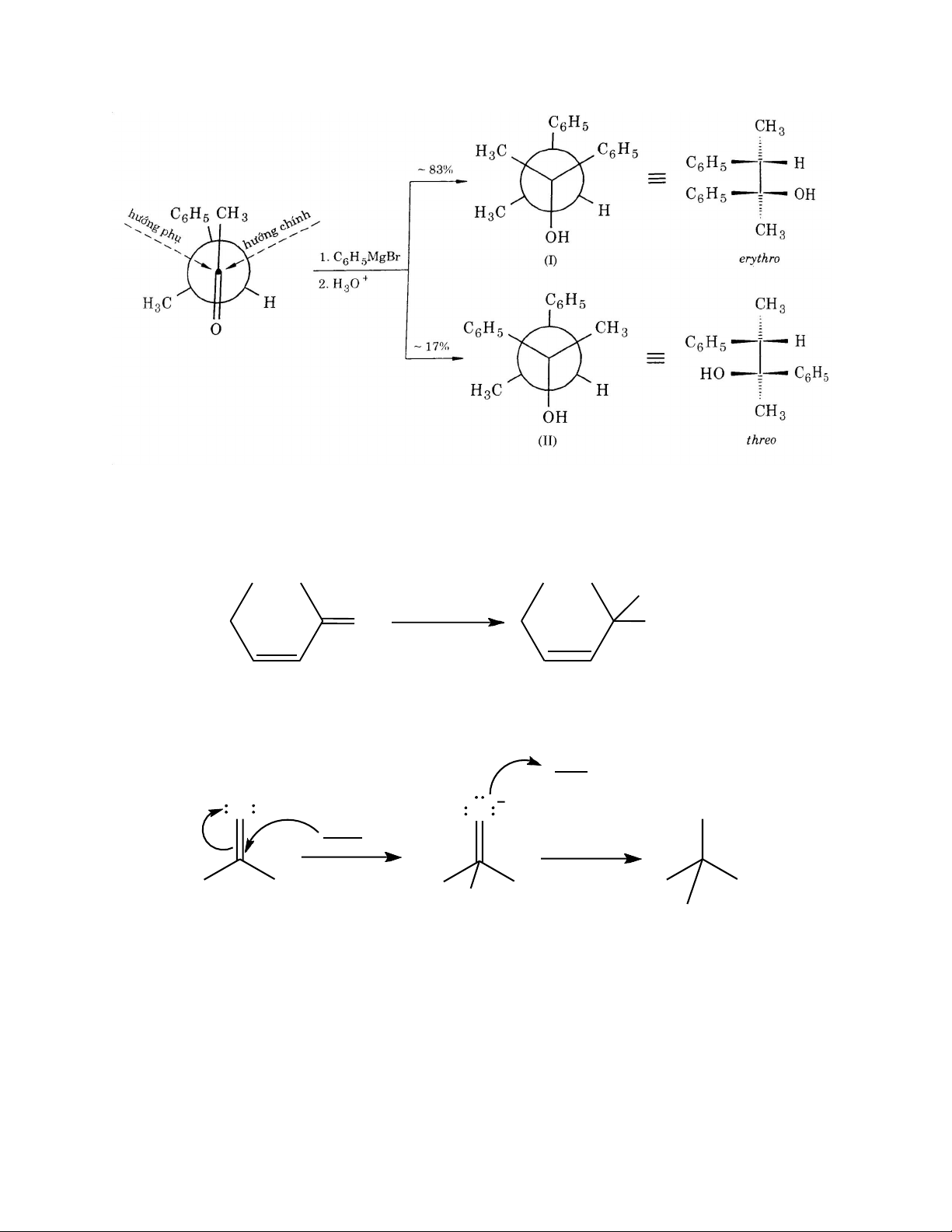
Về phương diện hóa học lập thể, phản ứng cộng vào nhóm carbonyl không có tính đặc
thù vì nhóm này có cấu trúc phẳng. Tuy nhiên nếu nhóm carbonyl liên kết bất đối thì
phản ứng sẽ tạo nên hỗn hợp 2 đồng phân lập thể không đối quan (erythro và threo). Để
dự đoán đồng phân chiếm ưu thế ta dựa vào quy tắc Cram (1952): “Nếu ba nhóm thế ở
nguyên tử carbon bất đối dính với nhóm carbonyl có kính thước khác nhau (ký hiệu L, TB,
N ứng với các nhóm thế lớn, trung bình, nhỏ) thì tác nhân nucleophile sẽ tấn công nhóm
carbonyl từ phí ít bị án ngữ không gian hơn, tức phía có nhóm thế với kích thước nhỏ hơn.”
Ví dụ: Phản ứng giữa 3-Phenyl-2-butanone với Phenylmagnessium bromide, sản phẩm
theo quy tắc Cram (I) nhiều gấp 5 lần sản phẩm trái quy tắc đó (II).
(a) Phản ứng với hợp chất cơ – Lithium:
Các hợp chất cơ – lithium cộng hợp chủ yếu vào nhóm carbonyl của aldehyde và ketone
α, β không no để tạo thành allylic alcohol (cộng hợp 1,2) Ví dụ: CH 1)CH 3 3Li ; ete O OH 2)H3O ; H2O
Cơ chế phản ứng cộng với aldehyde, ketone: H OH O O OH R' Li R H THF R R' H R H R'
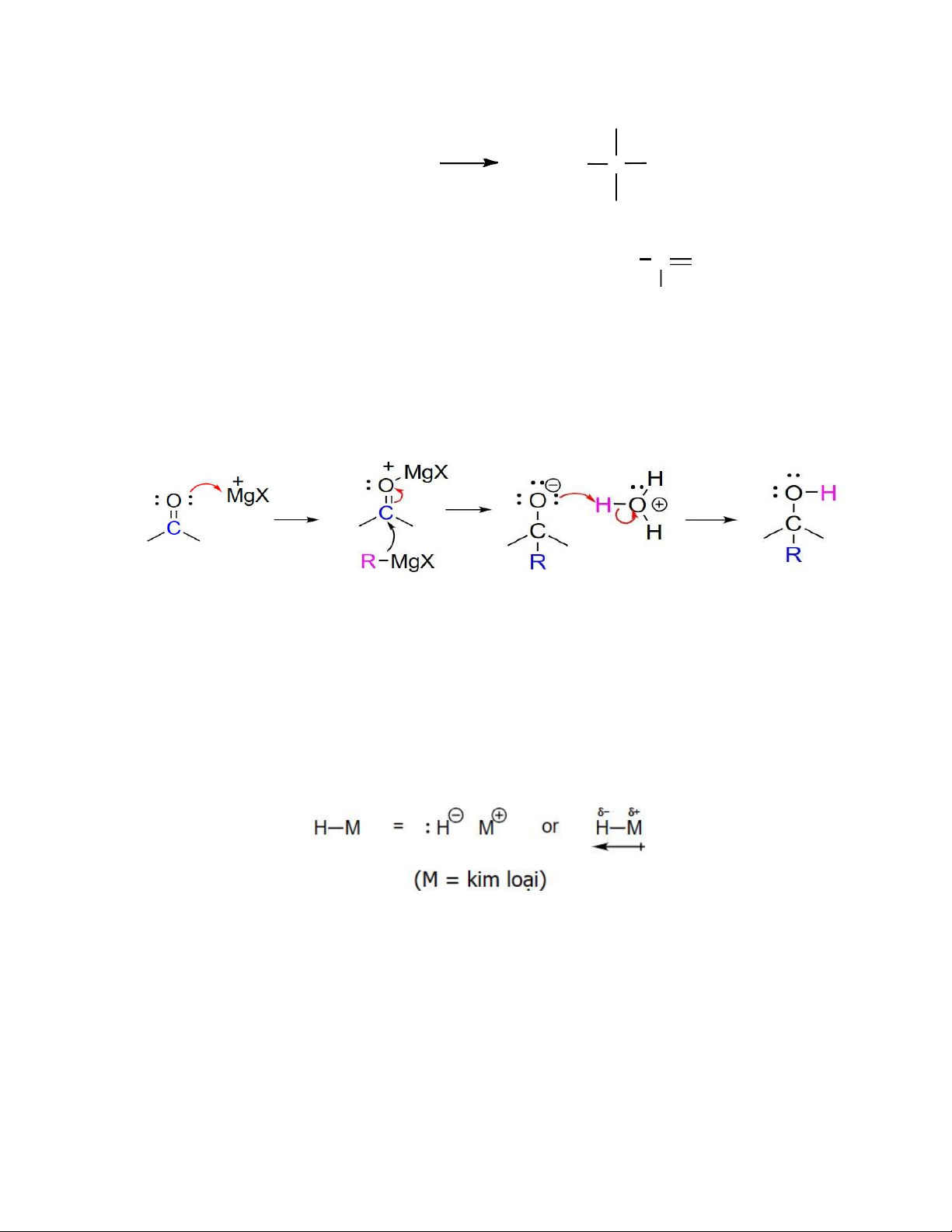
(b) Phản ứng cộng RMgX (Thuốc thử Grignard):
Tương tự hợp chất cơ – Li, tuy nhiên dùng RMgX có nhiều hạn chế do có thể có sản
phẩm phụ bởi hiện tượng enol hóa. Ví dụ: CH3 (CH + CH 3)2CHCOCH(CH3)2 + CH3MgBr (CH3)2CH C CH(CH3)2 4 OMgBr + (CH3)2CH C C(CH3)2 OMgBr
Do đó, hợp chất cơ – Lithium có hoạt tính cao hơn RMgX nên có thể thực hiện phản ứng cộng thuận lợi hơn
Cơ chế phản ứng cộng RMgX:
3.3 Cộng với hydride:
Giống như carbon, hydrogen có thể được xem là một nucleophile nếu nó liên kết với kim
loại và liên kết này phân cực về phía hydrogen. Một nguyên tử hydrogen có một cặp
electron không chia sẻ được và mang điện tích âm gọi là ion hydride.
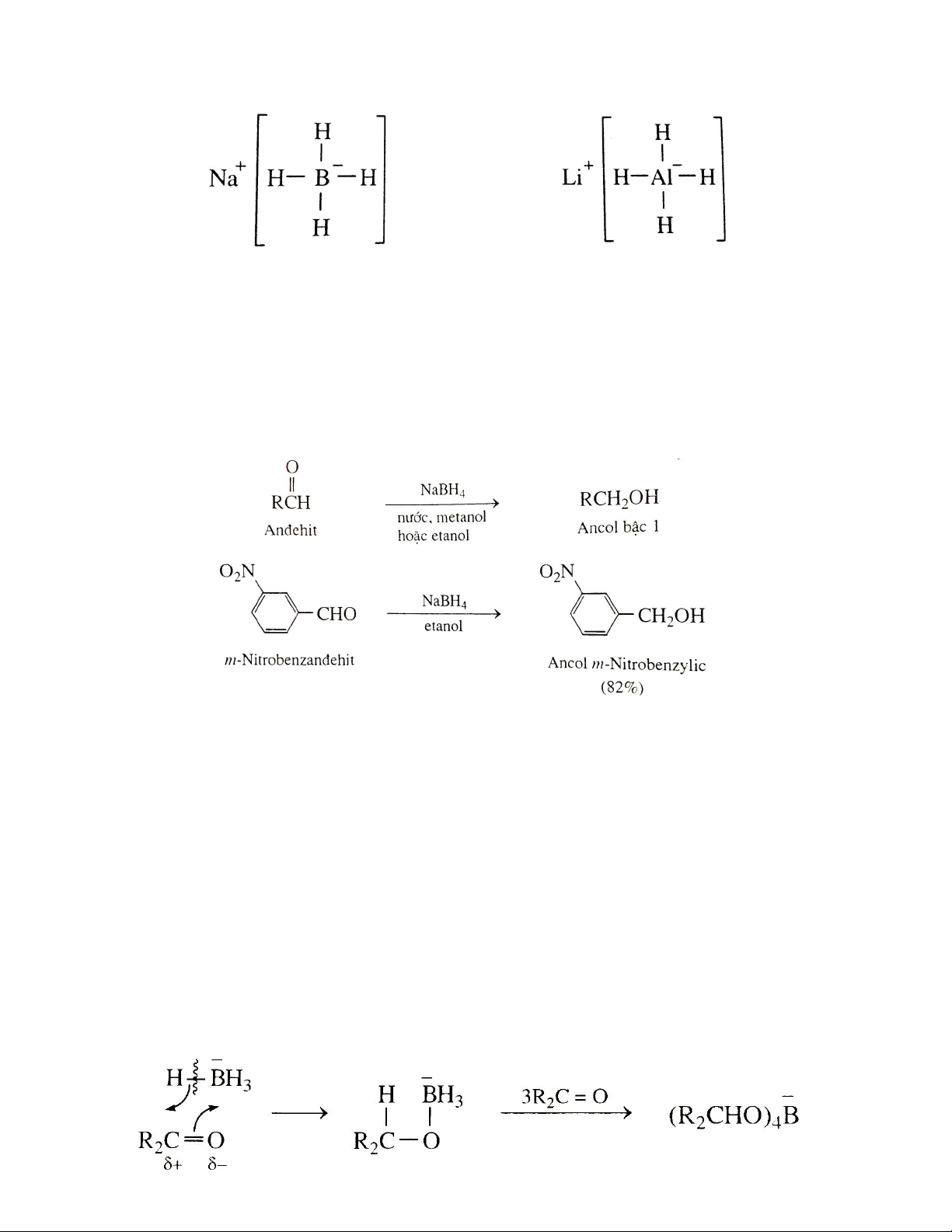
Sodium borohydride (NaBH4) và lithium aluminum hydride (LiAlH4) là những tác nhân
khử , là nguồn cung cấp ion hydride (H- ) phổ biến nhất. LiAlH4 là tác nhân khử mạnh
hơn NaBH4 do nhôm có độ âm điện nhỏ hơn boron. Sodium borohydride (NaBH4)
Lithium aluminum hydride (LiAlH4)
Sodium borohydride (NaBH4) đặc biệt dễ sử dụng, nó tan được trong nước và alcohol, do
đó khi thực hiện phản ứng khử, người ta thêm nó vào dung dịch nước hoặc alcohol của
aldehyde hoặc ketone, cần tránh sử dụng acid mạnh :
Trong khi NaBH4 không phản ứng với các nhóm chức khác như ester, nitrile, amide,
lactone, oxirane,. thì LiAlH4 phản ứng với tất cả các chất trên và phản ứng mãnh liệt với
nước, alcohol. Từ đó thấy rằng LiAlH4 kém chọn lọc hơn nhiều so với NaBH4 nên phản
ứng phải thực hiện trong dung môi như ether khan hoặc tetrahydrofuran (THF) khan.
Cơ chế phản ứng của hydride tương tự cơ chế phản ứng của tác chất Grignard với
aldehyde, chỉ khác ở chỗ chúng không cung cấp carbanion.
Với NaBH4, borohydride chuyển dịch một hydrogen cùng cặp electron liên kết tấn công
vào tâm thân hạch của nhóm carbonyl, nguyên tử oxygen mang điện tích âm tấn công vào
nguyên tử B trong -BH4 làm dịch chuyển một cặp electron liên kết của C=O vào boron
tạo trung gian alkoxide tứ diện. Tetraalkoxy borate
Bằng phản ứng thủy phân hoặc alcohol phân, chất trung gian trên được chuyển thảnh alcohol tương ứng.
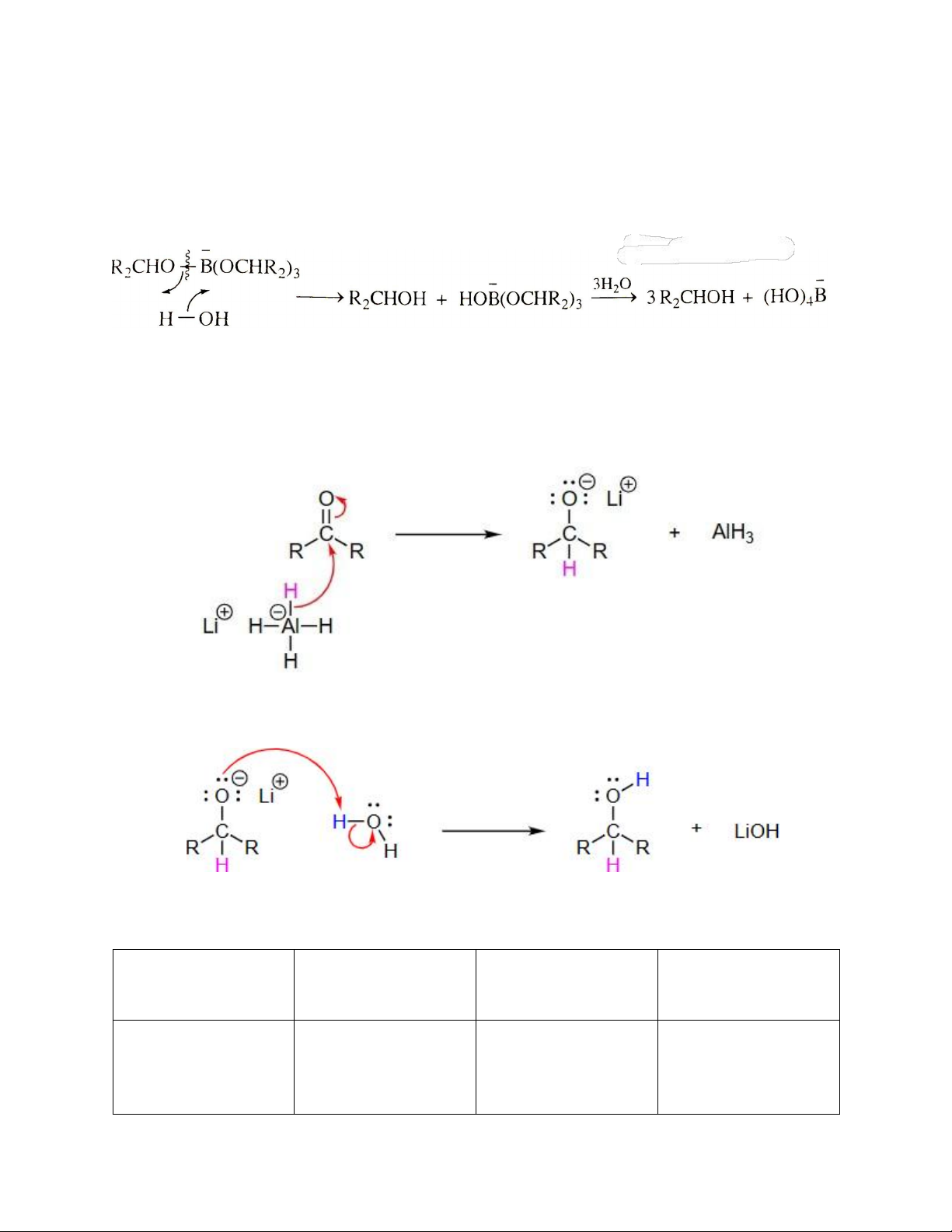
Với LiAlH4 cũng xảy ra cơ chế tương tự. Tuy nhiên vì quá phức tạp nên cơ chế được đơn giản hóa như sau:
Bước 1: Tấn công nucleophile hình thành trung gian alkoxide tứ diện
Bước 2: Proton hóa tạo thành alcohol:
Bảng tóm tắt một số đặc điểm quan trọng: Thuốc thử Dung môi Sản phẩm khử Cách xử lý phản ứng NaBH4
Ethanol; dung dịch Aldehyde -> 1˚- 1. Trung hòa đơn ethanol 15% alcohols giản NaOH; diglyme Ketone -> 2˚- Tránh acid mạnh alcohols 2. Chiết xuất sản Phản ứng chọn lọc. phẩm LiAlH4 Ether; THF
Aldehyde -> 1˚- 1. Thêm nước cẩn Tránh alcohols, alcohols thận amine, hợp chất Ketone -> 2˚- 2. Loại bỏ muối halogen, acid mạnh alcohols nhôm Kém chọn lọc 3. Chiết xuất sản phẩm
3.4 Phản ứng hydrate hóa – cộng với nước
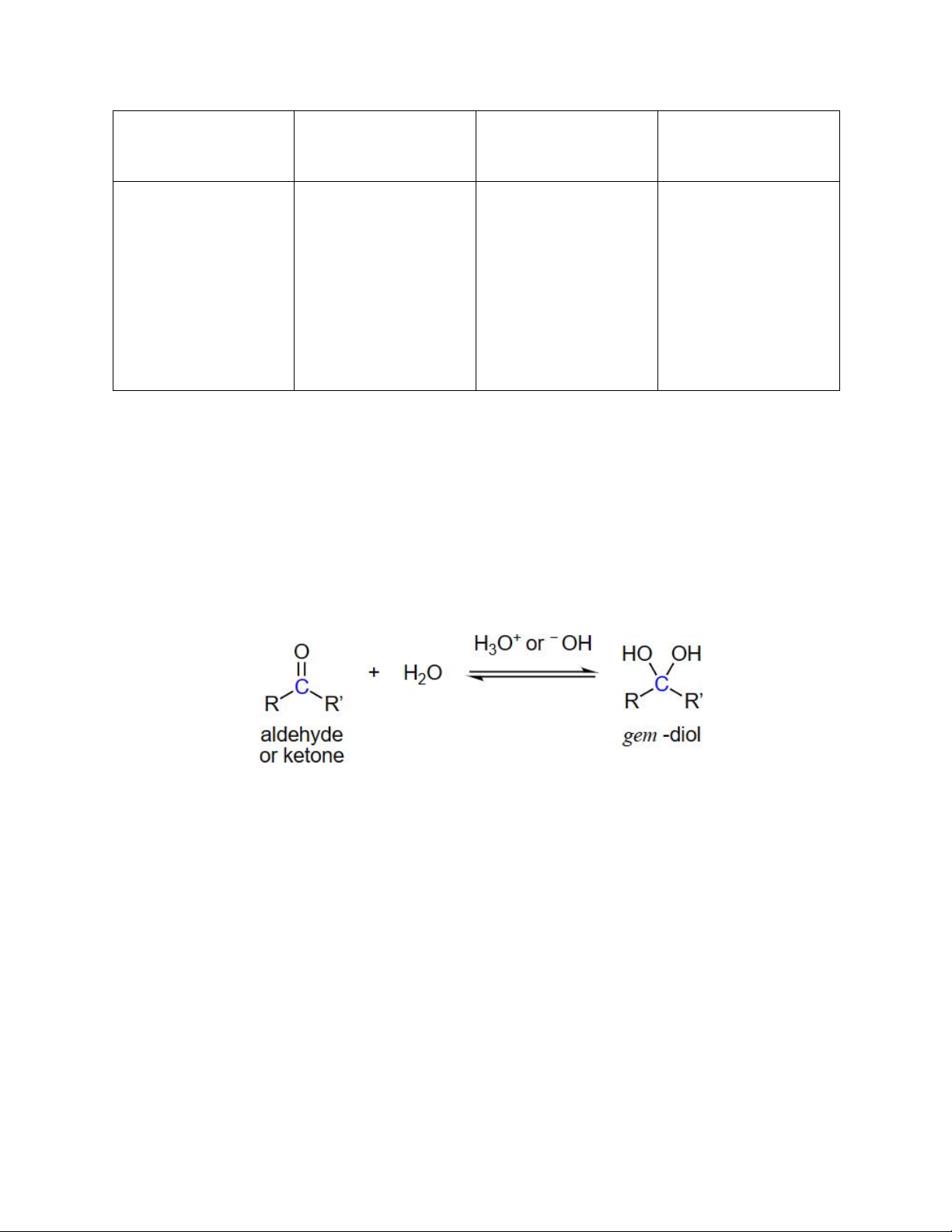
Khi hòa tan aldehyde và ketone trong nước, với sự có mặt của acid hoặc base sẽ xảy ra sự
tương tác giữa nước với nhóm carbonyl tạo ra gem-diol (tiền tố gem- chỉ 2 nhóm -OH
cùng gắn trên một nguyên tử carbon, bắt nguồn từ tiếng Latinh có nghĩa là “sinh đôi”- geminus)
Trong khi các gem-diol nói chung là những chất không bền, dễ bị tách nước trở thành hợp
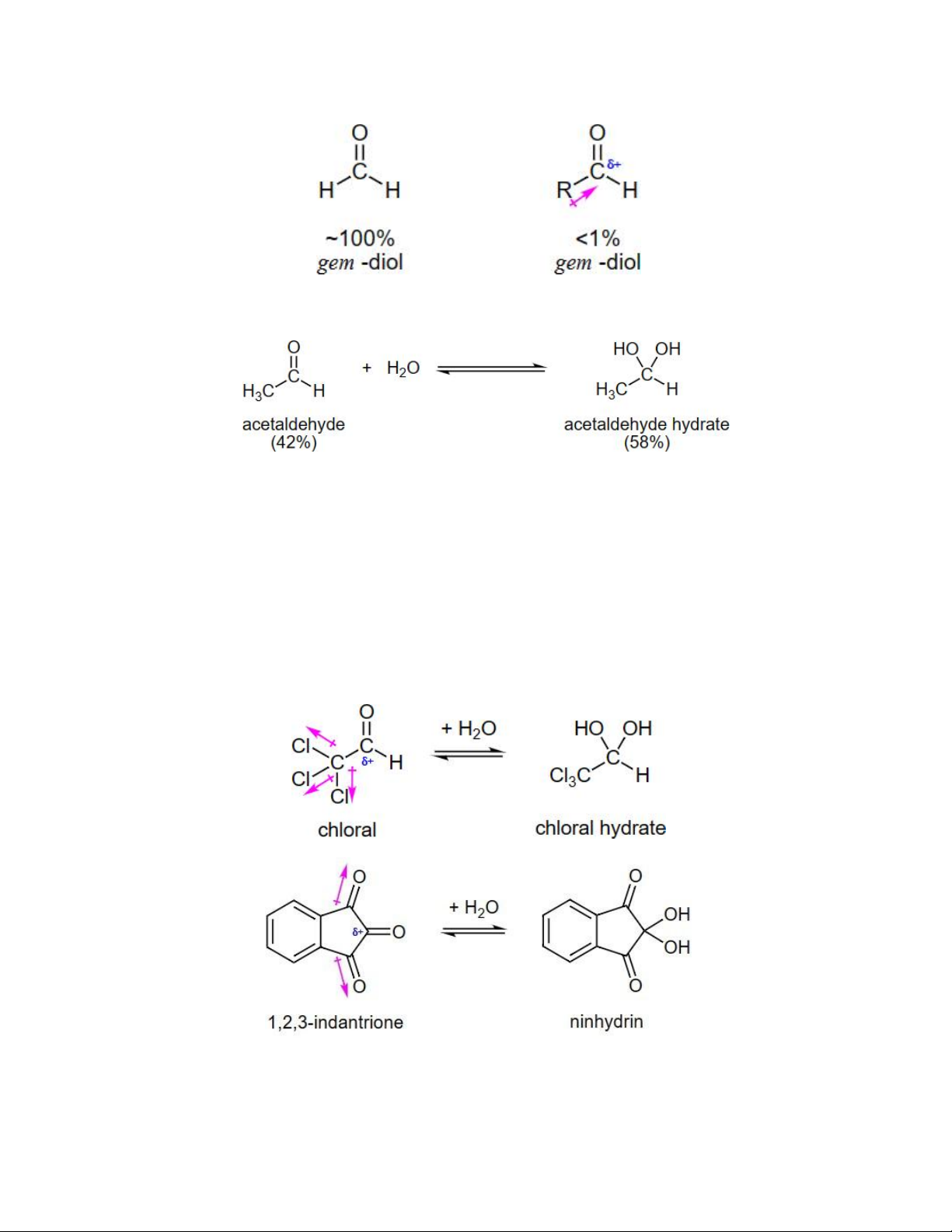
chất carbonyl ban đầu thì lại tồn tại một ngoại lệ. Formaldehyde (HCHO) bị hydrate hóa
hoàn toàn. Khi thay nguyên tử hydrogen trong nhóm HCHO bằng nhóm alkyl (R) cho
điện tử đã ổn định một phần điện tích dương trên carbon carbonyl nên khả năng hydrate
hóa giảm đi nhiều làm giảm lượng sản phẩm gem-diol. Do đó ketone có xu hướng
hydrate hóa ít hơn 1% trong khi formaldehyde lại ~100% Ví dụ:
Tương tự, nếu thay H trong HCHO thành nhóm rút điện tử sẽ làm mất ổn định carbon
carbonyl từ đó hydrate hóa trở nên ổn định.
ví dụ về điều này là chloral (CCl3CHO) và 1,2,3-indantrione. Cần lưu ý rằng chloral
hydrate là một thuốc an thần và đã được thêm vào đồ uống có cồn để tạo ra một thức
uống "knock-out" còn được gọi là Mickey Finn. Ngoài ra, ninhydrin thường được các nhà
điều tra pháp y sử dụng để tiết lộ dấu vân tay.
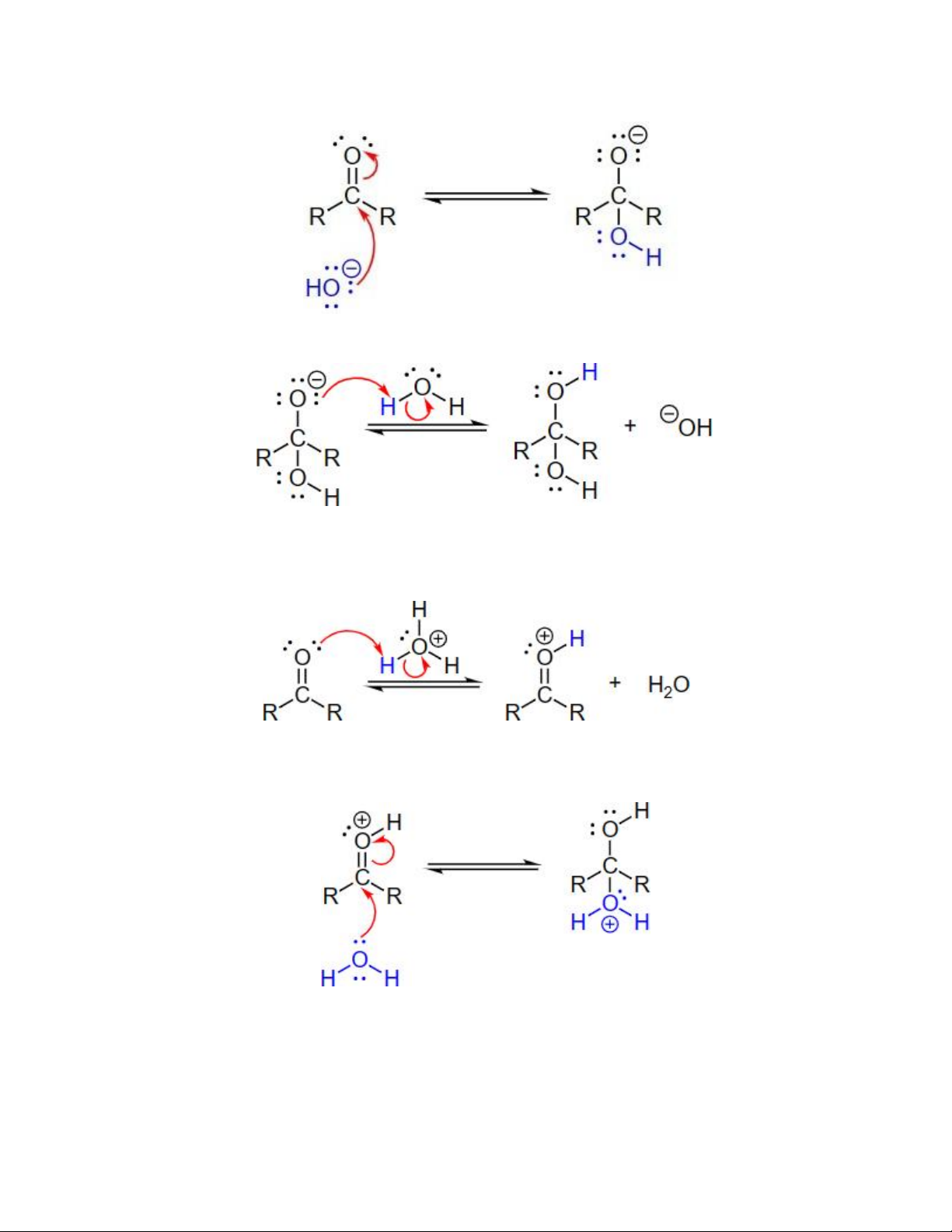
• Cơ chế hydrate hóa aldehyde hay ketone trong điều kiện base gồm 2 giai đoạn:
Giai đoạn 1: Ion -OH tấn công thân hạch vào tâm carbonyl
Giai đoạn 2: Proton hóa sản phẩm tở giai đoạn 1
• Cơ chế hydrate hóa aldehyde hay ketone trong xúc tác acid gồm 3 giai đoạn:
Giai đoạn 1: Proton hóa nguyên tử O của nhóm C=O
Giai đoạn 2: Nước tấn công thân hạch vào tâm C của aldehyde hay ketone đã proton hóa
Giai đoạn 3: Nước đóng vai trò như một base khử proton chất trung gian, tạo sản phẩm gem-diol
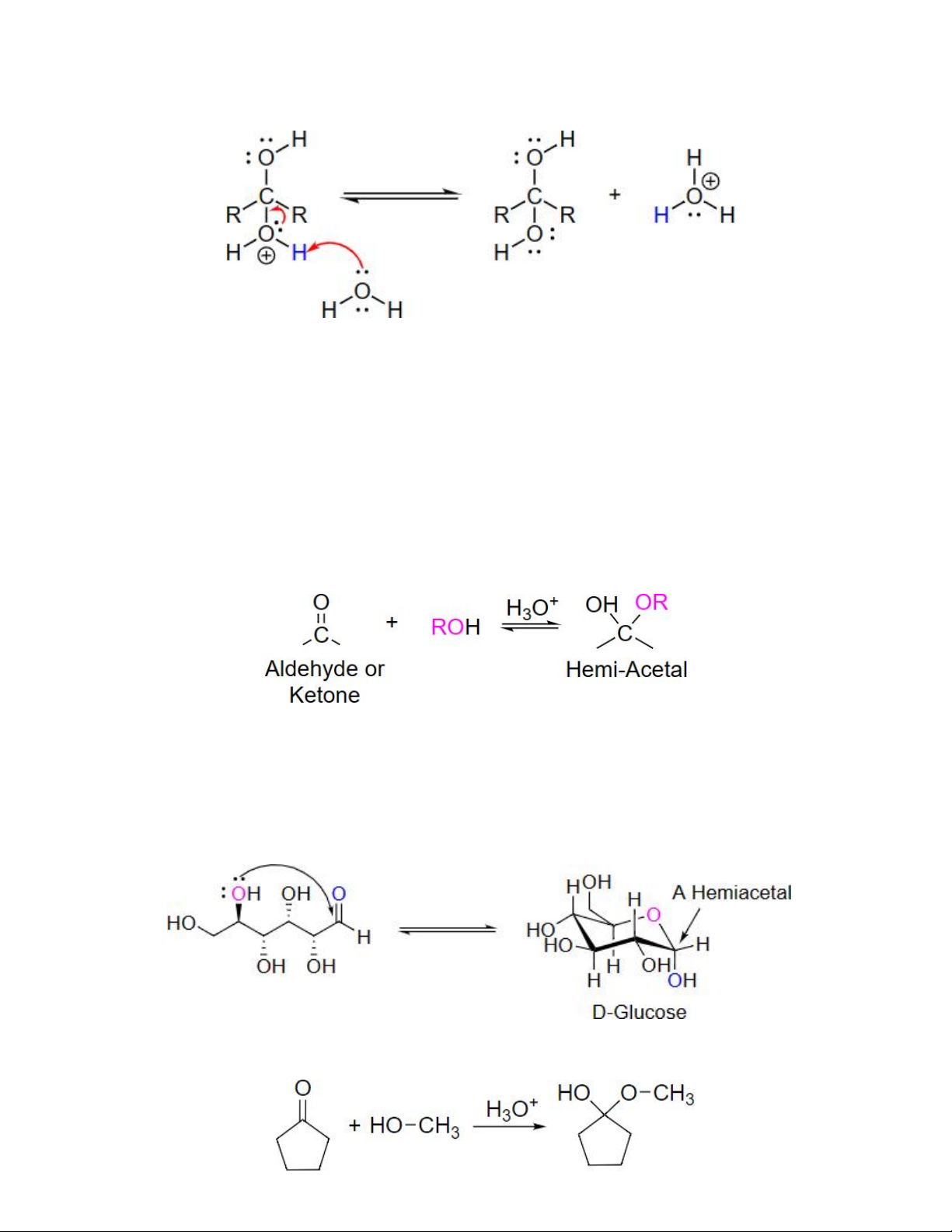
3.5 Cộng với alcohol – sự tạo thành hemiacetal và acetal
Tương tự nước, alcohol có thể phản ứng với aldehyde và ketone, xúc tác acid, tạo ra sản
phẩm kém bền gọi là hemiacetal. Khi dùng với lượng dư alcohol và có mặt của xúc tác
acid, hemiacetal tiếp tục phản ứng cho ra sản phẩm acetal – hợp chất bền có tính chất
tương tự ester nhưng khả năng phản ứng cao hơn.
Tổng quát phản ứng tạo Hemiacetal
Tuy hemiacetal mạch hở kém bền nhưng các hemiacetal vòng năm và sáu cạnh đủ bền và
có thể phân lập được. Những phản ứng đóng vòng nội phân tử năm hay sáu cạnh diễn ra
nhanh và dễ dàng hơn so với các phản ứng khác. Vì thế các hợp chất đường đơn giản
trong tự nhiên đều tồn tại ở dạng hemiacetal mạch vòng mà glucose là một ví dụ.
Ví dụ: -Sự hình thành Hemiacetal -Sự thủy phân Hemiacetal
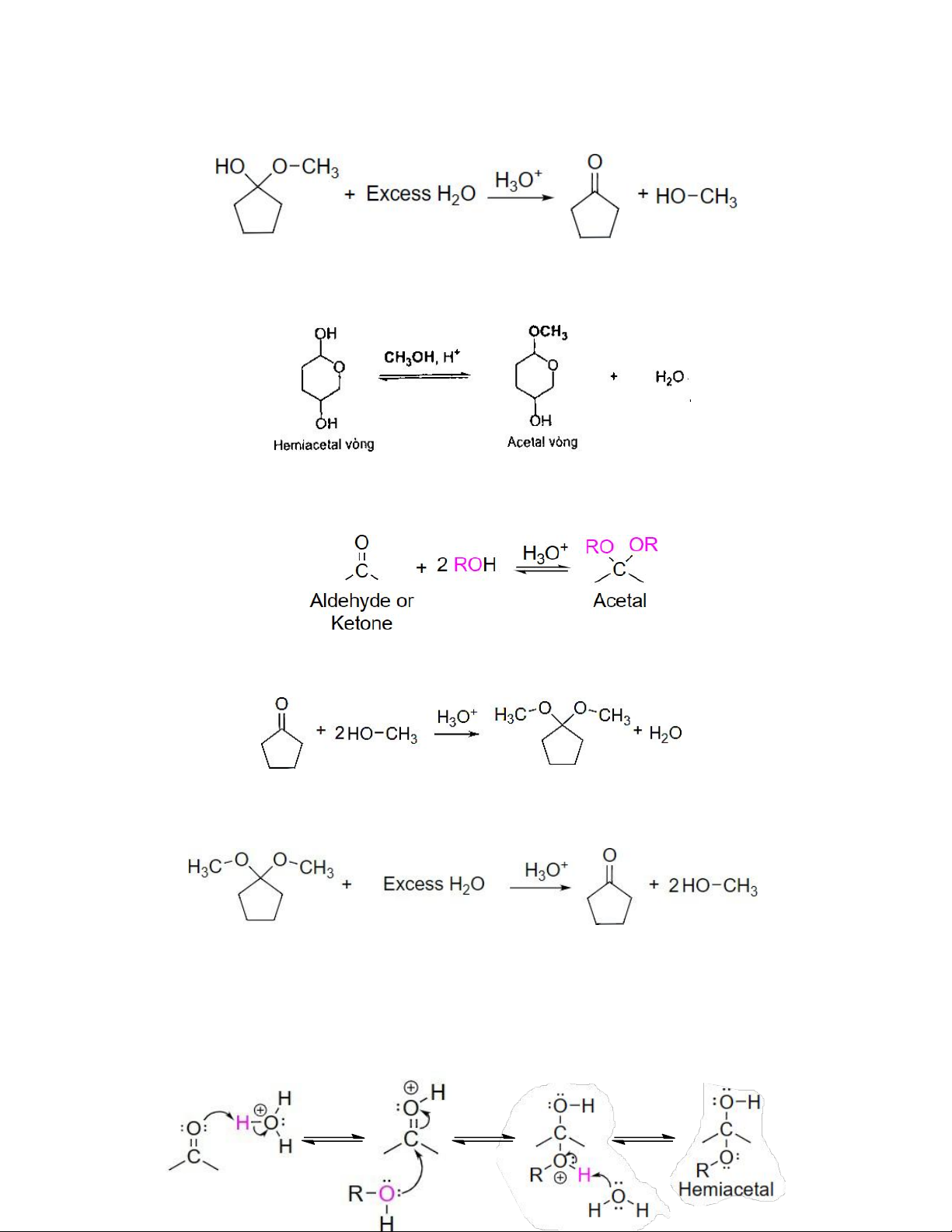
Hemiacetal vòng có thể chuyển thành acetal vòng khi cho phản ứng trực tiếp với alcohol xúc tác acid
Ví dụ: -Sự tạo thành Acetal -Sự thủy phân Acetal
• Cơ chế hình thành hemiacetal :
Bước 1: Chất xúc tác acid proton hóa oxygen carbonyl, làm carbonyl ưa điện
Bước 2: ROH tấn công thân hạch vào nhóm C=O đã được hoạt hóa
Bước 3: Tách loại proton tạo hemiacetal trung hòa điện [1] [2] [3]
Downloaded by Nguyen Linh (vjt32@gmail.com)
• Cơ chế hình thành acetal gồm 2 giai đoạn:
Giai đoạn 1: Hình thành hemiacetal
Giai đoạn 2: Hình thành acetal
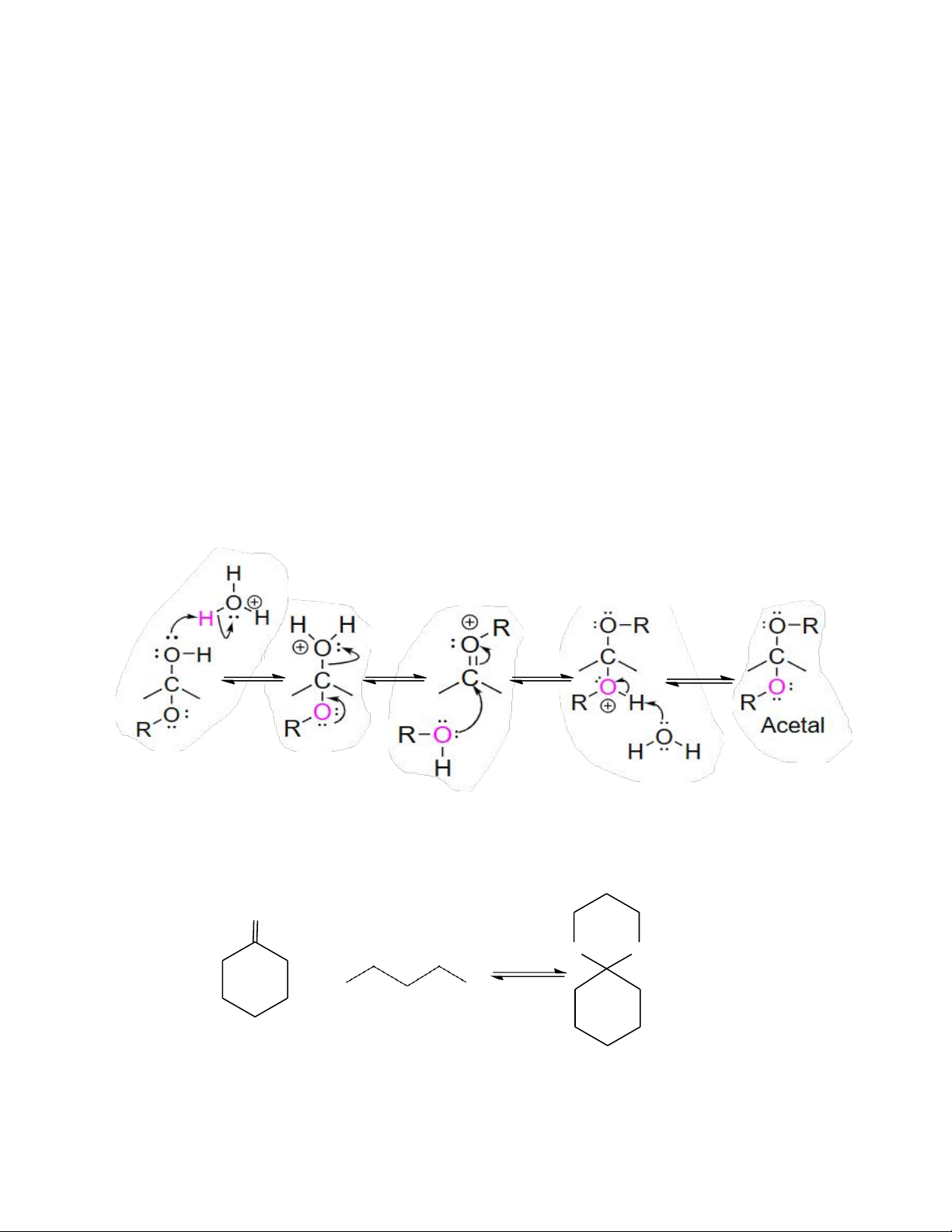
- Bước 1: Proton hóa nhóm -OH của hemiacetal tạo nhóm xuất tốt
- Bước 2: Tách loại H2O tạo cation bền nhờ cộng hưởng
- Bước 3: Tấn công thân hạch của phân tử alcohol thứ hai
- Bước 4: Tách loại proton tạo thành sản phẩm acetal [1] [2] [3] [4] -H2O
Aldehyde và ketone phản ứng với 1,2-diol tạo thành acetal vòng năm cạnh và 1,3-diol tạo
thành acetal vòng sáu cạnh. Với cơ chế tương tự acetal thông thường, ngoại trừ việc chỉ
cần một đương lượng diol thay cho hai alcohol. O H + O O + H + 2O HO OH
Thiol cũng cho phản ứng tương tự diol tạo thành thiolacetal. O SCH3 2 CH3SH R R' + H2O R R' HCl SCH3
Dithiol cho phản ứng với aldehyde và ketone cho thioketal. Sản phẩm có thể bị khử bằng H2/Raney nikel. O H H H + S S H2 + HS SH Raney Ni
Acetal bị thủy phân trong môi trường acid nhưng bền với base mạnh và tác nhân
nucleophile. Acetal dễ dàng được điều chế từ aldehyde và ketone tương ứng cũng như dễ
tái tạo lại hợp chất carbonyl ban đầu. Do đó acetal thường được dùng để bảo vệ nhóm
chức trong tổng hợp hữu cơ. TÀI LIỆU THAM KHẢO
[1] Đặng Như Tại – Ngô Thị Thuận. (2015). Hóa học Hữu cơ – tập 2. Hà Nội: NXB Giáo Dục Việt Nam.
[2] PSG. TS. Thái Doãn Tĩnh. (2003). Cơ sở Hóa học Hữu Cơ – tập 2. Hà Nội: NXB
Khoa Học và Kỹ Thuật Hà Nội.
[3] PSG. TS. Bùi Thị Bửu Huê. (2023) Hóa Hữu cơ 2. Cần Thơ: NXB Đại Học Cần Thơ.
[4] ht ps://www.chemistrysteps.com/wp-content/uploads/2021/02/Aldehydes-and-
Ketones-cheat-sheet-study-guide.pdf
[5] 14.3: Sự hình thành Acetal - Hóa học LibreTexts
[6] 19.5: Nucleophilic Addition of Water- Hydration - Chemistry LibreTexts
[7] 19.10: Nucleophilic Addition of Alcohols- Acetal Formation - Chemistry LibreTexts
[8] 19.7: Nucleophilic Addition of Hydride and Grignard Reagents- Alcohol
Formation - Chemistry LibreTexts
Document Outline
- 3.Một số phản ứng cộng thân hạch.
- 3.2Cộng với hợp chất cơ kim:
- 3.3Cộng với hydride:
- 3.4Phản ứng hydrate hóa – cộng với nước
- 3.5Cộng với alcohol – sự tạo thành hemiacetal và acet