















Preview text:
Chuyên đề: PHỨC CHẤT
CHUYÊN ĐỀ PHỨC CHẤT
PHẦN I: LÝ THUYẾT VỀ PHỨC CHẤT
I.1. KHÁI NIỆM VỀ PHỨC CHẤT
I.1.1.Định nghĩa và các khái niệm cơ bản
Phức chất được tạo thành từ các ion kim loại kết hợp với các ion hoặc phân tử
khác. Chúng có khả năng tồn tại trong dung dịch, đồng thời có khả năng phân li
thành các cấu tử tạo thành phức.
Thí dụ phản ứng tạo phức:
- Phản ứng giữa một cation và một phân tử: Ag+ + 2NH + 3 → Ag(NH3)2
- Phản ứng giữa một anion và một phân tử: I- + I - 2 → I3
- Phản ứng giữa một cation và một anion: Cd2+ + 2Cl- → CdCl2 Fe3+ + 3SCN- → Fe(SCN)3
Trong trường hợp tổng quát hai dạng M, L cùng tồn tại trong dung dịch có khả năng
phản ứng với nhau để tạo ra một hoặc một số phức chất: pM + qL MpLq
M: là nhóm trung tâm của phức chất hay còn gọi là chất tạo phức L: là phối tử
Về thành phần cấu tạo, một phân tử phức chất bao gồm 2 phần:
1- Cầu nội : gồm có chất tạo phức và phối tử. Số phối tử trong cầu nội gọi là số phối
trí của phức chất. Cầu nội được viết trong dấu móc vuông
a) Chất tạo phức có thể là ion hay nguyên tử và được gọi là nguyên tử trung tâm
- Cầu nội của phức chất có thể là cation
TỔ HÓA HỌC – THPT chuyên Lào Cai 1
Chuyên đề: PHỨC CHẤT
VD: [Al(H2O)6]Cl3; [Zn(NH3)4]Cl2; …
- Cầu nội của phức chất có thể là anion:
VD: H2[SiF6] ; K2[Zn(OH)4] ; …..
- Cầu nội của phức chất có thể là phân tử trung hoà về điện, không phân li trong dung dịch VD: [Co(NH3)3Cl3], [Ni(CO)4] b) Phối tử
- Phối tử có thể là anion: F-, Cl-, I-, OH-, CN-, SCN-, NO - 2- 2 , S2O3 , EDTA, ….
- Phối tử có thể là phân tử: H2O, NH3, CO, NO, piriđin, etylenđiamin, ….
Dựa vào số phối trí mà một phối tử có thể tạo thành xung quanh nguyên tử trung tâm
mà có thể chia phối tử thành phối tử một càng và phối tử nhiều càng
+ Phối tử một càng chỉ có thể tạo một liên kết phối trí với nguyên tử trung tâm VD: H2O, NH3, …
+ Phối tử hai càng, ba càng,… là phối tử có thể tạo hai, ba,… liên kết phối trí với nguyên tử trung tâm
VD: H2N-CH2-CH2-NH2 là phối tử 2 càng
2- Cầu ngoại là phần ion đối nằm ngoài liên kết với cầu nội
3-Độ bền của phức phụ thuộc vào bản chất của nguyên tử trung tâm và phối tử
- Các phức chất của ion kim loại với halogenua có độ bền tăng dần từ Cl- đến
I-. Các phức xiano kim loại thường rất bền.
VD: Xét các phức tetrahalogeno thuỷ ngân (II) HgX 2- 4 có độ bền như sau:
Biểu diễn qua logarit hằng số bền càng lớn thì phức càng bền: HgCl 2- 2- 2-
4 : 14,92 ; HgBr4 : 21,00 ; HgI4 : 29,83
--> Phức iodo bền hơn phức bromo và phức bromo bền hơn phức cloro.
TỔ HÓA HỌC – THPT chuyên Lào Cai 2
Chuyên đề: PHỨC CHẤT
- Các phức chất của các ion kim loại hoá trị cao thường bền hơn các phức chất
tương ứng của ion có số oxi hoá thấp hơn
VD: Xét phức Co2+ và Co3+ với NH3:
[Co(NH3)6]2+ : 4,39 ; [Co(NH3)6]3+ : 35,16
àPhức Co(III) bền hơn phức Co(II).
- Độ bền của phức chất còn thay đổi theo bản chất của dung môi
VD: Phức [Co(SCN)4]2- ở trong nước kém bền nhưng trong dung môi nước +
axeton hoặc trong rượu iso amilic lại bền
- Tính chất của các dung dịch chứa các cation kim loại bị thay đổi khi có mặt chất
tạo phức vì có thể tạo thành những phức chất khá bền:
VD: Chẳng hạn, dung dịch FeCl3 có tính axit mạnh do tạo phức hiđroxo FeOH2+: Fe3+ + 2HOH FeOH2+ + H3O+
Tuy vậy, dung dịch Fe(CN) 3- 3- 6
lại có tính bazơ yếu, bởi vì Fe(CN)6 rất bền phân li rất yếu: Fe(CN) 3- -1 6 Fe3+ + 6CN- β6 = 10-42
Mặt khác, ion CN- lại có tính bazơ:
4- Tên gọi của phức chất
Gồm tên của cầu nội và cầu ngoại
a) Tên gọi của cầu nội gồm có: số phối tử + tên phối tử là anion+số phối tử và tên
của phối tử là phân tử trung hoà, tên của nguyên tử trung tâm và hoá trị * Số phối tử:
- để chỉ số phối tử một càng nguời ta dùng các tiếp đầu ngữ: đi, tri,….
TỔ HÓA HỌC – THPT chuyên Lào Cai 3
Chuyên đề: PHỨC CHẤT
- để chỉ số phối tử nhiều càng người ta thường dùng các tiếp đầu ngữ: bis, tris, tetrakis, pentakis,…. * Tên phối tử:
- Nếu phối tử là anion, người ta lấy tên của anion và thêm đuôi o ; F- : Floro Cl-: cloro Br-: Bromo I: Iođo NO - 2- 2- 2- 2 : nitro SO3 : sunfito
S2O3 : tiosunfato C2O4 :oxalato CO 2- 3 : cacbonato OH-: hiđroxo CN-: xiano SCN-: tioxianato
- Nếu phối tử là phân tử trung hoà, người ta lấy tên của phân tử đó: C2H4: etilen C5H5N: pyriđin CH3NH2: metylamin H2N-CH2CH2-NH2: etylenđiamin C6H6: benzen
- Một số phối tử trung hoà được đặt tên riêng: H2O: aqua NH3: ammin CO: cacbonyl NO: nitrozyl
* Tên nguyên tử trung tâm và hoá trị:
- Nếu nguyên tử trung tâm ở trong cation phức, người ta lấy tên của nguyên
tử đó kèm theo số La Mã viết trong dấu ngoặc đơn để chỉ hoá trị hay số oxi hoá khi cần
- Nếu nguyên tử trung tâm ở trong anion phức, ta lấy tên của nguyên tử đó
kèm theo đuôi –at và kèm theo số La Mã viết trong dấu ngoặc đơn để chỉ hoá trị hay
số oxi hoá, nếu phức chất là axit thì thay đuôi –at bằng đuôi –ic. VD:
[Co(NH3)6]Cl3 : hexaammincoban(III) clorua
[Cr(NH3)6]Cl3: hexaammincrom(III) clorua
[Co(H2O)5Cl]Cl2: cloropentaaquacoban(III)clorua
[Cu(H2N-CH2-CH2-NH2)2]SO4: bisetylenđiamin đồng(II) sunfat
Na2[Zn(OH)4]: natri tetrahiđroxozincat
TỔ HÓA HỌC – THPT chuyên Lào Cai 4
Chuyên đề: PHỨC CHẤT
K4[Fe(CN)6] : kali hexaxianoferat(II)
K3[Fe(CN)6] : kali hexaxianoferat(III)
H2[SiF6]: axit hexaflorosilicic
5. Đặc điểm tính chất của phức
Nhiều phức chất có những tính chất đặc trưng như có màu, ít tan, được dùng
để phát hiện các ion kim loại và để định lượng chúng. Chẳng hạn, Cu2+ màu
xanh nhạt tạo được với NH 2+
3 phức màu xanh đậm Cu(NH3)n (n = 1 - 4). Ion
Fe3+ tạo được các phức màu đỏ máu với ion SCN- Fe(SCN)n (n = 1 – 5), tạo với Fe(CN) 4- 6
phức ít tan màu xanh đậm Fe4[Fe(CN)6]3, ion Fe2+ tạo với Fe(CN) 3- 6
phức Fe3[Fe(CN)6]2 cũng ít tan và màu xanh đậm.
Nhiều ion kim loại tạo với các thuốc thử hữu cơ các hợp chất nội phức có
màu, tan trong nước hoặc dung môi hữu cơ. Ví dụ Ni2+ tạo được với
đymetylglypxim phức ít tan màu đỏ, ion Al3+ với alizarin phức màu đỏ ít tan,v.v….
6 .Ứng dụng của phức
Lợi dụng độ bền khác nhau của các phức chất, người ta có thể xác định định
tính và định lượng của các ion kim loại trong hỗn hợp của chúng. Ví dụ, để phát
hiện sự có mặt của Co2+ , Fe3+ người ta sử dụng phản ứng tạo phức giữa Co2+
với SCN- khi có mặt lượng
dư ion F-. Ở đây Fe3+ tạo phức bền với ion F- (FeF3) không màu và không cản
trở đến phản ứng giữa Co2+ và SCN-.
I.1.2. Hằng số cân bằng tạo phức trong dung dịch
TỔ HÓA HỌC – THPT chuyên Lào Cai 5
Chuyên đề: PHỨC CHẤT
Sự tạo phức giữa các ion kim loại với phối tử thường diễn ra theo từng nấc với
sự hình thành nhiều phức với số phối trí khác nhau.
Để đặc trưng cho độ bền của phức chất người ta thường sử dụng các hằng số
bền hoặc hằng số tạo thành từng nấc. Người ta cũng hay biểu diễn phản ứng tạo
phức trực tiếp từ ion kim loại và phối tử. Lúc đó ta có các quá trình tạo phức tổng
hợp và các hằng số tạo thành tổng hợp hoặc hằng số bền tổng hợp
1. Hằng số tạo thành từng nấc
Trong trường hợp tổng quát sự tạo thành phức giữa ion kim loại Mn+ với phối
tử Lm- được biểu diễn theo sơ đồ sau : M + L ML k1 ML + L ML2 k2 ….. ….... MLn-1 + L MLn kn
k1, k2, ……kn là các hằng số tạo thành từng nấc hoặc hằng số bền từng nấc của
các phức chất tương ứng . Các giá trị k cho biết độ bền của từng phức và cho phép so
sánh khả năng tạo phức từng nấc.
2. Hằng số tạo thành tổng hợp
Chúng ta cũng có thể biểu diễn cân bằng tạo phức qua hằng số tạo thành tổng
hợp bằng cách tổ hợp các cân bằng từng nấc . M + L ML β1 M + 2L ML2 β2 M + 3L ML3 β3 …… ….. ……. M + nL MLn βn
TỔ HÓA HỌC – THPT chuyên Lào Cai 6
Chuyên đề: PHỨC CHẤT
β được gọi là hằng số tạo thành tổng hợp hay là hằng số bền tổng hợp
β1=k1 , β2=k1 k2 , β3=k1k2k3…… βn=k1k2k3…..kn=
β càng lớn thì phức càng bền. Từ β ta có thể biểu diễn trực tiếp nồng độ các
dạng phức theo nồng độ cân bằng của ion kim loại và phối tử. Trong các dung dịch
loãng khi có thể coi hệ số hoạt độ của các cấu tử bằng 1 thì :
[ML]= β1 [M][L] ; [ML2] = β2 [M][L]2 ……. [MLn]= βn[M][L]n
Đối với phức nhiều nhân thì hằng số tạo thành tổng hợp có thêm chỉ số cho
biết số lượng ion trung tâm, chỉ số sau này để sau chỉ số phối tử. Như : 2Ag+ + 6I- Ag 4- 2I6 β62= 1030
3. Hằng số không bền từng nấc ML M + L k -1 1 ML -1 2 ML + L k2 ….. ….... ML -1 n MLn-1 + L kn k -1 -1 -1
1 , k2 , ……kn là các hằng số phân ly từng nấc hoặc hằng số không bền từng
nấc của các phức chất tương ứng . Các giá trị k-1 cho biết độ bền của từng phức và
cho phép so sánh khả năng phân ly từng nấc của phức chất. Dĩ nhiên hằng số không
bền càng lớn thì phức phân ly càng nhiều và càng ít bền.
4. Hằng số không bền tổng hợp
Xét quá trình phân ly tổng hợp của phức chất MLn trong dung dịch ta có: ML M + L K -1 1= β1 ML -1 2 M + 2L K2= β2 ML -1 3 M + 3L K3= β3
TỔ HÓA HỌC – THPT chuyên Lào Cai 7
Chuyên đề: PHỨC CHẤT …… ….. ……. ML -1 n M + nL Kn= βn
Các giá trị nghịch đảo của k, β đăc trưng cho sự phân ly từng nấc hoặc sự
phân li toàn phần của phức chất, đặc trưng cho tính không bền của phức chất. Vì vậy
các giá trị này được gọi là hằng số không bền từng nấc (k-1) hoặc hằng số không bền chung (β-1).
Chú ý rằng cân bằng tạo phức tổng hợp được viết trực tiếp từ ion kim loại
và phối tử. càng lớn thì phức càng bền. từ ta có thể biểu diễn trực tiếp nồng độ các dạng phức
theo dạng nồng độ cân bằng của ion kim loại và phối tử. Trong các dung dịch
loãng khi có thể coi hệ số hoạt độ các cấu tử bằng 1 thì:
[ML] = 1 [M] [L]; [ML2] = 2 [M] [L]2 …; [MLn] = n [M][L]n
Ví dụ 1: tính nồng độ cân bằng của các dạng phức trong dung dịch AgNO3
và NH3, biết [Ag+]= 1,0. 10-6M; [NH3] = 0,10M. Các quá trình xảy ra: AgNO - 3 Ag+ + NO3 Ag+ + NH + 3 ⇌AgNH3 1 = k1 = 103,32 (1) Ag+ + 2NH + 3 ⇌ Ag(NH3)2 2 = k2 = 107,24 (2)
Theo (1) [Ag(NH3)+] = 1[Ag+][NH3]= 103,23. 10-6. 10-1 = 2,1 . 10-4M Theo (2) [Ag(NH +
3)2 ] = 2[Ag+] [NH3]2= 107,24. 10-6 . 10-2= 0,17M
Các giá trị nghịch đảo của k và đặc trưng cho sự phân ly từng nấc hoặc sự phân
li toàn phần của phức chất, đặc trưng cho tính không bền của phức chất. Vì vậy
TỔ HÓA HỌC – THPT chuyên Lào Cai 8
Chuyên đề: PHỨC CHẤT
các giá trị này được gọi là hằng số không bền từng nấc (k-1) hoặc hằng số không bền chung ( -1).
Đối với phức nhiều nhân thì hằng số tạo thành tổng hợp có thêm chỉ số cho
biết số lượng ion trung tâm, chỉ số này để sau chỉ số phối tử. Ví dụ: 2Ag+ + 6I- Ag 4- 2I6 62 = 1030
5. Hằng số tạo thành điều kiện
Hằng số điều kiện β’ là hằng số bền có tính đến ảnh hưởng của các phản ứng phụ.
Giả sử trong dd chứa ion kim loại Mn+ , anion Y4− (EDTA).
Phản ứng tạo phức : Mn+ + Y4− ⇌ MY(4−n)−
Phản ứng phụ của ion M : MLn−1 + L ⇌ MLn βn = (n)
Phản ứng phụ của ion Y4− : Y4− + H+ ⇌ HY3− K4 = HY3− + H+ ⇌ H2Y2− K3 = H2Y2−+ H+ ⇌ H3Y− K2 = H3Y− + H+ ⇌ H4Y K1 =
⟹Hằng số bền điều kiện của phức MY(4−n)− được tính bằng biểu thức: β’ =
TỔ HÓA HỌC – THPT chuyên Lào Cai 9
Chuyên đề: PHỨC CHẤT
Và β’=β×αM(L)×αY(H). Trong đó α-1M(L) × [M] = [M]’ ; α-1Y(H) × [Y4-] = [Y]’
*Ý nghĩa của hằng số bền điều kiện là đại lượng để đánh giá mức độ phản ứng
phức chất ở điều kiện tương ứng.
I.2. ĐỒNG PHÂN
1. Đồng phân hiđrat hóa: là những chất có cùng thành phần nhưng khác nhau về
chức năng (đặc điểm liên kết) của các phân tử nước trong thành phần của phức chất.
Vd: [Cr(H2O)6]Cl3: xanh hơi tím, tạo kết tủa với AgNO3 theo tỉ lệ số mol 1:3
[Cr(H2O)5Cl]Cl2: màu lục, tạo kết tủa với AgNO3 theo tỉ lệ số mol 1:2
[Cr(H2O)4Cl2]Cl: màu lục, tạo kết tủa với AgNO3 theo tỉ lệ số mol 1:1
2. Metame ion hoá: là những chất có cùng thành phần nhưng trong nước phân li thành các ion khác. Vd: [Co(NH 2-
3)5Br]SO4 [Co(NH3)5Br]2+ + SO4
[Co(NH3)5 SO4]Br [Co(NH3)5SO4]+ + Br-
3. Đồng phân muối: là các chất có cùng thành phần nhưng phối tử của chúng là
đồng phân vô cơ của nhau.
Vd: [Co(NH3)5NO2]X: xanto màu vàng, không bị thuỷ phân trong môi trường axit
[Co(NH3)5ONO]X: isoxanto màu nâu tươi, thuỷ phân khi tác dụng với axit gp NO2
4. Đồng phân phối trí: là những chất có cùng khối lượng phân tử nhưng có sự
phân bố khác nhau của các phối tử trong thành phần của các ion phức tạo nên phân tử hợp chất.
[Co(NH3)6]Cl3 + K3[Cr(CN)6] 3KCl + [Co(NH3)6] [Cr(CN)6]
[Cr(NH3)6]Cl3 + K3[Co(CN)6] 3KCl + [Cr(NH3)6] [Co(CN)6]
5. Đồng phân hình học: là những hợp chất có cùng công thức phân tử nhưng có sự
phân bố khác nhau của các phối tử xung quanh ion trung tâm:
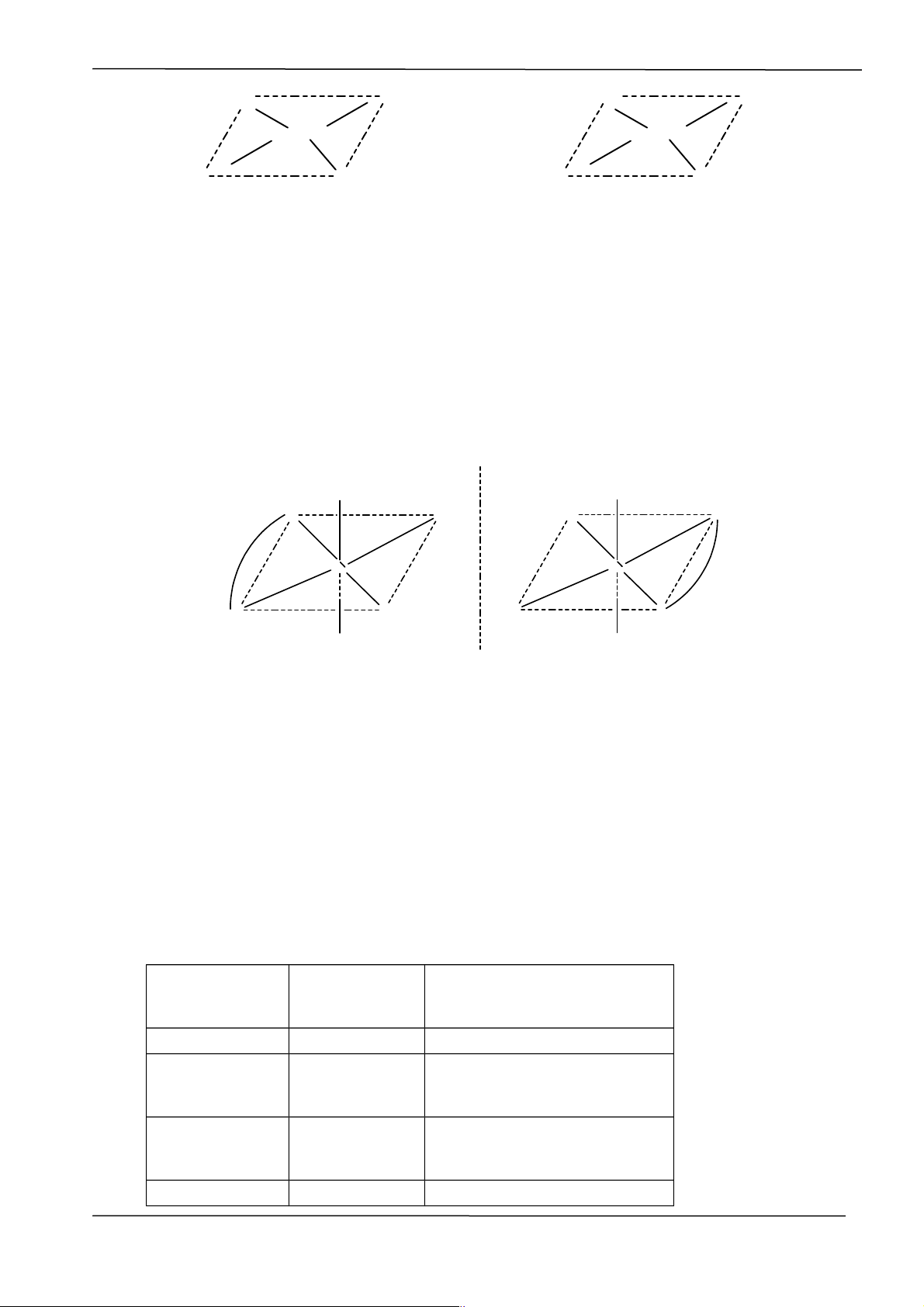
Vd: [Pt(NH3)2Cl2] tồn tại hai đồng phân cis – trans:
TỔ HÓA HỌC – THPT chuyên Lào Cai 10
Chuyên đề: PHỨC CHẤT H3N Cl- Cl- NH3 Pt2+ Pt2+ H3N Cl- H3N Cl-
Cis điclorođiammin platin (II) Trans điclorođiammin platin (II) (da cam) (vàng nhạt)
6. Đồng phân quang học: là những chất có cùng khối lượng phân tử, các phân tử
của chúng không có tâm đối xứng và không có mặt phẳng đối xứng. Do đó chúng
có khả năng làm quay mặt phẳng phân cực của ánh sáng. Vd: Cl Cl N Cl Cl N Co Co N NH3 H3N N NH3 NH3
I.3. GIẢI THÍCH LIÊN KẾT TRONG PHỨC CHẤT:
* Thuyết liên kết hoá trị: 1. Luận điểm:
Liên kết hoá học hình thành trong phức chất được thực hiện bởi sự xen phủ
giữa AO chứa cặp e riêng của phối tử với AO lai hoá trống có định hướng không
gian thích hợp của hạt trung tâm.
2. Một số trường hợp lai hoá: Dạng lai hoá Dạng hình Một số ion trung tâm học sp đường thẳng Ag+; Cu+… sp3 tứ diện Fe3+; Al3+; Zn2+; Co2+; Ti3+ … dsp2
vuông phẳng Pt2+; Pd2+; Cu2+; Ni2+; Au3+ … d2sp3 hoặc bát diện Cr3+; Co3+; Fe3+; Pt4+; Rh3+
TỔ HÓA HỌC – THPT chuyên Lào Cai 11
Chuyên đề: PHỨC CHẤT sp3d2 …
3. Cường độ của phối tử:
- Các phối tử có tương tác khác nhau đến ion trung tâm, nó ảnh hưởng đến trạng thái
lai hoá của ion trung tâm và từ tính của phức. Khả năng tương tác của các phối tử
được xếp theo trình tự sau: I-2- -
2O4 - Dãy phối tử được gọi là dãy quang phổ hoá học, những phối tử đứng trước có trường
yếu hơn phối tử đứng sau. Thường những phối tử đứng trước NH3 gây trường yếu,
đứng sau NH3 gây trường mạnh.
4. Các bước xác định cấu trúc ion phức:
Bước 1: Xác định cấu hình của ion trung tâm
Bước 2: Dựa vào đặc điểm của phối tử (mạnh hay yếu) để xác định lai hoá của ion trung tâm.
Bước 3: Viết giản đồ lai hoá AO của ion trung tâm và sự phân bố e của ion phức
Bước 4: Trên cơ sở cấu hình e của phức, xác định các tính chất của phức theo VB.
- Từ tính: thuận từ có e độc thân; nghịch từ e đã ghép đôi
- Quang phổ của phức: màu của phức chất Vd: [Co(CN)6]3- Ion Co3+:
CN- là phối tử trường mạnh nên có sự dồn electron. Ion Co3+ ở trạng thái lai hoá d2sp3 d2sp3
Dạng hình học của ion phức:
TỔ HÓA HỌC – THPT chuyên Lào Cai 12
Chuyên đề: PHỨC CHẤT CN- CN- CN- Co3+ CN- CN- CN-
Ion phức không còn electron độc thân nên có tính nghịch từ Vd 2: [CoF6]3- Ion Co3+:
F- là phối tử trường yếu không có hiện tượng dồn e. Ion Co3+ ở trạng thái lai hóa sp3d2 sp3d2
Dạng hình học của ion phức: F- F- F- Co3+ F- F- F-
Ion phức còn electron độc thân nên có tính thuận từ
5. Ưu điểm và hạn chế: - Ưu điểm:
+ Giải thích đơn giản liên kết hình thành và dạng hình học của phức chất
+ Giải thích được từ tính của phức chất - Nhược điểm:
+ Không giải thích được màu của phức chất
TỔ HÓA HỌC – THPT chuyên Lào Cai 13
Chuyên đề: PHỨC CHẤT
* Thuyết trường tinh thể (phối tử):
1. Luận điểm:
- Liên kết hoá học trong phức chất là lực tương tác tĩnh điện giữa ion trung tâm và phối tử:
- Ion trung tâm (thường là cation kim loại) được nghiên cứu cấu trúc e một cách chi
tiết. Phối tử được coi như những điện tích điểm (nếu là anion) hay lưỡng cực điểm
(nếu là phân tử trung hoà) tạo nên trường có đối xứng xác định tác dụng lên ion trung tâm.
- Các AO d của ion trung tâm ở trạng thái tự do gồm dxy; dxz; dyz; dx2-y2; dz2 có cùng
mức năng lượng. Tương tác của ion trung tâm với trường tĩnh điện của phối tử làm
các AO d giảm bậc suy biến, tách thành các mức có năng lượng khác nhau.
- Quy tắc điền e vào các AO d của ion trung tâm cũng giống như quy tắc điền e vào
nguyên tử, xong có chú ý đến năng lượng ghép đôi e và thông số tách mức năng lượng của AO d.
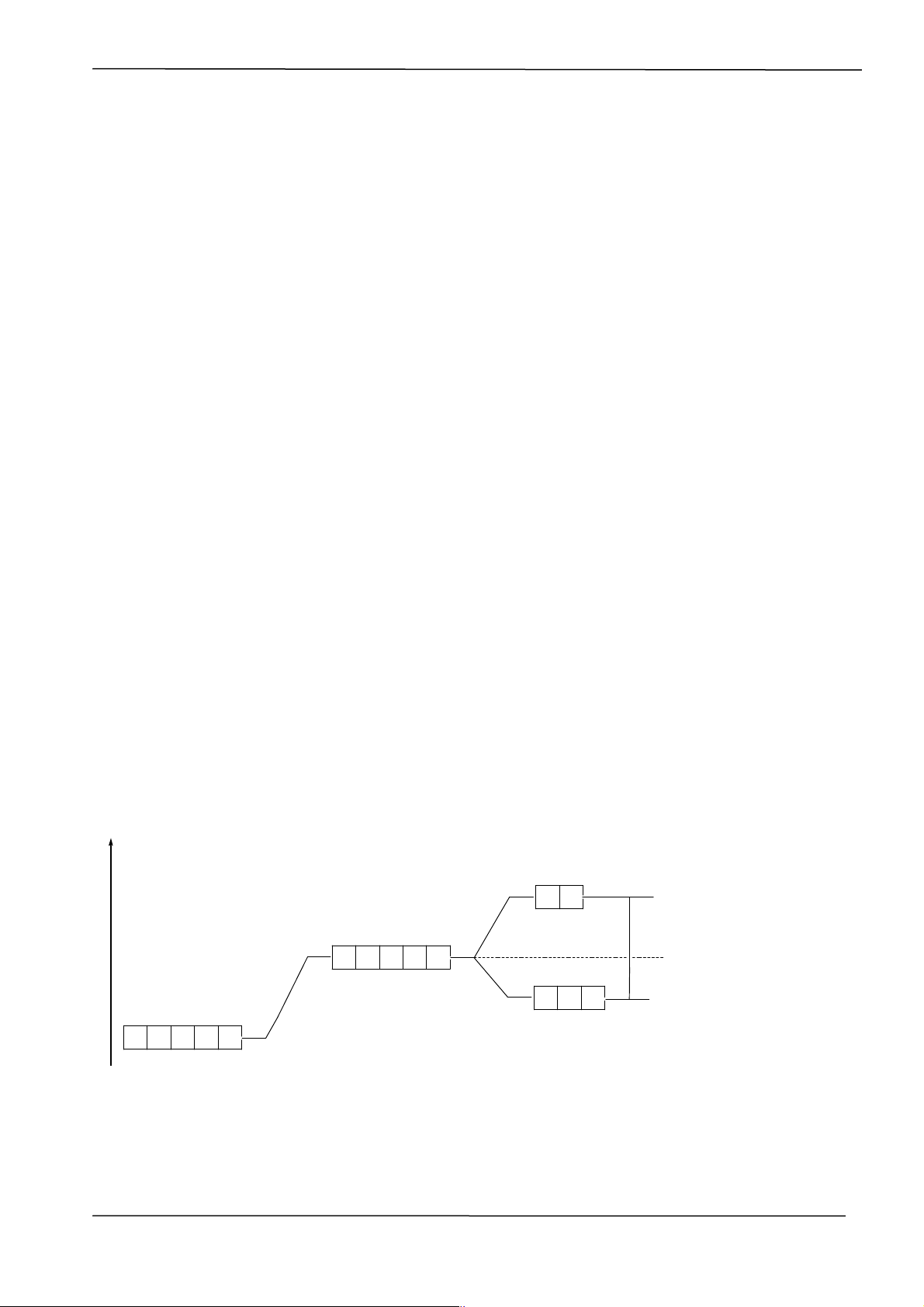
a. phức bát diện:
- Các AO dz2; dx2-y2 phân bố trên trục z; x; y nên gần phối tử hơn, do đó chịu lực đẩy
mạnh hơn nên nó có năng lượng cao hơn (eg). Ba AO dxy; dxz; dyz nằm trên đường
phân giác của các trục x; y; z tương ứng ở xa phối tử nên có năng lượng thấp hơn (t2g). dz2 dx2-y2 eg t2g dxy dxz dyz
Vd trường phối tử giải thích [CoF6]3- thuận từ, spin cao
[Co(CN6)]3- nghịch từ, spin thấp
b. Phức tứ diện:
TỔ HÓA HỌC – THPT chuyên Lào Cai 14
Chuyên đề: PHỨC CHẤT
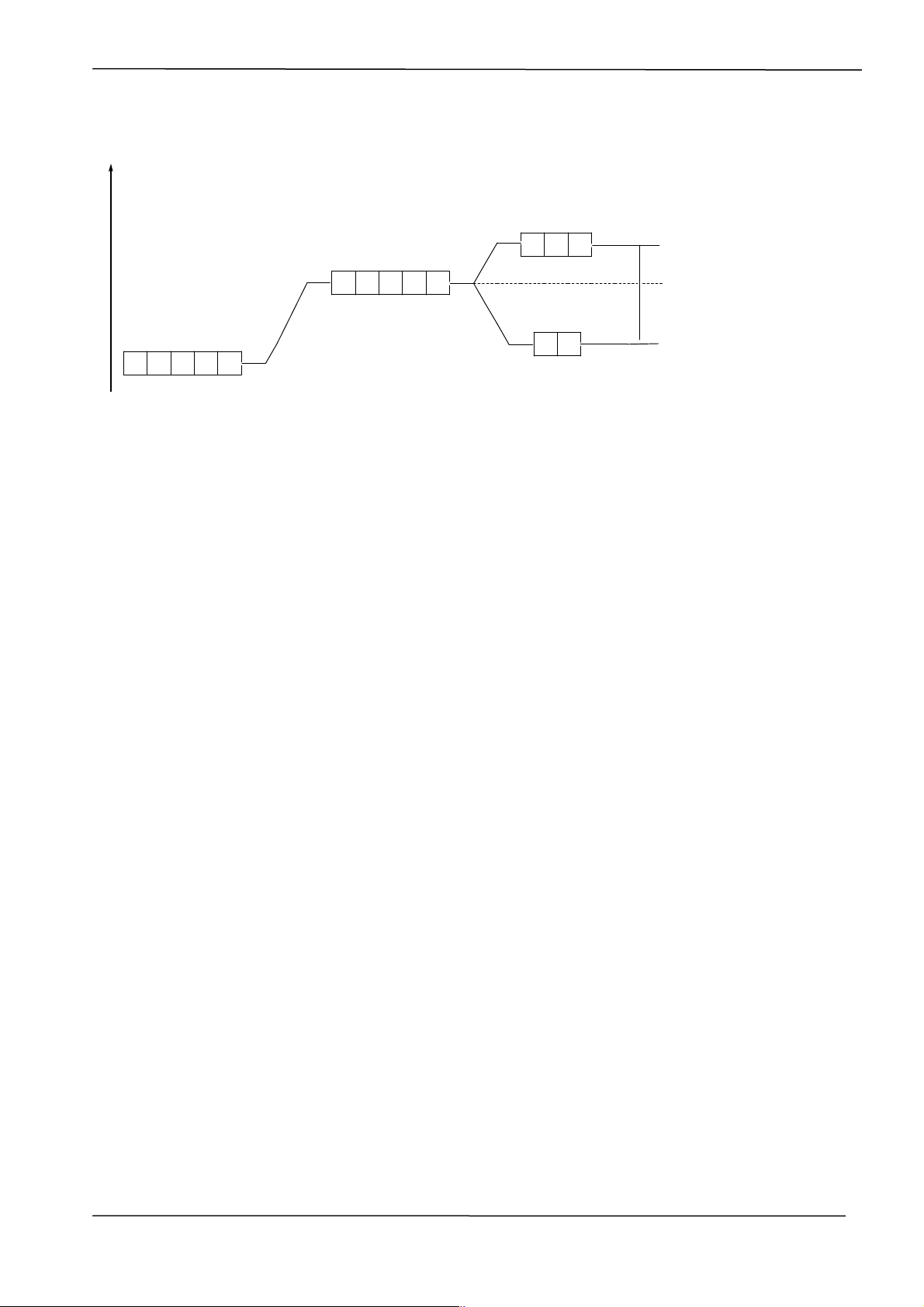
- Ngược với trường bát diện các AO dxy; dxz; dyz gần phối tử hơn nên bị đẩy lên mức
năng lượng cao, còn AO dz2; dx2-y2 có năng lượng thấp hơn. t2g dxy dxz dyz dz2 dx2-y2 eg Vd: [Cu(NH3)4]SO4
c. phức vuông phẳng:
- Hiện tượng phân chia năng lượng của các AO d phức tạp hơn: AO dx2-y2 gần phối tử
hơn nên có năng lượng cao hơn dz2. AO dxy chịu tác dụng trực tiếp nên có năng lượng hơi cao hơn dxz; dyz
Như vậy phức vuông phẳng là biến dạng của phức bát diện khi hai nhóm thế ở
vị trí trans trên trục z bị mất đi. Do đó obitan dz2 làm bền hơn nhiều và obitan dxz; dyz
được làm bền thêm một ít còn các obitan dx2-y2; dxy kém bền hơn so với phức bát diện.
2. Giải thích một số tính chất của phức:
a. Thông số tách năng lượng( ): là hiệu năng lượng của obitan d “cao” với obitan d “thấp”.
- Với phức bát diện: mỗi electron chiếm obitan eg có năng lượng cao hơn 3/ 5 o ,
mỗi electron chiếm obitan t2g có năng lượng thấp hơn 2 / 5o
- Với phức tứ diện: mỗi electron chiếm obitan t 2 / 5
2g có năng lượng cao hơn T , mỗi electron chiếm obitan e 3/ 5
g có năng lượng thấp hơn T
- Các yếu tố ảnh hưởng tới : + o o 9 / 4
T , nếu cùng ion trung tâm và phối tử thì T
+ Điện tích ion trung tâm lớn thì lớn
+ Bán kính ion trung tâm lớn thì lớn
TỔ HÓA HỌC – THPT chuyên Lào Cai 15
Chuyên đề: PHỨC CHẤT
+ Phối tử càng mạnh thì càng lớn
Thông số tách năng lượng trong trường bát diện (cm-1) [CrCl6]4-: 13000 [Co(H2O)6]3+: 18200 [Cr(H2O)6]2+: 14000 [Co(NH3)6]3+: 22900 [CrCl6]3-: 13200 [Co(CN)6]3-: 33.500 [Cr(H2O)6]3+: 17400 [Fe(CN)6]4-: 32800 [Cr(NH3)6]3+: 21500 [Fe(CN)6]3-: 35000 b. Từ tính:
- Nếu P> thì e được phân bố trên 5AO d rồi sau đó mới ghép đôi và phức có spin cao
- Nếu P< thì e được điền đủ cặp vào những AO có năng lượng thấp và phức có spin thấp.
Vd ion [CoF6]3- và [Co(CN)6]3- được đề cập ở trên.
c. Năng lượng bền của phức: ELb là hiệu năng lượng của các electron phân bố ở các
obitan d thấp với các electron ở các obitan d cao:
Vd: ion Co2+ trong phức bát diện có cấu hình 6 1 t e 6 2 . / 5 3/ 5 9 / 2 g g có ELb = o o 5 o
- Năng lượng làm bền cao giải thích tính trơ động học của phức chất spin thấp.
d. Hiệu ứng Jan-Telơ: trạng thái suy biến của một phân tử không thẳng hang là
không bền, phân tử sẽ biến dạng hình học để giảm tính đối xứng và độ suy biến.
e. Phổ hấp thụ và màu của phức chất:
- Một trong những thành tựu nổi bật nhất của thuyết trường tinh thể là giải thích
nguyên nhân sinh ra phô hấp thụ của phức chất các kim loại chuyển tiếp.
- Phổ hấp thụ electron của đa số phức chất của nguyên tố d gây nên bởi sự chuyển
dời electron từ obitan d có năng lượng thấp đến obitan d có năng lượng cao (sự chuyển dời d-d) Vd: ion phức [Ti(H 2O)6]3+ có o 8 ,
242 kj / mol có: h c . hcN E o N 1 0 . 4926 10 m 4926A 0 o
Màu bị hấp thụ là màu lục-chàm, nên phức có màu đỏ.
Bước sóng của ánh sáng trông thấy và màu:
Bước sóng của bức Màu của bức xạ Màu trông thấy xạ bị hấp thụ (màu phụ)
TỔ HÓA HỌC – THPT chuyên Lào Cai 16
Chuyên đề: PHỨC CHẤT bị hấp thụ (A0) 4000-4350 Tím Vàng - lục 4350-4800 Xanh chàm Vàng 4800-4900 Lam Da cam 4900-5000 Lam Đỏ 5000-5600 Lục Đỏ tía 5600-5750 Lục – vàng Tím 5750-5900 Vàng Xanh chàm 5900-6050 Da cam Lam 6050-7300 Đỏ Lam 7300-7600 Đỏ tía Lục
3. Ưu điểm và hạn chế: - Ưu điểm:
+ Giải thích được quang phổ hấp thụ của phức chất - Nhược điểm:
+ Không giải thích được phổ chuyển dịch điện tích
+ Không đề cập đến liên kết hình thành trong phức chất
* Thuyết obitan phân tử MO: 1. Luận điểm:
- Thuyết MO coi phân tử phức chất là một hạt thống nhất bao gồm ion (nguyên tử)
trung tâm và các phối tử. Các electron chuyển động trên obitan phân tử (MO).
- Sự tổ hợp tuyến tính các obitan nguyên tử của ion trung tâm và phối tử có cùng
tính đối xứng tạo nên các MO có năng lượng thấp hơn được gọi là obitan phân tử
liên kết (MOlk), các MO có năng lượng cao hơn được gọi là obitan phân tử phản liên kết (MO*) Vd: [Ti(H lk 2 lk 2 lk 2 lk 2 lk 2 ( ) ( 2 ) ( 2 2 ) ( ) ( ) ( ) 2O)6]3+: 1 s x y xy z x y - Những MO lk
định chỗ chủ yếu là của phân tử nước, vì obitan của nước bền
hơn nhiều so với ion trung tâm
- Các obitan không định chỗ và phản liên kết chủ yếu là của ion trung tâm
- Thông số tách được tính là hiệu năng lượng của d và d
TỔ HÓA HỌC – THPT chuyên Lào Cai 17
Chuyên đề: PHỨC CHẤT
2. Ưu điểm và hạn chế: - Ưu điểm:
+ Mô tả được bản chất liên kết trong phức chất
+ Giải thích sự hình thành liên kết trong phức
+ Giải thích hầu hết các tính chất của phức - Hạn chế:
+ Phương pháp này chỉ mang tính chất tham khảo, vì với trình độ và nội dung
kiến thức trung học phổ thông các em chưa thể hiểu sâu về thuyết này được. I.4. TÍNH CHẤT
I.3.1. Độ bền và tính chất của phức chất
Trong dung dịch các phức chất phân ly hoàn toàn thành ion phức và ion cầu
ngoại. Tùy vào độ bền khác nhau mà ion phức phân ly nhiều hay ít thành ion trung tâm và các phối tử.
Độ bền của các phức chất phụ thuộc vào ion trung tâm và phối tử. Các phức
chất của ion kim loại có hóa trị cao thường bền hơn các phức chất tương ứng có hóa trị thấp.
VD: Phức của Fe(III) với EDTA bền hơn phức của Fe(II) với EDTA hay phức
của Co(III) với NH3 bền hơn phức của Co(II) với NH3
Độ bền của các ‘phức càng’ tạo bởi ion kim loại với các phối tử đa phối trí
thường rất bền vì có sự tạo thành một hoặc nhiều vòng kín (năm cạnh hoặc sáu cạnh
là những vòng bền). Chẳng hạn phức của EDTA với các ion kim loại đều rất bền.
Độ bền của phức cũng thay đổi theo bản chất của dung môi. Như phức
Co(SCN)4 ở trong nước rất ít bền nhưng lại bền trong hỗn hợp nước + axeton hay trong ancol iso amilic.
Do độ bền của phức chất khá lớn nên nhiều dung dịch chứa ion kim loại bị
thay đổi khi có mặt các chất tạo phức. Dung dịch Fe3+ có tính axit do phản ứng tạo
phức hidroxo của ion Fe3+ nhưng độ axit giảm dần khi thêm NaF vào dung dịch vì
ion Fe3+ đã tạo phức bền với F- Fe3+ + H2O FeOH2+ + H3O+ Fe3+ + 3F- FeF3
TỔ HÓA HỌC – THPT chuyên Lào Cai 18
Chuyên đề: PHỨC CHẤT
Nhiều phức chất có tính chất đặc trưng như có màu, ít tan trong nước, tan
được trong dung môi hữu cơ… Vì vậy nhiều phản ứng được dùng để xác định định
tính cũng như định lượng chúng.
Đặc biệt nhiều ion kim loại có khả năng tạo phức rất bền với các thuốc thử
hữu cơ thành các hợp chất nội phức có màu đặc trưng và theo một tỉ lệ nhất định do
đó có thể sử dụng trong chuẩn độ để xác định chính xác hàm lượng của các ion kim
loại trong những mẫu thực tế.
I.3.2. Hằng số cân bằng tạo phức trong dung dịch
Sự tạo phức giữa các ion kim loại với phối tử thường diễn ra theo từng nấc với
sự hình thành nhiều phức với số phối trí khác nhau.
Để đặc trưng cho độ bền của phức chất người ta thường sử dụng các hằng số
bền hoặc hằng số tạo thành từng nấc. Người ta cũng hay biểu diễn phản ứng tạo
phức trực tiếp từ ion kim loại và phối tử. Lúc đó ta có các quá trình tạo phức tổng
hợp và các hằng số tạo thành tổng hợp hoặc hằng số bền tổng hợp
a. Hằng số tạo thành từng nấc
Trong trường hợp tổng quát sự tạo thành phức giữa ion kim loại Mn+ với phối
tử Lm- được biểu diễn theo sơ đồ sau : M + L ML k1 ML + L ML2 k2 ….. ….... MLn-1 + L MLn kn
k1, k2, ……kn là các hằng số tạo thành từng nấc hoặc hằng số bền từng nấc của
các phức chất tương ứng . Các giá trị k cho biết độ bền của từng phức và cho phép so
sánh khả năng tạo phức từng nấc.
b. Hằng số tạo thành tổng hợp
Chúng ta cũng có thể biểu diễn cân bằng tạo phức qua hằng số tạo thành tổng
hợp bằng cách tổ hợp các cân bằng từng nấc . M + L ML β1 M + 2L ML2 β2
TỔ HÓA HỌC – THPT chuyên Lào Cai 19
Chuyên đề: PHỨC CHẤT M + 3L ML3 β3 …… ….. ……. M + nL MLn βn
β được gọi là hằng số tạo thành tổng hợp hay là hằng số bền tổng hợp
β1=k1 , β2=k1 k2 , β3=k1k2k3…… βn=k1k2k3…..kn=
β càng lớn thì phức càng bền. Từ β ta có thể biểu diễn trực tiếp nồng độ các
dạng phức theo nồng độ cân bằng của ion kim loại và phối tử. Trong các dung dịch
loãng khi có thể coi hệ số hoạt độ của các cấu tử bằng 1 thì :
[ML]= β1 [M][L] ; [ML2] = β2 [M][L]2 ……. [MLn]= βn[M][L]n
Đối với phức nhiều nhân thì hằng số tạo thành tổng hợp có thêm chỉ số cho
biết số lượng ion trung tâm, chỉ số sau này để sau chỉ số phối tử. Như : 2Ag+ + 6I- Ag 4- 2I6 β62= 1030
c. Hằng số không bền từng nấc ML M + L k -1 1 ML -1 2 ML + L k2 ….. ….... ML -1 n MLn-1 + L kn k -1 -1 -1
1 , k2 , ……kn là các hằng số phân ly từng nấc hoặc hằng số không bền từng
nấc của các phức chất tương ứng . Các giá trị k-1 cho biết độ bền của từng phức và
cho phép so sánh khả năng phân ly từng nấc của phức chất. Dĩ nhiên hằng số không
bền càng lớn thì phức phân ly càng nhiều và càng ít bền.
d. Hằng số không bền tổng hợp
Xét quá trình phân ly tổng hợp của phức chất MLn trong dung dịch ta có: ML M + L K -1 1= β1 ML -1 2 M + 2L K2= β2 ML -1 3 M + 3L K3= β3 …… ….. …….
TỔ HÓA HỌC – THPT chuyên Lào Cai 20




