













Preview text:
TRƯỜNG ĐẠI HỌC BÁCH KHOA HÀ NỘI
Viện Kỹ thuật Hóa học
---------------o0o---------------
TIỂU LUẬN MÔN HỌC: HÓA SINH ĐẠI CƯƠNG
ĐỀ TÀI: TÌM HIỂU VỀ ENZYM
Giảng viên hướng dẫn: TS. Giang Thị Phương Ly
Sinh viên thực hiện MSSV Lớp
Nguyễn Thị Thu 20181034 Hóa học-K63
Nguyễn Thị Ngọc Ánh 20181023 Hóa học-K63
Dương Thị Quỳnh Mai 20181032 Hóa học-K63
Phạm Thị Thu Hoài 20181029 Hóa học-K63 Hà Nội, 6/2021
TRƯỜNG ĐẠI HỌC BÁCH KHOA HÀ NỘI
Viện Kỹ thuật Hóa học
---------------o0o---------------
TIỂU LUẬN MÔN HỌC: HÓA SINH ĐẠI CƯƠNG
ĐỀ TÀI: TÌM HIỂU VỀ ENZYM
Giảng viên hướng dẫn: TS. Giang Thị Phương Ly
Sinh viên thực hiện MSSV Lớp
Nguyễn Thị Thu 20181034 Hóa học-K63
Nguyễn Thị Ngọc Ánh 20181023 Hóa học-K63
Dương Thị Quỳnh Mai 20181032 Hóa học-K63
Phạm Thị Thu Hoài 20181029 Hóa học-K63 Hà Nội, 6/2021
LỜI MỞ ĐẦU ............................................................................................................. 3
A. TỔNG QUAN. ....................................................................................................... 4
I. ĐỊNH NGHĨA. ................................................................................................. 4 II.
CẤU TẠO. ..................................................................................................... 4
2.1. Thành phần. .................................................................................................. 4
2.2. Cấu trúc không gian. ................................................................................... 5
2.3. Trung tâm hoạt động. .................................................................................. 6
2.4. Trung tâm dị lập thể. ................................................................................... 7
III. CƠ CHẾ XÚC TÁC ENZYM. ........................................................................ 8
3.1.Cơ chế chung cơ chất kết hợp với trung tâm hoạt động: .......................... 8
3.2. Cơ chế hoạt động của trung tâm dị lập thể. ............................................ 11
IV.TÍNH CHẤT CHUNG. ................................................................................... 12
4.1. Tính chất của enzym. ................................................................................. 12
4.2. Tính đặc hiệu. ............................................................................................. 12
4.3. Tác dụng xúc tác của enzym. .................................................................... 15
V. VAI TRÒ VÀ ỨNG DỤNG. ........................................................................... 16
5.1. Vai trò của enzym trong quá trình chuyển hóa vật chất. ....................... 16
5.2. Vai trò của enzym trong cơ thể sống. ....................................................... 17
5.3. Ứng dụng của enzym trong đời sống. ....................................................... 18
VI. PHÂN LOẠI ENZYM ................................................................................... 20
6.1. Phân loại theo cơ chế xúc tác .................................................................... 20
6.2. Phân loại theo cấu tạo ................................................................................ 25
VII. TỐC ĐỘ PHẢN ỨNG CỦA ENZYM VÀ CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN
TỐC ĐỘ PHẢN ỨNG. ......................................................................................... 33
7.1. Tốc độ phản ứng của enzym. ..................................................................... 33
7.2. Thuyết Michaelis-Menten .......................................................................... 34
7.3. Các yếu tố ảnh hưởng đến tốc độ phản ứng enzym. ............................... 38
B. CÁC LOẠI ENZYM THƯỜNG GẶP .............................................................. 46
I. ENZYM PROTEASE. ...................................................................................... 46
1.1. Định nghĩa. .................................................................................................. 46
1.2. Nguồn gốc .................................................................................................... 47
1.3. Cơ chế .......................................................................................................... 47
1.4. Vai trò trong cơ thể .................................................................................... 48
1.5. Ứng dụng ..................................................................................................... 49
II. ENZYM LIPASE ............................................................................................. 49
2.1. Định nghĩa ................................................................................................... 49
2.2. Nguồn gốc .................................................................................................... 50
2.3. Cơ chế .......................................................................................................... 50
2.4. Vai trò trong cơ thể .................................................................................... 51
2.5. Ứng dụng ..................................................................................................... 51
III. ENZYM α-AMYLASE ................................................................................. 53
3.1. Định nghĩa ................................................................................................... 53
3.2. Nguồn gốc .................................................................................................... 53
3.3. Cơ chế quá ................................................................................................. 54
3.4. Vai trò trong cơ thể người ......................................................................... 55
3.5. Ứng dụng ..................................................................................................... 55
IV. ENZYM LACTASE ....................................................................................... 56
4.1. Định nghĩa ................................................................................................... 56
4.2. Nguồn gốc .................................................................................................... 56
4.3. Cơ chế .......................................................................................................... 57
4.4. Vai trò trong cơ thể .................................................................................... 58
4.5. Ứng dụng ..................................................................................................... 58
C. KẾT LUẬN .......................................................................................................... 60
TÀI LIỆU THAM KHẢO ...................................................................................... 61
Hóa sinh đại cương DANH MỤC HÌNH ẢNH
Hình 1. Sơ đồ minh họa sự tương ứng về cấu trúc giữa enzym và cơ chất theo thuyết
ổ khóa và chìa khóa của Fisher. ...................................................................................... 10
Hình 2. Sơ đồ minh hoạ thuyết tiếp xúc phản ứng của Koshland. .............................. 11
Hình 3. Sơ đồ mô tả minh họa cơ chế hoạt động của trung tâm lập thể .................... 11
Hình 4. Đồ thị Michaelis-Menten về sự phụ thuộc của tốc độ phản ứng vào nồng độ cơ
chất mà ở đó tốc độ phản ứng bằng ½ tốc độ tối đa. .................................................... 36
Hình 5. Đồ thị Lineweaver-Burk .................................................................................... 37
Hình 6. Sự phụ thuộc của tốc độ phản ứng vào nhiệt độ. ............................................ 40
Hình 7. Sự phụ thuộc của tốc độ phản ứng vào pH. ..................................................... 41
Hình 8. Cơ chế hoạt động của enzym khi có chất ức chế cạnh tranh. ........................ 44
Hình 9. Cơ chế hoạt động của enzym khi có chất ức chế không cạnh tranh. ............ 45
Hình 10. Sự phụ thuộc của tốc độ phản ứng vào chất ức chế thuận nghịch. ............. 45
Hình 11. Cơ chế xúc tác thủy phân liên kết peptide của enzym protease .................. 48
Hình 12. Cơ chế xúc tác thủy phân liên kết este của enzym lipase ............................. 51
Hình 13. Sơ đồ thủy phân tinh bột của enzym amylase ............................................... 55
Hình 14. Sơ đồ thủy phân lactose của enzym lactase ................................................... 57
Hình 15. Cơ chế xúc tác thủy phân của D-lactose của enzym lactase ......................... 58 1
Hóa sinh đại cương
BẢNG PHÂN CHIA CÔNG VIỆC NHÓM: STT Tên MSSV Chức vụ Nhiệm vụ 1 Nguyễn Thị Thu 20181034 Nhóm
Phụ trách phần B, phần kết luận (trang 47 trưởng – 61) 2
Dương Thị Quỳnh Mai 20181032 Thành viên
Phụ trách mục I, II, III, IV, V trong phần A (trang 4 – 20) 3
Nguyễn Thị Ngọc Ánh 20181023 Thành viên
Phụ trách phần mở đầu (trang 3), mục VI
trong phần A (trang 20 – 34) 4 Phạm Thị Thu Hoài 20181029 Thành viên
Phụ trách mục VII trong phần A (trang 34 - 47) 2
Hóa sinh đại cương LỜI MỞ ĐẦU
Trong thế kỷ XXI đã chứng kiến sự phát triển chưa từng có của sinh học phân tử và công
nghệ sinh học, đặc biệt là các ứng dụng của enzym. Các enzym là nền tảng xúc tác trong
trao đổi chất, chính vì thế nó được chú trọng trong nhiều sinh vật y học, trong các phát minh
trị liệu công nghệ dược, trong lĩnh vực hoá sinh về tách đồng và biểu hiện các protein bằng
các phương pháp sinh học phân tử, ...
Enzym là chất xúc tác cho các phản ứng sinh học, làm tăng tốc độ phản ứng cao hơn nhiều
so với các chất xúc tác tổng hợp. Chúng có tính đặc hiệu cơ chất rất cao và xúc tác các phản
ứng hoá học đặc biệt ở nhiệt độ, áp suất và pH bình thường, phần lớn các chất xúc tác khác
đều không có đặc tính này.
Enzym là chìa khoá quan trọng để hiểu biết cách tồn tại và nhân lên của tế bào. Chúng xúc
tác hàng trăm phản ứng của chuỗi trao đổi chất giúp cho các chất dinh dưỡng bị phân giải,
năng lượng được bảo toàn và chuyển hoá, các chất sinh học phân tử lớn được tạo thành từ
các tiền chất đơn giản.
Một số enzym tham gia vào quá trình trao đổi chất với chức năng là các enzym điều hoà,
những enzym này có thể phản ứng với các tín hiệu trao đổi chất khác nhau bằng cách thay
đổi hoạt động xúc tác một cách hợp lý. Nhờ hoạt động của các enzym điều hoà mà các hệ
thống enzym dược phối hợp một cách nhịp nhàng để thực hiện các phản ứng trao đổi chất
cần thiết cho sự sống. Như vậy, enzym có vai trò vô cùng quan trọng trong sự sống.
Trong khuân khổ bài tiểu luận này, nhóm em thực hiện đề tài: “Tìm hiểu về enzym” với hai
nội dung chính là tổng quan và các loại enzym hay gặp. 3
Hóa sinh đại cương A. TỔNG QUAN. I. ĐỊNH NGHĨA.
Enzym là chất xúc tác sinh học đặc biệt của cơ thể sống, có bản chất là protein (trừ
ribozyme-ARN), có tác dụng xúc tác cho hầu hết các phản ứng hóa sinh trong cơ thể.
Các enzym không bị hao hụt trong quá trình phản ứng.
Các enzym không phải là chất tham gia phản ứng mà chúng có khả năng làm tăng tốc
độ phản ứng lên gấp hàng vạn lần. Chúng làm thay đổi tốc độ phản ứng nhưng không làm
thay đổi hằng số cân bằng của phản ứng mà chúng xúc tác.
Enzym có tính đặc hiệu cao là chỉ xúc tác để tạo ra các sản phẩm mong muốn từ các
chất phản ứng cho trước hoặc từ cơ chất (cơ chất là chất phản ứng được chuyển hóa dưới
tác động của enzym [4]). Enzym cũng thể tính đặc hiệu tương đối với một số cơ chất có cấu
trúc gần giống nhau. (vấn đề này sẽ được làm rõ ở mục 3.2)
Enzym chỉ hoạt động ở vùng có nhiệt độ và độ pH phù hợp [4]. II. CẤU TẠO. 2.1. Thành phần.
Enzym là các phân tử protein hoặc các phân tử protein liên kết với các chất khác
không phải protein có khối lượng phân tử từ 12000 đến hàng triệu đvC [15].
Thành phần nguyên tố của enzym bao gồm:
- Thành phần các nguyên tố chính: C, H, O, N
- Một số thành phần khác như: S, P, ion kim loại, ...
Enzym có thể có một chuỗi hay nhiều chuỗi polypeptit tạo nên.
- Enzym đơn chuỗi là enzym do 1 chuỗi polypeptit cấu tạo lên.
Ví dụ: lipase, pepsin, chymotrypsin, …
- Enzym đa chuỗi là enzym do hai hay nhiều chuỗi polypeptit cấu tạo nên. 4
Hóa sinh đại cương Ví dụ:
• 2 chuỗi: aspartat transaminase (AST); alkalin phosphatase (ALP); creatin kinase (CK); hexokinase (HK).
• 4 chuỗi: lactat dehydrogenase (LDH) • 5 chuỗi: RNA polymerase
• 12 chuỗi: ATP synthetase.
• 40 chuỗi: glutamat dehydrogenase (GLDH) [15].
2.2. Cấu trúc không gian.
Enzym được cấu tạo từ protein và có thể có các nhóm ngoại (không phải protein).
Trong thực tế các chuỗi polypeptit cấu tạo nên enzym tồn tại ở trạng thái không gian cấu
trúc bậc 3 và 4 nên enzym có cấu trúc bậc 3, bậc 4.
Về hình dạng phân tử: đa số enzym có dạng hình cầu (dạng hạt).
Đa số enzym thuộc loại enzym đa cấu tử. Hiện nay người ta cũng đã xác định được
rằng phần lớn các enzym trong tế bào có cấu trúc bậc bốn. Ở những điều kiện xác định,
phân tử của chúng có thể phân ly thuận nghịch tạo thành các protomer (protomer là 1 chuỗi
polypeptit hay còn gọi là các các đơn vị nhỏ, hay tiểu phần dưới đơn vị) khi đó hoạt độ
enzym bị giảm hoặc bị mất hoàn toàn. Ở những điều kiện thích hợp các phần dưới đơn vị
lại có thể kết hợp lại với nhau và hoạt độ xúc tác của enzym được phục hồi.
Các protomer tương tác với nhau bằng các kiểu liên kết khác nhau. Trong đa số
trường hợp nhờ tương tác kỵ nước, liên kết hydrogen, mội số trường hợp khác nhờ liên kết
disulfide (ví dụ glucoseoxydase của Asp.niger) hoặc cầu polypeptide (ví dụ như ở enzyme
leucin-s-RNAsynthetase). Cầu polypeptide này có vai trò quan trọng với tính đặc hiệu của
enzyme, khi mất nó sẽ thay đổi tính chất phản ứng.
Các chuỗi polypeptide có cấu trúc bậc ba có thể kết hợp với nhau tạo thành phân tử
enzym có cấu trúc bậc bốn. Như vậy cấu trúc bậc bốn là cách sắp xếp đặc trưng trong không 5
Hóa sinh đại cương
gian của các chuỗi polypeptide riêng biệt trong phân tử enzym. Đến nay người ta đã xác
định rằng số lớn các enzym trong tế bào đều có cấu trúc bậc bốn. Sự sắp xếp của các chuỗi
polypeptit trong phân tử enzym thường có tính chất đối xứng cao.
2.3. Trung tâm hoạt động.
Enzym là protein đặc biệt. Ngoài cấu trúc giống như cấu trúc của protein, enzym
còn có cấu trúc đặc biệt liên quan đến hoạt động của enzym. Không phải toàn bộ các bộ
phận của enzym đều tham gia hoạt động xúc tác mà chỉ có bộ phận đặc biệt này mới tham
gia xúc tác phản ứng. Bộ phận này được gọi là trung tâm hoạt động.
Trung tâm hoạt động của enzym là phần nhỏ của enzym chứa các nhóm chức trực
tiếp kết hợp với cơ chất tham gia trực tiếp trong việc hình thành và cắt đứt liên kết đề tạo
thành sản phẩm phản ứng.
Trung tâm hoạt động chứa những nhóm phân cực hoặc ion hóa có khả năng tạo liên
kết hydro hoặc liên kết ion với đơn chất, là các acid amin có nhóm chức có hoạt tính cao
như serine (có chứa nhóm -OH), systeine (chứa nhóm -SH), axit glutamic (chứa nhóm -
COOH), lysine (chứ nhóm -NH + 3 ), …. [4].
Các gốc amino axit tạo ra trung tâm hoạt động của enzym thường không nằm cạnh
nhau trong chuỗi polypeptit thẳng (cấu trúc bậc 1). Nhưng trong thực tế, chuỗi polypeptit
cấu tạo nên enzym tồn tại ở trạng thái cấu trúc không gian bậc 3, bậc 4 nên các gốc
aminoaxit thường tồn tại gần nhau theo cấu trúc không gian. Do đó trung tâm hoạt động được tạo thành.
Mỗi enzym thường có một đến vài trung tâm hoạt động. Tác dụng của các trung tâm
hoạt động không phụ thuộc vào nhau.
Đặc điểm của trung tâm hoạt động:
- Chiếm một thể tích nhỏ của enzym.
- Cấu trúc không gian ba chiều.
- Liên kết với cơ chất bằng liên kết yếu (không phải liên kết cộng hóa trị). 6
Hóa sinh đại cương
- Thường là các hố, vết gãy trên bề mặt enzym (được tạo ra từ nếp gấp khúc của protein).
- Liên kết có tính đặc hiệu không gian.
Các nhóm chức năng của trung tâm hoạt động:
- Nhóm tiếp xúc: có tác dụng liên kết với các nhóm trên phân tử cơ chất để giữ cơ
chất ở trung tâm hoạt động. Nhóm tiếp xúc quyết định tính đặc hiệu của enzym.
- Nhóm xúc tác: phản ứng trực tiếp với cơ chất, làm biến đổi cấu tạo điện tử của
cơ chất để sẵn sàng tạo thành sản phẩm.
- Các nhóm tham gia duy trì hình dạng không gian của trung tâm hoạt động của
enzym để phù hợp với cơ chất trong khi gắn và phản ứng với cơ chất. Có enzym
chỉ có một trung tâm hoạt động, có enzym có hai hay nhiều trung tâm hoạt động,
các trung tâm hoạt động của một phân tử enzym có thể giống nhau hoặc khác
nhau về cấu tạo và chức năng, nên một phân tử enzym có thể xúc tác nhiều phản
ứng hóa học khác nhau [15].
2.4. Trung tâm dị lập thể.
Trong phân tử enzym ngoài vị trí trung tâm hoạt động còn một số vị trí khác có thể
tương tác với các chất khác được gọi là vị trí dị lập thể.
Vị trí dị lập thể là vị trí gắn với chất ức chế không cạnh tranh hoặc chất hoạt hóa của enzym [15].
Enzym có một đến vài vị trí dị lập thể.
Enzym tiếp nhận yếu tố dị lập thể để điều chỉnh hoạt động xúc tác của enzym. Khi
các chất này kết hợp với enzym làm thay đổi cấu trúc không gian, gây ra sự thay đổi trong
hình dạng hoặc hình thể của phân tử enzym, cụ thể là của trung tâm hoạt động do đó làm
thay đổi hoạt độ xúc tác của enzym [15]. 7
Hóa sinh đại cương
III. CƠ CHẾ XÚC TÁC ENZYM.
3.1. Cơ chế chung cơ chất kết hợp với trung tâm hoạt động:
E + S → ES → E + P, trong đó: E là enzym, S là cơ chất, P là sản phẩm.
- Giai đoạn thứ nhất: enzym kết hợp với cơ chất bằng liên kết yếu tạo thành phức
hợp enzym - cơ chất (ES) không bền, phản ứng này xảy ra rất nhanh và đòi hỏi
năng lượng hoạt hóa thấp. Các loại liên kết chủ yếu được tạo thành giữa E và S trong phức ES là:
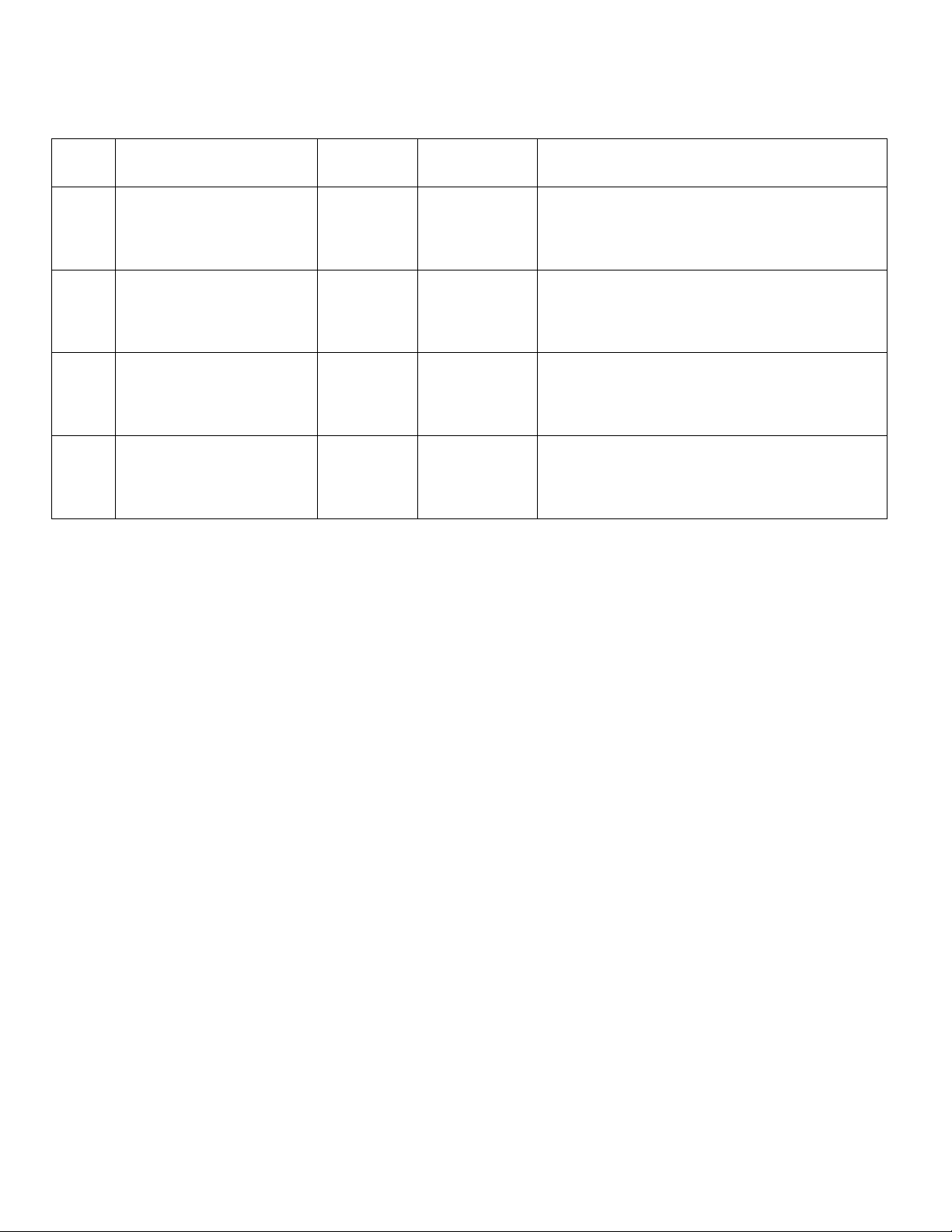
+ Tương tác tĩnh điện (liên kết hydro): được tạo thành giữa nhóm tích điện
của cơ chất và nhóm tích điện trái dấu trong phân tử enzym.
+ Liên kết hyđro: được tạo thành theo kiểu A-H…B, trong đó hydro liên kết
với A bằng liên kết cộng hóa trị, đồng thời tạo liên kết yếu với B.
Ví dụ: Liên kết hydro được hình thành:
• Giữa nhóm -NH- trong liên kết peptide của enzym với nhóm cacbonyl của urin.
• Giữa nhóm -NH- của urin với nhóm -OH của treonin trong phân tử enzym.
• Giữa nhóm -OH trong gốc xerin của enzym với nhóm cacbonyl của uridin [4]. 8
Hóa sinh đại cương
+ Tương tác Van der Waals: yếu, thể hiện rõ khi nhiều nguyên tử của
cơ chất cơ thể đồng thời tiếp cận với nhiều nguyên tử enzym. Điều này
chỉ xảy ra khi có sự ăn khớp về hình dạng giữa cơ chất và enzym [4].
+ Tương tác kị nước giữa các nhóm không gian phân cực. Các nhóm,
phần không phân cực của các gốc trong phân tử cơ chất và enzym có
khuynh hướng kết lại với nhau, do đó tương tác kị nước đóng vai trò
quan trọng quá trình cuộc lại của các chất phân tử lớn cũng như tương
tác giữa cơ chất và enzym [4].
Mỗi loại liên kết đòi hỏi những điều kiện khác nhau và chịu ảnh hưởng khác nhau khi có nước.
- Giai đoạn thứ hai: khi cơ chất tạo phức với enzym sẽ bị thay đổi cấu hình không
gian, cả mức độ bền vững của liên kết dẫn đến các liên kết cộng hóa trị bị phá vỡ và tạo ra sản phẩm.
- Giai đoạn thứ ba: tạo thành sản phẩm, còn enzym được giải phóng ra dưới dạng tự do.
Yêu cầu: E và S phải bổ sung về mặt không gian và hợp nhau về mặt hóa học,
có khả năng hình thành nhiều liên kết yếu với nhau. Chúng liên kết sao cho có
thể tạo ra và cắt đứt sự dính nhau được gây nên do biến động nhiệt ngẫu nhiên ở nhiệt độ thường [4]. 9
Hóa sinh đại cương
Trong một số enzym còn có "trung tâm dị lập " - những phần enzym khi kết hợp
với các chất có phân tử nhỏ nào đó sẽ làm biến đổi cấu trúc bậc ba của toàn bộ
phân tử enzym làm cấu trúc trung tâm hoạt động thay đổi, làm biển đổi hoạt tính của enzym.
Các giả thiết về sự hoạt động của trung tâm hoạt động:
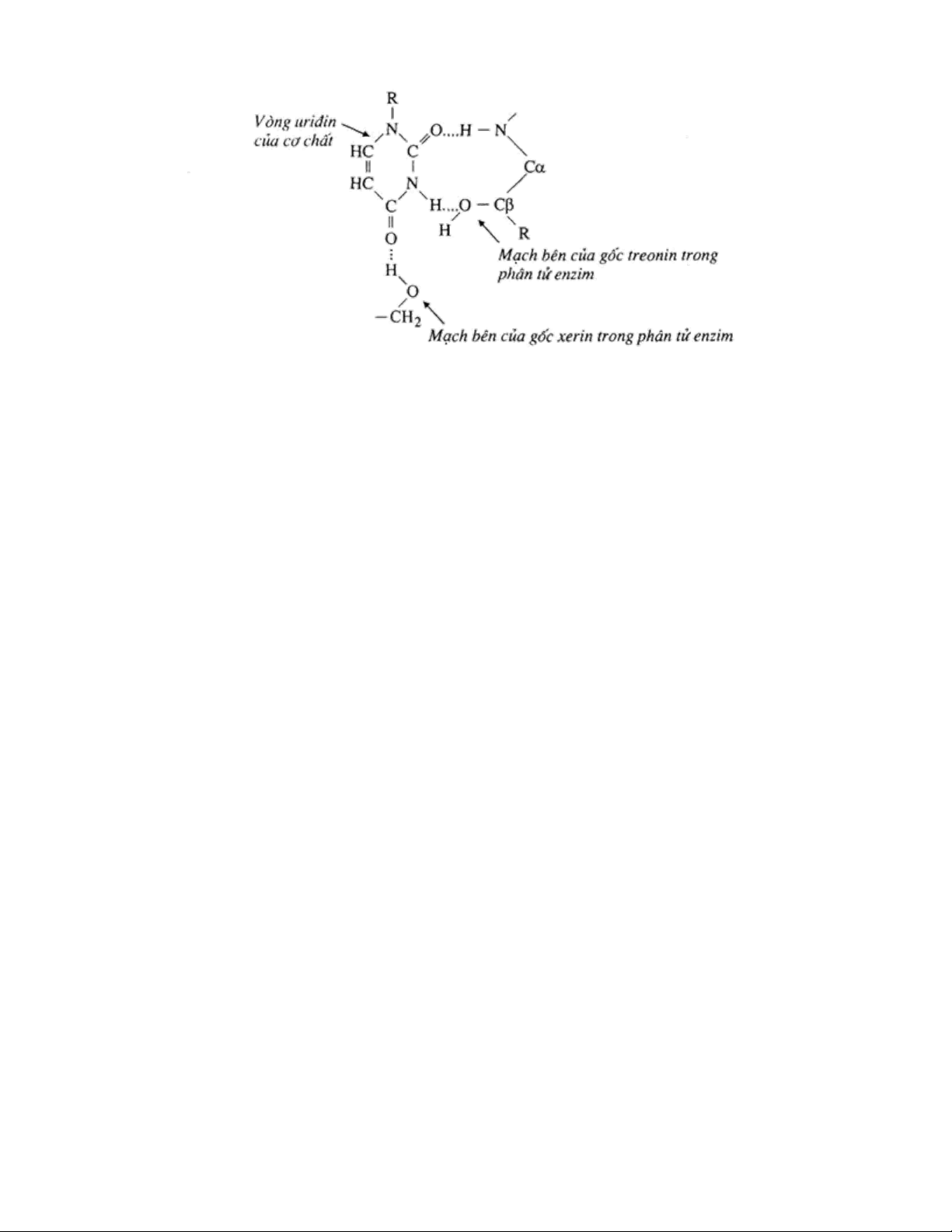
- Theo bổ sung hay thuyết “chìa khóa (S) và chìa khóa (E) của Fisher.E
- Theo thuyết thích hợp cảm ứng của Kosland.
3.1.1. Theo bổ sung hay thuyết “chìa khóa (S) và chìa khóa (E) của Fisher.E:
Trung tâm hoạt động của enzym được hình thành sẵn với cấu trúc không gian xác
định. Cơ chất có cấu trúc tương ứng với cấu trúc của trung tâm hoạt động mới được kết hợp
vào. Giải thích tính đặc hiệu tương đối của enzym. [4]
Hình 1. Sơ đồ minh họa sự tương ứng về cấu trúc giữa enzym và cơ chất theo
thuyết ổ khóa và chìa khóa của Fisher.
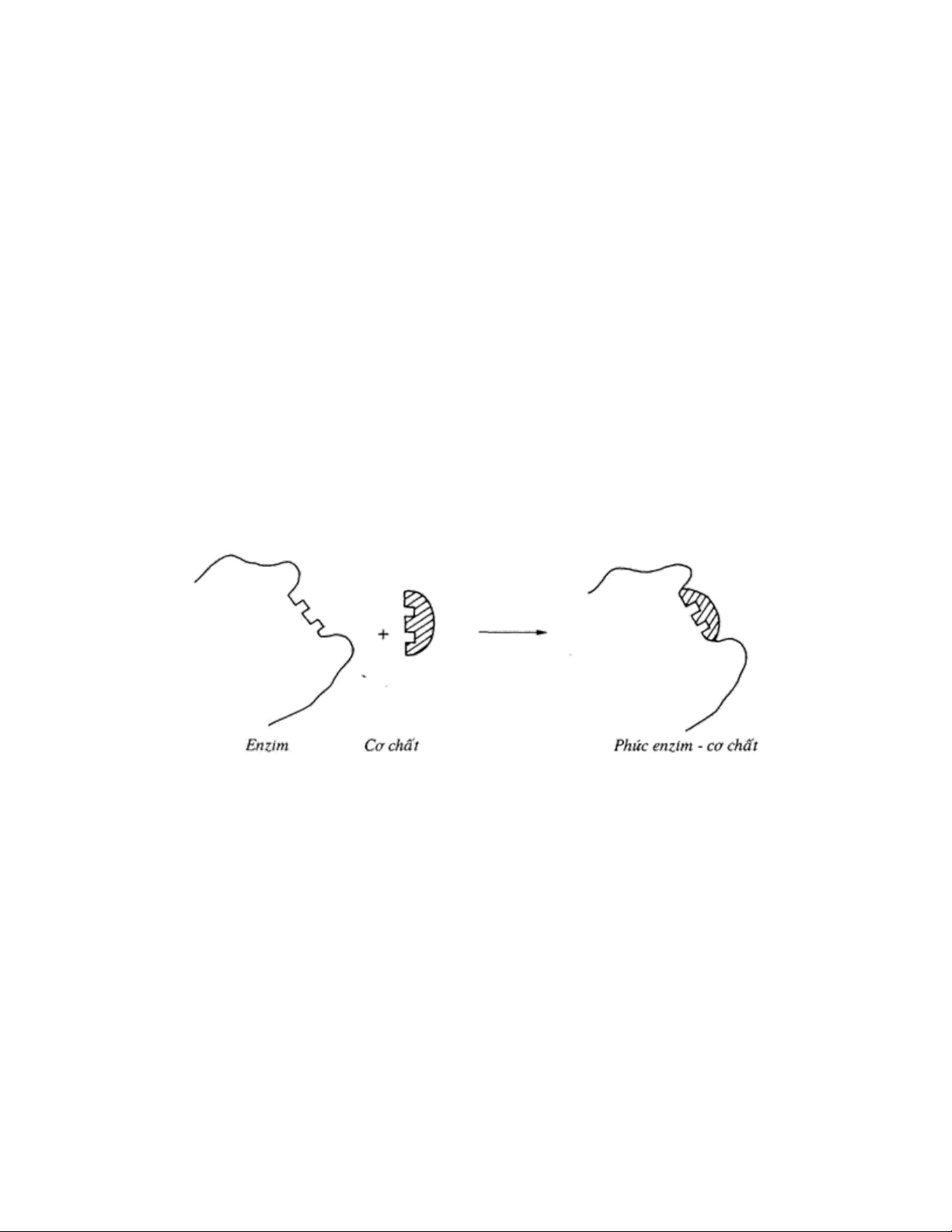
3.1.2. Theo thuyết thích hợp cảm ứng của Koshland:
Trung tâm hoạt động của enzym có cấu trúc không gian mềm dẻo và linh động, các
nhóm chức năng của trung tâm hoạt động vẫn tự do ở tư thế sẵn sàng hoạt động.
Khi tiếp xúc với cơ chất thì chính cơ chất gây ra cảm ứng không gian làm biến đổi
hình dạng phân tử enzym. Các nhóm chức năng của trung tâm hoạt động di chuyển và định
hướng thích hợp, chính xác để thành lập phức hợp cơ chất- enzym. Dẫn đên trung tâm hoạt 10
Hóa sinh đại cương
động có cấu trúc không gian tương tự cơ chất. Trung tâm hoạt động của enzym chỉ thực sự
hình thành trong quá trình tiếp xúc giữa enzym và cơ chất. [4]
Hình 2. Sơ đồ minh hoạ thuyết tiếp xúc phản ứng của Koshland.
A, B, C là các nhóm chức trung tâm hoạt động.
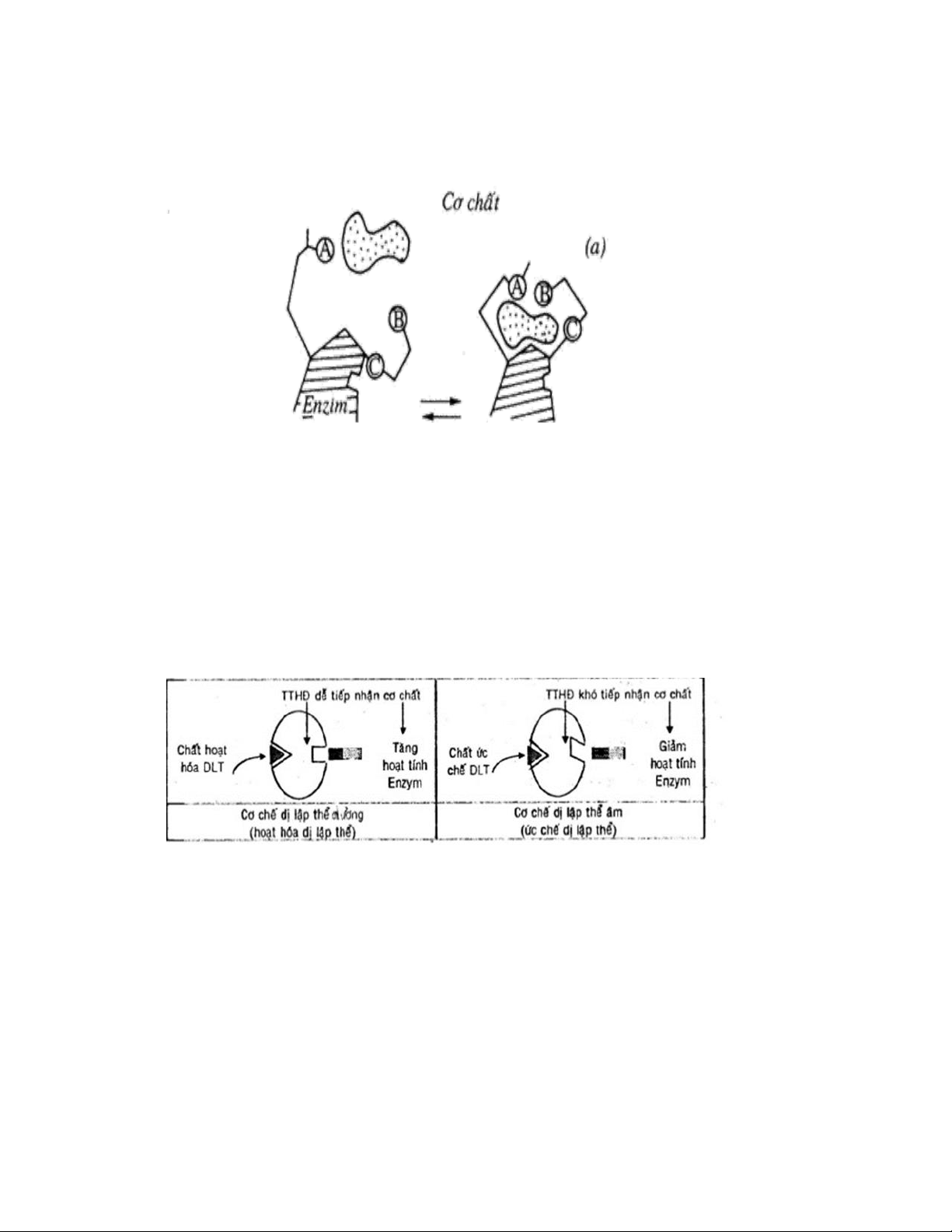
3.2. Cơ chế hoạt động của trung tâm dị lập thể.
Những thay đổi trong hoạt tính enzym thường bắt nguồn từ những biến đổi trong ái
lực biểu kiến của enzym đối với cơ chất
Hình 3. Sơ đồ mô tả minh họa cơ chế hoạt động của trung tâm lập thể
Các loại vị trí dị lập thể:
+ Vị trí dị lập thể dương: •
Vị trí dị lập thể dương là nơi tiếp nhận yếu tố dị lập thể dương (chất hoạt hóa). 11
Hóa sinh đại cương •
Cấu hình enzym thay đổi theo hướng có lợi, enzym được hoạt
hóa tạo phức hợp enzym - cơ chất tốt hơn, tốc độ phản ứng được tăng lên.
+ Vị trí dị lập thể âm: •
Vị trí dị lập thể âm là nơi tiếp nhận yếu tố dị lập thể âm (chất ức chế). •
Cấu hình enzym thay đổi theo hướng bất lợi, enzym bị ức chế,
ái lực enzym- cơ chất giảm dẫn đến tốc độ phản ứng giảm. IV.TÍNH CHẤT CHUNG.
4.1. Tính chất của enzym.
Enzym có bản chất là protein nên có tất cả thuộc tính lý hóa của protein. Đa số enzym
có dạng hình cầu và không đi qua màng bán thấm do có kích thước lớn.
Tan trong nước và các dung môi hữu cơ phân cực khác, không tan trong ete và các dung môi không phân cực.
Không bền dưới tác dụng của nhiệt độ, nhiệt độ cao thì enzym bị biến tính. Môt
trường axit hay bazơ cũng làm enzym mất khả năng hoạt động.
Enzym có tính lưỡng tính: tùy pH của môi trường mà tồn tại ở các dạng: cation,
anion hay trung hòa điện [15].
4.2. Tính đặc hiệu.
Tính đặc hiệu ra làm 3 kiểu: - Đặc hiệu phản ứng. - Đặc hiệu cơ chất. - Đặc hiệu không gian. 12
Hóa sinh đại cương
4.2.1. Đặc hiệu phản ứng.
Đó là biểu hiện của một enzym chỉ thường xuyên xúc tác cho một kiểu phản ứng nhất định.
Ví dụ amino axit có khả năng xảy ra phản ứng khử carboxyl, và phản ứng vận chuyển
nhóm amine, vì vậy mỗi phản ứng ấy cần có một enzym đặc hiệu tương ứng xúc tác theo
thứ tự là decarboxylase, aminotransferase.
4.2.2. Đặc hiệu cơ chất.
Mỗi enzym chỉ xúc tác cho sự chuyển hóa của một hay một số chất nhất định.
Tuỳ mức độ người ta chia thành: đặc hiệu tương đối và đặc hiệu tuyệt đối. -
Đặc hiệu tuyệt đối: Một số enzym hầu như chỉ xúc tác cho phản ứng chuyển hóa
một cơ chất xác định và chỉ xúc tác cho phản ứng ấy mà thôi. cấu trúc trung tâm
hoạt động của enzyme tương ứng rất chặt chẽ với cấu trúc của cơ chất đến mức
chỉ một sai khác nhỏ về cấu trúc của cơ chất cũng đủ làm cho enzym không xúc tác được. Ví dụ: NH2 Enzym urease (ure) C=O + H2O CO2 + 2 NH3 NH2 HOHN Enzym urease
(Hydroxyure) C=O + H2O NH2OH + CO2 + NH3 NH2 13
Hóa sinh đại cương
Enzym urease phân giải ure ngoài ra nó còn có thể phân giải hydroxyure
nhưng với tốc độ thấp hơn 120 lần [4].
- Đặc hiệu nhóm tuyệt đối: Các enzym này chỉ tác dụng lên những chất có cùng
một kiểu cấu trúc phân tử, một kiểu liên kết và có những yêu cầu xác định đối
với nhóm nguyên tử ở phần liên kết chịu tác dụng.
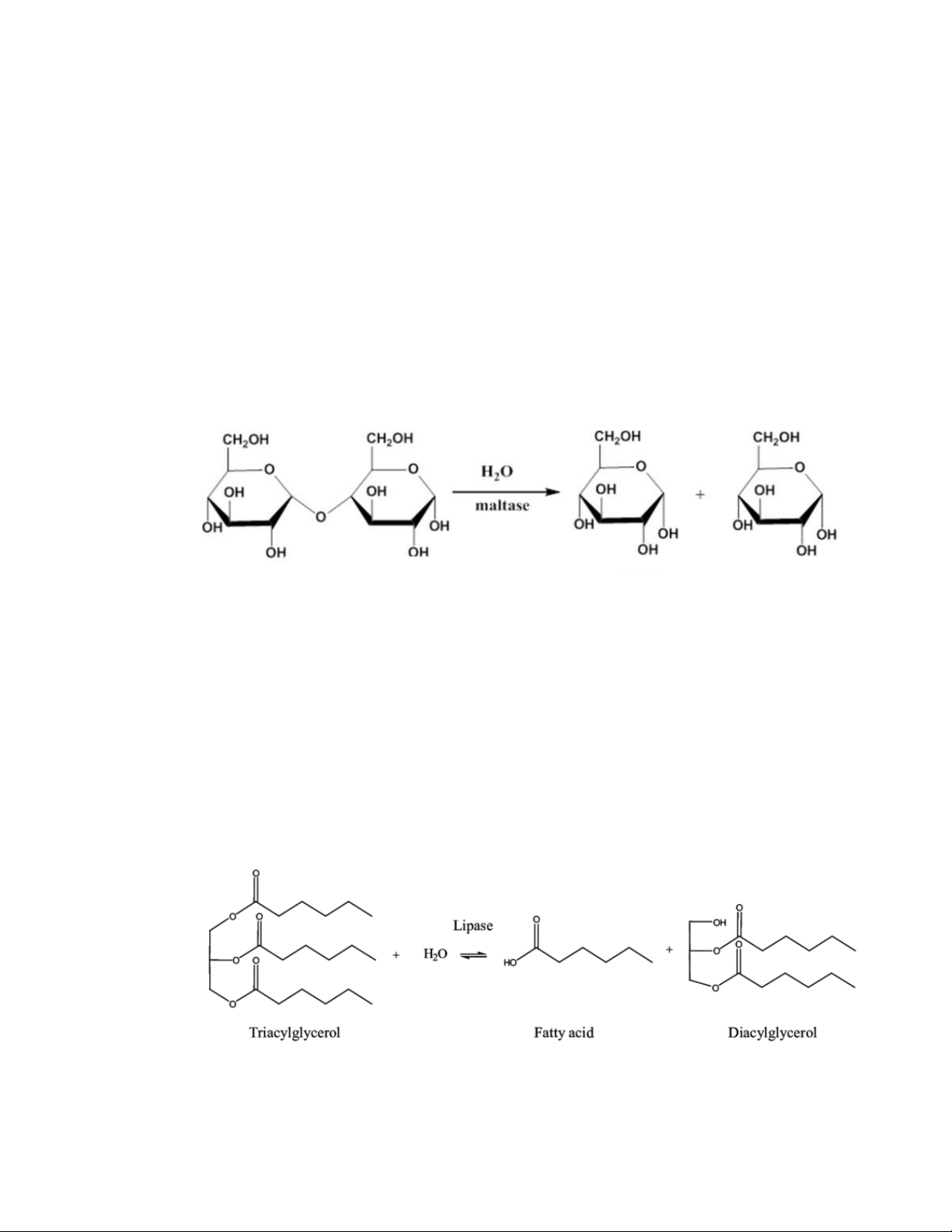
Ví dụ: maltase thuộc nhóm - glucosidase chỉ xúc tác cho phản ứng thủy phân liên
kết glucoside được tạo thành từ nhóm -OH glucoside của glucose với nhóm -OH của một monose khác [4].
- Đặc hiệu nhóm tương đối: Mức độ đặc hiệu của các enzym thuộc nhóm này kém
hơn nhóm trên. Enzym có khả năng tác dụng lên một kiểu liên kết hóa học nhất
định trong phân tử cơ chất mà không phụ thuộc vào cấu tạo của các phần tham
gia tạo thành mối liên kết đó.
Ví dụ: lipase có khả năng thủy phân được tất cả các mối liên kết este[4]. 14
Hóa sinh đại cương lipase monoglyceride glycerol
4.2.3. Đặc hiệu quang học.
Hầu như tất cả các enzym đều có tính đặc hiệu quang học rất chặt chẽ, nghĩa là các
enzym chỉ xúc tác cho một dạng đồng phân nào đó như dạng L hay dạng D, dạng cis hay trans mà thôi [4].
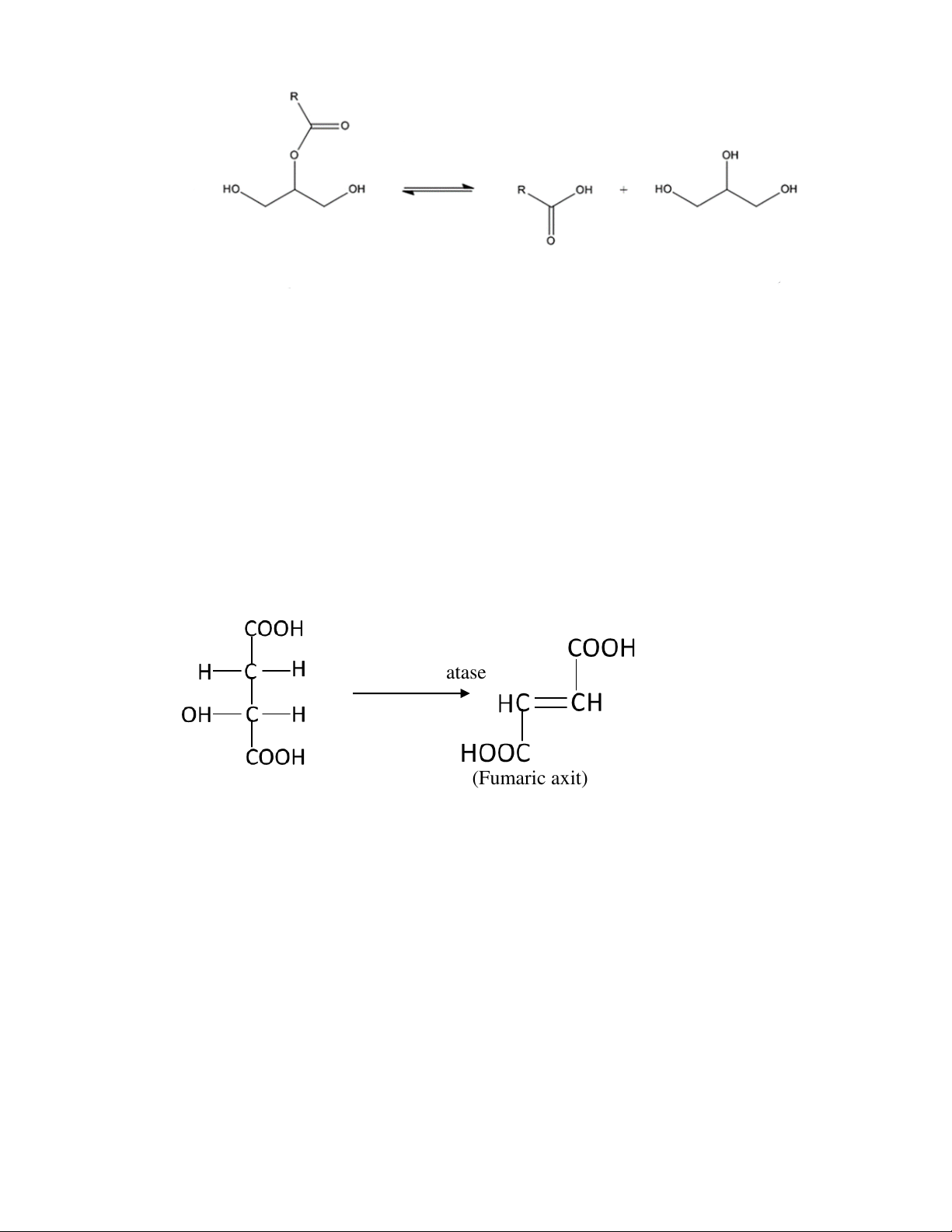
Ví dụ phản ứng khử nước của malic axit để tạo thành fumaric axit dưới taocs dụng
của enzym fumarathytase chỉ xảy ra đối với L-Malic axit mà không xảy ra với D- Malic axit. fumarathydratase (L- Malic axit) (Fumaric axit)
4.3. Tác dụng xúc tác của enzym.
Trong cơ thể con người và sinh vật các phản ứng xảy ra với tốc độ rất nhanh ở những
điều kiện đặc biệt của nhiệt hóa học như:
- Nhiệt độ (thân nhiệt).
- Môi trường có nước và không phát nhiệt mạnh.
- Hiệu quả phân giải và tổng hợp cao hơn so với trình độ xúc tác kỹ thuật. 15



