













Preview text:
TRƢỜNG ĐẠI HỌC BÁCH KHOA HÀ NỘI
Viện Kỹ thuật Hóa học
---------------o0o---------------
TIỂU LUẬN MÔN HỌC: HÓA SINH ĐẠI CƢƠNG
ĐỀ TÀI: TÌM HIỂU VỀ PROTEIN
Giảng viên hƣớng dẫn: TS.Giang Thị Phƣơng Ly
Sinh viên thực hiện: Bùi Thị Hồng Tƣơi - 20181037
Vũ Thị Hồng Yên - 20175382
Nguyễn Thúy Hằng - 20181027 Nguyễn Thế Anh - 20181022
Đặng Trần Ngọc Tú - 20181036 Hà Nội, 4/2021 i MỤC LỤC
I.ĐẠI CƢƠNG VỀ PROTEIN .................................................................................................................1
1.1. Tổng quan ......................................................................................................................................1
1.1.1. Khái niệm ...............................................................................................................................1
1.1.2. Nguồn protein .........................................................................................................................2
1.1.3. Vai trò của protein .................................................................................................................3
1.2. Các dạng tồn tại cả protein. ...........................................................................................................3
1.2.1. Peptit-Protein .........................................................................................................................3
1.2.2. Aminoacid...............................................................................................................................4
II. PHÂN LOẠI PROTEIN ................................................................................................................... 18
2.1. Phân loại theo hình dạng ............................................................................................................ 18
2.2. Phân loại theo cấu trúc hóa học .................................................................................................. 20
III. CẤU TẠO CỦA PROTEIN ............................................................................................................ 23
3.1. Thành phần nguyên tố của protein ............................................................................................. 23
3.2. Sự hình thành bốn bậc cấu trúc của protein ............................................................................... 25
3.2.1. Cấu trúc bậc nhất ................................................................................................................ 26
3.2.2. Cấu trúc bậc hai .................................................................................................................. 26
3.2.3. Cấu trúc bậc ba ................................................................................................................... 28
3.2.4. Cấu trúc bậc bốn ................................................................................................................. 29
3.3. Sự biến tính của Protein ............................................................................................................. 30
3.3.1. Tính chất của protein sau khi bị biến tính ........................................................................... 30
3.3.2. Tác nhân biến tính ............................................................................................................... 30
3.3.3. Ứng dụng sự biến tính của protein trong sản xuất thực phẩm ........................................... 32
3.3.4. Ứng dụng biến tính trong bảo quản thực phẩm .................................................................. 35
3.4. Các phản ứng của protein ........................................................................................................... 35
IV. QUÁ TRÌNH TỔNG HỢP VÀ PHÂN GIẢI PROTEIN ................................................................ 39 ii 4.1.
Quá trình tổng hợp protein .................................................................................................... 39
4.1.1. Khái niệm ............................................................................................................................ 39
4.1.2. Quá trình tổng hợp .............................................................................................................. 39
4.1.3 Ứng dụng .............................................................................................................................. 45
4.2. Quá trình phân giải protein ........................................................................................................ 46
4.2.1 Khái niệm .............................................................................................................................. 46
4.2.2 Các yếu tố ảnh hưởng .......................................................................................................... 47
4.2.3 Quá trình phân giải .............................................................................................................. 48
4.2.4 Ứng dụng .............................................................................................................................. 49
V. TÍNH CHẤT VÀ CHỨC NĂNG SINH HỌC CỦA PROTEIN quá sơ sài .................................... 49
5.1. Protein cấu trúc .......................................................................................................................... 50
5.2.Protein enzym .............................................................................................................................. 50
5.3. Protein điều hòa .......................................................................................................................... 51
5.4. Protein vận tải ............................................................................................................................ 52
5.5. Protein vận động ........................................................................................................................ 53
5.6. Protein thụ quan ......................................................................................................................... 53
5.7. Protein dự trữ ............................................................................................................................. 53
5.8. Protein bảo vệ ............................................................................................................................. 54
5.9. Protein cung cấp năng lƣợng ...................................................................................................... 54
TÀI LIỆU THAM KHẢO ............................................................................................................. 55 iii DANH MỤC HÌNH ẢNH
Protein trong đời sống ............................................................................................................1
Protein trong động vật (thịt, cá, trứng, sữa) ...........................................................................2
Protein trong thực vật (hạt).....................................................................................................3
Hình 4. 1 Tổng quan về phiên mã ......................................................................................................... 40
Hình 4. 2 Các bước phiên mã. Quá trình xảy ra theo ba bước: bắt đầu, kéo dài và kết thúc ............... 41
Hình 4. 3 Quá trình tổng hợp chuỗi polypeptit ............................................................................... 44
Hình 4. 4 Tổng hợp chuỗi polypeptit bước mở đầu ........................................................................ 44
Hình 4. 5 Tổng hợp chuỗi polypeptit bước kéo dài ............................................................................... 45
Hình 4. 6 Tổng hợp chuỗi polypeptit bước kết thúc .............................................................................. 45
Hình 4. 7 Vi khuẩn lam Spirulina ........................................................................................................... 46
Hình 4. 8 Tảo Chlorella ......................................................................................................................... 46 iv
Phân chia công việc STT Tên Chức vụ Nhiệm vụ 1 Bùi Thị Hồng Tƣơi Nhóm
Phụ trách chung, phụ trách phần III trƣởng 2 Vũ Thị Hồng Yên Thành viên Phụ trách phần I 3
Nguyễn Thúy Hằng Thành viên Phụ trách phần IV 4 Nguyễn Thế Anh Thành viên Phụ trách phần V 5
Đặng Trần Ngọc Tú Thành viên Phụ trách phần II v
I.ĐẠI CƢƠNG VỀ PROTEIN
1.1: Protein trong đời sống 1.1. Tổng quan
1.1.1. Khái niệm
- Protein (hay còn gọi là chất đạm) là lớp chất hữu cơ trùng phân tự nhiên với các
đơn phân là các α-amino acid theo quan điểm hóa học. Mặt khác theo quan điểm sinh
học thì protein là các chất hữu cơ mang sự sống,nghĩa là chất nào có protein thì chất
đó có mang sự sống. [1] - Đặc điểm:
+ Là đại phân tử (trọng lƣợng phân tử lớn)
+ Luôn chứa nitrogen với tỉ lệ tƣơng đối ổn định khoảng 16%
Tính độ đạm (protein) tức là tính tỉ lệ N có trong mẫu
Tỉ lệ % protein = Số lƣợng N có trong protein x f x 100%
Trong đó: f = 6.25 (protein thƣờng) f = 5.7 (protein ngũ cốc) f = 6.38 (protein sữa) 1
- Các protein khác nhau chủ yếu ở trình tự sắp xếp của các amino acid trong cấu tạo.
1.1.2. Nguồn protein
- Protein có trong cả động vật và thực vật:
+ Thực phẩm nguồn gốc động vật (thịt, cá, trứng, sữa) là nguồn protein quý,
nhiều về số lƣợng, cân đối hơn về thành phần và đậm độ amino acid cần thiết cao.Tuy
nhiên cần sử dụng vừa đủ loại protein này vì khi ăn nhiều protein động vật chúng ta có
nguy cơ mắc chứng bệnh nhƣ gout,.. [1]
h 1.2: Protein trong động vật (thịt, cá, trứng, sữa)
+ Hàm lƣợng các amino acid cần thiết trong thực phẩm nguồn gốc thực
vật (gạo, mì, ngô, các loại đậu khác...) không cao (trừ đậu nành) nhƣng cơ thể
vẫn phải bổ sung cân đối đấy đủ các loại này.Và hiện nay trên thế giới phong
trào ăn chay đang phát triển mạnh mẽ và vì thế nhu cầu protein thực vật cũng
ngày càng đƣợc chú trọng. [1] 2
1.3: Protein trong thực vật (hạt)
1.1.3. Vai trò của protein
- Protein rất đa dạng về mặt cấu trúc,tính đặc hiệu loài rất cao, tham gia vào tất cả
các biểu hiện của sự sống:
+ Sự vận động và đáp nhận kích thƣớc
+ Sự sinh trƣởng, phát dục và sinh sản
+ Sự di truyền và biến dị
+ Sự trao đổi chất không ngừng với môi trƣờng xung quanh
- Các protein cấu trúc: tham gia cấu tạo mọi tế bào, mô bào
- Các protein phi cấu trúc (có hoạt tính sinh học): enzym (xúc tác sinh học nhƣ
amylase trong nƣớc bọt giúp phân giải tinh bột); kháng thể (chức năng bảo vệ nhƣ
interferon chống virus); hormone (điều hòa sinh học nhƣ insulin điều hòa hàm lƣợng đƣờng glucose trong máu)
- Khi protein bị oxy hóa sẽ cung cấp khoảng 10-15% nhu cầu năng lƣợng.
1.2. Các dạng tồn tại cả protein.
1.2.1. Peptit-Protein
- Peptit: bao gồm các amino acid (axit amin) liên kết với nhau bằng liên kết peptit. [1] - Phân loại:
+ Dipeptit: gồm hai gốc amino acid 3
+ Oligopeptit: cấu trúc bởi một vài đến 10 amino acid.
+ Polypeptit : chuỗi gồm hơn 20 gốc amino acid
- Protein: Phân tử bao gồm (các) chuỗi dài polypeptit có cấu trúc không gian
(bậc cao). Khối lƣợng phân tử lớn hơn 10,000 Da (lớn hơn 100 gốc axit amin). Các
gốc axit amin liên kết với nhau bằng liên kết peptit.
1.2.2. Aminoacid
1.2.2.1. Định nghĩa
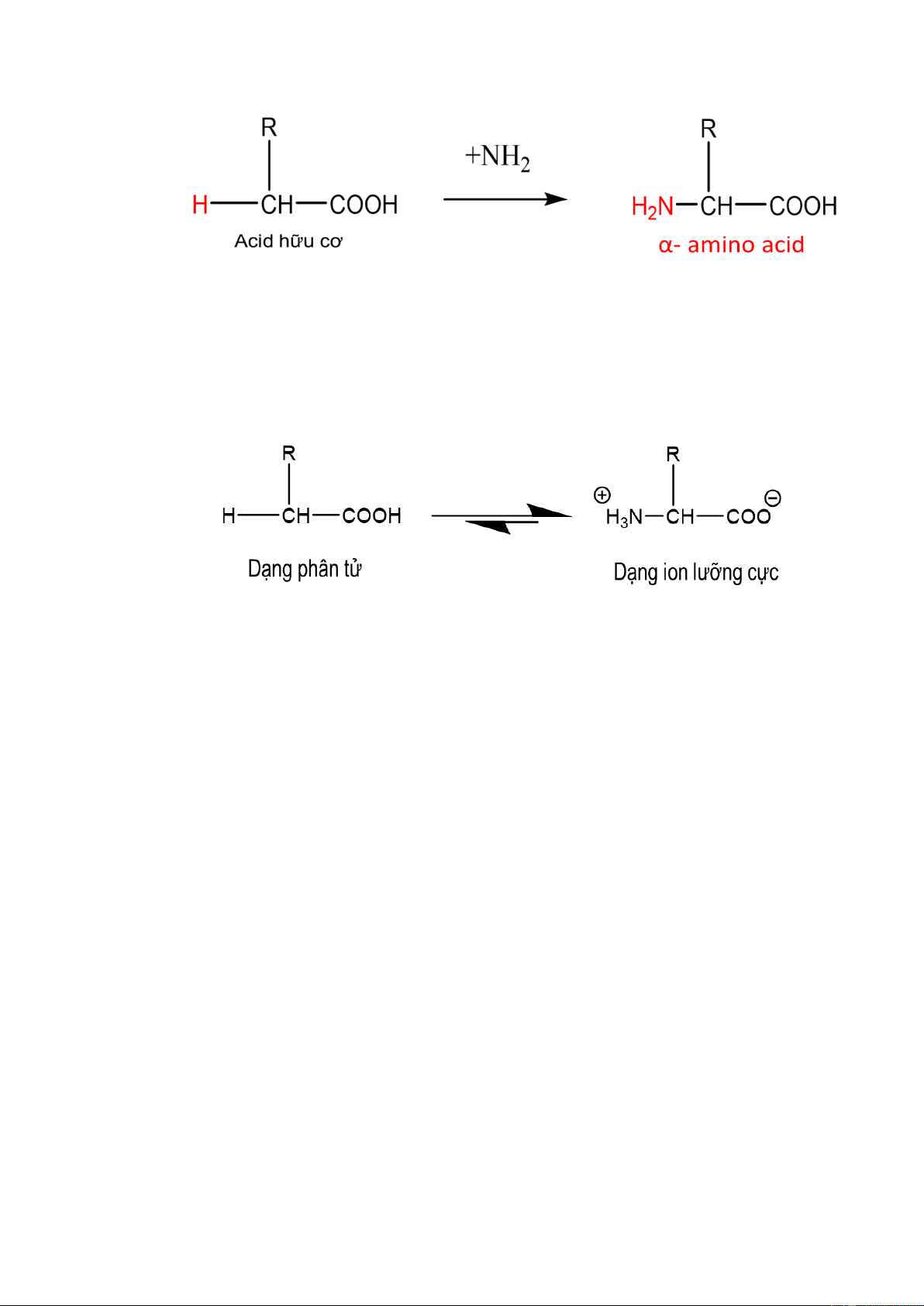
- Khái niệm chung: Amino axit là loại hợp chất hữu cơ tạp chức mà phân tử chứa
đồng thời nhóm amino (NH2) và nhóm cacboxyl (COOH) –. Công thức chung: (H2N)x – R – (COOH)y.
- Trong cơ thể động, thực vật: là acid hữu cơ trong đó một H ở Cα của gốc alkyl
đƣợc thế bởi nhóm amine ( -NH2 ). Nếu có nhóm amine thứ hai thì thƣờng chúng nằm
ở carbon xa nhất so với nhóm –COOH. Aminoacid là đơn vị cấu tạo của protein. [2] 4
1.2.2.2. Cấu tạo phân tử
- Trong phân tử amino acid có nhóm NH2 và nhóm COOH tƣơng tác với nhau
tạo ion lƣỡng cực. Vì vậy, amino acid kết tinh tồn tại ở dang ion lƣỡng cực.
- Trong dung dịch, dạng ion lƣỡng cực chuyển một phần nhỏ thành dạng phân tử. 1.2.2.3..Danh pháp Cách đọc tên:
a) Tên thay thế: axit + vị trí + amino + tên axit cacboxylic tƣơng ứng. Ví dụ: HOOC–[CH –
2]2 CH(NH2)–COOH: axit 2-aminopentanđioic
b) Tên bán hệ thống: axit + vị trí chữ cái Hi Lạp (α, β, γ, δ, ε, ω) + amino + tên
thông thƣờng của axit cacboxylic tƣơng ứng. Ví dụ: CH –
3 CH(NH2)–COOH: axit α-aminopropionic H –COOH : axit ε 2N–[CH2]5 -aminocaproic H –COOH: axit ω 2N–[CH2]6 -aminoenantoic
c) Tê t ô g t ường: các amino axit thiên nhiên (α-amino axit) đều có tên thƣờng. Ví dụ: H – 2N–CH2 COOH: glyxin (Gly) 1.2.2.4. Phân loại
a.Theo cấu trúc hóa học
Gồm 5 loại: 5
Nhóm 1: amino acid (monoamino mono carboxyl acid) STT Tên Ký hiệu Công thức hóa học 01 Glycine Gly (G) (amino acetic) 02 Alanine Ala (A) (α-amino propioic acid) 03 Valine Val (V) (α-amino isovaleric acid) 04 Leucine Leu (L) (α-amino isocapronic acid) 05 Isoleucin Ili (I) (α-amino β-mythyl Valeric acid)
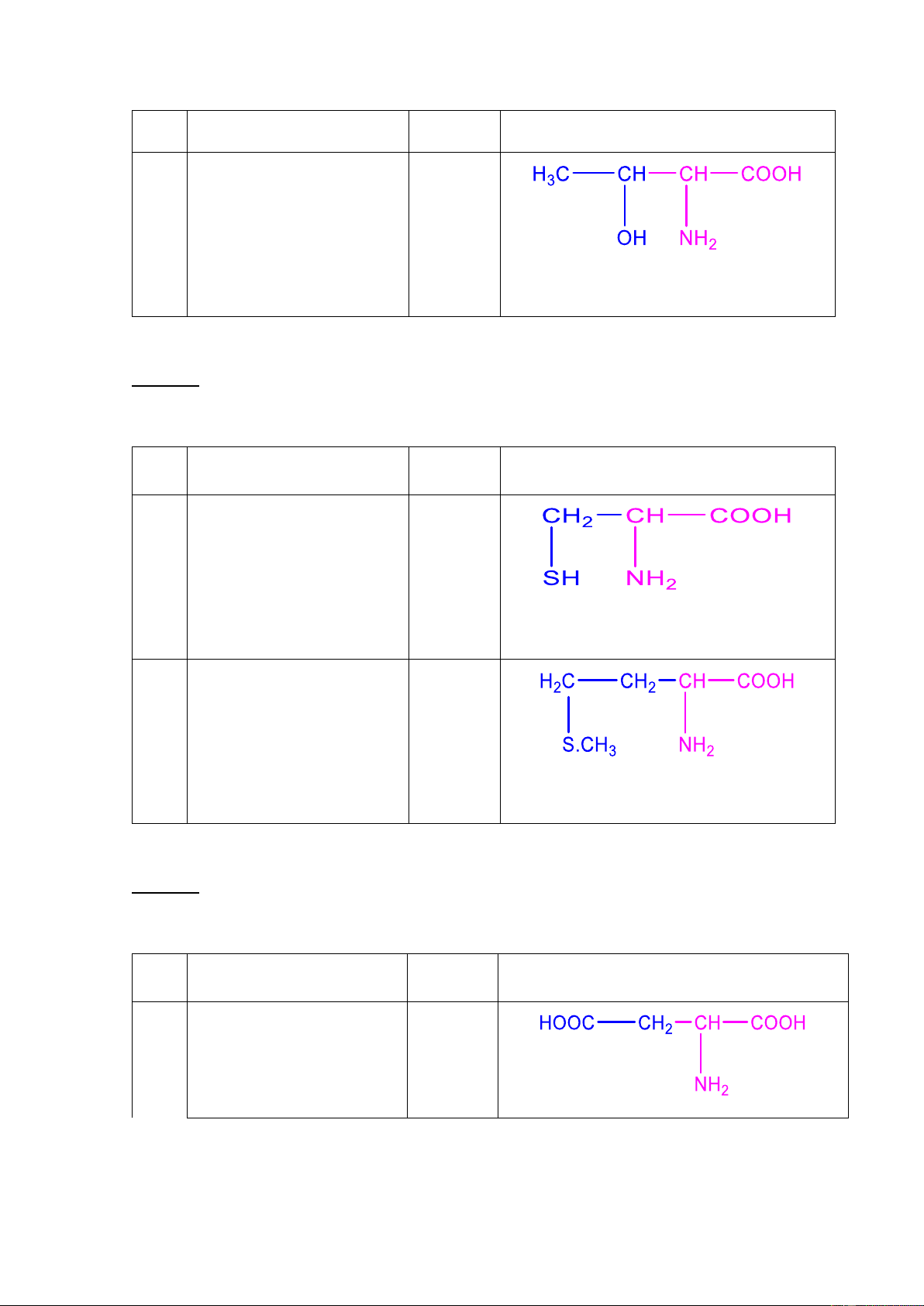
Nhóm 2: amino acid chứa nhóm OH STT Tên Ký hiệu Công thức cấu tạo 06 Serine Ser (S) (α-amino β-hydroxyl propionic acid 6 07 Threonine Thr (T) (α-amino β-hydroxyl butyric acid)
Nhóm 3: amino acid chứa lƣu huỳnh STT Tên Ký hiệu Công thức cấu tạo 08 Cysteine Cys (C) (α-amino β-mercapto propionic acid) 09 Methionine Met (M) (α-amino ϒ-thiomethyl butyric acid)
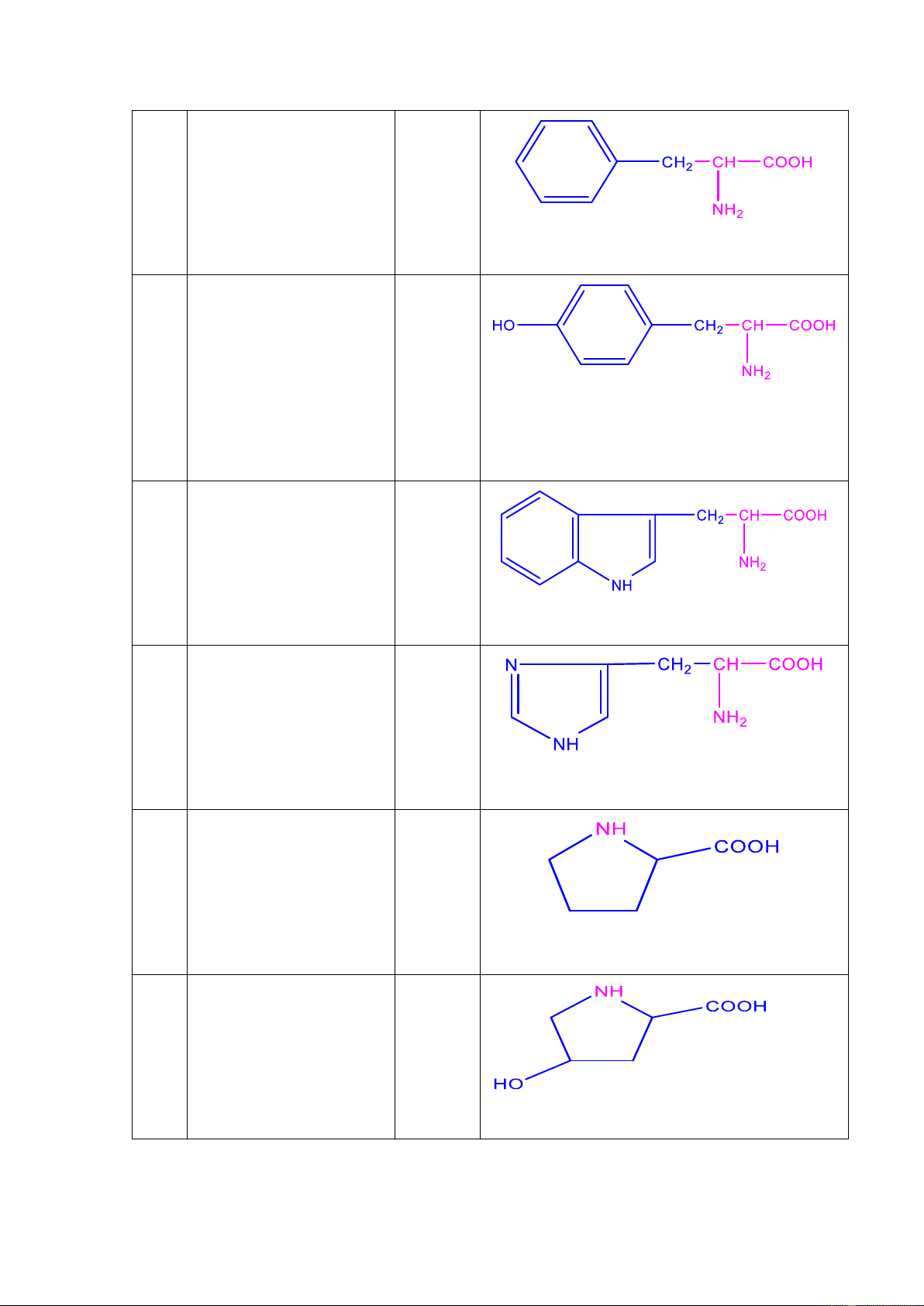
Nhóm 4: amino acid ( monoamino dicarboxylic) STT Tên Ký hiệu Công thức cấu tạo 10 A.Aspartic Asp (D) (α-amino succinic acid) 7 Asparagine Asn (N) (amid of α-amino succinic acid) 11 A.Glutamic Glu (E) (α-amino glutaric acid) Glutamine Gln (Q) (amid of α-amino glutaric acid) 12 Arginine Arg (R) (α-amino δ-guanidine valerianic acid) 13 Lysine Lys (K) (α,ɛ- diamino caproic acid) 14 Hydroxy – Lysine
Nhóm 5: amino acid mạch vòng STT Tên Ký hiệu Công thức cấu tạo 8 15 PhenylAlanine Phe (F) (α-amino β-phenyl propionic acid) 16 Tyrosine Tyr (Y) (α-amino β-hydroxyphenyl propionic acid) 17 Tryptophan Trp (W) (α-amino β-indolyl propionic acid) 18 Histidine His (H) (α-amino β-imizazolyl propionic acid) 19 Proline Pro (P) (pyrrolidine α- carboxylic acid) 20 Hydroxyproline (ϒ-hydroxy pirrolidine α-carboxylic acid) 9
b.Theo vai trò sinh học
Các amino acid thiết yếu ( không thay thế): Một axit amin thiết yếu (essential
amino acid), hay axit amin không thể thiếu (indispensable amino acid), là axit amin mà
sinh vật không thể tự tổng hợp đƣợc từ đầu với tốc độ tƣơng xứng với nhu cầu của nó,
và do đó tất cả các loại đó mà phải đƣa từ ngoài vào qua thức ăn. Gồm 9 loại:
Isoleucine: Có nhiều trong thịt gà, cá, hạnh nhân, hạt điều, trứng, gan, đậu lăng
và thịt bò. Rất quan trọng trong quá trình phục hồi sức khỏe sau thời gian luyện tập thể
dục thể thao, đồng thời giúp điều tiết lƣợng đƣờng glucose trong máu, hỗ trợ quá trình
hình thành hemoglobin và đông máu. Với ngƣời trƣởng thành cần cung cấp mỗi ngày
khoảng khoảng 20mg/1kg trọng lƣợng cơ thể.
Leucine: Có nhiều trong đậu tƣơng, đậu lăng, lòng đỏ trứng, hạnh nhân, cá, lạc,
tôm. Tƣơng đối quan trọng trong quá trình điều chỉnh hàm lƣợng đƣờng trong
máu (nên tốt cho ngƣời mắc chứng gia tăng đƣờng huyết hoặc ngƣời muốn đốt cháy
chất béo nhanh chóng). Với ngƣời trƣởng thành cần cung cấp mỗi ngày khoảng
khoảng 39mg/1kg trọng lƣợng cơ thể. Loại amino acid này còn có chức năng duy trì
lƣợng hormone tăng trƣởng để thúc đẩy quá trình phát triển mô cơ.
Lysine: Có nhiều trong phô mai, khoai tây, sữa, trứng, thịt đỏ, các sản phẩm men.
Nhiệm vụ quan trọng nhất là hấp thụ canxi giúp cho xƣơng chắc khỏe, chống lão hóa
cột sống, duy trì trạng thái cân bằng nitơ trong cơ thể, nhờ đó giúp tránh hiện tƣợng
giãn cơ và mệt mỏi. Với ngƣời trƣởng thành cần cung cấp mỗi ngày khoảng
khoảng 30mg/1kg trọng lƣợng cơ thể. Nó còn có tác dụng tạo ra kháng thể và điều tiết
hormone truyền tải thông tin.
Methionine: Có nhiều trong thịt, cá, đậu đỗ tƣơi, trứng, đậu lăng, hành, sữa
chua, các loại hạt. Đặc biệt cần thiết cho nam giới nếu muốn phát triển cơ bắp vì nó
nhanh chóng phân hủy và đốt cháy chất béo, đồng thời tăng lƣợng testosterone sinh
dục nam. Với ngƣời trƣởng thành cần cung cấp mỗi ngày khoảng
khoảng 15mg/1kg trọng lƣợng cơ thể. Methionine còn hỗ trợ chống chữa kiệt sức,
viêm khớp và bệnh gan... 10
Phenylalanine: Có nhiều trong sữa, hạnh nhân, bơ, lạc, các hạt vừng. Có chức
năng bồi bổ não, tăng cƣờng trí nhớ và tác động trực tiếp đến mọi hoạt động của não
bộ. Phenylalanine có thể làm tăng lƣợng chất dẫn truyền xung động thần kinh, tăng tỷ
lệ hấp thụ tia UV từ ánh sáng mặt trời giúp tạo ra vitamin D nuôi dƣỡng làn da. Với
ngƣời trƣởng thành cần cung cấp mỗi ngày khoảng khoảng 25mg/1kg trọng lƣợng cơ
thể. Tuy nhiên amino acid này nếu dùng nhiều có thể dẫn đến độc hại, cần hạn chế.
Threonine: Có nhiều trong thịt, cá, trứng. Những ngƣời ăn chay có thể bổ sung
từ sữa đã tách kem, gạo tấm, đậu tƣơi, lạc, hạt điều (nhƣng hàm lƣợng trong các nguồn
này rất thấp, nên buộc phải dùng sinh tố bổ sung). Chức năng chính là hỗ trợ hình
thành collagen và elastin là 2 chất liên kết tế bào trong cơ thể. Với ngƣời trƣởng thành
cần cung cấp mỗi ngày khoảng khoảng 15mg/1kg trọng lƣợng cơ thể. Ngoài ra, nó rất
tốt cho hoạt động của gan, tăng cƣờng hệ miễn dịch và thúc đẩy cơ thể hấp thụ mạnh các dƣỡng chất.
Tryptophan: Có nhiều trong chuối, đậu phộng, hạt sen, gạo, thịt gà tây, bí đỏ (bí
đỏ chứa một lƣợng tryptophan rất dồi dào). Có 2 chức năng quan trọng, 1 là đƣợc gan
chuyển hóa thành niacin (vitamin B3), 2 là cung cấp tiền chất của serotonin - 1 chất
dẫn truyền thần kinh giúp cơ thể điều hòa sự ngon miệng, giấc ngủ ngon và tâm trạng
thoải mái. Với ngƣời trƣởng thành cần cung cấp mỗi ngày khoảng
khoảng 4mg/1kg trọng lƣợng cơ thể.
Valine: Có nhiều trong sữa, thịt, ngũ cốc, nấm, đậu tƣơng và lạc. Giúp chữa lành
tế bào cơ và hình thành tế bào mới, đồng thời giúp cân bằng nitơ cần thiết. Nó còn
giúp phân hủy đƣờng glucozơ có trong cơ thể. Với ngƣời trƣởng thành cần cung cấp
mỗi ngày khoảng khoảng 26mg/1kg trọng lƣợng cơ thể.
Histidine: Có nhiều trong thịt, sữa, cá, gạo, bột mì. Giúp cơ thể phát triển và liên
kết mô cơ bắp với nhau. Nó còn giúp hình thành màng chắn myelin, 1 chất bảo vệ bao
quanh dây thần kinh và giúp tạo ra dịch vị kích thích tiêu hóa. Với ngƣời trƣởng thành
cần cung cấp mỗi ngày khoảng khoảng 10mg/1kg trọng lƣợng cơ thể.
- 9 loại amino acid thiết yếu này liên kết chặt chẽ với nhau, kích thích cơ thể phát
triển mạnh mẽ. Nếu thiếu 1 trong số chúng cơ thể dễ dẫn đến 1 số bệnh tật nguy hiểm. 11
- Nhƣ vậy, các axit amin thiết yếu là cốt lõi quan trọng tham gia vào nhiều quá
trình sinh hóa của cơ thể. Sự thiết hụt axit amin thiết yếu có thể tác động tiêu cực đến
toàn bộ cơ thể, bao gồm hệ thần kinh, hệ sinh sản, hệ miễn dịch và hệ tiêu hóa
- Protein có giá trị dinh dƣỡng hoàn toàn có nguồn gốc từ động vật nhƣ thịt,
trứng, sữa- chứa đầy đủ các amino acid thiết yếu.
Các amino acid không thiết yếu (thay thế được): Các axit amin không thiết yếu
đƣợc cơ thể tự tổng hợp nếu nhƣ chúng ta ăn đầy đủ protein có chứa 9 axit amin thiết
yếu. Các axit amin này đóng vai trò quan trọng trong quá trình phát triển và xây dựng
cơ bắp. Nếu bạn ăn quá ít, cơ thể tổng hợp không đủ cho khối lƣợng cơ bắp trong cơ
thể của bạn thì rất khó để bạn xây dựng và phát triển cơ bắp.
Alanine: Alanine là axit amin chính có ích cho mô liên kết và giúp cải thiện và
tăng cƣờng hệ miễn dịch, cho phép cơ bắp và các mô khác lấy năng lƣợng từ các amino axit.
Arginine: Arginine giúp ích cho cơ thể tạo hormone tăng trƣởng, cải thiện hệ
miễn dịch, đồng thời hỗ trợ quá trình tạo ra collagen, cũng là tiền thân của oxit nitric.
Aspartate: Aspartate giúp chuyển hóa carb (tinh bột) thành năng lƣợng cho cơ
bắp. Ngoài ra nó còn giúp tăng cƣờng hệ miễn dịch và hạn chế lƣợng ammonia trong
cơ thể sau mỗi buổi tập cƣờng độ cao.
Cystine: Cystine cải thiện chứng viêm đau, giúp tạo bạch cầu và giúp cải thiện
quá trình tự phục hồi, tái tạo của cơ thể, cải thiện sức mạnh của các mô liên kết.
Glutamic: Glutamic cũng là một nguồn năng lƣợng, chất này quan trọng cho não
và sự trao đổi chất của axit amin
Glycine: Glycine giúp tổng hợp các amino acid khác. Chất này có thể giúp làm
mất cảm giác thèm đồ ngọt.
Ornithine: Ornithine giúp tạo hormone tăng trƣởng, hỗ trợ quá trình tái tạo, tăng
cƣờng sức miễn dịch và hỗ trợ gan.
Proline: Proline có ích cho tim và các mô liên kết, tạo nhiều năng lƣợng cho cơ bắp hơn. 12
Serine: Serine giúp tái tạo năng lƣợng cho tết bào, giúp ích cho hệ thần kinh và
cải thiện trí nhớ, giúp tăng khả năng miễn dịch.
Tyrosine: Tyrosine giúp tăng cảm giác hƣng phấn, giúp tạo hormone tăng
trƣởng, và là tiền thân của dopamine và epinephrine.
- Hầu hết các axit amin đều hƣớng vào cơ bắp. Vai trò chính của axit amin là duy
trì và phát triển khối lƣợng cơ nạc. Điều này đƣợc thực hiện theo hai cách - nó cung
cấp các khối xây dựng để phát triển cơ bắp mới trong tình trạng dƣ thừa calo và giúp
ngăn ngừa mất cơ bắp khi thiếu hụt calo.
- Protein có giá trị dinh dƣỡng không hoàn toàn-chứa không đầy đủ các amino
acid thiết yếu- thƣờng là các protein có nguồn gốc thực vật. 1.2.2.5.Tính chất a.Tính hoạt quang
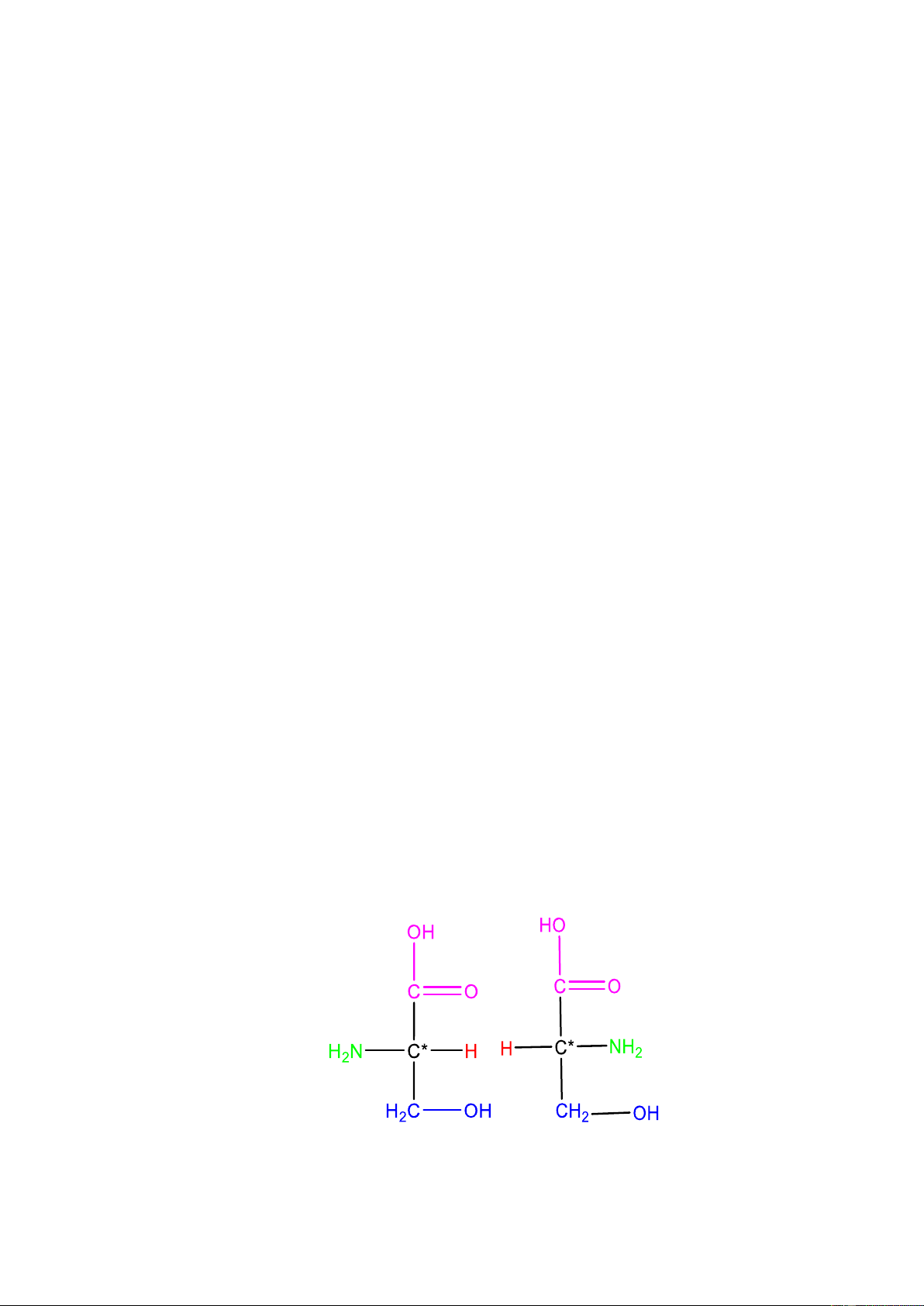
- Do amino acid có ít nhất một C* (R ≠ H nên Cα trở thành C*) ( ngoại trừ
glycine R = H) , chúng có tính hoạt quang ( quay mặt phẳng tia phân cực của ánh
sáng) và tồn tại dƣới hai dạng đồng phân quang học D và L (trong tự nhiên gặp chủ yếu ớ dạng L).
- Hầu hết các amino acid đều có 2 dạng đồng phân lập thể là D và L. + Nếu có nhóm NH +
3 hoặc NH2 nằm ở phía bên phải thì là đồng phân D. + Nếu có nhóm NH +
3 hoặc NH2 nằm ở phía bên trái thì là đồng phân L Ví dụ: L – Serine D – Serine 13
+Dạng D chỉ gồm một số amino acid trong các protein có trong các sinh vật sống
dƣới nƣớc, ví dụ ốc hình nón.
+Dạng L gồm những amino acid có vai trò quan trọng có trong các protein.
- Chúng cũng có nhiều các thành phần vách tế bào proteoglycan của bacteria.
Đồng phân dạng D của aspartic acid có trong một số protein là kết quả của quá trình
biến đổi sau dịch mã tự phát kết hợp với sự hóa già protein hoặc giống nhƣ là sản
phẩm phụ của quá trình biến đổi enzyme đƣợc xúc tác bởi protein L-isoaspartyl methyltransferase. [3]
b.Tính lưỡng tính và điểm đẳng điện
Điện tích tổng số phụ thuộc pH môi trƣờng và số nhóm –NH2, nhóm –COOH
trong phản ứng. Vừa tác dụng với acid (do nhóm –NH2), vừa tác dụng với base (do nhóm –COOH).
Ở trị số pH và tại đó amino acid trung hòa điện tích (bằng 0) thì gọi đó là điểm đẳng điện (pI).
15 amino acid có nhóm thiol, hydroxyl hoặc gốc hydrocarbon có giá trị pI từ 5.0 đến 6.5.
D và E có nhóm acid nên có giá trị pI thấp.
H, R, K có nhóm base nên có giá trị pI cao.
Tính phân ly lƣỡng tính: pI = ½ (pk1 + pk2)
c.Khả năng hydrat hóa và tính tan
- Tính tan: + Phụ thuộc vào gốc R (Gốc R chứa các nhóm chức có khả năng tạo
liên kết hydro với nƣớc, thƣờng khả năng hydrat hóa cao sẽ có tính hòa tan)
+ Phụ thuộc pH môi trƣờng, tại pI độ tan nhỏ
+ Tùy thuộc loại dung môi (dung môi phân cực : nƣớc , ethanol 75- 80%...)
Áp dụng để loại bỏ các dung môi khác không mong muốn.
Ứng dụng: + Sữa chua: pH giảm do VSV lên men đƣờng: protein sữa đông tụ. 14
+ Đậu phụ: pH giảm khi thêm nƣớc chua : protein đậu nành đông tụ.
d.Tính chất hóa học
Phản ứng của nhóm α-amin:
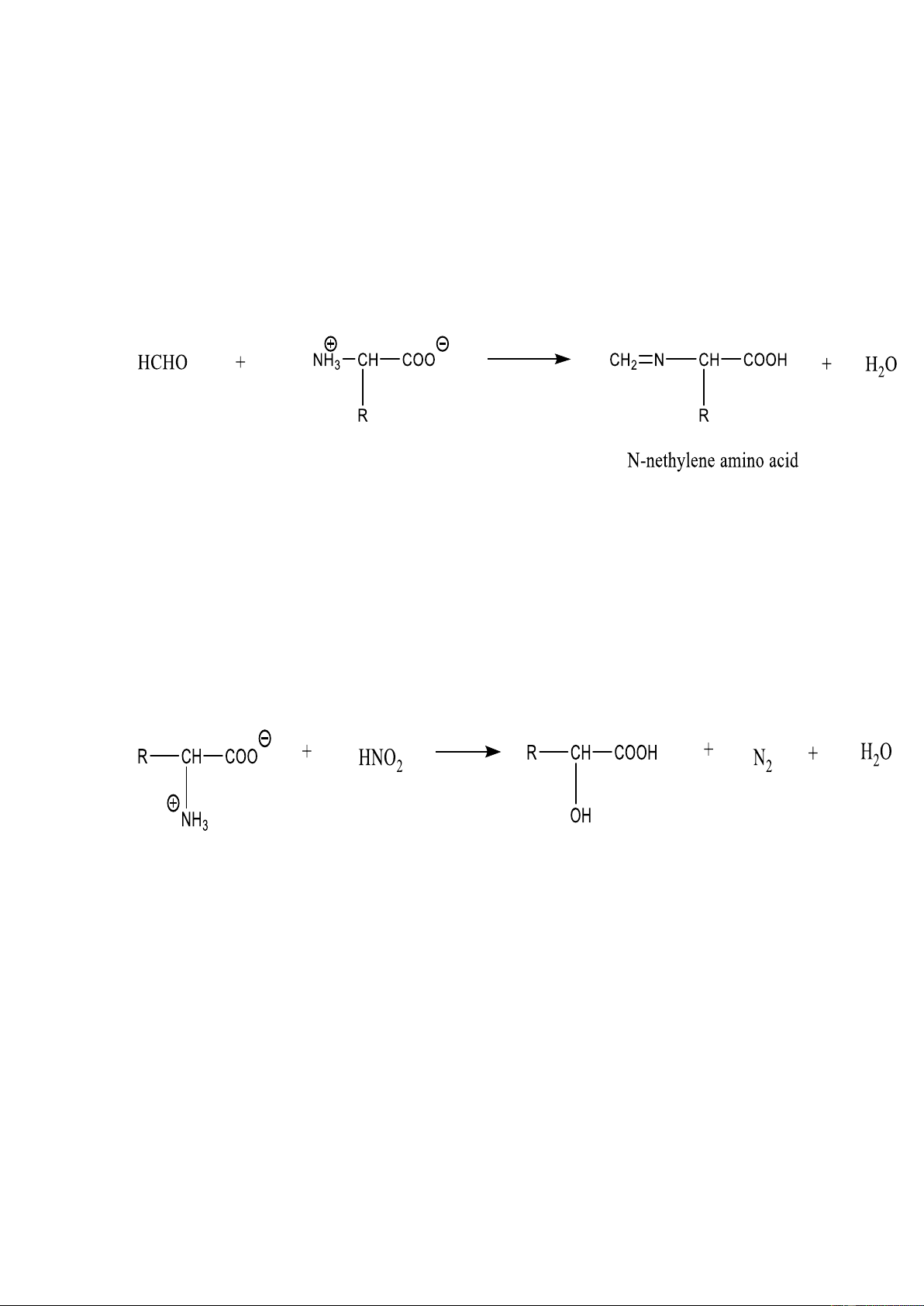
Phản ứng Sorensen (đánh giá mức độ thủy phân của protein). Với formaldehyde:
Khóa nhóm -NH2 của amino acid
Định lƣợng –COOH bằng phƣơng pháp chuẩn độ
Suy ra hàm lƣợng của amino acid. Phát hiện α-amino acid (phƣơng pháp sắc kí giấy)
Phản ứng với axit nitơ, HNO2
Định lƣợng amino acid theo lƣợng khí N2 tạo thành
Phản ứng do nhóm α- carboxyl và α- amin Phản ứng Ninhydrin – Nhiệt độ cao ~100ºC
– NH3, các peptide phản ứng chậm hơn so với amino acid
– Prolin, hydroprolin tạo phức màu vàng với Ninhydrin. 15



