








Preview text:
lOMoARcPSD|50202050
ĐẠI HỌC QUỐC GIA HÀ NỘI
ĐỀ THI KẾT THÚC HỌC KỲ I
TRƯỜNG ĐẠI HỌC KHOA HỌC TỰ NHIÊN NĂM HỌC 2010-2011
Môn thi: Hóa Đại cương Số tín chỉ: 03 Đề số: 01
Dành cho sinh viên khóa: K56 Ngành:
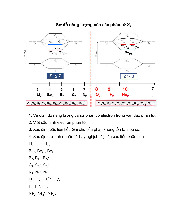
Thời gian làm bài: 90 phút (không kể thời gian phát ề) Câu 1: Theo thuyết MO, hãy:
a, Vẽ giản ồ năng lượng của phân tử F2.
b, Viết cấu hình electron của các phân tử và ion phân tử: F2; F2−; F2+. So sánh ộ bền của các phân tử
và ion phân tử trên. Biết F(Z=9).
Câu 2: Phản ứng tổng hợp amoniac có giá trị Kp ở 900K là 3,7 x 10-6. Coi ∆H0 của phản ứng không phụ
thuộc vào nhiệt ộ và có giá trị là -92kJ. Tính hằng số cân bằng Kp ở 550K và cho biết chiều hướng chuyển
dịch cân bằng khi nhiệt ộ giảm từ 900K xuống 550K. Câu 3:
a, Cho các phản ứng:
C2H2(k) + 5/2O2(k) → 2CO2(k) + H2O(l) ∆H0 = −1300,0 kJ
C(r) + O2(k) → CO2(k) ∆H0 = −394,0 kJ H2(k) +
1/2O2(k) → H2O(l) ∆H0 = −286,0 kJ Hãy tính ∆H0 của phản ứng sau:
2C(r) + H2(k) → C2H2(k) b, Tính ∆G0của phản ứng dưới ây ở 250C và áp suất 1 atm: 2SO2(k) + O2(k) → 2SO3(k)
Cho các dữ kiện nhiệt ộng sau: SO2(k) SO3(k) O2(k) ∆Hsn0 -297,0 -396,0 (kJ/mol) S0(J/mol.K) 248,0 257,0 205,0 Câu 4:
Cho dung dịch amoniac 10-3M, Kb của amoniac là 1,8.10-5.
a, Tính pH của dung dịch.
b, Nếu hòa tan 0,535 g NH4Cl vào trong 100 mL dung dịch trên (coi thể tích dung dịch không thay
ổi) thì pH của dung dịch sẽ là bao nhiêu?. Biết Cl(M=35,5), N(M=14), H(M=1). Câu 5:
Một pin gồm một iện cực dương là iện cực hydro tiêu chuẩn, iện cực âm là iện cực Ni nhúng vào
dung dịch NiSO4 0,01M có sức iện ộng là 0,309 V. Tính thế iện cực tiêu chuẩn của iện cực Ni.
Đề thi gồm 01 trang. Cán bộ coi thi không giải thích gì thêm. lOMoARcPSD|50202050
ĐẠI HỌC QUỐC GIA HÀ NỘI
ĐỀ THI KẾT THÚC HỌC KỲ I
TRƯỜNG ĐẠI HỌC KHOA HỌC TỰ NHIÊN NĂM HỌC 2012-2013
Môn thi: Hóa Đại cương Số tín chỉ: 03 Đề số: 1
Dành cho sinh viên khóa: K57 Ngành:
Thời gian làm bài: 90 phút (không kể thời gian phát ề) Câu 1:
a, Bằng phương pháp MO-LCAO, vẽ giản ồ năng lượng và viết cấu hình electron của các phân tử và ion phân tử F2, F2+.
b, Xác ịnh từ tính của phân tử và ion phân tử trên. So sánh ộ bền của F2+ và F2. Biết F(Z=9). Câu 2:
Cho pin gồm hai iện cực: Cd kim loại nhúng trong dung dịch Cd2+ và Cu kim loại nhúng trong dung
dịch Cu2+. Sức iện ộng của pin o ược là 0,745V. Hãy xác ịnh nồng ộ của dung dịch Cu2+. Biết thế tiêu chuẩn
E0 của cặp Cu2+/Cu là 0,34V, của cặp Cd2+/Cd là -0,4V và nồng ộ dung dịch Cd2+ là 0,05M. Câu 3:
Dung dịch bão hòa của AgCl có pH = 7. Trộn 950 ml dung dịch bão hòa AgCl vào 50 ml dung dịch
HCl 1M. Tính pH của dung dịch và nồng ộ của Ag+ sau khi trộn. Biết TAgCl=1,6.10-10. Câu 4:
Sự phân hủy của C2H5I xảy ra theo phản ứng: C2H5I → C2H4 + I
Ở 600K , giá trị hằng số tốc ộ phản ứng k = 1,60 x 10-5 s-1. Khi tăng nhiệt ộ phản ứng lên 700K thì
hằng số tốc ộ phản ứng tăng tới 6,36 x 10-3 s-1. Tính năng lượng hoạt hóa của phản ứng này? Cho R = 8,314 J/mol.K. Câu 5: Cho phản ứng:
4HCl(k) + O2(k) → 2Cl2(k) + 2H2O(l)
Tính entanpi tiêu chuẩn ∆H0 và biến thiên nội năng tiêu chuẩn ∆U0của phản ứng trên. Biết sinh nhiệt tiêu
chuẩn của một số chất như sau: ∆H298(0
HClk) = −92,30 kJ/mol; ∆H298(0 H2Ol) = -285,84 kJ/mol. lOMoARcPSD|50202050
Đề thi gồm 01 trang. Cán bộ coi thi không giải thích gì thêm.
ĐẠI HỌC QUỐC GIA HÀ NỘI
ĐỀ THI KẾT THÚC HỌC KỲ I
TRƯỜNG ĐẠI HỌC KHOA HỌC TỰ NHIÊN NĂM HỌC 2013-2014
Môn thi: Hóa ại cương
Lớp môn học: CHE1080 Số tín chỉ: 03 Đề số: 1
Dành cho sinh viên lớp môn học: CHE1080 (Môn Hóa Đại cương cho toàn trường ĐHKHTN)
Thời gian làm bài: 90 phút (Không kể thời gian phát ề)
Câu 1(1 iểm). Tính năng lượng cần thiết ể kích thích electron trong nguyên tử hydro từ mức n = 1 lên mức
n = 2. Tính bước sóng của bức xạ iện từ theo ơn vị (nm). (1 eV = 1,6.10-19 J, 1 m = 109 nm). Câu 2(1,5 iểm).
Hãy xây dựng giản ồ MO của ion phân tử 𝐎+𝟐 . Chỉ ra cấu hình electron, bậc liên kết, từ tính của ion phân
tử trên. Dựa vào giản ồ MO của ion phân tử O2+, hãy so sánh ộ bền của các ion O−2 , O2, O+2 .
Câu 3(2 iểm). Sắt ược sản xuất bằng cách khử sắt (III) oxit bằng CO:
𝐅𝐞𝟐𝐎𝟑 (𝐫) + 𝟑𝐂𝐎(𝐤) → 𝟐𝐅𝐞(𝐫) + 𝟑𝐂𝐎𝟐 (𝐤) ∆H0 (kJ/mol) -826 -110 0 -394 S0(J/mol.K) 90 198 27 214
Hãy tính biến thiên năng lượng tự do chuẩn (∆G0) ở 250C cho phản ứng trên và nhận xét chiều hướng phản
ứng xảy ra ở iều kiện ó?
Câu 4(2 iểm). Cho phản ứng:
𝐍𝟐𝐎𝟒 (𝐤) ↔ 𝟐𝐍𝐎𝟐 (𝐤)
a. Cho 18,4 gam khí N2O4 vào bình chân không dung tích 5,904 lít ở 270C. Lúc cân bằng áp suất trong bình
là 1,0 atm. Tính áp suất riêng phần của mỗi khí khi hệ ạt trạng thái cân bằng.
b. Nếu áp suất hệ khi cân bằng là 0,5 atm thì áp suất riêng phần của N2O4 và NO2 là bao nhiêu?
Câu 5(2,5 iểm). a, Tính pH của dung dịch muối NaF 0,3 M. Cho biết Ka của HF là 7,2.10-4. b, Để iều chế
dung dịch chứa HF và NaF, người ta thêm 0,32 mol axit HF vào 1lít dung dịch NaF 0,3 M.
Tính pH của dung dịch ệm thu ược (KHF = 7,2 x 10-4).
c, Tính ộ tan của muối ít tan CaF2 trong môi trường nước ở 250C biết TCaF2 = 4,0. 10−11. lOMoARcPSD|50202050
Câu 6(1 iểm). Pin gavani ược thiết lập gồm iện cực Ag nhúng trong dung dịch Ag+ 0,1 M và iện cực Pt
nhúng trong dung dịch hỗn hợp FeCl3 0,005 M và FeCl2 0,15 M. Thế iện cực của các cặp oxi hóa khử liên
hợp: EAg0 +/Ag = 0,80 V; EFe0 3+/Fe2+ = 0,77 V.
Viết phương trình oxi hóa khử khi pin làm việc và xác ịnh sức iện ộng (hay thế iện cực chuẩn) ∆E của pin ở 250C.
----------------------------------------------HẾT---------------------------------------------- Đề
thi gồm 01 trang. Cán bộ coi thi không giải thích gì thêm. lOMoARcPSD|50202050
ĐẠI HỌC QUỐC GIA HÀ NỘI
ĐỀ THI KẾT THÚC HỌC KỲ I
TRƯỜNG ĐẠI HỌC KHOA HỌC TỰ NHIÊN NĂM HỌC 2015-2016
Môn thi: Hóa Đại cương
Lớp môn học: CHE1080 1→ 𝟏𝟓
Số tín chỉ: 03
Dành cho sinh viên lớp môn học: CHE1080 (Môn Hóa Đại cương cho toàn trường ĐHKHTN)
Thời gian làm bài: 90 phút (Không kể thời gian phát ề) Câu 1(1,0 iểm). Tính bước
sóng (theo nm) của ánh sáng phát xạ khi electron chuyển từ n = 3 về n = 2 trong nguyên tử hidro.
Câu 2(1,5 iểm). Hãy xây dựng giản ồ MO và viết cấu hình electron của ion phân tử 𝐅𝟐−. Hãy tính bậc liên
kết của các ion phân tử F2, F2−, F2+ và cho cho biết chúng là thuận từ hay nghịch từ.
Câu 3(2,0 iểm). Nhiên liệu ẩy tàu vũ trụ trong không gian sử dụng phản ứng dưới ây:
3Al (r) + NH4ClO4 (r) → Al2O3 (r) + AlCl3 (r) + 3NO (k) + 6H2O (k) Biết ∆HSN0 (kJ/mol) -295 -1676 -704 90 -242 S0 (J/mol.K) 28 186 51 111 211 189
Hãy xác ịnh G0 (kJ/mol) của phản ứng ở 250C và cho biết chiều hướng phản ứng ở nhiệt ộ này?
Câu 4(1,0 iểm). Cho phản ứng phân hủy N2O5:
𝟐𝐍𝟐𝐎𝟓 (𝐤) → 𝟒𝐍𝐎𝟐 (𝐤) + 𝐎𝟐 (𝐤)
Ở 250C hằng số tốc ộ phản ứng là k1 = 1,72.10-5 s-1. Ở 350C hằng số tốc ộ phản ứng là k2 = 6,65.10-5 s-1.
Tính năng lượng hoạt hóa (Ea) của phản ứng phân hủy N2O5 ở trên.
Câu 5(1,0 iểm). Một mẫu khí PCl5 ược cho vào bình chân không, áp suất ban ầu của PCl5 là 0,5 atm ở
2500C. Ở iều kiện này, PCl5 phân hủy theo phản ứng:
𝐏𝐂𝐥𝟓 (𝐤) → 𝐏𝐂𝐥𝟑 (𝐤) + 𝐂𝐥𝟐 (𝐤)
Áp suất tổng cộng của hệ khi ạt cân bằng là 0,84 atm. Hãy tính Kp và Kc của phản ứng ở nhiệt ộ này.
Câu 6(2,0 iểm). a, Tính pH của dung dịch axit benzoic C6H5COOH 0,2 M có Ka = 6,4.10-5 và pH của dung
dịch KCN 0,1M có KHCN = 7,9.10-10. b, Trộn 100mL dung dịch HCOOH 0,1M với 100mL dung dịch NaOH
0,05M ược 200mL dung dịch A.
Hãy xác ịnh pH của dung dịch A. Biết HCOOH ở cùng iều kiện có hằng số iện ly Ka = 1,7.10-4. c, Tính
ộ tan (s) của Mg(OH)2 biết tích số tan cho tương ứng TMg(OH)2= 8,9.10-12.
Câu 7(1,5 iểm). Pin gavani ược xây dựng từ 2 nửa phương trình và thế iện cực chuẩn (φ0) tương ứng: Ag+ + e → Ag0 φ0(Ag+/Ag) = +0,80 V Cu2+ + 2e → Cu0 φ0(Cu2+/Cu) = +0,34 V
a, Hãy viết phương trình làm việc của pin gavani trên và chỉ ra âu là catot và anot? b, Tính ∆G0 của
phản ứng ở 250C. c, Tính suất iện ộng (∆E0) của pin làm việc ở nồng ộ các chất là [Ag+] = 0,01M và [Cu2+] = 0,01M. lOMoARcPSD|50202050
ĐẠI HỌC QUỐC GIA HÀ NỘI
ĐỀ THI KẾT THÚC HỌC KỲ I
TRƯỜNG ĐẠI HỌC KHOA HỌC TỰ NHIÊN NĂM HỌ
Môn thi: Hóa Đại cương
Lớp môn học: CHE1080 Số tín chỉ:
----------------------------------------------HẾT----------------------------------------------
Cho biết h= 6,625 x 10-34 J.s; c = 3 x 108 m/s; 1 m = 109 nm; R = 8,314 J/mol.K, 0,082 L.at/mol.K
Đề thi gồm 01 trang. Cán bộ coi thi không giải thích gì thêm.
ĐẠI HỌC QUỐC GIA HÀ NỘI
II TRƯỜNG ĐẠI HỌC KHOA HỌC TỰ NHIÊN NĂM HỌC 2015-2016
Môn thi: Hóa Đại cương
Lớp môn học: CHE1080
Số tín chỉ: 03
Dành cho sinh viên lớp môn học: CHE1080 (Môn Hóa Đại cương cho toàn trường ĐHKHTN)
Thời gian làm bài: 90 phút (Không kể thời gian phát ề) Câu 1(1,0 iểm). Tính bước
sóng (theo nm) của ánh sáng phát xạ khi electron chuyển từ n = 3 về n = 2 trong ion Li2+.
Câu 2(2,0 iểm). Viết cấu hình electron (theo thuyết MO) của ion phân tử 𝐎−𝟐 . Tính bậc liên kết của các ion
và phân tử O−2 , O2, O+2 và cho biết chúng là thuận từ hay nghịch từ. Câu 3(2,0 iểm). Sự tạo thành rỉ sắt
bởi oxi tuân theo phương trình phản ứng:
𝟒𝐅𝐞 (𝐫) + 𝟑𝐎𝟐 (𝐤) → 𝟐𝐅𝐞𝟐𝐎𝟑 (𝐫) Biết: ∆Htt0 (kJ/mol) 0 -826 S0 (J/mol.K) 27 205 90
Xác ịnh G0 (kJ/mol) của phản ứng ở 250C và cho biết chiều hướng phản ứng ở nhiệt ộ này?
Câu 4(1,0 iểm). Xét phản ứng phân hủy PH3 thành P và H2. Ở 250C, hằng số tốc ộ phản ứng là k1 = 3,2.10-
3 s-1. Ở 350C, hằng số tốc ộ của phản ứng là k1 = 7,8.10-3 s-1. Tính năng lượng hoạt hóa (Ea) của phản ứng phân hủy PH3 ở trên.
Câu 5(1,0 iểm). Một mẫu S8(k) ược cho vào bình chân không ở 1325 K, áp suất ban ầu của S8(k) là 1 atm.
Ở iều kiện này S8(k) phân hủy theo phản ứng: 𝐒𝟖(𝐤) → 𝟒𝐒𝟐(𝐤). Khi hệ ạt cân bằng, áp suất riêng phần của
S8(k) là 0,3 atm. Tính Kp và Kc của phản ứng ở nhiệt ộ này.
Câu 6(1,5 iểm). a, Tính pH của dung dịch axit axetic CH3COOH 0,2 M có Ka = 4,8.10-5.
b, Cần trộn bao nhiêu mL dung dịch CH3COOH 0,2 M với bao nhiêu mL dung dịch CH3COONa 0,3 M ể
thu ược 1 L dung dịch có pH = 5,2. c, Tính ộ tan (s) của BaSO4 biết tích số tan của BaSO4 là T = 1,2.10-10.
Câu 7(1,5 iểm). Một pin ược xây dựng từ 2 nửa phương trình và thế iện cực chuẩn (E0) tương ứng: Ag+ + e → Ag0 E0(Ag+/Ag) = +0,80 V Zn2+ + 2e → Zn0 E0(Zn2+/Zn) = -0,76 V lOMoARcPSD|50202050
ĐỀ THI KẾT THÚC HỌC KỲ
a, Viết phương trình phản ứng xảy ra trong pin trên và chỉ ra âu là catot và anot? b, Tính ∆G0
(theo J/mol) của phản ứng ở 250C. c, Tính sức iện ộng của pin làm việc ở nồng ộ các chất là
[Ag+] = 0,01M và [Zn2+] = 0,01M.
----------------------------------------------HẾT----------------------------------------------
Cho biết h= 6,625x10-34 J.s; c = 3x108 m/s; 1 m = 109 nm; R = 8,314 J/mol.K, 0,082 L.at/mol.K 1eV
= 1,6.10-19 J; T(K) = T(0C) +273.
Đề thi gồm 01 trang. Cán bộ coi thi không giải thích gì thêm. C 2016-2017 03
Dành cho sinh viên lớp môn học: CHE1080 (Học phần Hóa Đại cương cho toàn trường ĐHKHTN)
Thời gian làm bài: 90 phút (Không kể thời gian phát ề) Câu 1 (1,0 iểm). Tính
bước sóng (theo nm) của ánh sáng phát xạ khi electron chuyển từ n = 3 về n = 2 trong ion nguyên tử He+
(1,0 eV = 1,6 x 10-19 J, 1 m = 109 nm).
Câu 2 (1,5 iểm). Hãy xây dựng giản ồ MO và viết cấu hình electron của ion phân tử N2+. Hãy tính bậc liên
kết của các ion phân tử N2, N2−, N2+ và cho biết chúng là thuận từ hay nghịch từ.
Câu 3 (2,0 iểm). Phản ứng giữa silica và cacbon trong khí clo xảy ra theo phương trình dưới ây:
𝐒𝐢𝐎𝟐 + 𝟐𝐂(𝐠𝐫𝐚𝐩𝐡𝐢𝐭) + 𝟐𝐂𝐥𝟐 (𝐤) → 𝐒𝐢𝐂𝐥𝟒 (𝐤) + 𝟐𝐂𝐎(𝐤)
Biết ∆HSN0 (kJ/mol) -910,9 -657,0 -110,5 S0(J/mol.K) 41,84 5,74 223,0 330,6 197,6
Hãy xác ịnh ∆𝐆𝟎(kJ/mol) của phản ứng ở 250C và cho biết chiều hướng phản ứng ở nhiệt ộ này?
Câu 4(1,0 iểm). Phản ứng phân hủy AsH3 thành As và H2 ở 250C có hằng số tốc ộ của phản ứng là k1 =
3,8x10-3 s-1. Ở 350C hằng số tốc ộ của phản ứng là k2 = 7,2 x 10-3 s-1. Tính năng lượng hoạt hóa (Ea, kJ/mol)
của phản ứng phân hủy AsH3 ở trên.
Câu 5 (1,0 iểm). Một mẫu khí NH3 ược nạp vào bình chân không ở 10520C, áp suất ban ầu của NH3 là 1,0
atm. Ở iều kiện này, khí NH3 phân hủy theo phản ứng: 𝐍𝐇𝟑 (𝐤) ⇔ 𝟏 𝟐𝐍⁄ 𝟐 (𝐤) + 𝟑 𝟐𝐇⁄ 𝟐 (𝐤). Khi hệ ạt
cân bằng, áp suất riêng
phần của NH3 là 0,3 atm. Tính Kp và Kc của phản ứng ở nhiệt ộ trên.
Câu 6 (2,0 iểm). a, Tính pH của dung dịch axit propanoic C3H5COOH 0,15 M có Ka = 1,3 x 10-5 và tính pH
của dung dịch muối NaOCl 0,20 M, biết hằng số iện li KHOCl = 3,5 x 10-8. lOMoARcPSD|50202050
ĐẠI HỌC QUỐC GIA HÀ NỘI
ĐỀ THI KẾT THÚC HỌC KỲ I
TRƯỜNG ĐẠI HỌC KHOA HỌC TỰ NHIÊN NĂM HỌ
Môn thi: Hóa Đại cương
Lớp môn học: CHE1080 Số tín chỉ:
b, Tính pH của dung dịch ệm iều chế bằng cách trộn 900 mL dung dịch HCOOH 0,5 M với 100 mL dung
dịch NaOH 1,5 M biết hằng số iện li KHCOOH = 1,8x10-4. c, Tính ộ tan (s) của muối Ag3PO4 biết tích số tan
tương ứng TAg3PO4 = 1,8 x 10-18.
Câu 7 (1,5 iểm). Một pin iện hóa ược xây dựng từ 2 nửa phương trình phản ứng oxi hóa/khử có thế iện cực chuẩn (E0) tương ứng:
Ag+ + e → Ag E(0Ag+⁄Ag) = + 0,80V
Fe2+ + 2e → Fe E(0Fe2+⁄Fe) = − 0,44V
a, Hãy viết phương trình làm việc của pin iện hóa kể trên và chỉ ra âu là catot và anot?
b, Tính ∆G0 (theo kJ/mol) của phản ứng ở 250C.
c, Tính sức iện ộng(∆E) của pin làm việc ở 250C khi nồng ộ: [Ag+] = 0,01 M và [Fe2+] = 0,01 M.
----------------------------------------------HẾT----------------------------------------------
Cho biết: h = 6,626 x 10-34 J.s; c = 3 x 108 m/s; R = 8,314 J/mol.K, 0,082 L.at/mol.K; T(K) = t(0C) + 273.
Đề thi gồm 01 trang. Cán bộ coi thi không giải thích gì thêm. lOMoARcPSD|50202050
ĐẠI HỌC QUỐC GIA HÀ NỘI
ĐỀ THI KẾT THÚC HỌC KỲ
TRƯỜNG ĐẠI HỌC KHOA HỌC TỰ NHIÊN NĂM HỌ
Môn thi: Hóa Đại cương
Lớp môn học: CHE1080 Số tín chỉ: II C 2016-2017 03
Dành cho sinh viên lớp môn học: CHE1080 (Môn Hóa Đại cương cho toàn trường ĐHKHTN)
Thời gian làm bài: 90 phút (Không kể thời gian phát ề) Câu 1 (1,0 iểm). Tính
bước sóng (theo nm và Å) của ánh sáng phát xạ khi electron chuyển từ n = 5 về n = 2 trong ion nguyên tử
He+ (1,0 eV = 1,6.10-19 J, 1 nm = 10-9 m, 1Å = 10-10 m).
Câu 2 (1,5 iểm). Xây dựng giản ồ MO và viết cấu hình electron của ion phân tử OF2-. Hãy tính bậc liên kết
của các ion phân tử OF2-, OF-,OF+ và cho biết chúng là thuận từ hay nghịch từ.
Câu 3 (2,0 iểm). Axit H3PO4(r) ược hình thành từ P4O10(r) theo phản ứng sau:
𝐏𝟒𝐎𝟏𝟎(𝐫) + 𝟔𝐇𝟐𝐎(𝐥) → 𝟒𝐇𝟑𝐏𝐎𝟒(𝐫)
Biết ∆HSN0 (kJ/mol) -2984 -285,8 -1281 S0(J/mol.K) 228,9 69,91 110,5
Xác ịnh ∆G0(kJ/mol) của phản ứng ở 250C và cho biết chiều hướng phản ứng ở nhiệt ộ này. Câu
4(1,0 iểm). Cho phản ứng phân hủy N2O(k):
𝟐𝐍𝟐𝐎(𝐤) → 𝟐𝐍𝟐(𝐤) + 𝐎𝟐(𝐤)
Ở 3000C, hằng số tốc ộ phản ứng là k1 = 2,6.10-11 s-1; ở 3300C, hằng số tốc ộ phản ứng là k1 = 2,1.10-10 s-1.
Tính năng lượng hoạt hóa (Ea theo kJ/mol) của phản ứng phân hủy N2O(k) ở trên.
Câu 5 (1,0 iểm). Một mẫu khí PCl5 ược cho vào bình chân không, áp suất ban ầu của PCl5 là 1,5 atm ở
230oC. Ở iều kiện này, PCl5 phân hủy theo phản ứng: PCl5(k) ⇔ PCl3(k) + Cl2(k).
Áp suất tổng cộng của hệ khi ạt cân bằng là 1,84 atm. Tính Kp và Kc của phản ứng ở nhiệt ộ này.
Câu 6 (2,0 iểm). a, Tính pH của dung dịch axit benzoic C6H5COOH 0,4 M có Ka = 6,4.10-5 và pH của dung
dịch KCN 0,15 M có Ka(HCN) = 7,9.10-10.
b, Trộn 100 mL dung dịch CH3COOH 0,1 M với 100 mL dung dịch KOH 0,05 M ược 200 mL dung dịch
A. Xác ịnh pH của dung dịch A. Biết CH3COOH ở cùng iều kiện có hằng số iện ly Ka = 1,7 x10-4. c, Tính
ộ tan (s theo mol/L) của AgI biết tích số tan cho tương ứng TAgI = 1,19.10-16.
Câu 7 (1,5 iểm). Một pin iện ược xây dựng từ 2 nửa phương trình và thế iện cực chuẩn (E0) tương ứng:
Fe2+ + 2e → Fe E(0Fe2+⁄Fe) = − 0,44V Cu2+ + 2e → Cu E(0Cu2+⁄Cu) = + 0,34V. lOMoARcPSD|50202050
ĐẠI HỌC QUỐC GIA HÀ NỘI
ĐỀ THI KẾT THÚC HỌC KỲ I
TRƯỜNG ĐẠI HỌC KHOA HỌC TỰ NHIÊN NĂM HỌ
Môn thi: Hóa Đại cương
Lớp môn học: CHE1080 Số tín chỉ:
a, Viết phương trình làm việc của pin iện trên. Chỉ ra âu là catot và anot, giải thích.
b, Tính ∆G0 (kJ/mol) của phản ứng ở 250C (F = 96500 C/mol).
c, Tính sức iện ộng(∆E0theo V) của pin làm việc ở nồng ộ các chất: [Fe2+] = 0,12 M và [Cu2+] = 0,25 M tại nhiệt ộ 250C.
----------------------------------------------HẾT----------------------------------------------
Cho biết: h = 6,626 x 10-34 J.s; c = 3 x 108 m/s; R = 8,314 J/mol.K, 0,082 L.at/mol.K; T(K) = t(0C) + 273.
Đề thi gồm 01 trang. Cán bộ coi thi không giải thích gì thêm. C 2017-2018 03
Dành cho sinh viên lớp môn học: CHE1080 (học phần Hóa Đại cương cho toàn trường ĐHKHTN)
Thời gian làm bài: 90 phút (Không kể thời gian phát ề)
Câu 1 (1,0 iểm). Năng lượng ion hóa là năng lượng cần thiết loại bỏ electron ể chuyển 1 mol nguyên tử ở
trạng thái khí thành 1 mol ion nguyên tử ở trạng thái khí. Tính năng lượng ion hóa nguyên tử H (theo ơn vị
kJ/mol, cho biết: 1 eV = 1,6 x 10-19 J, 1 m = 109 nm).
Câu 2 (1,5 iểm). Hãy xây dựng giản ồ MO (orbitan phân tử) và viết cấu hình electron của ion phân tử O+2 .
Dựa vào giản ồ MO của O2+ hãy cho biết từ tính của các ion phân tử O2, O−2 , O+2 và cho biết ion nào có ộ
dài liên kết ngắn nhất.
Câu 3 (2,0 iểm). Cho phản ứng oxi hóa – khử sau:
𝐂𝐇𝟔𝐍𝟐 (𝐫) + 𝐍𝟐𝐎𝟓 (𝐫) → 𝟐𝐍𝟐 (𝐤) + 𝐂𝐎𝟐 (𝐤) + 𝟑𝐇𝟐𝐎(𝐥)
Biết ∆Hsinhnhi0 ệt(kJ/mol) 54,0 -42,0 0 -393,5 -286,0 S0(J/mol.K) 166,0 178,0 192,0 214,0 70,0
Hãy xác ịnh ∆G0 (kJ/mol) của phản ứng ở 250C và cho biết chiều hướng phản ứng ở nhiệt ộ này?
Câu 4(1,0 iểm). Phản ứng phân hủy H2O2 thành H2O và O2 ở 20oC là phản ứng bậc 1 có hằng số tốc ộ của
phản ứng là k = 1,8.10-5 s-1. Tính thời gian bán hủy (t1/2) của phản ứng phân hủy trên. Nếu nồng ộ ban ầu
của H2O2 là 0,30 M thì hỏi sau bao lâu sẽ phân hủy hết 90% H2O2 ban ầu?
Câu 5 (1,0 iểm). Metan (CH4) và hidro sunfua (H2S) phản ứng với nhau:
CH4 (k) + 2H2S (k) ⇔ CS2 (k) + 4H2 (k) lOMoARcPSD|50202050
Khi hệ phản ứng ạt trạng thái cân bằng ở 727oC, áp suất riêng phần của CH4 là 0,20 atm; H2S là 0,25 atm;
CS2 là 0,52 atm; H2 là 0,10 atm. Tính Kp và Kc của phản ứng ở nhiệt ộ trên.
Câu 6 (2,0 iểm). a, Metylamin (CH3NH2) tan trong nước hình thành ion CH3NH3− và OH-. Tính nồng ộ
CH3NH3− và pH của dung dịch CH3NH2 0,50 M ở 25oC, cho biết KCH3NH2 = 4,38 x10-4.
b, Tính pH của dung dịch muối tan NaCl 0,25 M ở 25oC, cho biết hằng số iện li KHCN = 6,2 x10-10.
c, Tính thể tích HNO2 0,60 M và thể tích NaNO2 0,45 M cần thiết ể trộn vào nhau thu ược 1,0 L dung dich
ệm có pH = 3,574 ở 25oC, biết hằng số iện li KHNO2 = 4,0 x10-4.
Câu 7 (1,5 iểm). Một pin iện ược xây dựng từ 2 nửa phương trình phản ứng oxi hóa khử có thế iện cực
chuẩn (ký hiệu thế iện cực chuẩn là φo hoặc Eo) tương ứng:
Cu2+ + 2e → Cu φ(oCu2+⁄Cu) = + 0,34V
Fe2+ + 2e → Fe φo(Fe2+⁄Fe) = − 0,44V
a, Hãy viết phương trình làm việc của pin iện hóa trên và chỉ ra âu là catot và anot?
b, Tính ∆G0 (J/mol) và hằng số cân bằng K của phản ứng iện hóa trên ở 25oC.
c, Ở 25oC nếu nồng ộ [Cu2+] = 0,30 M thì cần nồng ộ [Fe2+] là bao nhiêu ể sức iện ộng của pin(∆E) ạt ược 1,03 V.
----------------------------------------------HẾT----------------------------------------------
Cho biết: h = 6,626 x 10-34 J.s; c = 3 x 108 m/s; R = 8,314 J/mol.K, 0,082 L.at/mol.K; F = 96500 C/mol.
Đề thi gồm 01 trang. Cán bộ coi thi không giải thích gì thêm.