



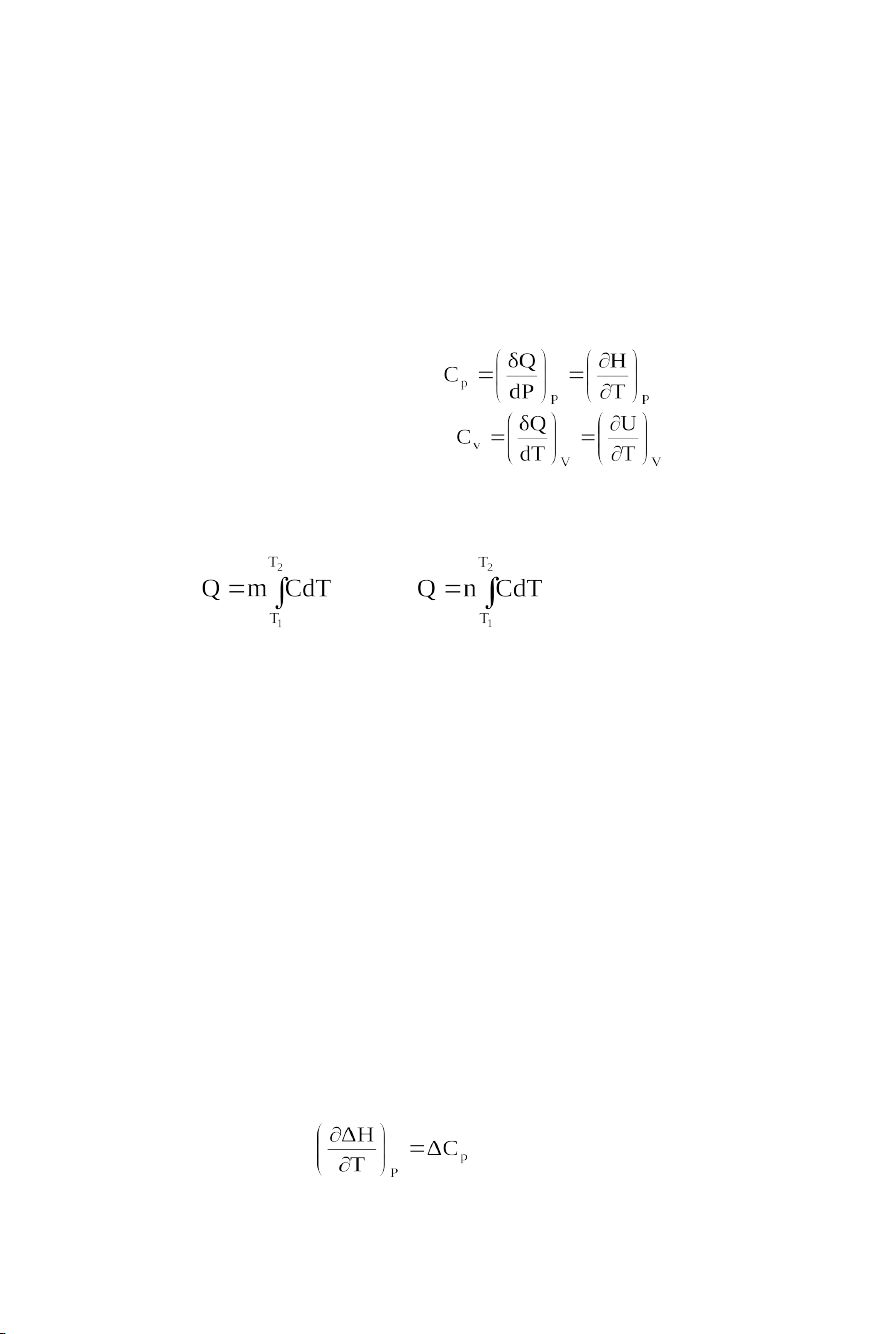













Preview text:
MỤC LỤC MỤC LỤC Chương 1
NGUYÊN LÝ I NHIỆT ĐỘNG HỌC Chương 2
NGUYÊN LÝ II NHIỆT ĐỘNG HỌC Chương 3 CÂN BẰNG HÓA HỌC Chương 4 CÂN BẰNG PHA DUNG DỊCH VÀ CÂN BẰNG DUNG DỊCH - HƠI Chương 6 CÂN BẰNG GIỮA DUNG DỊCH LỎNG VÀ PHA RẮN Chương 7 ĐIỆN HÓA HỌC Chương 8 ĐỘNG HÓA HỌC 1 Chương 9 HẤP PHỤ VÀ HÓA KEO
NGÂN HÀNG CÂU HỎI MÔN HỌC HÓA LÝ 2 Chương 1
NGUYÊN LÝ I NHIỆT ĐỘNG HỌC
1.1. Nguyên lý I nhiệt động học
1.1.1. Nhiệt và công
Nhiệt và công là hai hình thức truyền năng lượng
của hệ. Công ký hiệu là A và nhiệt ký hiệu là Q. Quy ước dấu Công A Nhiệt Q Hệ sinh > 0 < 0 Hệ nhận < 0 > 0
1.1.2. Nguyên lý I nhiệt động học
Biểu thức của nguyên lý I nhiệt động học: U = Q - A
Khi áp dụng cho một quá trình vô cùng nhỏ: dU = Q - A
Ở dạng tích phân nguyên lý I có thể được viết:
1.1.3. Áp dụng nguyên lý I cho một số quá trình.
1.1.3.1. Quá trình đẳng tích: V = const, dV = 0. 3 Từ đó ta có: QV = ΔU
1.1.3.2. Quá trình đẳng áp: P = const, dP = 0. Ap = P.(V2 - V1) = P.V Do đó:
Qp = ΔU + PV = (U + PV) = H
1.1.3.3. Quá trình đẳng áp của khí lý tưởng
Từ phương trình trạng thái khí lý tưởng: PV = nRT Ta có: Ap = PV = nRΔT ΔUp = Qp – nRΔT
1.1.3.4. Quá trình dãn nở đẳng nhiệt của khí lý tưởng
Biến thiên nội năng khi dãn nở đẳng nhiệt (T =
const) khí lý tưởng là bằng không nên: Trong đó:
P1: áp suất ở trạng thái đầu.
P2: áp suất ở trạng thái cuối.
1.1.3.5. Nhiệt chuyển pha Trong đó:
cp: nhiệt chuyển pha (cal hoặc J)
nc = -đđ, hh = -ngtụ Ghi chú:
R là hằng số khí lý tưởng và có các giá trị sau:
R = 1,987 cal/mol.K = 8,314 J/mol.K R = 0,082 lit.atm/mol.K
1 cal = 4,18 J; 1 l.atm = 101,3 J = 24,2 cal 4
1.2. Định luật Hess
1.2.1. Nội dung định luật
Trong quá trình đẳng áp hoặc đẳng tích, nhiệt phản
ứng chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối
mà không phụ thuộc vào các trạng thái trung gian.
Biểu thức của định luật Hess: QV = ΔU và Qp = ΔH Trong đó:
U: nhiệt phản ứng đẳng tích.
H: nhiệt phản ứng đẳng áp.
Khi quá trình xảy ra ở điều kiện tiêu chuẩn ta có
nhiệt phản ứng tiêu chuẩn: H0298, U0298.
Đối với các quá trình xảy ra khi có mặt các chất khí
(được xem là khí lý tưởng), ta có: ΔH = ΔU + RTΔn
Với n là biến thiên số mol khí của quá trình.
1.2.2. Các hệ quả của định luật Hess
Nhiệt phản ứng nghịch bằng nhưng trái dấu với nhiệt phản ứng thuận. ΔHnghịch = - ΔHthuận
Nhiệt phản ứng bằng tổng nhiệt sinh của các chất
tạo thành trừ đi tổng nhiệt sinh của các chất tham gia phản ứng.
ΔH phản ứng = ∑ΔHssp - ∑ ΔHstc
Nhiệt phản ứng bằng tổng nhiệt cháy của các chất
tham gia phản ứng trừ đi tổng nhiệt cháy của các chất tạo thành. 5
ΔH phản ứng = ∑ΔHchtc - ∑ ΔHchsp
Ghi chú: Nhiệt tạo thành tiêu chuẩn (H0298, tt), nhiệt
đốt cháy tiêu chuẩn (H0298,đc) được cho sẵn trong sổ tay hóa lý. 1.3. Nhiệt dung 1.3.1. Định nghĩa Nhiệt dung đẳng áp: Nhiệt dung đẳng tích: Mối liên hệ: Cp - Cv = R
Nhiệt lượng Q được tính: hoặc
1.3.2. Ảnh hưởng của nhiệt độ đến nhiệt dung
Sự phụ thuộc vào nhiệt độ của nhiệt dung được
biểu diễn bằng các công thức thực nghiệm dưới dạng các hàm số: Cp = a0 + a1.T + a2.T2 Hoặc Cp = a0 + a1.T + a-2.T-2
Trong đó: a0, a1, a2, a-2 là các hệ số thực nghiệm có
thể tra giá trị của chúng trong sổ tay hóa lý.
1.2.2. Định luật Kirchhoff
Hiệu ứng nhiệt của phản ứng phụ thuộc vào nhiệt
độ được biểu diễn bởi định luật Kirchhoff: 6 Hoặc
Sau khi lấy tích phân ta được:
Nếu lấy tích phân từ T1 đến T2 ta được: 1.4. Bài tập mẫu
Ví dụ 1: Tính biến thiên nội năng khi làm bay hơi 10g
nước ở 200C. Chấp nhận hơi nước như khí lý tưởng và
bỏ qua thể tích nước lỏng. Nhiệt hóa hơi của nước ở 200C bằng 2451,824 J/g. Giải
Nhiệt lượng cần cung cấp để làm hóa hơi 10g nước là:
Q = m. = 10. 2451,824 = 24518,24 (J)
Công sinh ra của quá trình hóa hơi là: A = P.V = P(Vh - Vl) = PVh = (J) Biến thiên nội năng là: U = Q – A = 23165 (J)
Ví dụ 2: Cho 450g hơi nước ngưng tụ ở 1000C dưới áp
suất không đổi 1 atm. Nhiệt hóa hơi của nước ở nhiệt
độ này bằng 539 cal/g. Tính A, Q và ΔU của quá trình. Giải 7
Nhiệt lượng tỏa ra khi ngưng tụ là:
Q = m.ng. tụ = 450. (- 539) = - 242550 (cal) Công của quá trình:
A = P.V = P. (Vl - Vh) = - P.Vh = - nRT =
Biến thiên nội năng của quá trình là:
U = Q – A = - 224021 (cal)
Ví dụ 3: Cho phản ứng xảy ra ở áp suất không đổi: 2H2 + CO = CH3OH(k)
nhiệt tạo thành tiêu chuẩn ở 298K của CO và CH3OH(k)
bằng -110,5 và -201,2 kJ/mol. Nhiệt dung mol đẳng áp
của các chất là một hàm của nhiệt độ: Cp (H2) = 27,28 + 3,26.10-3T (J/mol.K)
Cp (CO) = 28,41 + 4,1.10-3T (J/mol.K)
Cp (CH3OH)k = 15,28 + 105,2.10-3T (J/mol.K)
Tính ΔH0 của phản ứng ở 298 và 500K? Giải
Nhiệt phản ứng ở 298K là:
H0298 = - 201,2 - (-110,5) = - 90,7 (KJ) Biến thiên nhiệt dung:
Cp = Cp(CH3OH) – Cp(CO) – 2Cp(H2) = - 67,69 + 94,58. 10-3T (J/K)
Nhiệt phản ứng ở 500K là : 8 = - 96750,42 (J)
Ví dụ 4: Cho 100g khí CO2 (được xem như là khí lý
tưởng) ở 00C và 1,013.105 Pa. Xác định Q, A, ΔU và ΔH
trong các quá trình sau. Biết Cp = 37,1 J/mol.K. a.
Dãn nở đẳng nhiệt tới thể tích 0,2 m3. b. Dãn đẳng áp tới 0,2 m3. c.
Đun nóng đẳng tích tới khi áp suất bằng 2,026.105 Pa. Giải a.
Dãn nở đẳng nhiệt (T = const) tới thể tích 0,2m3. (J) U = 0 b.
Dãn nở đẳng áp (P = const) tới 0,2m3. H = Qp = n.Cp. (T2 – T1)
J A = PV = P(V2 – V1)
U = Q – A = 67469 - 15120 = 52349 (J) 9 c.
Đun nóng đẳng tích (V = const) tới áp suất bằng 2,026.105Pa (2 atm) A = 0
Cv = Cp - R = 37,1 - 8,314 = 28,786 (J/mol.K) U = Qv = n.Cv.(T2 – T1) Ta có:
Suy ra: U = Qv = 1 28,786(546 - 273) = 7859 (J)
H = U + PV = 7859 (J)
Ví dụ 5: Một khí lý tưởng nào đó có nhiệt dung mol đẳng
tích ở mọi nhiệt độ có Cv = 2,5R (R là hằng số khí). Tính
Q, A, U và H khi một mol khí này thực hiện các quá trình sau đây: a.
Dãn nở thuận nghịch đẳng áp ở áp suất 1atm từ 20dm3 đến 40dm3. b.
Biến đổi thuận nghịch đẳng tích từ trạng thái (1atm; 40dm3) đến (0,5atm; 40dm3). c.
Nén thuận nghịch đẳng nhiệt từ 0,5 atm đến 1 atm ở 250C. Giải a.
Dãn nở thuận nghịch đẳng áp (P = const). Tính công A: (J) 10 Tính nhiệt lượng Q: (l.atm) (J) Biến thiên nội năng: U = Q – A = 5069 (J) Biến thiên entapy H = Qp = 7097 (J) b.
Dãn nở thuận nghịch đẳng tích (V = const). A = 0 Nhiệt lượng: (l.atm) (J) U = Qv = - 5069 (J) c.
Nén đẳng nhiệt (T = const) U = 0 (J)
Ví dụ 6: Tính nhiệt tạo thành của etan biết: Cgr + O2 = CO2 H0298 = -393,5 KJ H2 + 1/2O2 = H2O(l) H0298 = -285 KJ 2C2H6 + 7O2 = 4 CO2 + H2O(l) H0298 = -3119,6 KJ Giải 11 Cgr + O2 = CO2 (1) H2 + 1/2O2 = H2O(l) (2)
2C2H6 + 7O2 = 4CO2 + 6H2O(l) (3)
Nhiệt tạo thành C2H6 là: 2C + 3H2 = C2H6 (4)
H0298(4) = 4H0298(1) + 6H0298(2) - H0298(3)
H0298(4) = 4(-393,5) + 6(-285) - (-3119,6) = 164,4 (KJ)
Ví dụ 7. Tính Q, A, U của quá trình nén đẳng nhiệt,
thuận nghịch 3 mol khí He từ 1atm đến 5 atm ở 4000K. Giải
Nhiệt và công của quá trình: U = 0
Ví dụ 8. Cho phản ứng: 1/2N2 + 1/2O2 = NO. Ở 250C,
1atm có H0298 = 90,37 kJ. Xác định nhiệt phản ứng ở
558K, biết nhiệt dung mol đẳng áp của 1 mol N2, O2 và
NO lần lượt là 29,12; 29,36 và 29,86 J.mol-1.K-1. Giải
Hiệu ứng nhiệt của phản ứng ở 558K là: Trong đó:
Cp = 29,86 – 1/2(29,12) – 1/2(29,36) = 0,62 (J.K-1)
H0558 = 90,37 + 0,62.(558 - 298).10-3 = 90,5312 (KJ) 12
1.5. Bài tập tự giải 1.
Xác định biến thiên nội năng khi làm hóa hơi 20g
etanol tại nhiệt độ sôi, biết nhiệt hóa hơi riêng của
etanol bằng 857,7 J/g và thể tích hơi tại nhiệt độ
sôi bằng 607 cm3/g (bỏ qua thể tích pha lỏng). ĐS: 2,54 kJ 2.
Tính ΔH và ΔU cho các quá trình sau đây: a.
Một mol nước đông đặc ở 00C và 1 atm; b.
Một mol nước sôi ở 1000C và 1 atm.
Biết rằng nhiệt đông đặc và nhiệt hóa hơi của 1
mol nước bằng -6,01 kJ và 40,79 kJ, thể tích mol của
nước đá và nước lỏng bằng 0,0195 và 0,0180 lit. Chấp
nhận hơi nước là khí lý tưởng. ĐS: a. ΔH = ΔU = -6,01 kJ
b. ΔH = 37,7 kJ; ΔU = 40,79 kJ 3.
Nhiệt sinh của H2O(l) và của CO2 lần lượt là -285,8
và -393,5 kJ/mol ở 250C, 1 atm. Cũng ở điều kiện
này nhiệt đốt cháy của CH4 bằng -890,3 kJ/mol.
Tính nhiệt tạo thành của CH4 từ các nguyên tố ở điều
kiện đẳng áp và đẳng tích.
ĐS: -74,8 kJ/mol; 72,41 kJ/mol 4.
Tính nhiệt tạo thành chuẩn của CS2 lỏng dựa vào các dữ liệu sau:
S(mon) + O2 = SO2 ΔH1 = -296,9 kJ
CS2(l) + 3O2 = CO2 + 2SO2 ΔH2 = -1109 kJ
C(gr) + O2 = CO2 ΔH3 = -393,5 kJ 13 ĐS: 121,7 KJ 5.
Trên cơ sở các dữ liệu sau, hãy tính nhiệt tạo thành của Al2Cl6 (r) khan:
2Al + 6HCl(l) = Al2Cl6(l) + 3H2 ΔH0298 = -1003,2 kJ
H2 + Cl2 = 2HCl(k) ΔH0298 = -184,1 kJ HCl(k) = HCl(l) ΔH0298 = -72,45 kJ Al2Cl6(r) = Al2Cl6(l) ΔH0298 = -643,1 kJ ĐS: 1347,1 kJ 6. Tính nhiệt phản ứng:
H2(k) + S(r) + 2O2(k) + 5H2O(l) = H2SO4.5H2O(dd)
Biết nhiệt sinh của H2SO4(l) là -193,75 Kcal/mol và
nhiệt hòa tan H2SO4(l) với 5 mol nước là -13,6 Kcal. ĐS: -207,35 Kcal 7.
Cho 100 gam khí nitơ ở điều kiện chuẩn (1atm,
250C), CP(N2) = 3,262 cal/mol.K. Tính giá trị của
các đại lượng Q, A và U trong các quá trình sau: a.
Nén đẳng tích tới 1,5 atm. b.
Dãn nở đẳng áp tới thể tích gấp đôi thể tích ban đầu. c.
Dãn nở đẳng nhiệt tới thể tích 200lít. d.
Dãn nở đoạn nhiệt tới thể tích 200lít.
ĐS: a. Qv = 2424 cal; b. QP = 8786 cal, AP = 1937 cal
c. QT = AT = 1775 cal; d. U = A = 1480 cal 8.
Ở 250C phản ứng tổng hợp NH3. N2(k) + 3H2(k) = 2NH3(k) H0298,tt (kcal/mol) 0 0 -11,04 14
Và nhiệt dung của các chất: CP (N2) = 6,65 + 10-3T (cal.mol-1.K-1) CP (H2) = 6,85 + 0,28.10-3T (cal.mol-1.K-1)
CP (NH3) = 5,92 + 9,96.10-3T (cal.mol-1.K-1)
Xác định hàm số H0T = f(T) và tính H01000 của phản ứng?
ĐS: H0T = -18,22 – 15,36.10-3T + 8.10-6T2 (Kcal) H0 = -25,58 Kcal 15 Chương 2
NGUYÊN LÝ II NHIỆT ĐỘNG HỌC
2.1. Nguyên lý II nhiệt động học
2.1.1. Định nghĩa entropy
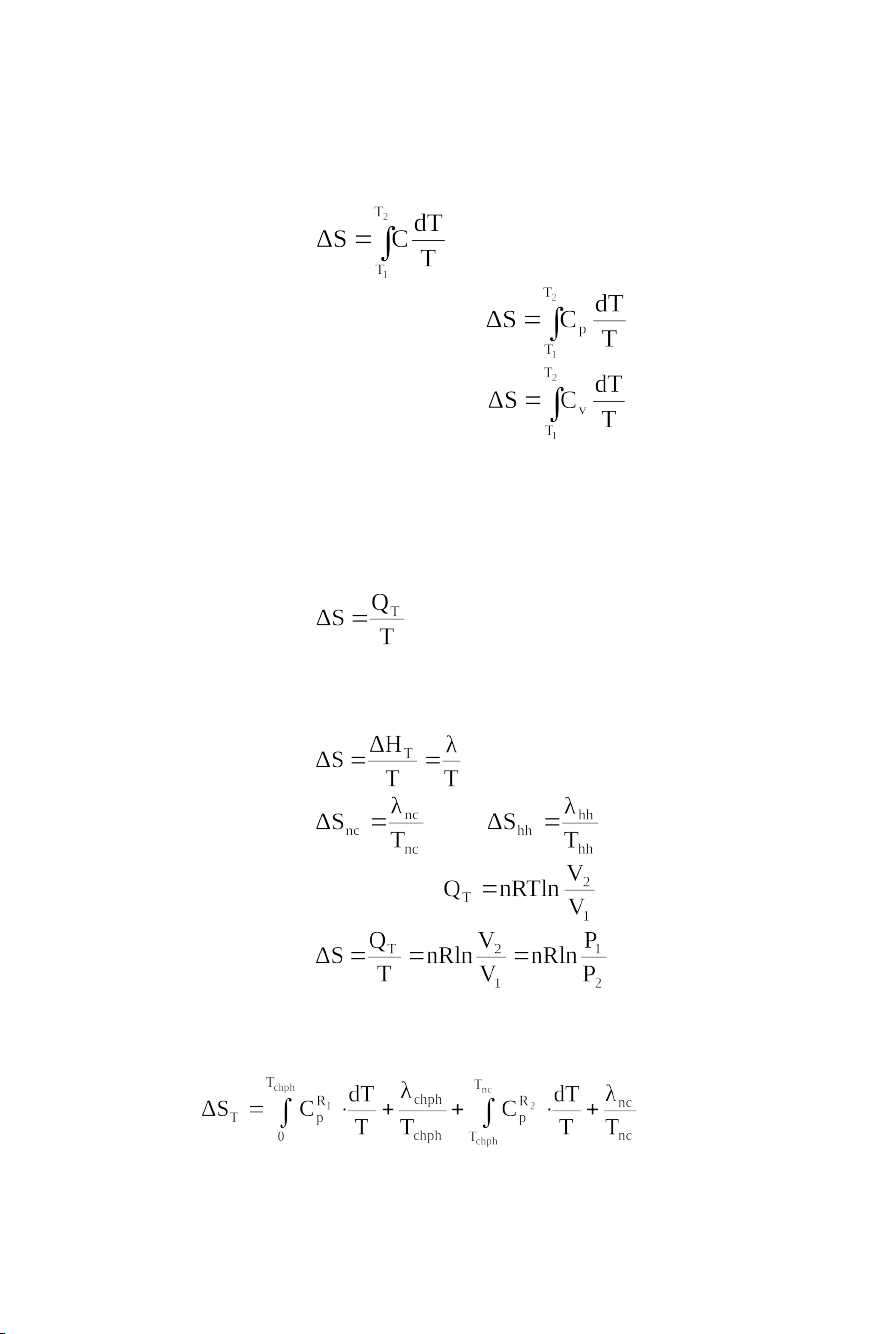
Trong quá trình thuận nghịch, biến thiên entropy
khi chuyển hệ từ trạng thái 1 sang trạng thái 2 được xác
định bằng phương trình: hay
Entropy được đo bằng đơn vị cal.mol-1.K-1 hay J.mol-1.K-1
2.1.2. Biểu thức toán của nguyên lý II
Dấu “=” khi quá trình là thuận nghịch.
Dấu “>” khi quá trình là bất thuận nghịch.
2.1.3. Tiêu chuẩn xét chiều trong hệ cô lập
Trong hệ cô lập (đoạn nhiệt) Nếu dS > 0 : Quá trình tự xảy ra
Nếu dS = 0 hay d2S < 0: Quá trình đạt cân bằng 16
2.1.4. Biến thiên entropy của một số quá trình thuận nghịch
2.1.4.1. Quá trình đẳng áp hoặc đẳng tích
Nếu quá trình đẳng áp:
Nếu quá trình đẳng tích:
2.1.4.2. Quá trình đẳng nhiệt
Trong quá trình thuận nghịch đẳng nhiệt, ta có thể áp dụng:
Đối với quá trình chuyển pha như quá trình nóng
chảy, quá trình hóa hơi… hay
Đối với khí lý tưởng: Ta được:
Biến thiên entropy ở nhiệt độ bất kỳ có thể tính bằng phương trình: 17 hoặc Trong đó:
: nhiệt dung ở trạng thái rắn 1
: nhiệt dung ở trạng thái rắn 2
Biến thiên entropy tiêu chuẩn của các phản ứng
được xác định bằng phương trình:
2.2. Thế nhiệt động
Các thế nhiệt động bao gồm: nội năng, entapy,
năng lượng tự do và thế đẳng áp.
Năng lượng tự do F và thế đẳng áp G được định
nghĩa bởi các phương trình sau: F = U - TS G = H - TS
Tại một nhiệt độ xác định, biến thiên thế đẳng áp
và đẳng tích được biểu diễn bằng phương trình sau: F = U - TS G = H - TS Và G = Gcuối - Gđầu F = Fcuối - Fđầu
Thế đẳng áp tạo thành tiêu chuẩn của các chất
(G0298) có thể tra trong sổ tay hóa lý.
2.2.1. Xét chiều trong hệ đẳng nhiệt, đẳng áp
Trong hệ đẳng nhiệt, đẳng áp 18 Nếu dG < 0 : Quá trình tự xảy ra
Nếu dG = 0 hay d2G > 0 : Quá trình đạt cân bằng
2.2.2. Xét chiều trong hệ đẳng nhiệt, đẳng tích
Trong hệ đẳng nhiệt, đẳng tích Nếu dF < 0 : Quá trình tự xảy ra
Nếu dF = 0 hay d2F > 0 : Quá trình đạt cân bằng 2.3. Bài tập mẫu
Ví dụ 1. Tính biến thiên entropy khi đun nóng thuận
nghịch 16 kg O2 từ 273K đến 373K trong các điều kiện sau: a. Đẳng áp b. Đẳng tích
Xem O2 là khí lý tưởng và nhiệt dung mol Cv = 3R/2. Giải a.
Đối với quá trình đẳng áp Cp = Cv + R = 5R/2 b.
Đối với quá trình đẳng tích
Ví dụ 2. Xác định nhiệt độ lúc cân bằng nhiệt và biến
thiên entropy khi trộn 1g nước đá ở 00C với 10g nước ở 19
1000C. Cho biết nhiệt nóng chảy của đá bằng 334,4 J/g
và nhiệt dung riêng của nước bằng 4,18 J/g.K. Giải
Gọi T (K) là nhiệt độ của hệ sau khi trộn. Giả sử hệ là cô lập. Ta có phương trình:
Nhiệt lượng tỏa ra = Nhiệt lượng thu vào
- Qtỏa = Qthu hay Q3 = Q1 + Q2
- 10.4,18.(T - 373) = 334,4 + 1.4,18.(T - 273) T = 356,64 (K)
Biến thiên entropy của hệ: S = S1 + S2 + S3 Với: S = 0,467 (J/K)
Ví dụ 3. Tính biến thiên entropy của quá trình nén đẳng nhiệt, thuận nghịch. a.
1 mol oxy từ P1 = 0,001atm đến P2 = 0,01atm. b.
1 mol mêtan từ P1 = 0,1 atm đến P2 = 1 atm.
Trong hai trường hợp trên khí được xem là lý tưởng. 20




