















Preview text:
ĐIỆN CỰC VÀ PIN Đ IỆN DS. Huỳnh Trường Hiệp MỤC TIÊU
Khái niệm và phân loại điện cực Thế điện cực
Hoạt động pin điện hóa
Ứng dụng phương pháp đo thế điện cực
ĐiỆN CỰC VÀ THẾ ĐiỆN CỰC
PHẢN ỨNG OXY HÓA/KHỬ Zn + H+ Zn+ + ½ H2 2Al + 3Cu2+ 2Al3+ + 3Cu Cl2 +2I- 2Cl- + I2 M - ne Mn+ X + ne Xn- Zn – 2e Zn++ Cặp oxy Zn2+/Zn Zn hóa/khử Zn++ + 2e Zn kim loại e- Zn++ SO -- SO -- Zn++ 4 4 e- Zn++ Zn++ e- Zn++ Zn++ dd ZnSO4 SO -- -- 4 SO4 CẶP OXY HÓA / KHỬ
Cu2+/Cu , Cl2/2Cl- , Zn2+/Zn , Fe3+/Fe2+ , 2H+/H2, …… M – ne Mn+ Mn+/M
“Cặp oxy hóa-khử là cặp các phân tử, nguyên
tử hoặc ion có thể biến đổi lẫn nhau trong
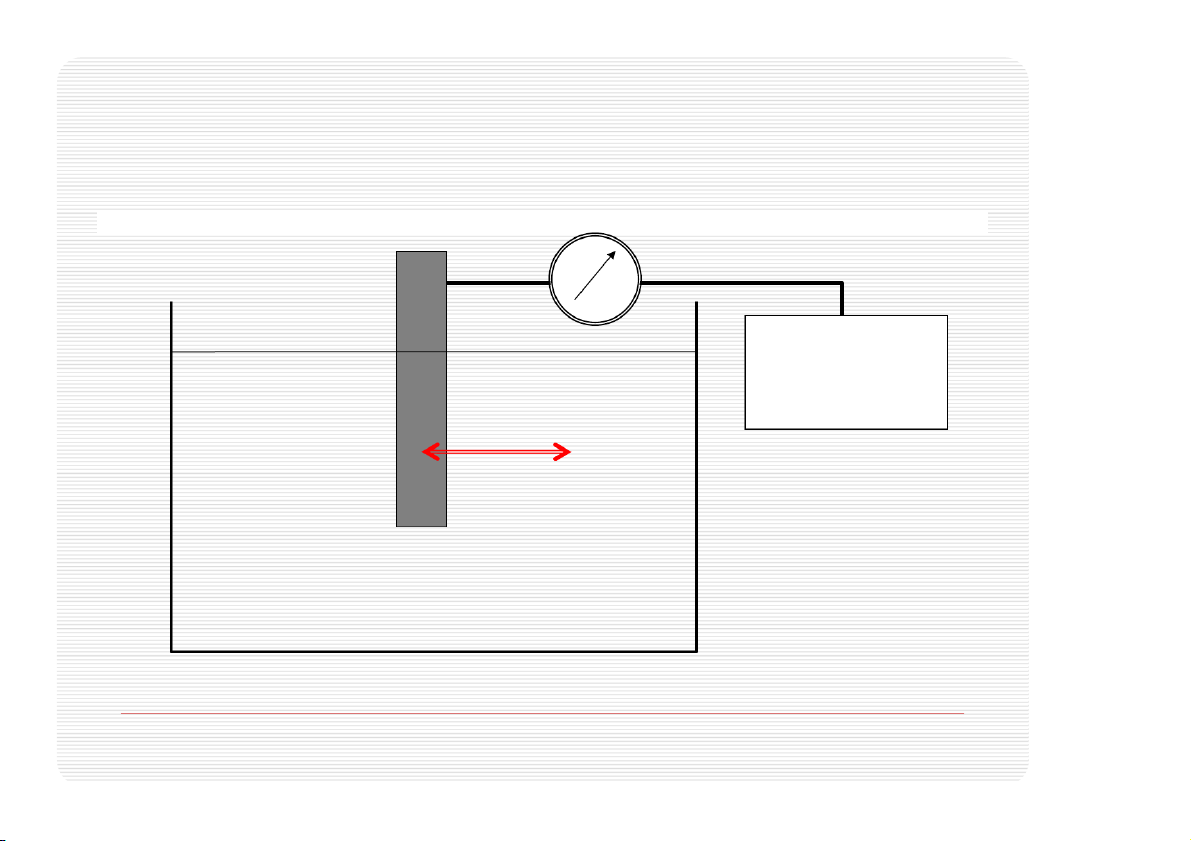
các phản ứng oxy hóa-khử” Thế oxy hóa/khử Volt kế Điện cực -- chuẩn e- Zn++ SO SO -- Zn++ 4 4 e- Zn++ Zn++ e- Zn++ Zn++ SO -- -- 4 SO4 THẾ OXY HÓA / KHỬ Zn – 2e Zn++ oxy hóa Zn Zn++ + 2e khử < 0 cho e > 0 nhận e Đo thế điện cực
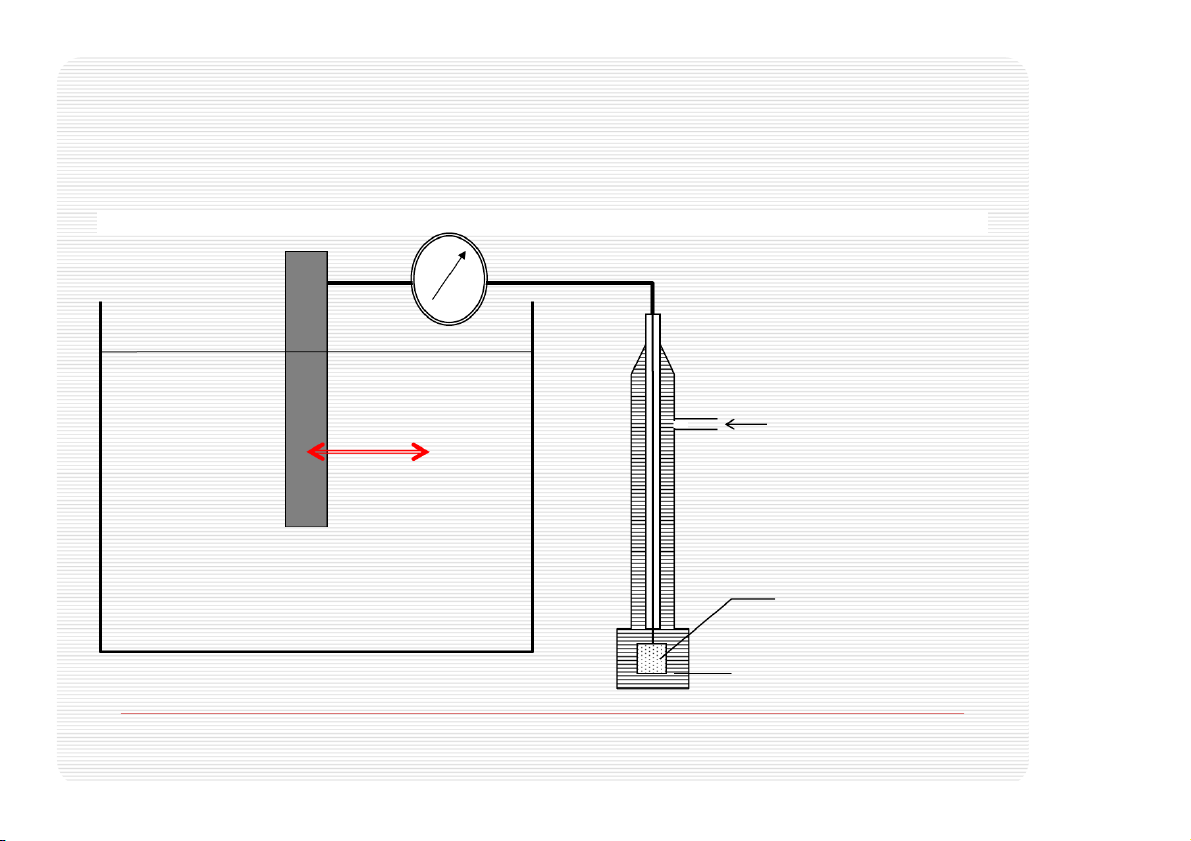
Không có phương pháp đo thế điện cực tuyệt đối. Qui ước 2H+/H , Pt 2 P
= 1 atm, [H+]=1 mol/lít và t=250C H2 Thế oxy hóa/khử T = 25oC -0.763 volt PH2=1 atm [H+]=aH+=1 e- Zn++ SO -- Hydro SO -- Zn++ 4 4 e- Zn++ Zn++ e- Zn++ Zn++ SO -- -- 4 SO4 Pt, H2 dd H+ Điện cực (volt) P ả h n ứng trong nữa pin



