


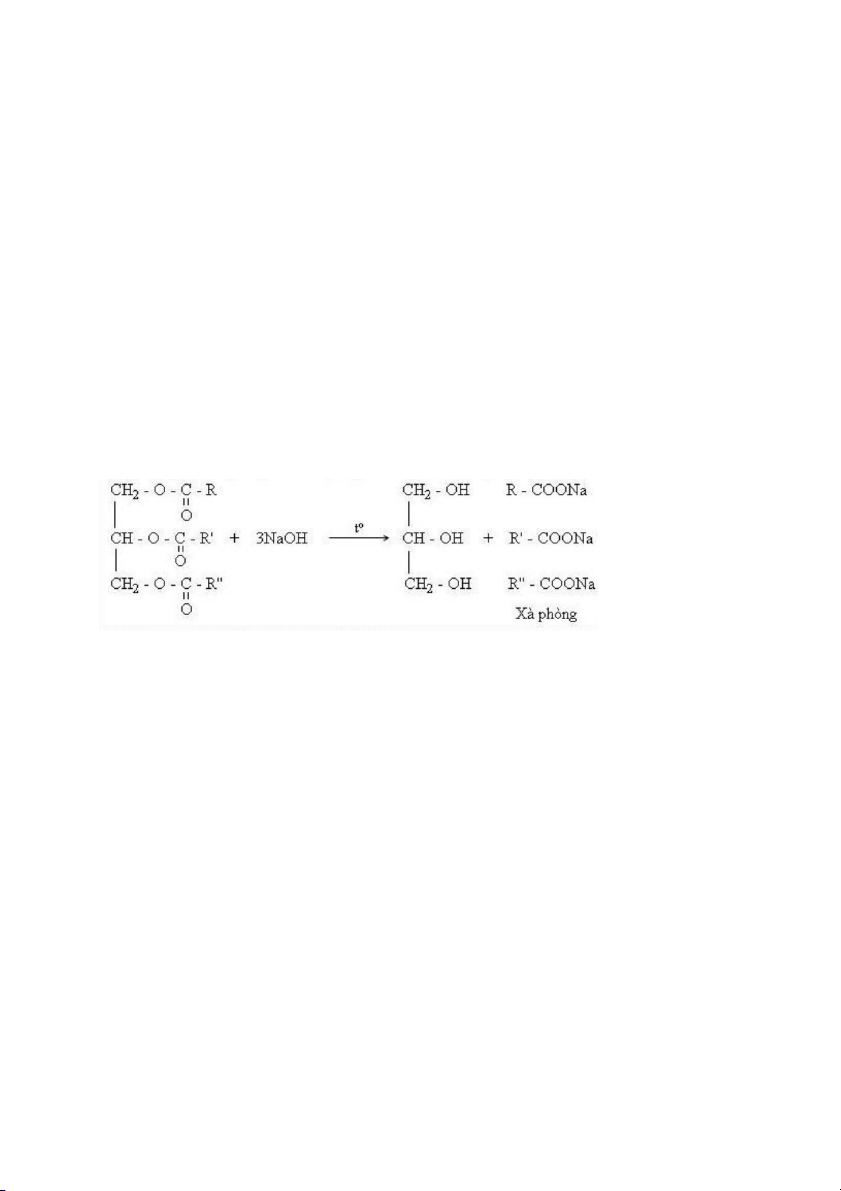




Preview text:
ĐỊNH TÍNH NHÓM CHỨC 6 lọ mất nhãn
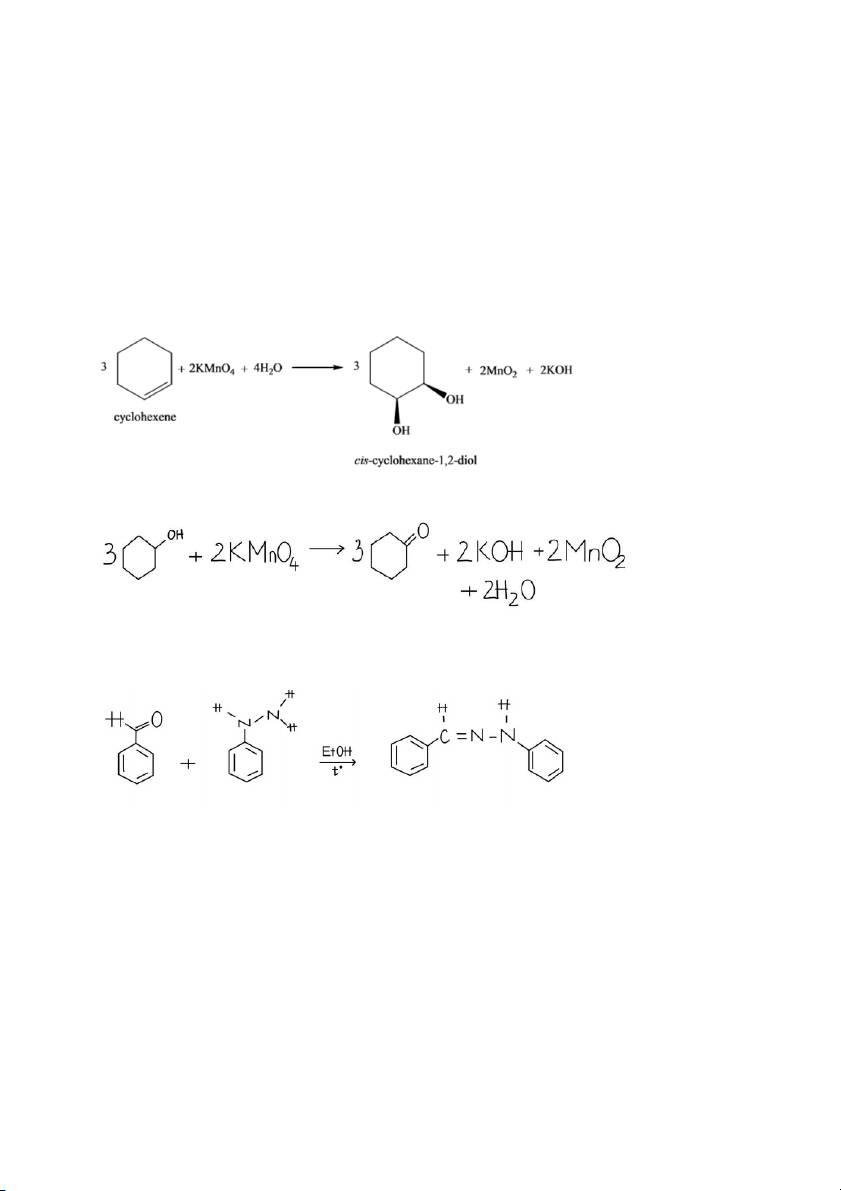
Bước 1: Cho 1 giọt dung dịch FeCl3, lắc đều thấy tạo phức màu xanh đen → phenol. PTHH: 6C H H ) 3- - + 6] 6 5OH + FeCl3 → [Fe(OC6 5 + 3Cl + 6H
Bước 2: Cho vài giọt dung dịch KMnO4 vào các ống nghiệm đã ngâm lạnh, lắc đều thấy:
Cyclohexan: không hiện tượng.
Cyclohexen: phản ứng nhanh → dung dịch mất màu, xuất hiện chất rắn màu đen (MnO2).
Cyclohexanol: phản ứng chậm → dung dịch mất màu, xuất hiện chất rắn màu đen (MnO2).
Bước 3: Dùng 1ml ethanol, lắc cho tan hết. Sau đó thêm tiếp 1ml dung dịch phenylhydrazin thấy tạo kết tủa → benzaldehyd.
Bước 4: Dùng 15 giọt thuốc thử Tollens vào 5 giọt dung dịch rồi lắc nhẹ vài giây. Sau đó đun cách thủy
ống nghiệm trong nước nóng khoảng 10 phút. Xuất hiện lớp bạc phủ quanh thành ống (tráng gương) → glucose. CH OH-(CHOH) 2 4CHO + 2AgNO + 3NH 3
3→ CH2OH-(CHOH) COONH 4 + 2NH 4 NO + 2Ag ↓ 3
ĐỒNG PHÂN CIS - TRANS
Lấy phần dung dịch qua lọc (còn gọi là nước cái, có chứa acid maleic hòa tan) vào một erlen 250ml thêm vào đó 10ml HCl đậm đặc.
Đun hoàn lưu nhẹ hỗn hợp đến khi vừa xuất hiện tinh thể acid fumaric trong dung dịch nóng (Chú ý: Đợi hỗn
hợp nguội mới tháo hệ thống sinh hàn). Để nguội hỗn hợp rồi lọc dưới áp suất kém bằng phễu buchner. TRẢ LỜI CÂU HỎI 1.
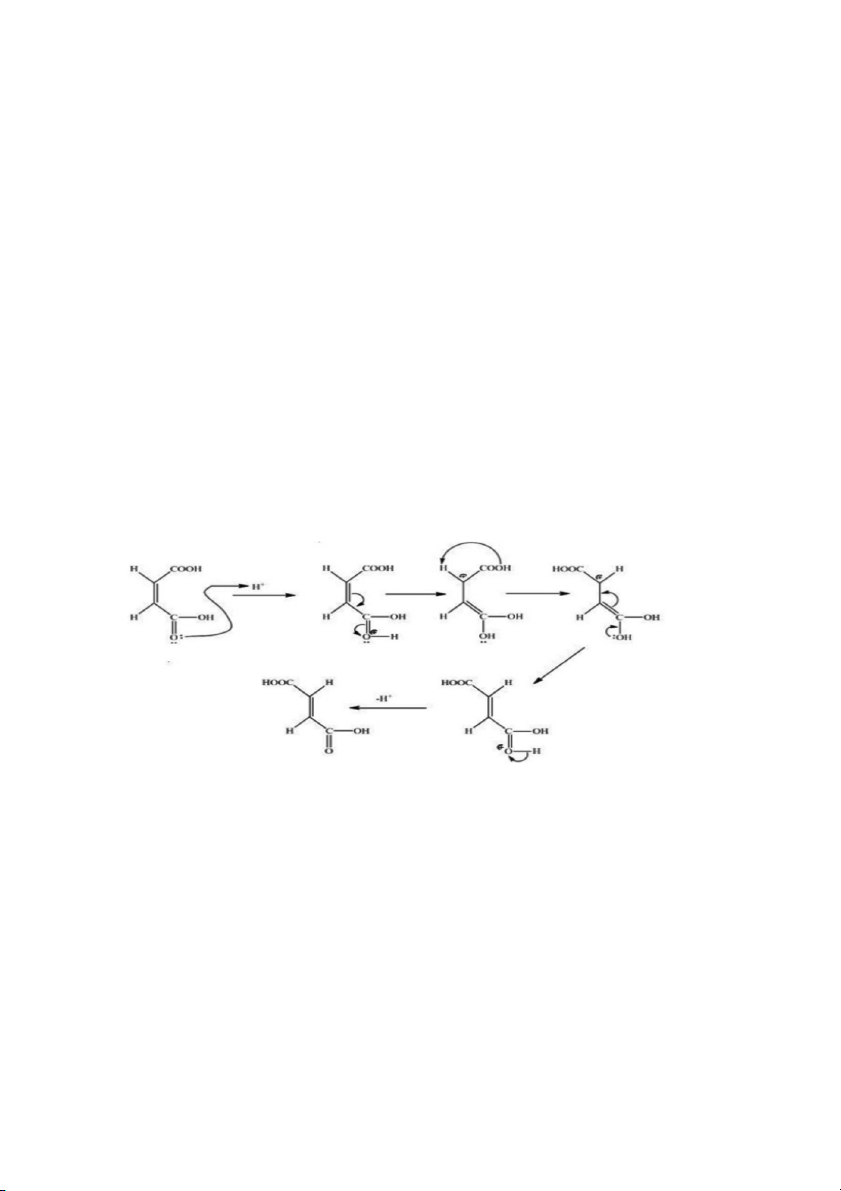
So sánh độ bền của acid maleic và acid fumaric? Giải thích?
Acid fumaric bền hơn acid maleic. Vì đồng phân trans có tính đối xứng cao hơn đồng phân cis nên mạng tinh
thể xếp chặt hơn dẫn đến nhiệt độ nóng chảy cao hơn. 2.
So sánh độ tan của 2 acid trên, làm sao biết chất kết tinh trong nước cái là acid fumaric? Giải thích
Acid maleic tan trong nước nhiều hơn acid fumaric ( do acid maleic dạng cis ) . Do giá trị momen lưỡng cực
của acid maleic lớn hơn nhiều so với của acid fumaric. Acid maleic có 2 nhóm –COOH cùng phía nên momen
lưỡng cực tạo thành theo quy tắc hình bình hành có giá trị µ1>0, còn acid fumaric có 2 nhóm –COOH khác phía
nên tổng hợp momen lực là µ2=0 vì vậy µ1>µ2 nên acid maleic phân cực hơn acid fumaric vì thế tan tốt hơn trong nước. 3.
Trình bày cơ chế chuyển hóa từ acid maleic sang acid fumaric trong môi trường acid. PHẢN ỨNG ANDOL HÓA
Trong erlen 100ml, hòa tan 1g NaOH ( NaOH dạng bột ) + 5ml nước. Làm nguội dung dịch ( đưa erlen
xuống vòi nước làm lạnh ) rồi cho vào 6ml Etanol và 3ml Acetophenol.
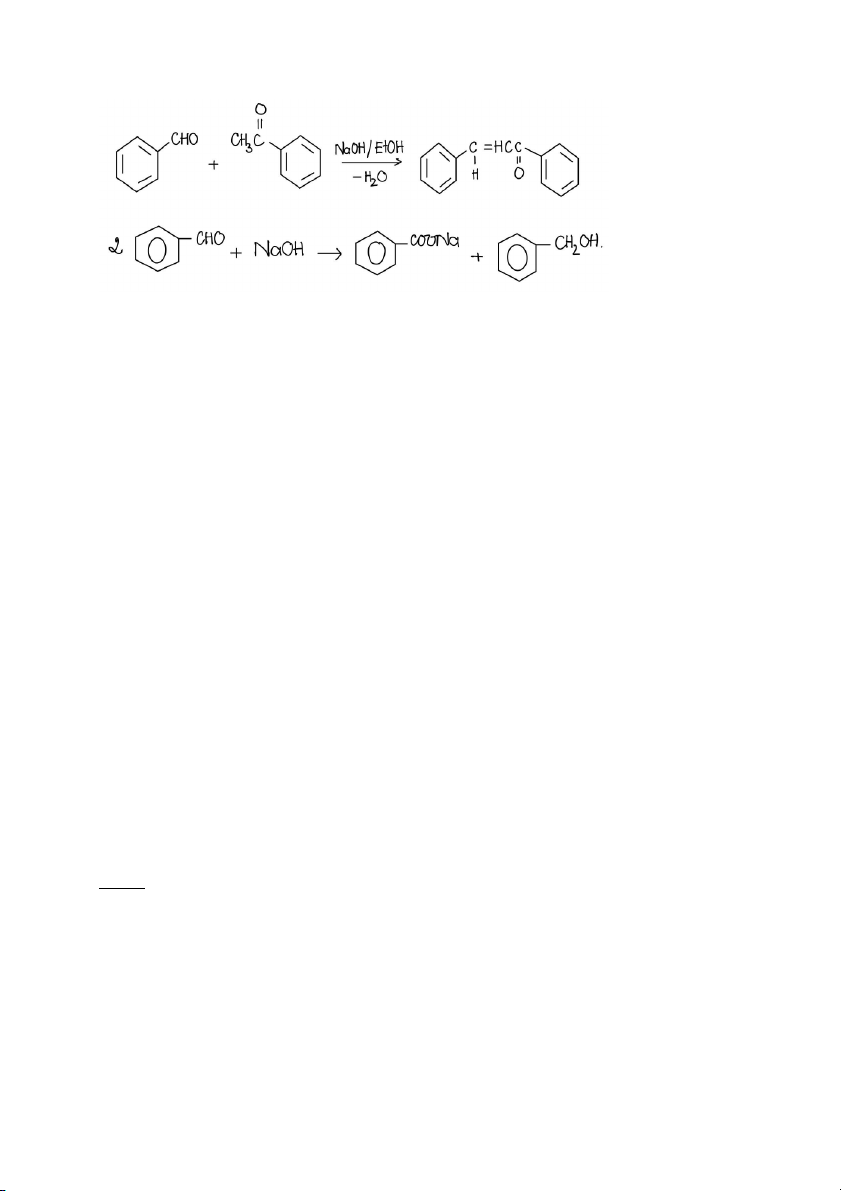
Lắc kỹ hỗn hợp và thêm vào từng lượng nhỏ (vừa thêm vừa lắc) Benzaldehyd ( cho từ từ và lắc lên ) cho đến
hết 3ml. Tiếp tục lắc đều hỗn hợp trong 30 phút. ( lắc tầm 10 - 15 p ) ( lắc đều và mạnh cho đến khi có nhũ
dầu thì dừng đem ngâm nước đá )
Giải thích: trong môi trường base, Benzaldehyd súc hợp với Acetophenol theo phản ứng aldol tạo thành Benzalacetophenol
( ngâm trong chậu nước đá erlen và etanol + nước cùng 1 lúc )
Để yên và làm lạnh erlen trong chậu nước đá khoảng 15 phút (nếu chất dầu không kết tinh thì cọ thành erlen
bằng đũa thủy tinh để chất dầu kết tinh hoàn toàn).
Giải thích: Cọ thành erlen bằng đũa thủy tinh để tạo mầm cho Benzalacetophenon nhanh kết tinh hơn.
Lấy cốc 250ml ngâm khoảng 150ml nước để làm nước rửa.
Lọc và rửa sản phẩm trên phễu Buchner với nước lạnh cho đến khi nước qua lọc không làm đổi màu giấy thảo lam.
Giải thích: Vì
kiềm có thể còn dư trong sản phẩm nên nếu nước qua lọc không đổi màu giấy thảo lam thì kiềm không còn dư nữa.
Sau cùng rửa với khoảng 5ml Etanol đã ngâm lạnh và nén thật khô trên phễu. TRẢ LỜI CÂU HỎI 1.
Tại sao phải cho acetophenol vào dd NaOH lắc kỹ rồi sau đó mới cho dd benzaldehyde vào?
Để OH- có thời gian deproton (lấy Hα) của acetophenol. 2.
Sản phẩm phụ có thể thu được?
Tự súc hợp aldol của acetophenol
Phản ứng Cannizzaro của benzaldehyde 3.
Công dụng của etanol?
Làm dung môi hòa tan NaOH và acetophenol với nhau. 4.
Tại sao phản ứng khử nước của sản phẩm andol hóa này lại không dùng xúc tác acid? Có phải NaOH
sử dụng ở đây là chất xúc tác khử nước không?
NaOH là tác nhân deproton hóa. Sản phẩm tạo thành có nối đôi C=C tiếp cách nhân thơm bền nên không cần
dùng xúc tác acid thì quá trình tách nước cũng tự diễn ra được. PHẢN ỨNG ESTE HÓA
1. Giai đoạn 2: Tinh chế và làm khan ester
- Cho hỗn hợp ester vào bình lóng đặt trên giá, thêm vào bình lóng 50ml nước ( tách lớp ester ) cất để rửa
ester, lắc đều tay, để yên cho đến khi trong bình lóng hai lớp chất lỏng tách lớp khỏi nhau, tách bỏ lớp nước phía dưới.
* Giải thích: Do phản ứng ester hóa là phản ứng thuận nghịch, nên hỗn hợp phản ứng tạo ra gồm: ester, acid,
ancol và nước. Khi cho nước vào hỗn hợp ester, ester không tan trong nước và nhẹ hơn nước nên tách lớp phía
trên, phần nước thêm vào kéo theo phần nước trong phản ứng tạo ester tách lớp phía dưới.
- Thêm vào bình lóng 30ml dung dịch NaHCO3 bão hòa (chú ý phản ứng sinh ra chất khí), lắc đều bình lóng.
Luôn xả khóa để điều hòa áp suất trong bình, để yên, khi trong bình lóng hai lớp chất lỏng tách khỏi nhau, tách
bỏ lớp nước muối phía dưới (rửa 3 lần với dung dịch NaHCO3 bão hòa).
* Giải thích: Dùng dung dịch NaHCO3 bão hòa để trung hòa lượng acid tham gia và xúc tác có trong sản phẩm.
Phản ứng sủi bọt mãnh liệt do tạo ra khí CO2.
* Tại sao phải rửa 3 lần mỗi lần 30ml NaHCO3 mà không rửa 1 lần 90ml : Vì rửa 1 lần 90ml thì sẽ không loại
bỏ được hết lượng acid trong dung dịch còn rửa 3 lần 30 ml thì sẽ loại bỏ được lượng acid tốt hơn.
Phương trình: H+ + HCO -3 CO2 + H2O *Chú ý:
Khi lắc bình lóng, một tay giữ chặt nắp bình để tránh khí phụt ra, một tay đặt ở khóa bình, lắc nhẹ, đều tay. Chú
ý xả khóa sau mỗi lần lắc, cho khí bay ra, điều hòa áp suất trong bình.
- Cho ester vào 1 erlen khô ( erlen 100ml
) rồi thêm vào 1,5g Na SO ( lắc khi 2
4 khan. Lắc nhẹ erlen cho đều
không thấy lượng Na SO , để yên vài phút 2
4 khan chạy nữa thì dừng lại )
* Giải thích: Dùng Na SO 2
4 khan để hút lượng nước còn lại trong ester.
2. Giai đoạn 3: Chưng cất acetat n-butyl
- Cho chất lỏng vào bình chưng cất, cho vài viên đá bọt
- Tiến hành chưng cất để lấy ester tinh khiết có độ sôi khoảng 124-126oC ( thu được tầm 5-6ml ester vs hiệu suất tầm 30-40% ) TRẢ LỜI CÂU HỎI Câu 2: NaHCO CO
3 dùng để trung hòa acid dư, tạo môi trường trung tính. Không thể dùng Na 2 3 hay NaOH vì
chúng tạo môi trường base mạnh sẽ làm thuỷ phân ester
Câu 3 : Tính hiệu suất của quá trình tổng hợp ester VD THAM KHẢO
Cho d: C4H9OH = 0.81 , CH3COOH = 1.05 CH3COOC4H9 = 0.88
CH3CH2CH2CH2OH + CH3COOH CH3COOCH2CH2CH2CH3 + H2O Ta có: m D × V D= => m=DxV => n 0,81 ×20 (C4H9OH)= = =0,219 mol V M 74 n 1,05× 20 CH3COOH= =0,35 mol 60
Số mol ester lí thuyết : nester lt =0,219 mol
Khối lượng ester theo lý thuyết: mester lt =116 x 0,219= 25,404g
Thể tích ester theo lí thuyết: V 25,404 ester lt = =28,8 ml 0,88
Thể tích ester thu được thực tế: Vester tt = 7,1 ml
Hiệu suất phản ứng: H= 7,1 ×100 %=24,65 % 28,8
PHẢN ỨNG ACETYL HÓA - ĐIỀU CHẾ ASPIRIN
Cho vào bình cầu đáy phẳng 250ml: 5g acid salicylic, 7.5g anhydric acetic ( 7ml ) và 3 giọt H SO 2 4 đđ. Đun cách
thủy nhẹ trong khoảng 30 phút. ( đun 20 p )
Tại sao phải đun cách thuỷ nhẹ aspirin : vì aspirin không bền với nhiệt độ cao khi đun trực tiếp thì aspirin dễ bị bay hơi
Để nguội và thêm vào bình cầu 100ml nước. Khuấy thật kĩ xong đem lọc khô dưới áp suất kém bằng phễu sứ
buchner, thu được aspirin thô. TRẢ LỜI CÂU HỎI
1. Viết cơ chế phản ứng:
- Nhóm Carbonyl của anhydride được proton hóa, hình thành cation trung gian.
- Nguyên tử oxygen trên phân tử acid salicylic tấn công vào cation này, kèm theo giai đoạn proton hóa và tạo thành acetic acid .
- Cuối cùng là giai đoạn tách proton, tái sinh xúc tác, hình thành aspirin.
2. Công dụng của 100ml nước:
Sau khi làm nguội , ta cho vào 100 ml nước là để phản ứng hết anhydride acetic dư tạo ra acid acetic và đồng
thời giúp cho aspirin kết tinh nhanh hơn vì ở nhiệt độ phòng aspirin chỉ hòa tan 0.33% trong nước.
3. Phương pháp nhận biết aspirin tinh khiết:
- Làm lạnh dd trong nước đá, aspirin sẽ kết tinh . Lọc lấy sản phẩm trên phễu Buchner.Rửa sản phẩm bằng nước
cất đến khi dịch lọc không cho màu tím với dd FeCl 0
3 1%. Sấy khô sản phẩm ở 60 C trong vòng 30 phút.
- Việc rửa sản phẩm thô đến khi dịch lọc không cho phản ứng với dd FeCl3 nhằm mục đích : Hợp chất loại
phenol có thể tạo với Fe3+ phức màu tím. Axit salixylic cũng thuộc loại hợp chất đó (Có nhóm OH gắn với nhân
thơm) nên nó cũng tạo phức màu tím với Fe3+. Vì vậy việc rửa sản phẩm đến khi không còn pứ với Fe3+ thực chất
là để nhận biết sản phẩm đã tinh khiết hay còn axit salixylic.
4. Có thể thay thế anhydric acetic trong phản ứng trên được không?
Không thể thay thế bằng acid phổ biến như acid acetic , vì OH phenol có hoạt tính yếu, khó tham gia phản ứng
este hóa với acid acetic. Nhưng với tác nhân acetic đã được tăng hoạt thì có thể xảy ra phản ứng dễ hơn .
Một số tác nhân acyl khác như :
+Halid acid: CH3COX ( X = CI , Br , I ) +Ketene: CH2 = C = 0
Ưu điểm của anhydride acetic : thể lỏng, bền ở nhiệt độ thường, điều kiện phản ứng không quá khô khan
PHẢN ỨNG XÀ PHÒNG HÓA PHẦN THI 1
Cho 15g dầu ăn ( 17 ml) vào 1 erlen 250ml, sau đó thêm vào erlen 25ml etanol, lắc đều cho dầu tan hoàn toàn.
Thêm vào đó 20 ml dung dịch NaOH 20% và vài viên đá bọt. Lắc đều và đem đun hoàn lưu nhẹ khoảng 30 phút
( đun và quan sát khi dung dịch đồng I in suốt không tách lớp đun tầm 10-15p ) đến khi dung dịch hoàn
toàn trong suốt (không còn tách lớp) thì dừng lại. Trong quá trình đun lưu ý thường xuyên lắc nhẹ erlen.
Đổ hỗn hợp phản ứng còn nóng vào một becher chứa 100 ml dung dịch NaCl bão hòa, đun sôi nhẹ để đuổi hết
etanol rồi để nguội, trong quá trình đun dùng đũa thủy tinh để khuấy hỗn hợp → dạng tủa trắng hơi vàng. Giải thích:
Trong quá trình đun dùng đũa thủy tinh để khuấy hỗn hợp nhằm tránh xà phòng bị vón cục. Sau khi đun, ta thấy
có lớp chất bọt đặc không tan nổi lên bề mặt dung dịch, đó là muối natri của axit hay còn gọi là xà phòng. Bởi
vì dầu ăn, hay lipid hay còn gọi là chất béo, có khả năng thủy phân trong môi trường kiềm (phản ứng xà phòng
hóa ester) sẽ tạo thành hỗn hợp muối natri của acid béo, còn gọi là xà phòng. Dầu ăn Glyxerol Xà phòng PHẦN THI 2
Lọc lấy xà phòng thô trên phễu buchner ở áp suất thấp.
Kết tinh lại xà phòng thô bằng 300ml nước, đun cho tan rồi thêm khoảng 30 g muối ( NaCl ) , khuấy đều cho
tan, để nguội, xà phòng sẽ kết tinh. Lọc khô bằng phễu buchner. TRẢ LỜI CÂU HỎI
1. Cho biết công dụng của ethanol.
Trả lời : Ethanol là dung môi phản ứng, hòa tan dầu ăn và NaOH.
2. Cho biết công dụng của 100 ml dung dịch NaCl bão hòa.
Trả lời: NaCl bão hòa làm kết tinh xà phòng. Do cho dung dịch NaCl làm thay đổi môi trường điện li, độ điện li
muối natri của acid béo (thành phần chủ yếu của xà phòng) giảm, hòa tan rất ít trong dung dịch và nổi lên trên.
3. Cho biết sự khác biệt giữa xà phòng thô và xà phòng kết tinh lại.
Trả lời: Điểm khác nhau chủ yếu của xà phòng thô và xà phòng kết tinh lại là:
- Xà phòng thô: Ngoài muối natri của acid béo còn có lẫn tạp chất như chất béo dư, NaOH dư, …
- Xà phòng tinh khiết: Tạp chất ít hơn. Độ tinh khiết cao hơn.
4. Tại sao phản ứng thủy phân ester với xúc tác acid là phản ứng thuận nghịch, còn phản ứng savon
hóa bằng dung dịch NaOH lại là phản ứng không thuận nghịch? Trả lời:
Phản ứng thủy phân ester là phản ứng thuận nghịch.
Trong môi trường base thì xảy ra phản ứng trung hòa
Phản ứng trung hòa làm giảm nồng độ acid carbocylic làm cho phản ứng ester hóa diễn ra theo chiều sinh ra
acid carbocylic và ancol (chiều thuận), nên phản ứng thủy phân ester trong môi trường base chỉ diễn ra theo một chiều.
Trong môi trường acid thì phản ứng trung hòa không diễn ra nên phản ứng thủy phân ester vẫn là phản ứng thuận nghịch. PHẢN ỨNG OXY HÓA
Thêm vào hỗn hợp sau phản ứng 100ml H SO
( làm trong tủ hút ) 2 4 20%
, khuấy thật đều bằng đũa thủy tinh rồi
cho từng lượng nhỏ (nhỏ giọt) H O 2
2 vừa thêm vừa khuấy cho đến khi dung dịch mất màu (chuyển sang màu trắng đục) thì ngưng.
Để nguội becher và làm lạnh dung dịch trong chậu nước, acid benzoic sẽ kết tinh, lọc khô sản phẩm dưới áp suất kém.
Kết tinh lại acid benzoic bằng nước.
Cho acid benzoic vừa lọc khô vào becher 100ml chứa một ít nước, đun nhẹ dung dịch cho đến nhiệt độ nóng
(vừa sôi), nếu acid benzoic chưa tan hết, thêm từ từ nước nóng đến khi tinh thể này tan hoàn toàn (ở nhiệt độ sôi).
Để nguội từ từ, acid benzoic sẽ kết tinh thành tinh thể hình kim. Lọc khô sản phẩm dưới áp suất kém.
Acid benzoic tinh khiết có nhiệt độ nóng chảy 122,4°C. TRẢ LỜI CÂU HỎI 1.
Công dụng của Na CO 2 3
Tạo môi trường base cho phản ứng xảy ra. 2. Công dụng của H O 2 2
Tác dụng khử, làm mất màu KMnO4 còn dư và MnO2 được tạo ra sau phản ứng 3.
Công dụng của bột tẩy
Làm chất hoạt động bề mặt do bột tẩy gồm một đầu ưa nước và một đầu ưa dầu, sẽ kéo các phân tử lại gần nhau
giúp phản ứng xảy ra dễ dàng hơn 4.
Tính hiệu suất của sản phẩm so với toluene C H + KMnO H COOK + MnO2 + H2O 4 → C 5CH 6 3 6 5 2C COOK + H → 2C H SO 6 5COOH + K 6H5 2SO4 2 4
d = 0,87g/ml → mtoluen = 0,87 x 5 = 4,35g toluen n 0,05 mol → m = 0,05 x 122 = 6,1g toluen axit benzoic (lý thuyết) m = 2,84g→ H% axit benzoic (thực tế) SẮC KÝ CỘT
1.1. Cách tiến hành và hiện tượng quan sát được
1.1.1. Chuẩn bị cột sắc ký
Sử dụng cọng kẽm nhồi một lớp bông gòn khoảng 1-2 mm vào đáy cột (không nhồi cứng). Lắp cột sắc ký vào giá
Cho 15ml dung môi ether dầu hỏa vào becher 100ml, thêm từ từ 5g silica gel vào và khuấy đều.
Cho silicagel vào cột sắc ký, mở khóa cho dung môi chảy (không nên gõ đều cột). Lưu ý luôn để dung môi
ngập trên silica gel. Sau khi cho hết silica gel, vẫn mở khóa để dung môi chảy từng giọt cho đến khi lớp
dung môi nằm trên silica gel khoảng 1mm thì khóa cột lại.
1.1.2. Trích ly sắc tố lá cây
Cho 5g lá cây đã rửa sạch, lau thật khô, cắt nhỏ vào cối rồi dùng chày nghiền nát.
Chuyển lá cây đã nghiền nát vào erlen 250ml có chứa sẵn 50ml hỗn hợp eter dầu hỏa:aceton với tỷ lệ 3:2, lắc
đều trong 10 phút, lọc lấy dịch trích và cho vào becher 100ml.
Cho dịch trích vào bình lóng, rửa bằng (20ml x 2 lần) nước cất, chuyển dịch trích vào erlen 50ml, làm
khan bằng Na2SO4 khan, lọc.
Đun cách thủy dịch trích đã làm khan để loại bớt dung môi, thu được một dung dịch sắc tố đậm đặc (khoảng
2ml). Dịch sắc tố này được đun để sắc ký bản mỏng và nạp vào cột sắc ký.
1.1.3. Nạp sắc tố vào cột sắc ký
Cho một ít mẫu sắc tố vào lọ đựng riêng để làm sắc ký bản mỏng, dùng ống nhỏ giọt để đưa mẫu sắc tố
vào đầu cột sắc ký, dùng ete dầu hỏa rửa thành cột và ống mao quản. Sau khi nạo xong, để yên 2 phút cho
mẫu được cân bằng với chất hấp phụ (silicagel) và dung môi giải ly (eter dầu hỏa). 1.1.4. Giải ly cột
Mở khóa cho dung môi chảy đến khi hh dung dịch sắc tố bằng với lớp chất hấp phụ thì nhẹ nhàng thêm
dung môi ete dầu hỏa vào đầu cột (thêm thật nhẹ nhàng), mở khóa và hứng phần dung môi chảy ra khỏi cột.
Liên tục cho dung môi ete dầu hỏa vào, sắc tố b -caroten
màu vàng sẽ di chuyển nhanh ra khỏi cột trước tiên,
hứng lấy phần sắc tố đó.
Sau khi sắc tố màu vàng ra khỏi cột, thay dung môi ete dầu hỏa bằng hệ dung môi ete dầu hỏa:etyl acetat (7:3).
Lúc này sắc tố chlorophyl màu xanh lục sẽ bắt đầu di chuyển xuống dưới, hứng lấy phần sắc tố đó. 1.2. Trả lời câu hỏi
1.2.1. Tại sao hỗn hợp mẫu chất sau khi nạp lên đầu cột cần được giải ly ngay, tránh ngưng quá trình giải ly một thời gian?
Vì nếu ngưng thì trật tự sắp xếp của các chất trong hỗn hợp sẽ bị xáo trộn làm cho sự tách không còn hiệu quả nữa.
1.2.2. Tại sao phải làm khan dịch trích trước khi nạp lên cột sắc ký?
Vì trong quá trình chuẩn bị ta sử dụng rất nhiều dung môi hữu cơ nên cần làm khan để loại bớt dung môi và
đồng thời để thu được một sắc tố đậm đặc.
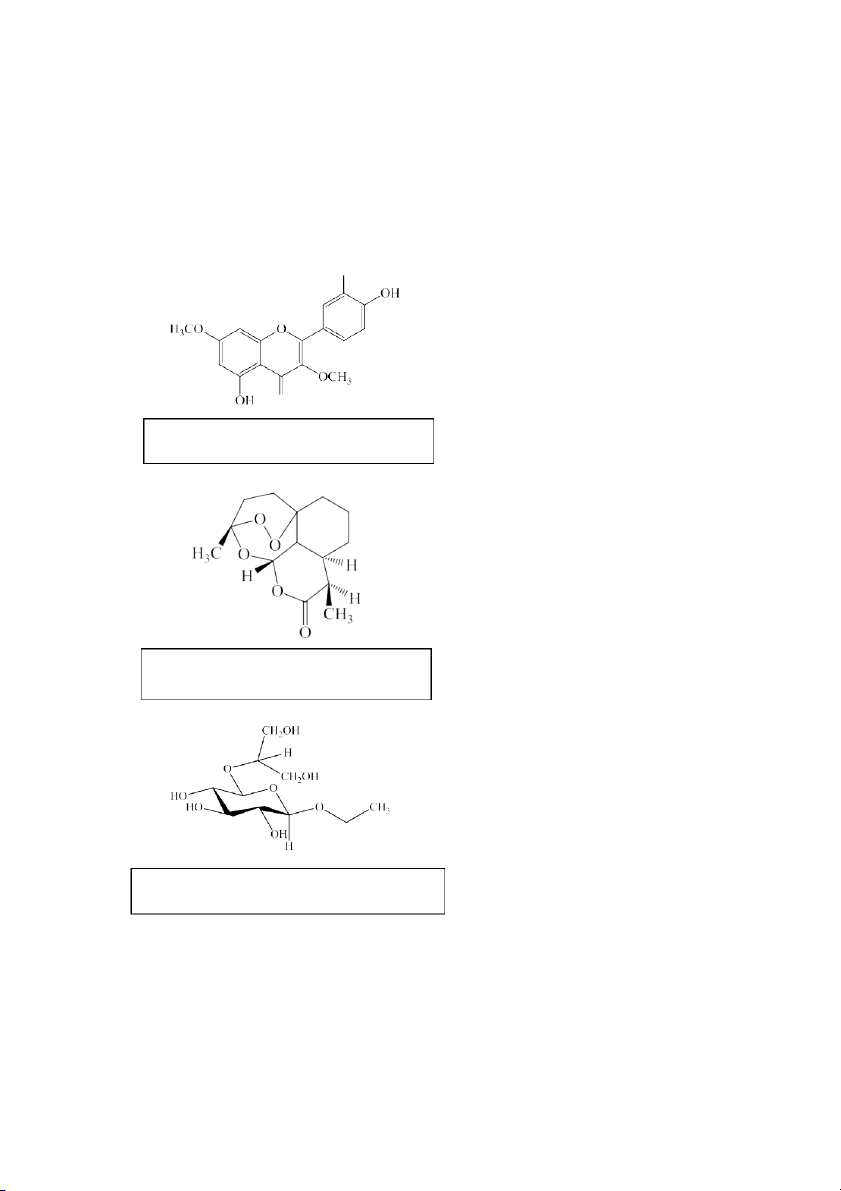
1.2.3 Dự đoán thứ tự ra khỏi cột của ba chất A,B,C
(A)2-(3,4-dihydroxyphenyl)-5-hydroxy- 3,7-dimethoxy-4H-chromen-4-one
(B) (3aS,9S,10aS)-3,9-dimethylldecahydro-2H-
6a,9-epidioxyxepino[4,3,2-ij]isochromen-2-one
(C) (2S,3S,4R,5R,6R)-2-((1,3-dihydroxypropan-2-
yl)oxy)-6-ethoxytetrahydro-2H-pyran-3,4,5-triol
Vì bản chất hóa học của bề mặt silica gel là những nhóm silanol-OH nên những chất phân cực hơn sẽ bị silica
gel giữ chặt lại và giải ly muộn hơn so với những chất khác vì có khả năng tạo liên kết hydrogen mạnh.
Thứ tự ra khỏi cột là: B A C. SẮC KÝ BẢN MỎNG 1.1. Cách tiến hành
1.1.1. Chuẩn bị bảng mỏng
Dùng bút chì đánh dấu trên mép vạch (vạch tiền tuyến) 0,5cm, dưới (vạch xuất phát) 1cm để định mức hẹ dung ly thấm nước
Dùng ống vi quản lần lượt chấm từng dung dịch lên tấm dưới tấm bảng mỏng thành 3 chấm: vết bên trái là
vanillin (chấm 2 lần), vết ở giữa là β-naphtol (chấm 2 lần), vết bên phải là sắc tố lá cây (chấm 3 lần). Chuẩn bị hai tấm bảng giống nhau.
2.1.2 Chuẩn bị bình triển khai
Lau thật sạch và khô bình triển khai (ly thủy tinh). Cắt một tấm giấy lọc đặt vào trong ly. −
Bản 1: giải ly với hệ 5ml ether dầu hỏa: acetat etyl (4:1) −
Bản 2: giải ly với hệ 5ml ether dầu hỏa: acetat etyl (2,5:2,5)
Cho 5ml hệ dung dịch vào bình. Đậy bình lại bằng tấm kiếng thủy tinh và để yên cho hệ dung dịch thấm ướt hết giấy lọc.
Cho bản mỏng vào bình triển khai, đậy nắp lại. Khi hệ dung môi thấm ướt đến mứt đánh dấu ở trên thì lấy bản mỏng ra.
2.1.3. Hiện hình bản mỏng và tính giá trị Rf
Khi hệ dung ly thấm ướt đến mức đánh dấu ở trên thì lấy bản mỏng ra. Để yên cho bản mỏng khô tự nhiên. Sau
khi để khô ta quan sát trên bản mỏng: − Bản 1:
+ Dung dịch Vanalin có màu hồng
+ Dung dịch β-napton không màu
+ Dung dịch chiết sắc tố lá cây có một vệt màu gồm nhiều màu (chủ yếu là vàng và xanh) − Bản 2:
+ Dung dịch Vanalin không có màu
+ Dung dịch β-napton không có màu
+ Dung dịch chiết sắc tố lá cây có một vệt màu gồm nhiều màu( chủ yếu là vàng và xanh) Cho Hiện hình bản mỏng và tính giá trị Rf
− Bản 1: bằng cách phun dung dịch FeCl3 rồi sấy khô, các vết dần hiện rõ ra.
+ Dung dịch Vanalin có màu hồng đậm. Rf = 0.25
+ Dung dịch β-napton có màu trắng. Rf = 0.475
+ Dung dịch chiết sắc tố có vệt gồm nhiều màu (chủ yếu xanh và vàng)
− Bản 2: Phun dung dịch H SO 2
4 đậm đặc, hơ bản trên bếp nóng.
+ Dung dịch Vanillin có màu đen. Rf = 0.625
+ Dung dịch β-napton có màu trắng. Rf = 0.8
+ Dung dịch chiết sắc tố gồm nhiều màu (chủ yếu xanh và vàng). 2.2. Trả lời câu hỏi
2.2.1. Tại sao phải đặt tờ giấy lọc vào bình sắc ký
Để kiểm tra độ bão hòa của hơi dung môi trong bình sắc ký.
2.2.2. Tại sao phải vạch lằn “mức tiền tuyến dung môi”? Để tiết kiệm (nhằm chấm được nhiều vết) có thể chấm
các vết sát lề bản mỏng được không? Tại sao?
Vạch lằn “mức tiền tuyến dung môi” để làm chỗ ta lấy bản sao cho không ảnh hưởng đến lớp silicagel trên
bản, nếu không có mức tiền tuyến ta sẽ chạm vào đường đi của bản mỏng và vô tình cung cấp tạp chất ảnh
hưởng đến hướng di chuyển của các chất.
Không thể chấm các vết sát lề bản mỏng được vì nếu chấm sát lề bản mỏng thì lúc này diện tích tiếp xúc
chính của chất là mặt bên bản mỏng. Nó rất nhỏ nên lực hút các chất vì vậy cũng nhỏ theo làm cho các
chất bên mặt bên cao hơn chất ở trên mặt trước làm cho giá trị Rf không chính xác.




