












Preview text:
Câu 2: Cách biểu diễn cấu trúc không gian của hchc, nêu các phương pháp,
phối cảnh, công thức Newman. Cho vd.
● Có 3 kiểu biểu diễn các phân tử trong không gian: -Công thức phối cảnh -Công thức Newman -Công thức Fischer
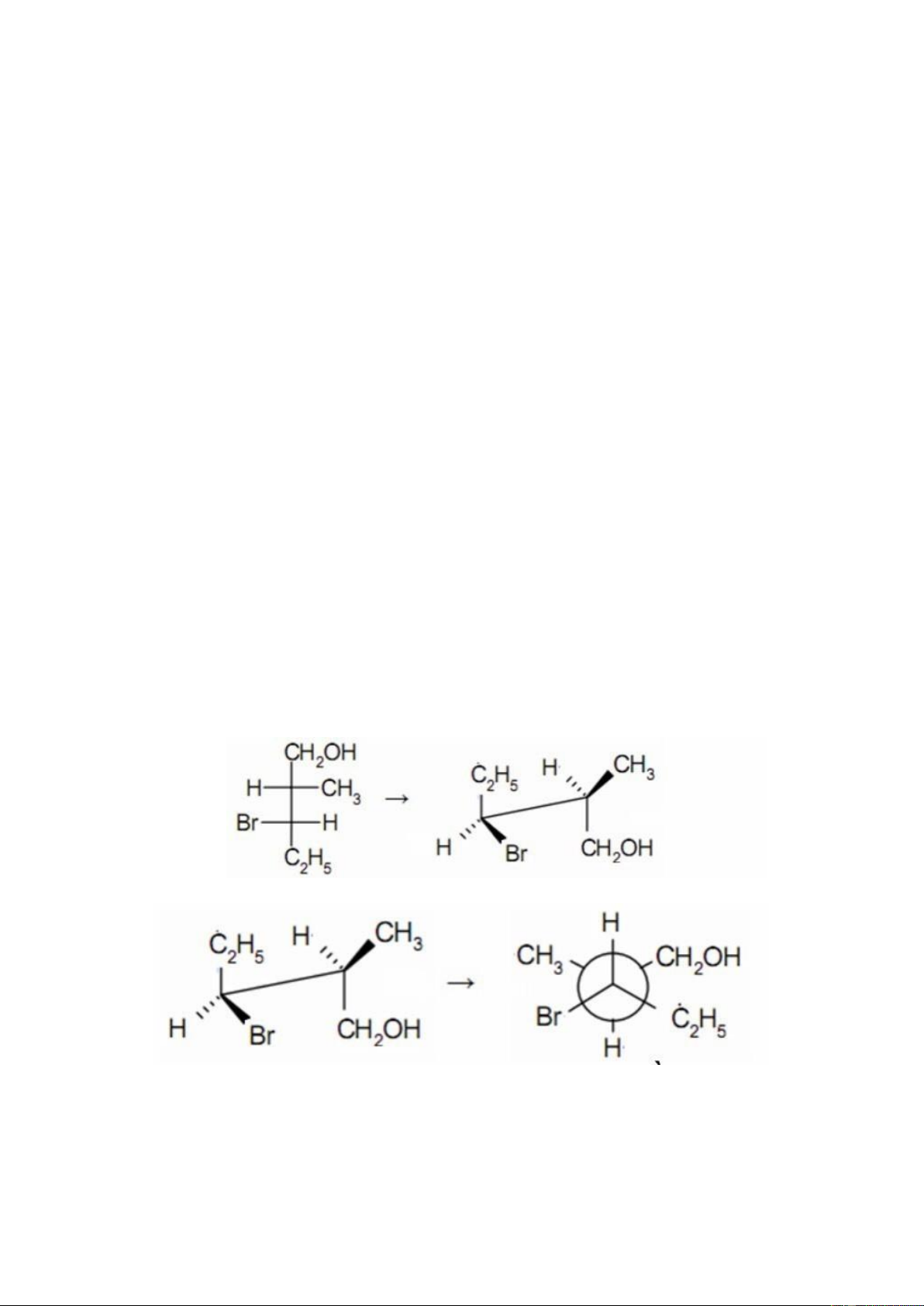
1. Phương pháp chuyển đổi từ công thức Fischer sang công thức phối
cảnh sang công thức Newman
2. Phương cháp chuyển đổi từ công thức Newman sang công thức phối
cảnh sang công thức Fischer
*từ CT phối cảnh qua Fischer
● Thực hiện các bước như sau:
-Đầu tiên, hợp chất được trình bày theo công thức phối cảnh ở cấu trạng lệch.
-Quay trục Cx——Cy một góc nào đó sao cho công thức ở cấu trạng che
khuất: các nhóm thế ở vị trí che khuất nhau từng đôi một. Việc quay như
vậy không làm thay đổi cấu hình tuyệt đối của carbon Cx và Cy nhưng
quay như thế để giúp thoả được mặt phẳng quy chiếu theo công thức Fischer
-Các nối nằm trong mặt phẳng (Cx—-Cy) và phía sau mặt phẳng (Cx—-
CH2OH và Cy—CHO) trong công thức phối cảnh sẽ được biểu diễn
bằng các vạch thẳng đứng trong công thức chiếu Fischer; các nối nằm
phía trước mặt phẳng (Cx—H; Cx—-OH; Cy—-H; Cy—-OH) được
biểu diễn bằng các vạch nằm ngang trong công thức chiếu Fischer.
● CT chuyển từ Fischer sang phối cảnh
● CT chuyển từ phối cảnh sang Newman
Câu 3: Đồng phân cấu dạng (trạng), cấu hình, nguyên nhân gây ra, vẽ các
cấu dạng bền với kém bền của hợp chất metyl, đimetyl, xiclohexan.
-Những hợp chất hữu cơ có cùng công thức phân tử nhưng có tính chất
khác nhau do phân bố các nhóm thế trong không gian khác nhau gọi là
đồng phân không gian hay đồng phân lập thể
- Tùy theo cách biến đổi giữa các đồng phân mà người ta phân biệt :
đồng phân cấu hình và đồng phân cấu trạng
- Đồng phân cấu trạng là các dạng khác nhau trong không gian của cùng
một cấu hình của một phân tử. Các đồng phân cấu trạng có được là do
một phần của phân tử quay chung quanh một nối đơn xích ma so với
phần còn lại của phân tử.
-Đồng phân cấu hình (diastereomer) là các đồng phân lập thể có cùng
công thức phân tử và công thức cấu tạo, nhưng khác nhau về cách sắp xếp
không gian của các nhóm nguyên tử xung quanh các nguyên tử trung tâm.
Không giống như đồng phân hình học (còn gọi là đồng phân cis-trans),
các đồng phân cấu hình không phải là ảnh gương của nhau.
- Ứng với một cấu hình cho sẵn có thể có nhiều đồng phân cấu trạng,
nhưng với một cấu trạng cho sẵn nào đó ứng với một cấu hình duy nhất.
- Một đồng phân cấu trạng này có thể chuyển thành đồng phân quang
học kia một cách dễ dàng mà không có sự đứt nối hoá trị nào cả
- Khi chuyển đổi từ một đồng phân này qua một đồng phân khác mà
không nhất thiết phải có sự đứt nối xích ma hoặc nối pi, mà sẽ có một sự thay đổi về cấu hình.
- Trong đồng phân cấu hình, các đồng phân không thể chuyển đổi qua
lại cho nhau như các đồng phân cấu trạng. Đồng phân cấu hình gồm
đồng phân hình học và đồng phân quang học.
Nguyên nhân chính gây ra đồng phân cấu hình là do sự hiện diện của các
trung tâm lập thể (chiral centers) hoặc các cấu trúc không thể tự do xoay
quanh trục liên kết, chẳng hạn như nối đôi C=C hoặc vòng trong phân tử.
Câu 4: Danh pháp RS, cistran, khái niệm và quy tắc xác định áp dụng cho vd Khái niệm
Hai nhóm thế giống nhau hoặc tương tự giống nhau của mỗi nguyên tử
carbon mang nối đôi (hoặc vòng no) mà về khác phía của liên kết đôi
(hoặc vòng no) gọi là đồng phân trans.
Hai nhóm thế giống nhau hoặc tương tự giống nhau của mỗi nguyên tử
carbon mang nối đôi (hoặc vòng no) mà về cùng một phía của liên kết đôi
(hoặc vòng no) gọi là đồng phân cis.
Muốn xác định cấu hình R/S của 1 carbon sp3 mang bốn nhóm thế
a,b,c,d khác nhau, giả sử a>b>c>d. Nhìn carbon thủ tính theo hướng
carbon C đến nhóm có thứ tự ưu tiên thấp nhất C-d, xét vị trí sắp xếp
của ba nhóm a,b,c còn lại. Nếu ( a-> b-> c theo chiều quay chiều kim
đồng hồ thì carbon đó có cấu hình R, còn nếu ngược chiều kim đồng hồ
thì cấu hình đó là S) Vd:…. axC=Cay
a nằm cùng phía với mặt phẳng pi -> cis còn khác phía -> trans.
Câu 5: Đồng phân quang học, khái niệm, nguyên nhân, đối quang, xuyên
lập thể phân, hỗn hợp Rasemic, hợp chất Meso là gì? Cho vd, nguồn gốc
nhận biết tính chất đối xứng gương là gì? Cho vd
Đồng phân quang học là đồng phân gây ra do vị trí khác nhau của các
nguyên tử hay nhóm nguyên tử trong không gian làm cho mặt phẳng ánh
sáng phân cực quay 1 góc alpha nào đó.
2 chất đối quang giống như bàn tay phải và bàn tay trái đối xứng với
nhau như vật và ảnh của nó trong gương nhưng không phải là 1 vì không
thể chồng khít lên nhau đc
-Nguyên nhân: điều kiện để xảy ra đồng phân quang học là các chất có
phân tử cấu trúc bất đối xứng trong đó có thể bất đối xứng phân tử hoặc
có nguyên tử C bất đối xứng.
- Nếu hợp chất hữu cơ có n C* thì có thể có tối đa 2n đồng phân quang học.
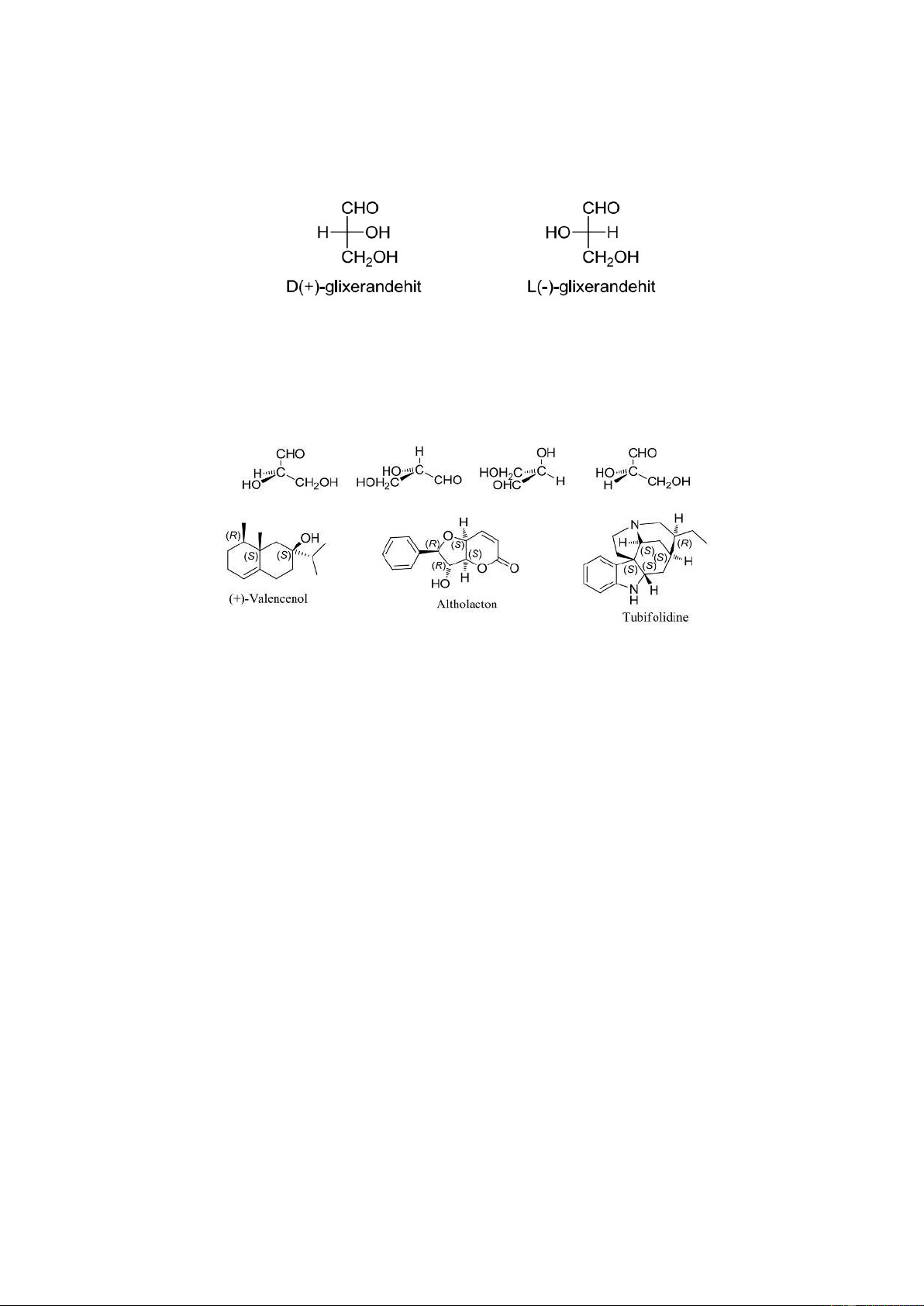
- Đồng phân đối quang: hai đồng phân quang học có cùng giá trị góc
quay cực riêng nhưng ngược dấu nhau gọi là hai đồng phân đối quang.
( Ví dụ: D-glixeranđehit: [α] 25 D= +8,7. L-glixeranđehit: [α] 25 D= -8,7)
-Hợp chất meso là các đp quang học có chứa nhiều C* nhưng do có mặt
phẳng đx hoặc có tâm đx nên không có tính quang hoạt.
-Biến thể raxemic - Hỗn hợp của hai đối quang với số mol bằng nhau
được gọi là biến thể raxemic. Hỗn hợp raxemic gồm hai loại phân tử đx
nhau qua gương, loại này làm quay mp sang trái, loại kia làm quay mp
sang phải với cùng độ lớn, nên chúng triệt tiêu lẫn nhau, do đó hh
raxemic cũng ko có tính quang hoạt. Ví dụ một hh đẳng phân tử của axit
(-)- và axit (+)-tactric, kí hiệu là axit (±)-tactric (tài liệu cũ: (d,l)), không có tính quang hoạt.
Câu 6: Tính quang hoạt là gì? Điều kiện, sơ đồ thí nghiệm, công thức
tính đối quay cực riêng, năng lực truyền quang và các yếu tố ảnh hưởng
Khái niệm tính quang hoạt: những chất (dạng tinh thể hay dung dịch) khi
đặt trên đương truyền của ánh sáng phân cực thẳng thì làm quay mặt
phẳng phân cực một góc α nào đó gọi là chất quang hoạt. Khả năng làm
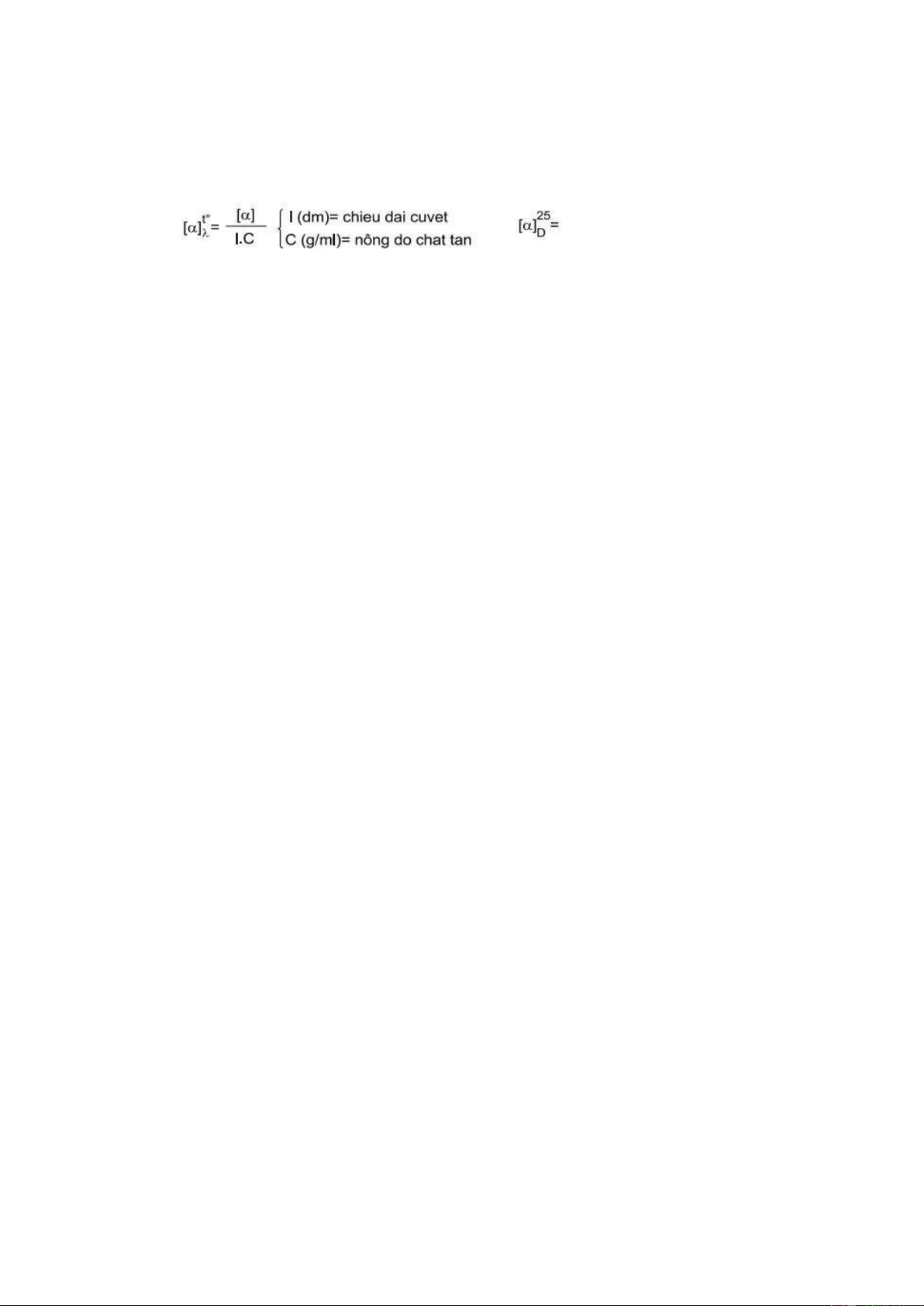
quay mặt phẳng ánh sáng phân cực được gọi là tính hoạt động quang hay tính quang hoạt. • Góc quay cực riêng:
• Góc quay mặt phẳng ánh sáng phân cực α được xác định bằng phân cực
kế. Giá trị của góc α phụ thuộc vào điều kiện đo: bước sóng của tia sáng
phân cực, nhiệt độ, bề dày của lớp chất mà ánh sáng đi phân cực đi qua
và nồng độ của chất quang hoạt.
• Để đặc trưng cho tính quang hoạt của một chất, người ta dùng đại
lượng: độ/góc quay cực riêng. Giá trị góc quay cực riêng của một chất
trong dung dịch được tính như sau:
Ví dụ: D-glixeranđehit: [α] 20 D= +14, [α] 25 D= +8,7. L-glixerandehit: [α]20 D= -14, [α]25 D= -8,7
Điều kiện để một chất có tính quang hoạt: có tính không trùng vật ảnh
↔ không có tâm và mp đối xứng. Năng lực triền quang
b) Đo năng lực triền quang ([a]p, Specific rotation, Độ quay cực riêng)
Để có thể so sánh các kết quả thực nghiệm với nhau, người ta đề xuất
điều kiện chuẩn về đo năng lực triền quang.
Năng lực triền quang, [a]p, của một hợp chất nào đó là góc quay quan sát
được khi đo mẫu với với nồng độ c là 1 g/mL bằng ánh sáng có bước
sóng 589.6 nanomét (nm; 1 nm = 10 m). Ánh sáng có bước sóng 589.6
nm còn được gọi là ánh sáng vàng D của đèn sodium (Na).
Trên thực tế, góc quay a quan sát được trên triền quang kế phụ thuộc vào
số lượng phân tử thủ tính được gặp ánh sáng phân cực phẳng. Giá trị này
thay đổi tùy vào bước sóng của nguồn sáng sử dụng, nhiệt độ lúc đo,
nồng độ mẫu đo, chiều dài ống đo, Thí dụ nếu tăng gấp đôi nồng độ mẫu,
góc quay đo được sẽ có giá trị gấp đôi. Nếu giữ nguyên nồng độ mẫu
nhưng sử dụng ống đo dài gấp đôi thì góc quay sẽ tăng gấp đôi.
Câu 7: Danh pháp DL, critro, trell là gì? Trình bày cách xác định, cho vd.
Mối quan hệ như thế nào với RS, DL hay không? Trình bày ưu và nhược
điểm của từng danh pháp đó.
1. Danh pháp DL (D-L Nomenclature)
Danh pháp D-L (hay danh pháp Fischer) được sử dụng để chỉ định cấu
hình của các hợp chất hữu cơ, đặc biệt là các hợp chất chứa carbon bất
đối xứng như đường và axit amin.
Dạng D và L:
D- (Dextrorotary): Một chất được gọi là D- nếu nhóm chức chính (như
nhóm hydroxyl trong đường) nằm ở bên phải khi viết công thức cấu hình Fischer.
L- (Levorotary): Một chất được gọi là L- nếu nhóm chức chính nằm ở
bên trái khi viết công thức cấu hình Fischer. Ví dụ
D-Glucose: Nhóm hydroxyl (OH) ở carbon số 5 nằm bên phải trong công thức Fischer.
L-Alanine: Nhóm amino (NH2) ở carbon bất đối xứng nằm bên trái trong công thức Fischer.
Hệ danh pháp D,L: dựa vào cấu hình tương đối của phân tử hchc. Gọi là
cấu hình tương đối vì khi đó cấu hình của phân tử được so sánh với cấu
hình của một chất được chọn làm chuẩn. Đó là glixeranđehit.
Lưu ý: không có mối liên quan nào giữa cấu hình tương đối D, L với
cấu hình tuyệt đối R,S. Cấu hình tuyệt đối (R, S, Z, E) viết trong
ngoặc, in nghiêng, cấu hình tương đối (D, L) viết thường, không có ngoặc. Danh pháp eritro treo
Danh pháp này rất xưa, thường áp dụng cho các hợp chất có
mang hai carbon thủ tính kề nhau. Các nhóm thế của carbon được
sắp xếp theo độ lớn: lớn (L); vừa (V) và nhỏ (N), rồi xét hai nhóm
vừa và nhỏ, xem chúng ở cùng bên (sẽ là eritro) hoặc hai bên (sẽ
là treo) so với trục thẳng đứng của công thức chiếu Fischer.
Câu 8: Liên kết H, liên kết yếu, khái niệm, bản chất, điều kiện, ứng dụng
để giải thích tính chất vật lí, tính chất hóa học và chiều hướng phản ứng như thế nào? Cho vd.
Khái niệm: Là liên kết đc hình thành giữa một nguyên tử H đã tham gia
liên kết cộng hóa trị với một nguyên tử khác cũng đã tham gia liên kết
cộng hóa trị và còn chứa cặp electron tự do
– Bản chất liên kết hydrogen là tĩnh điện. Tương tác hút tĩnh điện xảy ra
giữa Hδ+ và Yδ– chính là bản chất của liên kết hydrogen.
Câu 9: Đồng phân cistran trong nối đôi và trong vòng no, ss tính chất vật
lí, nhiệt độ nóng chảy, nhiệt độ sôi, momen lưỡng cực. Cho vd.
❖ Tính chất vật lý ● Sự Giống Nhau:
1. Cùng cấu trúc phân tử: Cả đồng phân cis và trans đều có cùng một số
lượng nguyên tử và liên kết hoá học.
2. Cùng công thức phân tử: Cả hai loại đồng phân đều có cùng một công thức hóa học. ● Sự Khác Biệt:
1. Điểm nóng chảy và sôi
• Đồng phân cis thường có điểm nóng chảy và sôi cao hơn so với đồng
phân trans do cấu trúc không gian của chúng. 2. Độ tan trong dung môi:
Có thể có sự khác biệt về độ tan trong dung môi giữa cis và trans.
Thường thì một trong hai có thể tan tốt hơn trong một dung môi nào đó so
với cái kia, tùy thuộc vào cấu trúc cụ thể của từng phân tử. 3. Tính chất phân cực:
Đồng phân cis thường có tính phân cực cao hơn so với đồng phân trans,
điều này có thể ảnh hưởng đến khả năng tương tác với các dung môi phân cực. 4. Tính chất magnet:
Có thể có sự khác biệt về tính chất magnet giữa đồng phân cis và trans,
dựa vào cấu trúc không gian và khả năng tạo cấu trúc electron. 5. Tính chất khác:
Cấu trúc không gian khác nhau có thể ảnh hưởng đến các tính chất khác
như tính linh hoạt của phân tử, khả năng tạo tinh thể, và các tính chất vật lý khác.
❖ Nhiệt độ nóng chảy ● Giống nhau:
1. Cả đồng phân cis và trans đều có cùng một số lượng nguyên tử và liên
kết hoá học, do đó có cùng một hạt khối.
2. Cả hai đồng phân đều có cùng một công thức hóa học. ● Khác nhau:
1. Nhiệt độ nóng chảy của đồng phân cis thường cao hơn so với đồng
phân trans. Điều này có thể
do cấu trúc không gian của đồng phân cis tạo ra các tương tác mạnh hơn
giữa các phân tử, làm tăng nhiệt độ nóng chảy.
2. Đồng phân trans thường có cấu trúc phân tử đặc hơn, dẫn đến mật độ
phân tử cao hơn và do đó có thể có nhiệt độ nóng chảy thấp hơn. ❖ Nhiệt độ sôi ● Giống nhau:
1. Cả đồng phân cis và trans đều có cùng một số lượng nguyên tử và liên kết hoá học, do đó có cùng một hạt khối.
2. Cả hai đồng phân đều có cùng một công thức hóa học. ● Khác nhau:
1. Nhiệt độ sôi của đồng phân cis thường cao hơn so với đồng phân trans.
Điều này có thể do cấu
trúc không gian của đồng phân cis tạo ra các tương tác tương đối mạnh
giữa các phân tử, làm tăng nhiệt độ sôi.
2. Cấu trúc không gian của đồng phân trans thường ít chứa các tương tác
giữa các phân tử hơn, dẫn đến nhiệt độ sôi thấp hơn so với đồng phân cis. ❖ Momen lưỡng cực ● Giống nhau:
1. Cả đồng phân cis và trans đều có các nguyên tử có điện tích không
đồng nhất (ví dụ như oxy, nitơ, hoặc clo), tạo điều kiện cho việc tạo ra momen lưỡng cực. ● Khác nhau:
1. Đồng phân cis thường có momen lưỡng cực lớn hơn so với đồng phân
trans. Điều này là do trong đồng phân cis, các nhóm chức có thể tạo ra
các tương tác phân cực mạnh hơn khi chúng ở gần nhau trên cùng một
bên của vòng hoặc liên kết.
2. Trong đồng phân trans, các nhóm chức có xu hướng chia xa nhau ở hai bên của vòng hoặc liên
kết, giảm sự tương tác phân cực giữa chúng và do đó giảm đi momen lưỡng cực.
Câu 11: Hiệu ứng liên hợp, hiệu ứng cảm ứng, siêu tiếp cách: định nghĩa,
phân loại, ứng dụng. Cho vd và vẽ công thức cộng hưởng.
❖ Định nghĩa ● Siêu tiếp cách
Các nhóm alkil gắn vào một hệ thống bất bão hòa (C=C; C=O; C=N..) sẽ
có hoạt tính cho điện tử. Đôi điện tử nối của nối đơn ở (nối C-H) của
nhóm alkil này có tính linh động một phần, có thể có sự cộng hưởng với
hệ thống n; sự cộng hưởng như vậy được gọi là hiệu ứng siêu tiếp cách. ● Hiệu ứng liên hợp
Hệ liên hợp là hệ thống bao gồm các liên kết đôi luân phiên với các liên
kết đơn ( liên hợp π, π), hoặc hệ thống có nguyên tử còn cặp electron tự
do nối với một liên kết đôi ( liên hợp p, π ): ● Hiệu ứng cảm ứng
Sự phân cực phân tử do sự dịch chuyển mật độ các electron o mà nguyên
nhân là do sự khác nhau về độ âm điện được gọi là ảnh hưởng cảm ứng
hay hiệu ứng cảm ứng. Kí hiệu I ( Inductive effect ) ❖ Phân loại: ● Hiệu ứng liên hợp:
Hiệu ứng liên hợp dương +C: Gây nên bởi các nhóm có khả năng đẩy
electron. Hiệu ứng +C thường gặp ở các hệ liên hợp p, 77 có dạng chung:
Trong đó X = -OH, -OR, -NH2, -NHR, -NR,, các halogen,... Chiều dịch
chuyển electron là từ nhóm thế X về phía liên kết π
Hiệu ứng liên hợp âm -C. Gây nên bởi các nhóm có khả năng hút
electron. Hiệu ứng -C thường gặp ở các hệ liên hợp n,tr có chứa các nhóm không no có dạng:
Trong đó C=Y là: -NO2, -COOH, -COOR, -CHO, CO, ... Chiều dịch
chuyển electron từ phía liên kết đôi tới nhóm C=Y ● Hiệu ứng cảm ứng
Hiệu ứng cảm ứng dương + thường gặp ở các nhóm ankyl và các nhóm
mang điện tích âm, nhóm ankyl càng dài, càng phân nhánh hiệu ứng +I càng mạnh: +I I = 0 -I
Hiệu ứng cảm ứng âm – thường gặp ở các nhóm không no, các nhóm
mang điện tích dương, các nguyên tử có độ âm điện lớn. Nguyên tử,
nhóm nguyên tử có độ âm điện càng lớn hiệu ứng – càng mạnh: -F> -CI > -Br>-I
-F > -OR > -NR2 > -CR3
Câu 12: Phản ứng thế eletrophin (SE) là gì? Vd phản ứng thế SE thường
gặp. Trình bày ảnh hưởng của các nhóm thế trên nhân thơm. Cho vd.
Phản ứng thế SE là sự tấn công của electrophin cation hay đầu dương của
lưỡng cực vào trung tâm giàu electron của nhân thơm. Thường gặp trong
các hệ thơm và ít gây ra ảnh hưởng về sự thay đổi cấu hình nhưng nó lại
làm thay đổi nhiều về sự định hướng nhóm thế.
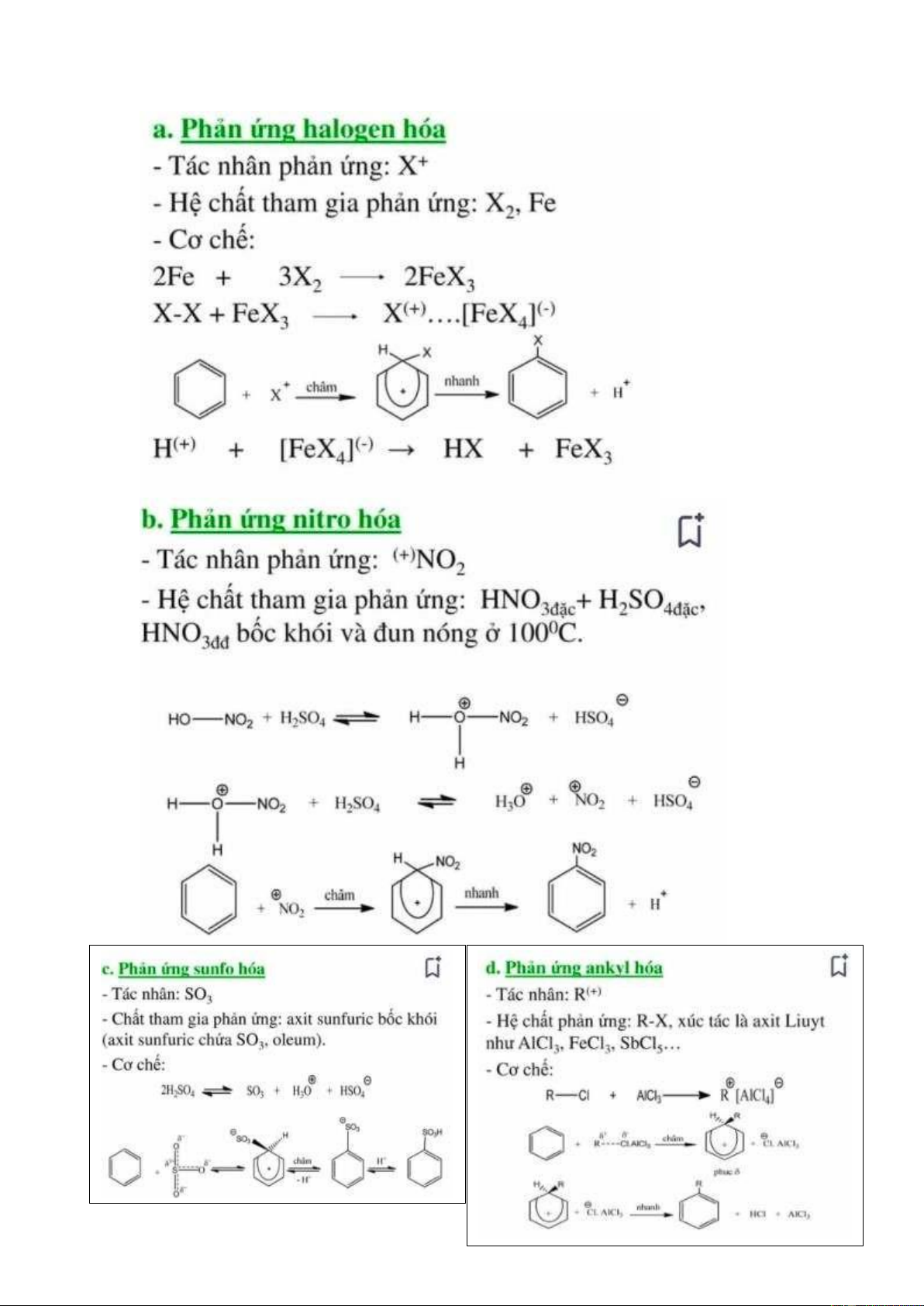
Một số phản ứng thế electrophin thường gặp: + Phản ứng Halogen hoá + Phản ứng nitro hoá + Phản ứng ankyl hoá + Phản ứng axyl hoá + Phản ứng Sunfo hoá
Sự định hướng của các nhóm thế trên nhân thơm:
+ Các nhóm hoạt hoá nhân thơm: định hướng nhóm thế vào vị trí para và
ortho + Các nhóm phản hoạn hoá nhân thơm: định hướng nhóm thế vào vị trí meta
*Lưu ý: Halogen là nhóm phản hoạt hoá nhân thơm, nhưng định hướng
nhóm thế vào vị trí o, p
*Nếu 2 nhóm thế đều là hoạt hoá, nhóm nào hoạt hoá mạnh hơn sẽ chiếm
ưu thế hơn trong sự định hướng
*Nếu là 2 nhóm, 1 nhóm hoạt hoá, 1 nhóm phản hoạt hoá, thì nhóm hoạt
hoá sẽ chiếm ưu thế trong sự định hướng VD
Câu 13: Định nghĩa, phân loại axit, bazo hữu cơ. Cho vd. Áp dụng ss tính
chất bazo, axit của các hợp chất hữu cơ và giải thích.
1. Axit Hữu Cơ: ❖ Định nghĩa
Acid Lewis: Acid Lewis là một chất, mà một nguyên tử nào đó của
này có vân đạo ngoại biên chưa đầy đủ điện tử, nên chất này có
khả năng nhận thêm đôi điện tử ❖ Phân loại:
1. Axit Carboxylic: Là dạng phổ biến nhất của axit hữu cơ, có một nhóm
carboxyl (-COOH). Ví dụ: axetic acid (CH3COOH), formic acid (HCOOH).
2. Axit Phenolic: Có một nhóm hydroxyl (-OH) gắn trực tiếp với nhân
phenol. Ví dụ: phenol (C6H5OH), salicylic acid (CH(OH)COOH).
3. Axit Sulphonic: Có một nhóm sulfonic (-SO3H). Ví dụ:
benzenesulfonic acid (C.H5SO3H), para-toluenesulfonic acid (CH3C6H4SO3H). 2. Bazơ Hữu Cơ: ❖ Định nghĩa
Base Lewis : là những chất có mang đôi điện tử tự do, . những
chất này sẽ sử dụng đôi diện tử tự do của mình để tạo nối với các
acid Lewis; với các cation; với các chất khác có đôi điện tử π ❖ Phân loại:
1. Amine: Là các dẫn xuất của amoniac (NH3) bằng cách thay thế một
hoặc nhiều nguyên tử hydro bằng nhóm hữu cơ. Phân loại thường dựa
trên số lượng nhóm amino và nhóm hữu cơ. Ví dụ: methylamine
(CH3NH2), ethylamine (C6H5NH2), aniline (CH5NH2).
2. Amine Teritary: Các hợp chất chứa một nhóm amino và hai nhóm hữu
cơ gắn trực tiếp với nguyên tử nitơ. Ví dụ:
trimethylamine (N(CH3)3), triethylamine (N(C2H5)3).
3. Amine Secondary: Các hợp chất chứa một nhóm amino và một nhóm
hữu cơ gắn trực tiếp với nguyên tử nitơ.
Ví dụ: dimethylamine (CH3)2NH, diethylamine (C2H5)2NH. ● Giống nhau: 1. Định nghĩa
Axit: Hợp chất có khả năng cho proton (H+) hoặc nhận cặp electron.
Bazơ: Hợp chất có khả năng nhận proton (H+) hoặc cho cặp electron. 2. Phản ứng hóa học:
Cả axit và bazơ đều tham gia vào phản ứng trung hòa để tạo thành muối và nước.
Cả hai đều tham gia vào các phản ứng trao đổi proton. 3. Tính chất hóa học:
Tính chất axit và bazơ đều có thể được xác định bằng các chỉ thị pH. Axit
làm đổi màu chỉ thị sang màu đặc trưng (thường là đỏ), trong khi bazơ
làm đổi màu chỉ thị sang màu khác (thường là xanh).
Cả axit và bazơ đều có thể phản ứng với kim loại, oxit, và hydroxide để
tạo thành các sản phẩm đặc trưng. ● Khác nhau:
1. Nhóm chức và cấu trúc phân tử:
• Axit hữu cơ: Thường chứa nhóm chức -COOH (như axit acetic
CH3COOH) hoặc nhóm phenol (-OH gắn với vòng benzen như phenol CH5OH).
Bazơ hữu cơ: Thường chứa nhóm chức amin (-NH2, -NHR, -NR2) như anilin (CH5NH2).
2. Cơ chế phản ứng:
• Axit hữu cơ: Cho proton (H+). Ví dụ: CH3COOH → CH3COO- + H+.
• Bazơ hữu cơ: Nhận proton (H+). Ví dụ: NH3 + H+
3. Độ mạnh yếu:
Axit hữu cơ: Độ mạnh phụ thuộc vào khả năng cho proton và cấu trúc
phân tử. Axit carboxylic thường mạnh hơn phenol và rượu.
Bazơ hữu cơ: Độ mạnh phụ thuộc vào khả năng nhận proton và cấu trúc
phân tử. Amin bậc 1, 2, 3 có độ bazơ khác nhau do hiệu ứng điện tử và
không gian của nhóm thế.
4. Ảnh hưởng của nhóm thế:
• Axit hữu cơ: Nhóm thế hút electron (như -NO2) làm tăng tính axit, còn
nhóm thế đẩy electron (như -CH ) làm giảm tính axit. 3
Bazơ hữu cơ: Nhóm thế đẩy electron (như -CH3) làm tăng tính bazơ, còn
nhóm thể hút electron (như -NO ) làm giảm tính bazơ. 2
5. Ứng dụng trong tổng hợp hóa học:
Axit hữu cơ: Thường được dùng trong tổng hợp ester, anhydrid, và amide.
Bazơ hữu cơ: Thường được dùng làm chất xúc tác, dung môi, hoặc trong
tổng hợp các hợp chất hữu cơ như amid và nitro hợp chất.
Câu 14: Dung môi phân cực proton, dung môi phân cực phi proton, phân
cực, không phân cực. Cho vd.
❖ Dung môi phân cực proton (Protic Polar Solvent)
● Định nghĩa: Dung môi phân cực proton là những dung môi có khả năng
tạo liên kết hydrogen vì chúng chứa nguyên tử hydro liên kết với nguyên
tử có độ âm điện cao (như oxy hoặc nitơ).
● Đặc điểm:
• Có liên kết hydro (H).
• Độ phân cực cao do sự chênh lệch lớn về độ âm điện giữa các nguyên tử.
• Thường có hằng số điện môi cao. ● Ví dụ: +Nước (H2O) +Methanol (CH3OH) +Ethanol (C2H5OH) +Axit acetic (CH3COOH) ● Ứng dụng:
Dung môi trong phản ứng hóa học, đặc biệt là các phản ứng axit-bazơ và
phản ứng tạo liên kết hydro.
Tác nhân tốt cho các ion hóa học và các phân tử phân cực.
❖ Dung môi phân cực phi proton (Aprotic Polar Solvent)
● Định nghĩa: Dung môi phân cực phi proton là những dung môi có độ
phân cực cao nhưng không chứa hydro có khả năng tạo liên kết hydrogen.
● Đặc điểm:
Không có liên kết hydro (H). Độ phân cực cao.
Thường có hằng số điện môi cao. ● Ví dụ: +Acetone (CH3COCH3)
+Dimethyl sulfoxide (DMSO, (CH3)2SO)
+Dimethylformamide (DMF, HCON(CH3)2 ) +Acetonitrile (CH3CN) Ứng dụng:
Dung môi trong các phản ứng nucleophilic substitution (SN2).
Phân cực tốt cho các phân tử và ion phân cực.
❖ Dung môi phân cực
● Định nghĩa: Dung môi phân cực là các dung môi có một lưỡng cực
điện, nghĩa là có sự chênh lệch lớn về độ âm điện giữa các nguyên tử
trong phân tử, dẫn đến sự phân bố không đều của điện tích.
● Đặc điểm:
• Có lưỡng cực điện
• Tương tác mạnh với các chất phân cực khác
• Hòa tan tốt các chất ion và phân cực ● Ví dụ:
• Tất cả các dung môi phân cực proton và phi proton đều thuộc nhóm này. ● Ứng dụng:
• Hòa tan các chất phân cực và ion.
• Sử dụng trong các phản ứng hóa học yêu cầu môi trường phân cực.
❖ Dung môi không phân cực
● Định nghĩa: Dung môi không phân cực là các dung môi không có
lưỡng cực điện rõ ràng, nghĩa là không có sự chênh lệch lớn về độ âm
điện giữa các nguyên tử trong phân tử.
● Đặc điểm:
• Không có lưỡng cực điện hoặc rất nhỏ.
• Tương tác yếu với các chất phân cực.
• Hòa tan tốt các chất không phân cực. ● Ví dụ: • Hexane (C6H14) • Benzene (C6H6) • Toluene (C7H8) • Diethyl ether (C4H10O) ● Ứng dụng:
• Hòa tan các chất không phân cực.
• Sử dụng trong các phản ứng và quá trình chiết xuất không phân cực.
Câu 15: Tác nhân nucluphin ( phân hạch ), eletrophin (phân điện tử). Cho vd.
● Tác nhân nucleophin (Nucleophin).
Nucleophil là các phân tử hoặc ion có mật độ điện tử cao và có khả năng
tấn công các tâm điện tử nghèo (các tâm tích điện dương hoặc phần tử
tích điện dương) trong phân tử khác. Nucleophil thường có một cặp điện
tử tự do hoặc liên kết pi mà chúng có thể sử dụng để tạo liên kết mới.
● Đặc điểm của nucleophil:
• Có cặp điện tử tự do hoặc liên kết pi.
• Thường là các anion hoặc các phân tử trung hòa có cặp điện tử tự do.
❖ Ví dụ về nucleophil: lon hydroxide (OH) lon cyanide (CN) Nước (H2O) Amoniac (NH3) Anion halide (Cl-, Br-, I )
● Tác nhân electrophil (Electrophile)
Electrophil là các phân tử hoặc ion có mật độ điện tử thấp và có khả năng
nhận cặp điện tử từ nucleophil. Electrophil thường có một tâm tích điện
dương hoặc phần tử tích điện dương, hoặc có một vùng trống để nhận cặp điện tử.
● Đặc điểm của electrophil:
Có thiếu hụt điện tử hoặc vùng trống để nhậnz cặp điện tử.
Thường là các cation hoặc các phân tử trung hòa có vùng trống điện tử.
❖ Ví dụ về electrophil: lon hydronium (H+) lon halogen (Cl2, Br2) lon carbocation (R3C+) Axit Lewis như BF3, AlCl3
Câu 16: Trình bày cơ chế phản ứng, và biểu thức vận tốc SN1, SN2,E1,E2
Các yếu tố ảnh hưởng và sự cạnh tranh giữa chúng. Cho vd.
● Cơ chế phản ứng S1N
- Giai đoạn đầu là giai đoạn ion hóa tạo ra ion, xảy ra chậm, cho nên tốc
độ ion hóa cũng là tốc độ của phản ứng
- Giai đoạn hai có tính chất ion tương tác nên được thực hiện nhanh.
Trước khi thực hiện giai đoạn hai ion cacbonyl ở trung tâm sẽ chuyển từ
trạng thái tứ diện sang trang thái mặt phẳng bên hơn. Nhờ vậy nhóm OH
có xác suất tấn công vào hai phía như nhau
● Ảnh hưởng
1. Cấu trúc chất nền: Carbocation càng ổn định, phản ứng càng dễ xảy ra
(bậc ba > bậc hai > bậc một).
2. Nhóm ra đi: Nhóm ra đi tốt (như I, Br, TsO) giúp phản ứng dễ xảy ra.
3. Dung môi: Dung môi phân cực proton (như nước, methanol) giúp ổn
định carbocation và nhóm ra đi.
4. Nucleophile: Nucleophile yếu cũng có thể tham gia vì không ảnh
hưởng đến bước quyết định tốc độ.
5. Nhiệt độ: Nhiệt độ cao làm tăng tốc độ phản ứng.
6. Hiệu ứng không gian: Ít cản trở lập thể giúp phản ứng S1 dễ xảy ra hơn N so với S2 . N
● Cơ chế phản ứng S2N
- Giai đoạn chậm nhất là giai đoạn tạo thành TTCT có sự tham gia của
CH3Cl và ion OH- , theo thuyết TTCT ba trung tâm phản ứng OH,C và
Cl ở TTCT phải nằm trên một đường thẳng. Đó là điều kiện đảm bảo
năng lượng tiêu tốn cho phản ứng cực tiểu. Khi liên kết OH và C đạt đến
hàng rào năng lượng chuyển tiếp thì Cl tách ra khỏi C. ● Ảnh hưởng
1. Cấu trúc chất nền: Chất nền ít cản trở lập thể sẽ phản ứng nhanh hơn
(Methyl > Bậc nhất > Bậc hai).
2. Nhóm ra đi: Nhóm ra đi tốt (như I, Br, TsO) giúp phản ứng dễ xảy ra.
3. Nucleophile: Nucleophile mạnh (như OH, CN) làm tăng tốc độ phản ứng.
4. Dung môi: Dung môi phân cực phi proton (như acetone, DMSO) giúp
tăng tốc độ phản ứng.
5. Hiệu ứng không gian: Ít cản trở lập thể giúp phản ứng S2 dễ xảy ra N hơn.
6. Nhiệt độ: Nhiệt độ cao làm tăng tốc độ phản ứng, nhưng cần cẩn thận
để tránh các phản ứng phụ. S2 S1 N N Chất nền
Thích hợp cho CH3-X Thích hợp cho chất nền
VÀ R-X nhất cấp.Các nào có thể tạo nên
chất nền có lập thể carbocation bền như R-X
cồng kềnh như R-X loại alil và benzil tam cấp không phản ứng theo S2 N Tác
chất Các tác chất thân hạch Không ảnh hưởng gì lên thân hạch mạnh vận tốc phản ứng Nhóm xuất
Cần nhóm xuất tốt (là Các nhóm xuất tốt (là các
các anion bền; là base anion bền; là base yếu) I- yếu) >Br->Cl->>F- Dung môi
Cần dung môi phân cực Cần dung môi phân
phi proton để bảo cực,thí dụ như nước để
quanh cation kim loại làm an định carboncation
đi kém, nhưng không trung gian bằng sự solvat
bao quanh tác chất hóa, nên làm tăng vận tốc
anion thân hạch. Dung phản ứng môi proton tạo nối hidrogen với chất thân
hạch làm giảm vận tốc phản ứng Chất xúc tác
Phản ứng S1 của các R-X N
thường được thúc đẩy mạnh khi thêm muối bạc
Câu 17: Trình bày cơ chế AN, AE, cho vd, các yếu tố ảnh hưởng.
1. Phản Ứng Cộng Ái Nhân (Nucleophilic Addition, AN):
a. Tính chất của tác nhân ái nhân (Nucleophile):
• Độ mạnh của ái nhân: Ái nhân mạnh hơn sẽ tấn công nhóm carbonyl
nhanh hơn. Ái nhân mạnh thường có điện tích âm hoặc cặp electron chưa
sử dụng sẵn sàng để tấn công.
• Điện tích: Ái nhân mang điện tích âm (như OH, CN) thường mạnh hơn
ái nhân trung tính (như H2O, NH3).
b. Tính chất của tác nhân điện tử (Electrophile):
• Độ hoạt hóa của carbonyl: Nhóm carbonyl có độ hoạt hóa cao hơn (do
sự hiện diện của các nhóm hút electron gần đó) sẽ dễ dàng bị tấn công hơn.
Cấu trúc không gian: Các nhóm thế cồng kềnh xung quanh nhóm
carbonyl có thể gây cản trở không gian, làm giảm tốc độ phản ứng.
c. Điều kiện phản ứng:
Dung môi: Dung môi phân cực protic (như nước, ethanol) thường hỗ trợ
các phản ứng ái nhân, trong khi dung môi phân cực aprotic (như DMSO,
acetonitril) có thể làm tăng hoạt tính của các ái nhân.
2. Phản Ứng Cộng Ái Điện Tử (Electrophilic Addition, AE):
a. Tính chất của tác nhân điện tử (Electrophile):
Độ mạnh của ái điện tử: Ái điện tử mạnh hơn (ví dụ như H*, Br*) sẽ tấn
công liên kết pi nhanh hơn.
Khả năng phân cực: Các phân tử dễ phân cực (như Br2) có thể tạo ra các
ion hoặc phức tạm thời dễ dàng hơn, tăng tốc độ phản ứng.
b. Tính chất của hợp chất chứa liên kết đôi:
Độ phân cực của liên kết đôi: Liên kết đôi với nhóm thế electron-
donating (cho electron) sẽ làm tăng mật độ electron trên liên kết n, làm
tăng khả năng phản ứng.
• Cấu trúc không gian: Các nhóm thế lớn có thể gây cản trở không gian,
làm giảm tốc độ phản úng.
c. Điều kiện phản ứng:
Dung môi: Dung môi phân cực protic (như nước) có thể giúp ổn định các
ion trung gian, tăng tốc độ phản ứng.
• Nhiệt độ: Tăng nhiệt độ thường làm tăng tốc độ phản ứng cộng ái điện tử.
Áp suất: Trong một số trường hợp, áp suất có thể ảnh hưởng đến phản
ứng cộng, đặc biệt là với các phản ứng cộng .
Câu 18: Trình bày về phản ứng thế gốc tự do, đặc trưng cho phản ứng nào? Cho vd.
+ Khởi đầu tạo ra gốc tự do từ chất khởi đầu thì bằng ánh sáng hoặc nhiệt
+ Phát triển mạch: Gốc tự do tiếp tục phản ứng tạo ra các gốc tự do mới, duy trì chuỗi phản ứng
+kết thúc. Hai gốc tự do kết hợp lại thành phần tử ổn định, dừng chuỗi phản ứng
Yêu cầu ánh sáng hoặc nhiệt. cần ánh sáng (thường là UV) hoặc nhiệt để khởi đầu phản ứng
Sự hình thành và tham gia gốc tự do. Gốc tự do có một electron chưa cặp
đôi, rất phản ứng và không bền
Không chọn lọc cao. Phản ứng không có tính chọn lọc cao, dẫn đến nhiều sản phẩm phụ
Tạo thành sp phụ. Do không chọn lọc, tạo ra nhiều sp phụ khác nhau
ứng dụng rộng rãi: được sự dụng trong tổng hợp hóa và công nghiệp như
trong sản xuất chloromethane, ethyl chloride và poly Vd




