
















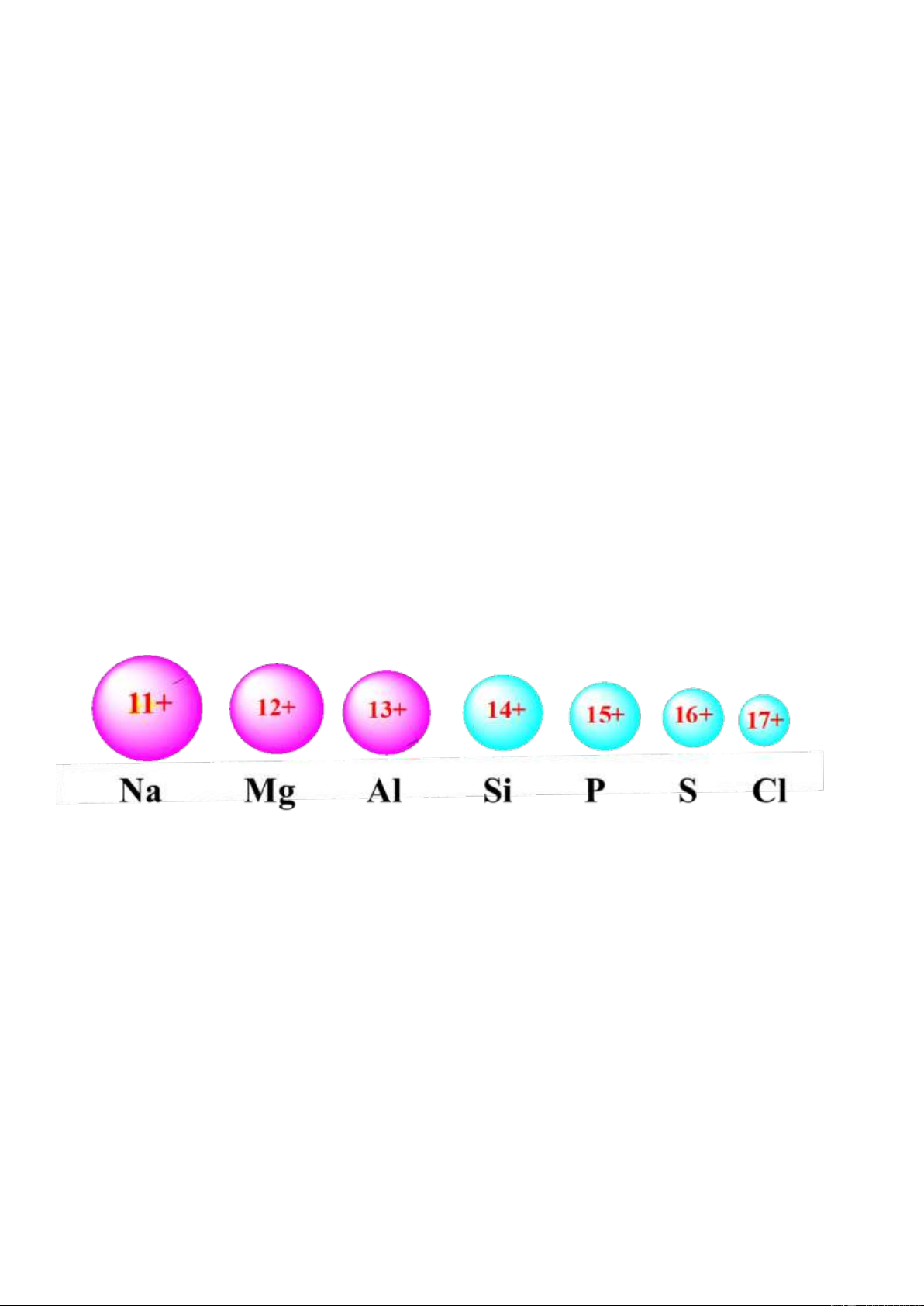




















Preview text:
TRƯỜNG THPT CHUYÊN…..
VỞ GHI BÀI HÓA HỌC 12 Isoamyl axetat có mùi thơm chuối chín Tinh bột có trong gạo
Amin, protein có trong cá thịt
Đồ mủ được làm từ polime
Các đồ vật bằng kim loại
Hợp kim của Al làm máy bay
Sắt cây dùng trong xây dựng
Phòng thí nghiệm hóa phân tích Hiệu ứng nhà kính
Họ tên học sinh:………………………………….Lớp:………………….
Năm học : 2022 – 2023
LƯU HÀNH NỘI BỘ Trang 0 MỤC LỤC Trang
MỘT SỐ VẤN ĐỀ CẦN NẮM ..................................................................... 02
CHỦ ĐỀ 1 : ESTE - LIPIT ................................................................................ 4
CHỦ ĐỀ 2: CACBOHIĐRAT .......................................................................... 7
CHỦ ĐỀ 3: AMIN – AMINOAXIT – PEPTIT – PROTEIN ........................ 11
CHỦ ĐỀ 4: POLIME – VẬT LIỆU POLIME ............................................... 17
CHỦ ĐỀ 5: ĐẠI CƯƠNG VỀ KIM LOẠI ..................................................... 22
CHỦ ĐỀ 6: KIM LOẠI KIỀM – KIỀM THỔ - NHÔM ................................ 31
CHỦ ĐỀ 7: SẮT – CROM & HỢP CHẤT ..................................................... 39
CHỦ ĐỀ 8+9: NHẬN BIẾT- HÓA HỌC MT-KT-XH .................................. 43 Trang 1
MỘT SỐ VẤN ĐỀ HÓA HỌC CẦN NẮM
I – DÃY HOẠT ĐỘNG HÓA HỌC KIM LOẠI:
Khi Bà Các Nàng Mai Áo Záp Sắt Nhớ Sang Phố Hỏi Cô Sắt (III) Á Hậu Phi Âu K Ba Ca Na Mg
Al Zn Fe Ni Sn Pb H Cu Fe3+ Ag Hg Pt Au Ý nghĩa: K Ba Ca Na Mg
Al Zn Fe Ni Sn Pb H Cu Fe3+ Ag Hg Pt Au + O2: nhiệt độ thường Ở nhiệt độ cao Khó phản ứng K Ba Ca Na Mg
Al Zn Fe Ni Sn Pb H Cu Fe3+ Ag Hg Pt Au
+ H2O Tác dụng ở t0 thường Không tác dụng với nước ở nhiệt độ thường K Ba Ca Na Mg
Al Zn Fe Ni Sn Pb H Cu Fe3+ Ag Hg Pt Au
+ Tác dụng với các axit (HCl, H2SO4 loãng) giải phóng H2 Không tác dụng. K Ba Ca Na Mg
Al Zn Fe Ni Sn Pb H Cu Fe3+ Ag Hg Pt Au
Kim loại đứng trước đẩy kim loại đứng sau ra khỏi muối K Ba Ca Na Mg
Al Zn Fe Ni Sn Pb H Cu Fe3+ Ag Hg Pt Au
+ H2, CO không khử được oxit
khử được oxit các kim loại này ở nhiệt độ cao II – HÓA TRỊ Kim loại Phi kim Nhóm nguyên tố -OH, -NO3 (nitrat), -NO2 Hóa trị I Li, Na, K, Ag. H, F, Cl, Br, I. (nitrit), -NH4 (amoni), - HSO3, -HSO4, -H2PO4. =SO Còn lại (Ca, Ba, Mg, 4 (sunfat), =SO3 Hóa trị II Zn,…). O (sunfit), =CO 3 (cacbonat), =HPO4. Hóa trị III Al, Au. ≡PO4 (photphat). Fe (II, III); Cu (I, II); Sn C (II, IV); N (I, II, III, Nhiều hóa trị (II, IV); Pb (II, IV). IV, V); S (II, IV, VI). III. TÍNH TAN
- Tất cả các muối nitrat (NO - +
3 ), Na, K, NH4 đều tan tốt.
- Đa số các muối clorua(Cl), bromua (Br) tan tốt (trừ AgCl, AgBr không tan), đa số các muối sunfat
(SO4) tan tốt (trừ BaSO4, PbSO4: không tan, CaSO4: ít tan).
- Đa số các muối cacbonat (CO 2- 3- +
3 ), photphat (PO4 ) đều không tan (trừ muối của Na, K, NH4 tan).
- Các hiđroxit kim loại: 1OH đều tan, 2OH đa số không tan (trừ Ba(OH)2, Sr(OH)2 tan, Ca(OH)2: ít
tan); 3OH đều không tan. Trang 2
IV – MỘT SỐ CÔNG THỨC
CÔNG THỨC TÍNH SỐ MOL: n
1. Số mol một chất bất kì:
3. Số mol của một chất trong dung dịch m n C V (V: lít) n (m: KL chất tan) M dd M
4. VA = VB (cùng điều kiện t0, p)
2. Số mol của chất khí ở đktc: => nA = n B V n (V: lít) , 22 4
CÔNG THỨC TÍNH THỂ TÍCH: V
1. Thể tích chất khí đktc: V = n. 22,4 (lít) n m 2. Thể tích dd: ct V ; dd(g) V dd C dd(ml) D M (g/ml)
CÔNG THỨC TÍNH NỒNG ĐỘ PHẦN TRĂM : C%
1. Từ khối lượng chất tan, khối lượng dung dịch
2. Từ khối lượng riêng và nồng độ C m 10 % 0 C M ct C% C M % ; D: KLR (g/ml) m 10 D dd
CÔNG THỨC TÍNH NỒNG ĐỘ MOL/LÍT: CM
1. Từ số mol chất tan và thể tích dung dịch
2. Liên hệ giữa nồng độ CM và C%. n 10 D C% ct C ( V C (M: KLPT) M dd : lít) M V M dd
CÔNG THỨC TÍNH KHỐI LƯỢNG CHẤT TAN: mct hoặc m
1.Công thức tính khối lượng chung: m n M
3. Từ khối lượng dung dịch và nồng độ %
2.Từ độ tan và khối lượng dung môi % C mdd m S.m ct dm 100% m ct 100
CÔNG THỨC TÍNH KHỐI LƯỢNG DUNG DỊCH: mdd
1) Từ dung môi và chất tan: m m m m 10 % 0 dd ct dm 3. Từ m ct và C%: m ct 2) Từ KLR và dd V dd: m V (g/ml) C% dd dd ml D
4. mddspứ = ∑ các chất ban đầu – m↓ - m↑
TỶ KHỐI HƠI CHẤT KHÍ : dA/B M M A d (M A d A / kk kk = 29) M A / B M kk B
CHỦ ĐỀ 1: ESTE- LIPIT Trang 3 A. ESTE
I– KHÁI NIỆM, DANH PHÁP: 1. Khái niệm: Xét phản ứng: 0 H SO ñaëc, t 2 4
CH COOH + C H OH
.......................................... 3 2 5 0 H SO ñaëc, t 2 4
CH COOH+HO-CH CH CH(CH )CH
................................................................... 3 2 2 3 3
Khái niệm:………………………………………………………………………………………………………… 2. Cấu tạo:
- CTCT của este đơn chức: RCOOR’
R: ……………………………………………………….
R’: ………………………………………………………
- CTTQ este no đơn chức, mạch hở: ………………………………………..
2. Danh pháp: Tên RCOOR’ = Tên R’ + tên RCOO.
VD: CH3COOC2H5: ……………………………………………..
HCOOCH3: ………………………………………………….
CH2 = C(CH3)- COOCH3: ………………………………….
II - TÍNH CHẤT VẬT LÍ
- Các este là chất ……………hoặc………… ở điều kiện thường, ………………….. trong nước.
- t0s, độ tan ( M): ............................>................... > este
- Các este có mùi ……………………………
III - TÍNH CHẤT HÓA HỌC
* Este bị thủy phân trong môi trường axit hoặc kiềm.
a) Phản ứng thủy phân trong môi trường axit: là phản ứng ………………………….., thông thường tạo
ra ……………………………….và ……………………………… tương ứng H SO d RCOO–R’ + H 2O 2 4
....................................................................... 0 t Ví dụ: H SO d CH 3COOC2H5 + H2O 2 4
....................................................................... 0 t
b) Phản ứng thủy phân trong môi trường kiềm (còn gọi là phản ứng xà phòng hóa): là phản ứng
...................................., thông thường tạo ra ............................. và ....................................tương ứng. 0 RCOO–R’ + NaOH t
................................................... Trang 4 Ví dụ: 0 CH t 3COOC2H5 + NaOH
.................................................................
* Ngoài ra tùy vào đặc điểm của gốc hiđrocacbon tạo nên este mà còn có phản ứng của gốc hiđrocacbon. IV - ĐIỀU CHẾ
* Thông thường đun nóng axit cacboxylic với ancol, có xúc tác H2SO4 đặc. 0 H SO ñaëc, t ' 2 4 ' RCOOH+R OH RCOOR +H O 2 0 H SO ñaëc, t Ví dụ: 2 4
CH COOH + C H OH
.......................................... 3 2 5
=> Vai trò của H2SO4 đặc: ....................................................................................................................
* Ngoài ra este có thể điều chế bằng một số cách khác (giảm tải). V- ỨNG DỤNG
- Dùng làm dung môi tách, chiết hợp chất hữu cơ. - Sản xuất chất dẻo.
- Chất tạo mùi hương trong công nghiệp thực phẩm,… B. LIPIT I – KHÁI NIỆM - Lipit
.......................................................................................................................................................................
....................................................................................................................................................................... .
-Lipit (este phức tạp) bao gồm: .................................................................................................................... II – CHẤT BÉO 1. Khái niệm
- Chất béo là ............................................................., gọi chung là .............................hay là .....................
- Axit béo là .................................................................................................................................................
Thường gặp các axit béo sau :
+ axit panmitic: .......................................(axit béo no)
+ axit stearic: ………………………… (axit béo no)
+ axit oleic:……………………………(axit béo không no có 1 C=C)
- Công thức chung của chất béo: Trang 5 R1COO CH2 CH2 OCOR1 R2COO CH hay CH OCOR2 R CH 3COO 2 CH OCOR 2 3
* R1, R2, R3: gốc hiđrocacbon của axit béo (có thể giống nhau hoặc khác nhau).
* Nếu R1, R2, R3 giống nhau (R) =>..............................................................hoặc....................................... Ví dụ:
Tripanmitin (tripanmitoylglixerol):.............................................................................
Tristearin (tristearoylglixerol) .....................................................................................
Triolein (trioleoylglixerol)..........................................................................................
2. Tính chất vật lí - Trạng thái:
+ Chất lỏng (dầu thực vật) là chất béo của axit béo ....................................
+ Chất rắn (mỡ động vật) là chất béo của axit béo ....................................
- Nhẹ hơn nước và không tan trong nước.
3. Tính chất hoá học
Chất béo là trieste => chất béo có TCHH giống este.
a. Phản ứng thuỷ phân trong môi trường axit: là phản ứng .......................................... 0 t , H (C
17H35CHOO)3C3H5 + ......H2O
........................................................................................... Tristearin
b. Phản ứng xà phòng hoá (thủy phân môi trường kiềm) : là phản ứng…………………… (C t 17H35CHOO)3C3H5 + ……NaOH 0
…………………………………………………… tristearin
* Natri stearat dùng làm xà phòng nên gọi là phản ứng xà phòng hóa.
c. Phản ứng cộng H2: (chất béo lỏng chất béo rắn) 0 (C Ni,t
17H33COO)3C3H5 + ........H2
.........................................................
Triolein (lỏng) ........................................................
Dầu mỡ động thực vật để lâu thường có mùi khó chịu, ta gọi đó là hiện tượng ôi mỡ. Nguyên
nhân chủ yếu là sự oxi hóa liên kết đôi bởi O2, không khí, hơi nước và xúc tác men, biến lipit thành
peoxit, sau đó peoxit phân hủy tạo thành những anđehit và xeton có mùi và độc hại. 4. Ứng dụng
- Là thức ăn quan trọng của con người.
- Là nguyên liệu để sản xuất xà phòng và glixerol. Trang 6
- Là nguyên liệu để sản xuất thực phẩm khác như mì sợi, đồ hộp,..
CHỦ ĐỀ 2: CACBOHĐRAT
Cacbohiđrat (gluxit hay saccarit) :
……………………………………………………………………………………………………………
…và thường có công thức chung là …………………………………… Phân làm 3 loại:
- Monosaccarit: ……………………………………………………..
- Đisaccarit: ………………………………………………………….
- Polisaccarit: ……………………………………………………… Phần 1. GLUCOZƠ
I-TÍNH CHẤT VẬT LÍ VÀ TRẠNG THÁI TỰ NHIÊN
- Glucozơ là chất rắn, không màu, dễ tan trong nước, có vị ngọt (không ngọt bằng đường mía).
- Glucozơ có trong hầu hết các bộ phận của cây : lá, hoa, rễ, quả,..., có trong cơ thể người và động vật
(trong máu người glucozơ chiếm 0,1%,...)
II- CẤU TẠO PHÂN TỬ :
- CTPT : ……………………………….
- Xác định cấu tạo mạch hở glucozơ dựa trên 4 thí nghiệm sau:
1) ……………………………………………………………………………………
2) …………………………………………………………………………………….
3) . ……………………………………………………………………………………
4) …………………………………………………………………………………….
Cấu tạo mạch hở glucozơ: ………………………………………………………………….
* Trong thực tế glucozơ tồn tại chủ yếu ở 2 dạng mạch …………………………………………
III- TÍNH CHẤT HÓA HỌC
1/ Có tính chất giống glixerol (poliancol):
- Phản ứng với …………………….. ở t0 thường tạo dung dịch………….. ……………………...
C6H12O6 + Cu(OH)2 .............................................................................................................
- Tạo este có 5 gốc axit axetic khi phản ứng với anhiđrit axetic.
2/ Có tính chất giống anđehit:
a/ phản ứng tráng bạc: (với dd AgNO3 trong NH3)
..................................................................................................................................................................
Lưu ý: 1 C6H12O6 2Ag
b) Khử glucozơ bằng H2 sobitol Trang 7
…………………………………………………………………………………………………………
3/ phản ứng lên men rượu C enzim 6H12O6
……………………………………………………………………………..
IV- ĐIỀU CHẾ VÀ ỨNG DỤNG:
- Điều chế: thuỷ phân tinh bột hoặc xenlulozơ
……………………………………………………………………………………………………….
- Ứng dụng: Làm thuốc tăng lực (huyết thanh), thức ăn, tráng ruột phích,... V- FRUCTOZƠ (C6H12O6)
1. Cấu tạo: là đồng phân của………………….. (glucozơ có nhóm anđehit, fructozơ có nhóm xeton).
CTCT:……………………………………………………………………………………………….
2.Tính chất vật lí: Là chất kết tinh, không màu, có vị ngọt hơn đường mía, trong mật ong có 40%.
3. Tính chất hóa học : tương tự glucozơ
- Tác dụng Cu(OH)2 cho dung dịch xanh lam. - Phản ứng cộng H2.
- Phản ứng tráng gương: Do .............................................................................................
......................................................................................................................
- Khác với glucozơ: fructozơ không phản ứng với .............................................................
Phần 2. SACCAROZƠ, TINH BỘT VÀ XENLULOZƠ
I – SACCAROZƠ: CTPT:......................................... (M=................)
- Có nhiều nhất trong cây................., củ ..................................... và hoa ...........................
1. Tính chất vật lí :
- Chất rắn, có vị ngọt, dễ tan trong nước.
2. Cấu trúc phân tử :
- Saccarozơ là ............................ gồm :.................................... và ........................... liên kết với nhau qua
nguyên tử ..........................
- Không có nhóm......................., có các nhóm .................................
3. Tính chất hóa học
* Không có phản ứng................................., tạo dung dịch ..............................................., bị .......................
a) Phản ứng với Cu(OH)2: tạo dung dịch ...................................... 2C12H22O11+Cu(OH)2
................................................................................................................ Trang 8
b) Phản ứng thủy phân: tạo ..................................................
* Bình thường saccarozơ không phản ứng tráng gương nhưng sau khi bị thủy phân thì tạo sản phẩm có tráng gương. C12H22O11+H2O + 0 H ,t
...................................................... saccarozơ
4. Ứng dụng: làm thực phẩm, pha chế thuốc,...
II – TINH BỘT: ............................ (M =.................)
1. Tính chất vật lí:
.......................................................................................................................................................................
.......................................................................................................................................................................
....................................................................................................................................................................... ...
2. Cấu trúc phân tử:
Tinh bột là .................................. cấu tạo từ nhiều ....................................................., ở hai dạng cấu trúc:
+Amilozơ : chỉ có liên kết ..................................; mạch ............................. ..............................
+Amilopectin: ngoài liên kết .................................... còn có liên kết ...........................; mạch .....................
* Trong cây xanh tinh bột được tạo thành từ quá trình .......................................
..........................................................................................................................................
3. Tính chất hóa học:
a) Phản ứng thủy phân: tạo .......................................................
...........................................................................................................................................
b) Phản ứng màu với iot: tạo hợp chất màu.................................với I2
=> Iot là thuốc thử đặc trưng để nhận biết tinh bột và ngược lại. Tinh bột + I t 2
hợp chất màu................................. 0
mất .................................. ñeånguoäi xuất
hiện lại màu..................................
Giải thích:.....................................................................................................................................................
.......................................................................................................................................................................
....................................................................................................................................................................... . 4. Ứng dụng:
- Chất dinh dưỡng cơ bản của người và động vật. Trang 9
- Sản xuất bánh kẹo,...
III – XELULOZƠ: .......................................................... (M =........................)
1. Tính chất vật lí, trạng thái tự nhiên:
*TCVL: ................................................................................................................................................
.............................................................................................................................................................
* Trong tự nhiên:có nhiều trong .........................................................................................................
2. Cấu trúc phân tử:
- Xenlulozơ là ..................................: cấu tạo từ nhiều ......................................, mạch
...............................
- Mỗi mắt xích (mỗi gốc C6H10O5) chứa 3 nhóm OH nên có thể viết công thức xenlulozơ:
.......................................................................
3. Tính chất hóa học
a) Phản ứng thủy phân: tạo ............................................
.....................................................................................................................
b) Phản ứng với axit HNO3: este hóa (xảy ra ở 3 nhóm OH).
.......................................................................................................................................................................
.......................................................................................................................................................................
........................................................................................................................................................ 4. Ứng dụng:
- Dùng trực tiếp hoặc chế biến thành giấy.
- Sản xuất tơ nhân tạo: tơ visco, tơ axetat,...
CHỦ ĐỀ 3: AMIN, AMINO AXIT VÀ PROTEIN Phần 1: AMIN Trang 10
I. KHÁI NIỆM, PHÂN LOẠI VÀ DANH PHÁP
1. Khái niệm, phân loại:
a) Khái niệm:
……………………………………………………………………………………………….. TD:
NH3 CH3NH2 CH3-NH-CH3 C6H5NH2
Amoniac metylamin đimetylamin phenylamin (anilin)
* Đồng phân amin: đồng phân mạch cacbon, vị trí nhóm chức, bậc amin.
TD: C4H11N có các đồng phân sau:
………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………
……………………………………………………………………………………………..
………………………………………………………………………………………………………………………
……………………………………………………………………………………………………..
………………………………………………………………………………………………………………………
……………………………………………………………………………………………………..
………………………………………………………………………………………………………………………
……………………………………………………………………………………………………..
……………………………………………………………………………………………………………..
b. Phân loại amin: theo 2 cách
- Theo gốc hiđrocacbon: Amin ...............................như ..........................................................................,
và amin .................................... như ............................................................................
- Theo bậc amin: amin bậc ................, amin bậc ................., amin bậc .........................
*Bậc amin = số ................................................ liên kết với ................................. 2. Danh pháp.
a. Tên gốc-chức: Tên gốc hiđrocacbon + amin.
VD: CH3NH2: ......................................... ; CH3CH2NH2: .............................
b. Tên thay thế: N-tên gốc R’, N-tên gốc R’’+ tên hiđrocacbon no R (có số C cao nhất) + amin. R N R' R''
* Nếu R’ và R’’ là H thì bỏ qua chúng. CTCT
Bậc Tên gốc chức Tên thay thế Tên thường CH3NH2 Trang 11 (CH3)2NH (CH3)3N C2H5NH2 CH3CH2CH2NH2 CH3CH(NH2)CH3 C6H5NH2 Anilin C6H5 -NH-CH3 N-metylanilin
II. TÍNH CHẤT VẬT LÍ
- Các amin có phân tử khối nhỏ như
...........................................................................................................là những chất .........., mùi ........., tan
.........................................................
- Các amin có phân tử khối lớn hơn là chất ..................hoặc ..........................., ít tan trong nước.
- Các amin đều ...............................
III. CẤU TẠO PHÂN TỬ VÀ TÍNH CHẤT HÓA HỌC
1. Cấu tạo phân tử.
Trong phân tử amin: Nguyên tử N có 5 e lớp ngoài cùng, 3 trong số đó tạo ra 3 liên kết cộng hóa trị,
còn một cặp e chưa liên kết biểu diễn bằng 2 dấu chấm. Cặp e này có thể tạo ra liên kết cho nhận (giống
NH3) do đó các amin có tính bazơ. R1 R1 R + 2 N + H+ R2 N H R3 R 3
2. Tính chất hóa học.
a. Tính bazơ.
- Tất cả các amin đều có ......................., nhưng chỉ có một số amin
.......................................................................... thì làm xanh quỳ tím hoặc làm phenolphtalein hóa hồng,
có lực bazơ mạnh hơn NH3 nhờ ảnh hưởng của nhóm ........................
- Anilin có tính bazơ nhưng không làm .................................., cũng không ............................................
vì lực bazơ của nó rất yếu và yếu hơn NH3. Nhưng tác dụng với axit HCl
................................................................................................................................................................
Kết luận: So sánh lực bazơ: (C6H5)2NH < C6H5NH2 < NH3 < CH3NH2 < C2H5NH2< (CH3)2NH
amin thơm ankyl amin (amin béo)
b. Phản ứng thế nhân thơm của anilin: tạo kết tủa trắng (nhận biết anilin). Trang 12 NH2 NH2 Br Br H + 2O 3 Br2 + 3 HBr Br
(2,4,6-tribromanilin) trắng
Hoặc viết gọn hơn:.............................................................................................................................. Phần 2: AMINOAXIT I. KHÁI NIỆM 1. Khái niệm
……………………………………………………………………………………………………………
…………………………………………………………………………………………………………… Thí dụ:
……………………………………………………………………………………………………………
…………………………………………………………………………………………………………… 2. Danh pháp
a)Tên thay thế : Vị trí nhóm NH2 theo thứ tự 2,3,4,5,6….
Tên aminoaxit = Axit+vị trí nhóm NH2+ amino +(vị trí mạch nhánh + tên nhánh) + tên axit (thay thế).
b)Tên bán hệ thống: Dùng chữ cái Hi lạp chỉ vị trí nhóm NH 2.Theo thứ tự: , , , , ,
c) Tên thường: Công thức Tên thay thế Tên bán hệ thống Tên thường Kí hiệu M
II-CẤU TẠO PHÂN TỬ VÀ TÍNH CHẤT HÓA HỌC Trang 13
1. Cấu tạo phân tử: amino axit tồn tại dưới dạng ................................
……………………………………………………………………………..
Dạng phân tử dạng ion lưỡng cực
* Amino axit là những chất…………, tan trong ……….. và nhiệt độ ……………………
2. Tính chất hóa học: tính lưỡng tính, tính chất mỗi nhóm chức, trùng ngưng.
a) Tính lưỡng tính: vừa tác dụng với ………………….., vừa tác dụng với …………………….
- Tác dụng với axit vô cơ mạnh (tính chất nhóm …………………..)
Thí dụ:…………………………………………………………………………………….
- Tác dụng với bazơ mạnh (tính chất nhóm…………………….)
Thí dụ:…………………………………………………………………………………….
b) Tính axit – bazơ của dung dịch amino axit: R(NH2)x(COOH)y
+ Nếu x = y: dd không làm đổi màu quỳ tím.
+ Nếu x < y : dd làm quỳ tím hoá đỏ.
+ Nếu x > y : dd làm quỳ tím hoá xanh.
- Dd Gly, Ala, Val (có..... nhóm COOH và có.......nhóm NH2) ==> ................................ màu quỳ tím.
- Axit glutamic (có...... nhóm COOH và có......... nhóm NH2) ==> làm quỳ tím ................................
- Dd Lysin (có....... nhóm COOH và có..... nhóm NH2) ==> làm quỳ tím ..........................................
c) Phản ứng của nhóm COOH: phản ứng este hoá:
.................................................................................................................................................................
.................................................................................................................................................................
.................................................................................................................................................................
d) Phản ứng trùng ngưng: các và - amino axit tham gia phản ứng trùng tạo polime thuộc loại poliamit.
……………………………………………………………………………………………………………
……………………………………………………………………………………………………………
……………………………………………………………………………………………………………
…………………………………………………………………………………………………………… III – ỨNG DỤNG
- Hầu hết các amino axit thiên nhiên đều là .......................................... là những hợp chất cơ sở tạo
protein của cơ thể sống. Trang 14
- Muối ......................................................... dùng làm gia vị thức ăn (bột ngọt hay mì chính), ...làm thuốc.
- Axit 6 –aminohexanoic (axit ε-aminocaproic) sản xuất tơ nilon-6 và 7-aminoheptanoic (aminoenatoic)
sản xuất tơ nilon -7,....
Phần 3: PEPTIT VÀ PROTEIN I. KHÁI NIỆM 1. Khái niệm
- Peptit là loại hợp chất chứa từ…… đến …….. gốc ………………….. liên kết với nhau bởi các liên kết peptit.
- Liên kết peptit là liên kết …………………….. giữa ……………………………….. Thí dụ: lieâ n keá t peptit ... NH CH C N CH C ... R1 O H R2 O
- Amino axit đầu N còn nhóm………………., amino axit đầu C còn nhóm……………………. Thí dụ: H2N CH2CO NH CH COOH CH3 amino axit ñaà u N amino axit ñaà u C
- Phân loại peptit: n = 2 50 (n: số gốc -amino axit )
+ n=2 10: oligopeptit (có 2,3,4,… gốc -amino axit gọi là đi-, tri-, tetrapeptit,…)
+ n = 11 50: polipeptit
* Để tạo thành peptit các -amino axit liên kết với nhau theo một trật tự nhất định và cấu tạo được biểu
diễn dưới dạng kí hiệu của chúng. Thí dụ: từ alanin (Ala) và glyxin (Gly) tạo thành các đipeptit sau:
..............................................................
2. Tính chất hóa học: phản ứng thủy phân và phản ứng màu biure.
a) Phản ứng thủy phân: tạo các -amino axit nhờ xúc tác axit hoặc kiềm hoặc enzim.
Xét n –peptit chứa 1 nhóm NH2 và 1 nhóm COOH
- Thủy phân trong môi trường trung tính (H2O) => tạo các -amino axit
H2N-CH2CONHCH(CH3)COOH + H2O
........................................+.............................................. Trang 15
Viết gọn: .............................. + H2O
……………+………………………
Tổng quát: n-peptit + (n -1) H2O
các -amino axit
-Thủy phân trong môi trường kiềm: => tạo muối của -amino axit.
H2N-CH2CONHCH(CH3)COOH+….NaOH
...........................................+.....................................+.................
Viết gọn: ............... + ........NaOH
…………….. + ……………….. + ……………
Tổng quát: n-peptit + nNaOH muối + H2O
- Thủy phân trong môi trường axit: => tạo muối của -amino axit.
H2NCH2CONHCH(CH3)COOH+ H2O +.....HCl
................................................+...........................................
Viết gọn: .............. +......HCl +H2O
………………………. + ……………………..
Tổng quát: n-peptit + nHCl +(n-1) H2O muối
* Nếu thủy phân không hoàn toàn tạo thành các peptit ngắn hơn.
b) Phản ứng màu biure:
Dd peptit (từ tri peptit trở đi) +Cu(OH) OH 2
phức chất có màu …………………….
(Màu tím là do …………………………………………………………………………………………). II – PROTEIN
1. Khái niệm: …………………………………………………………………………………………… Phân làm 2 loại:
- Protein đơn giản: protein chỉ tạo nên …………………………………………
Vd: ………………………………………………………………………………………………..
- Protein phức tạp: protein đơn giản + “phi protein”.
2. Cấu tạo phân tử: Tương tự peptit nhưng có số gốc -amino axit lớn hơn 50 (n>50) 3. Tính chất:
a) Tính chất vật lí:
- Nhiều protein ……………trong nước tạo ………………………….
- Protein bị đông tụ khi: ………………………………………………………………………………….
b) Tính chất hóa học:
- Phản ứng thủy phân: tạo các ………………………….
- Phản ứng ……………………. với Cu(OH)2/OH- cho sản phẩm có ……………………..
4. Vai trò của protein đối với sự sống: Trang 16
- Protein là cơ sở của sự sống, có protein mới có sự sống.
- Thành phần chính trong thức ăn là protein. CHỦ ĐỀ 4: POLIME
A. ĐẠI CƯƠNG VỀ POLIME I- KHÁI NIỆM 1. Khái niệm - Polime là
.....................................................................................................................................................
....................................................................................................................................................................... Thí dụ : 0,xt,p n CH t 2=CH2 CH2 CH2 n
- n: Hệ số polime hóa (hệ số trùng hợp) hay độ polime hóa.
- Monome: là các phân tử tạo nên từng mắt xích của polime. 2. Danh pháp
+ Tên của polime = Poli + tên monome tương ứng. Vd: CH2 CH : polietilen 2 n
+ Nếu tên monome gồm 2 từ trở lên hoặc polime tạo bởi từ hai monome thì tên monome phải để trong ngoặc đơn. Vd: CH2 CHCl : poli(vinylclorua) n
+ Một số polime có tên riêng (tên thông thường) Vd: CF : teflon 2 CF2 n 3. Phân loại
- Theo nguồn gốc: có 3 loại:
+ Polime …………………: có sẵn trong …………………… như: ………………………
+ Polime ………………………: do …………………… như: …………………………..
+ Polime……………………….: polime …………………… được chế biến một phần như: ……………. Trang 17
- Theo cách tổng hợp: có 2 loại:
+ polime ……………………. như: ……………………………………
+ polime …………………… như: ………………………………….
II- CẤU TRÚC : có 3 dạng
+ Mạch …………………………… như: ……………………………………………
+ Mạch …………………………. .…như: ………………………………………….
+ Mạch ………………………………..như:………………………………………..
III- TÍNH CHẤT VẬT LÍ
Poloime là những chất rắn, không bay hơi; không có nhiệt độ nóng chảy cố định; khó hoà tan; nhiều
chất cách điện, cách nhiệt…; một số có tính dẻo, đàn hồi… IV- ĐIỀU CHẾ
Có thể điều chế polime bằng phản ứng trùng hợp hoặc trùng ngưng.
1. Phản ứng trùng hợp
-Trùng hợp ………………………………………………………………………………………………..
…………………………………………………………………………………………………………… …
- Điều kiện cần về cấu tạo của monome tham gia phản ứng trùng hợp là trong phân tử phải có
………………………. hoặc là ………………………………………… n CH to, P, xt 2 CH CH2 CH Cl Cl n
vinyl clorua poli(vinyl clorua) (PVC) CH2 CH2 C O t0 n CH ,xt 2 NH CH2 CO CH 5 n 2 CH2 NH caprolactam capron
2. Phản ứng trùng ngưng - Trùng ngưng
………………………………………………………………………………………………
……………………………………………………………………………………………………………
- Điều kiện cần để có phản ứng trùng ngưng : Các monome tham gia phản ứng trùng ngưng phải có
………………………………………………………………………….để tạo được liên kết với nhau.
….HOOCC6H4COOH + .HOCH2CH2OH
………………………………………………………
…………………………………………………………………………………………………………. Trang 18
V - ỨNG DỤNG: Có nhiều ứng dụng phục vụ trong đời sống và sản xuất. B. VẬT LIỆU POLIME I – CHẤT DẺO
1. Khái niệm về chất dẻo và vật liệu compozit
- Chất dẻo là …………………………………………………………………………………………….. - Vật liệu compozit là
………………………………………………………………………………………
………………………………………………………………………………………………………………
* Thành phần của vật liệu compozit gồm ………………………….. và các ……………….……………
=>Các chất nền có thể là nhựa nhiệt dẻo hay nhựa nhiệt rắn. Chất độn có thể là sợi (bông, đay, poliamit,
amiăng,…) hoặc bột (silicat, bột nhẹ (CaCO3), bột tan (3MgO.4SiO2.2H2O),…
2. Một số polime dùng làm chất dẻo a) Polietilen (PE)
PT điều chế: ………………………………………………………………………
PE là chất dẻo mềm, nóng chảy ở nhiệt độ trên 1100C, có tính “trơ tương đối” của ankan mạch không
phân nhánh, được dùng làm màng mỏng, vật liệu điện, bình chứa,…
b) Poli(vinyl clorua) hay PVC
PT điều chế: ……………………………………………………………………………………………
…………………………………………………………………………………………………………..
PVC là chất rắn vô định hình, cách điện tốt, bền với axit, được dùng làm vật liệu cách điện, ống dẫn
nước, vải che mưa.
c) Poli(metyl metacrylat) hay PMM (Thủy tinh hữu cơ)
PT điều chế: ……………………………………………………………………………………………
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………...
Poli(metyl metacrylat) là chất rắn trong suốt cho ánh sáng truyền qua tốt (gần 90%) nên được dùng chế
tạo thủy tinh hữu cơ plexiglas.
d) Poli(Phenol-fomanđehit) : PPF Monome Tính chất Ứng dụng Trang 19 a)Polietilen (PE) CH2=CH2
Chất dẻo mềm, nóng chảy ở nhiệt Làm màng mỏng, vật
độ trên 1100C, có tính “trơ tương liệu điện, bình chứa đối” b) Poli(vinyl CH2=CHCl
Chất rắn vô định hình, cách điện dùng làm vật liệu clorua) hay tốt, bền với axit cách điện, ống dẫn PVC nước, vải che mưa, da nhân tạo,,, c) Poli(metyl CH2=C(CH3)COOCH3
Chất rắn trong suốt cho ánh sáng dùng chế tạo thuỷ metacrylat) hay
truyền qua tốt (gần 90%) tinh hữu cơ PMM plexiglas. d) Poli(phenol- C6H5OH, HCHO fomanđehit) II – TƠ 1. Khái niệm
- Tơ là …………………………………………………………………………………………………..
- Trong tơ, những phân tử polime có mạch không phân nhánh, sắp xếp song song với nhau. 2. Phân loại
a) Tơ thiên nhiên (sẵn có …..........................…………....) như ……………………..………………….
b) Tơ hoá học (chế tạo bằng ……………………………………………..)
- Tơ tổng hợp (chế tạo từ ………………..) như:…………………………………………………………..
- Tơ bán tổng hợp hay tơ nhân tạo (xuất phát từ ………………………………………… nhưng được
chế biến thêm bằng con ………………………………) như:……………………………………………..
3. Một số loại tơ tổng hợp thường gặp a) Tơ nilon-6,6
PT điều chế: ……………………………………………………………………………………………
…………………………………………………………………………………………………………..
- Tính chất: Tơ nilon-6,6 dai, bền, mềm mại, óng mượt, ít thấm nước, giặt mau khô nhưng kém bền với
nhiệt, với axit và kiềm.
- Ứng dụng: Dệt vải may mặc, vải lót săm lốp xe, dệt bít tất, bện làm dây cáp, dây dù, đan lưới,…
b) Tơ nitron (hay olon)
PT điều chế: ……………………………………………………………………………………………
…………………………………………………………………………………………………………..
- Tính chất: Dai, bền với nhiệt và giữ nhiệt tốt.
- Ứng dụng: Dệt vải, may quần áo ấm, bện len đan áo rét. III – CAO SU Trang 20
1. Khái niệm: Cao su là …………………………………………………………..
2. Phân loại: Có hai loại cao su: Cao su thiên nhiên và cao su tổng hợp.
a) Cao su thiên nhiên
Cấu tạo: Đun nóng cao su thiên nhiên đến 2500C - 3000C thu được:,,,,,,,,,,,,,,,,,,,,,,,,,,
Cao su thiên nhiên là polime của …………………….. CH2 C CH CH2 n ~ ~ 1.500 - 15.000 CH n 3
Tính chất và ứng dụng
- Cao su thiên nhiên có tính đàn hồi, không dẫn điện và nhiệt, không thấm khí và nước, không tan trong
nước, etanol, axeton,…nhưng tan trong xăng, benzen.
- Cao su thiên nhiên tham gia được phản ứng cộng (H2, HCl, Cl2,…) do trong phân tử có chứa liên kết
đôi. Tác dụng được với lưu huỳnh cho cao su lưu hoá có tính đàn hồi, chịu nhiệt, lâu mòn, khó hoà tan
trong các dung môi hơn so với cao su thường.
- Bản chất của quá trình lưu hoá cao su (đun nóng ở 1500C hỗn hợp cao su và lưu huỳnh với tỉ lệ khoảng
97:3 về khối lượng) là tạo cầu nối −S−S− giữa các mạch cao su tạo thành mạng lưới. S S S S 0 nS ,t S S S S
Cao su thô cao su lưu hóa
b) Cao su tổng hợp: Là loại vật liệu polime tương tự cao su thiên nhiên, thường được điều chế từ các
ankađien bằng phản ứng trùng hợp.
Cao su buna trùng hợp từ……………………………………………………
PT điều chế: ……………………………………………………………………………………………
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
Cao su buna có tính đàn hồi và độ bền kém cao su thiên nhiên.
Cao su buna-S đồng trùng hợp từ ..................................................và................................................
PT điều chế: ……………………………………………………………………………………………
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
Cao su buna-N đồng trùng hợp từ ..................................................và................................................
PT điều chế: …………………………………………………………………………………………… Trang 21
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
CHỦ ĐỀ 5: ĐẠI CƯƠNG VỀ KIM LOẠI
PHẦN 1: VỊ TRÍ CỦA KIM LOẠI TRONG BTH VÀ CẤU TẠO CỦA KIM LOẠI
I – VỊ TRÍ CỦA KIM LOẠI TRONG BẢNG TUẦN HOÀN
Trong BTH khoảng ………...................../110 nguyên tố và được phân bố như sau:
- Nhóm …….. (trừ hiđro), nhóm …………, nhóm………(trừ bo) và một phần nhóm ………………..
- Tất cả các nguyên tố ………………….
- Họ lantan và actini xếp riêng thành ……………………………………
II – CẤU TẠO CỦA KIM LOẠI
1. Cấu tạo nguyên tử
- Nguyên tử của hầu hết các nguyên tố kim loại đều có ……………………...... ở lớp ngoài cùng.
Thí dụ: Na: ……………… Mg: …………………. Al: ………..…..
- Trong chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử ……………………………. và
điện tích hạt nhân …………………………………. so với các nguyên tử của nguyên tố phi kim. Thí dụ:
ĐAĐ 0,93 1,31 1,61 1,90 2,19 2,58 3,16 BK 0,157
0,136 0,125 0,117 0,110 0,104 0,099
2. Cấu tạo tinh thể
- Ở nhiệt độ thường, trừ ……….. ở thể lỏng, còn các kim loại khác ở ……….. và có cấu tạo …………..
- Trong tinh thể kim loại, ……………….… và …………………… nằm ở những nút của mạng tinh thể.
Các electron ……………liên kết ……… với hạt nhân nên ………………….. nguyên tử và
…………………………..trong mạng tinh thể.
3. Liên kết kim loại Liên kết kim loại là
…………………………………………………………………………………………
....................................................................................................................................................................... Trang 22
Phần 2: TÍNH CHẤT CỦA KIM LOẠI & DÃY ĐIỆN HÓA CỦA KIM LOẠI
I – TÍNH CHẤT VẬT LÍ
1.Tính chất vật lí chung: Ở điều kiện thường, các kim loại đều ở trạng thái …... (trừ …….....), có
tính………., dẫn ……….., dẫn……….. và có ……………………. a) Tính dẻo
Kim loại có tính dẻo : Au……Ag……Al……Cu…… b) Tính dẫn điện
- Trật tự dẫn điện: Ag …. Cu …. Au …. Al ….. Fe
- Ở nhiệt độ càng cao thì tính dẫn điện của kim loại càng …………do ở nhiệt độ cao, các ion dương
………………………………………………………………………….. c) Tính dẫn nhiệt
- Các electron trong vùng nhiệt độ cao có ……………….. lớn, chuyển động ……………………… và
- Thường các kim loại dẫn …………………… tốt cũng dẫn ……………..tốt. d) Ánh kim
Các electron tự do trong tinh thể kim loại phản xạ ………………………………………………………,
do đó kim loại có vẻ sáng lấp lánh gọi là ánh kim.
Kết luận: Tính chất vật lí chung của kim loại gây nên bởi sự có mặt của
…………………………………. trong mạng tinh thể kim loại.
2. Tính chất vật lí riêng:
- Khối lượng riêng: Nhẹ nhất: …………..(0,5g/cm3); Nặng nhất ………… (22,6g/cm3).
- Nhiệt độ nóng chảy: Thấp nhất: ………….(−390C); cao nhất ……………(34100C).
- Tính cứng: Kim loại mềm nhất là …. (dùng dao cắt được) và cứng nhất là … (có thể cắt được kính).
II. TÍNH CHẤT HOÁ HỌC
Trong một chu kì so với phi kim thì kim loại có: BKNT ……, ĐTHN ………. số e hóa trị ít do đó lực
liên kết với hạt nhân tương đối yếu nên chúng dễ tách khỏi nguyên tử.
Tính chất hoá học chung của kim loại là tính khử. M → Mn+ + ne
1. Tác dụng với phi kim
a) Tác dụng với clo, oxi:
b) Tác dụng với lưu huỳnh:
Fe + Cl2→ ............................................
Fe + S→ ............................................
Al + O2→ ............................................
Hg + S→ ............................................
-Lưu ý: Au, Pt, Ag không bị oxi hóa.
-Với Hg xảy ra ở nhiệt độ ………….., các kim loại
khác cần ………………. Trang 23
-Lưu ý: Để xử lý thủy ngân bị đổ ra ngoài người ta
dùng bột ……………………. rắc lên.
2. Tác dụng với dung dịch axit
K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Ag Hg Pt Au
a) Dung dịch HCl, H2SO4 loãng 𝐻𝐶𝑙 𝐶𝑙−
𝐾𝑙(𝑡𝑟ướ𝑐 𝐻) + { → 𝑀𝑢 ⏟ ố 𝑖 { 𝐻 2− + 𝐻2 ↑ 2𝑆𝑂4(𝑙) 𝑆𝑂 𝑠𝑜ℎ 𝑡ℎấ𝑝 4 0 +1
𝐹𝑒 + 𝐻 𝐶𝑙 →…………………………………………………………….. 0 +1
𝐹𝑒 + 𝐻2𝑆𝑂4(𝑙) →…………………………………………………….. 0 +1
𝐴𝑙 + 𝐻2𝑆𝑂4(𝑙) →……………………………………………………..
b) Dung dịch HNO3, H2SO4 đặc: Phản ứng với hầu hết các kim loại (trừ Au, Pt)
K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Ag Hg Pt Au 𝐻𝑁𝑂 𝑁𝑂− 𝑁𝑂 𝐾𝑙 3 3
2; 𝑁𝑂; 𝑁2𝑂; 𝑁2; 𝑁𝐻4𝑁𝑂3
(𝑡𝑟ừ 𝐴𝑢,𝑃𝑡) + { → 𝑀𝑢 ⏟ ố 𝑖 { + 𝐻 𝐻 2−+spk{ 2𝑂 2𝑆𝑂4(đ, 𝑡°) 𝑆𝑂 𝑆𝑂 𝑠𝑜ℎ 𝑐𝑎𝑜 4
2(𝑘ℎí 𝑘𝑜 𝑚à𝑢, 𝑚ù𝑖 𝑠ố𝑐)
Cu + HNO3 loãng→ …………………………………………………………………. 0 Fe + HNO t 3 đặc
………………………………………………………………………
Al + HNO3 loãng→ ……………………………………………………………….……
Al + HNO3 loãng→ ……………………….+……N2O + ……………………….
Zn + HNO3 loãng→ ……………………….+……N2 + ……………………….
Al + HNO3 loãng→ ………………….+………NH4NO3 + ………………………. 0 Cu + H t 2SO4 đặc
…………………………………………………………………… 0 Fe + H t 2SO4 đặc
…………………………………………………………………… *Chú ý:
- Nếu không có gợi ý gì thì HNO3 loãng=>tạo NO; HNO3đặc => tạo NO2
- Al,Fe,Cr bị thụ động hóa trong HNO3 đặc, nguội và H2SO4 đặc nguội.
- Pt, Au không tác dụng với HNO3 đặc H2SO4 đặc (cả nóng và nguội).
3. Tác dụng với nước
K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Ag Hg Pt Au Trang 24
- Các kim loại có tính khử mạnh: kim loại ….. và……... (trừ Be, Mg) khử H2O dễ dàng ở nhiệt độ thường.
Thí dụ: Na + H2O→ …………………………………………………………………………
- Các kim loại có tính khử trung bình chỉ khử nước ở nhiệt độ cao (Fe, Zn,…). Các kim loại tính khử
yếu (Cu, Ag...) không khử được H2O.
4. Tác dụng với dung dịch muối:
K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Ag Hg Pt Au
a) Kim loại phản ứng với nước ở nhiệt độ thường + dung dịch muối: xảy ra 2 giai đoạn: Vd: Na + dd FeCl3 → ? Vd: Na + dd CuSO4 → ? Na + H2O→NaOH + 1/2H2 ↑
3NaOH +FeCl3→ Fe(OH)3↓+3NaCl
b) Kim loại không phản ứng với nước ở nhiệt độ thường + dung dịch muối: Theo luật kim loại
………….. có thể khử được ion của ………………………… trong dung dịch muối thành kim loại tự do.
Fe + CuSO4 → .............................................
=>Hiện tượng quan sát: Đinh sắt có..........................................................
dd CuSO4 bị...........................................................
III – ĐÃY ĐIỆN HOÁ CỦA KIM LOẠI
1. Cặp oxi hoá – khử của kim loại + Ag + 1e Ag 2+ Cu + 2e Cu 2+ Fe + 2e Fe Daïng oxi hoùa Daïng khöû
Dạng ……… và dạng ……..của cùng một nguyên tố kim loại tạo nên cặp oxi hoá – khử của kim loại.
Thí dụ: Cặp oxi hoá – khử Ag+/Ag; Cu2+/Cu; Fe2+/Fe
2. So sánh tính chất của các cặp oxi hoá – khử
Thí dụ: So sánh tính chất của hai cặp oxi hoá – khử Cu2+/Cu và Ag+/Ag. Cu + 2Ag+ → Cu2+ + 2Ag
Kết luận: Tính khử: …………………………
Tính oxi hoá: ……………………
3. Dãy điện hoá của kim loại
Tính oxi hóa của ion kim loại tăng dần Trang 25
K+ Ba2+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ 2H+ Cu2+ Fe3+ Ag+ Hg2+ Pt2+ Au3+
K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Fe2+ Ag Hg Pt Au
Tính khử của kim loại giảm dần
4. Ý nghĩa dãy điện hoá của kim loại
Dự đoán chiều của phản ứng oxi hoá – khử theo quy tắc :
Phản ứng giữa hai cặp oxi hoá – khử sẽ xảy ra theo chiều chất oxi hoá …………….hơn sẽ oxi hoá chất
khử …………..hơn, sinh ra chất oxi hoá yếu hơn và chất khử yếu hơn.
Thí dụ: Phản ứng giữa hai cặp Fe2+/Fe và Cu2+/Cu xảy ra theo chiều ion Cu2+ oxi hoá Fe tạo ra ion Fe2+ và Cu. Fe2+ Cu2+ Fe Cu Fe + Cu2+ Cu + Fe2+
Chất khử mạnh chất oxi hóa mạnh Chất khử yếu chất oxihóa yếu
Phần 3: HỢP KIM(học sinh tự học )
Phần 4 : SỰ ĂN MÒN KIM LOẠI I – KHÁI NIỆM:
…………………………………………………………………………………………...
……………………………………………………………………………………………………………… .
Khi bị ăn mòn kim loại bị oxi hoá thành ion dương:………………………………………………………..
II – CÁC DẠNG ĂN MÒN KIM LOẠI
1. Ăn mòn hoá học:
………………………………………………………………………………………………………………
………………………………………………………………………………………………………………
…………………………………………………………………………………………………………. Thí dụ:
- Thanh sắt trong nhà máy sản xuất khí Cl2:
……………………………………………………………….
- Các thiết bị của lò đốt, các chi tiết của động cơ đốt trong
2. Ăn mòn điện hoá học Trang 26 a) Khái niệm
………………………………………………………………………………………………………………
………………………………………………………………………………………………………………
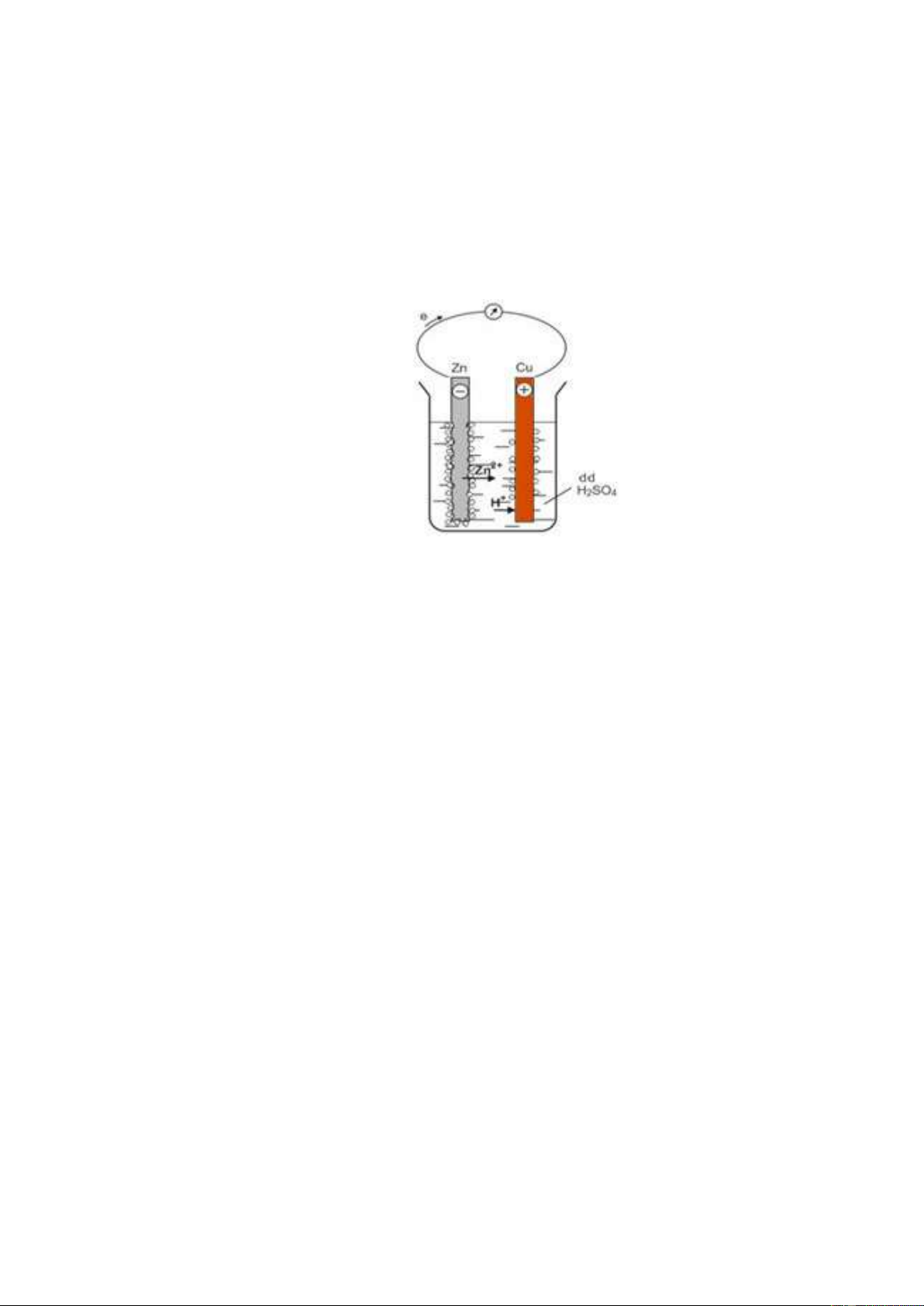
……………………………………………………………………………………………………………… Thí nghiệm:
Nhúng thanh Zn và Cu (không tiếp xúc với nhau) vào cốc đựng dung dịch H2SO4 loãng.
Nối thanh Zn và Cu bằng dây dẫn cho đi qua một điện kế.
Thí nghiệm về sự ăn mòn điện hóa học Hiện tượng:
- Kim điện kế ………….. chứng tỏ có …………………………..
- Thanh Zn bị …………………………………….
- Bọt khí H2 thoát ra ……………………………. Giải thích:
- Điện cực âm (anot), ………….bị ăn mòn.
…………………………………………….......................................................................
Ion ………… đi vào dung dịch, các ………………….. theo dây dẫn sang ……………
- Điện cực dương (catot): ………… của dung dịch H2SO4 nhận …………tạo ....................
..................................................................................................................……………………………
→ Kết quả:....................................................................................................................
b) Ăn mòn điện hoá học hợp kim sắt trong không khí ẩm
Thí dụ: Sự ăn mòn gang trong không khí ẩm.
- Trong không khí ẩm trên bề mặt của gang luôn có một lớp nước rất mỏng đã hoà tan O2 và khí CO2,
tạo thành dung dịch chất điện li.
- Gang là hợp kim (Fe - C) cùng tiếp xúc với dung dịch đó tạo nên vô số các pin nhỏ mà sắt là anot và cacbon là catot. Trang 27 Lôù p dd chaá t ñieä n li Fe2+ O2 + 2H2O + 4e 4OH- C Fe Vaä t laø m baè ng gang e
Tại anot: ………………………………………………………………………………………………….
Các ……………………được giải phóng chuyển dịch đến ……………………….
Tại catot: ...................................................................................................................................................
Ion ................ tan vào dung dịch chất điện li có hoà tan khí O2, Tại đây, ion ......................... tiếp tục bị
oxi hoá, dưới tác dụng của ion ................ tạo ra gỉ sắt có thành phần chủ yếu là ................................
c) Điều kiện xảy ra sự ăn mòn điện hoá học
Các điện cực phải ........................................................:................................................................
Các điện cực phải ..........................................................................................................................
Các điện cực cùng .........................................................................................................................
Lưu ý: - Dung dịch chất điện li gồm: axit, bazơ, muối, không khí ẩm.
- Thiếu một trong ba điều kiện trên sẽ không xảy ra ăn mòn điện hóa học.
III – CHỐNG ĂN MÒN KIM LOẠI
1. Phương pháp bảo vệ bề mặt
........................................................................................................................................................................
........................................................................................................................................................................
Thí dụ: Sắt tây là …………………………………
Tôn là ………………………… Các đồ vật làm bằng sắt được mạ …………………
2. Phương pháp điện hoá
……………………………………………………………………………………………………………
……………………………………………………………………………………………………………
Thí dụ: Bảo vệ vỏ tàu biển làm bằng thép bằng cách ……………………… của vỏ tàu (phần chìm dưới
nước) những khối ……………… kết quả là …………………bị nước biển ăn mòn thay cho thép. Trang 28
Phần 5: ĐIỀU CHẾ KIM LOẠI I – NGUYÊN TẮC
…………………………………………………………………………………………………………….
…………………………………………………............................................................................. II – PHƯƠNG PHÁP
1. Phương pháp nhiệt luyện: Điều chế kim loại....................................................
Nguyên tắc: Khử .................................... trong hợp chất ở nhiệt độ cao bằng các chất khử như
.......................................................hoặc các ....................................................................... Thí dụ: 0 PbO + H t 2
…………………………………………….. 0 Fe t 2O3 + CO
………………………………………….. 0 Fe t 3O4 + Al
…………………………………………..
2. Phương pháp thuỷ luyện: Điều chế kim loại....................................................
Nguyên tắc: Dùng ……………….. mạnh (không tan ……………..) khử ion …………………… hơn
ra khỏi dung dịch …………………
Thí dụ: Fe + CuSO4 ………………………….
Fe + Cu2+ ……………………………..
3. Phương pháp điện phân:
a) Điện phân hợp chất nóng chảy: Điều chế kim loại....................................................
Nguyên tắc: …………………………………………………………………………………………….
……………………………………………………………………………………………………………..
Thí dụ 1: Điện phân Al2O3 nóng chảy để điều chế Al.
Ở catot (-)……………………………………………………………………………………………
Ở anot (+)……………………………………………………………………………………………
PT điện phân: ………………………………………………………………………………………..
Thí dụ 2: Điện phân MgCl2 nóng chảy để điều chế Mg.
Ở catot (-)……………………………………………………………………………………………
Ở anot (+)……………………………………………………………………………………………
PT điện phân: ………………………………………………………………………………………..
b) Điện phân dung dịch: Điều chế kim loại....................................................
Nguyên tắc: Điện phân dung dịch muối của kim loại.
Thứ tự các phản ứng xảy ra ở các cực Trang 29
Catot (-) chứa ion dương (cation)
Anot (+) chứa ion âm (anion) Quá trình khử: Quá trình oxi hóa Li+………Al3+……..Mn+
S2-…I-…Br-…Cl-…OH- ….H2O
-Chỉ có ion kim loại sau Al3+ mới bị khử trong -Anion SO 2- -
4 , NO3 không bị oxi hóa dung dịch S2- → S + 2e Mn+ + ne → M
2X- → X2 + 2e ( X=Cl, Br, I)
-Hết Mn+ thì H2O bị khử 4OH- + 4e → O2 +2 H2O
2H2O + 2e → H2 + 2OH- (pH >7)
2H2O → O2 + 4H+ + 4e (pH<7)
Thí dụ 1: Điện phân dung dịch CuCl2 để điều chế kim loại Cu.
Ở catot (-)……………………………………………………………………………………………
Ở anot (+)……………………………………………………………………………………………
PT điện phân: ………………………………………………………………………………………..
Thí dụ 2: Điện phân dung dịch CuSO4 để điều chế kim loại Cu.
Ở catot (-)……………………………………………………………………………………………
Ở anot (+)……………………………………………………………………………………………
PT điện phân: ………………………………………………………………………………………..
c) Tính lượng chất thu được ở các điện cực
Dựa vào công thức Farađay: …………………………..
m: Khối lượng chất thu được ở điện cực (g).
A: Khối lượng mol nguyên tử của chất thu được ở điện cực.
n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận.
I: Cường độ dòng điện (ampe)
t: Thời gian điện phân (giây)
F: Hằng số Farađây (F = 96500).
Chủ đề 6: KIM LOẠI KIỀM – KIỀM THỔ - NHÔM VÀ HỢP CHẤT Trang 30
A.KIM LOẠI KIỀM – KIỀM THỔ
Phần 1: KIM LOẠI KIỀM
I – VỊ TRÍ TRONG BẢNG TUẦN HOÀN, CẤU HÌNH ELECTRON NGUYÊN TỬ
- Thuộc nhóm ………của bảng tuần hoàn, gồm các nguyên tố: …………………………….. và Fr (nguyên tố phóng xạ).
- Cấu hình electron nguyên tử:
Li: ……………. Na: ……………………………. K: ……………………………
Rb: ………………………….
Cs: ………………………
II – TÍNH CHẤT VẬT LÍ
* to sôi, to nóng chảy, KLR, độ cứng………………..
=> Do kim loại kiềm………………………………………… và ……………………… Li Na K Rb Cs
to sôi, to nóng chảy ……………………… từ Li đến Cs Khối lượng riêng
……………………… từ Li đến Cs Độ cứng
……………………… từ Li đến Cs
Mức độ hoạt động ……………………… từ Li đến Cs
III – TÍNH CHẤT HOÁ HỌC
Các nguyên tử kim loại kiềm có năng lượng ion hoá nhỏ, vì vậy kim loại kiềm có tính ………………..
Tính khử …………………dần từ Li Cs.
Trong các hợp chất, các kim loại kiềm có số oxi hoá …………….
1.Tác dụng với phi kim
a. Tác dụng với oxi
O2 khô: Na + O2 ............................................
Không khí khô: Na + O2 ........................................
b. Tác dụng với clo: K + Cl2 ........................................
2. Tác dụng với axit: phản ứng xảy ra mãnh liệt và gây nổ.
Na + HCl ...............................................................
Lưu ý: Kim loại kiềm + dung dịch axit: phản ứng axit trước, nếu hết axit kim loại còn dư thì sẽ phản ứng với nước.
3. Tác dụng với nước: Tất cả KLK (M) tác dụng ...................với nước và tăng dần từ...............................
M+ H2O ............................
K + H2O ............................ Trang 31
Để bảo vệ kim loại kiềm người ta ..............................................................
IV – ỨNG DỤNG, TRẠNG THÁI THIÊN NHIÊN VÀ ĐIỀU CHẾ 1. Ứng dụng:
- Hợp kim …………… Trao đổi nhiệt trong lò phản ứng hạt nhân.
- Hợp kim ..................... Siêu nhẹ dùng trong kĩ thuật hàng không.
- .................. tế bào quang điện.
2. Trạng thái tự nhiên
Tồn tại ở dạng hợp chất: NaCl (nước biển), một số hợp chất của kim loại kiềm ở dạng silicat và
aluminat có ở trong đất. 3. Điều chế:
Khử ion của kim loại kiềm trong hợp chất bằng cách điện phân nóng chảy hợp chất của chúng. M+ + e M đ𝑝𝑛𝑐 đ𝑝𝑛𝑐 NaCl → NaOH →
Phần 2: HỢP CHẤT CỦA KIM LOẠI KIỀM
I. NATRI HIĐROXIT: NaOH (xút ăn da) 1. Tính chất
* Chất rắn, không màu, hút ẩm, tan nhiều trong nước. * Tính bazơ:
a. Tác dụng với CO2, SO2: NaOH + CO2 → NaHCO3(1)
2NaOH + CO2 → Na2CO3 + H2𝑂(2) Đặt 𝑛𝑁𝑎𝑂𝐻 = 𝑇 𝑛𝐶𝑂2
T < 1: tạo NaHCO3, CO2 dư
T =1: tạo NaHCO3 (đủ)
1< T < 2: NaHCO3 và Na2CO3 T = 2: Na2CO3 => 𝑛Na = n 2CO3 CO2
T > 2: Na2CO3 và NaOH dư
b. Tác dụng với axit: HCl,H2SO4, HNO3 => Muối + H2O
NaOH + H2SO4 → .......................................... c. Tác dụng với muối: Trang 32
NaOH + CuSO4 → …………………………………………………… 𝑡0
NaOH + NH4Cl→ ............................................................................
2.Ứng dụng: Đứng hàng thứ 2 (sau H2SO4)
- NaOH dùng để nấu xà phòng, chế phẩm nhuộm, tơ nhân tạo, tinh chế quặng nhôm trong công nghiệp.
II. NATRI HIĐROCACBONAT:NaHCO3
III. NATRI CACBONAT: Na2CO3 1. Tính chất 1. Tính chất
a. Kém bền với nhiệt (dễ bị nhiệt phân)
a. Bền với nhiệt (không dễ bị nhiệt phân) 𝑡0 𝑡0
NaHCO3→ ..................................... Na2CO3→
b. Tính lưỡng tính
b. Tính chất của muối: tác dụng với axit,
NaHCO3 + HCl →.................................
muối, bazơ sau phản ứng phải có ↑, ↓)
NaHCO3 + NaOH→.............................
Na2CO3 + HCl → ....................................
c) Tính kiềm yếu, khi đun nóng tính
Na2CO3 + Ba(OH)2 → .............................. kiềm tăng.
Na2CO3 + CaCl2 → ................................... 2. Ứng dụng: Na2CO3 + AlCl3 + H2O→
+ Dược phẩm (thuốc đau dạ dày)
..............................................................................
+ Thực phẩm (bột nở)
c. Trong dd có môi trường kiềm (pH>7)
2. Ứng dụng: Công nghiệp thủy tinh, bột giặt.
Phần 3: KIM LOẠI KIỀM THỔ
I. VỊ TRÍ – CẤU TẠO
* Nhóm IIA gồm: ………………………………………Ra (phóng xạ)
* Có 2 electron lớp ngoài cùng.........................
* Cấu hình e: 12Mg..................................................; 20Ca:.................................................. * Kiểu mạng tinh thể: Be Mg Ca Sr Ba Kiểu mạng tinh thể
II. TÍNH CHẤT VẬT LÍ
* to sôi, to nóng chảy, KLR (D): biến đổi……………………………………………………………
do……………………………………
III. TÍNH CHẤT HÓA HỌC
Tính khử mạnh (…………dần từ Be => Ba) 𝑀 →………………………………………… Trang 33 𝑡0
1. Tác dụng với phi kim: Mg +Cl2 → ………………. 𝑡0
Ca + N2→ ……………….. 𝑡0
Mg + O2→ ..............................
2. Tác dụng với axit
a) Tác dụng vói HCl, H2SO4loãng tạo muối + H2
Mg + HCl → …………….................
Mg + H2SO4 loãng → ……………....
b) Tác dụng với H2SO4 đặc tạo Muối + SO2 + H2O
Mg + H2SO4 đặc→ ……………………+ .....SO2…+…………………………..
Ca + H2SO4 đặc→ ……………………+ S + ……………………………..
Ca + H2SO4 đặc→ .....................................+ H2S + ..........................................
c) Tác dụng với HNO3 tạo muối + (NO, NO2, N2, N2O, NH4NO3) + H2O
Ca + HNO3 loãng→ …...........................+ N2O +......................................
Mg + HNO3 loãng → ........................... + NH4NO3 +......................................
Mg + 4HNO3 đặc → ..............................................................................................
3. Tác dụng với nước: * Ở to thường:
- Be……………………………….- Mg………………………………..
- Ca, Sr, Ba: ……………………….
𝑀 + 𝐻2𝑂 →. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ..…..
IV. ĐIỀU CHẾ: Điện phân nóng chảy muối halogenua ñpnc MX M + X 2 2 ñpnc CaCl
.......................... ; 2
Phần 4. MỘT SỐ HỢP CHẤT QUAN TRỌNG CỦA KIM LOẠI KIỀM THỔ
I. CANXI HIĐROXIT Ca(OH)2 (vôi tôi (rắn màu trắng) hay dung dịch nước vôi trong)
* TCVL: Chất rắn, màu trắng, ít tan trong nước. * TCHH: Tính bazơ.
* Ứng dụng: Ca(OH)2 là một bazơ mạnh rẻ tiền nên được sử dụng rộng rãi trong nhiều ngành
công nghiệp: sản xuất ammoniac (NH3) , clorua vôi(CaOCl2), vật liệu xây dựng,…
* Dẫn CO2 dư vào nước vôi trong thì xuất hiện kết tủa và kết tủa tan.
CO2 + Ca(OH)2 → ................................... Trang 34
CO2dư + CaCO3 + H2O→ ………………….
II. CANXI CACBONAT CaCO3 (đá vôi)
* TCVL: Chất rắn, màu trắng, không tan trong nước (nhưng tan trong nước có khí CO2). * TCHH: 𝑡𝑜
a. Bị nhiệt phân hủy: CaCO3 → . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. (xảy ra trong quá trình nung vôi). (1)
b. Tan trong nước có CO2: CaCO3+ CO2+ H2𝑂 ⇄ Ca(HCO3)2
- Phản ứng thuận (1): giải thích sự………………………………………….
- Phản ứng nghịch (2): Giải thích sự hình thành……………………… trong hang động núi đá
vôi, cặn trong ấm nước…
* Trạng thái tự nhiên: Đá vôi, đá phấn, đá hoa, vỏ sò, ốc… * Ứng dụng:
+ Đá …….. dùng làm vật liệu xây dựng, sản xuất vôi, xi măng, thủy tinh,…
+ Đá ………dùng trong các công trình mỹ thuật (tạc tượng, trang trí,…)
+ Đá………. dễ nghiền thành bột mịn làm phụ gia của thuốc đánh răng,…
III. CANXI SUFAT CaSO4 (thạch cao)
* TCVL: Chất rắn, màu trắng, ít tan trong nước. * Phân loại: 3 loại
- Thạch cao sống: ……………………..
- Thạch cao nung ……………………...=> dùng: nặn tượng, đúc khuôn, bó bột khi gãy xương.
- Thạch cao khan…..............................
* Khi nghiền clanhke người ta cho thêm 5 – 10% thạch cao để điều chỉnh tốc độ đông cứng của xi măng. IV. NƯỚC CỨNG
1) Khái niệm: Nước cứng là nước có chứa nhiều ion……………………………Nước chứa ít hoặc
không chứa …………………………… là nước mềm. 2)Phân
Nước cứng tạm thời
Nước cứng vĩnh cửu
Nước cứng toàn phần loại Các ion: Các ion: Các ion Thành
………………………….
………………………….
……………………………. phần Vd: Vd:
Vd: …………………………
…………………………
………………………… Trang 35
3) Cách làm mềm nước:
Nguyên tắc làm mềm nước ứng:…………………………………………………………………..............
………………………………………………………………………………………………………………
*Phá độ cứng tạm thời:
*Phá độ cứng vĩnh cửu
Dùng :…………………..
…… hoặc dùng ……………. (vừa
Dùng :………………….. đủ), NaOH
CaCl2+Na2CO3→................ a.PP 𝑡0
Ca(HCO3)2→ .............................
...........................................
kết tủa Ca(HCO3)2+Ca(OH)2→................. MgSO4 + Na3PO4→..........
Ca(HCO3)2 + NaOH→ ...........
............................................
.........................................................
b. Phương pháp trao đổi ion: cho nước cứng đi qua chất trao đổi ion (ionit), chất này hấp thụ Ca2+, Mg2+,
giải phóng Na+, H+ → nước mềm => làm mềm nước cứng : tạm thời, vĩnh cửu, toàn phần.
4) Tác hại của nước cứng:
- Tốn nhiên liệu, gây nổ. - Tắc ống dẫn nước.
- Quần áo mau hư, tốn xà phòng (=> Nên dùng chất giặt rửa tổng hợp)
- Giảm hương vị của thức ăn, nấu thức ăn lâu chín.
B. NHÔM- HỢP CHẤT CỦA NHÔM Phần 1: NHÔM
I. VỊ TRÍ – CẤU TẠO
* 13Al : Cấu hình e:..................................................=>vị trí:ô.........chu kì.........nhóm .............
* Dễ nhường 3e lớp ngoài cùng => trong hợp chất Al luôn có số oxi hóa:.................
II. TÍNH CHẤT VẬT LÍ
* Màu trắng bạc, mềm, nhẹ, dễ kéo sợi dễ dát mỏng, dùng làm giấy gói kẹo, gói thuốc lá....
* Tính dẫn điện: ………………………………………………………………………………
III. TÍNH CHẤT HÓA HỌC
Tính khử mạnh (yếu hơn ....................) Al → . . . . . . . . . . . . . . . . . . . . . . . . . ..
1. Tác dụng với phi kim.
Bột Al tự bốc cháy khi tiếp xúc với khí clo: Al + Cl2........................................ Al + O2................
=> Nhôm bền trong không khí do có lớp......................................................... Trang 36
2. Tác dụng với axit:
a. Với dd HCl, H2SO4 loãng: => Muối + H2↑
Al + HCl → ..................................................
Al + H2SO4loãng → ...............................................
b. Với dd H2SO4 đặc nóng, HNO3 => Muối + Sản phẩm khử + H2O o t Al + H SO (ñaëc)
........................................................ 2 4 o t Al + HNO (ñaëc)
...................................................... 3 Al + HNO loaõ ng
............................N ............................ 3 2 Al + HNO loaõ ng
............................N O............................ 3 2 Al + HNO loaõ ng
............................NH NO ............................ 3 4 3
Chú ý: Al bị thụ động hóa với ………………………. và ……………………..
3.Tác dụng với oxit kim loại kém hoạt động hơn nhôm = phản ứng nhiệt ………… 𝑡𝑜
Al + Fe2𝑂3 → . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ..
Chú ý: ứng dụng dùng hàn ………………………..
4. Tác dụng với nước:
- Vật dụng bằng nhôm: không tác dụng với H2O do có …………………..………………..
……………………………………………………………………………………………………....
- Nếu phá vỡ màng oxit thì Al phản ứng với H2O: ......Al + ....H2𝑂 → .........................................
=> Phản ứng dừng lại do ……………. không tan sinh ra bám lên miếng Al.
5. Tác dụng với dung dịch kiềm:
…………………………………………………………………………………….
……………………………………………………………………………………
……………………………………………………………………………………
Al + NaOH + H2𝑂 → . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. IV. SẢN XUẤT NHÔM
1. Nguyên liệu: Quặng boxit ……………………….
2. Sản xuất: Điện phân nóng chảy hỗn hợp Al2O3 ( + Criolit Na3AlF6) * Tác dụng của criolit:
- Hạ ………………………….. (tác dụng chính).
- Tăng khả năng ………………….
- Bảo vệ nhôm khỏi bị ……………… trong không khí. Trang 37
* Khi điện phân nóng chảy Al2O3 thì
- Ở catot (-) xảy ra sự ……………. ...thành ……………: ...........................................
- Ở anot (+) xảy ra sự ……………… thành ………..: ...................................................
PT điện phân nóng chảy:………………………………………………………….....
V. ỨNG DỤNG – TRẠNG THÁI TỰ NHIÊN 1. Ứng dụng:
- Do Al nhẹ, bền đối với không khí và nước nên dùng chế tạo máy bay, ô tô, tên lửa, tàu vũ trụ…
- Do Al và hợp kim Al có màu trắng bạc đẹp nên dùng trong xây dựng...................và trang trí ...............
- Al nhẹ, dẫn điện tốt nên dùng làm ....................... thay cho đồng.
- Dẫn nhiệt tốt ít bị gỉ và không độc nên dùng làm dụng cụ ......................
- Làm hỗn hợp tecmit (bột Al+bột sắt oxit) thực hiện phản ứng nhiệt nhôm dùng hàn .......................
2. Trạng thái tự nhiên:
- Al là nguyên tố phổ biến thứ ba sau Si và oxi trong vỏ Trái Đất và chỉ tồn tại dạng hợp chất. - Hợp chất có nhôm: ................... ........... Boxit Criolit
Al2O3.2SiO2.2H2O K2O.Al2O3.6SiO2
............................ .................
Phần 2: HỢP CHẤT CỦA NHÔM NHÔM OXIT NHÔM HIĐROXIT NHÔM SUNFAT Al2O3 Al(OH)3 Al2(SO4)3
- Chất rắn màu trắng, - Kết tủa keo trắng * Phèn chua:
TCVL không tan trong nước.
..............................................
* Oxit ..........................
- Hiđroxit ........................
Hay ......................................
Al2O3+ HCl…………….... Al(OH)3+HCl……………... * Phèn nhôm:
TCHH ........................................... ............................................. Thay K+ = Na+, Li+, NH + 4 Al2O3 + NaOH………… Al(OH)3+ NaOH…………
..........................................
.............................................. Có 2 dạng:
- Đánh trong nước, thuộc
* Al2O3 ngậm nước là quặng boxit: dùng sản xuất Al. da, phẩm nhuộm, giấy... Ứng
* Al2O3 khan: tinh thể đá quý (ít phổ biến):Dùng làm trang * Cơ chế lóng phèn: dụng
sức, làm chất xúc tác tổng hợp hữu cơ,…... 3+ + 2Al +6H O 2Al(OH) +6H 2 3
Al(OH) dạng keo sẽ kết 3
dính các chất bẩn lắng Trang 38 xuống, làm nước trong.
MỘT SỐ HIỆN TƯỢNG LIÊN QUAN ĐẾN NHÔM VÀ HỢP CHẤT.
Al tác dụng được với dd axit HCl và dd kiềm NaOH nhưng không gọi Al là kim loại lưỡng tính. =>
nhớ: Al2O3 là oxit lưỡng tính; Al(OH)3 là hiđroxit lưỡng tính. TT Thí nghiệm Hiện tượng
Phương trình hóa học 1 Dd NaOHdư + dd AlCl3
.............................. NaOH+AlCl3 ……………………
............................... NaOHdư+Al(OH)3 ……………….. 2
Dd NaOH + dd AlCl3ddư .............................. NaOH+AlCl3 …………
............................... Al(OH)3 ……………….. với AlCl3dư 3 dd NH3 vào dd AlCl3
.............................. AlCl3+ NH3+ H2O ………………….. (NH3dư hoặc AlCl3dư)
............................... Al(OH)3 ………… trong dd NH3dư hoặc AlCl3dư
Phương án tốt nhất điều chế Al(OH)3 là cho muối Al3+ tác dụng với dd …………… 4
CO2 dư vào dd natri .............................. NaAlO2 +CO2+ H2O aluminat NaAlO2
............................... Al(OH)3 …………… trong khí CO2 dư. 5
Dd HCl dư vào dd natri .............................. NaAlO2 +HCl + H2O ...................... aluminat NaAlO2
............................... Al(OH)3 + HCldư ............... 6
Dd HCl vào dd natri .............................. NaAlO2 +HCl + H2O …………………… aluminat NaAlO2 dư
............................... Al(OH)3 ................. với AlCl3dư
=>Phương án tốt nhất tái tạo Al(OH)3 từ muối NaAlO2 là sục khí ……….. dư vào dung dịch muối này.
CHỦ ĐỀ 7: SẮT VÀ HỢP CHẤT CỦA SẮT Phần 1: SẮT
I. VỊ TRÍ – CẤU TẠO – TRẠNG THÁI TỰ NHIÊN
1. Vị trí – cấu tạo
* Ô 26, chu kì 4, nhóm VIIIB, cấu hình electron …………………………. hay [Ar]……..
* Cấu hình ion Fe2+: [Ar]……. Fe3+: [Ar]……
2. Tính chất vật lí
* Dẻo, dẫn điện, dẫn nhiệt tốt… Trang 39
* Có tính nhiễm từ
3. Trạng thái tự nhiên Quặng Hematit đỏ Hematit nâu Manhetit Xiđerit Pirit sắt ....................... Công Hàm lượng Fe thức ............
II. TÍNH CHẤT HÓA HỌC
Tính khử trung bình => Fe2+, Fe3+ Tính chất PTHH Ghi chú 𝑡𝑜
Fe + O2 → . . . . . . . . . . . . . . . . . . . . . . . . . . Tính oxi hóa
1. Tác dụng với phi kim: O2, 𝑡𝑜
Fe + Cl → . . . . . . . . . . . . . . . . . . . . . . . . . . của Cl 2 2, S…. 𝑡𝑜 S……O2….Cl2
Fe + S → ....................................
2. Tác dụng với dd HCl, dd
Fe + HCl → . . . . . . . . . . . . . . . . . . . . . . . . . .
H2SO4 loãng => Muối Fe (II) + Fe + H
→ . . . . . . . . . . . . . . . . . . . . . . .. H 2SO4 2↑ Fe bị thụ động
3. Tác dụng với dd HNO3, o t
Fe + H SO (ñaëc) ........................................... hóa trong H 2 4
2SO4 đặc nóng => Muối Fe o t
Fe + HNO (ñaëc) ............................................. HNO 3 3, H2SO4
(III) + (NO2, NO…SO2) + H2O (đặc nguội)
3. Tác dụng với dung dịch
Fe + CuSO → . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. muối 4
HT:…………………………………… Fe : đinh sắt
Fe đẩy được những kim loại
…………………………………………
đứng sau Fe ra khỏi muối.
Phần 2. HỢP CHẤT CỦA SẮT
Hợp chất sắt (II)
Hợp chất sắt (III) - Tính oxi hóa
- Tính oxi hóa(đặc trưng) - Tính khử (đặc trưng)
- FeO, Fe(OH)2 thể hiện tính bazơ.
- Fe2O3, Fe(OH)3 thể hiện tính bazơ.
1. Sắt (II) oxit = FeO
1. Sắt (III) oxit = Fe2O3 Trang 40
- FeO là chất bột màu…………, không tan trong - Fe2O3 là chất bột màu ………… không tan nước. trong nước. -FeO là oxit bazơ: - Fe2O3 là oxit bazơ
FeO + HCl →. . . . . . . . . . . . . . . . . . . . . ..
Fe2𝑂3+ HCl → .....................……………. - FeO có tính khử: - Fe2O3 có tính oxi hóa: FeO + HNO 𝑡𝑜
3 →. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ..
Fe2𝑂3+..Al → . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. - Điều chế: 𝑡𝑜
- Điều chế: Fe(OH) → ...................................... 𝑡𝑜,khôngcókhôngkhí 3
Fe(OH)2 → . . . . . . . . . . . . . . . . . . . ..
2. Sắt (II) hiđroxit = Fe(OH)2
2. Sắt (III) hiđroxit = Fe(OH)3
- Fe(OH)2 là kết tủa màu …………….. (lục nhạt). - Fe(OH)3 là kết tủa màu ……………….. - Fe(OH)2 có tính bazơ - Fe(OH)3 có tính bazơ:
Fe(OH)2+...HCl →. . . . . . . . . . . . . . . . . . . . . . ..
Fe(OH)3+....HCl → .......................... - Fe(OH)2 là chất khử:
Fe(OH)2+ O2+ H2𝑂 → .....................
- Điều chế:FeCl2+ NaOH →
- Điều chế: FeCl3+ NaOH →
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ..
. . . . . . . . . . . . . . . . . . . . . . . . . . .. 3. Muối sắt (II) 3. Muối sắt (III) FeSO4.7H2O; FeCl2.4H2O
Fe2(SO4)3 .9H2O ; FeCl3.6H2O
a. TCHH: Tính khử + Tính oxi hóa
a. TCHH: Tính oxi hóa
=> khử: FeCl2+ Cl2 → ...................
FeCl3+ Fe → .................... FeSO4 + KMnO4+ H2SO4
FeCl3+ Cu → ................................
→ .................................................................
=> oxi hóa: Zn+FeCl2 → ........................ b. Điều chế: b. Điều chế: - Fe + dd HCl, H2SO4 loãng.
- Fe + HNO3, H2SO4 đặc nóng.
- FeO, Fe(OH)2 + dd HCl, H2SO4 loãng.
- Fe(OH)3, Fe2O3 + axit HCl, H2SO4 loãng...
4. Ứng dụng của hợp chất sắt (II)
4. Ứng dụng của hợp chất sắt (III)
+ Muối FeSO4: diệt sâu bọ, diệt cỏ.
- Phèn sắt – amoni được dùng làm trong nước.
+ Muối sắt (II): pha sơn, mực, nhuộm vải.
- Muối FeCl3 chất cầm máu.
- Fe2O3 dùng pha sơn chống gỉ.
MỘT SỐ LƯU Ý VỀ SẮT VÀ HỢP CHẤT SẮT
* Hợp chất sắt chỉ có tính oxi hóa là hợp chất sắt ............Fe2O3, FeCl3, Fe(OH)3,Fe2(SO4)3,… Trang 41
* Hợp chất sắt mang tính khử (khử chủ yếu) và oxi hóa là hợp chất sắt......: FeO,FeCl2,Fe(OH)2,FeSO4…
* Fe và các hợp chất Fe (II) hoặc Fe3O4 + HNO3 thì xảy ra phản ứng .................. => tạo khí.
(HNO3 loãng tạo khí NO; HNO3 đặc tạo khí NO2)
* Fe +HNO3,H2SO4đặc nóng dư →tạo hợp chất sắt......................................
Fedư + HNO3,H2SO4đặc nóng dư →tạo hợp chất sắt..................................
* Fe2O3; Fe(OH)3 + HNO3 không tạo ra........................ và không thuộc loại pứ .........................
* Fe +...AgNO3dư →..................................
Fedư +.....AgNO3 → ..................................
* Zn, Al, Mgdư + Fe(NO3)3 : Fe(III) bị khử đến Fe
Mgdư + Fe(NO3)3 → ...........................................
* Zn, Al, Mg +Fe(NO3)3 dư: Fe(III) bị khử đến Fe(II) :
Mg + Fe(NO3)3 dư → ...........................................
Phần 3: HỢP KIM CỦA SẮT GANG THÉP 1. Định nghĩa 1. Định nghĩa
Gang là hợp kim Fe – C (…..% - ….%) và một Thép là hợp kim Fe – C (…..% -…..%) và
số nguyên tố khác: Si, Mn, S...
một lượng rất ít các nguyên tố Si, Mn...
2. Phân loại: Có 2 loại:
2. Phân loại: Có 2 loại:
* Gang ……..: Chứa ít C, rất ít Silic, chứa a) Thép thường (thép cacbon) nhiều xementit Fe3C.
- Thép mềm: Chứa không quá ………%C.
- Gang …….. cứng và giòn được dùng để luyện Được dùng để kéo sợi, cán thành thép lá dùng thép.
chế tạo các vật dụng trong đời sống và xây
* Gang ……….: Chứa nhiều C, Si. dựng nhà cửa.
- Gang ……… ít cứng và ít giòn được dùng để - Thép cứng: Chứa trên …….% C, được đúc các vật dụng.
dùng để chế tạo các công cụ, các chi tiết máy
như các vòng bi, vỏ xe bọc thép,…
b) Thép đặc biêt:
- Thép chứa 13% Mn rất cứng, được dùng để làm máy nghiền đá.
- Thép chứa khoảng 20% Cr và 10% Ni rất
cứng và không gỉ, được dùng làm dụng cụ gia
đình (thìa, dao,…), dụng cụ y tế. Trang 42
- Thép chứa khoảng 18% W và 5% Cr rất
cứng, được dùng để chế tạo máy cắt, gọt như
máy phay, máy nghiền đá,…
3. Nguyên liệu sản xuất gang
3. Nguyên liệu sản xuất
- Quặng sắt : quặng …………….: …………
- Gang …………., ………..xám, Thép phế - ………….. liệu. - Chất chảy: ………… - Chất chảy:………… - Không khí. - Không khí hoặc O2
- Nhiên liệu là dầu mazut, khí đốt.
4. Nguyên tắc luyện gang: dùng chất khử CO
4. Nguyên tắc sản xuất thép: Oxi hóa các
để khử các oxit sắt thành sắt (PP nhiệt luyện)
………….trong ……….để làm giảm tỉ lệ C, +3 +CO +8/3 +CO +2 +CO Si, S, P có trong gang.
Fe2𝑂3 → Fe 3𝑂4 → Fe𝑂 → Fe Tam từ nhị nguyên
5. Những phản ứng hóa học chính
5. Những phản ứng hóa học chính
* Phản ứng tạo thành chất khử CO: 𝑡𝑜 C+O2 → ………. 𝑡𝑜 C+O 𝑡𝑜 2 → ……….. S+O2 → ……….. 𝑡𝑜 CO 𝑡𝑜 2+C → ………. Si+O2 → ………..
* Phản ứng khử oxit sắt: 𝑡𝑜 P+5O → … … . .
Tam→từ →nhị→nguyên 2 400𝑜𝐶 CaO+P → ………… Fe 2𝑂5
2𝑂3+CO → ………….+………. 500-600𝑜𝐶 CaO+SiO2 → …………..
Fe3𝑂4+CO → ………….+………. 700-800𝑜𝐶
FeO+CO → ………….+………. * Phản ứng tạo xỉ: 𝑡𝑜
CaCO3 → ………….+………. 𝑡𝑜 CaO+SiO2 → …………….
* Gang và thép đều chứa ………… và ……… (……….. chiếm chủ yếu).
* Chất xỉ đều có ở cả quá trình luyện gang và thép là …………..: CaO + SiO2→…….
* Nguyên liệu sản xuất gang là quặng ……… (thường là Hematit đỏ ………). Trang 43
CHỦ ĐỀ 8: NHẬN BIẾT CÁC CHẤT HỮU CƠ VÀ VÔ CƠ
1. Dựa vào cation (ion dương) Cation Thuốc thử Dấu hiệu
Phương trình ion rút gọn
Các hợp chất của Na khi cháy đều cho Na+ Ngọn lửa Màu vàng ngọn lửa màu vàng. dd kiềm/to và Khí có mùi khai và làm NH + + 4 giấy quỳ tím ướt NH +3OH− → NH xanh giấy quì tím ướt 4 3 ↑ +H2𝑂 Mg2+ ↓ trắng Mg(OH)2 Mg2++2OH− → Mg(OH)2 ↓ ↓ keo trắng Al(OH)3 tan Al3++3OH− → Al(OH)3 ↓ Al3+
trong dd NaOH dư (không Al3++3NH3+3H2𝑂 → Al(OH)3 ↓
dd kiềm: NaOH tan trong dd NH + 3) +3NH4 (Hoặc dd NH3) ↓ xanh Cu(OH)2 Cu2++2OH− → Cu(OH)2 ↓ Cu2+ Cu(OH)2 tan trong dd NH3 Cu2++2NH3+2H2𝑂 → Cu(OH)2
=> dd có màu xanh lam ↓ +2NH + 4 Cu(OH)2+4NH3 đặc trưng → [Cu(NH3)4](OH)2 * dd kiềm hoặc Fe2++2OH− → Fe(OH) * ↓ Fe(OH) 2 ↓ 2 trắng xanh Fe2+ dd NH3 MnO −+5Fe2++8H+ * dd KMnO 4 4/H+ * Mất màu dd KMnO4 → Mn2++5Fe3++4H2𝑂 * dd kiềm, * ↓ nâu đỏ Fe(OH) Fe3++3OH− → Fe(OH) Fe3+ 3 3 ↓ dd NH3 Ba2+ * dd SO 2- 2- 4 /H+ * ↓ trắng BaSO4 Ba2++SO4 → BaSO4 ↓ Ca2+ dd Na 2- 2CO3 ↓ trắng CaCO3 Ca2++CO3 → CaCO3 ↓
2.Dựa vào anion (ion âm) Anion Thuốc thử Dấu hiệu
Phương trình ion rút gọn ↓ trắng AgCl Ag++Cl− → AgCl ↓ Cl-
(Đặc biệt AgCl tan trong AgCl+2NH dd NH 3 → [Ag(NH3)2]Cl 3) Br- Dd AgNO3/H+ ↓ vàng nhạt AgBr Ag++Br− → AgBr ↓
↓ vàng đậm AgI (không tan I- Ag++I− → AgI ↓ trong HNO3 loãng) Trang 44
↓ vàng (tan trong HNO PO 3- 3 3- 4 3Ag++PO → Ag loãng) 4 3PO4 ↓ SO 2- 2- 4 Dd BaCl2/H+ ↓ trắng BaSO4 Ba2++SO4 → BaSO4 ↓ * dd HCl, H2SO4 ↑ sủi bọt khí CO CO 2-+2H+ → CO (l) 2 3 2 ↑ +H2𝑂 CO 2- 3 ↓ trắng CaCO CO 2-+Ca2+ → CaCO * dd CaCl 3, BaCO3 3 3 ↓ 2, BaCl2
3. NHẬN BIẾT CÁC CHẤT KHÍ Khí Thuốc thử Dấu hiệu
Phương trình hóa học dd nước vôi trong ↓ trắng CaCO CO 3, BaCO3 (dd 2 Ca(OH)2 hoặc dd bị đục) CO
2+Ca(OH)2 → CaCO3 ↓ +H2𝑂 Ba(OH)2 SO2+Br2+H2𝑂 → 2HBr+H2SO4 * dd Br * dd mất màu đỏ nâu 2 5SO2+2KMnO4+2H2𝑂 * dd KMnO * dd mất màu tím 4 → 2H2SO4 + SO2 2MnSO4+K2SO4
* Giấy quỳ tím ướt. * Hóa đỏ
SO2+Ca(OH)2 → CaSO3 ↓ +H2𝑂 * dd Ca(OH) * ↓ trắng CaCO 2 3(dd bị đục) dd Pb(NO H 3)2, 2S ↓ đen PbS, CuS 𝐻 Cu(NO
2S+Pb(NO3)2 → PbS ↓ +2HNO3 3)2 NH3
* Giấy quỳ tím ướt. * Hóa xanh (khí mùi khai) * HCl đặc * Tạo khói trắng
NH3(𝑘)+HCl(𝑘) → NH4Cl(𝑟) Trang 45 Trang 46


