












Preview text:
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022
XÉT NGHIỆM PHÂN MẢNH DNA TINH TRÙNG VÀ HỖ TRỢ TRONG SINH SẢN
Vô sinh được định nghĩa là sự thất bại của một cặp vợ chồng để đạt được thai kỳ lâm
sàng sau một năm quan hệ tình dục thường xuyên, không dùng các biện pháp bảo vệ. Hiện nay,
vô sinh đang ảnh hưởng đến hơn 180 triệu người trên toàn thế giới, trong đó yếu tố vô sinh nam
giới được tìm thấy ở gần 10% ở các cặp vợ chồng và chịu trách nhiệm cho khoảng 50% nguyên
nhân gây ra vô sinh. Vô sinh nam được biết đến là rối loạn của hệ thống sinh sản, chủ yếu gây
ra bởi các yếu tố liên quan đến tinh dịch, di truyền và bẩm sinh, khiếm khuyết giải phẫu, rối
loạn nội tiết, bất thường về miễn dịch hoặc chức năng,…[1]. Đánh giá khả năng sinh sản của
nam giới vẫn dựa vào phân tích tinh dịch thông thường Trên thực tế, khoảng 15% bệnh nhân
vô sinh có phân tích tinh dịch đồ bình thường. Tuy nhiên, đánh giá nồng độ tinh trùng, khả
năng vận động và hình thái có thể không phản ánh đầy đủ tính toàn vẹn DNA tinh trùng, gây
bất lợi cho việc thụ tinh bình thường, phát triển phôi và thành công của công nghệ hỗ trợ sinh
sản [2], trong khi tính toàn vẹn DNA của tinh trùng có vai trò quan trọng, không thể thiếu đối
với sự ra đời khỏe mạnh của con cái. Ngày càng có nhiều bằng chứng chỉ ra sự phân mảnh
DNA tinh trùng (SDF), dấu hiệu của nhiễm sắc thể bị tổn thương, có vai trò độc lập và đáng
chú ý trong vô sinh nam và tỷ lệ thành công sinh sản [3,4,5].
Tinh trùng là kết quả của quá trình phức tạp và sự biệt hóa tế bào. Giai đoạn chính của
giảm phân là ở kì đầu I, nơi các tế bào sinh tinh tạo ra sự phá vỡ DNA chuỗi kép (double strand
DNA breaks - DSB) thông qua protein SPO11. DSB là cần thiết cho các nhiễm sắc thể tương
đồng để diễn ra quá trình tái tổ hợp DNA. DSB kích hoạt hệ thống sửa chữa DNA thông qua
protein kinase ataxia-telangiectasia đột biến (ATM) để sửa chữa các đầu tự do và tạo ra điểm
tiếp xúc (chiasma) bằng cách tái tổ hợp tương đồng và ATM cũng chịu trách nhiệm ức chế sự
hình thành DSB mới bởi SPO11. Sau khi giảm phân, tinh trùng trải qua quá trình biệt hóa tế
bào, chúng mất hầu hết các phần của tế bào chất, hình thành midpiece và đuôi để có khả năng
vận động sau khi xuất tinh. Tuy nhiên, về mặt chất nhiễm sắc, sự thay đổi quan trọng nhất xảy
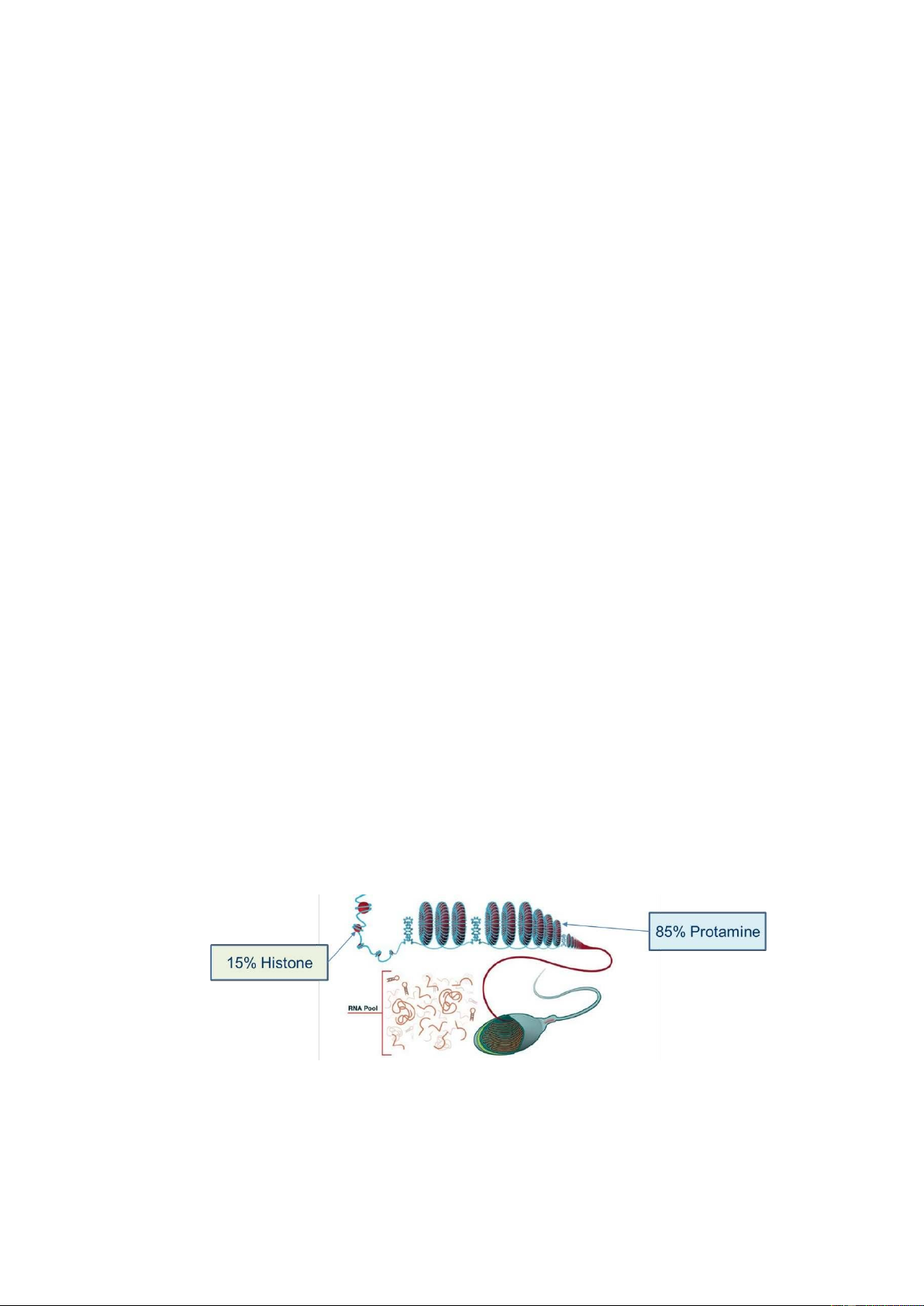
ra ở tinh trùng là sự thay thế histones bằng các protamine, điều này xảy ra khoảng 85% DNA
tinh trùng và giữ chúng trong cấu trúc hình xuyến liên kết với ma trận hạt nhân bởi các vùng
đính kèm ma trận (vùng MAR). Các vùng MAR này vẫn được nén bởi histones và chiếm một
phần rất nhỏ của bộ gen, khoảng 15% của nhiễm sắc thể tinh trùng. Việc siêu nén DNA này với
các protamines, kết hợp với một cấu trúc di động của tế bào, cung cấp cho tinh trùng khả năng
hoàn hảo để mang vật liệu di truyền đến tế bào trứng để tạo thành hợp tử. Rõ ràng nếu cấu trúc
này có chứa sự thay đổi, những điều này có thể ảnh hưởng đến hợp tử theo một cách nào đó [17].
Phân mảnh DNA của tinh trùng (Sperm DNA Fragmentation - SDF), hoặc phân mảnh
tinh trùng (Sperm Fragmentation), đề cập đến các tổn thương hoặc phá vỡ trong vật liệu di
truyền của tinh trùng, và là một trong những nguyên nhân chính của vô sinh nam. Phân mảnh
DNA tinh trùng (SDF) có thể được gây ra bởi các yếu tố bên ngoài (nghĩa là phơi nhiễm nhiệt,
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022
hút thuốc, các chất ô nhiễm môi trường, hóa trị liệu) cũng như các yếu tố bên trong (sự trưởng
thành của tế bào mầm khiếm khuyết, apoptosis không hoàn toàn và stress oxy hóa [OS]) [2].
Bệnh nhân bị phân mảnh DNA tinh trùng có thể bị ảnh hưởng xấu đến khả năng thụ tinh, đặc
biệt khi mức độ phân mảnh cao. Mức độ stress oxy hóa (OS) gây ra chết tế bào thông qua
apoptosis có thể phá vỡ tất cả các khía cạnh chức năng của tinh trùng, bao gồm khả năng vận
động, exocytosis acrosomal và phản ứng tổng hợp tế bào sinh tinh. Tuy nhiên, tinh trùng với
nhiễm sắc thể hỏng có thể giữ được khả năng thụ tinh của chúng. Nhiều nghiên cứu đánh giá
SDF cho thấy tinh trùng vẫn có khả năng thụ tinh có thể được giải thích, ít nhất là một phần,
bởi tính chất đa dạng của DNA và khả năng sửa chữa của tế bào trứng [1].
Trọng tâm chính của nghiên cứu SDF trong 20 năm qua đã nhấn mạnh ảnh hưởng của
các yếu tố lối sống, giãn mạch thừng tinh và nhược tinh (asthenozoospermia). SDF tăng cao có
liên quan đến vô sinh nam do các yêu tố độ tuổi, ung thư, bệnh mãn tính, tiếp xúc với độc tố
môi trường và các yếu tố lối sống [1]. Đại dịch Covid-19 toàn cầu gây ra các vấn đề nghiêm
trọng đến hệ thống chăm sóc y tế với rất nhiều người tử vong. Các ảnh hưởng chính của virus
được hướng vào hệ hô hấp nhưng nhiều nghiên cứu đã xác nhận rằng các mô khác cũng dễ bị
ảnh hưởng bởi virus, bao gồm thận, gan, cơ bắp, hệ thần kinh và lách. Một vấn đề khác liên
quan đến Covid-19 có thể được cộng đồng quan tâm lớn là ảnh hưởng đến hệ thống sinh sản
của nam giới [7]. Trên thực tế, nhiễm SARS-CoV-2 gây các tình trạng viêm tinh hoàn do OS,
tinh trùng bất thường, suy giảm chất lượng tinh dịch, phân mảnh DNA tinh trùng, ảnh hưởng
xấu đến khả năng sinh sản của nam giới [6,8,9,10].
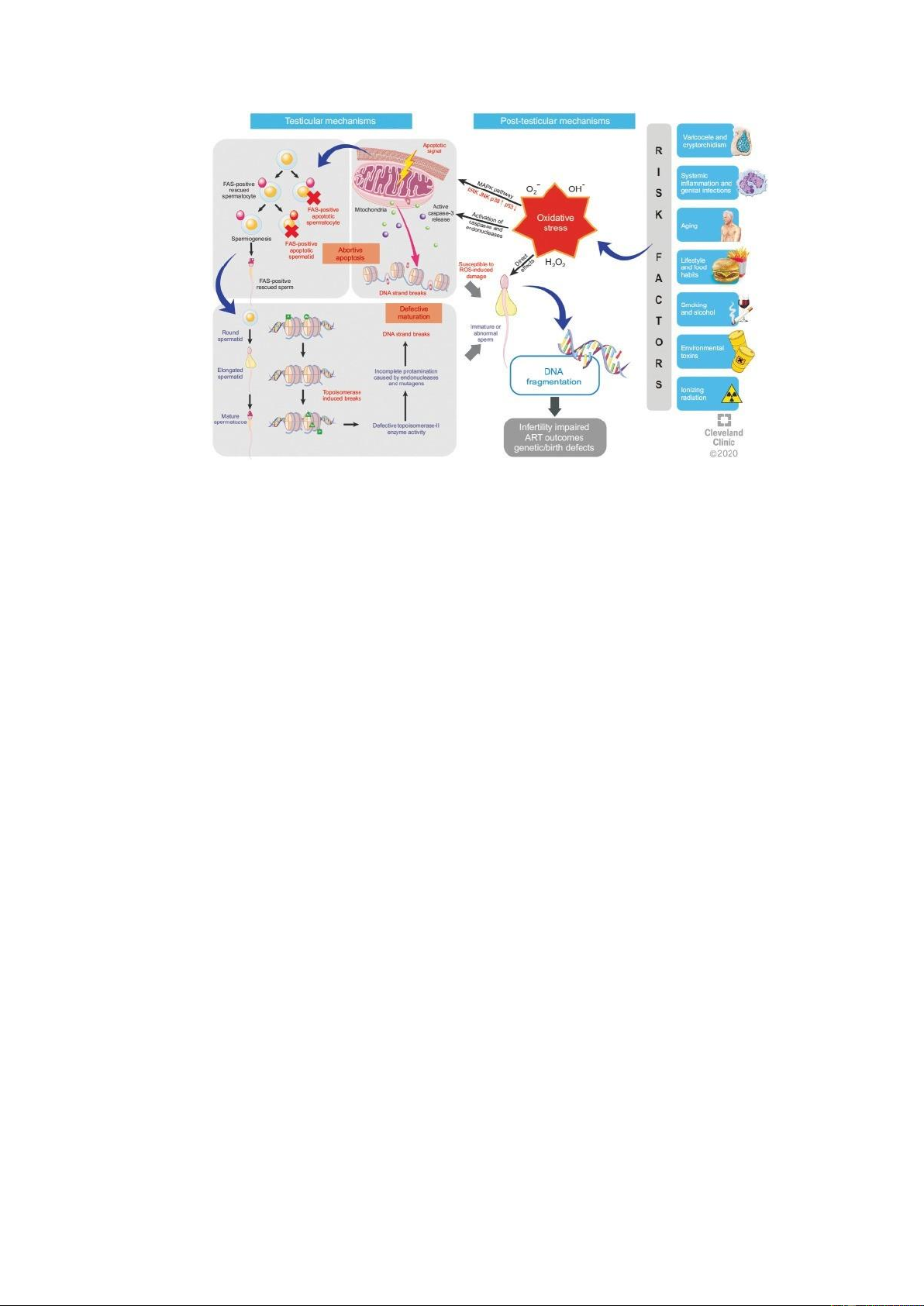
SDF chủ yếu xuất hiện do sự trưởng thành khiếm khuyết của tinh trùng trong tinh hoàn,
hoặc stress oxy hóa (OS) trong hệ thống sinh sản nam giới. Trong quá trình sinh tinh, chất
nhiễm sắc được nén thông qua thay thế histone bằng protamine [17]. Điều này được thực hiện
bởi topoisomerase II nội sinh, tạo ra sự phá vỡ DNA để giảm căng thẳng xoắn cho việc tháo
histone và đóng gói chất nhiễm sắc [18]. Nếu không được sửa chữa, sự suy yếu trong quá trình
đóng gói chất nhiễm sắc có thể dẫn đến sự trưởng thành khiếm khuyết và sự xuất hiện của tinh
trùng với SDF tăng lên trong xuất tinh. SDF cũng có thể xuất hiện bởi apoptosis thất bại trong
quá trình sinh tinh. Apoptosis đảm bảo không có tế bào mầm khiếm khuyết được biệt hóa thành
tinh trùng, tuy nhiên sự thất bại của quá trình này có thể dẫn đến sự gia tăng của tinh trùng
khiếm khuyết trong tinh dịch [19]. Apoptosis ngoại bào qua trung gian liên kết FAS-ligand với
các thụ thể FAS, DRS, TNFR1, kích hoạt caspase-8 hoặc 10. Sự gia tăng của FAS trong tinh
trùng là một chỉ số về tăng apoptosis thất bại. ROS quá mức có thể gây ra tổn thương DNA và
cũng kích hoạt các con đường apoptotic trong tinh trùng. Hơn nữa, SDF có thể do stress oxy
hóa thông qua các sản phẩm phụ của peroxid hóa lipid, cụ thể là malondialdehyde (MDA) và
4-hydroxynonenal (4HNE) có thể tạo thành DNA adducts, chẳng hạn như 8-hydroxy-2′-
deoxyguanosine (8-OHDG), 1, N6-ethenoadenosine và 1, N6ethenoguanosine, dẫn đến tổn
thương DNA [20]. OS kích hoạt con đường MAPK, tăng biểu hiện p53 và caspase 3 và giảm
biểu hiện BCL-2 làm suy giảm sự trưởng thành và thúc đẩy apoptosis. OS kích hoạt apoptosis
nội bào trong tinh trùng, trong đó ngoại hóa phosphatidylserine là một dấu hiệu sớm và SDF là
một dấu hiệu muộn của apoptosis. Quá trình này được bắt đầu thông qua trung gian ty thể,
trong đó cytochrom C được giải phóng vào cytosol dẫn đến kích hoạt phân giải protein của caspase 3, 6 và 7 [1].
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022
Như đã đề cập, stress oxy hóa (OS) được coi là một nguyên nhân quan trọng của vô
sinh nam. OS được gây ra khi sự cân bằng giữa các chất oxy hóa và chất khử (chất chống oxy
hóa) bị phá vỡ do tăng sản xuất các loại oxy hóa phản ứng (ROS). Mức độ tăng của ROS có
thể ảnh hưởng đến tính toàn vẹn cấu trúc và chức năng của tinh trùng, bao gồm khả năng vận
động, hình thái, số lượng, khả năng sống và mức độ phân mảnh DNA tinh trùng [21]. Điều này
có thể làm giảm tỷ lệ thụ tinh, giảm tỷ lệ chuyển phôi, làm giảm sự phát triển phôi và tăng tỷ lệ mất thai.
Độ tuổi cao cho thấy sự gia tăng của SDF, SDF bắt đầu từ tuổi sinh sản và tăng gấp đôi
trong độ tuổi từ 20 đến 60 tuổi [22]. Độ tuổi tăng dẫn đến sự đóng gói nhiễm sắc thể bị lỗi và
apoptosis bị rối loạn xảy. Các tình trạng lâm sàng dẫn đến tăng SDF bao gồm giãn tĩnh mạch
tinh, tổn thương tinh hoàn, tăng nhiệt độ nội mô dẫn đến OS và apoptosis. Nhiễm trùng tuyến
sinh dục và bạch cầu làm tăng sản xuất ROS, làm tăng SDF [23].
Các yếu tố lối sống và môi trường cũng gây ra SDF. Nam giới béo phì có mức độ OS
và SDF cao hơn so với cân nặng bình thường hoặc nam giới thừa cân [24]. Tăng nhiệt độ bìu,
mất cân bằng nội tiết là các cơ chế liên quan giữa béo phì với chức năng tinh trùng thay đổi và
giảm khả năng sinh sản. Thật vậy, các nghiên cứu đã cho thấy sự cải thiện đáng kể về SDF và
khả năng sinh sản tổng thể với việc giảm cân. Đàn ông mắc tiểu đường cho thấy mức độ SDF
cao hơn do OS, kết hợp với việc tạo ra các sản phẩm cuối glycation thứ cấp. SDF tăng khi nhiệt
độ sinh lý bìu tăng nhẹ 2 - 3℃, một phần qua trung gian qua OS gây ra apoptosis và tăng biểu
hiện protein gây căng thẳng [25]. Nhiệt độ bìu tăng lên do các bất thường về thể chất như tinh
hoàn ẩn bẩn sinh, tinh hoàn co rút lại và giãn mạch thừng tinh, cũng như lối sống ít vận động.
Phơi nhiễm với các kim loại nặng như chì, cadmium, fenvalerate (thuốc trừ sâu tổng hợp) và
thuốc trừ sâu organophospho có thể gây tổn thương DNA. Ảnh hưởng của độc tố trong nghề
nghiệp phụ thuộc vào mức độ tiếp xúc và thời gian phơi nhiễm. Bisphenol A và Styrene được
tìm thấy trong cao su tổng hợp hoặc polyesters, cũng làm thay đổi tính toàn vẹn DNA của tinh
trùng [26]. Hút thuốc lá tác động tiêu cực đến tính toàn vẹn DNA do các chất chuyển hóa như
nicotine, cadmium, chì và benzopyrene. Sử dụng rượu cũng có thể làm tăng SDF và apoptosis
[27]. Các yếu tố rủi ro lâm sàng và môi trường làm tăng sản xuất ROS theo các cơ chế khác
nhau, dẫn đến OS và cuối cùng dẫn đến SDF.
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022
Tác động của SDF đối với thành công sinh sản phụ thuộc vào sự cân bằng giữa mức độ
tổn thương DNA và khả năng sửa chữa DNA của tế bào trứng. Mặc dù quá trình sửa chữa có
thể xảy ra ở giai đoạn pronuclei trước khi thụ tinh, nhưng người ta thấy rằng tổn thương DNA
tinh trùng vượt quá khả năng sửa chữa của tế bào trứng, hoặc tế bào trứng sửa chữa DNA thất
bại, ảnh hưởng đến tiềm năng phát triển phôi và sức khỏe của con cái. Trong những trường hợp
này, nhiễm sắc thể tinh trùng được đóng gói bằng protaminase không được thay thế đủ bằng
histones, cần thiết cho quá trình sao chép DNA bình thường. Ví dụ, bất thường quá trình oxy
hóa DNA có thể dẫn đến đột biến thay thế (ví dụ: G - C thành T - A), thay đổi biểu hiện gen
nếu không được sửa chữa bởi các enzyme oocyte base excision repair (BER) trước khi diễn ra
pha S hợp tử (zygote S phase). Do đó, phôi có thể không phát triểnhoặc làm tổ ở tử cung hoặc
có thể bị sảy thai sớm tự nhiên ở giai đoạn sau. Ngược lại, nếu các cơ chế sửa chữa DNA hiện
tại trong tế bào trứng có thể khôi phục bộ gen ổn định về mặt sinh học, tổng hợp bình thường
và sự phát triển phôi sau đó vẫn có thể xảy ra [2].
Có nhiều phương pháp được sử dụng để đánh giá mức độ SDF trong lâm sàng thông
qua chỉ số DFI (DNA Fagmentation Index). Phương pháp TUNEL dựa trên việc gắn gốc 3′ OH
nicks tự do với dUTP. Phương pháp Comet xác định SDF dựa trên sự phân tách điện di của
DNA trong đó DNA tổn thương có hình dạng giống như sao chổi. Trong SCD (Sperm
Chromatin Dispersion), DNA bị phân mảnh không tạo ra các quầng sáng đặc trưng như quầng
sáng của các mạch vòng DNA nguyên vẹn sau khi biến tính bằng axit và loại bỏ các protein
nhân. Với phương pháp SCSA (Sperm Chromatin Structure Assay), DNA tinh trùng bị phân
mảnh đã biến tính sẽ bắt màu đỏ, còn DNA nguyên vẹn sẽ bắt màu xanh khi nhuộm với acridine
orange [34]. Các kỹ thuật được sử dụng phổ biến trong xét nghiệm SDF là SCSA và SCD [17].
Trong đó, SCSA được xem là tiêu chuẩn vàng trong đánh giá phân mảnh ADN tinh trùng
[35,36], có độ chính xác cao [36], không phụ thuộc vào kinh nghiệm của người thực hiện, quy
trình thực hiện đơn giản, thời gian trả kết quả nhanh. Nghiên cứu thực hiện tại Mỹ (2016) cho
thấy SCSA là phương pháp xác định mức độ phân mảnh tinh trùng có độ chính xác và đặc hiệu
cao hơn hẳn so với các phương pháp khác (SCD, TUNEL, COMET) [37].
Một bước quan trọng trong việc tìm giải pháp cho vô sinh liên quan đến xác định nguyên
nhân. Phương pháp SCSA xác định một cách nhanh chóng và chính xác những nam giới ít có
khả năng thụ thai tự nhiên hoặc với các kỹ thuật hỗ trợ sinh sản (IUI, IVF/ICSI). Kết quả từ xét
nghiệm phân mảnh DNA tinh trùng bằng phương pháp SCSA có thể giúp các cặp vợ chồng và
bác sĩ đưa ra phác đồ điều trị thích hợp. DFI sử dụng để chỉ ra tiềm năng sinh sản theo phương pháp SCSA (bảng) [38].
Kết quả mang thai (không có yếu tố vô sinh nữ) %DFI Tốt đến rất tốt < 15% Vừa đến tốt 15% ≤ DFI < 25% Thấp đến vừa 25% ≤ DFI < 40% Rất thấp ≥ 40%
Theo Esteves (2021), ngưỡng lâm sàng cho xét nghiệm phân mảnh DNA tinh trùng
bằng phương pháp SCSA đưa ra khuyến cáo cho các bác sĩ lâm sàng trong chẩn đoán và can
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022
thiệp điều trị cho bệnh nhân. Chẩn đoán vô sinh nam nếu DFI > 20%. Thực hiện can thiệp IUI
nếu DFI > 20% và can thiệp IVF/ICSI nếu DFI > 30% - 35% [16].
Như đã đề cập, tính toàn vẹn của DNA tinh trùng đóng vai trò quan trọng trong quá
trình thụ tinh và phát triển phôi sớm. Khả năng thụ thai tự nhiên có thể bị ảnh hưởng nếu tính
toàn vẹn này không được đảm bảo. Nhiều nghiên cứu chỉ ra mức độ SDF cao đi cùng sự phát
triển phôi kém, tỷ lệ làm tổ thấp hơn và tỷ lệ xảy thai cao hơn [39]. Trong phân tích tổng hợp
bao gồm 3 nghiên cứu và 616 cặp vợ chồng cho thấy mức độ SDF cao liên quan đến khả năng
mang thai tự nhiên giảm [40]. Do các khuyến khuyết của tinh trùng có thể không thể quan sát
thất, xét nghiệm SDF có thể mang lại thông tin bổ sung cho đánh giá chất lượng tinh trùng của nam giới [39].
Đối với các phương pháp hỗ trợ sinh sản, DFI cao có thể ảnh hưởng tiêu cực đến kết
quả của các kỹ thuật hỗ trợ sinh sản (IUI, IVF/ICSI). Liên quan đến bơm tinh trùng vào buồng
tử cung (IUI), Chen và cộng sự đã phân tích kết quả của 10 nghiên cứu và chứng minh rằng
mức độ SDF cao có liên quan đến tỷ lệ mang thai và tỷ lệ sinh thấp hơn đáng kể [41]. Trong
nghiên cứu năm 2020 của Sugihara và cộng sự đã phân tích của 3 nghiên cứu và báo cáo rằng
trong khi SDF thấp có liên quan đến tỷ lệ mang thai tốt hơn [42]. DFI ảnh hưởng tới sự thành
công của IUI, DFI tăng khiến cho tỉ lệ thành công của IUI giảm mạnh [12]. DFI liên hệ đồng
biến với tỉ lệ thành công IVF một cách rõ rệt hơn so với tỉ lệ thành công của ICSI [11]. Nghiên
cứu trên 234 cặp đôi với 285 mẫu tinh dịch, cho kết quả không có khác biệt giữa ICSI và IVF
khi DFI < 27%, IVF không thể thành công khi DFI > 27% [31]. Nghiên cứu 203 cặp đôi IVF
và 136 cặp đôi ICSI, kết quả IVF thấp hơn đáng kể (13%) khi DFI > 50% và không thấy sự
khác nhau khi thực hiện ICSI [32]. Năm 2021, nghiên cứu thực hiện trên 357 cặp đôi cho thấy
tỷ lệ thành công khi thực hiện IUI giảm khi DFI > 20% và tỷ lệ thành công là 0 - 5% khi DFI
> 30% [3]. Có những nghiên cứu cho thấy có sự liên hệ đồng biến giữa DFI và tỉ lệ phôi tốt
[13]. Nghiên cứu thực hiện trên 163 cặp đôi năm 2021, cho thấy DFI > 20% cho tỷ lệ hình
thành phôi nang giảm (p < 0,05) và cho tỷ lệ xảy thai cao hơn [28]. DFI liên quan một cách rõ
rệt với sảy thai, DFI tăng làm tăng nguy cơ sảy thai [14]. Năm 2020, nghiên cứu trên 2000 cặp
đôi, kết quả cho thấy tỷ lệ mang thai lâm sàng thấp hơn nếu DFI cao (p < 0,05), tỷ lệ mang thai
lâm sàng lần lượt là 59,6% (DFI < 15%); 28,3% (15% 40%) [30].
Mức độ DFI cao ảnh hưởng tiêu cực đến kết quả IVF/ICSI. Nghiên cứu trên 550 cặp đôi người
Trung Quốc (415 thực hiện IVF, 135 thực hiện ICSI), DFI > 22,3% giảm tỷ lệ thành công thụ
tinh lâm sàng khi thực hiện IVF/ICSI [33]. Nhiều nghiên cứu chứng minh SDF cao có liên quan
đến việc giảm tỷ lệ mang thai với IUI, IVF và tỷ lệ sảy thai tăng theo cả IVF và ICSI. Tác động
tiêu cực của mức độ DFI cao đối với tỷ lệ thành công trong hỗ trợ sinh sản có thể khuyến khích
nhiều bác sĩ lâm sàng sử dụng xét nghiệm SDF trong lâm sàng.
Giãn mạch thừng tinh là nguyên nhân chính xác phổ biến nhất của vô sinh nam, phổ
biến ở khoảng 40% nam giới bị vô sinh nguyên phát và lên đến 80% nam giới bị vô sinh thứ
phát. Can thiệp điều trị phẫu thuật cắt bỏ giãn mạch thừng tinh không đúng bệnh nhân là một
lý do quan trọng của các tranh cãi liên quan đến ảnh hưởng của điều trị đối với hiệu quả mang
thai. Điều này được giải quyết bằng cách can thiệp phẫu thuật cho bệnh nhân mắc bệnh rõ ràng
về mặt lâm sàng và các thông số tinh dịch bất thường [43]. Tuy nhiên, ngay khi thực hiện can
thiệp với bệnh nhân thích hợp, kết quả thai kỳ chỉ đạt 40% - 50% sau phẫu thuật [44]. Nhiều
nghiên cứu đã chứng mình mối quan hệ giữa nam giới mắc giãn mạch thừng tinh và mức độ
SDF cao [45,46,47]. Trong nghiên cứu thực hiện trên 2399 nam giới, 16,3% (391/2399) được
chẩn đoán mắc bệnh giãn mạch thừng tinh [46]. Nam giới mắc giãn mạch thừng tinh có tỷ lệ
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022
SDF trong tinh dịch tăng (p < 0,05), sự đóng gói nhiễm sắc thể bất thường (p = 0,001) so với
nam giới không mắc bệnh.
Sẩy thai tái phát (RPL) là tình trạng sảy thai 3 lần liên tiếp nhau lúc thai nhỏ hơn 20
tuần tuổi hoặc trọng lượng thai nhỏ hơn 500g. Sẩy thai trước 20 tuần thai kỳ đã được chứng
minh có liên kết với mức độ SDF cao trong một số nghiên cứu. Các nghiên cứu được thực hiện
bằng các phương pháp xét nghiệm SDF khác nhau như SCD, TUNEL và SCSA đã báo cáo mức
SDF cao hơn đáng kể ở những bệnh nhân mắc RPL so với nhóm chứng bình thường. Năm
2019, Tan và cộng sự thực hiện nghiên cứ tổng hợp trên 12 nghiên cứu với 1169 nam giới trong
đó 530 nam giới đã mắc RPL đã thực hiện xét nghiệm SDF và 639 nam giới trong nhóm đối
chứng. Kết quả nghiên cứu cho thấy các cặp vợ chồng có tiền sử RPL không rõ nguyên nhân
có mức SDF cao hơn so với các cặp đôi đối chứng (p < 0,001) [48]. Nghiên cứu trên 872 cặp
đôi cho thấy 42,3% nam giới mắc RPL có mức DFI cao (DFI ≥ 30.0%) [29]. Năm 2020, trong
nghiên cứu thực hiện tại Trung Quốc trên 461 nam giới mắc RPL và 411 nam giới trong nhóm
đối chứng bình thường, kết quả cho thấy tỷ lệ nam giới bị phân mảnh DNA nghiêm trọng (DFI
≥ 30,0%) cao hơn đáng kể ở nhóm RPL (42,3%) so với nhóm đối chứng (13,1%) [49]. Những
kết quả này hỗ trợ giá trị chẩn đoán của SDF so với phân tích tinh dịch thông thường, cũng như
hỗ trợ xác định nguyên nhân của RPL không giải thích được.
Vô sinh nam vô căn (UMI) đề cập đến nam giới có kết quả phân tích tinh dịch nằm
trong các giá trị bình thường và các bất thường về thể chất cũng như nội tiết đã được loại trừ,
nhưng người vợ vẫn chưa có thai sau một năm chung sống, quan hệ tình dục trung bình 2-3
lần/tuần, không sử dụng bất kỳ biện pháp tránh thai nào. Nhiều nghiên cứu cho thấy những
người đàn ông có thông số tinh dịch bình thường vẫn có thể có SDF cao. Nghiên cứu của
Oleszczuk và cộng sự cho thấy 10,5% nam giới có thông số tinh dịch tiêu chuẩn bình thường
có mức DFI ≥ 20.0% [50]. Tương tự, vô sinh nam vô căn có liên quan đến SDF cao, nhiều
nghiên cứu đã xác nhận mối tương quan nghịch đáng kể giữa mức SDF và số lượng tinh trùng,
khả năng vận động và hình thái bình thường [51,52,53]. Trong một tỷ lệ đáng kể của các trường
hợp vô sinh nam "không giải thích được", tính toàn vẹn DNA tinh trùng ít nhất có thể giải thích
như là một phần của vấn đề về kết quả sinh sản. Xét nghiệm phân mảnh DNA tinh trùng có thể
giúp xác định nam giới có vấn đề về khả năng sinh sản và do đó có thể giúp đỡ trong việc tư
vấn cho các cặp vợ chồng vô sinh. DFI tinh trùng không tương quan mạnh với các thông số
tinh dịch thông thường. Do đó, xét nghiệm phân mảnh DNA tinh trùng nên được thực hiện như
một bước bổ sung trong việc điều tra khả năng sinh sản của nam giới [52,53].
Nhiều nghiên cứu khác nhau đã chứng minh một số yếu tố lối sống/phơi nhiễm môi
trường với mức SDF cao. Những yếu tố rủi ro cao này được chia thành [1]: -
Các tác nhân vật lý như bức xạ và nhiệt -
Các tác nhân hóa học như khói thuốc lá, ô nhiễm không khí và hóa trị liệu -
Các yếu tố sinh học bao gồm nhiễm trùng lây truyền qua đường tình dục,
độ tuổi,chỉ số khối cơ thể (BMI) và các tình trạng y tế như bệnh tiểu đường, hay như
mới đây nhất là nhiễm Covid-19.
Đánh giá chất lượng và tổn thương DNA tinh trùng của 118 nam giới từ tỉnh Jilin, Trung
Quốc, những người đang tiếp xúc với bức xạ ion hóa. Kết quả là sự vận động và hình thái bình
thường của tinh trùng thấp hơn đáng kể trong nhóm phơi nhiễm so với nhóm đối chứng. Chỉ số
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022
phân mảnh DNA của tinh trùng cao hơn đáng kể so với nam giới đối chứng [60]. Nghiên cứu
trên 30 nam giới trưởng thành khỏe mạnh chịu sự nóng lên của bìu ở 43 ° C trong 30-40 phút
trong hai ngày liên tiếp mỗi tuần trong 3 tháng, các thông số tinh trùng như tính toàn vẹn DNA
tinh trùng, nhiễm sắc thể, hoạt động acrosin, alpha-glucosidase tinh dịch bị ảnh hưởng bởi việc
tiếp xúc với nhiệt độ stress nhiệt tinh hoàn không đổi vài độ so với nhiệt độ sinh lý bình thường
[64]. Nghiên cứu 83 nam giới tiếp xúc với bức xạ ion hóa, kết quả cho thấy tính toàn vẹn của
nhiễm sắc thể tinh trùng đã thay đổi liên quan đến việc tăng mức độ chống oxy hóa huyết tương
tinh dịch [66]. Các nghề có đặc thù tiếp xúc với các yếu tố bức xạ, tăng nhiệt độ bìu, bác sĩ lâm
sàng có thể khảo sát nghề nghiệp bệnh nhân để chỉ định xét nghiệm và có phác đồ điều trị phù hợp.
Nghiên cứu trên 327 nam giới tại Łodź, Poland tiếp xúc với các chất ô nhiễm không khí
được kiểm tra (PM10, PM2.5, SO2, NOX, CO). Kết quả cho thấy tiếp xúc với các chất ô nhiễm
không khí (PM10, PM2.5, CO, NOX) liên quan tiêu cực đến mức độ testosterone. Phơi nhiễm
với PM2.5, PM10 làm tăng tỷ lệ tế bào có chất nhiễm sắc chưa trưởng thành (HDS) [54]. Tiếp
xúc với cadmium làm suy giảm sự sinh tinh, chất lượng tinh dịch, tổng hợp/giải phóng nội tiết
tố và suy giảm khả năng sinh sản [55]. Ngoài ra, phơi nhiễm cadmium clorua dẫn đến tăng tỷ
lệ tinh trùng hình thái bất thường, phản ứng acrosome sớm, giảm số lượng tế bào tinh trùng và
tăng phân mảnh DNA [56]. Chất lượng tinh trùng và tính toàn vẹn DNA là các thông số chức
năng có thể được sử dụng để đánh giá phơi nhiễm nghề nghiệp với khả năng sinh sản của nam
giới. Pyrethroid là dẫn xuất của este cacboxylat (còn gọi là este pyrethrum hoặc este của
pyrethrin) được sử dụng nhiều trong thuốc trừ sâu. Nghiên cứu trên 240 nam giới Trung Quốc
cho thấy Pyrethroid tác động tiêu cực đến tính toàn vẹn DNA của tinh trùng và chất lượng tinh
dịch ở nam giới [57]. Năm 2019, nghiên cứu thực hiện trên 500 cặp đôi chỉ ra tác hại của việc
hút thuốc, tác động với các thông số tinh dịch, tính toàn vẹn của DNA tinh trùng và sự phân
mảnh DNA tinh trùng do cotinine và apoptotic caspase-3. Các bệnh nhân vô sinh có hút thuốc
(< 10 thuốc lá/ngày) có những thay đổi đáng kể về sự phân mảnh tinh trùng, caspase-3 và
cotinine tác động tiêu cực đến khả năng vận động, hình thái và pH của tinh dịch so với các đối
tượng vô sinh không hút thuốc [59,61]. Mức OS tăng cao được cho là cơ chế chính dẫn đến
SDF với các phơi nhiễm này. Hơn nữa, phơi nhiễm nghề nghiệp đã được chứng minh có ảnh
hưởng đến SDF và thay đổi khả năng sinh sản.
Nghiên cứu trên 54 nam giới Nhật Bản cho thấy sự vận động tiến triển của tinh trùng
và sử dụng rượu mãn tính (DFI tăng lên 49,6 ± 23,3%) là những yếu tố dự báo đáng kể của
SDF [58]. Đánh giá tác động của bệnh tiểu đường loại I (DM1) và loại II (DM2) trên 38 bệnh
nhân DM1 và 55 bệnh nhân DM2 có tiền sử vô sinh vô căn và 100 nam giới trong nhóm đối
chứng đến chức năng của tinh trùng. Kết quả cho thấy chất lượng tinh trùng (giảm vận động,
tăng phân mảnh DNA tinh trùng và giảm sức sống) so với nhóm đối chứng [62]. Chế độ ăn
uống là một biến phơi nhiễm khá phức tạp, tuy nhiên nhiều nghiên cứu đã được thực hiện với
nhiều kết quả khác nhau. Nghiên cứu bao gồm 336 nam giới có nồng độ tinh dịch bình thường
từ 20 đến 300 mln/ml hoặc mắc oligozoospermia nhẹ (nồng độ tinh dịch 15-20 mln/ml) và chế
độ ăn uống được đánh giá thông qua bảng câu hỏi tần số sử dụng thực phẩm và các mô hình
chế độ ăn uống được xác định bằng phân tích nhân tố. Chế độ ăn có ảnh hưởng đến nồng độ
tinh trùng, mức độ testosterone. Các chế độ ăn khác nhau cho kết quả phân tích khác nhau [63].
Đánh giá 1824 mẫu tinh dịch được lấy từ nam giới trải qua đánh giá/điều trị khả năng sinh sản,
cho thấy chỉ số khối cơ thể (BMI) cao ảnh hưởng tiêu cực đến nồng độ, sức sống, khả năng vận
động, hình thái tinh trùng và tăng tổn thương ty thể trong tinh trùng (p < 0.05) [65]. Trong một
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022
nghiên cứu khác trên 305 nam giới, giá trị BMI tăng có liên quan đến việc giảm hoạt động của
ty thể, sự vận động và tăng phân mảnh DNA tinh trùng [67]. Hậu quả bất lợi của các yếu tố
sinh học đối với kết quả hỗ trợ sinh sản (ART), bác sĩ lâm sàng nên thảo luận về việc giảm cân
khi tư vấn cho các cặp vợ chồng quan tâm đến điều trị khả năng sinh sản.
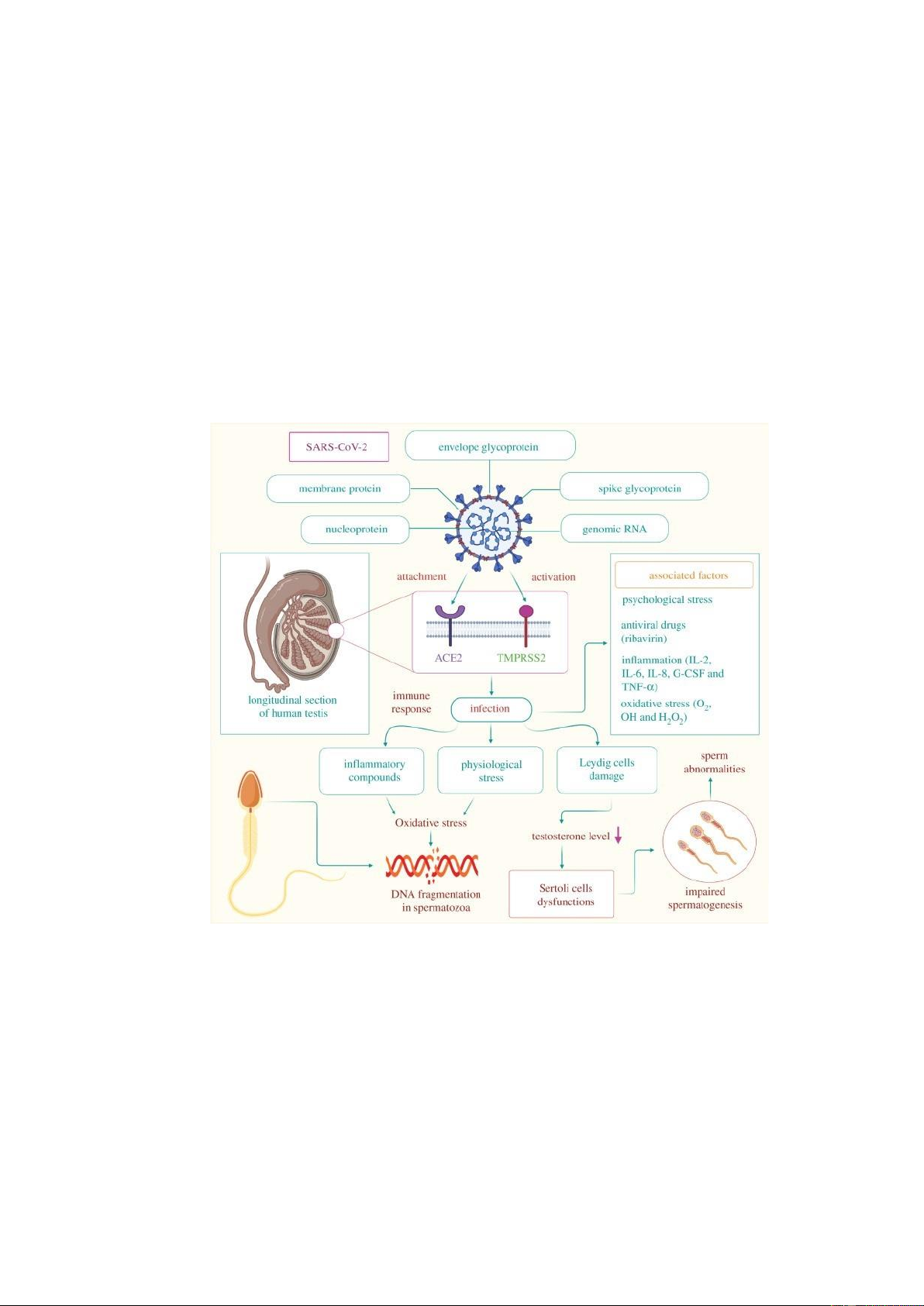
Theo nhiều nghiên cứu trong và sau đại dịch Covid-19, cho thấy ảnh hưởng rõ ràng của
SARS-CoV-2 đối với sức khỏe sinh sản nam giới [7]. SARS-CoV-2 xâm nhập vào hệ thống
sinh sản thông qua thụ thể ACE2 và TMPRSS2 có trên các mô tinh hoàn. Khi nhiễm, phản ứng
miễn dịch được kích hoạt, cơ thể sản xuất chất gây viêm khác nhau (cytokine, …) gây ra stress
oxy hóa (OS) trong các tế bào tinh hoàn, dẫn tới phân mảnh DNA tinh trùng. Căng thẳng tâm
lý khác nhau khi mắc Covid-19 dẫn đến việc sản xuất oxy hóa phản ứng (ROS) dẫn tới phân
mảnh DNA tinh trùng. SARS-CoV-2 cũng gây tổn thương các tế bào Leydig (vùng kẽ tinh
hoàn), giảm sản xuất testosterone, cản trở hoạt động chức năng đặc biệt của tế bào Sertoli. Chức
năng suy giảm phá vỡ quá trình sinh tinh dẫn đến tinh trùng bất thường [9].
Theo báo cáo trường hợp tại Nhận Bản năm 2021, bệnh nhân cho thấy sự gia tăng DFI
từ 29% lên 76% trong một vài tháng. DFI tinh trùng đã trở lại mức cơ bản sau bốn tháng (nhiều
hơn một chu kỳ sinh tinh hoàn chỉnh) sau khi nhiễm Covid-19 [68]. Nghiên cứu trên 20 bệnh
nhân Covid-19 cho thấy các tác động bất lợi của Covid-19 đối với các đặc tính của tinh trùng
(khả năng vận động của tinh trùng và phân mảnh DNA tinh trùng) gây ra bởi stress oxy hóa,
sau đó kết quả giảm sau ngày 120 [69]. Nghiên cứu năm 2021 trên 120 bệnh nhân Covid-19 tại
Bỉ đã hồi phục, giảm vận động được tìm thấy ở 60% nam giới được xét nghiệm trong thời gian
ngắn (<1 tháng), 37% nam giới xét nghiệm 1 đến 2 tháng và 28% nam giới xét nghiệm > 2
tháng. Số lượng tinh trùng trung bình đã giảm ở 37% nam giới được xét nghiệm trong thời gian
ngắn (<1 tháng), 29% nam giới đã xét nghiệm 1 đến 2 tháng, 6% nam giới xét nghiệm > 2 tháng
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022
[70]. Các cặp vợ chồng có mong muốn mang thai nên được cảnh báo rằng chất lượng tinh trùng
sau khi nhiễm trùng Covid-19 có thể bị ảnh hưởng tiêu cực. Thời gian phục hồi ước tính là 3
tháng, nhưng các nghiên cứu tiếp theo đang được tiến hành để xác nhận điều này và để xác
định xem thiệt hại vĩnh viễn có xảy ra ở một số ít nam giới hay không.
SDF gây bất lợi cho việc thụ tinh bình thường, phát triển phôi và thành công của kỹ
thuật hỗ trợ sinh sản, thử nghiệm SDF đang ngày càng được sử dụng trong việc đánh giá vô
sinh nam. SDF có thể được tạo ra một cách nội sinh hoặc bởi OS. Nó cũng có thể là kết quả
của các nguồn ngoại sinh bao gồm tình trạng bệnh lâm sàng (varicocele, ung thư, tiểu đường),
các yếu tố nguy cơ lối sống (hút thuốc, nghiện rượu, béo phì, covid-19) và phơi nhiễm môi
trường (ô nhiễm không khí, thuốc trừ sâu, hóa chất công nghiệp). Có nhiều phương pháp kiểm
tra SDF khác nhau. Ngưỡng 20% được cho là có độ chính xác phân biệt tốt giữa nam giới bình
thường và chẩn đoán vô sinh. Đánh giá tài liệu kỹ lưỡng được trình bày xác định các kịch bản
lâm sàng cụ thể trong đó xét nghiệm SDF có lợi nhất. Chúng bao gồm những bệnh nhân bị vô
sinh không rõ nguyên nhân, RPL, giãn mạch thừng tinh, hỗ trợ sinh sản và ở những người có
yếu tố nguy cơ lối sống/môi trường cao. Điều trị chống oxy hóa, thay đổi lối sống, phẫu thuật
cắt bỏ và sử dụng các kỹ thuật lựa chọn tinh trùng cho ICSI là các ví dụ về phương pháp điều
trị có thể được sử dụng ở những bệnh nhân như vậy.
TÀI LIỆU THAM KHẢO [1]
Esteves, S. C., Zini, A., Coward, R. M., Evenson, D. P., Gosálvez, J., Lewis, S., Sharma, R.,
&Humaidan, P. (2021). Sperm DNA fragmenta 琀椀 on tes 琀椀 ng: Summary evidence and clinical prac 琀 椀 ce recommenda 琀 椀
ons. Andrologia, 53(2), e13874. h 琀 琀
ps://doi.org/10.1111/and.13874 [2]
Agarwal, A., Majzoub, A., Baskaran, S., Panner Selvam, M. K., Cho, C. L., Henkel, R.,
Finelli,R., Leisegang, K., Sengupta, P., Barbarosie, C., Parekh, N., Alves, M. G., Ko, E., Arafa, M., Tadros, N.,
Ramasamy, R., Kavoussi, P., Ambar, R., Kuchakulla, M., Robert, K. A., … Shah, R. (2020). Sperm DNA
Fragmenta 琀椀 on: A New Guideline for Clinicians. The world journal of men's health, 38(4), 412–
471. h 琀琀 ps://doi.org/10.5534/wjmh.200128 [3]
Rex, A. S., Wu, C., Aagaard, J., & Fedder, J. (2021). DNA Fragmenta 琀椀 on in
HumanSpermatozoa and Pregnancy Rates a 昀琀 er Intrauterine Insemina 琀椀 on. Should the DFI Threshold Be
Lowered?. Journal of clinical medicine, 10(6), 1310. h 琀琀 ps://doi.org/10.3390/jcm10061310 [4]
Zhu, X. B., Chen, Q., Fan, W. M., Niu, Z. H., Xu, B. F., & Zhang, A. J. (2020). Sperm
DNAfragmenta 琀椀 on in Chinese couples with unexplained recurrent pregnancy loss. Asian journal
of andrology, 22(3), 296–301. h 琀琀 ps://doi.org/10.4103/aja.aja_60_19
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022 [5]
Cheng, H., Han, M., Ding, J., Wang, F., Wang, G., Shen, L., Wang, J., Zheng, B., Meng,
Q.,Wang, W., Yang, S., & Li, H. (2020). Importance of a semen analysis report for determining the rela
琀椀 onship between SCSA sperm DNA fragmenta 琀椀 on index and assisted reproduc 琀椀 ve
technology pregnancy rate. Reproduc 琀 椀
ve biology, 20(4), 460–464. h 琀 琀
ps://doi.org/10.1016/j.repbio.2019.09.002 [6]
Delli Mu 琀椀, N., Finocchi, F., Tosse 琀琀 a, G., Salvio, G., Cu 琀椀 ni, M., Marzioni,
D., & Balercia, G.(2022). Could SARS-CoV-2 infec 琀椀 on a 昀昀 ect male fer 琀椀 lity and sexuality?.
APMIS : acta pathologica, microbiologica, et immunologica Scandinavica, 130(5), 243–252. h 琀琀
ps://doi.org/10.1111/apm.13210 [7]
Sengupta, P., & Du 琀琀 a, S. (2020). Does SARS-CoV-2 infec 琀椀 on cause sperm
DNAfragmenta 琀椀 on? Possible link with oxida 琀椀 ve stress. The European journal of contracep
琀椀 on & reproduc 琀椀 ve health care : the o 昀케 cial journal of the European Society of Contracep
琀椀 on, 25(5), 405– 406. h 琀琀 ps://doi.org/10.1080/13625187.2020.1787376 [8]
Du 琀琀 a, S., & Sengupta, P. (2020). SARS-CoV-2 infec 琀椀 on, oxida 琀椀 ve stress
and malereproduc 琀椀 ve hormones: can tes 琀椀 cular-adrenal crosstalk be ruled-out?. Journal of
basic and clinical physiology and pharmacology, 31(6), 10.1515/jbcpp-2020-0205. h 琀 琀
ps://doi.org/10.1515/jbcpp2020-0205 [9]
Roychoudhury, S., Das, A., Jha, N. K., Kesari, K. K., Roychoudhury, S., Jha, S. K., Kosgi, R.,
Choudhury, A. P., Lukac, N., Madhu, N. R., Kumar, D., & Slama, P. (2021). Viral pathogenesis of SARS-
CoV-2 infec 琀椀 on and male reproduc 琀椀 ve health. Open biology, 11(1), 200347. h 琀琀
ps://doi.org/10.1098/rsob.200347 [10]
Mintziori, G., Duntas, L. H., Vene 琀椀, S., & Goulis, D. G. (2022). Metabolic, Oxida 琀
椀 ve andPsychological Stress as Mediators of the E 昀昀 ect of COVID-19 on Male Infer 琀椀 lity: A
Literature Review. Interna 琀椀 onal journal of environmental research and public health, 19(9), 5277.
h 琀琀 ps://doi.org/10.3390/ijerph19095277 [11]
Malić Vončina, S., Stenqvist, A., Bungum, M., Schyman, T., & Giwercman, A. (2021).
Sperm DNA fragmenta 琀椀 on index and cumula 琀椀 ve live birth rate in a cohort of 2,713 couples
undergoing assisted reproduc 琀椀 on treatment. Fer 琀椀 lity and sterility, 116(6), 1483–1490. h 琀
琀 ps://doi.org/10.1016/j.fertnstert.2021.06.049 [12]
Depuydt, C., Donders, G., Verstraete, L., Beert, J., Salembier, G., Bosmans, E., Dhont, N.,
Kerkhofs, C., & Ombelet, W. (2021). Nega 琀椀 ve Impact of Elevated DNA Fragmenta 琀椀 on and
Human Papillomavirus (HPV) Presence in Sperm on the Outcome of Intra-Uterine Insemina 琀椀 on
(IUI). Journal of clinical medicine, 10(4), 717. h 琀琀 ps://doi.org/10.3390/jcm10040717 [13]
Duarte, C., Núñez, V., Wong, Y., Vivar, C., Benites, E., Rodriguez, U., Vergara, C.,
&Ponce, J. (2017). Impact of the Z poten 琀椀 al technique on reducing the sperm DNA fragmenta 琀
椀 on index, fer 琀椀 liza 琀椀 on rate and embryo development. JBRA assisted reproduc 琀椀 on, 21(4), 351–355.
h 琀琀 ps://doi.org/10.5935/1518-0557.20170055
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022 [14]
Deng, C., Li, T., Xie, Y., Guo, Y., Yang, Q. Y., Liang, X., Deng, C. H., & Liu, G. H. (2019).
Sperm DNA fragmenta 琀椀 on index in 昀氀 uences assisted reproduc 琀椀 ve technology outcome:
A systema 琀椀 c review and meta-analysis combined with a retrospec 琀椀 ve cohort study. Andrologia, 51(6), e13263.
h 琀琀 ps://doi.org/10.1111/and.13263 [16]
Esteves, S. C., Zini, A., Coward, R. M., Evenson, D. P., Gosálvez, J., Lewis, S., Sharma,
R.,& Humaidan, P. (2021). Sperm DNA fragmenta 琀椀 on tes 琀椀 ng: Summary evidence and clinical prac 琀 椀 ce recommenda 琀 椀
ons. Andrologia, 53(2), e13874. h 琀 琀
ps://doi.org/10.1111/and.13874 [17]
Ribas-Maynou, J., & Benet, J. (2019). Single and Double Strand Sperm DNA Damage: Di 昀昀 erent Reproduc 琀椀 ve E 昀昀 ects on Male Fer 琀椀 lity. Genes, 10(2), 105. h 琀 琀
ps://doi.org/10.3390/genes10020105 [18]
Rousseaux, S., Boussouar, F., Gaucher, J., Reynoird, N., Montellier, E., Curtet, S., Vi 琀
琀 e, A.L., & Khochbin, S. (2011). Molecular models for post-meio 琀椀 c male genome reprogramming. Systems biology in reproduc 琀 椀 ve medicine, 57(1-2), 50–53. h 琀 琀
ps://doi.org/10.3109/19396368.2010.498076 [19]
Mar 琀椀 n-Hidalgo, D., Bragado, M. J., Ba 琀椀 sta, A. R., Oliveira, P. F., & Alves, M.
G. (2019). An 琀椀 oxidants and Male Fer 琀椀 lity: from Molecular Studies to Clinical Evidence. An 琀
椀 oxidants (Basel, Switzerland), 8(4), 89. h 琀琀 ps://doi.org/10.3390/an 琀椀 ox8040089 [20]
Moazamian, R., Polhemus, A., Connaughton, H., Fraser, B., Whi 琀 椀 ng, S.,
Gharagozloo, P.,& Aitken, R. J. (2015). Oxida 琀椀 ve stress and human spermatozoa: diagnos 琀椀 c
and func 琀椀 onal signi 昀椀 cance of aldehydes generated as a result of lipid peroxida 琀椀 on.
Molecular human reproduc 琀椀 on, 21(6), 502–515. h 琀琀 ps://doi.org/10.1093/molehr/gav014 [21]
Agarwal, A., Roychoudhury, S., Bjugstad, K. B., & Cho, C. L. (2016). Oxida 琀椀 on-
reduc 琀椀 onpoten 琀椀 al of semen: what is its role in the treatment of male infer 琀椀 lity?.
Therapeu 琀椀 c advances in urology, 8(5), 302–318. h 琀琀 ps://doi.org/10.1177/1756287216652779 [22]
Pino, V., Sanz, A., Valdés, N., Crosby, J., & Mackenna, A. (2020). The e 昀昀 ects of
aging onsemen parameters and sperm DNA fragmenta 琀椀 on. JBRA assisted reproduc 琀椀 on, 24(1), 82–86.
h 琀琀 ps://doi.org/10.5935/1518-0557.20190058 [23]
Pratap, H., Ho 琀 goudar, S. Y., Nichanahalli, K. S., Rajendran, S., & Bheemanathi, H. S.
(2019). Sperm DNA Integrity in Leukocytospermia and Its Associa 琀椀 on with Seminal Adenosine Deaminase. Journal of human reproduc 琀椀 ve sciences, 12(3),
182–188. h 琀琀 ps://doi.org/10.4103/jhrs.JHRS_1_19 [24]
Pearce, K. L., Hill, A., & Tremellen, K. P. (2019). Obesity related metabolic
endotoxemiais associated with oxida 琀椀 ve stress and impaired sperm DNA integrity. Basic and
clinical andrology, 29, 6. h 琀琀 ps://doi.org/10.1186/s12610-019-0087-5 [25]
Hamilton, T., Siqueira, A., de Castro, L. S., Mendes, C. M., Delgado, J. C., de Assis, P.
M.,Mesquita, L. P., Maiorka, P. C., Nichi, M., Goissis, M. D., Visin 琀椀 n, J. A., & Assumpção, M. (2018).
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022
E 昀昀 ect of Heat Stress on Sperm DNA: Protamine Assessment in Ram Spermatozoa and Tes 琀椀 cle. Oxida 琀 椀
ve medicine and cellular longevity, 2018, 5413056. h 琀 琀
ps://doi.org/10.1155/2018/5413056 [26]
Radwan, M., Jurewicz, J., Polańska, K., Sobala, W., Radwan, P., Bochenek, M., &
Hanke,W. (2016). Exposure to ambient air pollu 琀椀 on--does it a 昀昀 ect semen quality and the
level of reproduc 琀 椀 ve hormones?. Annals of human biology, 43(1), 50–56. h 琀 琀
ps://doi.org/10.3109/03014460.2015.1013986 [27]
Aboulmaouahib, S., Madkour, A., Kaarouch, I., Sefrioui, O., Saadani, B., Copin,
H.,Benkhalifa, M., Louanjli, N., & Cadi, R. (2018). Impact of alcohol and cigare 琀琀 e smoking consump
琀椀 on in male fer 琀椀 lity poten 琀椀 al: Looks at lipid peroxida 琀椀 on, enzyma 琀椀 c an 琀椀
oxidant ac 琀椀 vi 琀椀 es and sperm
DNA damage. Andrologia, 50(3), 10.1111/and.12926. h 琀琀 ps://doi.org/10.1111/and.12926 [28]
Mar 琀 nez, E., Bezazián, C., Bezazián, A., Lindl, K., Peliquero, A., Ca 琀琀 aneo, A.,
Gnocchi, D.,Irigoyen, M., Tessari, L., & Mar 琀 nez, A. G. (2021). Sperm DNA fragmenta 琀椀 on and
male age: results of in vitro fer 琀椀 liza 琀椀 on treatments. JBRA assisted reproduc 琀椀 on, 25(4),
533–539. h 琀琀 ps://doi.org/10.5935/1518-0557.20210018 [29]
Zhu, X. B., Chen, Q., Fan, W. M., Niu, Z. H., Xu, B. F., & Zhang, A. J. (2020). Sperm
DNAfragmenta 琀椀 on in Chinese couples with unexplained recurrent pregnancy loss. Asian journal
of andrology, 22(3), 296–301. h 琀琀 ps://doi.org/10.4103/aja.aja_60_19 [30]
Cheng, H., Han, M., Ding, J., Wang, F., Wang, G., Shen, L., Wang, J., Zheng, B., Meng,
Q.,Wang, W., Yang, S., & Li, H. (2020). Importance of a semen analysis report for determining the rela
琀椀 onship between SCSA sperm DNA fragmenta 琀椀 on index and assisted reproduc 琀椀 ve
technology pregnancy rate. Reproduc 琀 椀
ve biology, 20(4), 460–464. h 琀 琀
ps://doi.org/10.1016/j.repbio.2019.09.002 [31]
Boe-Hansen, G. B., Fedder, J., Ersbøll, A. K., & Christensen, P. (2006). The spermchroma
琀椀 n structure assay as a diagnos 琀椀 c tool in the human fer 琀椀 lity clinic. Human reproduc 琀
椀 on (Oxford, England), 21(6), 1576–1582. h 琀琀 ps://doi.org/10.1093/humrep/del019 [32]
Simon, L., Proutski, I., Stevenson, M., Jennings, D., McManus, J., Lu 琀琀 on, D., &
Lewis, S. E.(2013). Sperm DNA damage has a nega 琀椀 ve associa 琀椀 on with live-birth rates a 昀 琀 er IVF. Reproduc 琀 椀
ve biomedicine online, 26(1), 68–78. h 琀 琀
ps://doi.org/10.1016/j.rbmo.2012.09.019 [33]
Xue, L. T., Wang, R. X., He, B., Mo, W. Y., Huang, L., Wang, S. K., Mao, X. B., Cheng, J.
P.,Huang, Y. Y., & Liu, R. (2016). E 昀昀 ect of sperm DNA fragmenta 琀椀 on on clinical outcomes for
Chinese couples undergoing in vitro fer 琀椀 liza 琀椀 on or intracytoplasmic sperm injec 琀椀 on. The Journal of interna 琀 椀
onal medical research, 44(6), 1283–1291. h 琀 琀
ps://doi.org/10.1177/0300060516664240 [34]
Simon, L., Emery, B., & Carrell, D. T. (2019). Sperm DNA Fragmenta 琀 椀 on:
Consequencesfor Reproduc 琀椀 on. Advances in experimental medicine and biology, 1166, 87–105.
h 琀琀 ps://doi.org/10.1007/978-3-030-21664-1_6
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022 [35]
Mã Phạm Quế Mai và cộng sự (2015), “ Các phương pháp đánh giá phân mảnh ADN
琀椀 nhtrùng người được xây dựng tại trung tâm nghiên cứu di truyền và sức khỏe sinh sản”, Hội nghị IVF Vũng Tàu 25/7/2015) [36]
Dai, C., Zhang, Z., Shan, G., Chu, L. T., Huang, Z., Moskovtsev, S., Librach, C., Jarvi, K.,
&Sun, Y. (2021). Advances in sperm analysis: techniques, discoveries and applica 琀椀 ons. Nature
reviews. Urology, 18(8), 447–467. h 琀琀 ps://doi.org/10.1038/s41585-021-00472-2 [37]
Evenson D. P. (2016). The Sperm Chroma 琀椀 n Structure Assay (SCSA(®)) and other
spermDNA fragmenta 琀椀 on tests for evalua 琀椀 on of sperm nuclear DNA integrity as related to fer 琀 椀 lity. Animal reproduc 琀 椀 on science, 169, 56–75. h 琀 琀
ps://doi.org/10.1016/j.anireprosci.2016.01.017 [38]
Scsadiagnos 琀椀 cs.com. 2022. SCSA Diagnos 琀椀 cs: SCSA Test. [online] Available at: [Accessed 30 June 2022]. [39]
Borges, E., Jr, Zane 琀, B. F., Se 琀, A. S., Braga, D., Provenza, R. R., & Iaconelli, A.,
Jr(2019). Sperm DNA fragmenta 琀椀 on is correlated with poor embryo development, lower implanta
琀椀 on rate, and higher miscarriage rate in reproduc 琀椀 ve cycles of non-male factor infer 琀椀 lity.
Fer 琀椀 lity and sterility, 112(3), 483–490. h 琀琀 ps://doi.org/10.1016/j.fertnstert.2019.04.029 [40]
Zini A. (2011). Are sperm chroma 琀椀 n and DNA defects relevant in the clinic?. Systemsbiology in reproduc 琀 椀 ve medicine, 57(1-2), 78–85. h 琀 琀
ps://doi.org/10.3109/19396368.2010.515704 [41] Chen, Q., Zhao, J. Y., Xue, X., & Zhu, G. X. (2019).
The associa 琀椀 on between sperm DNA fragmenta 琀椀 on and reproduc 琀椀 ve outcomes following
intrauterine insemina 琀椀 on, a meta analysis. Reproduc 琀 椀 ve toxicology (Elmsford, N.Y.), 86, 50–55. h 琀 琀
ps://doi.org/10.1016/j.reprotox.2019.03.004 [42]
Sugihara, A., Van Avermaete, F., Roelant, E., Punjabi, U., & De Neubourg, D. (2020).
Therole of sperm DNA fragmenta 琀椀 on tes 琀椀 ng in predic 琀椀 ng intra-uterine insemina 琀椀
on outcome: A systema 琀椀 c review and meta-analysis. European journal of obstetrics, gynecology,
and reproduc 琀椀 ve biology, 244, 8–15. h 琀琀 ps://doi.org/10.1016/j.ejogrb.2019.10.005 [43]
Prac 琀椀 ce Commi 琀琀 ee of the American Society for Reproduc 琀椀 ve Medicine,
& Society forMale Reproduc 琀椀 on and Urology (2014). Report on varicocele and infer 琀椀 lity: a commi
琀 琀 ee opinion. Fer 琀 椀 lity and sterility, 102(6), 1556–1560. h 琀 琀
ps://doi.org/10.1016/j.fertnstert.2014.10.007 [44]
Kim, K. H., Lee, J. Y., Kang, D. H., Lee, H., Seo, J. T., & Cho, K. S. (2013). Impact of
surgicalvaricocele repair on pregnancy rate in subfer 琀椀 le men with clinical varicocele and impaired
semen quality: a meta-analysis of randomized clinical trials. Korean journal of urology, 54(10), 703–
709. h 琀琀 ps://doi.org/10.4111/kju.2013.54.10.703 [45]
Tanaka, T., Kobori, Y., Terai, K., Inoue, Y., Osaka, A., Yoshikawa, N., Shimomura,
Y.,Suzuki, K., Minami, T., Iwahata, T., Onota, S., Yamamoto, A., Sugimoto, K., & Okada, H. (2022).
Seminal oxida 琀椀 on-reduc 琀椀 on poten 琀椀 al and sperm DNA fragmenta 琀椀 on index increase
among infer 琀椀 le men with varicocele. Human fer 琀椀 lity (Cambridge, England), 25(1), 142–146.
h 琀琀 ps://doi.org/10.1080/14647273.2020.1712747
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022 [46]
Dieamant, F., Petersen, C. G., Mauri, A. L., Conmar, V., Ma 琀 la, M., Vagnini, L. D.,
Renzi,A., Costa, B. P., Zamara, C., Oliveira, J., Baru 昀케, R., & Franco, J. G., Jr (2017). Semen parameters
in men with varicocele: DNA fragmenta 琀椀 on, chroma 琀椀 n packaging, mitochondrial membrane
poten 琀 椀 al, and apoptosis. JBRA assisted reproduc 琀 椀 on, 21(4), 295–301. h 琀 琀
ps://doi.org/10.5935/15180557.20170053 [47]
Moazzam, A., Sharma, R., & Agarwal, A. (2015). Rela 琀椀 onship of spermatozoal
DNAfragmenta 琀椀 on with semen quality in varicocele-posi 琀椀 ve men. Andrologia, 47(8), 935–
944. h 琀琀 ps://doi.org/10.1111/and.12360 [48]
Tan, J., Taskin, O., Albert, A., & Bedaiwy, M. A. (2019). Associa 琀椀 on between sperm
DNAfragmenta 琀椀 on and idiopathic recurrent pregnancy loss: a systema 琀椀 c review and meta- analysis. Reproduc 琀 椀 ve biomedicine online, 38(6), 951–960. h 琀 琀
ps://doi.org/10.1016/j.rbmo.2018.12.029 [49]
Zhu, X. B., Chen, Q., Fan, W. M., Niu, Z. H., Xu, B. F., & Zhang, A. J. (2020). Sperm
DNAfragmenta 琀椀 on in Chinese couples with unexplained recurrent pregnancy loss. Asian journal
of andrology, 22(3), 296–301. h 琀琀 ps://doi.org/10.4103/aja.aja_60_19 [50]
Oleszczuk, K., Augus 琀椀 nsson, L., Bayat, N., Giwercman, A., & Bungum, M. (2013).
Prevalence of high DNA fragmenta 琀椀 on index in male partners of unexplained infer 琀椀 le couples.
Andrology, 1(3), 357–360. h 琀琀 ps://doi.org/10.1111/j.2047-2927.2012.00041.x [51]
Majzoub, A., Arafa, M., Mahdi, M., Agarwal, A., Al Said, S., Al-Emadi, I., El Ansari,
W.,Ala 琀琀 ar, A., Al Rumaihi, K., & Elbardisi, H. (2018). Oxida 琀椀 on-reduc 琀椀 on poten 琀椀 al
and sperm DNA fragmenta 琀椀 on, and their associa 琀椀 ons with sperm morphological anomalies
amongst fer 琀 椀 le and infer 琀 椀 le men. Arab journal of urology, 16(1), 87–95. h 琀 琀
ps://doi.org/10.1016/j.aju.2017.11.014 [52]
Le, M. T., Nguyen, T., Nguyen, H., Nguyen, T., Nguyen, V. T., Le, D. D., Nguyen, V., &
Cao,N. T. (2019). Does sperm DNA fragmenta 琀椀 on correlate with semen parameters?. Reproduc
琀椀 ve medicine and biology, 18(4), 390–396. h 琀琀 ps://doi.org/10.1002/rmb2.12297 [53]
Ganzer, L. M., Larcher, J. S., Avramovich, V. I., Tissera, A. D., & Estofan, G. M. (2017).
Rela 琀椀 onship between semen parameters and sperm DNA fragmenta 琀椀 on. Fer 琀椀 lity and Sterility, 108(3), e137-e138. [54]
Radwan, M., Jurewicz, J., Polańska, K., Sobala, W., Radwan, P., Bochenek, M., &
Hanke,W. (2016). Exposure to ambient air pollu 琀椀 on--does it a 昀昀 ect semen quality and the
level of reproduc 琀 椀 ve hormones?. Annals of human biology, 43(1), 50–56. h 琀 琀
ps://doi.org/10.3109/03014460.2015.1013986 [55]
Kumar, S., & Sharma, A. (2019). Cadmium toxicity: e 昀昀 ects on human reproduc 琀
椀 on andfer 琀 椀 lity. Reviews on environmental health, 34(4), 327–338. h 琀 琀
ps://doi.org/10.1515/reveh-20190016 [56]
Oliveira, H., Spanò, M., Santos, C., & Pereira, M. (2009). Adverse e 昀昀 ects of
cadmiumexposure on mouse sperm. Reproduc 琀椀 ve toxicology (Elmsford, N.Y.), 28(4), 550–555. h
琀琀 ps://doi.org/10.1016/j.reprotox.2009.08.001
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022 [57]
Ji, G., Xia, Y., Gu, A., Shi, X., Long, Y., Song, L., Wang, S., & Wang, X. (2011). E 昀昀 ects
ofnon-occupa 琀椀 onal environmental exposure to pyrethroids on semen quality and sperm DNA
integrity in Chinese men. Reproduc 琀椀 ve toxicology (Elmsford, N.Y.), 31(2), 171–176. h 琀琀
ps://doi.org/10.1016/j.reprotox.2010.10.005 [58]
Komiya, A., Kato, T., Kawauchi, Y., Watanabe, A., & Fuse, H. (2014). Clinical
factorsassociated with sperm DNA fragmenta 琀椀 on in male pa 琀椀 ents with infer 琀椀 lity.
TheScien 琀椀昀椀 cWorldJournal, 2014, 868303. h 琀琀 ps://doi.org/10.1155/2014/868303 [59]
Ranganathan, P., Rao, K. A., & Thalaivarasai Balasundaram, S. (2019). Deteriora 琀椀
on ofsemen quality and sperm-DNA integrity as in 昀氀 uenced by cigare 琀琀 e smoking in fer 琀椀
le and infer 琀椀 le human male smokers-A prospec 琀椀 ve study. Journal of cellular biochemistry,
10.1002/jcb.28458. Advance online publica 琀椀 on. h 琀琀 ps://doi.org/10.1002/jcb.28458 [60]
Zhou, D. D., Hao, J. L., Guo, K. M., Lu, C. W., & Liu, X. D. (2016). Sperm quality and
DNAdamage in men from Jilin Province, China, who are occupa 琀椀 onally exposed to ionizing radia 琀椀 on. Gene 琀椀 cs and molecular research : GMR, 15(1),
10.4238/gmr.15018078. h 琀琀 ps://doi.org/10.4238/gmr.15018078 [61]
Antoniassi, M. P., Intasqui, P., Camargo, M., Zylbersztejn, D. S., Carvalho, V. M.,
Cardozo,K. H., & Bertolla, R. P. (2016). Analysis of the func 琀椀 onal aspects and seminal plasma
proteomic pro 昀椀 le of sperm from smokers. BJU interna 琀椀 onal, 118(5), 814–822. h 琀琀
ps://doi.org/10.1111/bju.13539 [62]
Condorelli, R. A., La Vignera, S., Mongioì, L. M., Alamo, A., & Calogero, A. E. (2018).
Diabetes Mellitus and Infer 琀椀 lity: Di 昀昀 erent Pathophysiological E 昀昀 ects in Type 1 and Type 2 on Sperm Func 琀 椀 on. Fron 琀 椀
ers in endocrinology, 9, 268. h 琀 琀
ps://doi.org/10.3389/fendo.2018.00268 [63]
Jurewicz, J., Radwan, M., Sobala, W., Radwan, P., Bochenek, M., & Hanke, W. (2018).
Dietary Pa 琀琀 erns and Their Rela 琀椀 onship With Semen Quality. American journal of men's health,
12(3), 575–583. h 琀琀 ps://doi.org/10.1177/1557988315627139 [64]
Zhang, M. H., Zhai, L. P., Fang, Z. Y., Li, A. N., Qiu, Y., & Liu, Y. X. (2018). Impact of a
mildscrotal hea 琀椀 ng on sperm chromosomal abnormality, acrosin ac 琀椀 vity and seminal alpha-
glucosidase in human fer 琀椀 le males. Andrologia, 10.1111/and.12985. Advance online publica 琀
椀 on. h 琀琀 ps://doi.org/10.1111/and.12985 [65]
Oliveira, J., Petersen, C. G., Mauri, A. L., Vagnini, L. D., Renzi, A., Petersen, B., Ma 琀
la,M., Dieamant, F., Baru 昀케, R., & Franco, J. G., Jr (2018). Associa 琀椀 on between body mass index
and sperm quality and sperm DNA integrity. A large popula 琀 椀 on study. Andrologia, 50(3),
10.1111/and.12889. h 琀琀 ps://doi.org/10.1111/and.12889 [66]
Kumar, D., Salian, S. R., Kalthur, G., Uppangala, S., Kumari, S., Challapalli,
S.,Chandraguthi, S. G., Jain, N., Krishnamurthy, H., Kumar, P., & Adiga, S. K. (2014). Associa 琀椀 on
between sperm DNA integrity and seminal plasma an 琀椀 oxidant levels in health workers occupa 琀
Phân mảnh DNA tinh trùng - Nguyễn Văn Quang - Edit: 18/07/2022
椀 onally exposed to ionizing radia 琀 椀 on. Environmental research, 132, 297–304. h 琀 琀
ps://doi.org/10.1016/j.envres.2014.04.023 [67]
Fariello, R. M., Pariz, J. R., Spaine, D. M., Cedenho, A. P., Bertolla, R. P., & Fraie 琀琀 a,
R.(2012). Associa 琀 椀 on between obesity and altera 琀 椀 on of sperm DNA integrity and mitochondrial ac 琀 椀 vity. BJU interna 琀 椀 onal, 110(6), 863–867. h 琀 琀
ps://doi.org/10.1111/j.1464-410X.2011.10813.x [68]
Moryousef, J., Alkandari, M. H., & Zini, A. (2022). Case - Sperm DNA fragmenta 琀椀
onassociated with COVID-19 infec 琀椀 on. Canadian Urological Associa 琀椀 on journal = Journal de
l'Associa 琀椀 on des urologues du Canada, 16(5), E301–E303. h 琀琀 ps://doi.org/10.5489/cuaj.7721 [69]
Falahieh, F. M., Zarabadipour, M., Mirani, M., Abdiyan, M., Dinparvar, M.,
Alizadeh, H., Pak 琀椀 nat, S., & Hosseinirad, H. (2021). E 昀昀 ects of moderate COVID-19
infec 琀椀 on on semen oxida 琀椀 ve status and parameters 14 and 120 days a 昀琀 er
diagnosis. Reproduc 琀椀 on, fer 琀椀 lity, and development, 33(12), 683–690. h 琀琀 ps://doi.org/10.1071/RD21153 [70]
Donders, G., Bosmans, E., Reumers, J., Donders, F., Jonckheere, J., Salembier,
G.,Stern, N., Jacquemyn, Y., Ombelet, W., & Depuydt, C. E. (2022). Sperm quality and absence
of SARS-CoV-2 RNA in semen a 昀琀 er COVID-19 infec 琀椀 on: a prospec 琀椀 ve, observa
琀椀 onal study and valida 琀椀 on of the SpermCOVID test. Fer 琀椀 lity and sterility, 117(2), 287–296.
h 琀琀 ps://doi.org/10.1016/j.fertnstert.2021.10.022



