
















Preview text:
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/ ợ ỗ Tr ệ Zalo H ọc Liên H ng Kí H Đă TLOT Official: 0333800642
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
KHÓA HỌC CẤP TỐC 14 NGÀY
NGÀY 01: ĐỀ DỰ ĐOÁN VẬN DỤNG CAO – SỐ 01
NAP 1: Chuẩn độ muối Fe(ll) bằng dung dịch thuốc tím KMnO4. Chuẩn bị:
Hoá chất: các dung dịch: KMnO4 C1 (M), H2SO4 10%, FeSO4 C2 (M).
Dụng cụ: pipette 5 mL, burette 25 mL, bình tam giác 100 mL, ống đong 10 mL, bình tia nước cất, giá đỡ, kẹp càng cua. Cách tiến hành:
- Dùng pipette lấy V1 mL dung dịch FeSO4 cho vào bình tam giác; dùng ống đong lấy thêm vào
bình tam giác V1 mL dung dịch H2SO4 10%.
- Cho dung dịch KMnO4 vào burette, điều chỉnh thể tích dung dịch trong burette về mức 0. Mở
khoá burette, nhỏ từng giọt dung dịch KMnO4 xuống bình tam giác, lắc đều. ợ ỗ Tr ệ Zalo H 2+10+8+2+1+5+8=36
a. Phản ứng chuẩn độ là KMnO4 + F ọ eSO4
c Liên H + H2SO4 MnSO4 + K2SO4 + Fe2(SO4)3 + H2O
với tổng hệ số tối giản của các chất trong phương trình phản ứng là 36.
b. Khi dung dịch trong bình tam g
ng Kí H iác xuất hiện màu hồng bền trong khoảng 20 giây thì Đă
dừng chuẩn độ, ghi lại thể tích dung dịch KMnO4 là V2. Tiến h TLOT Official: 0333800642 ành chuẩn độ 3 lần.
c. Có thể thực hiện phép chuẩn độ trên bằng cách đựng dung dịch KMnO4 ở bình tam
giác và dung dịch FeSO4 trong môi trường acid ở burette cũng cho kết quả tương tự. Khó thực hiện
d. Cần xác định hàm lượng nguyên tố sắt trong một viên thuốc bổ sung sắt bằng dung
dịch KMnO4. Viên thuốc nặng 250 mg chứa nguyên tố sắt (iron) chỉ ở dạng muối Fe(II) cùng
một số chất khác. Kết quả kiểm nghiệm thấy lượng Fe(II) trong viên này phản ứng vừa đủ với
10,0 mL dung dịch KMnO4 0,04 M. Phần trăm khối lượng của nguyên tố sắt trong viên thuốc trên là 44,8%.
NAP 2: Khi nguồn nước tự nhiên có hàm lượng sắt vượt quá tiêu chuẩn cho phép (nước sẽ có
màu vàng và mùi tanh) sẽ cần phải xử lí để loại bỏ sắt. Một trong những cách loại sắt khỏi nước
là dùng vôi tôi với lượng vừa đủ, sau đó cho tiếp xúc với không khí, kết tủa Fe(OH)2 tạo thành
và được tách ra ở bể lắng. Một mẫu nước nhiễm phèn có hàm lượng sắt cao gấp 28 lần, so với
ngưỡng cho phép quy định là 0,30 mg/L (QCVN 01 - 1:2018/BYT). Giả thiết sắt trong mẫu nước
trên chỉ tồn tại ở hai dạng là Fe3+ và Fe2+ với tỉ lệ mol Fe3+ : Fe2+ = 3 : 1. Cần tối thiểu bao nhiêu kg
(làm tròn đến hàng phần mười) Ca(OH)2 để kết tủa hoàn toàn lượng sắt có trong 1000 m3 nước trên
Đáp số: …………… 15,3
Thay đổi tư duy – Bứt phá thành công | 1
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
NAP 3: Siderite là một khoáng vật quan trọng trong công nghiệp, có thành phần chính là FeCO3
(còn lại là các tạp chất không chứa sắt). Để xác định hàm lượng sắt trong quặng này, người ta tiến hành như sau:
- Bước 1: Cân chính xác 1,0 gam mẫu quặng siderite đã nghiền mịn và chuyển toàn bộ sang cốc thủy tinh 100 mL.
- Bước 2. Thêm 50 mL dung dịch H2SO4 loãng vào cốc, xử lí theo quy trình thích hợp thu được
dung dịch FeSO4 trong môi trường H2SO4 loãng. Thêm nước cất vào cốc để đạt định mức 100 mL dung dịch.
- Bước 3. Lấy chính xác 10 mL dung dịch sau khi định mức cho vào bình tam giác. Tiến hành
chuẩn độ bằng dung dịch KMnO4 0,01 M. Khi toàn bộ dung dịch ở bình tam giác có màu hồng
nhạt ổn định trong khoảng 20 giây thì dừng lại (coi dung dịch không chứa tạp chất tác dụng với dung dịch KMnO4).
- Bước 4. Lặp lại phép chuẩn độ thêm hai lần nữa. Thể tích trung bình của dung dịch KMnO4
sau ba lần chuẩn độ là 10,5 mL.
a. Hàm lượng (phần trăm khối lượng) sắt trong quặng siderite là 29,4%.
b. Ở Bước 2, thay dung dịch H2SO4 loãng bằng dung dịch HCl cho kết quả tương tự.
c. Phản ứng chuẩn độ xảy ra ở Bước 3 là: không cho kqua tg tự vì ion cl- trong hcl có tính khử sẽ bị ợ
khử thành khí cl2 bay lên
MnO4-(aq) + 5Fe2+(aq) + 8H+(aq) → Mn2+(aq) + 5Fe3+(aq) + 4H2O(l) ỗ Tr +8h2o
d. Ở Bước 3, có thể thực hiện phép chuẩn độ trên bằng cách cho dung dịch KMnO4 vào
bình tam giác và dung dịch chứa FeSO4 trong môi trường H2SO4 loãng ở burette cho kết quả ệ Zalo H tương tự. khó thực hiện
NAP 4: Thép thường (thép carbon) là hợp kim của Fe, C và một số nguyên tố khác. Tiến hành thí ọc Liên H
nghiệm sau đây để xác định hàm lượng Fe có trong một mẫu thép:
- Cân 3,56 gam mẫu thép rồi hòa tan hết b
ng Kí H ằng dung dịch H�SO�1M, chuyển toàn bộ dung dịch
sau hòa tan vào bình định mức 100 m
Đă L rồi thêm nước cất tới vạch, thu được 100 mL dung dịch TLOT Official: 0333800642 X.
- Chuẩn độ 10,0 mLX (trong môi trường sulfuric acid loãng, dư) bằng dung dịch KMnO�0,1M
đến khi xuất hiện màu hồng nhạt bền trong khoảng 20 giây thì dừng. Thể tích của dung dịch
KMnO� sau 3 lần chuẩn độ như sau: Lần chuẩn độ Lần 1 Lần 2 Lần 3
Thể tích dung dịch KMnO�0,1M(mL) 12,6 12,4 12,5
Phần trăm khối lượng của Fe trong mẫu thép là a%. Giá trị của a bằng bao nhiêu (làm tròn đến hàng phần mười)?
Đáp số: …………… 98,3
NAP 5: Một muối ngậm nước cua sắt có công thức FeC�O� ⋅ xH�O. Để xác định giá trị của x, tiến
hành hòa tan 1,95 gam FeC�O� ⋅ xH�O bằng sulfuric acid loãng. dư rồi pha thành 250,0 mL dung
dịch Y. Lấy 10,00 mL dung dịch Y cho vào bình tam giác, đun nóng 80 − 90∘C trong 3 phút, lắc
đều, chuẩn độ dung dịch trọng bình tam giác bằng dung dịch KMnO�0,02M đến khi xuất hiện
màu hồng nhạt bền trong khoảng 20 giây thì dừng. Cho phương trình hóa học của phản ứng chuẩn độ:
2 | Thay đổi tư duy – Bứt phá thành công
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
10FeC�O� + 6KMnO� + 24H�SO� ⟶ 5Fe�(SO�)� + 6MnSO� + 20CO� + 3 K�SO� + 24H�O
Lặp lại thí nghiệm chuẩn độ thêm 2 lần nữa. Thể tích trung bình của dung dịch KMnO� sau 3 lần
chuẩn độ là 13,00 mL. Tính giá trị của x.
Đáp số: …………… 2
NAP 6: Dung dịch iron (II) sulfate để lâu ngày bị oxi hóa một phần bởi oxygen của không khí
tạo thành iron (III) sulfate (dung dịch X). Cho 30 mL dung dịch H2SO4 0,5M vào 10 mL dung
dịch X thu được dung dịch Y.
Thí nghiệm 1: Chuẩn độ 10,0 mL dung dịch Y bằng dung dịch KMnO4 0,05M cho đến khi
xuất hiện màu hồng nhạt bền (phản ứng coi như vừa đủ) thì thấy hết 9,0 mL dung dịch KMnO4.
Thí nghiệm 2: Ngâm một lá sắt dư vào 10,0 mL dung dịch Y, khuấy đều đến khi khử hoàn
toàn sắt(III) thành Fe(II). Lấy lá sắt ra, rồi chuẩn độ bằng dung dịch KMnO4 0,05M. Khi màu
hồng nhạt bền xuất hiện thì thấy hết 10,5 mL dung dịch KMnO4. Tỉ lệ iron (II) sulfate đã bị oxi
hóa trong không khí là a%. Giá trị của a bằng bao nhiêu? (kết quả làm tròn đến phần nguyên).
Đáp số: …………… 14
NAP 7: Sodium carbonate (Na2CO3) là chất thường dùng để làm mềm nước cứng theo phương
pháp kết tủa. Độ cứng của nước có thể được tính theo số mg CaCO3 trong 1 lít nước, trong đó
độ cứng không vượt quá 60 mg.L-1 là nước mềm. Để xử lí một mẫu nước cứng vĩnh cửu có độ ợ
cứng a (mg CaCO3/L) người ta cho 1 lít dung dịch Na2CO3 0,020 M vào 19 lít mẫu nước cứng ỗ Tr
trên, lắc đều, thu được kết tủa CaCO3 và nước mềm Y. Nồng độ Ca2+ và CO32- có trong nước
mềm Y lần lượt là 5,00.10-4 M và 8,93.10-6 M. Giả thiết rằng, mẫu nước cứng chỉ chứa cation Ca2+ ệ Zalo H
và các anion khác, các ion khác này không tham gia phản ứng, ion CO32- và ion Ca2+ không bị
thuỷ phân trong nước. Giá trị của a là bao nhiêu? (Chỉ làm tròn kết quả ở phép tính cuối cùng; kết ọc Liên H
quả làm tròn tới hàng đơn vị). 158
Đáp số: …………… ng Kí H Đă
NAP 8: Để xác định hàm lượng của FeCO3 trong quặng sider TLOT Official: 0333800642
ite, người ta có thể làm như sau:
cân 0,31 gam mẫu quặng, xử lí theo một quy trình thích hợp thu được dung dịch FeSO4 trong
môi trường H2SO4 loãng. Biết dung dịch không chứa tạp chất tác dụng với KMnO4. Chuẩn độ
dung dịch thu được bằng dung dịch KMnO4 0,02 M cho đến khi xuất hiện màu hồng nhạt thì
dừng lại. Thể tích trung bình của dung dịch KMnO4 sau 3 lần chuẩn độ là 24 mL. Phần trăm
khối lượng của FeCO3 trong mẫu quặng trên là bao nhiêu (theo %, làm tròn kết quả đến hàng phần mười)?
Đáp số: …………… 89,8
NAP 9: Trong quá trình bảo quản, muối FeSO4.7H2O thường bị oxi hoá bởi oxygen không khí
tạo thành hỗn hợp X chứa các hợp chất Fe(II) và Fe(III). Để xác định lượng Fe(II) bị oxi hoá
người ta hoà tan một lượng X trong dung dịch loãng chứa 0,06 mol H2SO4, thu được 100 mL
dung dịch Y. Tiến hành hai thí nghiệm với Y:
Thí nghiệm 1. Cho lượng dư dung dịch BaCl2 vào 25 mL dung dịch Y, lọc kết tủa, sấy khô
rồi đem cân thu được 5,825 gam chất rắn.
Thí nghiệm 2. Thêm dung dịch H2SO4 (loãng, dư) vào 25 mL dung dịch Y, thu được dung
dịch Z. Chuẩn độ dung dịch Z bằng dung dịch chuẩn KMnO4 0,1 M đến khi dấu xuất hiện màu
hồng (tồn tại khoảng 20 giây) thì hết 17,5 mL.
Thay đổi tư duy – Bứt phá thành công | 3
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
Phần trăm Fe(II) đã bị oxi hoá là a %. Tính giá trị của a (làm tròn kết quả đến hàng phần mười).
Đáp số: …………… 12,5
NAP 10: Khi hàm lượng ion phosphate ( 3 4
PO ) trong nước tăng cao sẽ dẫn đến hiện tượng phú
dưỡng. Để tránh hiện tượng phú dưỡng có thể làm giảm hàm lượng ion phosphate bằng cách
thêm Fe3+ hoặc Al3+ để tạo thành các hợp chất phosphate không tan. Một nguồn nước thải có
hàm lượng ion phosphate là 16 mg L-1. Trong một hệ thống xử lý nguồn nước thải trên với lưu
lượng 25000 m3/ngày thì cần x kg FeCl3. Biết thực tế người ta sử dụng tỉ lệ mol Fe : P = 1,25 : 1.
(làm tròn kết quả đến hàng đơn vị) 855
Đáp số: ……………
NAP 11: Trong dung dịch, ion Fe2+ có thể bị oxi hoá bởi ion Ag+ theo cân bằng sau:
Fe2+(aq) + Ag+(aq) ⇌Fe3+(aq) + Ag(s) (*)
Để xác định hằng số cân bằng KC của cân bằng trên, một học sinh tiến hành các thí nghiệm như sau ở 25 °C:
- Đầu tiên, trộn 100,0 mL dung dịch AgNO3 0,20 M vào bình tam giác chứa 100,0 mL dung dịch
Fe(NO3)2 0,20 M, lắc nhẹ và để dung dịch phản ứng đạt đến cân bằng trong 1 giờ.
- Tiếp theo, dùng pipette hút 20,0 mL dung dịch sau phản ứng cho vào bình tam giác 250 mL;
thêm 5,0 mL dung dịch NaCl 1,0 M vào bình tam giác thấy xuất hiện kết tủa trắng; thêm tiếp ợ
20,0 mL dung dịch H2SO4 1,0 M vào bình tam giác và tiến hành chuẩn độ. ỗ Tr
- Chuẩn độ dung dịch trong bình tam giác bằng dung dịch KMnO4 0,020 M (dung dịch trên
burette). Sau 3 lần chuẩn độ, giá trị thể tích đọc được ệ trên Zalo H
burette lần lượt là 16,70 mL; 16,80 mL và 16,90 mL. 2,27
Tính giá trị hằng số cân bằng KC của phản ứng (*) ở 25 °C (Kết quả được làm tròn đến hàng phần ọc Liên H trăm).
Đáp số: …………… ng Kí H Đă
NAP 12: Trong quá trình bảo quản, một mẫu muối FeSO4
TLOT Official: 0333800642 .7H2O bị oxi hóa bởi oxygen trong
không khí tạo thành hỗn hợp X chứa các hợp chất của Fe(II) và Fe(III). Hòa tan hoàn toàn X
trong dung dịch loãng chứa 0,05 mol H2SO4, thu được 100 mL dung dịch Y. Tiến hành hai thí nghiệm với dung dịch Y:
Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 25,0 mL dung dịch Y, thu được 6,99 gam kết tủa.
Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 25,0 ml dung dịch Y, thu được dung
dịch Z. Nhỏ từ từ dung dịch KMnO4 0,1M vào Z đến khi phản ứng vừa đủ thì hết 30,0 mL. Tính
phần trăm số mol Fe(II) đã bị oxi hóa trong không khí (làm tròn đến hàng phần mười).
Đáp số: …………… 14,3
NAP 13: Để xác định hàm lượng muối Fe(II) trong 1 mẫu dung dịch A có thể dùng dung dịch
thuốc tím KMnO4, phương trình ion như sau: MnO + 5Fe2+ + 8H⁺ → Mn2+ + 5Fe3+ + 4H 4 2O
- Lấy 25,00 mL dung dịch A cho vào bình định mức, thêm nước cất cho đủ 100 mL, dung dịch
thu được gọi là dung dịch X.
- Lấy 10,00 mL dung dịch X chuyển vào bình tam giác sau đó thêm khoảng 5mL dung dịch H2SO4 2M.
- Tiến hành chuẩn độ 3 lần bằng dung dịch KMnO4 0,02M.
4 | Thay đổi tư duy – Bứt phá thành công
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
Kết quả thể tích KMnO4 sau 3 lần chuẩn độ lần lượt là 20,50 mL; 20,55 mL; 20,55 mL.
Tính hàm lượng muối Fe2+ (g/L) trong dung dịch A với giả thiết lượng KMnO4 chỉ phản ứng với
Fe2+. (Làm tròn kết quả đến hàng phần mười).
Đáp số: …………… 46
NAP 14: Trong danh mục tiêu chuẩn chất lượng sản phẩm có chỉ tiêu về dư lượng chlorine
không vượt quá 1 mg/L (ngưỡng cho phép).
Phương pháp chuẩn độ iodine – thiosulfate được dùng để xác định dư lượng chlorine trong
thực phẩm theo phương trình: Cl2 + 2KI → 2KCl + I2
Sản phẩm I2 tạo ra ở phản ứng trên được nhận biết bằng hồ tinh bột và bị khử bởi dung dịch
chuẩn sodium thiosulfate theo phương trình: I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Dựa vào thể tích dung dịch Na2S2O3 phản ứng, tính được dư lượng chlorine trong dung dịch
mẫu. Tiến hành chuẩn độ 100 ml dung dịch mẫu A bằng dung dịch Na2S2O3 0,01M, thấy thể tích
Na2S2O3 trung bình sau 3 lần chuẩn độ là 2,8 mL. Vậy dư lượng chlorine có trong mẫu A bằng
bao nhiêu mg/L? (Làm tròn kết quả đến hàng phần trăm)
Đáp số: …………… 9,94
NAP 15: Một viên thực phẩm chức năng có khối lượng 250 mg chứa nguyên tố sắt (iron) ở dạng
muối Fe(II) cùng một số chất khác. Kết quả kiểm nghiệm thấy lượng Fe(II) trong viên này phản ợ
ứng vừa đủ với 8,5 mL dung dịch KMnO4 0,04M. Phần trăm khối lượng của nguyên tố sắt trong ỗ Tr
viên thực phẩm chức năng trên là bao nhiêu? (Làm tròn kết quả đến hàng phần mười)
Đáp số: …………… 38,1 ệ Zalo H
NAP 16: Một mẫu nước thải của nhà máy sản xuất dây lưới thép có pH = 4,0. Để thải được ra
môi trường, nhà máy đó cần phải tăng pH trong nước thải lên tới 5,8 – 8,6 (theo tiêu chuẩn quy ọc Liên H
định). Tính lượng vôi sống (theo gram) cần dùng để tăng pH trong 2 m3 nước thải từ 4,0 lên 7,0.
Giả thiết thể tích nước thải thay đổi không
ng Kí H đáng kể và bỏ qua sự thủy phân của các muối (nếu có). Đă TLOT Official: 0333800642
Đáp số: …………… 5,6
NAP 17: Hòa tan 0,350 gam mẫu khoáng vật của sắt trong dung dịch sulfuric acid dư, sao cho
tất cả lượng sắt có trong quặng đều chuyển thành Fe2+, thu được dung dịch X. Chuẩn độ Fe2+
trong dung dịch X ba lần bằng chất chuẩn là dung dịch thuốc tím KMnO4 0,015M. Kết quả: Lần chuẩn độ Lần 1 Lần 2 Lần 3
V dung dịch KMnO4 đã dùng (mL) 14,90 15,05 15,10
a. Trong quá trình chuẩn độ trên, cần nhỏ từ từ dung dịch thuốc tím từ burette vào bình
tam giác chứa dung dịch X.
b. Cần thêm chất chỉ thị phù hợp vào bình tam giác chứa dung dịch X để xác định được
thời điểm kết thúc quá trình chuẩn độ.
c. Cần tiến hành thí nghiệm chuẩn độ 3 lần để giảm sai số ngẫu nhiên, bảo đảm tính
chính xác của kết quả.
d. Nếu chỉ có Fe2+ trong dung dịch X tác dụng được với thuốc tím thì việc chuẩn độ dung
dịch X sẽ giúp xác định được lượng nguyên tố sắt trong mẫu khoáng vật. Từ đó tính được %
(theo khối lượng) của nguyên tố sắt có trong mẫu khoáng vật là 18,02%.
Thay đổi tư duy – Bứt phá thành công | 5
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
NAP 18: Trong quá trình bảo quản, một mẫu muối FeSO4.7H2O (có khối lượng m gam) bị oxi
hóa bởi oxygen không khí tạo thành hỗn hợp X gồm các hợp chất của Fe(II) và Fe(III). Hòa tan
toàn bộ X trong dung dịch loãng chứa 0,035 mol H2SO4, thu được 100 mL dung dịch Y. Tiến
hành hai thí nghiệm với Y:
Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 20 mL dung dịch Y, thu được 2,33 gam kết tủa.
Thí nghiệm 2: Thêm dung dịch H2SO4 (loãng, dư) vào 20 mL dung dịch Y, thu được dung dịch Z.
Nhỏ từ từ dung dịch KMnO4 0,03M vào Z đến khi phản ứng vừa đủ thì hết 18 mL.
Phần trăm số mol Fe(II) đã bị oxi hóa trong không khí là a%. Tính giá trị của a.
Đáp số: …………… 10
NAP 19: Phân tích một mẫu nước cứng thấy có chứa các ion: Ca2+, Mg2+, Cl⁻, HCO ; trong đó 3
nồng độ Cl⁻ là 0,006 M và của HCO là 0,01M. Cần lấy bao nhiêu ml dung dịch Na 3 2CO3 0,2M để
chuyển 10 lít nước cứng trên thành nước mềm? Coi nước mềm là nước không chứa các ion Ca2+,
Mg2+. (Kết quả làm tròn đến hàng đơn vị)
Đáp số: …………… 40
NAP 20: Có nhiều vụ tai nạn giao thông xảy ra do ngườig lá xe uống rượu. Người ta có thể xác
định hàm lượng ethanol bằng xét nghiệm máu hoặc đo hơi thở bằng máy đo (có chứa hỗn hợp
K2Cr2O7 và H2SO4) theo phương trình như sau: ợ CH Tr
3CH2OH + K2Cr2O7 + H2SO4 CH3CO
ỗ OH + Cr2(SO4)3 + K2SO4 + H2O
Khi chuẩn độ 25,0 gam huyết tương màu của một người lá xe cần dùng 20,0 mL dung dịch K ệ Zalo H
2Cr2O7 0,010 M. Nồng độ phần trăm ethanol trong 25 gam huyết tương máu của một người lá xe là 0,11
Đáp số: …………… ọc Liên H
NAP 21: Trong dung dịch, ion Fe2+ có thể bị oxi hóa bởi ion Ag+ theo cân bằng sau:
Fe2+(aq) + Ag(aq) ⇌ Fe3+(aq) + Ag(s) (*) ng Kí H Đă
Để xác định hằng số cân bằng KC của cân bằng trên, một họ
TLOT Official: 0333800642 c sinh tiến hành các thí nghiệm như sau ở 25oC:
- Đầu tiên trộn 100,0 mL dung dịch AgNO3 0,20 M vào bình tam giác chứa 100,0 mL dung dịch
Fe(NO3)2 0,20 M, lắc đều và để dung dịch phản ứng đạt đến cân bằng trong 1 giờ.
- Tiếp theo, dùng pipette hút 20,0 mL dung dịch sau phản ứng cho vào bình tam giác 250 mL;
thêm 5,0 mL dung dịch NaCl 1,0 M vào bình tam giác thấy xuất hiện kết tủa trắng; thêm tiếp
20,0 mL dung dịch H2SO4 1,0 M vào bình tam giác và tiến hành chuẩn độ.
- Chuẩn độ dung dịch trong bình tam giác bằng dung dịch KMnO4 0,020M (dung dịch trên
burette). Sau 3 lần chuẩn độ, giá trị thể tích đọc được trên burette lần lượt là 16,70 mL; 16,80 mL và 16,90 mL.
- Tính giá trị hằng số cân bằng KC của phản ứng (*) ở 25oC. Kết quả được làm tròn đến hàng phần trăm.
Đáp số: …………… 2,27
6 | Thay đổi tư duy – Bứt phá thành công
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
NAP 22: Thép thường hay là thép carbon là hợp kim của Fe và C (≤ 2%), nguyên tố khác rất ít
hoặc không có. Để xác định hàm lượng Fe trong một mẫu thép chứa Fe, C và Si người ta thực
hiện các thí nghiệm sau:
- Cân 10,00 gam mẫu thép rồi vào 200 mL dung dịch H2SO4 1 M, đến khi phản ứng xảy ra
hoàn toàn được 200,0 mL dung dịch X.
- Lấy 10,0 mL dung dịch X vào trong cốc thủy tinh, thêm tiếp dung dịch H2SO4 1 M (dư) rồi
chuẩn độ bằng dung dịch KMnO4 0,1 M. Kết thúc chuẩn độ, thể tích (mL) dung dịch KMnO4 0,1
M sử dụng qua 3 lần chuẩn độ như sau: Lần chuẩn độ Lần 1 Lần 2 Lần 3 Thể tích dung dịch KMnO4 16,6 16,4 16,5
a. Hàm lượng Fe trong thép > 98,0%. 92,4
b. Điểm tương đương (kết thúc chuẩn độ) là khi dung dịch trong cốc bắt đầu chuyển
màu hồng tồn tại bền trong khoảng 20 giây.
c. Trong phản ứng chuẩn độ, KMnO4 đóng vai trò là chất oxi hóa.
d. Khi để mẫu thép trên ở trong không khí ẩm thì xảy ra hiện tượng ăn mòn điện hóa
trong đó sắt đóng vai trò là cathode.
NAP 23: Để xác định nồng độ Fe2+ trong dung dịch một học sinh tiến thành thí nghiệm như sau: ợ
Cân 1,5 gam muối FeSO4.7H2O rồi hòa tan vào nước, sau đó định mức trong bình 50 mL. Chuẩn ỗ Tr
độ 5 mL dung dịch vừa pha bằng dung dịch KMnO4 0,02M trong môi trường H2SO4 loãng cho
đến khi dung dịch có màu hồng nhạt ổn định trong 20 giây thì dừng lại. Lặp lại thí nghiệm 3 ệ Zalo H
lần, kết quả thể tích dd KMnO4 thu được như sau: Lần TN 1 2 3 ọc Liên H Thể tích ddKMnO4 4,9 5 5,1
Từ kết quả chuẩn độ xác định nồng độ Fe2+
ng Kí H trong dung dịch đã pha.
Đáp số: …………… Đă 0,1 TLOT Official: 0333800642
NAP 24: Khi bảo quản trong phòng thí nghiệm, muối Mohr FeSO4.(NH4)2SO4.6H2O hút ẩm và bị
oxi hóa một phần bởi O2 trong không khí thành hỗn hợp X. Để xác định phần trăm khối lượng
muối Mohr trong X, tiến hành thí nghiệm theo các bước sau:
- Bước 1: Cân chính xác 3,0 gam X, rồi cho vào bình định mức 100 mL, cho nước cất vào, dùng
đũa thủy tinh khuấy cho tan hết. Thêm nước cất vào bình định mức đến vạch, lắc đều, thu được 100 mL dung dịch Y.
- Bước 2: Lấy 10,00 mL dung dịch Y cho vào bình tam giác, thêm 5 mL sulfuric acid nồng độ
1M. Tiến hành chuẩn độ bằng dung dịch KMnO4 0,015M đến khi dung dịch chuyển từ không
màu sang màu tím nhạt bền trong 20 giây (đây là điểm tương đương của phép chuẩn độ). Lặp
lại thí nghiệm chuẩn độ thêm 2 lần nữa. Kết quả thể tích dung dịch KMnO4 0,015M được ghi trong bảng sau: Thí nghiệm Lần 1 Lần 2 Lần 3 VKMnO4 (mL) 9,4 9,2 9,3
Phần trăm khối lượng của muối Mohr trong X là a%. Tính giá trị của a (làm tròn đến hàng phần mười).
Đáp số: …………… 91,1
Thay đổi tư duy – Bứt phá thành công | 7
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
NAP 25: Mùn là loại vật chất hữu cơ phức tạp trong đất, độ màu mỡ của đất phụ thuộc vào
hàm lượng mùn trong đất. Xác định carbon trong đất để tính hàm lượng mùn trong đất theo
phương pháp Tiurin như sau:
Bước 1: Cân 0,35 gam một mẫu đất khô rồi cho phản ứng với 11,7 mL dung dịch K2Cr2O7 0,1 M
trong H2SO4 loãng, dư, đun nóng (cho biết có 90% lượng carbon đã bị oxi hóa ở phản ứng này)
thu được dung dịch X, sơ đồ phản ứng xảy ra như sau:
K2Cr2O7 + C + H2SO4 → K2SO4 + Cr2(SO4)3 + CO2 + H2O (1)
Bước 2: Chuẩn độ dung dịch X thu được ở bước 1 bằng dung dịch FeSO4 0,1221 M trong H2SO4
loãng với chất chỉ thị thích hợp (cho biết phản ứng xảy ra hoàn toàn) thì dùng hết 18,7 mL, sơ
đồ phản ứng xảy ra như sau:
K2Cr2O7 + FeSO4 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O (2)
Theo phương pháp Tiurin, khối lượng mùn trong đất bằng khối lượng carbon trong đất nhân
với hệ số 1,724 và từ đó xác định được hàm lượng mùn trong đất là a% khối lượng. Giá trị của a
bằng bao nhiêu? (Không làm tròn khi tính toán và kết quả cuối cùng làm tròn đến hàng phần mười).
Đáp số: …………… 7,8
---------------- HẾT ---------------- ợ ỗ Tr ệ Zalo H ọc Liên H ng Kí H Đă TLOT Official: 0333800642
8 | Thay đổi tư duy – Bứt phá thành công
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
KHÓA HỌC CẤP TỐC 14 NGÀY
NGÀY 02: ĐỀ DỰ ĐOÁN VẬN DỤNG CAO – SỐ 02
NAP 1: Cho các thông tin sau: Cặp oxi hóa – khử
Thế điện cực chuẩn (V) Fe3+/Fe2+ -0,77 2 Cr O + 14H+/2Cr3+ + 7H 2 7 2O 1,33 MnO + 8H+/Mn2+ + 4H 4 2O 1,53
a. Chuẩn độ được Fe2+ trong dung dịch gồm Fe2+, 2
SO và H+ bằng dung dịch chứa chất 4 chuẩn là KMnO4.
b. Có diễn ra phản ứng oxi hóa – khử theo phương trình hóa học sau:
6Fe3+(aq) + 2Cr3+(aq) + 7H2O(l) → 6Fe2+(aq) + 2 Cr O (aq) + 14H+(aq) 2 7
c. Không chuẩn độ được Fe2+ trong dung dịch gồm Fe2+, và H+ bằng dung dịch chứa chất chuẩn là K2Cr2O7.
d. Trong môi trường acid, anion 2
Cr O (từ sự phân li của muối potassium dichromate, 2 7 ợ
K2Cr2O3) có tính oxi hóa mạnh hơn anion MnO ( từ sự ph ỗ ân l Tr i của muối KMnO 4 4).
NAP 2: C60600 là hợp kim của copper (Cu) và aluminium (Al). Phản ứng sau đây có thể được
sử dụng để xác định hàm lượng Cu trong C60600. ệ Zalo H
2Cu2+(aq) + 4I-(aq) → 2CuI(s) + I2(aq)
Quy trình thực hiện thí nghiệm như sau: ọc Liên H
Bước 1: Hòa tan 0,5 gam mẫu hợp kim C60600 trong sulfuric acid đặc, rồi pha loãng bằng nước.
Bước 2: Thêm dung dịch I- đến dư. ng Kí H Đă
Bước 3: Thêm dần dung dịch S2O32- 0,50 M để phản ứng iodin
TLOT Official: 0333800642 e theo phản ứng sau:
I2(aq) + 2S2O32-(aq) → 2I-(aq) + S4O62-(aq)
Thể tích dung dịch S2O32- (aq) cần để phản ứng trên xảy ra vừa đủ là 14,85 mL. Tính hàm lượng
% khối lượng Cu trong mẫu hợp kim C60600? (Làm tròn kết quả đến hàng đơn vị)
Đáp số: ……………
NAP 3: Nước ngầm, bên cạnh nước hồ đập và nước biển khử muối, là một phần của nguồn
cung cấp nước cho các hộ gia đình. Nước ngầm chứa nhiều loại hóa chất khác nhau có thể ảnh
hưởng đến chất lượng nước uống. Một trong những chất gây ô nhiễm là sắt, thường được tìm
thấy ở dạng iron(II) hydrogencarbonate. Iron có thể được loại bỏ bằng cách thêm khí chlorine,
calcium hydrogencarbonate được thêm vào để duy trì độ pH hơi base. Phản ứng có thể được
biểu diễn bằng phương trình sau:
2 Fe(HCO3)2 + Cl2 + Ca(HCO3)2 → 2Fe(OH)3 + CaCl2 + 6 CO2
Dẫn 7,00 gam khí chlorine được sục qua 30000 L nước ngầm chứa 38982 mg iron(II)
hydrogencarbonate, trong đó đã thêm 16,2 gam calcium hydrogencarbonate. Tính khối lượng
(gam) iron(III) hydroxide sẽ kết tủa, phản ứng xảy ra hoàn toàn. (Làm tròn kết quả đến hàng phần mười)
Đáp số: ……………
Thay đổi tư duy – Bứt phá thành công | 9
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
NAP 4: Trong y học, oxalic acid (H2C2O4) được sử dụng để điều trị một số bệnh về da. Tuy
nhiên, việc sử dụng quá liều oxalic acid có thể gây ngộ độc. Để kiểm soát chất lượng của dung
dịch oxalic acid, người ta thường sử dụng phương pháp chuẩn độ bằng dung dịch KMnO4. Một
dung dịch H2C2O4 được lấy ra 10,00 mL và pha loãng thành 250,0 mL dung dịch. Lấy 25,00 mL
dung dịch này cho vào bình nón, thêm H2SO4 loãng dư rồi chuẩn độ bằng dung dịch KMnO4
0,02 M. Thể tích trung bình của dung dịch KMnO4 tiêu tốn sau 3 lần chuẩn độ là 15,60 mL.Tính
nồng độ mol của dung dịch H2C2O4 ban đầu (làm tròn đến hàng phần trăm). Biết sản phẩm phản
ứng chuẩn độ tạo ra gồm K2SO4, MnSO4, CO2.
Đáp số: ……………
NAP 5: Học sinh A tìm hiểu quá trình làm giấm ăn từ dung dịch ethyl alcohol loãng với giả thiết
“khi nhiệt độ tăng thì tốc độ lên men giấm càng nhanh”. Để kiểm tra giả thiết này, học sinh A đã
tiến hành thí nghiệm như sau:
- Chuẩn bị: 1 lít rượu vang trắng (nồng độ ethyl alcohol khoảng 10o), 1 ly giấm nuôi, 5 cốc thủy
tinh chia vạch loại 200 mL.
- Cách làm: Lấy 200 mL rượu vang trắng vào cốc thứ nhất (mẫu trắng). Cho giấm nuôi vào
lượng rượu còn lại, rồi cho vào 4 cốc thủy tinh đến vạch định mức, đậy nắp bằng tấm bìa giấy.
Bảo quản các cốc trong điều kiện ít chiếu sáng ở các nhiệt độ: 0o (mẫu 1); 10o (mẫu 2); 30o (mẫu ợ 3); 50o (mẫu 4). ỗ Tr
Sau 1 tháng, lấy các mẫu đem lọc sạch, để ổn định ở nhiệt độ môi trường thì thấy thể tích dung dịch
trong các mẫu hầu như không thay đổi.. Lần lượt lấy 5 mL các mẫu: mẫu trắng và các mẫu 1; 2; 3; 4 ệ Zalo H
rồi pha loãng thành 100 mL và tiến hành chuẩn độ bằng dung dịch NaOH 0,1 M với chỉ thị
phenolpthalein. Kết quả thu được như bảng sau: ọc Liên H Mẫu Mẫu trắng Mẫu 1 Mẫu 2 Mẫu 3 Mẫu 4
Thể tích dung dịch NaOH 0,1M (mL) ng Kí H 4,8 5,2 7,4 25,2 8,6
Biết trong các mẫu chỉ chứa C Đă 2H5OH, CH3COOH và H2O TLOT Official: 0333800642
a. Trong thí nghiệm trên, nhiệt độ tối ưu cho quá trình lên men giấm là 30 oC.
b. Trong rượu vang trắng đã có một lượng CH3COOH.
c. Từ kết quả thí nghiệm, kết luận giả thuyết của học sinh A là đúng.
d. Trong thí nghiệm trên, lượng CH3COOH được tạo thành nhiều nhất trong một mẫu (200 mL) là 4,896 gam.
NAP 6: Một mẫu nước thải của nhà máy sản xuất có pH = 4. Để thải ra ngoài môi trường thì cần
phải tăng pH lên từ 5,8 đến 8,6 (theo đúng quy định), nhà máy phải dùng vôi sống thả vào
nước thải. Khối lượng vôi sống cần dùng cho 1m3 nước để nâng pH từ 4 lên 7 là bao nhiêu gam?
(Bỏ qua sự thủy phân của các muối nếu có) (Kết quả làm tròn đến hàng phần mười).
Đáp số: ……………
NAP 7: Cho dung dịch A chứa hỗn hợp FeSO4 và Fe2(SO4)3 trong môi trường H2SO4 loãng. Lấy
25,00 mL dung dịch A rồi chuẩn độ bằng dung dịch KMnO4 0,025M thì hết 18 mL dung dịch đó.
Lại lấy 25,00 mL dung dịch A nữa rồi thêm vào đó lượng dư dung dịch NH3, lọc, rửa kết tủa,
nung kết tủa trong không khí ở nhiệt độ cao đến khi khối lượng không đổi, cân được 1,2 gam.
Tổng nồng độ của 2 muối trong dung dịch là bao nhiêu? (Làm tròn kết quả đến hàng phần trăm)
Đáp số: ……………
10 | Thay đổi tư duy – Bứt phá thành công
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
NAP 8: Một học sinh thực hiện các thí nghiệm chuẩn độ dung dịch HCl (có nồng độ trong
khoảng 0,10M – 0,12M) bằng dung dịch NaOH 0,0985M với chỉ thị phenolphthalein như sau:
- Thí nghiệm 1: Dung dịch NaOH được cho vào burette (loại 25 mL); bình tam giác (loại 100
mL) chứa 10,0 mL dung dịch HCl và 2 giọt chất chỉ thị phenolphtalein. Thể tích dung dịch
NaOH trung bình sau 3 lần chuẩn độ là 10,35 mL.
- Thí nghiệm 2: Dung dịch HCl được cho vào burette (loại 25 mL); bình tam giác (loại 100 mL)
chứa 10,0 mL dung dịch NaOH và 2 giọt chất chỉ thị phenolphthalein. Thể tích dung dịch HCl
trung bình sau 3 lần chuẩn độ là V1 mL.
a. Nồng độ của dung dịch HCl xác định được từ thí nghiệm 1 là 0,1050M.
b. Trong quá trình chuẩn độ, pH của dung dịch chứa trong bình tam giác ở hai thí nghiệm không thay đổi.
c. Trong hai thí nghiệm trên, tại điểm kết thúc chuẩn độ, dung dịch trong bình tam giác
đổi màu từ hồng sang không màu.
d. Nếu nồng độ dung dịch HCl xác định được từ thí nghiệm 1 và thí nghiệm 2 là như
nhau, thì giá trị của V1 bằng 10,35 mL.
NAP 9: Phèn chua có công thức KAl(SO4)2.12H2O. Ở các vùng quê người dân thường dùng
phèn chua để làm trong nước đục với liều lượng thường dùng 1,0 gam phèn chua cho 20 lít ợ
nước đục. Để kiểm chứng em học sinh A làm thí nghiệm như sau: ỗ Tr
Bước 1: Cho 1,0 lít nước ao sau khi đã lắng cặn nhưng vẫn còn đục vào chậu thủy tinh.
Bước 2: Hòa tan khoảng 0,05 gam phèn chua vào phía trên mặt nước trong châu thủy tinh ở ệ Zalo H
bước 1, khuấy đều rồi để yên trong thời gian khoảng 2 giờ.
a. Một hộ gia đình cần xử lý một thùng đựng 24 m3 nước do bị ngập lũ nên sau khi nước ọc Liên H
rút nước trong thùng bị đục, để xử lý nước đục hộ gia đình đó cần dùng ít nhất 0,12 kg phèn
chua (với liều lượng như trên). ng Kí H
b. Phèn chua làm trong nước
Đă đục do khi hòa tan phèn chua phân li ra ion Al3+, ion này TLOT Official: 0333800642
tham gia thủy phân với nước tạo ra kết Al(OH)3 nó hấp phụ các chất bẩn lơ lửng trong nước lắng xuống đáy.
c. Sau bước 2 nước trong chậu có pH tăng, do tạo ra dung dịch KOH có tính base.
d. Sau bước 2 thấy nước trong chậu từ đục chuyển sang trong.
NAP 10: Theo tiêu chuẩn Việt Nam, hàm lượng ion cyanide trong nước thải của các nhà máy
phải xử lí trong khoảng 0,05-0,20 mg/lít trước khi thải ra môi trường. Phân tích một mẫu nước
thải của một nhà máy người ta đo được hàm lượng ion cyanide là 97,62 mg/lít. Để làm giảm
hàm lượng cyanide đến 0,12 mg/lít người ta sục khí chlorine vào nước thải trong môi trường có
pH = 9. Khi đó ion cyanide chuyển thành nitrogen không độc theo phản ứng:
CN- + OH- + Cl2 → CO2 + Cl- + H2O + N2
Để xử lí cyanide trong 1 000 m³ nước thải trên cần dùng tối thiểu x m3 khí chlorine (đkc). Giá trị
của x là bao nhiêu? (kết quả làm tròn đến hàng đơn vị)
Đáp số: ……………
Thay đổi tư duy – Bứt phá thành công | 11
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
NAP 11: Cân 3,2005 gam quặng sắt chứa Fe O và các tạp chất trơ khác đem hòa tan trong 2 3 dung dịch H SO 2
4 (loãng, dư), sau đó khử hoàn toàn hết 3
Fe trong dung dịch bằng Zn thành 2
Fe , thu được 100,0 mL dung dịch X (sử dụng bình định mức 100,00mL). Lấy chính xác 10,00mL X và dung dịch H SO 2
4 loãng, dư cho vào bình tam giác cho mỗi lần thí nghiệm và sau
đó chuẩn độ dung dịch thu được bằng 3 KMnO 9,147 10
M . Chuẩn độ dung dịch đến khi dung 4
dịch trong bình tam giác xuất hiện màu hồng nhạt trong khoảng 20 giây thấy thề tích dung
dịch KMnO4 trên burette tiêu tốn cho ba lần thí nghiệm lần lượt là 8,24 ; 8,28 và 8,20 mL .
a. Phản ứng hòa tan Fe O
2 3 trong quặng: Fe O 3H SO Fe SO 3H O . 2 3 2 4 2 4 3 2
b. Phương trình ion rút gọn của phản ứng chuẩn độ là: 2 2 3 MnO 5Fe 8H Mn 5Fe 4H O. 4 2
c. Khi màu hồng nhạt trong bình tam giác bền trong khoảng 20 giây thì có thể coi như phản ứng vừa đủ.
d. Từ kết quả chuẩn độ, xác định được phần trăm khối lượng của Fe O 2 3 trong quặng là 18,8% .
NAP 12: Hydrochloric acid (HCl) là một chất được phát hiện trong dịch vị dạ dày có nồng độ
10–4 – 10–3 mol/L và độ pH duy trì ở mức 3 – 4 đối với ngườợi bình thường. Nếu thiếu acid trong
dạ dày thì thức ăn không chuyển hóa được lâu dần gây s ỗ uy
Tr nhược cơ thể, nếu dư acid lâu ngày
thì nó sẽ phá hủy đường ruột gây viêm loét dạ dày. Khi cơ thể dư acid HCl, người bệnh có thể
sử dụng thuốc giảm đau dạ dày có tên gọi là Nabic ệ a (thàn Zalo H
h phần chính là NaHCO3), được dùng
để trung hòa bớt lượng acid dư trong dạ dày.
Giả sử dịch vị dạ dày người bệnh chứa 1,5 lí ọ t du
c Liên H ng dịch hỗn hợp thức ăn lỏng, trong đó chứa
0,09125 gam HCl. Nếu khả năng tiêu thụ NaHCO3 của cơ thể người bệnh là 70% thì khối lượng NaHCO ng Kí H
3 người đó cần đưa vào cơ thể để duy trì độ pH trong dạ dày ở mức 3 là bao nhiêu? Đă
Đáp số: …………… TLOT Official: 0333800642
NAP 13: Dung dịch iron (II) sulfate để lâu ngày bị oxi hóa một phần bởi oxygen của không khí
tạo thành iron (III) sulfate (dung dịch X). Cho 30 mL dung dịch H2SO4 0,5M vào 10 mL dung
dịch X thu được dung dịch Y.
Thí nghiệm 1: Chuẩn độ 10,0 mL dung dịch Y bằng dung dịch KMnO4 0,05M cho đến khi
xuất hiện màu hồng nhạt bền (phản ứng coi như vừa đủ) thì thấy hết 9,0 mL dung dịch KMnO4.
Thí nghiệm 2: Ngâm một lá sắt dư vào 10,0 mL dung dịch Y, khuấy đều đến khi khử hoàn
toàn sắt(III) thành Fe(II). Lấy lá sắt ra, rồi chuẩn độ bằng dung dịch KMnO4 0,05M. Khi màu
hồng nhạt bền xuất hiện thì thấy hết 10,5 mL dung dịch KMnO4. Tỉ lệ iron (II) sulfate đã bị oxi
hóa trong không khí là a%. Giá trị của a bằng bao nhiêu? (kết quả làm tròn đến phần nguyên).
Đáp số: ……………
NAP 14: Một mẫu NaOH kỹ thuật (đã hút ẩm và bị carbonate hóa). Để xác định % NaOH đã bị
carbonate hóa, người ta tiến hành như sau:
Bước 1: Cân 5,0 gam mẫu cho vào bình định mức 250 mL, thêm khoảng 100 mL nước cất, lắc
đều cho tan hết rồi thêm tiếp nước cấy cho đến vạch định mức. Chứa dung dịch vào chai polyethylene có nút kín.
12 | Thay đổi tư duy – Bứt phá thành công
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
Bước 2: Dùng pipette hút 5 mL dung dịch (Bước 1) cho vào bình tam giác dung tích 200 mL,
thêm 20 mL nước cất sau đó thêm 3 giọt phenolphthalein. Dùng dung dịch chuẩn HCl 0,1 M
chuẩn độ đến khi dung dịch mất màu ( 2
CO chuyển hết sang HCO) thì thể tích dung dịch 3 3
HCl tiêu tốn là 18,7 mL. Thêm tiếp vào bình tam giác 2 giọt methyl orangen 0,1% rồi tiếp tục
chuẩn độ đến khi dung dịch ở bình erlen chuyển từ màu vàng sang màu đỏ ( HCOchuyển hết 3
sang CO2). Tổng thể tích dung dịch HCl tiêu tốn là 21,3 mL. Biết phenolphthalein có màu hồng
khí pH > 8 và không màu khi pH < 8; methyl orange có màu vàng khi pH > 4 và màu đỏ khi pH
< 4. Lượng NaOH đã bị carbonate hóa là bao nhiêu % (làm trong đến hàng phần mười)?
Đáp số: ……………
NAP 15: Rỉ đường là sản phẩm phụ trong quá trình sản xuất và tinh luyện đường mía. Việc tận
dụng rỉ đường làm môi trường nuôi cấy lactic acid có tiềm năng giảm thiểu ô nhiễm môi trường
và góp phần phát triển bền vững. Một nhóm học sinh đã nghiên cứu quá trình sử dụng vi
khuẩn Lactobacillus để lên men rỉ đường tạo lactic acid ở nhiệt độ 37°C, trong môi trường có pH
= 6,0. Giả thuyết được đưa ra là: “với tỉ lệ rỉ đường càng cao (hàm lượng glucose càng lớn),
lượng lactic acid thu được càng nhiều.”
Thí nghiệm được tiến hành như sau:
- Chuẩn bị dung dịch rỉ đường với các nồng độ: 5%, 10%, 15% ợ
và 20%. Mỗi mẫu được bổ
sung 10% vi khuẩn Lactobacillus, sau đó thêm nước cất đến ỗ Trđủ 200 mL.
- Dùng hóa chất thích hợp để điều chỉnh pH môi trường đạt 6,0.
- Ủ các mẫu ở nhiệt độ 37°C trong vòng 30 g ệ iờ. Tro
Zalo H ng đó: mẫu 1: rỉ đường 5%, mẫu 2: rỉ
đường 10%, mẫu 3: rỉ đường 15%, mẫu 4: rỉ đường 20%, mẫu trắng: rỉ đường 5% không bổ sung
vi khuẩn Lactobacillus. ọc Liên H
- Sau thời gian ủ, thể tích dung dịch các mẫu gần như không đổi. Mỗi mẫu được lấy 5 mL,
pha loãng đến 100 mL, sau đó tiến hành
ng Kí H chuẩn độ bằng dung dịch NaOH 0,1 M với chỉ thị Đă
phenolphthalein. Kết quả thu được như bảng sau: TLOT Official: 0333800642 Mẫu Mẫu trắng Mẫu 1 Mẫu 2 Mẫu 3 Mẫu 4 Thể tích NaOH 0,1 M (mL) 0,0 2,92 5,8 8,7 7,2
a. Dựa trên kết quả thí nghiệm, giả thuyết ban đầu của nhóm học sinh là sai.
b. Trong mẫu trắng, lượng lactic acid tạo thành rất nhiều nên không xác định bằng
phương pháp chuẩn độ với NaOH.
c. Quá trình lên men tạo lactic acid đạt cao nhất ở tỷ lệ rỉ đường 15%.
d. Phương pháp thí nghiệm này được ứng dụng để sản xuất lactic acid từ rỉ đường mà
không cần sử dụng vi khuẩn Lactobacillus.
NAP 16: Ion NH�� trong nước uống có thể ảnh hưởng đến hệ thần kinh và quá trình vận chuyển
oxygen trong máu. Trong xử lí nước sinh hoạt, người ta sử dụng quá trình nitrate hóa để chuyển hóa NH� �
� thành NO3−, sau đó áp dụng quá trình khử nitrate để chuyển NO� thành khí
N2, giúp loại bỏ hoàn toàn nitrogen ra khỏi nước. Phương trình xử lí như sau:
Quá trình nitrate hóa (hiệu suất 95%): NH� � � + 2O2 NO� + 2H+ + H2O
Khử nitrate thành khí N2 (hiệu suất 90%): 2NO�� + 10e + 12H+ N2 + 6H2O
Thay đổi tư duy – Bứt phá thành công | 13
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
Một nhà máy xử lí nước có bể chứa 500 m³ nước bị nhiễm ammonium với nồng độ 56 mg/L
theo qui trình 2 bước như trên. Lượng khí O2 tối thiểu cần cung cấp cho quá trình xử lí là a kg,
lượng khí N2 tạo thành là b (kg). Tính tổng a + b. (Kết quả làm tròn đến hàng đơn vị)
Đáp số: ……………
NAP 17: Trong thực tiễn, Fe(II) thường được bảo quản dưới dạng muối Mohr có công thức hóa
học là FeSO4.(NH4)2SO4.6H2O.
Một nhóm học sinh tiến hành tổng hợp muối Mohr theo các bước sau:
Bước 1: Hòa tan 2,00 g bột Fe bằng 25 mL dung dịch H2SO4 20% trong một cốc thủy tinh loại 100
mL. Lọc, thu lấy phần dung dịch màu xanh, thêm tiếp 4,7 g tinh thể (NH4)2SO4 vào phần dung
dịch, khuấy đều cho tan hết.
Bước 2: Đun dung dịch hỗn hợp đến khi thể tích còn khoảng 15 mL, để nguội về nhiệt độ phòng.
Bước 3: Kết tinh dung dịch, lọc lấy tinh thể màu xanh nhạt, sấy khô, thu được 12,44 g mẫu sản phẩm.
Bước 4: Cho 0,20 g mẫu sản phẩm vào bình tam giác, thêm khoảng 10 mL nước cất, 5 mL dung
dịch H2SO4 10%, lắc đều cho chất rắn tan hết.
Tiến hành chuẩn độ hàm lượng FeSO4 trong bình tam giác bằng dung dịch KMnO4 0,02 M thì ợ
cần vừa đủ 5,00 mL. Phần trăm khối lượng muối Mohr trong mẫu sản phẩm ở Bước 4 là a%. Giá ỗ Tr
trị của a là bao nhiêu? (Làm trong kết quả đến phần mười).
Đáp số: …………… ệ Zalo H
NAP 18: Cyanide (CN-) là một hoá chất cực độc nhưng vẫn được dùng trong ngành khai thác
vàng nhờ khả năng tạo phức mạnh. Một công ty khai thác vàng sử dụng potassium cyanide ọc Liên H
(KCN) để hoà tan vàng từ quặng, để đảm bảo hiệu quả khai thác và giảm thiểu rủi ro môi
trường, họ cần kiểm tra độ tinh khiết của KCN t ng Kí H rước khi sử dụng.
Hàm lượng ion cyanide có thể xác
Đăđịnh bằng phương pháp chuẩn độ Liebig: dùng dung dịch TLOT Official: 0333800642
AgNO3 0,1 M làm chất chuẩn.
Phương trình phản ứng chuẩn độ: 2CN- + Ag+ ⇌ Ag(CN)2-
Tại điểm tương đương (phản ứng không làm ảnh hưởng đến thể tích chất chuẩn):
Ag(CN)2- + Ag+ ⇌ Ag[Ag(CN)2]
Một kỹ thuật viên đã thực hiện xác định độ tinh khiết của 0,650 gam mẫu KCN với dung dịch
AgNO3 0,1 M. Chuẩn độ 3 lần thì cho kết quả như sau: Lần chuẩn độ 1 2 3
Thể tích chất chuẩn đã dùng (mL) 43,85 44,05 44,10
Tính độ tinh khiết (%) của mẫu KCN trên (kết quả làm tròn đến hàng đơn vị).
Đáp số: ……………
NAP 19: Chuẩn độ hàm lượng ion Fe2+ trong môi trường acid (chứa trong bình tam giác) bằng
dung dịch KMnO4 đã biết nồng độ (chứa trên burette). Trong quá trình chuẩn độ, nếu dung
dịch trên burette được thêm vào bình tam giác quá nhanh thì trong bình sẽ xuất hiện kết tủa
nâu MnO2 theo phương trình hóa học dưới đây, dẫn đến sai lệch kết quả chuẩn độ:
MnO4-(aq) + H+(aq) + Fe2+(aq) → MnO2(s) + Fe3+ + H2O(l)
14 | Thay đổi tư duy – Bứt phá thành công
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
Giả sử một học sinh thao tác chuẩn độ sai, làm 55% lượng MnO4- chuẩn độ chuyển thành MnO2
(phần còn lại vẫn phản ứng tạo Mn2+), tổng lượng Fe2+ bị oxi hóa là 2,4 mmol. Thể tích dung dịch
KMnO4 0,02M đã dùng tăng bao nhiêu mL so với khi chuẩn độ với thao tác phù hợp? (Kết quả làm
tròn đến hàng phần trăm)
Đáp số: ……………
NAP 20: Trong phòng thí nghiệm, soda (Na2CO3) khi để lâu ngày bị chuyển hóa và hút ẩm tạo
thành hỗn hợp X gồm Na2CO3, NaHCO3 và H2O. Hòa tan hoàn toàn một lượng X trong nước
thu được 100 mL dung dịch Y. Tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Cho 27 mL dung dịch HCl 1M vào 10 mL dung dịch Y, sau đó đun nhẹ. Để trung
hòa dung dịch thu được được cần dùng 25 mL dung dịch NaOH 0,2M.
- Thí nghiệm 2: Cho dung dịch NaOH vào 10 mL dung dịch Y, sau đó thêm tiếp dung dịch BaCl2
dư thu được 2,364 gam kết tủa và dung dịch T. Nếu đun nóng dung dịch T thì không xuất hiện thêm kết tủa.
Biết các phản ứng xảy ra hoàn toàn. Phần trăm Na2CO3 đã bị chuyển hóa thành NaHCO3 là bao
nhiêu (làm tròn đến hàng phần trăm)?
Đáp số: ……………
NAP 21: Vỏ trứng có chứa calcium ở dạng CaCO3. Để xác định hàm lượng CaCO3 trong vỏ ợ
trứng, các bước thí nghiệm được tiến hành như sau: ỗ Tr
Bước 1: Cân 2,0 gam vỏ trứng khô, đã làm sạch, hoà tan hoàn toàn trong 50 mL dung dịch HCl
0,1 M. Lọc dung dịch sau phản ứng thu được 50 mL dung dịch X. ệ Zalo H
Bước 2: Chuẩn độ 10,0 mL dung dịch X bằng dung dịch NaOH chuẩn với chỉ thị
phenolphthalein thì tại điểm kết thúc chuẩn độ, dung dịch xuất hiện màu hồng. ọc Liên H
Kết quả chuẩn độ 10,0 mL dung dịch X khi sử dụng dung dịch chuẩn NaOH 0,01 M được ghi trong bảng sau: ng Kí H Đă Lần 1 Lần 2 Lần 3 TLOT Official: 0333800642 Thể tích NaOH (mL) 3,9 4,1 4,0
Giả thiết các tạp chất khác trong vỏ trứng không phản ứng với HCl, chấp nhận sai số chuẩn độ
không đáng kể, các thành phần khác trong vỏ trứng không ảnh hưởng đến kết quả chuẩn độ.
Tính hàm lượng % CaCO3 về khối lượng có trong 2,0 gam vỏ trứng.
Đáp số: ……………
NAP 22: Sự gia tăng hàm lượng nitrate trong nước là một trong những nguyên nhân của hiện
tượng phú dưỡng. Một trong những quy trình xác định hàm lượng nitrate trong nước được thực hiện như sau:
Thí nghiệm 1: Lấy 10,0 mL dung dịch muối Mohr [(NH4)2SO4.FeSO4.6H2O], thêm H2SO4 1M vào
và chuẩn độ bằng dung dịch KMnO4.
Thí nghiệm 2: Lấy 10,0 mL dung dịch muối Mohr cho vào 100 mL nước chứa ion nitrate, thêm
NaOH(s) vào để đạt khoảng 28%, khi đó muối Mohr khử nitrate thành ammonia theo các phản ứng: NO (aq) + 2Fe(OH) NO + 2Fe(OH) 3 2 + H2O 2 3 (1) NO (aq) + 6Fe(OH) 2 2 + 5H2O NH3 + 6Fe(OH)3 + OH- (2)
Thay đổi tư duy – Bứt phá thành công | 15
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
Sau khi các phản ứng (1) và (2) hoàn toàn, lọc bỏ kết tủa, acid hóa dung dịch bằng dung dịch
H2SO4 1M và chuẩn độ lượng Fe2+ dư bằng dung dịch KMnO4 (Các chất và ion khác trong dung
dịch không phản ứng với KMnO4). Hãy cho biết mỗi mmol KMnO4 chênh lệch giữa thí nghiệm
1 với thí nghiệm 2 sẽ tương ứng với bao nhiêu mg NO trong nước. (Làm trong kết quả đến hàng 3 phần mười)
Đáp số: ……………
NAP 23: Cyanide (CN-) là một loại chất độc hại được tìm thấy trong nước thải của các công ty
khai thác quặng kim loại. Cyanide có khả năng tạo phức mạnh với kim loại, các công ty khai
thác mỏ đã kiếm được lợi nhuận khổng lồ từ việc sử dụng cyanide để chiết xuất Au từ quặng của nó.
Hàm lượng ion cyanide có thể xác định bằng phương pháp chuẩn độ Liebig: dùng dung dịch
AgNO3 0,1 M làm chất chuẩn.
Phương trình chuẩn độ: 2 CN- + Ag+ Ag(CN)2-
Tại điểm tương đương: Ag(CN)2- + Ag+ Ag[Ag(CN)2]
Thực hiện xác định độ tinh khiết của 0,4723 gam mẫu KCN với dung dịch AgNO3 0,1 M.
Chuẩn độ 3 lần thì cho kết quả như sau: Lần chuẩn độ ợ 1 2 3 ỗ Tr
Thể tích chất chuẩn đã dùng 34,9 35 34,95
Xác định độ tinh khiết của mẫu KCN trên. (làm trong đáp án đến hàng phần mười) ệ Zalo H
Đáp số: ……………
NAP 24: Hàm lượng sắt (iron) trong nước là số miligam nguyên tố sắt có trong 1 lít nước, đơn ọc Liên H
vị tính là mg/L. Để xác định hàm lượng sắt trong một mẫu nước giếng, một nhóm học sinh tiến hành thí nghiệm sau: ng Kí H
‒ Bước 1: Lấy 200 mL mẫu nước vào
Đă bình tam giác, thêm 1 mL dung dịch H2SO4 1M (xem như TLOT Official: 0333800642
không làm thay đổi thể tích mẫu) rồi dẫn dư khí SO2 qua dung dịch hỗn hợp để khử toàn bộ
Fe3+ thành Fe2+ theo phản ứng: 3 2 2 2Fe SO 2H O 2Fe 4H SO 2 2 4
‒ Bước 2: Đun nhẹ bình chứa dung dịch mẫu ở nhiệt độ 600C để đuổi hết khí SO2 dư ra khỏi dung dịch.
‒ Bước 3: Chuẩn độ 25,00 mL dung dịch mẫu bằng dung dịch KMnO4 0,02M.
Sau 5 lần chuẩn độ, thể tích trung bình của dung dịch KMnO4 là 8,00 mL. Hãy tính hàm lượng
của sắt (đơn vị mg/L) trong mẫu nước giếng trên (lấy đến hàng đơn vị).
Đáp số: ……………
NAP 25: Hàm lượng glucose có trong một mẫu dược phẩm có thể được xác định bằng phương
pháp chuẩn độ iodine như sau: Cân 2,103 g mẫu hòa tan vào 100 mL nước, thêm tiếp 120 mL
nước iodine 0,1 M (dư) và 10 mL dung dịch NaOH 5% để tạo môi trường kiềm, lắc, trộn đều.
Đậy nút bình và để vào chỗ tối trong khoảng 20 phút. Lấy bình ra, thêm từ từ 15 mL H2SO4
10%, lắc nhẹ. Sau đó, thêm vào dung dịch sau phản ứng vài giọt dung dịch hồ tinh bột, rồi vừa
lắc vừa nhỏ từ từ dung dịch sodium thiosulfate (Na2S2O3) 0,1 M vào dung dịch ở trên đến khi
mất màu xanh thì dừng lại. Kết quả thể tích dung dịch sodium thiosulfate đã tiêu tốn sau 3 lần
chuẩn độ được ghi lại ở bảng sau:
16 | Thay đổi tư duy – Bứt phá thành công
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/ Lần chuẩn độ Lần 1 Lần 2 Lần 3
Thể tích dung dịch Na2S2O3 0,1 M (mL) 27,0 27,1 27,1
Biết rằng, phản ứng glucose với iodine và phản ứng giữa iodine với sodium thiosulfate xảy ra như sau: I2 + 2OH- → I- + IO- + H2O
CH2OH[CHOH]4-CHO + IO- → CH2OH[CHOH]4-COOH + I-
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Phần trăm khối lượng glucose trong mẫu dược phẩm ban đầu là x%. Tính x (làm tròn đến hàng đơn vị).
Đáp số: ……………
---------------- HẾT ---------------- ợ ỗ Tr ệ Zalo H ọc Liên H ng Kí H Đă TLOT Official: 0333800642
Thay đổi tư duy – Bứt phá thành công | 17
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/
KHÓA HỌC CẤP TỐC 14 NGÀY
NGÀY 03: ĐỀ DỰ ĐOÁN VẬN DỤNG CAO – SỐ 03
NAP 1: Khi hòa tan muối NiCl2 khan có màu vàng vào nước, thu được dung dịch có màu xanh
lá cây do chứa phức chất aqua của Ni2+ dạng bát diện (phức chất X). Thêm tiếp dung dịch NH3
đặc vào cho đến khi có sự thay thế của tất cả các phối tử aqua trong phức chất của nickel(II)
bằng các phối tử ammine (NH3) thu được dung dịch có màu xanh dương (có chứa phức chất Y).
Biết quá trình phản ứng không làm thay đổi dạng hình học của phức chất.
a. Trong phức chất Y, có 6 liên kết cho nhận giữa phối tử ammine và nguyên tử trung tâm Ni2+.
b. Phức chất aqua của nickel(II) có công thức là [Ni(H2O)6]2+.
c. Dấu hiệu nhận biết sự hình thành các phức chất là sự thay đổi màu sắc.
d. Phản ứng thế phối tử xảy ra là: [Ni(H2O)6]2+(aq) + 4NH3(aq) → [Ni(NH3)4]2+(aq) + 6H2O(l)
NAP 2: Muối CuSO4 khan màu trắng khi tan vào nước tạo thành dung dịch có màu xanh do
hình thành phức chất X. Nhỏ từ từ đến dư dung dịch NH� đặc vào dung dịch thu được, lúc đầu ợ
thấy xuất hiện kết tủa Y màu xanh nhạt, sau đó kết tủa tan dần tạo thành dung dịch màu xanh ỗ Tr lam chứa phức chất Z.
a. Công thức của X và Y lần lượt là [Cu(H�O) ệ �]��
Zalo Hvà [Cu(NH�)�]��.
b. CuSO4 là hợp chất của kim loại chuyển tiếp dãy thứ nhất.
c. Trong phức chất X, liên kết giữa nguyên tử trung tâm và phối tử là liên kết ion. ọc Liên H
d. CuSO4 khan được dùng để phát hiện nước lẫn trong xăng dầu nhờ sự đổi màu khi tiếp xúc với nước. ng Kí H
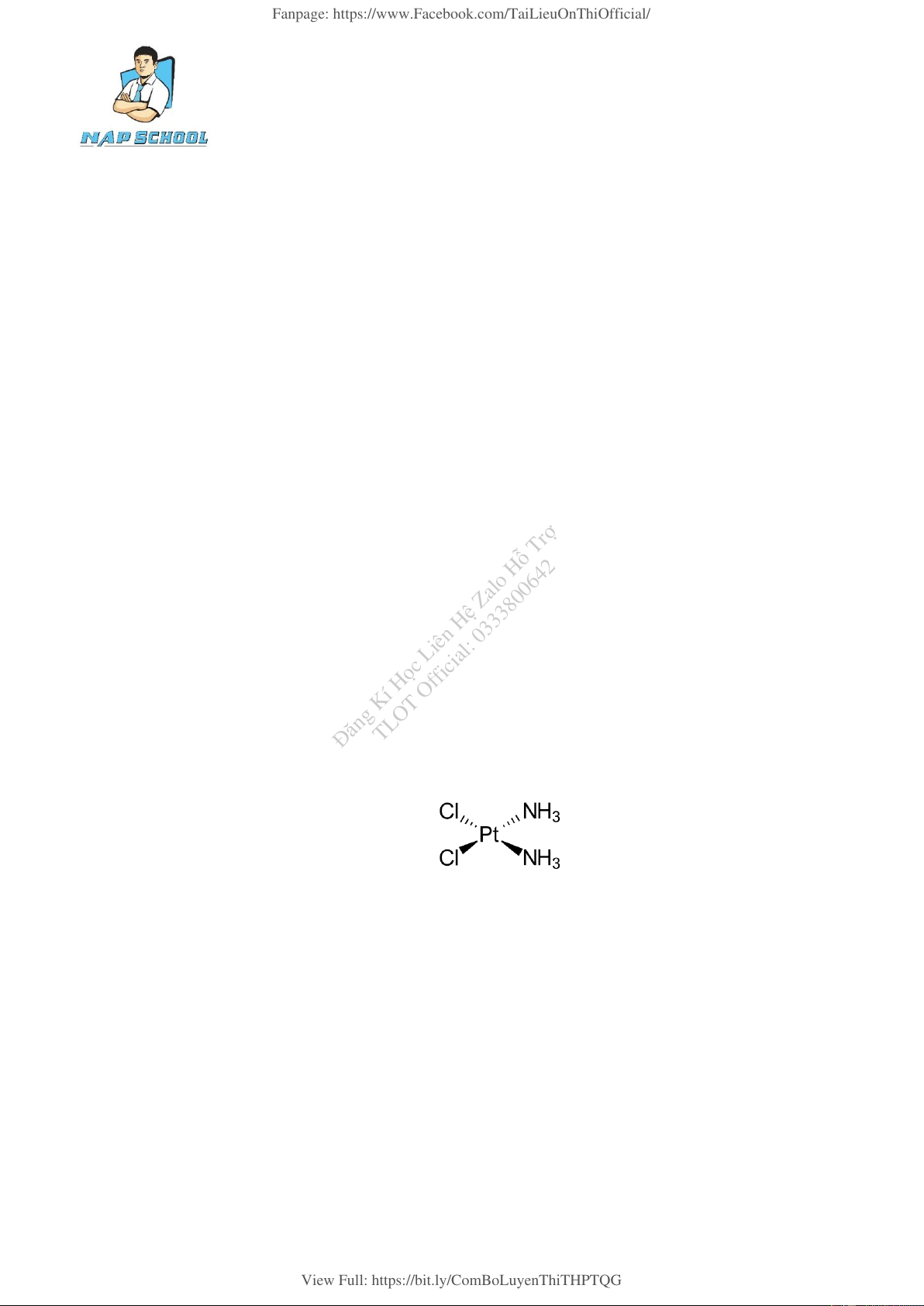
NAP 3: Cisplatin là hóa chất được s
Đă ử dụng để điều trị một số bệnh ung thư. Cisplatin có công TLOT Official: 0333800642
thức cấu tạo được mô tả nhu hình bên:
Trong phức chất, số phối trí của nguyên tử trung tâm là số liên kết 𝜎 giữa nguyên tử trung tâm
với các phối tử. Số phối trí của nguyên tử trung tâm trong cisplatin là bao nhiêu?.
Đáp số: ……………
NAP 4: Cation Cu2+ có cấu hình electron [Ar]3d9 có thể tạo phức được với nhiều phối tử bằng
liên kết cho-nhận giữa phối tử với các orbital trống của cation Cu2+. Một thí nghiệm về sự tạo
thành hợp chất phức được thực hiện như sau:
(1) Hoà tan một lượng muối CuSO4 khan màu trắng vào nước, thu được dung dịch X có màu xanh
(2) Thêm tiếp dung dịch NH3 vào dung dịch X, thu được kết tủa (Y) màu xanh nhạt
(3) Tiếp tục thêm dung dịch NH3 đặc đến dư vào đến khi kết tủa bị hoà tan, thu được dung dịch Z có màu xanh lam.
Chuỗi thí nghiệm trên được biểu diễn qua sơ đồ sau:
18 | Thay đổi tư duy – Bứt phá thành công
View Full: https://bit.ly/ComBoLuyenThiTHPTQG
Fanpage: https://www.Facebook.com/TaiLieuOnThiOfficial/ CuSO4(s) (�)
�� [Cu(OH2)6]SO4(aq) (�)
�� [Cu(OH)2(OH2)4](s) (�)
�� [Cu(NH3)4(OH2)2](OH)2(aq)
Màu xanh của kết tủa và dung dịch được lí giải là do sự hình thành các phức chất gây ra.
a. Trong phức [Cu(NH3)4(OH2)2](OH)2, phối tử tạo phức là NH3, H2O, OH-.
b. Số electron lớp ngoài cùng của cation Cu2+ là 9.
c. Màu xanh của dung dịch X là do anion trong phức chất gây ra.
d. Các phản ứng (2), (3) đều có sự thay thế một số phối tử trong phức chất.
NAP 5: Cho các quá trình tạo phức bát diện sau:
Fe3+(aq) + 6H2O(l) [Fe(H2O)6]3+(aq) (I)
[Fe(H2O)6]3+(aq) + SCN-(aq) ⇌ [Fe(H2O)5(SCN)]2+(aq) + H2O(l) KC = 1,4.102 (II)
[Fe(H2O)6]3+(aq) + F-(aq) ⇌ [Fe(H2O)5F]2+(aq) + H2O(l) KC = 2,0.105 (III)
Biết dung dịch [Fe(H2O)6]3+ có màu vàng nâu, dung dịch [Fe(H2O)5(SCN)]2+ có màu đỏ, dung
dịch [Fe(H2O)5F]2+ và các ion SCN-, F- đều không màu.
a. Quá trình (I) xảy ra khi hòa tan iron(III) chloride trong nước, thu được dung dịch có
chứa lượng lớn Fe3+ và phức chất aqua [Fe(H2O)6]3+.
b. So với anion F-, anion SCN- dễ thay thế phối tử H2O trong [Fe(H2O)6]3+ hơn.
c. Khi cho từ từ dung dịch KSCN vào dung dịch ở quá trình (III) thì dung dịch này sẽ có màu. ợ
d. Trong các quá trình (I), (II), (III), mỗi phân tử ỗ H
Tr 2O hoặc ion SCN- hay ion F- đều sử
dụng số cặp electron như nhau để cho vào AO trống của cation Fe3+.
NAP 6: Cho bảng số liệu của một số kim loại chuyển t ệ iếp dãy t Zalo H hứ nhất sau: Kim loại Cr Mn Fe Co
Cấu hình electron của nguyên tử [Ar ọ ]3d
c Liên H54s1 [Ar]3d54s2 [Ar]3d64s2 [Ar]3d74s2
Thế điện cực chuẩn ( o E ) -0,912 -1,180 -0,440 -0,277 (V ) 2 M /M ng Kí H
a. Ở điều kiện chuẩn, ion H+ Đă ( o E
= 0,00V) chỉ oxi hóa được các kim loại Cr, Mn, Fe 2H /H2 TLOT Official: 0333800642
trong số các kim loại ở trên thành cation M2+.
b. Ở điều kiện chuẩn, kim loại manganese có thể khử được Fe2+(a) thành kim loại.
c. Trong phản ứng hóa học, khi nguyên tử Cr nhường đi 2 electron để tạo thành ion Cr2+,
thì số electron còn lại trên phân lớp 3d là 3.
d. Trong bảng tuần hoàn các nguyên tố hóa học, các kim loại chuyển tiếp trên được xếp ở chu kì 4.
NAP 7: Copper(II) hydroxide tan trong dung dịch NH3 tạo phức chất bát diện X có công thức
[Cu(NH3)n(OH2)2]2+. Phân tử khối của X bằng bao nhiêu?
Đáp số: ……………
NAP 8: Cho 5 giọt dung dịch CoCl� 0,5M vào ống nghiệm, sau đó nhỏ từng giọt dung dịch
KCN 0,5M cho đến khi dung dịch chuyển sang màu vàng. Phương trình hóa học của phản ứng xảy ra nhu sau:
[Co(H�O)�]��(𝑎𝑞) + 6CN�(𝑎𝑞) ⟶ [Co(CN)�]��(𝑎𝑞) + 6H�O(ℓ) Màu hồng Màu vàng
a. Nguyên tử Co nhận cặp electron hóa trị riếng từ 6 phối tử CN�, tạo thành phức chất có
công thức [Co(CN)�]��.
Thay đổi tư duy – Bứt phá thành công | 19
View Full: https://bit.ly/ComBoLuyenThiTHPTQG



