

Preview text:
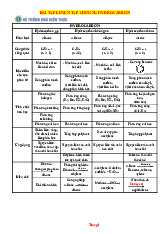
MA TRẬN THÀNH PHẦN CỦA NĂNG LỰC – CẤP ĐỘ TƯ DUY
ĐỀ THI CUỐI KÌ MÔN HOÁ- LỚP 11
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 16.
Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: HH.1.2 – Biết- Cân bằng hoá học
Trong các phát biểu sau đây, phát biểu nào đúng khi một hệ ở trạng thái cân bằng?
A. Phản ứng thuận đã dừng.
B. Phản ứng nghịch đã dừng.
C. Nồng độ chất tham gia và sản phẩm bằng nhau.
D. Nồng độ của các chất trong hệ không đổi.
Câu 2: HH.1.2 – Biết- Cân bằng hoá học
[NB] Mối quan hệ giữa tốc độ phản ứng thuận (vt) và tốc độ phản ứng nghịch (vn) ở trạng thái
cân bằng được biểu diễn như thế nào? A. vt = 2vn.
B. vt = vn 0.
C. vt = 0,5vn. D. vt = vn = 0.
Câu 3: HH.1.1- Biết – Cân bằng trong dung dịch nước
Công thức tính pH là A. pH = - log [H+]
B. pH = log [H+]
C. pH = +10 log [H+]
D. pH = - log [OH-]
Câu 4. HH.1.1- Biết –Nitrogen
Liên kết hoá học trong phân tử N2 là liên kết
A. cộng hoá trị phân cực. B. ion.
C. cộng hoá trị không phân cực. D. kim loại.
Câu 5: HH.1.2- Biết - Ammonia
Chất có thể dùng để làm khô khí NH3 là A. H2SO4 đặc. B. CaO. C. FeSO4 khan. D. P2O5.
Câu 6. HH.1.1- Biết – Sulfur
Hơi thủy ngân rất độc, do đó phải thu hồi thủy ngân (mercury) rơi vãi bằng cách
A. nhỏ nước bromide lên giọt thủy ngân. B. nhỏ nước ozon lên giọt thủy ngân.
C. rắc bột sulfur lên giọt thủy ngân. D. rắc bột phosphorus lên giọt thủy ngân.
Câu 7: HH.1.2- Biết-Sulfuric acid
Cách pha loãng H2SO4 đặc an toàn là
A. Rót nhanh acid vào nước và khuấy đều. B. Rót nhanh nước vào acid và khuấy đều.
C. Rót từ từ nước vào acid và khuấy đều. D. Rót từ từ acid vào nước và khuấy đều.
Câu 8. HH.1.6- Biết-Một số hợp chất của Nitrogen với oxygen
Phú dưỡng là hiện tượng xảy ra do sự gia tăng hàm lượng của nguyên tố nào trong nước? A. Fe, Mn. B. N, P. C. Ca, Mg. D. Cl, F.
Câu 9. HH.1.1- Biết- Sulffur và Sulfur dioxide
Khi núi lửa hoạt động có sinh ra khí sulfur dioxide gây ô nhiễm không khí. Công thức của sulfur dioxide là A. H2S. B. SO3. C. SO2. D. NO2.
Câu 10. HH.1.1- Biết- Sulfuric acid và muối sulfate
Muối X không tan trong nước và các dung môi hữu cơ. Trong y học, X thường được dùng làm
chất cản quang xét nghiệm X-quang đường tiêu hóa. Công thức của X là A. BaSO4 B. Na2SO4 C. K2SO4 D. MgSO4
Câu 11: HH.1.1- Biết- Hợp chất hữu cơ và Hoá học hữu cơ
Liên kết hoá học chủ yếu giữa các nguyên tử trong hợp chất hữu cơ là
A. liên kết hydrogen.
B. tương tác Van der waals. C. liên kết ion.
D. liên kết cộng hoá trị.
Câu 12. HH.1.1- Biết- Cấu tạo phân tử hợp chất hữu cơ
Trong những dãy chất sau đây, dãy nào có các chất là đồng phân của nhau? A. C2H5OH, CH3CHO
B. CH3 CH2CHO, CH3 COCH3
C. CH3CH2CH2OH, C2H5OH D. C4H10, C6H6
Câu 13. HH.1.1- Biết- Alkane
Ở điều kiện thường hydrocarbon nào sau đây ở thể lỏng? A. C4H10. B. C2H6. C. C3H8. D. C5H12.
Câu 14: HH.1.3- Hiểu- Cân bằng hoá học
Cho phản ứng thuận nghịch: CaCO3(s) ⇌ CaO(s) + CO2(g). Biểu thức tính hằng số cân bằng
(KC) của phản ứng này là
A. KC.= [CaO].[CO2] B. KC = [CaCO3] . [CaCO3] [CaO].[CO2] C. KC = [CaO].[CO2]. D. KC = [CO2].
Câu 15. HH.2.4- Vận dụng- Cân bằng trong dung dịch nước
Để xác định nồng độ của một dung dịch NaOH, người ta đã tiến hành chuẩn độ bằng dung dịch
HCl 0,1 M. Để chuẩn độ 10 mL dung dịch NaOH này cần 12 mL dung dịch HCl. Nồng độ của dung dịch NaOH trên là A. 0,1. B. 1,2. C. 0,12. D. 0,012.
Câu 16. HH.2.4- Vận dụng- Phương pháp tách biệt và tinh chế chất hữu cơ
Ngâm củ nghệ với ethanol nóng, sau đó lọc bỏ bã, lấy dung dịch đem cô để làm bay hơi bớt
dung môi. Phần dung dịch còn lại sau khi cô được làm lạnh, để yên một thời gian rồi lọc lấy
kết tủa curcumin màu vàng. Từ mô tả ở trên, hãy cho biết, người ta đã sử dụng các kĩ thuật tinh
chế nào để lấy được curcumin từ củ nghệ?
A. Chiết, chưng cất và kết tinh.
B. Chiết và kết tinh.
C. Chưng cất và kết tinh.
D. Chưng cất, kết tinh và sắc kí.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 3. Trong mỗi ý a), b),
c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.(Đ – S)
Câu 1: Cho sơ đồ điều chế sulfuric acid từ quặng pyrite theo 3 giai đoạn như sau: (1) (2) (3) FeS2 → SO2→ SO3→ H2SO4
a) HH.1.1-Biết-Sulfur và hợp chất của sulfur
Có thể thay thế quặng pyrite bằng khoáng vật sulfur.
b) HH.1.2- Hiểu- Sulfuric acid và muối sulfate
Ở giai đoạn 3 người ta dùng nước để hấp thụ SO3, sản phẩm thu được gọi là oleum.
c) HH.1.2- Vận dụng- Sulfuric acid và muối sulfate
Trong sơ đồ điều chế trên có 3 phản ứng thuộc loại phản ứng oxi hoá khử
d) HH.2.4- Vận dụng- Sulfuric acid và muối sulfate
Một loại quặng pyrite chứa 96% FeS2. Nếu mỗi ngày nhà máy sản xuất 100 tấn sulfuric
acid 98% thì cần 70,44 tấn quặng pyrite với hiệu suất của cả quá trình sản xuất H2SO4 là 90%.
Câu 2: Đốt cháy hoàn toàn chất A tạo thành CO2 và H2O.
a) HH.1.1- Biết- Hợp chất hữu cơ và Hoá học hữu cơ
Để nhận ra sự có mặt của H2O trong sản phẩm cháy người ta dẫn sản phẩm cháy qua ống chứa Cu(OH)2 khan.
b) HH.1.2-Hiểu- Hợp chất hữu cơ và Hoá học hữu cơ
Trong thành phần chất A chắc chắn có C, H và O.
c) HH.3.1- Vận dụng- Hợp chất hữu cơ và Hoá học hữ cơ
Trên phổ IR của A thấy có hấp thụ ở 1 720 cm−1 chứng tỏ trong phân tử chất A có thể
có nhóm chức carboxylic acid hoặc ester hoặc ketone hoặc aldehyde.
d) HH.3.1- Vận dụng-Lập công thức phân tử chất hữu cơ
Phân tử khối của A luôn là số chẵn.
Câu 3: Cho cân bằng hoá học sau: N +3H ⎯⎯ → ⎯ ⎯ 2NH H = − 91,8 kJ 2 (g) 2 (g) 3(g) r
a) HH.1.1- Biết- Cân bằng hoá học
Phản ứng trên là phản ứng thu nhiệt.
b) HH.1.2- Hiểu- Cân bằng hoá học
Khi phản ứng đạt đến trạng thái cân bằng, hỗn hợp chất có chứa N2, H2 và NH3.
c) HH.2.1-Vận dụng- Cân bằng hoá học
Cân bằng trên dịch chuyển theo chiều thuận khi tăng áp suất và giảm nhiệt độ.
d. HH.2.6-Vận dụng- Cân bằng hoá học
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp phản ứng sẽ tăng.
PHẦN III: Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 3.
Câu 1: HH.1.2- Hiểu- Ammonia và muối ammonium
Cho dung dịch NH3 lần lượt vào các dung dịch sau: Ca(OH)2, BaCl2, CH3COOH, Mg(NO3)2.
Có bao nhiêu trường hợp có phản ứng xảy ra ?
Câu 2: HH.1.2- Hiểu- Một số hợp chất của Nitrogen với oxygen
Cho sơ đồ chuyển hóa nitrogen trong khí quyển thành phân đạm: + + + + 2 O 2 O 2 O H2O N NO NO HNO NO− ⎯⎯⎯ → ⎯⎯⎯ → ⎯⎯⎯⎯ → → . 2 2 3 3
Số phản ứng thuộc loại oxi hóa – khử trong sơ đồ là bao nhiêu?
Câu 3- HH.3.1- Vận dụng- Ammonia
Hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X một thời gian trong
bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Tính hiệu
suất của phản ứng tổng hợp NH3.
ĐÁP ÁN - KIỂM TRA CUỐI HK 1 – HOÁ 11
(theo mẫu đề minh hoạ của Bộ 2025)
Phần I: Mỗi câu trả lời đúng được 0,25 điểm Câu Đáp án Câu Đáp án 1 D 9 C 2 B 10 A 3 A 11 D 4 C 12 B 5 B 13 D 6 C 14 D 7 D 15 C 8 B 16 B
Phần II: Điểm tối đa của 01 câu hỏi là 1 điểm
- Thí sinh chỉ lựa chọn chính xác 01 ý trong 1 câu hỏi được 0,1 điểm
- Thí sinh chỉ lựa chọn chính xác 02 ý trong 1 câu hỏi được 0,25 điểm
- Thí sinh chỉ lựa chọn chính xác 03 ý trong 1 câu hỏi được 0,5 điểm
- Thí sinh lựa chọn chính xác cả 04 ý trong 1 câu hỏi được 1 điểm Câu Lệnh hỏi Đáp án Câu Lệnh hỏi Đáp án (Đ/S) (Đ/S) 1 a Đ 3 a S b S b Đ c S c Đ d S d S 2 a Đ 4 b S c Đ d Đ
Phần III: Mỗi câu trả lời đúng được 1,0 điểm Câu Đáp án 1 2 2 3 3 25 Hướng dẫn giải câu 3 N a 28 5,2 a 5,2 1 2 7,2 = = H b 2 20,8 b 20,8 4 2
Chọn a =1 mol ; b =4 mol n = 5 mol X n M 2 X Y = =
n = 4,5 mol n − n = 2n = 0,5 mol Y X Y N2 phaûn öùng n M 1,8 Y X a b 0,25 h = .100% = 25% N2 1 3 1