





Preview text:
Axit nitric (HNO3) là gì? Tính chất hóa học và bài tập về Axit nitric
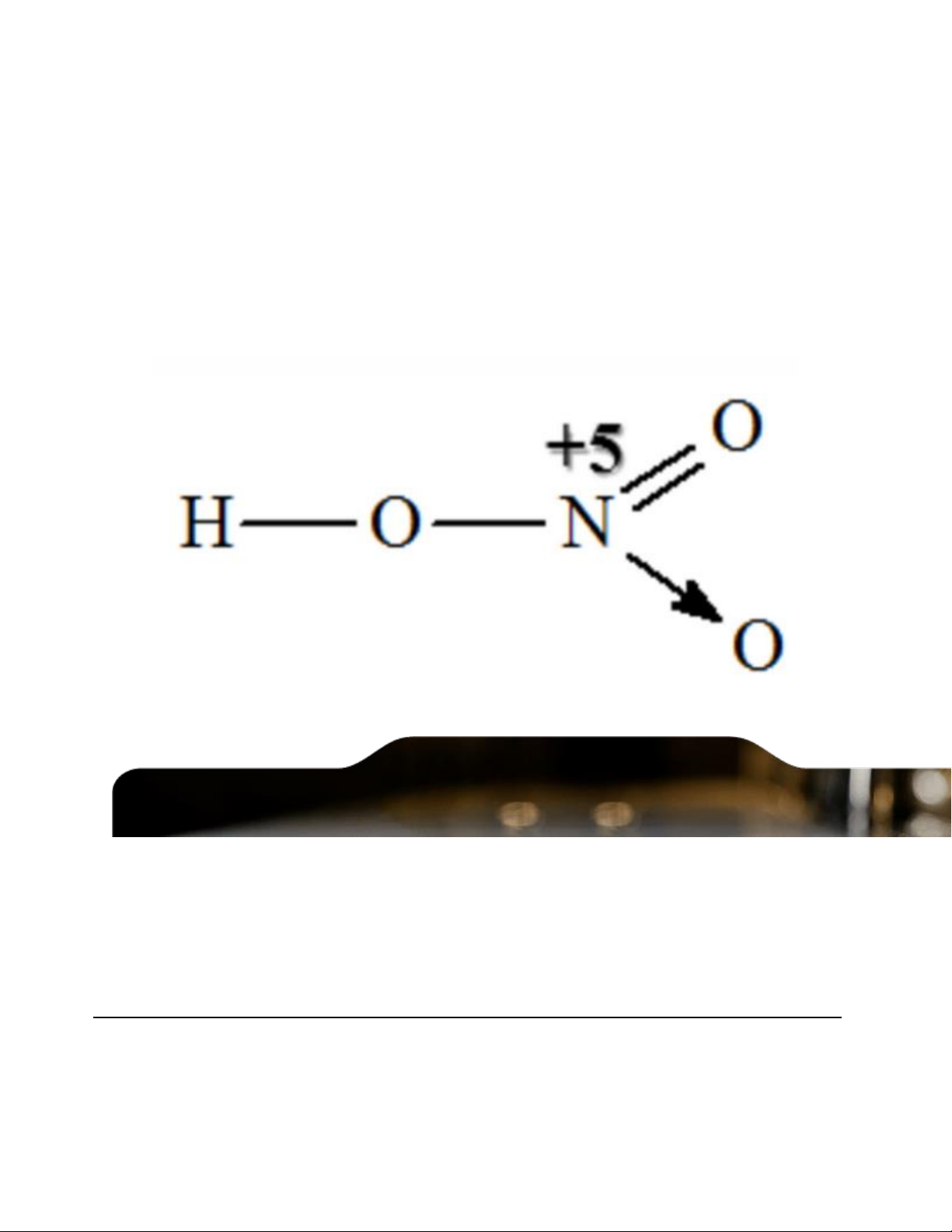
1. Axit nitric là gì? Cấu tạo phân tử HNO3
Axitr nitric (HNO3) là một hợp chất vô cơ có công thức hóa học là HNO3, được xem là một dung
dịch nitrat hidro hay còn gọi là axit nitric khan.
Axit nitric được hình thành trong tự nhiên, do sấm và sét trong những cơn mưa tạo thành. - Công thức cấu tạo:
Trong hợp chất HNO3, nguyên tố nito có số oxi hóa cao nhất là +5
2. Tính chất vật lí
- Chất lỏng không màu, bốc khói mạnh trong không khí ẩm
- HNO3 kém bền, điều kiện thường khi có ánh sáng, bị phân hủy một phần tạo khí NO2 => dung dịch màu vàng
- HNO3 tan trong nước theo bất kì tỉ lệ nào
3. Tính chất hóa học 3.1. Tính axit HNO3 → H+ + NO3- => Dung dịch HNO3 + Đỏ quỳ tím + Tác dụng với oxit bazo
CuO + 2HNO3 → Cu(NO3)2 + H2O + Tác dụng với bazo
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
+ Tác dụng với muối của axit yếu hơn
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O 3.2. Tính oxi hóa
HNO3 là một trong những axit có tính oxi hóa mạnh. Tùy thuộc vào nồng độ của axit và bản chất
của chất khử mà HNO3 có thể bị khử đến một số sản phẩm khác nhau của nito. a. Với kim loại
HNO3 oxi hóa được hầu hết kim loại lên số oxi hóa cao nhất (trừ Au và Pt)
Kim loại + HNO3 => muối nitrat + sản phẩm khử + H2O
- Với kim loại có tính khử yếu (Cu, Pb, Ag...) => NO2, NO
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O (nâu đỏ)
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O (khí hóa nâu ngoài không khí)
- Với kim loại có tính khử mạnh (Mg, Zn, Al,...)
8Al + 22HNO3 loãng → 8Al(NO3)2 + 3N2O + 11H2O
5Mg + 12HNO3 loãng → 5Mg(NO3)2 + N2 + 6H2O
4Zn + 10HNO3 loãng → 4Zn(NO3)2 + NH4NO3 + 3H2)
Chú ý: Al, Fe bị thụ động hóa trong dung dịch HNO3 đặc, nguội vì tạo nên một màng oxit bền
trên bề mặt các kim loại này, bảo vệ cho kim loại không tác dụng với HNO3 và những axit khác
mà trước đó chúng tác dụng dễ dàng. b. Với phi kim
Khi đun nóng, axit nitric đẵ có thể oxi hóa được nhiều phi kim như C, S, P...Khi đó, các phi kim
bị oxi hóa đến mức oxi hóa cao nhất, còn HNO3 bị khử đến NO2 hoặc NO tùy theo nồng độ của axit.
S + 6HNO3 đặc → H2SO4 + 6NO2 + 2H2O c. Với hợp chất
Khi đun nóng, HNO3 có thể oxi hóa được nhiều hợp chất như H2S, HI, SO2, FeO, muối sắt (II)...
3H2S + 2HNO3 loãng → 3S + 2NO + 4H2O
Nhiều chất hữu cơ bị phá hủy hoặc bốc cháy khi tiếp xúc với axit HNO3 đặc
4. Ứng dụng của axit nitric
HNO3 là một trong những hóa chất cơ bản quan trọng. Phần lớn axit HNO3 sản xuất trong công
nghiệp được dùng để điều chế phân đạm NH4NO3...Axit nitric HNO3 còn được dùng để sản xuất
thuốc nổ (ví dụ như TNT - trinitrotoluen), thuốc nhuộm, dược phẩm...
5. Câu hỏi ôn tập
Câu 1. Hóa trị và số oxi hóa của N trong phân tử HNO3 là? A. IV và +5 B. IV và +4 C. V và +5 D. IV và +3 Đáp án đúng là A
Câu 2. Xét phản ứng sau: FeO + HNO3 → X + NO + H2O
X và tổng hệ số cân bằng của sản phẩm là? A. Fe(NO3)2 và 18 B. Fe(NO3)3 và 9 C. Fe(NO3)3 và 6 D. Fe(NO3)3 và 22 Đáp án đúng là B
Câu 3. Nhiệt phân 23,5 gam muối Cu(NO3)2 đến khi phản ứng kết thúc thu được 12,7 gam
chất rắn và V lít khí ở điều kiện tiêu chuẩn. Tính hiệu suất phản ứng nhiệt phân muối và V? Hướng dẫn giải Phương trình phản ứng:
Cu(NO3)2 → CuO + 2NO2 + 1/2 O2 0,125 x x 2x 1/2 x 0,125-x x 2x 0,5 x
12,7 = mCu(NO3)2 + mCuO = 188 (0,125 - x) + 80x => x = 0,1
H phản ứng = 0,1/0,125 . 100% = 80% n Khí = 2,5 x = 0,25 => V khí = 5,6 lít
Câu 4. Nhúng thanh Al vào dung dịch HNO3 loãng, không thấy có khí thoát ra. Kết luận nào sau đây là đúng?
A. Al không phản ứng với dung dịch HNO3 loãng
B. Al bị thụ động hóa trong dung dịch HNO3 loãng
C. Al phản ứng với HNO3 tạo ra muối amoni D. Cả A và B đều đúng
Câu 5. Hiện tượng nào xảy ra khi cho mảnh đồng kim loại vào dung dịch HNO3 loãng?
A. không có hiện tượng gì
B. dung dịch có màu xanh, H2 bay ra
C. dung dịch có màu xanh, có khí màu nâu bay ra
D. dung dịch có màu xanh, có không khí màu bay ra, bị hóa nâu trong không khí
Câu 6. Hòa tan m gam Al vào dung dịch HNO3 loãng vừa đủ, thu được 17,92 lít (điều kiện
tiêu chuẩn) hỗn hợp khí X gồm N2O và N2 biết tỉ khối hơi của X so với H2 là 18 (không còn
sản phẩm khử nào khác) và dung dịch Y chứa a gam muối nitrat. Giá trị của m là? Hướng dẫn giải
MX = 18 . 2 = 36 => nN2O / NN2 = 1/1 => nN2 = nN2O = 0,4
nAl = (10nN2 + 8nN2O) / 3 = 2,4 mol m = 2,4 . 27 = 64,8 gam
Câu 7. Hòa tan hoàn toàn hỗn hợp X gồm (21,6 gam Ag và 32 gam Cu) trong HNO3 loãng
dư thu được V lít (điều kiện tiêu chuẩn) hỗn hợp khí Z gồm (NO2 va NO), biết tỉ khối hơi
của Z so với H2 là 21 (không còn sản phẩm khử nào khác) và dung dịch Y. Giá trị của V là? Hướng dẫn giải MX = 21 . 2 = 42 nN2O / nNO = 3 / 1 = 3x / x
=> 0,1 . 1 + 0,5 . 2 = 3x + 3x => x = 0,2
Vậy V = 0,2 . 4 . 22, 4 = 17 , 92 lít
Câu 8. Hòa tan hoàn toàn 2,32 gam hỗn hợp FeO và Fe2O3 vào dung dịch HNO3 đặc, dư thì
thu được 0,224 lít khí NO2 (điều kieenjt iêu chuẩn). Tính khối lwongjw muối Fe(NO3)3 tạo
thành sau phản ứng. Hướng dẫn giải nNO2 = 0,224/22,4 = 0,01 mol
Trong hỗn hợp chỉ có FeO phản ứng tạo thành chất khí Phương trình hóa học:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
Theo phương trình: nFeO = nNO2 = 0,01 mol
bảo toàn nguyên tố Fe: nFe9NO3)3 = nFeO + 2nFe2O3 = 0,03 mol
=> mFe(NO3)3 = 0,03 . 242 = 7,26 gam
Câu 9. Khi cho lá Al vào dung dịch HNO3 nguội thì? A. lá Al tan nhanh B. lá Al tan chậm
C. lá Al không tan, do Al là kim loại hoạt động kém
D. lá Al không tan do hình thành một lớp màng oxit bảo vệ
Câu 10. Cho các phát biểu sau: a. HNO3 là một axit mạnh
b. HNO3 là một axit có tính oxi hóa mạnh
c. HNO3 có thể hòa tan tất cả mọi kim loại
d. HNO3 là chất điện li mạnh
e. HNO3 tan vô hạn trong nước Số phát biểu sai là? A. 1 B. 2 C. 3 D. 4
Câu 11. Phản ứng nào sau đây không tạo ra muối sắt (III)?
A. Fe2O3 tác dụng với HCl
B. Fe(OH)3 tác dụng với H2SO4
C. Fe dư tác dụng với dung dịch HNO3 đặc, nóng
D. FeO tác dụng với dung dịch HNO3 loãng dư
Câu 12. Kim loại M có tinshc hất nhẹ, bền trong không khí ở nhiệt độ thường, tan được trong
dung dịch NaOH nhưng không tan được trong dung dịch HNO3 đặc nguội và H2SO4 đặc
nguội. Kim loại M là? A. Zn B. Fe C. Cr D. Al
Câu 13. Các kim loại Fe, Cr, Cu cùng tan trong dung dịch nào sau đây? A. dung dịch HCl
B. dung dịch HNO3 đặc nguội C. dung dịch HNO3 loãng
D. dung dịch H2SO4 đặc nguội
Câu 14. Hoa tan một oxit kim loại vào dung dịch H2SO4 lấy dư thu được dung dịch X. Cho
dung dịch NaNO3 vào dung dịch X thấy thoát ra khí không màu hóa nâu ngoài không khí.
Công thức của oxit kim loại là? A. MgO B. CuO C. Fe3O4 D. Fe2O3
Câu 15. Phát biểu nào sau đây là đúng?
A. hỗn hợp FeS và CS tan được hết trong dung dịch HCl dư
B. thổi không khí qua than nung đỏ, thu được khí than ướt
C. photpho đỏ dễ bốc cháy trong không khí ở điều kiện thương
D. dung dịch hỗn hợp HCl và KNO3 hòa tan được bột đồng
Câu 16. Phát biểu nào sau đây không đúng?
A. trong công nghiệp, kim loại Al được điều chế bằng phương pháp điện phân AL2O3 nóng chảy
B. Al(OH)3 phản ứng được với dung dịch HCl và dung dịch KOH
C. Kim loại Al tan được trong dung dịch HNO3 đặc nguội
D. Trong các phản ứng hóa học, kim loại Al chỉ đóng vai trò là chất khử




