










Preview text:
lOMoAR cPSD| 58490434 lOMoAR cPSD| 58490434 Thành viên nhóm 4
Võ Thị Thu Hằng MSSV 23105005
Lê Anh Hoàng Linh MSSV 23 Võ Thị Kim Huệ
Nguyễn Thị Hồng Thắm lOMoAR cPSD| 58490434 MỤC LỤC
Chương 1. ĐẠI CƯƠNG VỀ HÓA HỌC HỮU CƠ...................................1 1.1. ĐẶC ĐIỂM CẤU
TẠO CỦA CARBON......................................2
1.2. LIÊN KẾT CỘNG HÓA TRỊ TRONG HỢP CHẤT HỮU CƠ.............4
1.3. ĐỒNG PHÂN.......................................................................6
1.4. CÁC HIỆU ỨNG CHUYỂN DỊCH ELECTRON..............................8 1.5. CƠ CHẾ CÁC LOẠI
PHẢN ỨNG TRONG HỢP CHẤT HỮU CƠ...11
Chương 2. ALKANE......................................................................17
2.1. ĐỊNH NGHĨA – PHÂN LOẠI..................................................18
2.2. TÍNH CHẤT HÓA HỌC........................................................18
2.3. ĐIỀU CHẾ.........................................................................19
CHƯƠNG 3. CÁC HỢP CHẤT ALKENE, ALKYNE, ALKADIENE.........21
3.1. ĐỊNH NGHĨA – PHÂN LOẠI-PHẢN ỨNG HÓA HỌC..................22
3.2. ĐIỀU CHẾ.........................................................................27 CHƯƠNG 4. CÁC HỢP
CHẤT HYDROCARBON THƠM..........................29
4.1. ĐỊNH NGHĨA – PHÂN LOẠI..................................................30
4.2. PHẢN ỨNG HÓA HỌC.........................................................30
4.3. ĐIỀU CHẾ.........................................................................32 Chương 5. DẪN XUẤT
HALOGEN....................................................33
5.1. ĐỊNH NGHĨA – PHÂN LOẠI..................................................34
5.2. TÍNH CHẤT HÓA HỌC........................................................34
5.3. ĐIỀU CHẾ.........................................................................36 Chương 6. ALCOHOL –
PHENOL – ETHER.........................................39
6.1. ĐỊNH NGHĨA, PHÂN LOẠI ALCOHOL , PHENOL....................40
6.2. TÍNH CHẤT HÓA HỌC........................................................40
6.3. ĐIỀU CHẾ.........................................................................42
6.4. ETHER..............................................................................43 Chương 7. HỢP CHẤT
CARBONYL..................................................45
7.1. ĐỊNH NGHĨA, PHÂN LOẠI...................................................46
7.2. TÍNH CHẤT HOÁ HỌC........................................................46
7.3. ĐIỀU CHẾ.........................................................................48 Chương 8. HỢP CHẤT
CARBOXYL...................................................50
8.1. ĐỊNH NGHĨA, PHÂN LOẠI...................................................51 lOMoAR cPSD| 58490434
8.2. TÍNH CHẤT HÓA HỌC CỦA ACID ĐƠN CHỨC........................51
8.3. TÍNH CHẤT HÓA HỌC CỦA ACID HAI CHỨC..........................53
8.4. ĐIỀU CHẾ.........................................................................53
8.5. DẪN XUẤT CỦA ACID CARBOXYLIC – ESTER........................54 Chương 9.AMINE -
AMINO ACID-PEPTID...........................................57
9.1. HỢP CHẤT AMINE.............................................................58
9.2. AMINO ACID.....................................................................60
9.3. HỢP CHẤT AMINE.............................................................62
TÀI LIỆU THAM KHẢO..................................................................65 lOMoAR cPSD| 58490434 CHƯƠNG 5: DẪN XUẤT HALOGEN MMMMMMMMMMMMMMMMMMMMM MMMMMM
Mục Tiêu Kiến thức:
– Hiểu rõ đặc điểm cấu tạo của các dẫn xuấthalogen.
– Nắm được các tính chất hóa học cơ bản.
– Hiểu phản ứng thế và phản ứng tách đồng thờixác định các
loại cơ chế phản ứng xảy ra.
– Trình bày cách điều chế các dẫn xuất halogenquan trọng. Kỹ năng
– Viết các công thức cấu tạo và gọi tên các đồngphân có thể có.
– Xác định cơ chế phản ứng xảy ra
– Giải thích các phản ứng đặc trưng cho loại hợpchất và lấy ví dụ minh họa Thái độ
–Hiểu được vai trò của các dẫn xuất halogen trong tổng hợp hữu cơ và trong thực tế. lOMoAR cPSD| 58490434
I. ĐỊNH NGHĨA – PHÂN LOẠI -
Khi thay thế một hay nhiều nguyên tử hydrogentrong phân tử
hydrocarbon bằng các nguyên tử halogen (F, Cl, Br, I ) ta được các
dẫn xuất halogen (oorgano halide). -
Dựa vào đặc điểm cấu tạo phân tử, có thể chia dẫnhalogen
thành nhiều loại khác nhau:
– Theo cấu tạo nhóm hydrocarbon có thể chia thành:
+ Dẫn xuất halogen no (nguyên tử halogen liên kết với nhóm no
mạch hở hay gắn với nhóm no mạch vòng)
Và dẫn xuất halogen không no (nguyên tử halogen liên kết với nhóm không no)
+ Dẫn xuất halogen thơm (nguyên tử halogen gắn với nhóm thơm)
– Theo số lượng nguyên tử halogen, có dẫn xuất:
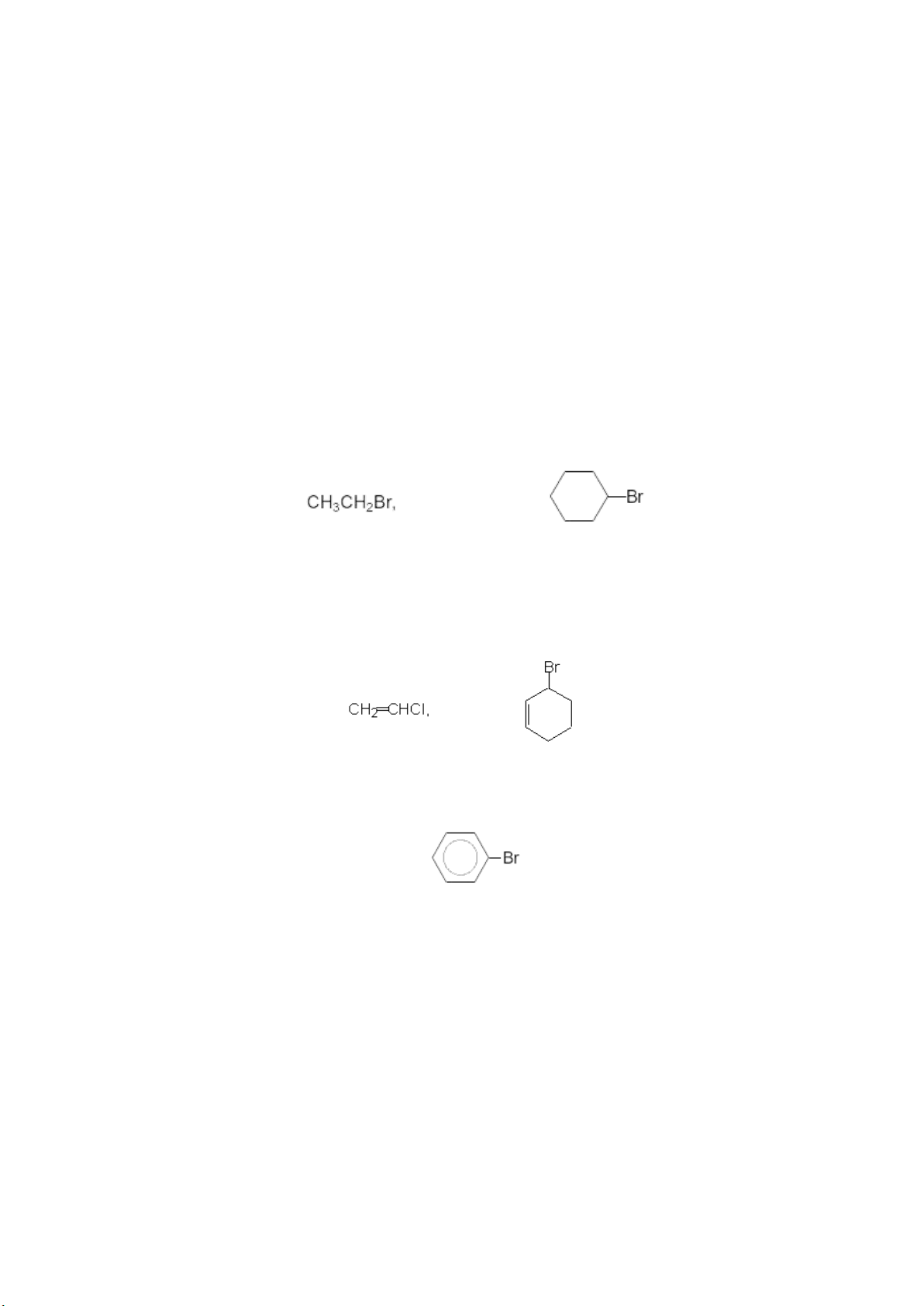
+ Monohalogen: CH3Br, CH3CH2Cl
+ Dẫn xuất dihalogen: CH2Cl2, ClCH2CH2Cl
+ Dẫn xuất polyhalogen: CHCl3, ClCH2CH(Cl)CH2Cl
– Theo bậc của nguyên tử carbon liên kết vớihalogen lOMoAR cPSD| 58490434
Dẫn xuất bậc I(10) Dẫn xuất bậc II(20) Dẫn xuất bậc III (30) II.Tính Chất Hóa Học
–Trung tâm phản ứng của các dẫn xuất hologen là liên kết C-X.
Do độ âm điện của halogen lớn hơn carbon nên liên kết C-X là
liên kết cộng hgóa trị phân cực. Mặt khác, khả năng phản ứng
của các halogen còn phụ thuộc vào đặc điểm của nhóm
hydrocarbon liên kết với halogen. Do đó người ta chia dẫn xuất halogen thành 3 loại: –
Loại có khả năng phản ứng kém gồm các alkenyl halide và
aryl halide, trong đó halogen nối trực tiếp với carbon lai hóa sp2 –
Loại có khả năng phản ứng trung bình gồm có alkylhalide và cycloalkyl halide. –
Loại có khả năng phản ứng cao bao gồm các dẫn xuất
halogen, trong đó nguyên tử halogen đính với nguyên tử carbon
ở bên cạnh carbon nối đôi, hoặc với nguyên tử carbon ở bên cạnh nhân thơm. –
Những phản ứng đặc trưng và quan trọng của dẫnxuất halogen
là phản ứng thế nucleophile, phản ứng tách hydro halidevà
phản ứng kim loại. Ngoài ra, dẫn xuất halogen còn có thể tham
gia phản ứng ở nhóm hydrocarbon (thế nhân thơm, cộng vào lOMoAR cPSD| 58490434 liên kết bội,..)
1. Phản ứng thế nucleophile
a. Phản ứng của dẫn xuất alkyl halogenua
–Phản ứng thế nguyên tử halogen xảy ra chủ yếu theo cơ chế thế nucleophile (SN). Ví dụ: CH3Cl + KOH CH3OH + KCl
CH3CH2Cl + CH3ONa CH3CH2–O–CH3 + NaCl
+ Khả năng phản ứng xảy ra phụ thuộc vào cấu trúc của dẫn xuất
halogen (cấu trúc của nhóm hydrocarbon R)
– Cơ chế SN2: CH3 > dẫn xuất 10 > dẫn xuất 20 > dẫn xuất 30
– Cơ chế SN1: dẫn xuất 10 < dẫn xuất 20 < dẫn xuất 30
+ Phụ thuộc vào khả năng bị thay thế của nguyên tử halogen: I- > Br- > Cl- > F-
+ Phụ thuộc vào tác nhân nucleophile (mật độ electron của tác nhân nucleophile)
RS−>I− > −C N > CH3O− > OH− > Br− > NH3 > Cl− > F− > CH3OH
+ Phụ thuộc vào dung môi: Dung môi phân cực có khả năng solvate
hoá trạng thái chuyển tiếp là carbocation mang điện tích dương,
do vậy thuận lợi cho phản ứng SN1. Ngược lại, dung môi kém phân
cực sẽ thuận lợi cho phản ứng SN2. lOMoAR cPSD| 58490434
b. Phản ứng của dẫn xuất benzyl và allyl halide– Các dẫn xuất
benzyl và allyl halide, giống như các dẫn xuất alkyl halide khác, có
tham gia phản ứng thế SN2. Mặt khác, các
dẫn xuất loại này cũng dễ dàng tham gia phản ứng thế SN1 do
carbocation trung gian được liên hợp với hệ thống electron
(của liên kết bội hoặc vòng thơm). c.
Phản ứng của dẫn xuất vinyl và aryl halide– Các dẫn xuất
vinyl và aryl halide không thể tham gia phản ứng thế SN2 vì hệ
thống electron của liên kết đôi hoặc/ và vòng thơm ngăn cản tác
nhân nucleophile tấn công từ phía sau nguyên tử carbon.
Cũng không phản ứng theo cơ chế SN1 vì carbocation sinh ra không bền. 2. Phản ứng tách HX
– Khi đun nóng dẫn xuất halogen với dung dịch kiềm trong alcohol
xẽ xảy ra phản ứng tách hydro halide để tạo thành hydrocarbon không no. Ví dụ : lOMoAR cPSD| 58490434
Hướng chính của các phản ứng tách tuân theo quy tắc Zaitsev. Sản phẩm chính
3. Phản ứng với kim loại
– Dẫn xuất halogen phản ứng với kim loại trong môi trường ether
khan sẽ cho hợp chất cơ- kim.
–Với Mg: Phản ứng có ý nghĩa quan trọng nhất của dẫn xuất
halogen là tác dụng với magnesi kim loại cho hợp chất cơ magnesi, RMgX. Với Na : III. ĐIỀU CHẾ
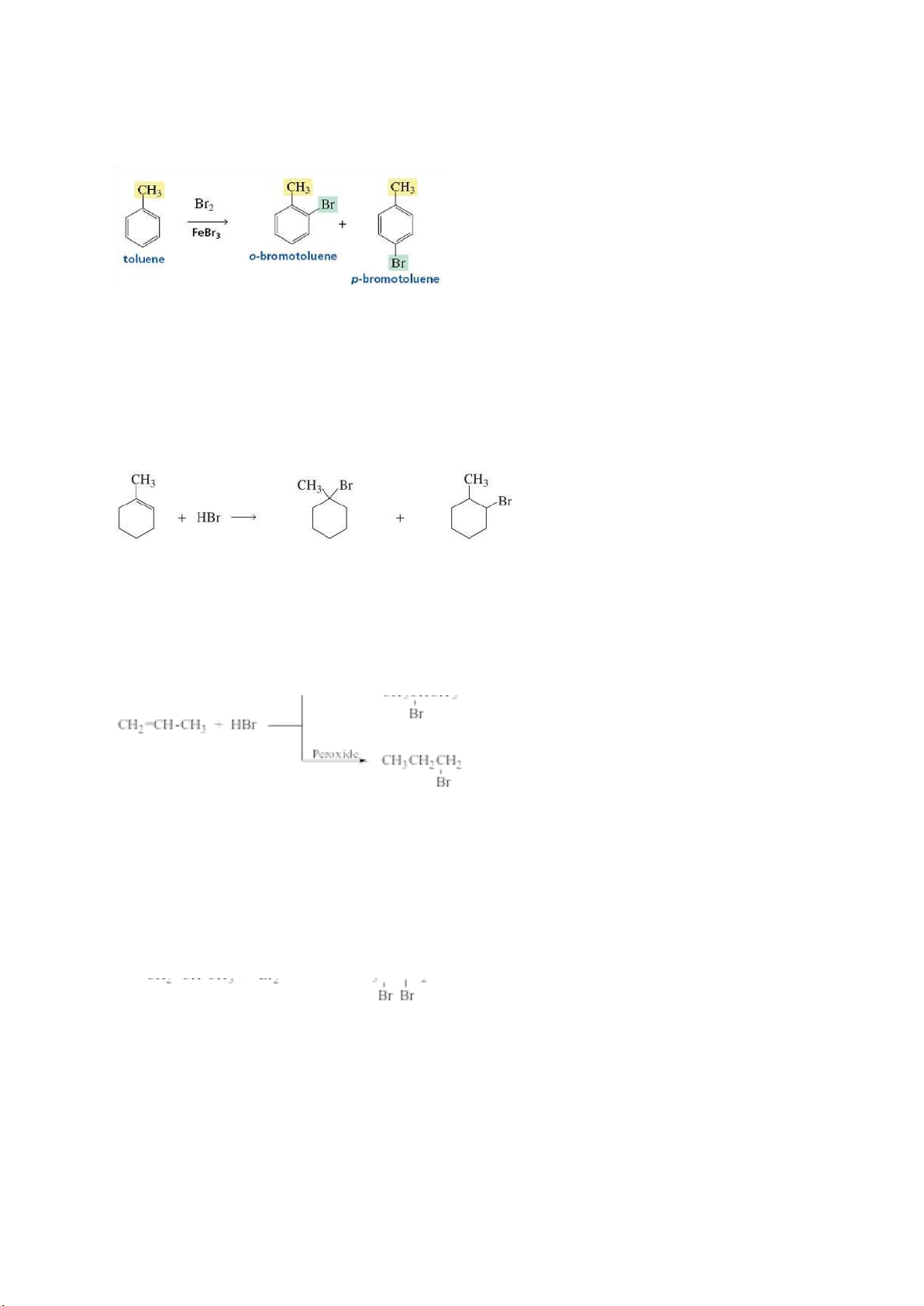
1. Phản ứng halogen trực tiếp hydrocarbon –
Nếu có ánh sáng, thì phản ứng halogen hóa arenesẽ xảy ra theo
cơ chế gốc tự do và phản ứng thế xảy ra ở nhánh alkyl. lOMoAR cPSD| 58490434 –
Nếu dùng xúc tác là acid Lewis (AlCl3, SnCl4, ZnCl2, FeCl3….)
trong phản ứng halogen hóa arene, thì các halogen sẽ thế các
nguyên tử hydrogen trên vòng benzene. 2.
Cộng HX vào hydrocarbon không no –
Khi dùng tác nhân HX ( HCl, HBr, HI ) tác dụng vớialkene, phản
ứng xảy ra theo cơ chế AE và theo quy tắc Markovnikov. –
Riêng với HBr, khi có mặt peroxide thì xảy ra ngượcquy tắc
Markovnikov (Hiệu ứng Kharash).
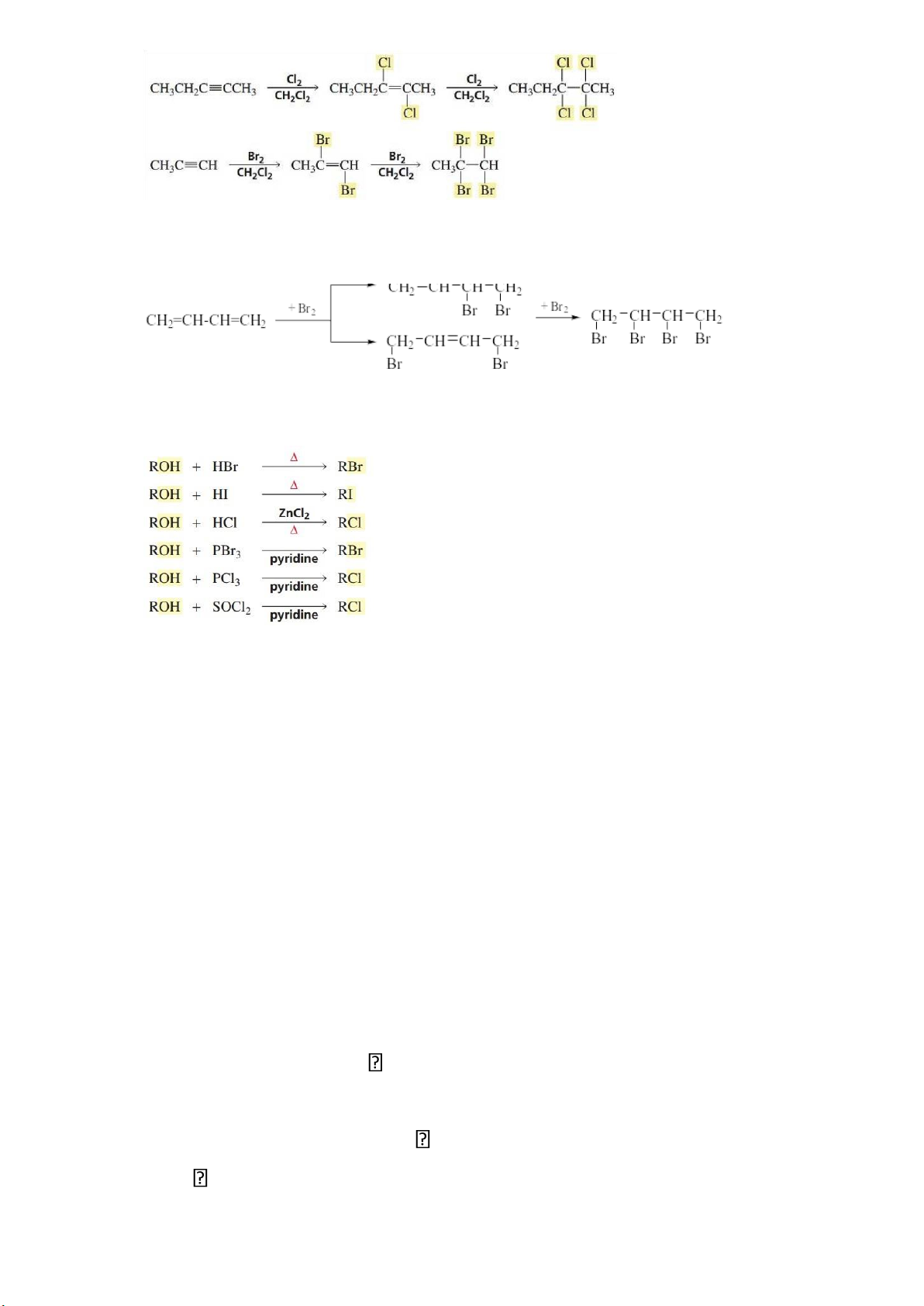
3. Phản ứng cộng X2 vào hydrocarbon không no
– Cộng phân tử halogen X2 ( Cl2, Br2 ) vào alkene cho dẫn xuất dihalogen.
– Alkyne và alkadiene có thể cộng hai phân tử halogen cho dẫn xuất tetrahalogen: lOMoAR cPSD| 58490434
– Với alkadiene liên hợp :
4. Phản ứng thế nhóm –OH của alcohol bằng halogen
CÂU HỎI VÀ BÀI TẬP VẬN DỤNG
Bài 1: Vẽ cấu tạo của các hợp chất có tên sau a. 1,2-dichlorobutane d. 1,2- dichlorobuta-2,3-diene
b. 3-chloro-2-methylbuatane e. vinyl floride c.
4-bromo-2-methylbutane f. isopentyl chloride
Bài 2: Vẽ cấu tạo và gọi tên các đồng phân có công thức phân tử
C4H8Br2. Trong đó công thức nào có đồng phân lập thể, đánh dấu
vào nguyên tử carbon không đối xứng.
Bài 3: Viết phương trình các phản ứng sau và cho biết cơ chế của từng phản ứng: a. C2H0 5Br + NaCN b. (CH3)3C-Br + H2O t→ c. CH3CH2CH2Br + NH3 d. CH3CH2CH2Br + NaI lOMoAR cPSD| 58490434
e. p-CH3C6H4CH2Br + H2O
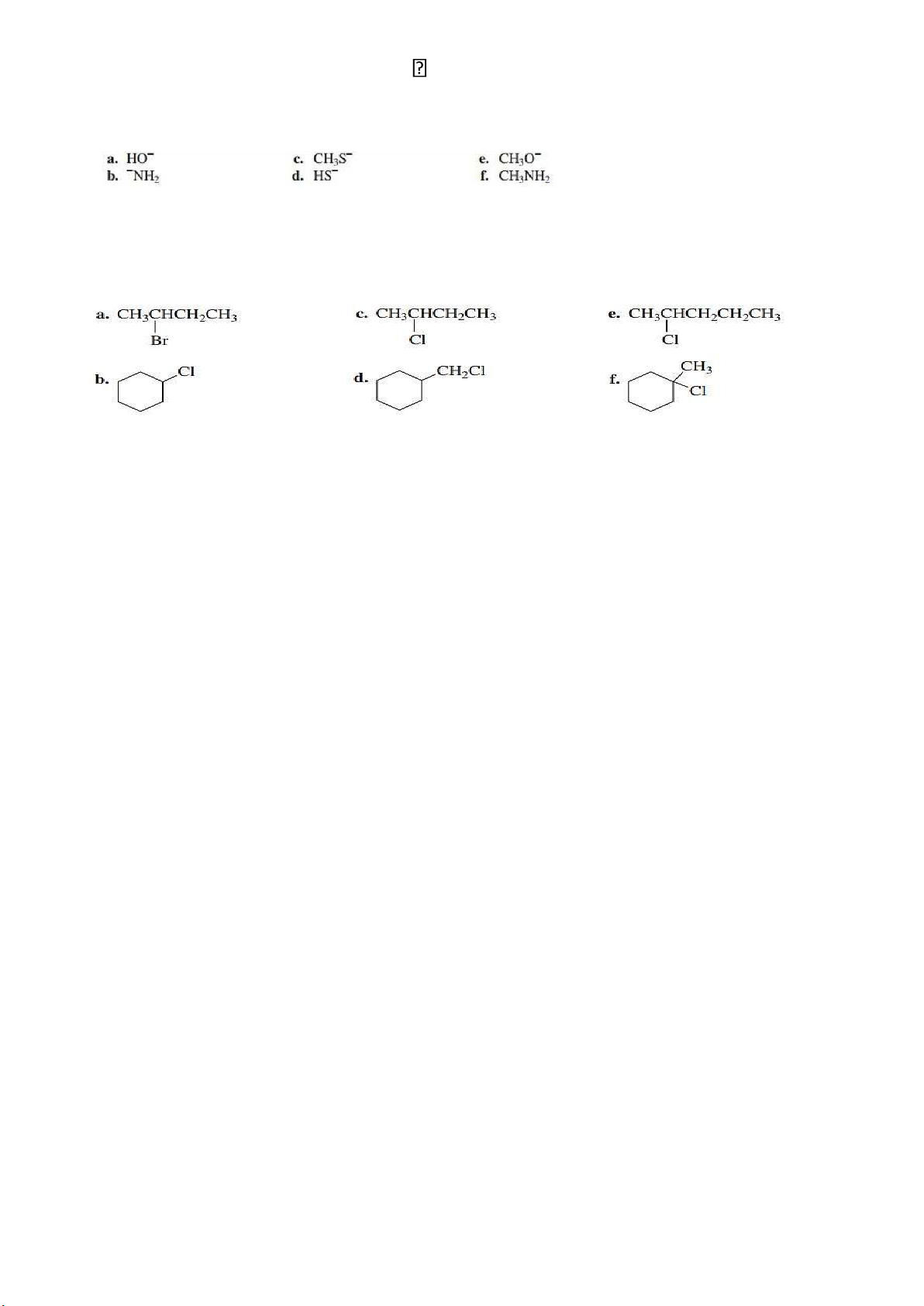
Bài 4: Xác định sản phẩm khi cho 1-bromopropane phản ứng lần
lượt với các tác nhân nucleophile sau:
Bài 5: Thực hiện phản ứng tách E2 các chất sau, xác định sản phẩm chính thu được lOMoAR cPSD| 58490434




