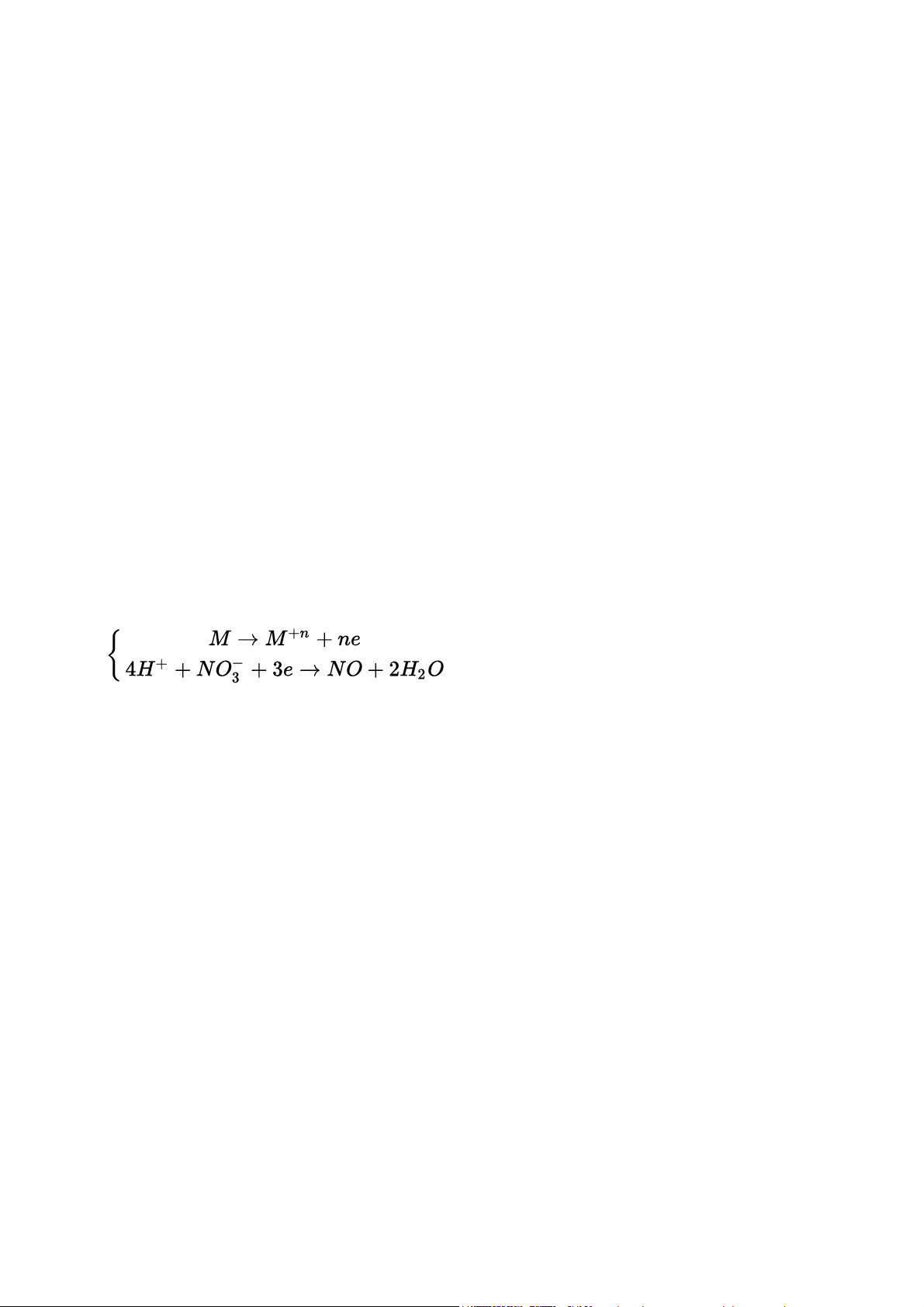




Preview text:
Bài tập Axit nitric và muối nitrat
1. Nguyên lý giải bài tập Axit nitric và muối nitrat Mo → Mn+ + ne N+5 + (5 – x)e → M+x Đặc biệt
Nếu phản ứng tạo ra nhiều sản phẩm khử của N thì ne nhường = ∑ne nhận
Nếu có nhiều chất khử tham gia phản ứng ∑ne nhường = ne nhận
Trong một số trường hợp cần kết hợp với định luật bảo toàn điện tích (tổng điện tích
dương = tổng điện tích âm) và định luật bảo toàn nguyên tố
Có thể sử dụng phương trình ion – electron hoặc các bán phản ứng để biểu diễn các quá trình.
+ Đặc biệt trong trường hợp kim loại tác dụng với axit HNO3 ta có:
nHNO3 (pư) = 2nNO2 = 4nNO = 10nN2O = 12nN2 = 10nNH4NO3
nNO3-(trong muối) = nNO2 = 3nNO = 8nN2O = 10nN2 = 8nNH4NO3
Nếu hỗn hợp gồm cả kim loại và oxit kim loại phản ứng với HNO3 (và giả sử tạo ra khí NO) thì:
nHNO3 (pư) = 4nNO + 2nO (trong oxit KL)
2. Bài tập luyện tập Axit nitric và muối nitrat
Bài 1: Nhiệt phân hoàn toàn 18 gam một muối nitrat của của một kim loại M (trong chân không). Sau khi
phản ứng kết thúc thu được 8 gam chất rắn. Tìm kim loại M và thể tích khí đo (đktc).
Bài 2: Nhiệt phân 26,1 gam một muối nitrat của của một kim loại M (trong chân không). Sau khi phản ứng
kết thúc thu được 20,7 gam chất rắn. Tìm kim loại M và thể tích khí đo (đktc). Biết
hiệu suất phản ứng đạt 50%.
Bài 3: Nhiệt phân (trong chân không) hoàn toàn 35,3 gam hỗn hợp 2 muối nitrat của
của 2 kim loại hóa trị 2 (không đổi). Sau khi phản ứng kết thúc thu được 0,5 mol khí,
và hỗn hợp rắn. Dẫn luồng khí H2 (dư) qua hỗn hợp rắn sau phản ứng thì thấy lượng
H2 phản ứng là 0,1 mol, và còn lại 12,1 gam chất rắn. Xác định 2 kim loại.
Bài 4: Nhiệt phân (trong chân không) hoàn toàn 35,3 gam hỗn hợp 2 muối nitrat của
của 2 kim loại hóa trị 2 (không đổi). Sau khi phản ứng kết thúc thu được 0,3 mol khí,
và hỗn hợp rắn. Dẫn luồng khí H2 (dư) qua hỗn hợp rắn sau phản ứng thì thấy lượng
H2 phản ứng là 0,1 mol, và còn lại 19,7 gam chất rắn. Xác định 2 kim loại.
Bài 5: Nhiệt phân hoàn toàn 34,4 gam hỗn hợp 2 muối nitrat của của 2 kim loại hóa trị
2 (trong chân không). Sau khi phản ứng kết thúc thu được 0,475 mol khí, và hỗn hợp
rắn. Dẫn luồng khí H2 (dư) qua hỗn hợp rắn sau phản ứng thì thấy lượng H2 phản
ứng là 0,15 mol, và còn lại 11,2 gam chất rắn. Xác định 2 kim loại.
Bài 6: Hỗn hợp A gồm ba oxit sắt (FeO, Fe3O4, Fe2O3) có số mol bằng nhau. Hòa tan
hết m gam hỗn hợp A này bằng dung dịch HNO3 thì thu được hỗn hợp K gồm hai khí
NO2 và NO có thể tích 1,12 lít (đktc) và tỉ khối hỗn hợp K so với hiđro bằng 19,8. Tính giá trị m?
Bài 7: Đem nung hỗn hợp A gồm: x mol Fe và 0,15 mol Cu, trong không khí một thời
gian, thu được 63,2 gam hỗn hợp B, gồm hai kim loại trên và hỗn hợp các oxit của
chúng. Đem hòa tan hết lượng hỗn hợp B trên bằng dung dịch HNO3 đậm đặc, thì thu
được 0,6 mol NO2. Trị số của x là:
Bài 8: Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 phản ứng hết với dung
dịch HNO3 loãng dư thu được 1,344 lit khí NO (đktc), là sản phẩm khử duy nhất và
dung dịch X. Dung dịch X có thể hòa tan tối đa 12,88 gam Fe. Số mol HNO3 trong
dung dịch đầu là bao nhiêu?
Bài 9: Nung m gam bột Cu trong oxi thu được 37,6 gam hỗn hợp rắn X gồm Cu, CuO
và Cu2O. Hòa tan hoàn toàn X trong dung dịch HNO3 đặc, nóng (dư) thấy thoát ra
6,72 lít khí (ở đktc). Giá trị của m là bao nhiêu?
Bài 10: Cho hỗn hợp gồm 6,96 gam Fe3O4 và 6,40 gam Cu vào 300 ml dung dịch
HNO3 CM (mol/l). Sau khi các phản ứng kết thúc thu được dung dịch X và còn lại 1,60
gam Cu. Giá trị CM là bao nhiêu?
3. Bài tập Axit nitric và muối nitrat có đáp án
Bài tập 1. Hoà tan hoàn toàn m g bột Cu trong 800 g dung dịch HNO3 được dung dịch
Y và 2,24 lít khí NO (đktc). Y tác dụng vừa đủ với 300 ml dung dịch NaOH 2M được
kết tủa R. Sau khi nung R đến khối lượng không đổi thu được 20 g chất rắn.
a. Tính khối lượng Cu ban đầu.
b. Tính khối lượng các chất trong Y và nồng độ % của dung dịch HNO3 đã dùng Hướng dẫn giải
nNO = 2,24/22,4 = 0,1 mol; nNaOH = 0,3.0,2 = 0,06 mol
a. Khi cho Y tác dụng với dung dịch NaOH thu được kết tủa R chỉ chứa Cu(OH)2.
Chất rắn thu được khi nung là CuO
nCuO = 20/80 = 0,25 mol => nCu(OH)2 = nCuO = 0,25 mol.
Theo định luật bảo toàn nguyên tố:
nCu (ban đầu) = nCu (trong CuO) = 0,25 mol => mCu = 0,25.64 = 16 g b. Trong X, n 2+ Cu
= nCu(OH)2 = 0,25 mol => mCu(NO3)2 = 188.0,25 = 47 g Cu → Cu2+ + 2e 0,25 0,5 mol Mà: N+5 + 3e → N+2 0,3 0,1 mol
Vậy chứng tỏ phản ứng của Cu và HNO3 phải tạo ra NH4NO3.
ne (Cu nhường) = ∑ne nhận = 0,5 mol => ne nhận = 0,5 – 0,3 = 0,2 mol N+5 + 8e → N-3 0,2 0,025 mol
nNH4NO3 = 0,025 mol => m NH4NO3 = 80.0,025 = 2 g
Theo định luật bảo toàn nguyên tố:
nHNO3 pư = nN (trongCu(NO3)2 ) + nN (trong NO) + nN (trong NH4NO3 )
= 2nCu(NO3)2 + nNO + 2nNH4NO3 = 0,65 mol
Bài tập 2. Hòa tan hoàn toàn 3,76 gam hỗn hợp H gồm: S, FeS, FeS2 trong HNO3 dư
được 0,48 mol NO2 và dung dịch X. Cho dung dịch Ba(OH)2 dư vào X, lọc kết tủa
nung đến khối lượng không đổi thì khối lượng chất rắn thu được là: Hướng dẫn giải
Gọi x, y lần lượt là tổng số mol Fe và S trong hỗn hợp (cũng có thể coi x, y là số mol
Fe và S đã tham gia phản ứng với nhau tạo ra hỗn hợp trên) Ta có: 56x + 32y = 3,76
Mặt khác: ne (cho) = 3x + 6y = 0,48 = ne (nhận) (vì hỗn hợp H bị oxi hóa tạo muối Fe3+ và H2SO4)
Từ đó có: x = 0,03; y = 0,065
Khi thêm Ba(OH)2 dư kết tủa thu được có: Fe(OH)3 (0,03 mol) và BaSO4 (0,065 mol).
Sau khi nung chất rắn có: Fe2O3 (0,015 mol) và BaSO4 (0,065 mol).
mchất rắn = 160.0,015 + 233.0,065 = 17,545 (gam)
Bài tập 3. Cho 61,2 gam hỗn hợp X gồm Cu và Fe3O4 tác dụng với dung dịch HNO3
loãng, đun nóng và khuấy đều. Sau khi các phản ứng xảy ra hoàn toàn, thu được 3,36
lít khí NO (sản phẩm khử duy nhất, ở đktc), dung dịch Y và còn lại 2,4 gam kim loại.
Cô cạn dung dịch Y, thu được m gam muối khan. Xác định giá trị của m? Hướng dẫn giải nNO = 0,15 (mol)
Gọi a là số mol Cu trong X đã phản ứng. Gọi b là số mol Fe3O4 trong X
Ta có: 64a + 232b = 61,2 – 2,4
Các nguyên tố Cu, Fe, O trong hỗn hợp X khi phản ứng với HNO3 chuyển thành muối
Cu2+, Fe2+ (vì dư kim loại), H2O do đó theo bảo toàn e: 2a + 2.3b – 2.4b = 3.0,15 Từ đó: a = 0,375; b = 0,15
Muối khan gồm có: Cu(NO3)2 (a = 0,375 mol) và Fe(NO3)2 (3b = 0,45 mol)
mmuối = 188.0,375 + 180.0,45 = 151,5 (gam)
Bài tập 4. Nung nóng 66,2 gam Pb(NO3)2 thu được 55,4 gam chất rắn.
a. Tính hiệu suất của phản ứng phân hủy.
b. Tính thể tích các khí thoát ra (đkc) và tỷ khối của hỗn hợp khí so với không khí. Hướng dẫn giải Phương trình phản ứng
Pb(NO3)2 → PbO + 2NO2 + 1/2 O2 x 2x 1/2x mol
mNO2 + mO2 = 46.2x + 32.0,5x = 66,2 – 55,4 ⇒ x = 0,1 mol
a. Khối lượng của Pb(NO3)2 phản ứng là: mPb(NO3)2 = 0,1.331 = 33,1 gam
Hiệu suất phản ứng thủy phân là: H = 33,1/66,2.100% = 50%
b. Thể tích khí thoát ra: V = (0,1.2 + 0,1/2).22,4 = 5,6 lít
Mtb = (0,2.46 + 0,05.32)/0,25 = 43,2 gam ⇒ dhh/kk = 43,2/29 = 1,49
Bài tập 5. Khi nhiệt phân hoàn toàn muối nitrat của kim loại hóa trị 1 thu được 32,4
gam kim loại và 10,08 lít khí (đktc). Xác định công thức và tính khối lượng muối ban đầu. Hướng dẫn giải
Gọi kim loại cần tìm là M ⇒ muối nitrat là: MNO3 MNO3 → M + NO2 + 1/2 O2 x x x x/2
x + x/2 = 1,5x = 10,08/22,4 = 0,45 ⇒ x = 0,3
M = 32,4/0,3 = 108 ⇒ M là Ag
m = 67,3 – (0,8.46 + 0,2.32) = 24,1 gam




