

Preview text:
BÀI TẬP CHƯƠNG 5
Câu 1: Tính sai số chỉ thị mắc phải khi chuẩn độ dung dịch HCl 0,1N bằng dung dịch NaOH
0,1N trong 2 trường hợp: (Chất chỉ thị được thêm vào trước trong dung dịch axit cần chuẩn độ)
a. Sử dụng chất chỉ thị là Metyl da cam.
b. Sử dụng chất chỉ thị là Phenoltalein.
Câu 2: Xác định các công thức biểu diễn mối quan hệ giữa pH với thể tích (V) của dung dịch
chuẩn thêm vào khi xây dựng đường cong chuẩn độ của (a) Chuẩn độ đơn axit mạnh (Co,Vo)
bằng đơn bazơ mạnh (C, V), (b) Chuẩn độ đơn bazơ mạnh (Co,Vo) bằng đơn axit mạnh (C, V) và
các giá trị mức độ định phân F ở 4 giai đoạn: - Truóc khi chuẩn độ.
- Trước điểm tương đương.
- Tại điểm tương đương
- Sau điểm tương đương.
Câu 3: Chứng minh các công thức được sử dụng trong xây dựng đường cong chuẩn độ khi
chuẩn độ một dung dịch đơn axit yếu HA (Co, Vo), hằng số axit Ka bằng dung dịch đơn bazơ
mạnh BOH (C, V) qua các gai đoạn sau:
a. Trước khi tiến hành chuẩn độ:
pH = 1 ( p K −lg C ) 2 a 0 b. C V −VC
Chuẩn độ trước điểm tương đương: pH = p K −lg o o a VC 1 c. C
Tại điểm tương đương:
pH =7+ p K 1 V 0 0 + lg 2
a 2 V +V 0 d. VC−V C Sau điểm tương đương: pH =14 +lg 0 0 V + V 0
Câu 4: Chứng minh các công thức được sử dụng trong xây dựng đường cong chuẩn độ khi
chuẩn độ một dung dịch đơn bazơ yếu BOH (Co, Vo), hằng số bazơ Kb bằng dung dịch đơn axit
mạnh HA (C, V) qua các giai đoạn sau: 1 1
a. Trước khi tiến hành chuẩn độ:
pH =14− p K + lg C 2 b 2 0
pH =14− 1 p K +1 C V −VC lg o o
b. Chuẩn độ trước điểm tương đương: 2 b 2 VC c. 1 1 VC
Tại điểm tương đương:
pH =7− p K − lg 2 b 2 V +V o VC −V C
d. Sau điểm tương đương: pH =−lg 0 0 V +V 0
Câu 5: Xây dựng đường cong chuẩn độ bằng việc xác định sự thay đổi của giá trị pH bình chuẩn
độ theo thể tích dung dịch chuẩn thêm vào ở 4 giai đoạn: (1) Khi chưa chuẩn độ F = 0; (2) Trước 1
điểm tương đương 0 < F < 1; (3) Tại điểm tương đương F = 1 và (4) Sau điểm tương đương F >
1, áp dụng cho 2 trường hợp:
a. Chuẩn độ 50 mL dung dịch HCl 0,1M bằng dung dịch NaOH 0,1M.
b. Chuẩn độ khi chuẩn độ 50 mL dung dịch CH3COOH 0,1M bằng dung dịch NaOH 0,1M
biết rằng hằng số phân ly pKa của CH3COOH = 4,75. Xây dựng đường cong chuẩn độ?
c. Nhận xét và so sánh bước nhảy pH của 2 trường hợp nói trên.
Gợi ý: Lập bảng cho từng trường hợp và xác định các công thức tính giá trị pH tại các giai đoạn khác nhau: V dung dịch Công thức tính F pH NaOH thêm (ml) pH 0.00 0 25.00 45.00 47.50 49.50 49.75 50.00 1 50.25 50.50 52.50 55.00 75.00
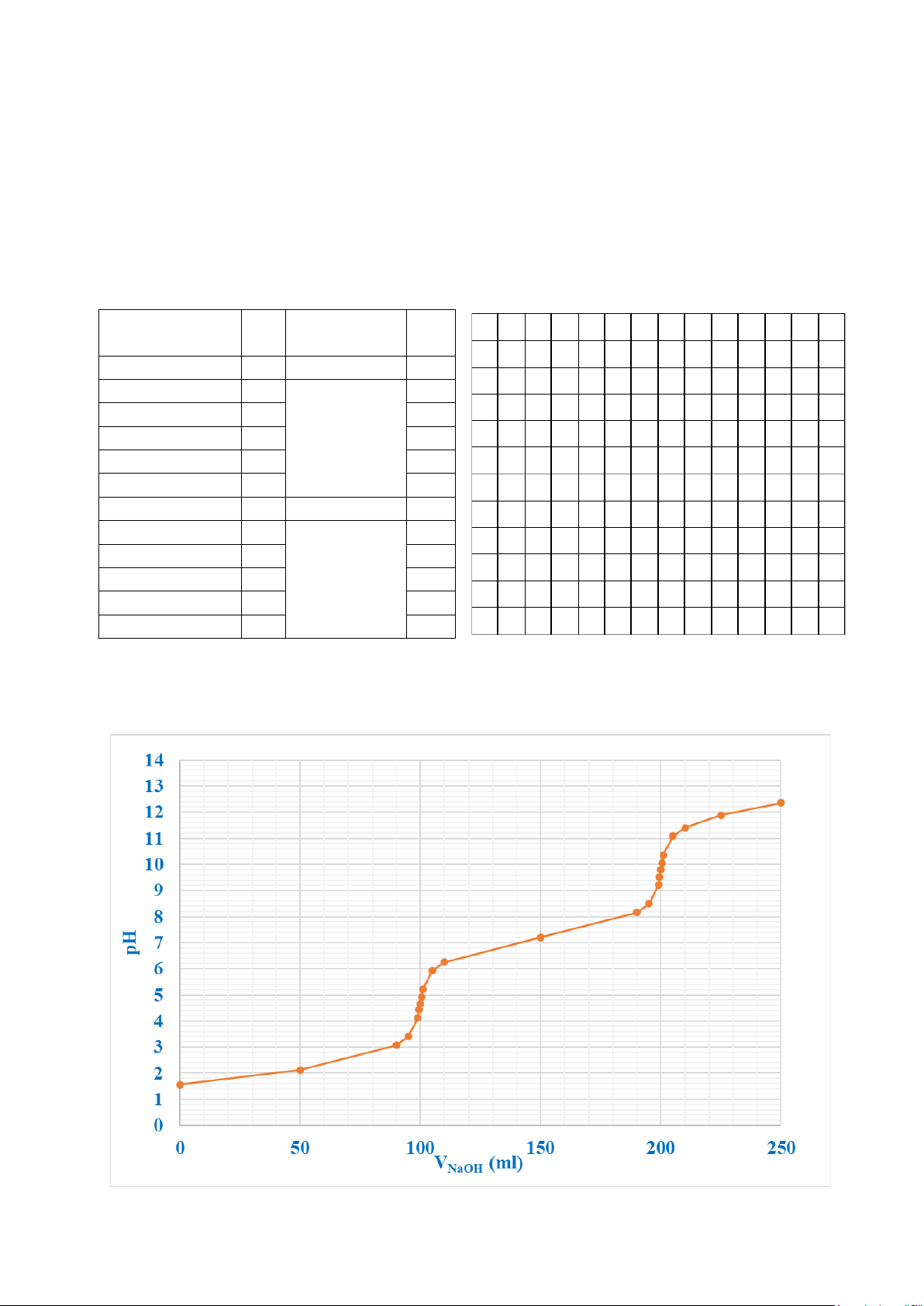
Câu 6: Xây dựng đường cong chuẩn độ của dung dịch đa axit H3PO4 0,1M có pKa1=2,12;
pKa2 = 7,21; pKa3 = 12,36 bằng dung dịch NaOH 0,1M, người ta chỉ thu được 2 bước nhảy pH như đồ thị sau đây: 2
a. Tại sao đường cong chuẩn độ của dung dịch H3PO4 chỉ có 2 bước nhảy pH?
b. Xác định pH của điểm tương đương 1 và 2 và kiểm tra giá trị của pH của các điểm tương đương trên đồ thị.
c. Cho biết các loại chỉ thị được sử dụng để có thể phát hiện ra các điểm tương đương nói trên. 3




