






Preview text:
BÀI TẬP ĐÚNG-SAI CHỦ ĐỀ ĐẠI CƯƠNG KIM LOẠI (Phần 2)
Câu 1. Ở điều kiện thường, các kim loại đều ở trạng thái rắn (trừ Hg.) Kim loại có những tính chất vật lí chung .
a. Kim loại có tính chất vật lí chung là do các electron tự do trong mạng tinh thể gây ra.
b. Những tính chất vật lí chung của kim loại là dẫn điện , dẫn nhiệt , tính dẻo, tính cứng.
c. Những tính chất vật lí chung của kim loại là dẫn điện , dẫn nhiệt , tính dẻo, ánh kim.
d. Những tính chất vật lí chung của kim loại là dẫn điện, dẫn nhiệt , ánh kim, khối lượng riêng.
Câu 2. Cho các kim loại sau: Cu, Au, Cr, W. Ag, Hg.
a. Kim loại dẫn điện tốt nhất là đồng nên được dùng làm dây dẫn điện trong nhà.
b. Chromium (Cr) là kim loại cứng nhất có thể cắt được kính.
c. Kim loại có nhiệt độ nóng chảy cao nhất là tungsten (vonfram, W) nóng chảy ở 3410 °C dùng làm dây tóc bóng đèn.
d. Kim loại có nhiệt độ nóng chảy thấp nhất là thủy ngân, kim loại dẻo nhất là Au.
Câu 3. Tính chất hóa học chung của kim loại là tính khử
a. Tất cả các kim loại đều tác dụng với oxygen tạo thành oxide.
b. Hg tác dụng với sulfur ngay ở nhiệt độ thường nên sulfur được sử dụng để khử độc thủy ngân khi vỡ nhiệt kế
thủy ngân trong phòng thí nghiệm.
c. Kim loại Fe tác dụng với phi kim S, Cl2 ra hợp chất sắt (II)
d. Cu có tính khử mạnh hơn Ag nên tác dụng được với dung dịch HCl giải phóng H2.
Câu 4. Acid HNO3 đặc nguội và H2SO4 đặc nguội tác dụng được với kim loại nào sau đây?
a. Tác dụng được với tất cả kim loại đứng trước hydrogen trong dãy điện hóa.
b. Tác dụng được hầu hết kim loại trừ Au, Pt.
c. Kim loại Al, Fe, Cr bị thụ động trong HNO3 đặc nguội và H2SO4 đặc nguội
d. Tác dụng được với tất cả kim loại đứng sau hydrogen trong dãy điện hóa.
Câu 5. Cho một đinh sắt mới (đã rửa sạch lớp dầu mỡ) vào cốc chứa khoảng 3 ml dung dịch CuSO4 1 M. Sau 5
phút dùng kẹp lấy đinh sắt ra khỏi dung dịch. Hiện tượng quan sát được là
a. Màu xanh của dung dịch CuSO4 đậm dần lên.
b. Màu xanh của dung dịch CuSO4 nhạt dần.
c. Đinh sắt tan hết.
d. Có lớp đồng màu đỏ bám ngoài đinh sắt.
Câu 6. Tính chất hoá học của kim loại
a. Các kim loại từ Cu đến Au trong dãy điện hoá không đẩy được H2 ra khỏi dung dịch của các acid như HCI, H2SO4 loăng.
b. Hầu hết kim loại tác dụng với dung dịch HCI, H2SO4 loãng giải phóng H2.
c. Hầu hết các kim loại nhóm IA và một số kim loại nhóm IIA tác dụng với nước ở nhiệt độ thường giải phóng H2.
d. Kim loại hoạt động mạnh hơn như Na, Mg, Al.... có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối của nó.
Câu 7. Cho vài hạt kẽm vào ống nghiệm,thêm tiếp khoảng 2 mL dung dịch H2SO4 10% vào.
a. Viên kẽm tan dần và có xuất hiện bọt khí.
b. Dung dịch sau phản ứng có màu xanh.
c. Cần đun nóng thì phản ứng mới xảy ra.
d. Xảy ra phản ứng là Zn + H SO → ZnSO + H . 2 4 4 2
Bài tập đúng-sai chủ đề đại cương ki loại
Câu 8. Cho lần lượt từng kim loại sau: Na, Fe, Ag, Zn tác dụng với dung dịch CuSO4 .
a. Có 3 kim loại đẩy được Cu ra khỏi dung dịch muối là Na, Fe, Zn.
b. Chỉ có 2 kim loại đẩy được Cu ra khỏi dung dịch muối là Fe, Zn.
c. Cả 4 kim loại đều tác dụng được với dung dịch CuSO4 .
d. có 1 trường hợp xuất hiện bọt khí và kết tủa màu xanh.
Câu 9. Cho Fe tác dụng với dung dịch HNO3 đặc nóng thu được khí X có màu nâu đỏ theo phản ứng sau :
aFe + bHNO3 → cFe(NO3)3 + dX+ eH2O. ( với a,b,c,d là các hệ số tối giản)
a. Khí X là nitrogendioxide (NO2).
b. Khí X là nitrogenoxide (NO).
c. Số phân tử HNO3 đóng vai trò là chất oxi hóa là 6.
d. Tỉ lệ a:d = 1:3.
Câu 10. Một trong những chất liệu làm nên vẻ đẹp kì ảo của tranh sơn mài là những mảnh màu vàng lấp lánh cực
mỏng. Đó chính là những lá vàng có chiều dày 1.10-4 mm. Người ta đã ứng dụng tính chất vật lí gì của vàng khi làm tranh sơn mài?
a. Nhiệt độ nóng chảy và tính cứng.
b. Tính dẻo, tính dẫn nhiệt.
c. Tính dẻo và có ánh kim.
d. Mềm, có tỉ khối lớn.
Câu 11. Cho các phát biểu sau:
a. Kim loại Fe dẫn điện tốt hơn kim loại Ag.
b. Ở nhiệt độ thường, H2 khử được MgO.
c. Cho Fe vào dung dịch CuSO4 có xảy ra ăn mòn điện hoá học.
d. Kim loại Al không tác dụng với dung dịch HNO3 đặc nóng.
Câu 12. Cho các nhận định sau
a. Tính chất hóa học chung của kim loại chủ yếu do các electron tự do trong kim loại gây ra.
b. Các kim loại nhẹ đều có khối lượng riêng nhỏ hơn 5g/cm3.
c. Tính chất hóa học đặc trưng của kim loại là tính oxi hóa.
d. Gang cũng như thép đều là hợp kim của iron với carbon và một số nguyên tố khác.
Câu 13. Cho các phát biểu sau:
a. Tính chất hóa học đặc trưng của kim loại là tính khử.
b. Bản chất của ăn mòn kim loại là quá trình oxi hóa - khử.
c. Ăn mòn hóa học phát sinh dòng điện.
d. Nguyên tắc chung để điều chế kim loại là khử ion kim loại thành nguyên tử kim loại.
Câu 14. Cho dãy điện hóa như sau:
a. Giá trị thế điện cực chuẩn: E 0 E0 . Cu2+ / Cu Fe2+ / Fe
b. Cu có thể khử Fe3+ thành Fe.
c. Sắp xếp tính oxi hóa giảm dần: Ag+ > Fe2+ > H+ > Zn2+.
d. Dãy điện hóa được sắp xếp dựa trên giá trị thế điện cực chuẩn của các cặp oxi hóa – khử. 2
Câu 15. Cho các cặp oxi hóa - khử được sắp xếp theo thứ tự tăng dần tính oxi hóa của các ion kim loại: Al3+/Al;
Fe2+/Fe; Sn2+/Sn; Cu2+/Cu. Tiến hành các thí nghiệm sau, những thí nghiệm xảy ra phản ứng.
a. Cho lá sắt vào dung dịch copper (II) sulfate.
b. Cho lá đồng vào dung dịch aluminium sulfate.
c. Cho thiếc vào dung dịch copper (II) sulfate.
d. Cho thiếc vào dung dịch iron(II) sulfate.
Câu 16. Cho các phát biểu sau:
a. Trong cùng chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử lớn hơn so với nguyên tử của nguyên tố phi kim.
b. Kim loại có những tính chất vật lí chung: tính ánh kim, tính dẫn điện, tính dẫn nhiệt và khối lượng riêng lớn.
c. Phương pháp điện phân các hợp chất điện li nóng chảy của kim loại (muối, oxide, ...) dùng để tách những kim loại có độ hoạt động mạnh.
d. Trong ăn mòn điện hóa học có xảy ra phản ứng oxi hoá - khử, còn trong ăn mòn hóa học thì không xảy ra phản ứng oxi hoá - khử.
Câu 17. Cho các nhận định sau đây:
a. Các kim loại đều chỉ có một số oxi hoá duy nhất trong các hợp chất.
b. Fe và Al tác dụng với HCl loãng dư đều thu được muối trong đó kim loại có hóa trị III.
c. Các kim loại đứng trước H mới có khả năng tác dụng với dung dịch HNO3 loãng.
d. Một số kim loại như Al, Zn có khả năng phản ứng với dung dịch NaOH giải phóng khí H2.
Câu 18. Cho các nhận định sau đây:
a. Tính chất vật lí chung của kim loại gồm tính cứng, tính dẫn điện dẫn nhiệt và ánh kim.
b. Kim loại dẻo nhất là Al, dẫn điện tốt nhất là Ag.
c. Tính chất vật lí chung của kim loại do các electron tự do gây ra.
d. Kim loại có khối lượng riêng nhỏ nhất là Li, kim loại cứng nhất là Cr.
Câu 19. Tiến hành các thí nghiệm, các phản ứng dưới đây tạo thành kim loại:
a. Cho Zn vào dung dịch AgNO3.
b. Cho Fe Vào dung dịch Fe2(SO4)3.
c. Cho Na vào dung dịch CuSO4.
d. Dẫn khí CO (dư) qua bột CuO nóng.
Câu 20. Khi điện phân dung dịch NaCl (cực âm bằng sắt, cực dương bằng than chì, có màng ngăn xốp) thì
a. ở cực âm xảy ra quá trình oxi hoá H2O và ở cực dương xảy ra quá trình khử ion Cl−.
b. ở cực dương xảy ra quá trình oxi hoá ion Na+ và ở cực âm xảy ra quá trình khử ion Cl−.
c. ở cực âm xảy ra quá trình khử H2O và ở cực dương xảy ra quá trình oxi hoá ion Cl−.
d. ở cực âm xảy ra quá trình khử ion Na+ và ở cực dương xảy ra quá trình oxi hoá ion Cl−.
Câu 21. Nếu vật làm bằng hợp kim Fe - Zn bị ăn mòn điện hoá thì trong quá trình ăn mòn
a. sắt đóng vai trò anode và bị oxi hoá.
b. kẽm đóng vai trò anode và bị oxi hoá.
c. sắt đóng vai trò cathode và ion H+ bị oxi hóa.
d. kẽm đóng vai trò cathode và bị oxi hóa.
Câu 22. Trong các trường hợp sau, trường hợp xảy ra ăn mòn điện hoá học là
a. Nhúng thanh Cu trong dd Fe2(SO4)3 có nhỏ một vài giọt dung dịch H2SO4.
b. Sự ăn mòn vỏ tàu trong nước biển.
c. Nhúng thanh Zn trong dung dịch H2SO4 có nhỏ vài giọt CuSO4.
Bài tập đúng-sai chủ đề đại cương ki loại
Câu 23. Trong các trường hợp sau, trường hợp xảy ra ăn mòn điện hoá học
a. Cho lá Fe vào dung dịch gồm CuSO4 và HCl.
b. Đốt dây Fe trong bình đựng khí O2.
c. Cho lá Cu vào dung dịch gồm Fe(NO3)3 và HNO3.
d. Cho lá Zn vào dung dịch CuCl2.
Câu 24. Trong các trường hợp sau, trường hợp xảy ra ăn mòn hoá học
a. Nhúng thanh Fe vào dung dịch FeCl3.
b. Nhúng thanh Fe vào dung dịch CuSO4.
c. Nhúng thanh Cu vào dd FeCl3.
d. Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dd HCl.
Câu 25. Tiến hành thí nghiệm theo các bước sau:
Bước 1: Lấy vào ống nghiệm thứ nhất 0,5 ml dung dịch HNO3 đặc (68%) và ống nghiệm thứ hai 0,5 ml dung dịch HNO3 15%.
Bước 2: Cho vào mỗi ống nghiệm một mảnh nhỏ đồng kim loại. Nút các ống nghiệm bằng bông tẩm dung dịch
NaOH. Đun nhẹ ống nghiệm thứ hai.
a. Ở hai ống nghiệm, mảnh đồng tan dần, dung dịch chuyển sang màu xanh
b. Ở ống nghiệm thứ nhất, có khí màu nâu đỏ thoát ra khỏi dung dịch
c. Ở ống nghiệm thứ hai, thấy có khí không màu, không hóa nâu thoát ra khỏi dung dịch
d. Bông tẩm dung dịch NaOH có tác dụng hạn chế khí độc NO2 thoát ra khỏi ống nghiệm
Câu 26. Có 2 chiếc thìa sắt như nhau, một chiếc giữ nguyên còn một chiếc bị vặn cong cùng đặt trong điều kiện
không khí ẩm như nhau. Hiện tượng xảy ra là
a. Cả 2 chiếc thìa đều không bị ăn mòn.
b. Cả 2 chiếc thìa đều bị ăn mòn với tốc độ như nhau.
c. Chiếc thìa cong bị ăn mòn nhiều hơn.
d. Chiếc thìa cong bị ăn mòn ít hơn.
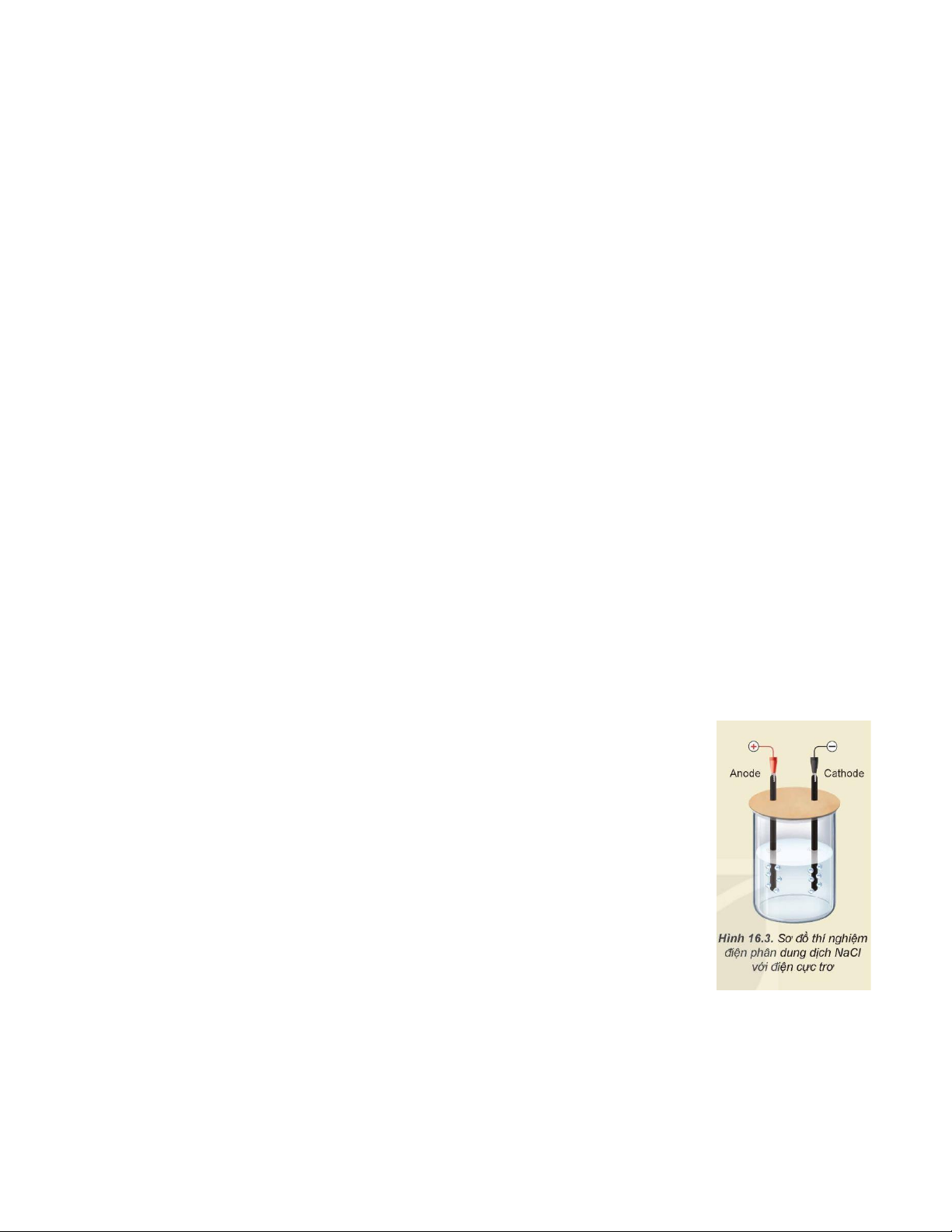
Câu 27. Thực hiện thí nghiệm theo các bước sau:
- Bước 1: Lắp thiết bị thí nghiệm điện phân dung dịch NaCl với điện cực trơ như Hình 16.3.
- Bước 2: Rót khoảng 80 mL dung dịch NaCl bão hoà vào cốc rồi nhúng hai điện cực
than chì vào dung dịch.
- Bước 3: Nối hai điện cực than chì với hai cực của nguồn điện và tiến hành điện phân
trong khoảng 5 phút.
- Bước 4: Cho một 1 giọt màu thực phẩm (màu đỏ) vào cốc chứa khoảng 10 mL dung dịch sau điện phân.
Những phát biểu nào sau đây là đúng hay sai?
a. Ở điện cực anode xảy ra quá trình oxi hóa.
b. Sau bước 3, dung dịch thu được chỉ chứa sodium hydroxide.
c. Sau bước 4, màu thực phẩm bị nhạt màu (hoặc mất màu).
d. Khí thoát ra ở cathode là khí H2.
Câu 28. Nhận xét các phát biểu sau về đặc điểm của ăn mòn hoá học
a. không làm phát sinh dòng điện.
b. giữa kim loại và môi trường xảy ra phản ứng trao đổi ion.
c. kim loại tinh khiết sẽ không bị ăn mòn hoá học.
d. xảy ra phản ứng oxi hóa – khử giữa kim loại và môi trường oxi hóa. 4
Bài tập đúng-sai chủ đề đại cương kim loại
Câu 29. Có thể bảo vệ kim loại không bị ăn mòn bằng cách là
a. Giữ cho bề mặt kim loại luôn luôn sạch, không có bùn đất bám vào.
b. Sử dụng vật dụng bằng kim loại tinh khiết không sử dụng hợp kim.
c. Tráng lên bề mặt kim loại cần bảo vệ bằng các kim loại khó bị oxi hóa.
d. Gắn kim loại cần bảo vệ với một kim loại khác có tính khử mạnh hơn.
Câu 30. Nhận định các phát biểu dưới đây
a. Gỉ sắt có công thức hoá học là Fe2O3. xH2O.
b. Trong quá trình ăn mòn, kim loại bị khử thành ion của nó.
c. Các đồ dùng bằng sắt thường bị ăn mòn do không được chế tạo từ Fe tinh khiết mà thường có lẫn các tạp chất khác.
d. Trong quá trình tạo thành gỉ sắt, ở catot xảy ra quá trình : O2 +2H2O + 4e → 4OH-
Câu 31. Nhận định các phát biểu dưới đây
a. Một biện pháp góp phần bảo vệ vỏ tàu biển là sử dụng sơn chuyên dùng để chống thấm, chống rỉ, chống hà và chống mài mòn.
b. Bộ phận của các thiết bị lò đốt dễ bị ăn mòn điện hóa.
c. Khi bảo quản thép xây dựng ở trong kho không nên sắp xếp lẫn lộn thép gỉ và thép chưa gỉ vào chung một chỗ.
d. Gắn kim loại cần bảo vệ với một kim loại khác có tính khử mạnh hơn là một phương pháp chống ăn mòn điện hóa.
Câu 32. Có rất nhiều hợp kim khác nhau được chế tạo có hóa tính, cơ tính và lí tính chiếm ưu thế như: không gỉ, độ
cứng cao, chịu nhiệt tốt, chịu ma sát tốt...
a. Gang là hợp kim siêu cứng.
b. Hợp kim Al – Cu – Mn – Mg nhẹ và cứng, dùng trong chế tạo tên lửa, tàu vũ trụ.
c. Hợp kim vàng tây (Au – Ag – Cu) cứng hơn vàng nguyên chất nên được dùng để chế tạo đồ trang sức.
d. Hợp kim Bi – Pb – Sn có nhiệt độ nóng chảy rất cao.
Câu 33. Hợp kim thường khó bị oxi hoá và có một số tính chất đáp ứng được nhiều mục đích sử dụng khác nhau.
a. Hợp kim được sử dụng phổ biến hơn kim loại.
b. Hợp kim thường được điều chế bằng cách nung chảy các thành phần rồi để nguội.
c. Thép inox hay thép không gỉ là hợp kim của sắt có chứa ít nhất 5% chromium theo khối lượng.
d. Trong lĩnh vực chế tạo máy bay, ô tô,... sử dụng những hợp kim có tính bền hóa học và cơ học cao,...
Câu 34. Tính chất vật lí của kim loại tinh khiết bị thay đổi khi biến thành hợp kim.
a. Nhiệt độ nóng chảy của hợp kim thấp hơn nhiệt độ nóng chảy của kim loại cơ bản trong hợp kim.
b. Tính dẫn điện, dẫn nhiệt của hợp kim kém hơn kim loại cơ bản trong hợp kim.
c. Độ cứng của hợp kim thường nhỏ hơn của kim loại cơ bản trong hợp kim.
d. Tính dẻo của hợp kim thường lớn hơn so với của kim loại cơ bản trong hợp kim.
Câu 35. Kim loại có độ dẫn nhiệt, dẫn điện tốt, ... nên được ứng dụng nhiều trong thực tế. Tuy nhiên, nhiều thiết bị,
đồ dùng phục vụ cho đời sống và sản xuất được làm từ hợp kim.
a. Những hợp kim nhẹ, bền, chịu được nhiệt độ cao, áp suất cao được dùng để chế tạo tên lửa, tàu vũ trụ, máy bay.
b. Hợp kim có nhiều tính chất vật lí, tính chất cơ học vượt trội so với kim loại thành phần trong hợp kim.
c. Hợp kim hay bị gỉ, mềm, chịu nhiệu tốt, chịu ma sát tốt.
d. Hợp kim không có tính dẫn điện, dẫn nhiệt, tính dẻo và ánh kim
Câu 36. Hợp kim có nhiều ứng dụng trong đời sống dựa vào tính chất vật lý, tính cơ học và tính chất hóa học.
a. Tính chất vật lí của kim loại tinh khiết bị thay đổi khi tạo thành hợp kim.
Bài tập đúng-sai chủ đề đại cương kim loại
b. Hợp kim dẫn điện, dẫn nhiệt tốt hơn kim loại nguyên chất tạo thành hợp kim.
c. Hợp kim có tính cứng và bền dùng để xây nhà cửa, cầu cống.
d. Thép không gỉ chứa chromium dùng để chế tạo dụng cụ y tế, đồ dùng nhà bếp...
Câu 37. Cho các phát biểu sau:
a. Đồng thau là hợp kim của copper và silver (Cu – Ag).
b. Đồng dẫn điện tốt hơn hợp kim đồng.
c. Thép 304 là loại thép không gỉ hay còn gọi là inox 304 được sử dụng phổ biến nhất hiện nay trên toàn thế giới.
d. Inox 304 ngoài chromium còn chứa tối thiểu 8% nickel. Chính chromium và nickel là 2 nguyên tố chính tạo
nên khả năng chống ăn mòn cho inox 304.
Câu 38. Cho các phát biểu sau về các loại hợp kim:
a. Vàng tây là hợp kim Au – Zn.
b. Vàng tây cứng hơn vàng nguyên chất, dùng để chế tạo đồ trang sức.
c. Duralumin là hợp kim chứa trên 90% nhôm về khối lượng.
d. Hợp kim duralumin được sử dụng trong lĩnh vực hàng không do đặc tính nổi bật của hợp kim nhôm là nhẹ và bền.
Câu 39. Hầu hết các hợp kim của sắt là thép. Các loại thép có thành phần khác nhau nên có tính chất và ứng dụng khác nhau.
a. Thép là hợp kim của Fe và C, là vật liệu chủ yếu trong ngành chế tạo máy, xây dựng và nhiều lĩnh vực khác của
đời sống và sản xuất.
b. Hợp kim thép (Fe – C) ít bị ăn mòn hơn sắt.
c. Fe – C – Mn tạo hợp kim thép không gỉ được dùng làm vật liệu chế tạo dao, kéo, dụng cụ phẫu thuật...
d. Thép là hợp kim của sắt chứa ít hơn 2% carbon và một số nguyên tố chromium, manganese...làm cho thép có
tính cứng, tính chịu nhiệt và các tính chất quý khác so với gang và sắt nguyên chất.
Câu 40. Sắt có độ tinh khiết cao ít được sử dụng trong thực tế nhưng các hợp kim của sắt được sử dụng rất phổ biến
trong sản xuất và đời sống.
a. Gang và thép là hai hợp kim quan trọng nhất của sắt và được ứng dụng nhiều nhất trong đời sống.
b. Gang là hợp kim của Fe và C, trong đó C chiếm khoảng từ 0,01% - 2% về khối lượng.
c. Gang có nhiệt độ nóng chảy thấp hơn nhiệt độ nóng chảy của sắt nguyên chất.
d. Gang cứng và giòn hơn thép.
Câu 41. Phương pháp nhiệt luyện và thuỷ luyện dùng để tách các kim loại hoạt động hoá học trung bình và yếu.
a. Phản ứng xảy ra trong quá trình tách Cu bằng phương pháp thuỷ luyện là: 0
Fe(s) + CuSO4(aq) ⎯⎯t → Cu(s) + FeS 4 O (aq)
b. Phản ứng xảy ra trong quá trình tách Zn bằng phương pháp thuỷ luyện là: 0
C(s) + ZnO(s) ⎯⎯t → Zn(s) + CO(g)
c. Phản ứng xảy ra trong quá trình tách Fe bằng phương pháp nhiệt luyện là: 0
3CO(g) + Fe2O3(s) ⎯⎯t → 2Fe(l) + 3C 2 O (g)
d. Phản ứng xảy ra trong quá trình tách Cu bằng phương pháp nhiệt luyện là: 0
CO(g) + CuO(s) ⎯⎯t → Cu(l) + 2 CO (g)
Câu 42. Phương pháp nhiệt luyện và thuỷ luyện dùng để tách các kim loại hoạt động hoá học trung bình và yếu.
a. Chất khử thường được sử dụng trong phương pháp nhiệt luyện là C, CO…
b. Phương pháp thuỷ luyện thường được dùng để tách những kim loại hoạt động hoá học yếu như Cu, Ag, Au,...
ra khỏi dung dịch muối của chúng bằng các kim loại có tính khử mạnh hơn như Na, K,... 6
Bài tập đúng-sai chủ đề đại cương kim loại
c. Phương pháp nhiệt luyện thường được dùng để tách các kim loại hoạt động hoá học trung bình và yếu như Zn,
Fe, Sn, Pb, Cu,... ra khỏi các muối của chúng bằng các chất khử phù hợp.
d. Chất khử thường được sử dụng trong phương pháp thuỷ luyện là Fe, Zn …
Câu 43. Điện phân là một trong ba phương pháp để tách kim loại.
a. Phương pháp điện phân được áp dụng để điều chế các kim loại hoạt động trung bình và yếu như Zn, Cu, Ag,...
bằng cách điện phân hợp chất của chúng trong dung dịch.
b. Việc tách kim loại hoạt động hoá học mạnh ra khỏi hợp chất thường được thực hiện bằng phương pháp điện
phân các hợp chất của chúng trong dung dịch.
c. Thực tế, để tách các kim loại thuộc nhóm IA, IIA và nhôm phải điện phân muối halide hoặc oxide của chúng ở trạng thái nóng chảy.
d. Dù tốn năng lượng nhưng phương pháp điện phân cho sản phẩm có độ tinh khiết cao, được dùng nhiều trong tinh chế kim loại.
Câu 44. Để tách magnesium ta có thể điện phân magnesium chloride nóng chảy với điện cực than chì (graphite).
a. MgCl2 nóng chảy phân li thành các ion Mg2+ và Cl−. Cation Mg2+ di chuyển về anode và anion Cl− di chuyển
về cathode của bình điện phân.
b. Tại anode xảy ra quá trình: 2Cl− → Cl2 + 2e
c. Tại cathode xảy ra quá trình: Mg2+ + 2e → Mg
d. Phương trình hoá học của phản ứng là: 2MgCl2(l) ⎯®⎯pnc⎯→ 2Mg(l) + Cl2 (g)
Câu 45. Trong công nghiệp, Al được tách ra bằng cách điện phân nóng chảy Al2O3.
a. Ở cực âm xảy ra sự khử ion Al3+: Al3+ + 3e → Al
b. Ở cực dương xảy ra sự khử ion O2-: 2O2- → O2 + 4e
c. Phương trình hoá học của phản ứng điện phân là 2Al2O3(l) ⎯®⎯pnc⎯→ 4Al(l) + 3O2 (g).
d. Trong thực tế, Al2O3 nóng chảy ở nhiệt độ rất cao (2072 °C). Bằng cách thêm cryolite (Na3AlF6), nhiệt độ nóng
chảy của hỗn hợp còn khoảng 1000 °C, từ đó tiết kiệm được nhiều năng lượng cũng như giảm giá thành chế tạo bể điện phân.
Câu 46. Trong công nghiệp, Na được tách ra bằng cách điện phân nóng chảy NaCl.
a. Ở cathode xảy ra sự oxi hoá kim loại Na: Na → Na+ + 1e
b. Ở anode xảy ra sự oxi hoá ion Cl−: 2Cl− → Cl2 + 2e
c. Phương trình hoá học của phản ứng điện phân là: 2NaCl(l) ⎯®⎯pnc⎯→ 2Na(l) + Cl2 (g).
d. NaCl nóng chảy điện li thành các ion Na+ và Cl− chuyển động tự do, trong điện trường, các ion sẽ di chuyển về
các điện cực cùng dấu
Câu 47. Trong vỏ Trái Đất, đa số các nguyên tố kim loại tồn tại ở dạng hợp chất oxide và muối không tan, một số
kim loại quý tồn tại ở dạng đơn chất hoặc hợp kim.
a. Khoáng vật chứa nhôm trong tự nhiên phổ biến là quặng bauxite (Al2O3.2H2O)
b. Khoáng vật chứa sắt trong tự nhiên phổ biến là quặng hematite (Fe3O4), pyrite (FeS2)
c. Khoáng vật chứa calcium trong tự nhiên phổ biến là quặng calcite (CaO)
d. Khoáng vật chứa sodium trong tự nhiên phổ biến là quặng halite (NaCl)
Câu 48. Các nguyên tố kim loại tồn tại trong vỏ Trái Đất, nước mặt, nước ngầm và cơ thể sinh vật.
a. Trong vỏ Trái Đất, đa số các nguyên tố kim loại tồn tại ở dạng hợp chất hydroxide và muối tan, một số kim loại
quý tồn tại ở dạng đơn chất hoặc hợp kim.
b. Trong nước mặt và nước ngầm, các nguyên tố kim loại tồn tại ở dạng cation, như Na+, Mg2+, Ca2+,...
Bài tập đúng-sai chủ đề đại cương kim loại
c. Trong cơ thể sinh vật, nguyên tố calcium có trong xương và răng; các nguyên tố như potassium, sắt, đồng,... có trong máu
d. Quặng kim loại chứa các khoáng vật tạo bởi hợp chất của kim loại hoặc đơn chất kim loại và tạp chất. Ví dụ:
Quặng chứa khoáng vật hematite (có thành phần chính là Fe2O3) hay quặng chứa khoáng vật pyrite (có thành phần
chính là FeS2),... đều được gọi là quặng săt.
Câu 49. Từ quặng kim loại, qua giai đoạn xử lí, ta thường thu được hợp chất của kim loại.
a. Trong hợp chất, nguyên tố kim loại tồn tại dạng cation kim loại (Mn+). Vì vậy, để tách được nguyên tố kim loại
ra khỏi hợp chất cần thực hiện phản ứng oxi hoá cation kim loại thành nguyên tử: Mn+ + ne → M
b. Tuỳ thuộc vào độ hoạt động hoá học của kim loại, cần áp dụng phương pháp phù hợp để tách chúng ra khỏi hợp chất.
c. Phương pháp thuỷ luyện thường được dùng để tách những kim loại hoạt động hoá học yếu như Cu, Ag, Au,... ra
khỏi dung dịch muối của chúng bằng các kim loại có tính khử mạnh hơn như Zn, Fe,...
d. Phương pháp nhiệt luyện thường được dùng để tách các kim loại hoạt động hoá học trung bình và yếu như Zn,
Fe, Sn, Pb, Cu,... ra khỏi các hydroxide của chúng bằng các chất khử phù hợp và phổ biến như C, CO,... ở nhiệt độ cao.
Câu 50. Tiến hành điện phân dung dịch gồm FeCl2 1M, CuCl2 1M và HCl 1M với hai điện cực trơ.
a. Kim loại thoát ra đầu tiên ở cathode là đồng.
b. Kim loại thoát ra đầu tiên ở cathode là sắt.
c. Thứ tự điện phân các ion dương ở cathode lần lượt là Cu2+, H+, Fe2+.
d. Khi khí bắt đầu thoát ra ở cathode thì các cation Cu2+ và Fe2+ đã điện phân hết. 8




