






Preview text:
Pham Van Trong Education Bài tập đúng-sai hóa học nâng cao
BÀI TẬP ĐÚNG-SAI NÂNG CAO (SỐ 03)
Câu 1: Vaniline là một dẫn xuất họ phenol – một trong những thành phần dùng
để tạo hương vani trong thực phẩm. Một nhóm học sinh được giao nhiệm vụ
xác định độ tinh khiết của một loại vaniline thương mại bằng phương pháp
chuẩn độ acid – base. Nhóm học sinh tiến hành nghiên cứu và thấy rằng: khi
chuẩn độ dung dịch chứa đồng thời NaOH và muối của vaniline bằng chỉ thị
thymolphthalein và methyl da cam thì khi dung dịch chuyển từ màu xanh sang màu vàng thì coi như NaOH đã hết
và khi dung dịch chuyển từ màu vàng sang màu đỏ thì muối của vaniline phản ứng vừa hết. Nhóm học sinh đã tiến hành thí nghiệm như sau:
• Bước 1: Cân 5,050 gam vaniline thương mại (dạng rắn) cho vào bình định mức 500 mL, hòa tan chất rắn bằng
dung dịch NaOH 0,100 M và định mức bằng dung dịch NaOH đến vạch định mức được dung dịch X.
• Bước 2: Lấy dung dịch HCl 0,200 M cho vào burette và 20 mL dung dịch X cho vào cốc. Thêm hỗn hợp chỉ thị
methyl da cam và tiến hành chuẩn độ ở nhiệt độ 50°C.
• Bước 3: Nhỏ từ từ dung dịch HCl vào cốc đựng dung dịch X cho đến khi dung dịch chuyển từ màu xanh sang
màu vàng (ghi lại thể tích là V1) và khi dung dịch chuyển từ màu vàng sang màu đỏ (ghi lại thể tích là V2). Lặp lại
thí nghiệm thêm 2 lần nữa Kết quả của 3 lần chuẩn độ như sau: Thí nghiệm Lần 1 Lần 2 Lần 3 V1 (mL) 3,45 3,35 3,40 V2 (mL) 10,1 9,9 10,0
Trước khi tiến hành thí nghiệm, nhóm học sinh đưa ra giả thuyết rằng: “Dựa vào sự chênh lệch thể tích V2 với V1
có thể xác định được hàm lượng vaniline trong mẫu”. Cho công thức cấu tạo của Vaniline là:
a) Hàm lượng vaniline xác định được dựa vào phép chuẩn độ khoảng 99,33%.
b) Biểu thức tính toán với hàm lượng vaniline trong thí nghiệm trên là
c) Giả thuyết của nhóm học sinh là chính xác.
d) Tại thời điểm dung dịch chuyển sang đỏ, thành phần chất tan chủ yếu của dung dịch là NaCl và muối sodium của vaniline.
Câu 2: Khi nói về thuốc thử Tollens, nhận định nào đúng, nhận định nào sai ?
a) Trong thuốc thử Tollens, nguyên tử trung tâm là NH3.
b) Cation cầu nội [Ag(NH3)2]+ quyết định tính chất của thuốc thử Tollens.
c) Thuốc thử Tollens thường dùng để phân biệt aldehyde với ketone.
d) [Ag(NH3)2]OH là công thức của thuốc thử Tollens.
Câu 3: Tinh bột biến tính (modified starch) là tinh bột được biến đổi bằng các phương pháp vật lí, hoá học hoặc
enzyme, nhờ đó những tính chất đặc thù của tinh bột như độ nhớt, độ kết dính, nhiệt độ hồ hoá, khả năng thuỷ
phân, ... được tăng cường hoặc điều chỉnh so với tinh bột tự nhiên. Tinh bột kháng (resistant starch) là loại tinh
bột không bị thuỷ phân ở ruột non mà đi đến và lên men trong ruột già, tạo ra nhiều vi khuẩn tốt giúp cải thiện sức
khoẻ đường ruột. Tinh bột kháng đóng vai trò như một chất xơ, có lợi cho sự tiêu hoá của cơ thể.
Tinh bột kháng xuất hiện tự nhiên trong một số loại thực phẩm như khoai tây, yến mạch, đu đủ, chuối xanh...
Lượng tinh bột kháng thay đổi khác nhau theo nhiệt độ, vì vậy yến mạch, chuối xanh sẽ mất một phần tinh bột
kháng khi nấu chín. Một số loại tinh bột kháng khác lại được tạo ra trong quá trình nấu và làm nguội như cơm
nguội có hàm lượng tinh bột kháng cao hơn cơm nóng. Ngoài ra, tinh bột tự nhiên khi được bổ sung maltogenic
amylase, một loại enzyme có chức năng thuỷ phân tinh bột thành maltose thì thu được tinh bột biến tính. Đây cũng
là một loại tinh bột kháng do maltogenic amylase kéo dài thời gian thuỷ phân tinh bột thành glucose giúp làm
chậm quá trình tiêu hoá. 1
Pham Van Trong Education Bài tập đúng-sai hóa học nâng cao
a) Chuối xanh, yến mạch, đu đủ, khoai tây có hàm lượng tinh bột kháng cao.
b) Tinh bột kháng do không bị thuỷ phân thành glucose ở ruột non mà lên men trong ruột già nên tạo ra ít
năng lượng hơn so với tinh bột bình thường, giúp hạn chế tình trạng béo phì và ổn định lượng đường huyết,
hạn chế bệnh đái tháo đường.
c) Tinh bột kháng giúp ruột kết khoẻ mạnh nhờ các vi khuẩn tốt trong ruột già có tác dụng biến tinh bột kháng
thành các acid béo chuỗi ngắn. Đây là nguồn năng lứợng “ưa thích” của các tế bào ruột kết.
d) Cách đơn giản để tăng lượng tinh bột kháng trong khẩu phần ăn hằng ngày là để nguội các thực phẩm
chứa tinh bột đã được nấu chín như cơm, mì trong tủ lạnh qua đêm hoặc bổ sung thêm men maltogenic
amylase vào tinh bột tự nhiên.
Câu 4: DHA (Docosahexaenoic acid) là một acid béo rất cần thiết cho sự phát triển trí não, thị giác của con người,
giúp tăng khả năng miễn dịch và giảm nguy cơ phát triển dị ứng của trẻ. Oleic acid rất tốt cho việc hỗ trợ các vấn
đề tim mạch, kiểm soát lượng đường nạp vào trong cơ thể, đồng thời cũng là chất chống oxy hóa hiệu quả. Cho
cấu trúc của DHA và olecic aicd như hình sau :
a) DHA thuộc nhóm acid béo omega-3.
b) Do có tương tác van der Waals mạnh hơn oleic acid, nên DHA có nhiệt độ nóng chảy cao hơn oleic acid.
c) Phần trăm khối lượng nguyên tố carbon trong DHA là 80,49%.
d) Phân tử DHA có cấu hình dạng trans.
Câu 5: Trong tinh dầu của nhiều loại thảo mộc chứa các alcohol có bậc khác nhau. Những alcohol này có mùi
thơm dễ chịu nên được sử dụng phổ biến làm hương liệu, mĩ phẩm. Công thức của một số alcohol có trong thảo
mộc được cho dưới đây.
a) Các hợp chất trên đều thuộc vào alcohol không no, đơn chức.
b) Độ bất bão hòa trong phân tử citronellol và trong menthol bằng nhau.
c) Tên gọi theo danh pháp thay thế của geraniol là 3,7,7-trimethylpenta-2,6-dien-1-ol.
d) Phân tử terpineol có chứa 10,25% oxygen về khối lượng
Câu 6: Một nhóm học sinh tiến hành thí nghiệm mạ đồng (copper) lên chiếc chìa khoá. Giả
thuyết được nhóm học sinh này đưa ra là: "Nồng độ của dung dịch CuSO4 trước và sau quá trình mạ là không đổi".
Để kiểm chứng giả thuyết, nhóm học sinh tiến hành các bước như sau:
- Bước 1: Cân để xác định khối lượng ban đầu của chiếc chìa khoá là 10 gam và của thanh đồng nguyên chất là 15 gam.
- Bước 2: Nối chiếc chìa khoá với 1 điện cực và thanh đồng với điện cực còn lại của nguồn điện
một chiều rồi nhúng vào cốc chứa dung dịch CuSO4 để tiến hành mạ với hiệu điện thế thích hợp (như hình vẽ): 2
Pham Van Trong Education Bài tập đúng-sai hóa học nâng cao
- Bước 3: Sau thời gian 15 phút điện phân, lấy chiếc chìa khoá và thanh đồng ra khỏi cốc, làm khô cẩn thận, đem
cân thì thấy khối lượng của chiếc chìa khoá là 10,32 gam, của thanh đồng là 14,68 gam. Biết hiệu suất của quá trình đạt 100%.
a) Thanh đồng được nối với cực âm, chiếc chìa khoá được nối với cực dương của nguồn điện.
b) Tại cathode xảy ra quá trình khử ion Cu2+, tại anode xảy ra quá trình oxi hoá Cu.
c) Do khối lượng của thanh đồng giảm nên giả thuyết ban đầu của nhóm học sinh là sai.
d) Sau khi mạ xong, độ giảm khối lượng của thanh đồng bằng độ tăng khối lượng của chiếc chìa khoá.
Câu 7: Một nhóm học sinh nghiên cứu hệ cân bằng:
2NO2 (g, nâu đỏ)
N2O4 (g, không màu) (*)
Dữ liệu thực nghiệm về nồng độ các khí trước và sau khi hệ đạt trạng thái cân bằng ở 25oC được nhóm học sinh
ghi lại ở bảng dưới đây:
Nồng độ ban đầu (mol/L)
Nồng độ trạng thái cân bằng (mol/L) Thí nghiệm C C [NO NO 2] [N2O4] 2 N2O4 1 0,0000 0,6700 0,0547 0,6430 2 0,0500 0,4460 0,0457 0,4480 NO22
a) Giá trị của biểu thức
gọi là hằng số cân bằng K của phản ứng (*) đang nghiên cứu. N O C 2 4
b) Hằng số cân bằng K của hai thí nghiệm trên có giá trị bằng nhau (kết quả làm tròn đến hàng đơn vị). C N O 2 4
c) Nếu thực hiện khảo sát cân bằng này ở 70oC thì giá trị biểu thức
của phản ứng không thay đổi. NO 2 2
d) Nhóm học sinh ngâm hệ cân bằng trên vào nước đá thấy màu nâu đỏ nhạt màu dần chứng tỏ phản ứng theo chiều thuận có o H > 0 . r 298
Câu 8: Cho các quá trình tạo phức chất bát diện sau:
Fe3+ + 6H2O ⇌ [Fe(OH2)6]3+ (aq) (1)
[Fe(OH2)6]3+ + SCN- ⇌ [Fe(OH2)5(SCN)]2+ + H2O; Kc = 1,4×102 (2)
[Fe(OH2)6]3+ + F- ⇌ [Fe(OH2)5F]2+ + H2O; Kc = 2,0×105 (3)
Biết các dung dịch: [Fe(OH2)6]3+ màu vàng nâu, [Fe(OH2)5(SCN)]2+ có màu đỏ, [Fe(OH2)5F]2+ và các anion SCN-
, F- đều không có màu. Khi hằng số Kc càng lớn, phức chất tạo ra càng bền (phản ứng thuận chiếm ưu thế).
a) Trong các quá trình (1), (2) và (3), mỗi phân tử H2O hoặc anion SCN- hay anion F- đều sử dụng số cặp
electron hoá trị riêng như nhau để cho vào orbital trống của cation Fe3+.
b) [Fe(OH2)6]3+ là phức chất aqua của ion kim loại chuyển tiếp.
c) So với anion F-, anion SCN- dễ thay thế phối tử H2O trong [Fe(OH2)6]3+ hơn.
d) Khi cho từ từ dung dịch KSCN vào dung dịch ở quá trình (3) thì dung dịch này sẽ có màu đỏ.
Câu 9: Ammonia có nhiều ứng dụng quan trọng trong đời sống và sản xuất. Trong công nghiệp, ammonia được
tổng hợp từ nitrogen và hydrogen theo phương trình phản ứng: N2(g) + 3H2(g) ⇌ 2NH3(g) (1). Kết quả nghiên cứu
sự phụ thuộc của hiệu suất phản ứng tổng hợp ammonia vào áp suất và nhiệt độ được thể hiện trong giản đồ ở bên.
Cho biết mỗi phát biểu sau là đúng hay sai?
a) Phản ứng (1) thực hiện ở nhiệt độ cao nên là phản ứng thu nhiệt.
b) Hiệu suất của phản ứng ở 500°C, 300 atm cao hơn hiệu suất ở 450°C, 200 atm.
c) Ở nhiệt độ 500°C, 250 atm, 2 mol N2 tác dụng với 3 mol H2 thu được 0,6 mol NH3.
d) Khi tăng áp suất thì cân bằng của phản ứng (1) chuyển dịch theo chiều thuận.
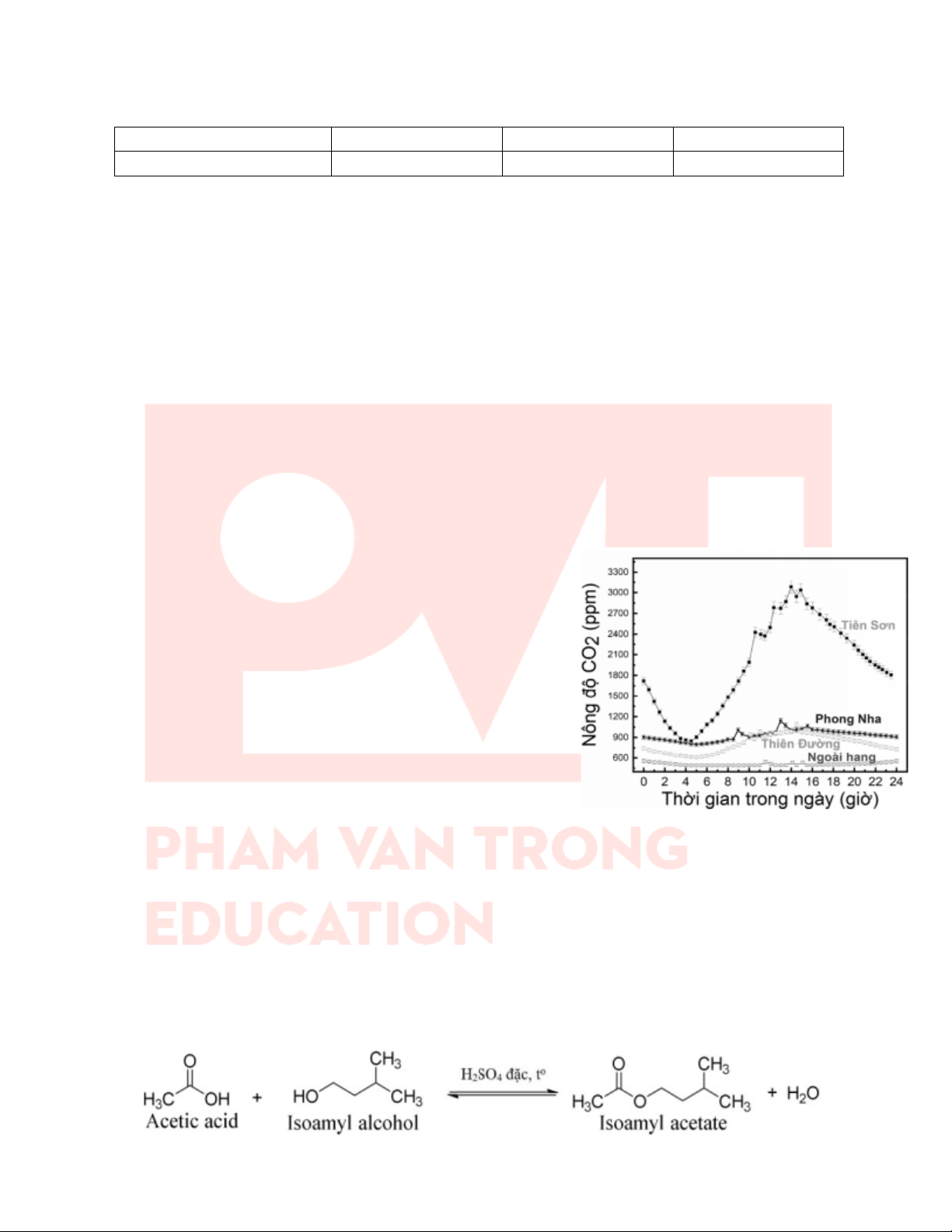
Câu 10: Trong một nghiên cứu nguồn gốc sự biến đổi hàm lượng khí CO2 và động học quá trình thành tạo nhũ đá
trong hệ thống hang động Vườn Quốc gia Phong Nha - Kẻ Bàng phục vụ phát triển du lịch bền vững đã xác định
“mối liên hệ giữa sự hình thành thạch nhũ và nguồn gốc CO2”, được tiến hành như sau: 3
Pham Van Trong Education Bài tập đúng-sai hóa học nâng cao
• Phân tích mối liên hệ giữa đồng vị δ¹³C thạch nhũ và mẫu đá gốc (là mẫu đá vôi nguyên thủy tại khu vực hang
động, chưa bị hòa tan hay tác động bởi dòng nước hoặc sinh học).
• Phân tích đồng vị δ¹³C là một phương pháp quan trọng trong địa hóa học và môi trường dùng để xác định nguồn
gốc carbon trong các vật chất.
+ Ý nghĩa giá trị đồng vị δ¹³C: Nguồn
Giá trị đồng vị δ¹³C (‰ VPDB)
Carbon vô cơ (đá vôi, trầm tích biển) ~0% đến +2%
Carbon hữu cơ (thực vật, CO2 sinh học) -10% đến -30% CO2 khí quyển khoảng -7% đến -8%
+ Kết quả phân tích đồng vị δ¹³C của mẫu thạch nhũ và đá gốc (‰ VPDB) trong nghiên cứu: Hang Thiên Đường Động Phong Nha Hang Tiên Sơn Mẫu thạch nhũ Cửa hang Giữa hang Cuối hang Mẫu đá gốc –0,47 –10,96 –9,94
Cho biết mỗi phát biểu sau là đúng hay sai?
a) Phương trình Ca(HCO3)2 ⇌ CaCO3 + CO2 + H2O có thể được sử dụng để giải thích vấn đề hình thành
thạch nhũ trong hang động.
b) Tăng khí CO2 do các hoạt động du lịch sẽ làm giảm khả năng kết tủa tạo thạch nhũ nên cần có biện pháp
để phát triển du lịch bền vững tại Phong Nha - Kẻ Bàng.
c) Một giả thuyết phù hợp với mục tiêu của nghiên cứu trên là: “nếu môi trường hang động có nhiều nguồn
làm tăng CO2 sinh học (như hô hấp của thảm thực vật bề mặt và du khách tham quan) thì giá trị δ¹³C của
thạch nhũ sẽ giảm xuống”.
d) Phân tích dữ liệu từ kết quả phân tích, cho thấy δ¹³C trong thạch nhũ có giá trị âm hơn rất nhiều với δ¹³C
trong đá gốc, chứng minh rằng CO2 từ môi trường sinh học không ảnh hưởng đến quá trình hình thành thạch nhũ.
Câu 11: Trên bao bì một số sản phẩm được làm từ polymer X có kí hiệu như hình bên.
a) Trong công nghiệp, PVC được sản xuất từ ethylene với hiệu suất gia định cho từng
bước theo sơ đồ sau: C2H4 → C2H4Cl2 → CH2=CHCl → PVC (hiệu suất lần lượt là 85%,
68%, 79%). Để sản xuất 1,0 tấn PVC theo sơ đồ và hiệu suất trên thì cần dùng 1,2 tấn
ethylene (đã làm tròn kết quả đến hàng phần chục).
b) Polymer X được điều chế bằng phản ứng trùng ngưng vinyl chloride.
c) Kí hiệu 3 mũi tên tạo vòng khép kín có nghĩa sản phẩm làm từ PVC có thể tái chế, tái sử dụng và hạn
chế sử dụng tránh ô nhiễm môi trường.
d) Polimer X là Poly(vinyl chloride) (PVC)
Câu 12: Một thí nghiệm điều chế butyl acetate được tiến hành như sau:
• Bước 1: Cho 64 mL butyl alcohol; 50 mL acetic acid “băng”
(nguyên chất, liquid) vào bình cầu 200 mL, sau đó cho cẩn thận, từ
từ 10 mL dung dịch H2SO4 đậm đặc vào thu được hỗn hợp X.
• Bước 2: Cho “cá tử” vào bình cầu, lắp sinh hàn như hình 1, đun
nóng bằng bếp đun có khuấy từ trong thời gian 3 giờ.
• Bước 3: Cho toàn bộ hỗn hợp trong bình cầu vào phễu chiết, cho
tiếp 50 mL nước cất vào phễu chiết, lắc đều phễu chiết, để yên vài
phút để hỗn hợp tách lớp, sau đó chiết bỏ lớp dưới. Lặp lại một lần nữa.
• Bước 4: Cho 50 mL dung dịch bão hòa sodium hydrogencarbonate vào phễu chiết sau bước 3, lắc đều phễu chiết
nhiều lần, loại bỏ lớp bên dưới. Lặp lại một lần nữa Cho phần còn lại vào cốc 150 mL.
• Bước 5: Cho khoảng 2 muỗng nhỏ calcium chloride khan vào cốc sau bước 4, lắc đều. 4
Pham Van Trong Education Bài tập đúng-sai hóa học nâng cao
• Bước 6: Tách phần hữu cơ sau bước 5 (hỗn hợp Y), cho vào bình cầu và lắp sinh hàn như hình 2. Tiến hành
chưng cất thì thu được butyl acetate có khối lượng là 68,1 gam.
Cho các dữ kiện về các chất: Chất Butyl alcohol Acetic acid (liquid) Butyl acetate
Khối lượng riêng (g/cm³) 0,81 1,05 0,88
Cho biết mỗi phát biểu sau là đúng hay sai?
a) Ở bước 2, lắp sinh hàn như hình 1 để hạn chế sự thất thoát các hóa chất; còn ở bước 6, lắp sinh hàn như
hình 2 là để tinh chế ester.
b) Công thức phân tử của butyl acetate là C6H12O2.
c) Vai trò của calcium chloride khan ở bước 5 là loại bỏ hoàn toàn nước có trong hỗn hợp.
d) Hiệu suất của phản ứng ester hóa này là 67,1%. (đã làm tròn kết quả đến hàng phần chục)
Câu 13: Cho sơ đồ chuyển hóa tạo poly(vinyl chloride) (PVC): monomer X → PVC. Cho biết mỗi phát biểu sau là đúng hay sai?.
a) PVC là một polymer có khả năng hòa tan trong nước do có nhóm -Cl phân cực.
b) Phản ứng tạo PVC từ X là một phản ứng trùng hợp.
c) Một nhà máy sản xuất sử dụng 518400 tấn X / 1 năm để sản xuất PVC, ban đầu với công nghệ cũ hiệu
suất là 90%, sau đó đã thay đổi nhiệt độ, chất xúc tác ban đầu và một số điều kiện thì hiệu suất tăng lên
95% tức khối lượng PVC tạo ra tăng 25920 tấn / 1 năm.
d) Monomer X có tên thay thế là chloroethane.
Câu 14: Trong một nghiên cứu về “sự biến đổi khí CO2 trong lòng các hang động đá vôi đã và đang khai thác du
lịch tại Vườn Quốc gia Phong Nha - Kẻ Bàng” đã tiến hành như sau:
– Tiến hành quan trắc thực địa và lấy mẫu phân tích trong phòng thí
nghiệm, vào mùa hè khi có lượng khách tham quan đông, ở các hang
động đã và đang khai thác du lịch, bao gồm:
+ Phong Nha: hang thông, có nhiều sông ngầm.
+ Tiên Sơn: hang đóng kín, ít thông gió.
+ Thiên Đường: hang thông, có nhiều suối ngầm.
– Kết quả về “sự biến đổi hàm lượng CO2 theo thời gian trong một
ngày đêm” như đồ thị như hình bên.
Cho biết mỗi phát biểu sau là đúng hay sai?
a) Về phương diện hóa học, sự hình thành thạch nhũ trong
hang động núi đá vôi dựa trên cân bằng hóa học: Ca(HCO3)2 ⇋ CaCO3 + CO2 + H2O.
b) Khi nồng độ CO2 tăng, sẽ làm chậm quá trình hình thành thạch nhũ, do đó cần có biện pháp thích hợp
để phát triển du lịch bền vững tại Phong Nha - Kẻ Bàng.
c) Giả thuyết phù hợp với mục đích và quá trình tiến hành nghiên cứu trên là “Nếu có nhiều khách du lịch
tham quan, sẽ làm cho hàm lượng khí CO2 trong các lòng hang động tăng, thì tốc độ hình thành thạch nhũ giảm”.
d) Trong đồ thị trên, vào khoảng thời gian tham quan của khách du lịch (8 – 16h) thì hàm lượng CO2 tăng
mạnh nhất ở những hang thông, thoáng.
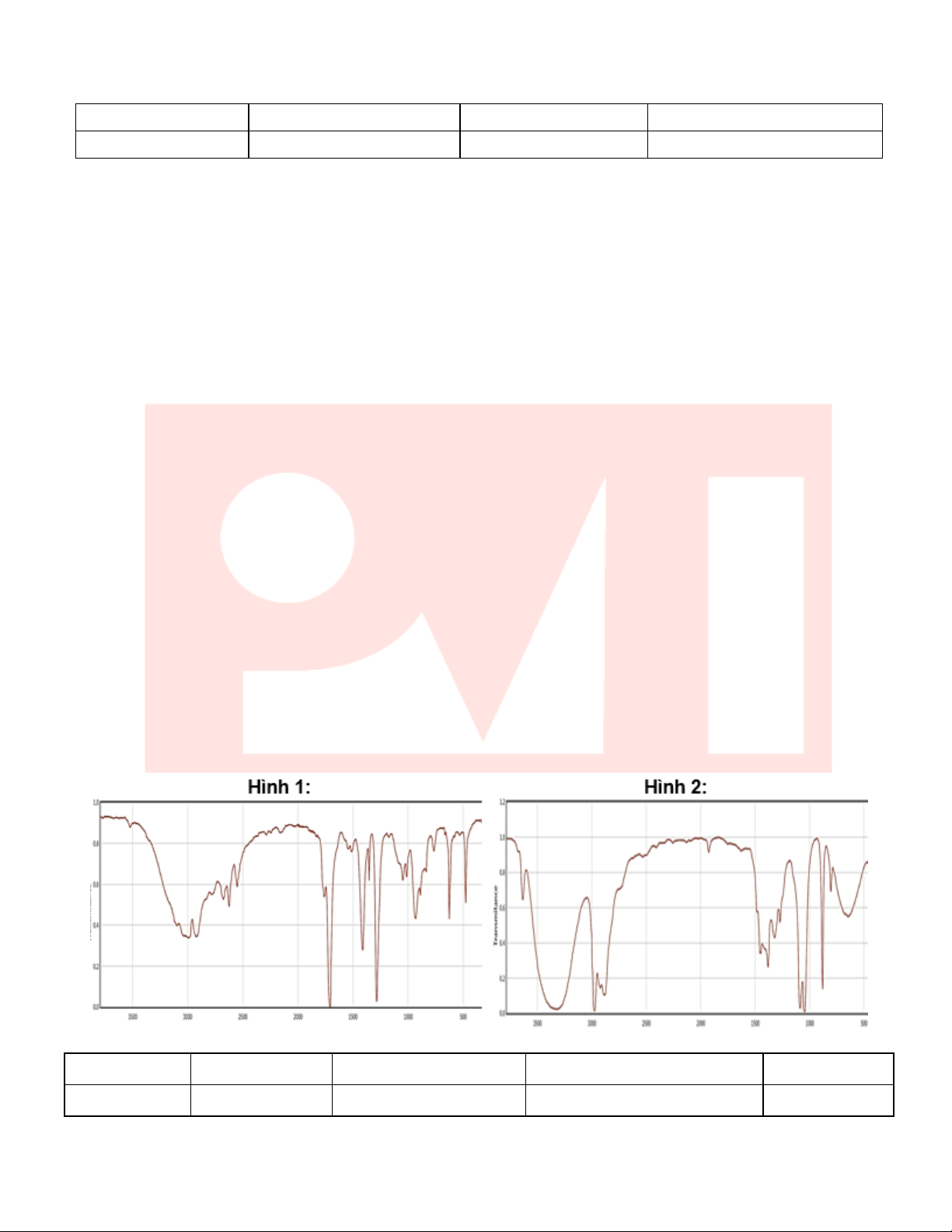
Câu 15: Một học sinh tiến hành tổng hợp chất X (thành phần chính của dầu chuối) từ acetic acid và isoamyl
alcohol theo phương trình hóa học sau: 5
Pham Van Trong Education Bài tập đúng-sai hóa học nâng cao
Sau thí nghiệm, tiến hành phân tách sản phẩm. Ghi phổ hồng ngoại của acetic acid, isoamyl alcohol và isoamyl
acetate. Biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng ngoại như sau: Liên kết O-H (alcohol)
O-H (carboxylic acid) C=O (ester, carboxylic acid) Số sóng (cm⁻¹) 3650 – 3200 3300 - 2500 1780 – 1650
Cho biết mỗi phát biểu sau là đúng hay sai?
a) Phổ hồng ngoại có số sóng hấp thụ ở 1750 cm⁻¹ mà không có số sóng hấp thụ đặc trưng của liên kết O–
H là phổ của isoamyl acetate.
b) Phản ứng tổng hợp trong thí nghiệm này được gọi là phản ứng thủy phân ester.
c) Công thức phân tử của X là C7H14O2.
d) Dựa vào phổ hồng ngoại, có thể phân biệt được acetic acid, isoamyl alcohol và isoamyl acetate.
Câu 16: Khi cháy, sulfur cũng như hợp chất của sulfur tạo khí SO2. Khí SO2 làm mất tím dung dịch thuốc tím theo
sơ đồ phản ứng: SO2 + KMnO4 + H2O ⟶ H2SO4 + MnSO4 + K2SO4. Hàm lượng sulfur cho phép trong xăng là
dưới 0,30% (về khối lượng). Cho biết mỗi phát biểu sau là đúng hay sai?
a) Để kiểm tra hàm lượng lưu hùynh trong một loại xăng, nguời ta đốt cháy hoàn toàn 10,0 gam xăng này,
tạo sản phẩm cháy coi như chỉ gồm CO2, SO2 và H2O, thì lượng sản phẩm cháy này làm mất màu vừa đủ
dung dịch có hòa tan 3,5.10–4 mol KMnO4, tính toán hàm lượng sulfur có trong mẫu xăng trên thấy rằng
đã gấp 1,5 lần hàm lượng cho phép.
b) Trong phản ứng của SO2 và thuốc tím, SO2 đóng vai trò là chất khử.
c) Khi cho SO2 vào dung dịch thuốc tím thì màu tím của dung dịch bị nhạt dần, đồng thời cuối cùng thu
được kết tủa nâu đen.
d) Xăng chứa một lượng nhất định sulfur nên khi sử dụng sẽ tạo khí có thể gây mưa acid.
Câu 17: Tiến hành điều chế ethyl acetate trong phòng thí nghiệm theo các bước sau đây:
• Bước 1: Cho khoảng 5 mL ethanol và 5 mL acetic acid tuyệt đối vào ống nghiệm, lắc đều hỗn hợp.
• Bước 2: Thêm khoảng vài giọt dung dịch H2SO4 đặc, lắc nhẹ để các chất trộn đều với nhau.
• Bước 3: Đặt ống nghiệm vào cốc nước nóng (khoảng 60°C – 70°C) trong khoảng 5 phút, thỉnh thoảng lắc đều
hỗn hợp. Sau đó lấy ống nghiệm ra khỏi cốc nước nóng, để nguội hỗn hợp rồi rót sang ống nghiệm khác chứa 10
mL dung dịch muối ăn bão hòa thì thấy chất lỏng trong ống nghiệm tách thành hai lớp, lớp trên có mùi thơm đặc
trưng. Phản ứng xảy ra trong thí nghiệm theo phương trình hoá học sau:
CH3COOH + C2H5OH ⇋ CH3COOC2H5 + H2O (1); Kc = 4
Cho phổ IR của hai hợp chất hữu cơ trong phản ứng trên như hình dưới đây.
Cho biết số sóng hấp thụ đặc trưng của một số liên kết trên phổ hồng ngoại như sau: Liên kết O–H (alcohol) O–H (carboxylic acid) C=O (ester, carboxylic acid) C–O (ester) Số sóng (cm-1) 3650 – 3200 3300 – 2500 1780 – 1650 1300 – 1000
a) Dung dịch NaCl bão hoà có vai trò làm tăng hiệu suất phản ứng ester hóa. 6
Pham Van Trong Education Bài tập đúng-sai hóa học nâng cao
b) Ban đầu, nếu cho 0,762 mol acetic acid tác dụng với 1 mol ethanol thì khi đạt đến trạng thái cân bằng,
hiệu suất phản ứng ester hóa là 75%.
c) Phổ IR trong hình 1 là của C2H5OH, hình 2 là của CH3COOH.
d) Sulfuric acid đặc vừa là chất xúc tác, vừa có tác dụng hút nước, làm tăng hiệu suất tạo ester.
Câu 18: Một học sinh tiến hành thí nghiệm nghiên cứu sự tạo thành phức chất, phản ứng của phức chất iron(III),
ghi lại hiện tượng quan sát được và đưa ra những nhận định như sau:
- Bước 1: Hòa tan iron(III) sulfate vào ống nghiệm chứa nước thu được dung dịch màu vàng nâu. Sau một thời
gian, thấy có kết tủa màu nâu đỏ trong ống nghiệm.
- Bước 2: Lọc bỏ kết tủa, thêm KSCN (potassium thiocyanate) vào nước lọc thấy dung dịch chuyển sang màu đỏ
máu của các phức chất bát diện chứa từ 1 đến 6 phối tử SCN-.
- Bước 3: Thêm tiếp dung dịch KF dư vào ống nghiệm thấy dung dịch nhạt màu dần và mất màu do tạo phức chất [FeF6]3-.
a) Các phức chất được tạo thành ở bước 2 đều là phức chất trung tính, không mang điện tích.
b) Ở bước 2, xảy ra phản ứng thay thế phối tử H2O bằng phối tử SCN-.
c) Trong thí nghiệm trên, khi tạo phức với ion Fe3+, phối tử là anion tạo luôn ra phức chất có màu đậm hơn
phối tử là phân tử trung hòa.
d) Ở bước 1 đã xảy ra quá trình hình thành và thủy phân phức chất aqua của ion Fe3+.
Câu 19: Đường nghịch chuyển (invert sugar) là hỗn hợp gồm các lượng như nhau của fructose và glucose, được
tạo ra từ quá trình thuỷ phân saccharose. Trong đời sống, đường nghịch chuyển được điều chế ở dạng siro. Loại
đường này được sử dụng rộng rãi trong sản xuất thực phẩm, đồ uống do có khả năng giữ nước cùng với có vị ngọt
cao hơn từ 20% - 25% so với saccharose, mang lại hương vị mới, hữu ích cho sản phẩm. Ví dụ đường nghịch
chuyển có khả năng giữ ẩm tốt hơn saccharose giúp sản phẩm nướng giữ được độ tươi và màu vỏ đẹp, tăng độ
mềm cho các món nướng; bánh kẹo nhờ đó được bổ sung độ ẩm, không bị khô nhanh. Đường nghịch chuyển cũng
giúp siro không có hiện tượng kết tinh lại đường, tạo độ mịn cho các sản phẩm như kem, giúp giảm điểm đóng
băng của kem, nhờ đó kem không bị xuất hiện các vảy đá khi bảo quản, ...
Để sản xuất đường nghịch chuyển, người ta tiến hành đun sôi nhẹ dung dịch saccharose trong chảo lớn với xúc tác
citric acid để làm giảm pH dung dịch xuống 1,6. Ba yếu tố này dẫn đến việc saccharose bị thuỷ phân thành glucose
và fructose. Cuối cùng, dùng NaHCO3 để trung hoà citric acid sau phản ứng.
a) Phương trình hoá học của phản ứng tạo đường nghịch chuyển là: + o H ,t C H O + H O ⎯⎯⎯ →C H O + C H O 12 22 11 2 6 12 6 6 12 6 saccharose glu cos e fructose
b) Đường nghịch chuyển ngọt hơn so với saccharose vì trong đường nghịch chuyển chứa fructose làm tăng độ ngọt của đường.
c) Trong quá trình chế biến mứt, đường nghịch chuyển được hình thành vì có sự hỗ trợ bởi xúc tác là acid có
trong trái cây và nhiệt độ khi đun nóng.
d) Từ 20 tấn saccharose có thể thu được tối đa 21,05 tấn đường nghịch chuyển (làm tròn tới hàng phần trăm)
Câu 20: Ở các cây cầu bê tông, cốt thép (thành phần chính là Fe) có thể bị ăn mòn. Quá trình ăn mòn này bắt đầu như sau: (1) Fe(r) → Fe2+(aq) + 2e
(2) O2(k) + 2H2O(l) + 4e → 4OH-(aq)
Một pin điện đã được thiết lập để xảy ra các phản ứng như quá trình ăn mòn ở trên (ở 25°C). Cho thế điện cực chuẩn ở 25°C:
Fe2+(aq) + 2e ⇋ Fe(r) E° = - 0,44V
O2(k) + 2H2O(l) + 4e ⇋ 4OH-(aq) E° = 0,40V 7
Pham Van Trong Education Bài tập đúng-sai hóa học nâng cao
a) Cho pin hoạt động trong 24h tại điều kiện chuẩn, tạo ra dòng điện không đổi 0,12A Giả sử H2O và O2
dư trong suốt quá trình. Khối lượng Fe bị oxi hóa thành Fe2+ sau 24h pin hoạt động là 3 gam (làm tròn đến hàng đơn vị).
b) Cathode của pin là Fe.
c) Sức điện động của pin (E°pin) ở 25°C bằng 0,84V.
d) Phản ứng xảy ra khi pin hoạt động là 2Fe + O2 + 2H2O → 2Fe2+ + 4OH-
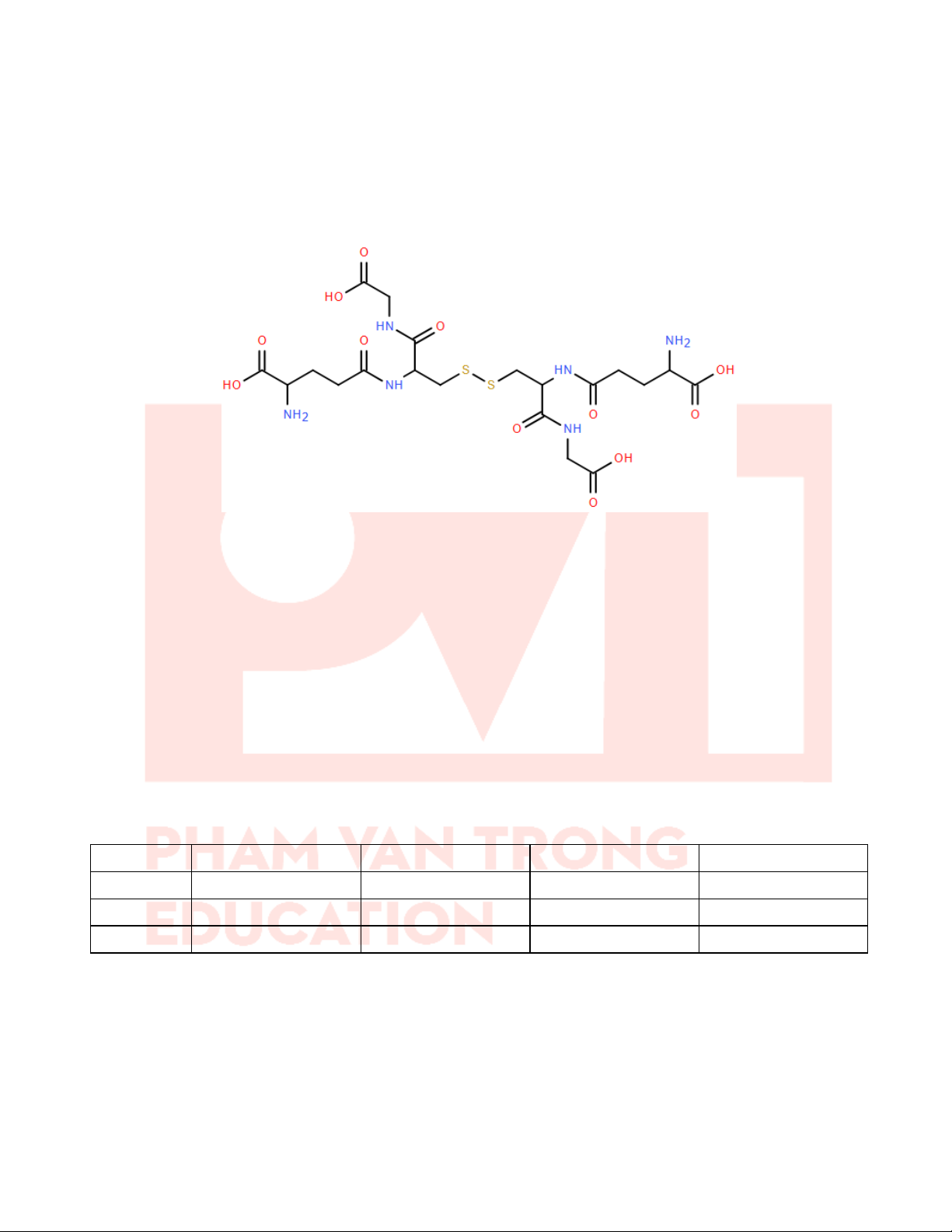
Câu 21: Glutathione disulfide (GSSG) là một hợp chất hình thành do 2 đơn vị Cysteine của peptide glutathione
(GSH) tạo cầu nối disulfide (S-S) với nhau. Cấu tạo của GSSG như hình bên.
Hệ thống GSH/GSSG đóng vai trò rất quan trọng trong việc duy trì cân bằng oxy hóa - khử (redox balance) trong
tế bào. Có thể viết như sau: 2GSH → GSSG + 2H+ + 2e
Mỗi phát biểu bếp dưới là đúng hay sai ?
a) GSH có 3 liên kết peptide, GSSG có 4 liên kết peptide.
b) GSH là tripeptide, GSSG là hexapeptide.
c) GSSG là dạng oxi hóa, GSH là dạng khử.
d) GSSG và GSH đều ở trạng thái rắn ở điều kiện thường (25°C).
Câu 22: Một nhóm học sinh nghiên cứu khoa học, khảo sát về cấu trúc, nguyên tắc hoạt động của Silicagel. Từ
những tham khảo và thí nghiệm khảo sát nhóm đã thu thập được các thông tin sau :
Dữ liệu 1: Silicagel loại dùng để hút ẩm có công thức hóa học là (SiO2.nH2O, n < 2) có cấu trúc gồm hàng triệu
lỗ nhỏ li ti (micropores và mesopores). Diện tích bề mặt nội tại rất lớn: khoảng 700–800 m²/gram, đủ để “giữ” lại nhiều phân tử nước.
Dữ liệu 2: Silica gel hút ẩm có nhiều loại khác nhau, phù hợp với từng ứng dụng cụ thể, phổ biến trên thị trường
là: Hạt hút ẩm silicagel trong (WSG), hạt hút ẩm silicagel xanh (BSG), hạt hút ẩm silicagel cam (OSG). Loại Giá thành (1 kg) Chất chỉ thị Màu dạng khô Màu dạng hút ẩm WSG 90K Không Trắng trong/đục Trắng trong/đục BSG 450K CoCl2 Xanh dương Hồng OSG 1200K Methyl Violet Cam Xanh lá
Mỗi phát biểu bên dưới là đúng hay sai ?
a) OSG thuộc loại chỉ thị acid - base thay đổi màu theo pH.
b) Dựa vào cấu trúc silicagel, khả năng hấp phụ lớn nước được giải thích dựa trên tổng diện tích bề mặt
lớn và khả năng tạo liên kết cộng hóa trị giữa silicagel với các phân tử nước.
c) Loại BSG và OSG có dùng chỉ thị, hai loại này khi hấp phụ nước, hình thành phức chất aqua nên đổi
màu, nhờ đó biết được mức độ hấp phụ, phát hiện nước.
d) Giá thành có sự chênh lệch khá lớn: loại WSG có giá rẻ nhất do không thêm chất chỉ thị; loại OSG giá
đắt nhất do dùng chỉ thị an toàn, còn BSG chỉ thị chứa kim loại nặng, có nguy cơ độc hại nên giá thành vừa phải. 8
Pham Van Trong Education Bài tập đúng-sai hóa học nâng cao
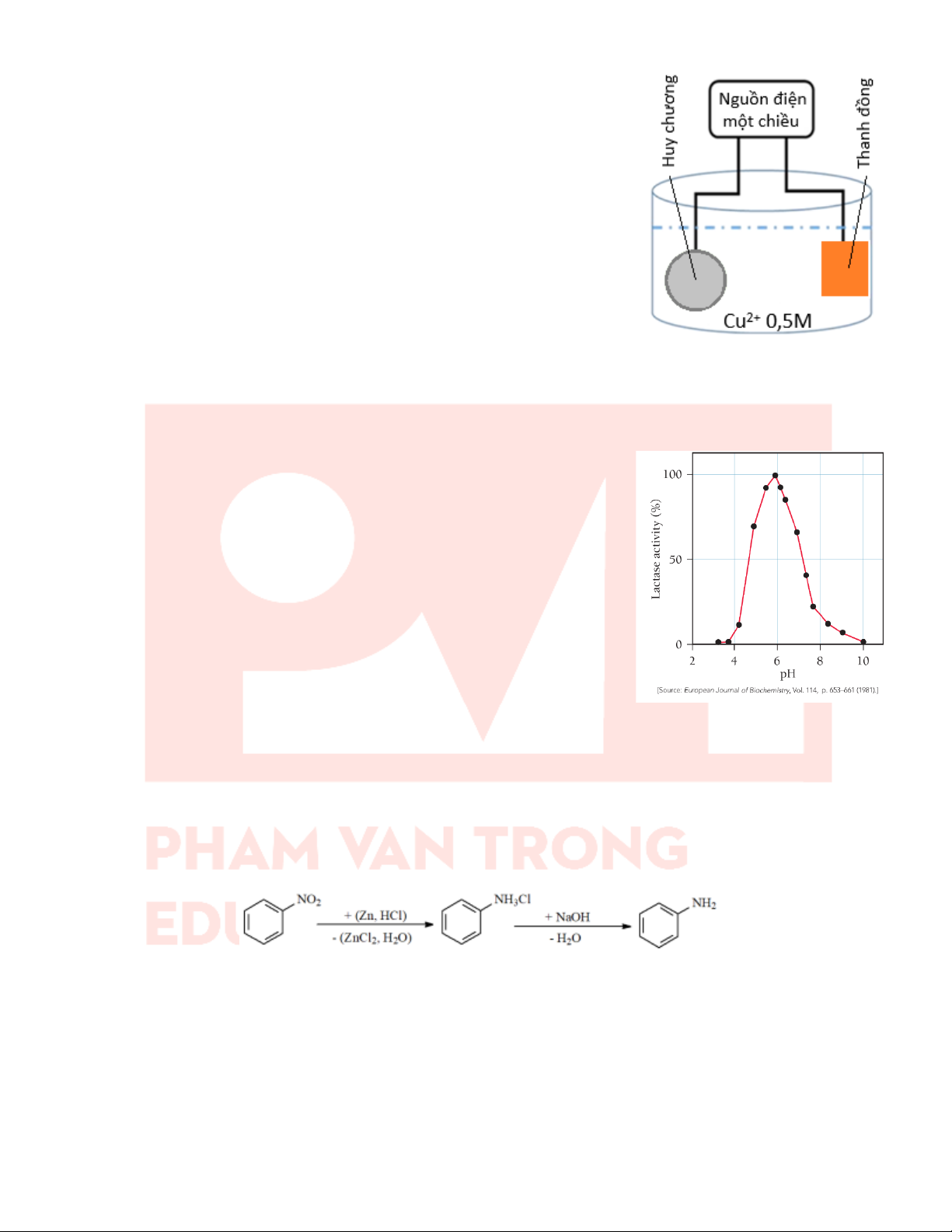
Câu 23: Quá trình điện phân để mạ đồng lên tấm huy chương hình trụ, đáy
tròn với bán kính 2,5 cm, chiều cao hình trụ 0,3 cm với lớp mạ dày 0,05 cm
được mô tả như hình sau:
Tiến hành điện phân dung dịch CuSO4 0,5M với cường độ dòng điện không
đổi 1,5A, khi kết thúc điện phân (quá trình mạ hoàn thành) thì thời gian là t
giây. Biết khối lượng riêng của copper là 8,95 g/cm³ và hiệu suất điện phân là
100%, giả thiết lớp mạ huy chương dày như nhau, toàn bộ lượng copper tạo
ra đều bám hết vào tấm huy chương. Cho hằng số Faraday F = 96500, π = 3,14.
a) Trong quá trình mạ điện tại điện cực anode không có khí thoát ra.
b) Chiều dòng electron di chuyển từ huy chương được mạ qua dây dẫn đến thanh đồng.
c) Giá trị t là 41018 (Kết quả làm tròn đến hàng đơn vị).
d) Thanh đồng là cathode, huy chương được mạ sẽ đóng vai trò anode.
Câu 24: Lactose là một loại đường disaccharide có trong sữa. Lactose gồm hai monosaccharide là galactose và
glucose, được nối với nhau bằng liên kết β-1,4-glycoside. Khi lactose được tiêu hóa, liên kết glycoside giữa
galactose và glucose bị thủy phân. Enzyme chịu trách nhiệm về thủy phân lactose là lactase, được tìm thấy ở ruột
non (pH ruột non trong khoảng 5-7).
Hàng triệu người thiếu lượng lactase cần thiết, và kết quả là họ gặp
phải tình trạng không dung nạp lactose. Nếu thiếu lượng lactase thì lactose
bị thủy phân không hết, nó vẫn còn trong ruột. Vi khuẩn trong ruột lên men
đường lactose, gây ra nhiều triệu chứng khó chịu như như khó tiêu, chuột rút
và đầy hơi. May mắn thay, các chế phẩm thương mại có thể cho phép những
người không dung nạp lactose tiêu thụ và tiêu hóa các sản phẩm sữa như
bình thường mà không bị triệu chứng khó chịu.
Hoạt động của enzyme Lactase, giống như hầu hết các enzyme, rất
nhạy cảm với độ pH. Hình bên minh họa hoạt động của lactase bị ảnh hưởng
như thế nào bởi pH của dung dịch.
a) Lactose chứa liên kết β-1,4-glycoside hình thành giữa nhóm
hydroxyl trên C-1 của galactose và C-4 của glucose.
b) Lactose có thể tồn tại cả dạng vòng và dạng mở vòng.
c) Enzyme lactase hoạt động tối ưu ở pH gần bằng 6. Nếu pH dưới 5 hoặc trên 7 thì hoạt động của enzyme lactase giảm mạnh.
d) Những người gặp phải tình trạng không dung nạp lactose sẽ vĩnh viễn không sử dụng được sữa.
Câu 25: Aniline (nhiệt độ nóng chảy –6,3°C; nhiệt độ sôi 184,13°C, độ tan là 3,6 g/100g nước ở 20°C) là hóa chất
được sử dụng nhiều trong lĩnh vực phẩm nhuộm, dược phẩm. Trong phòng thí nghiệm, quá trình điều chế aniline
từ nitrobenzene được thực hiện theo sơ đồ phản ứng sau:
a) Trong phản ứng khử nitrobenzene bằng (Zn + HCl), tác nhân khử là hydrogen mới sinh [H].
b) Nitrobenzene được điều chế trực tiếp từ benzene bằng phản ứng nitro hóa.
c. Phương pháp có thể sử dụng để tách aniline ra khỏi hỗn hợp sau kiềm hóa là phương pháp chiết lỏng – lỏng.
d) Độ tan của aniline trong nước lớn hơn độ tan của aniline trong dung dịch acid và dung dịch kiềm.
Câu 26: Tiến hành thí nghiệm theo các bước sau:
• Bước 1: Cho một nhúm bông (khoảng 2 gam) vào cốc chứa 20 mL dung dịch H2SO4 70%, dùng đũa thủy tinh
khuấy nhẹ cho đến khi bông tan hết, thu được dung dịch (1).
• Bước 2: Thêm tiếp dung dịch NaOH 1M vào dung dịch (1) cho đến khi quỳ tím chuyển sang màu xanh. Thêm
khoảng 1 mL dung dịch CuSO4 5% vào và 1 mL dung dịch NaOH 1 M nữa, thu được dung dịch (2). 9
Pham Van Trong Education Bài tập đúng-sai hóa học nâng cao
• Bước 3: Ngâm cốc đựng dung dịch (2) trong nồi nước nóng trong khoảng thời gian 10 phút.
a) Sau bước 2, dung dịch thu được có màu xanh lam.
b) Phản ứng thủy phân cellulose xảy ra ở bước 1.
c. Sau bước 3, trong cốc xuất hiện kết tủa màu đỏ gạch.
d) Tại bước 1, có thể thay dung dịch H2SO4 70% bằng dung dịch H2SO4 98% thì kết quả các bước sau tương tự.
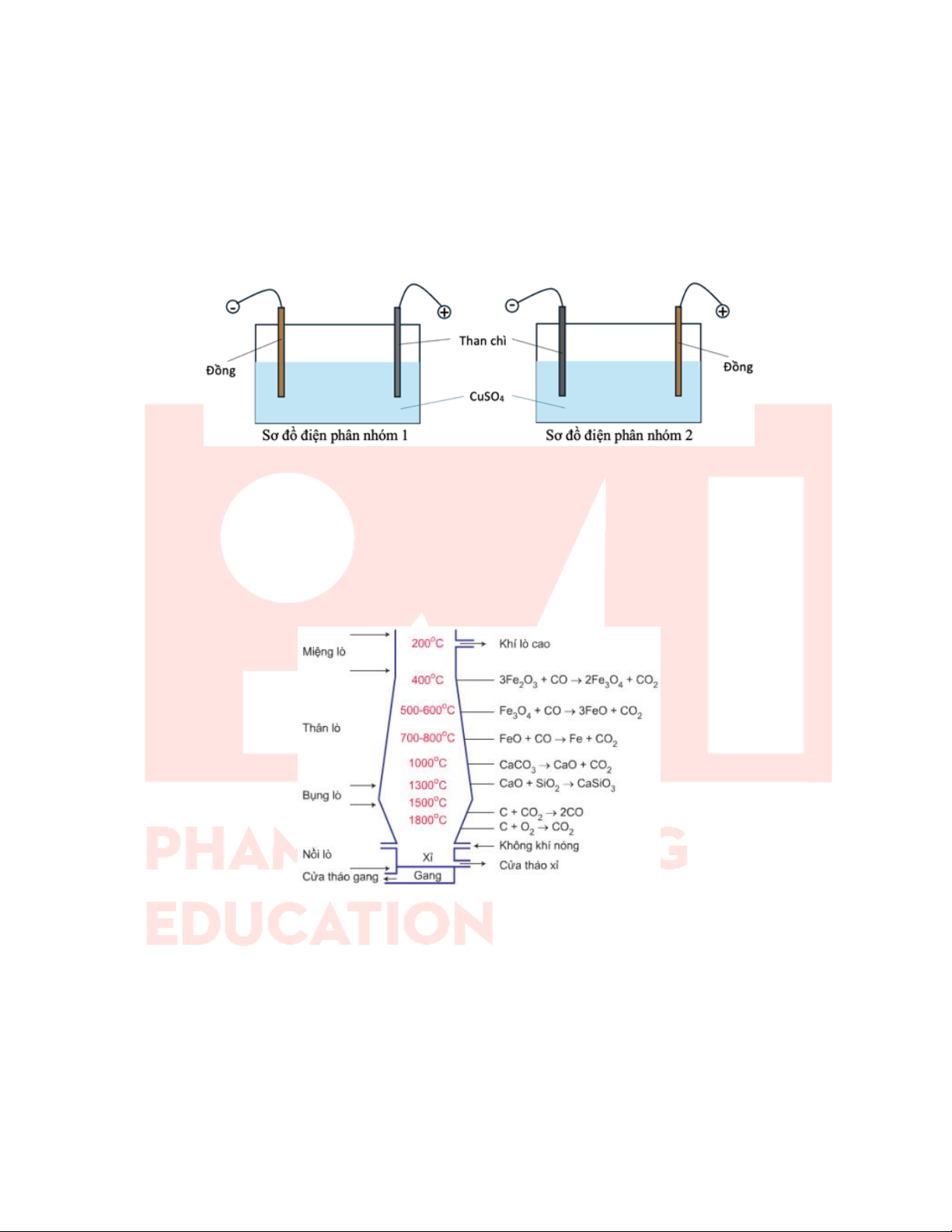
Câu 27: Hai nhóm học sinh tiến hành thí nghiệm điện phân dung dịch CuSO4 với một điện cực than chì và một
điện cực bằng đồng (bỏ qua sự thay đổi thể tích của dung dịch khi điện phân).
Nhóm 1: Nối điện cực than chì với cực dương và điện cực đồng với cực âm của nguồn điện.
Nhóm 2: Nối điện cực than chì với cực âm và điện cực đồng với cực dương của nguồn điện.
Hai nhóm đều đưa ra giả thuyết sau: trong quá trình điện phân, nồng độ ion Cu2+ giảm dần ứng với màu xanh của dung dịch nhạt dần.
a) Ở nhóm thứ hai, tại anode xảy ra quá trình oxi hoá đồng.
b) Đối với cả hai nhóm đều có kim loại đồng bám vào cathode.
c) Ở nhóm thứ nhất, pH của dung dịch điện phân giảm dần.
d) Giả thuyết đúng với nhóm thứ nhất và sai với nhóm thứ hai.
Câu 28: Gang là hợp kim chứa khoảng 95% sắt, 2% đến 5% carbon và một số nguyên tố khác. Gang được sản
xuất trong lò cao với nhiều phản ứng xảy ra liên tiếp nhau như hình sau
a) Quặng sắt dùng sản xuất gang là quặng hematit (thành phần chính là Fe2O3) và manhetit (thành phần chính là Fe3O4).
b) Gang được tạo ra ở nhiệt độ 800°C.
c. Xỉ có thành phần chính là CaSiO3 và có khối lượng riêng nhẹ hơn gang.
d) Để sản xuất thép người ta sử dụng nguyên liệu là sắt thép phế liệu (chứa 75% Fe, 23% Fe2O3 và 2% C)
phối trộn với gang (chứa 95% Fe và 5% C). Nếu trộn 3,5 tấn sắt thép phế liệu với 6 tấn gang thì sẽ luyện
được loại thép chứa 1,6%C. Biết phản ứng trong lò luyện thép như sau: 2Fe2O3 + 3C → 4Fe + 3CO2.
Câu 29: Trong phương pháp nấu rượu gạo truyền thống, gạo được nấu chín, để nguội, rắc men rồi trộn đều, ủ kín
3 - 5 ngày. Khi ngửi thấy mùi thơm, thêm nước và ủ kín 1 - 2 tuần, thu được hỗn hợp chủ yếu gồm: ethanol, nước và bã rượu.
Các phản ứng hóa học xảy ra trong quá trình trên là :
- Thủy phân tinh bột: (C6H10O5)n + nH2O (enzyme) → nC6H12O6 10
Pham Van Trong Education Bài tập đúng-sai hóa học nâng cao
- Lên men rượu: C6H12O6 (enzyme) → 2C2H5OH + 2CO2
(Biết: Độ rượu là % thể tích ethanol trong rượu (hỗn hợp ethanol và nước), khối lượng riêng của ethanol là 0,8 g/mL).
a) Khối lượng của ethanol có trong 1,5 lít rượu 30º là 450 gam (làm tròn đến hàng đơn vị).
b) Công thức phân tử của ethanol là C2H6O.
c) Phương pháp điều chế ethanol bằng cách trên được gọi là phương pháp sinh học.
d) Để tách rượu (hỗn hợp ethanol và nước) ra khỏi hỗn hợp trên, người ta sử dụng phương pháp chưng cất là phù hợp nhất.
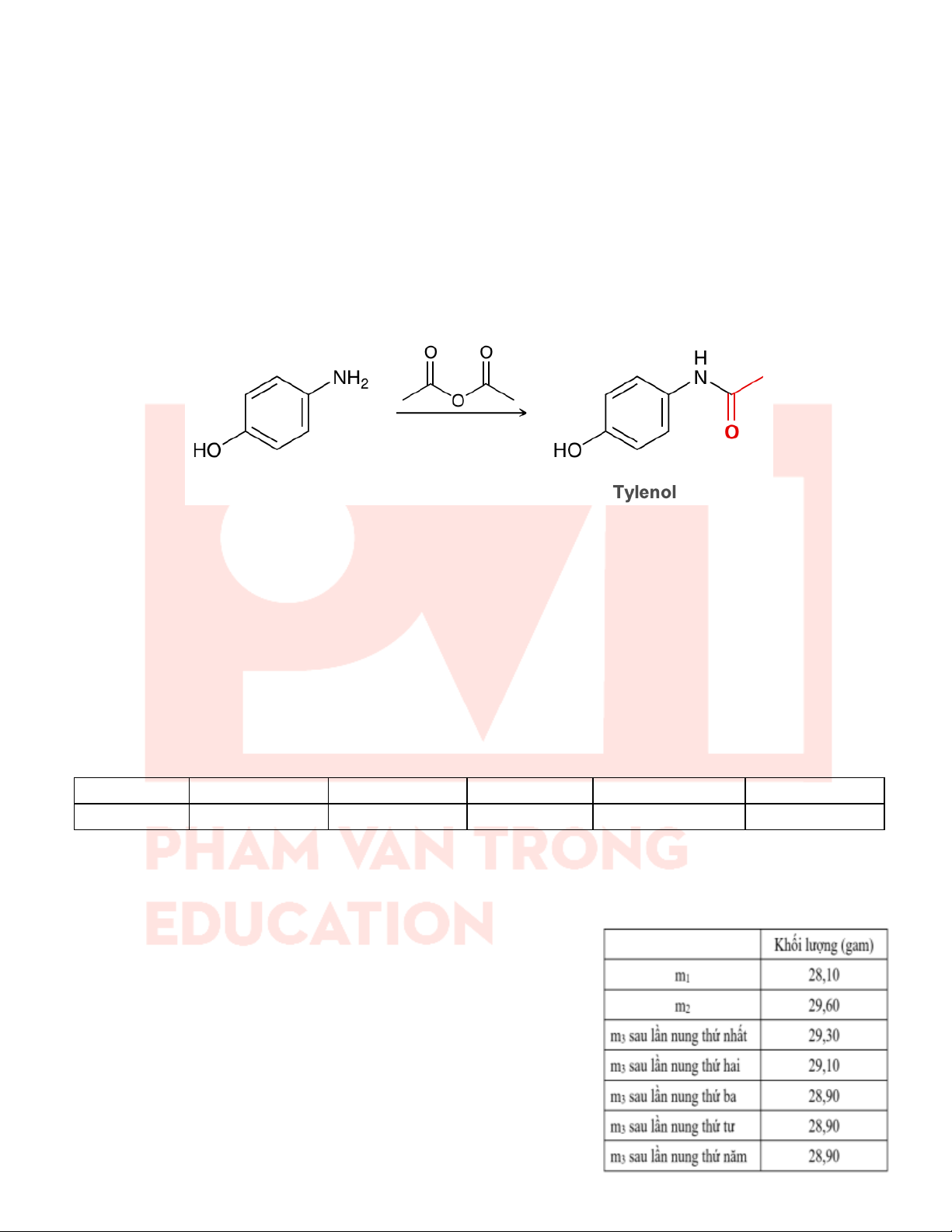
Câu 30: Tylenol 500mg (1 viên chứa 500 mg thuốc Tylenol tinh khiết) là tên thương hiệu của dược chất
acetaminophen, thuốc giảm đau, hạ sốt, chống viêm không steroid. Thuốc được bào chế dưới dạng viên nén dài,
bao gồm thành phần chính là Paracetamol. Tylenol được điều chế từ p-aminophenol và acetic anhydride theo sơ đồ sau
a) Tylenol chứa liên kết peptide.
b) 1 mol Tylenol phản ứng với tối đa 2 mol NaOH
c) Phản ứng điều chế Tylenol là phản ứng ester hóa.
d) Để sản xuất 10 nghìn hộp thuốc, mỗi hộp chứa 325 viên Tylenol 500mg cần 1564 kg p-amino phenol.
Cho hiệu suất cả quá trình là 75% (làm tròn kết quả đến hàng đơn vị)
Câu 31: Một nhóm học sinh tiến hành thí nghiệm đo pH để so sánh tính base của một số amine và ammonia trong
dung môi nước với giả thuyết “Khi tăng số lượng carbon trong phân tử amine thì tính base của amine tăng làm cho
pH của dung dịch tăng”. Nhóm học sinh tiến hành như sau :
• Bước 1: Chuẩn bị các cốc chứa dung dịch có nồng độ 0,1M của các chất NH3, CH3NH2, CH3CH2NH2, (CH3)2NH
và CH3CH2CH2NH2 đều ở 25°C.
• Bước 2: Dùng thiết bị đo pH để đo giá trị pH của các dung dịch.
• Bước 3: Ghi kết quả đo được ở bảng sau : Dung dịch NH3 CH3NH2 CH3CH2NH2 CH3CH2CH2NH2 (CH3)2NH Giá trị pH 11,1 11,3 11,4 11,5 11,7
a) Từ kết quả thí nghiệm, kết luận giả thuyết ban đầu của nhóm học sinh là chưa đúng.
b) Trong các chất được khảo sát, CH3CH2CH2NH2 có tính base mạnh nhất.
c) Bậc amine không ảnh hưởng đến tính base của amine.
d) CH3NH2 có tên gốc – chức là methylamine.
Câu 32: Khi đun nóng nhẹ ở nhiệt độ phù hợp, lượng nước kết tinh
thường tách ra khỏi hợp chất. Để xác định hàm lượng nước kết tinh
trong muối FeSO4.xH2O (hợp chất A, coi như không lẫn tạp chất) bằng
phương pháp đun nóng, một nhóm học sinh thực hiện thí nghiệm theo các bước sau :
• Bước 1: Cân chén nung và ghi lại khối lượng vào bảng kết quả (m1).
• Bước 2: Thêm một lượng khoảng từ 1,45 gam đến 1,65 gam chất A
(có màu xanh nhạt) vào chén nung. Cân và ghi khối lượng mới của chén nung có chứa A (m2). 11
Pham Van Trong Education Bài tập đúng-sai hóa học nâng cao
• Bước 3: Đặt chén nung chứa A lên lưới tam giác và đun nóng nhẹ trong khoảng 2 phút, tránh đun nóng mạnh
dẫn đến sự phân hủy FeSO4 tạo thành Fe2O3 (có màu đỏ nâu).
• Bước 4: Để nguội cân lại chén nung cùng phần chất rắn (không có màu đỏ nâu) còn lại bên trong, ghi khối lượng (m3).
Lặp lại bước 3 và bước 4 cho đến khi khối lượng cân được ở bước 4 không đổi. Kết quả thí nghiệm của nhóm học
sinh được ghi trong bảng (hình trên).
Dựa vào số liệu, học sinh tính phần trăm lượng nước kết tinh có trong A.
a) Giả thiết phù hợp với mục đích và quá trình tiến hành thí nghiệm trên là “Nếu đun nóng nhẹ mẫu rắn
FeSO4.xH2O, thì nước kết tinh sẽ bị tách ra ở dạng hơi làm cho khối lượng mẫu rắn giảm, nhờ đó xác định
được hàm lượng nước kết tinh”.
b) Chưa có dấu hiệu hình thành iron (III) oxide trong quá trình nung.
c) Phần trăm khối lượng (làm tròn đến hàng phần mười) của nước kết tinh trong muối FeSO4.xH2O xác
định được từ số liệu của thí nghiệm trên là 13,3%.
d) Sự giảm khối lượng của chén nung chứa A là do nước kết tinh tách ra khỏi A và bay hơi.
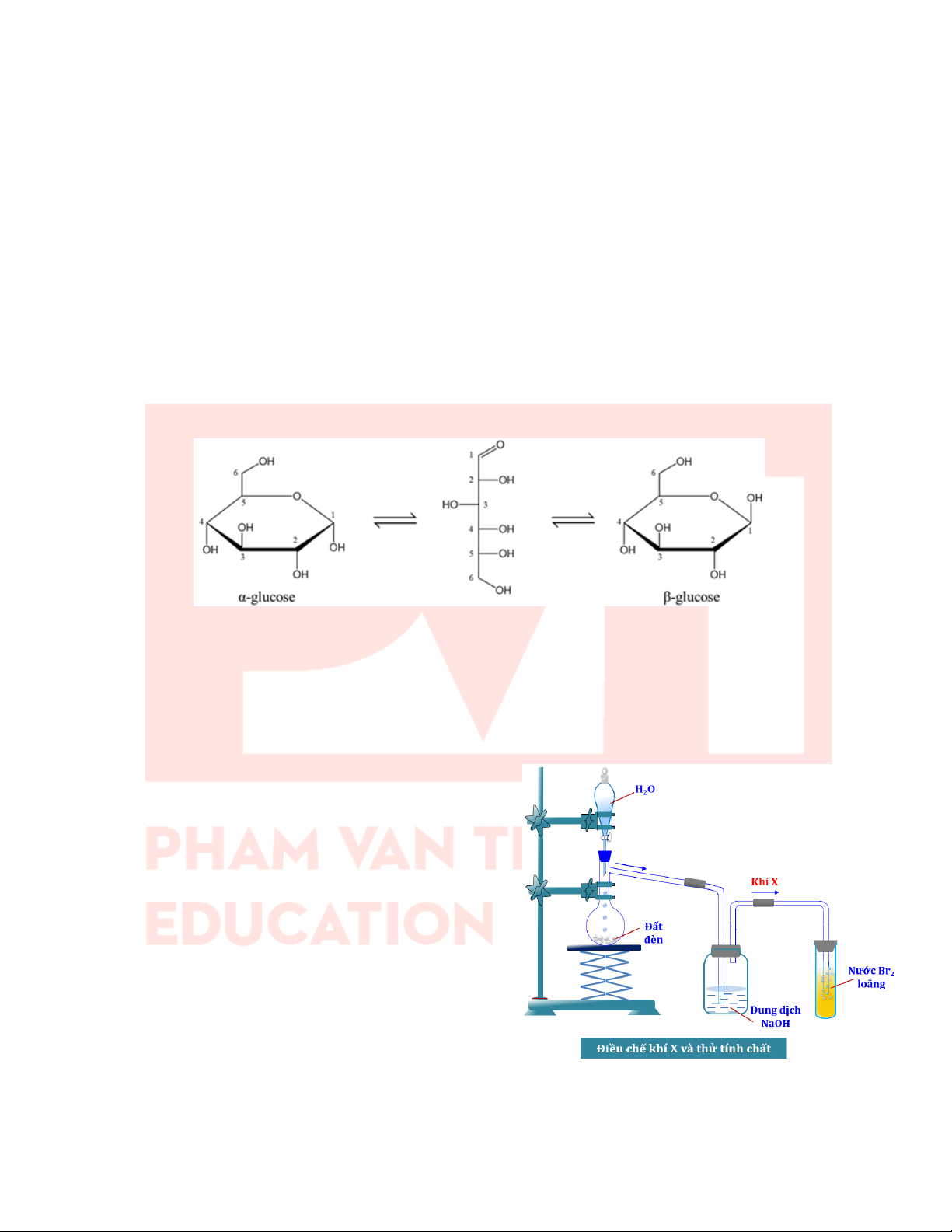
Câu 33: Glucose là loại monosaccharide phổ biến và có nhiều ứng dụng. Glucose tồn tại chủ yếu ở hai dạng mạch
vòng là α-glucose và β-glucose. Trong dung dịch, hai dạng mạch vòng này có thể chuyển hoá lẫn nhau thông qua
dạng mạch hở như hình sau:
a) Dạng α-glucose và β-glucose khác nhau vị trí trong không gian của nhóm -OH hemiacetal.
b) Khi phản ứng với CH3OH (dư) trong HCl thì chỉ có nhóm -OH hemiacetal của α-glucose bị ether hoá.
c) Glucose ở dạng vòng α và β đều không tham gia phản ứng lên men.
d) Khi phản ứng với Cu(OH)2/NaOH ở nhiệt độ thường và Cu(OH)2/NaOH đun nóng thì glucose đều bị oxi hóa.
Câu 34: Thí nghiệm điều chế và thử tính chất hoá học của khí X Tiến hành:
Bước 1: Cho khoảng 5g đất đèn vào bình cầu có nhánh
và cho nước cất vào phễu nhỏ giọt. Lắp dụng cụ như hình
trên (chú ý đuôi của phễu nhỏ giọt không chạm vào chất rắn).
Bước 2: Mở khoá phễu nhỏ giọt để nước chảy từ từ
xuống, khí X sinh ra được sục ngay vào các ống nghiệm
chứa dung nước Br2 đã chuẩn bị ở trên đến khi dung dịch mất màu.
Bước 3: Thay ống dẫn khí thuỷ tinh hình chữ L bằng ống
dẫn thuỷ tinh có đầu vuốt nhọn. Dùng que đóm đang cháy
để đốt khí X sinh ra ở đầu ống dẫn khí.
Hãy cho biết những nhận xét sau về thí nghiệm trên là đúng hay sai?
a) Đất đèn có thành phần chính là Al4C3.
b) Bình chứa dung dịch NaOH dùng để hấp thụ các tạp chất độc hại như phosphine, arsine có mùi sốc (có thể có trong đất đèn).
c) Khí X thoát ra có tên thông thường là ethyne và làm mất màu nước bromine.
d) 1 phân tử X có thể cộng tối đa với 2 phân tử bromine. 12
Pham Van Trong Education Bài tập đúng-sai hóa học nâng cao
Câu 35: Để mạ nickel (Ni) lên iron (sắt – Fe), ta có thể tiến hành theo một trong hai cách sau:
- Cách 1: Nhúng thanh Fe vào dung dịch chứa NiSO4 có nồng độ thích hợp, sau một thời gian sẽ xuất hiện một lớp Ni phủ lên bề mặt Fe.
- Cách 2: Sử dụng kỹ thuật mạ điện bằng cách điện phân dung dịch chứa NiSO4 và H2SO4 với một điện cực là
thanh Fe cần mạ và điện cực còn lại là một thanh Ni.
Cho E°Fe2+/Fe = -0,440V; E°Ni2+/Ni = -0,236V.
a) Trong khoảng thời gian như nhau, cả 2 cách đều xuất hiện lớp Ni phủ trên bề mặt thanh sắt với lượng bằng nhau.
b) Sử dụng cách 1 chỉ mạ được một lớp nickel rất mỏng lên bề mặt thanh sắt và tốc độ của phản ứng giảm nhanh theo thời gian.
c) Cả 2 cách Ni đều đóng vai trò cực âm và xảy ra quá trình oxi hoá.
d) Để mạ lớp Ni (dày 0,2 mm) lên thanh sắt hình trụ có đường kính 5cm, chiều dài 12 cm theo cách 2 với
cường độ dòng điện 8,0A, cần thời gian là 3,83 giờ. Biết khối lượng riêng của Ni bằng 8,91 g/cm³. Làm
tròn đến phàn phần trăm, lấy π = 3,14; F = 96500, Ni = 59.
Câu 36: - Biodiesel (dầu sinh học) là hỗn hợp các methyl ester của acid béo. Có thể chuyển hoá dầu thực vật, mỡ
động vật ((CxHyCOO)3C3H5) thành dầu biodiesel bằng phản ứng với lượng dư methanol, có mặc xúc tác KOH
hoặc NaOH. Thành phần của 100 gam biodiesel được phân tích và cho kết quả sau: C15H31COOCH3 C17H33COOCH3 C17H31COOCH3 C17H29COOCH3 14 gam 23 gam 51 gam 12 gam
- Xăng E5 có chứa 5% ethanol (d = 0,789 g/mL) về thể tích, còn lại là hỗn hợp 2 alkane C8H18 và C9H20 (tỉ lệ mol
tương ứng 4 : 3, d = 0,7 g/mL)
a) Trong 4 methyl ester trên, có 1 methyl ester thuộc loại no, đơn chức, mạch hở.
b) Dầu ăn đã qua sử dụng có thể thu gom để chế tạo dầu biodiesel.
c) Đốt cháy hoàn toàn cùng 1 thể tích dầu biodiesel (khối lượng riêng 0,88 kg/L, có thành phần như trên)
hoặc xăng E5, thì lượng khí CO2 thoát ra của dầu biodiesel nhiều hơn so với xăng E5.
d) Điểm hạn chế của dầu biodiesel là khó dùng ở những nơi có thời tiết lạnh, vì dễ bị đóng thành lớp mỡ.
Câu 37: Cho 2 hydrocarbon dưới đây
A: Limonene có trong tinh dầu cam, chanh
B: Isooctane một thành phần của xăng.
a) A là alkene, B là alkane.
b) A có số nguyên tử carbon nhiều hơn B.
c) Để nhận biết A và B có thể dùng phản ứng với dung dịch bromine hoặc dung dịch KMnO4.
d) B tác dụng với Cl2(as, 1:1) có thể cho tối đa 5 sản phẩm thế monohalogen.
Câu 38: Thuốc mỡ xoa bóp Salymet hỗ trợ điều trị các triệu chứng như nhức mỏi do vận động, sưng đau, tê thấp.
Thành phần trong Salymet có chứa một hợp chất hữu cơ X. Bằng phương pháp phân tích nguyên tố, xác định được
thành phần các nguyên tố của hợp chất X chứa 63,16% carbon, 5,26% hydrogen về khối lượng, còn lại là ôxygen.
Phổ IR của X ngoài vùng hấp thụ với peak đặc trưng của liên kết C=O (số sóng 1750 - 1735 cm-1), liên kết C-O
(số sóng 1300 - 1000 cm-1) còn có peak đặc trưng của liên kết O-H (số sóng 3600 - 3200 cm-1). Dựa vào phổ khối
(MS), xác định được phân tử khối của X là 152 amu. Hợp chất X được điều chế bằng phản ứng giữa một alcohol
Y và một hợp chất hữu cơ Z. (biết rằng Z là hợp chất tạp chức có chứa vòng benzene). Có các phát biểu sau:
a) Y là ethyl alcohol.
b) Tổng số nguyên tử trong phân tử X là 17.
c) Z có nhóm -OH và -COOH. 13
Pham Van Trong Education Bài tập đúng-sai hóa học nâng cao
d) 1 mol Z tác dụng vừa đủ với 1 mol sodium hydroxide.
Câu 39: Trinitroglycerin, C3H5N3O9 (thường được gọi đơn giản là nitroglycerin), đã được sử dụng rộng rãi làm
chất nổ. Alfred Nobel đã sử dụng nó để tạo ra thuốc nổ vào năm 1866. Thật ngạc nhiên, nó cũng được sử dụng
như một loại thuốc để giảm đau thắt ngực (đau ngực do động mạch bị tắc một phần đến tim) bằng cách làm giãn
mạch máu. Ở áp suất 1 bar và nhiệt độ 25 °C, enthalpy phân hủy trinitroglycerin để tạo thành khí nitrogen, khí
carbon dioxide, nước lỏng và khí oxygen là -1541,4 kJ/mol. Cho nhiệt tạo thành chuẩn của CO2, H2O lần lượt là -393,5 kJ/mol ; -285,8 kJ/mol
a) Phương trình hóa học của quá trình phân hủy trinitroglycerin là:
b) Nhiệt tạo thành tiêu chuẩn của trinitroglycerin là -353,6 kJ/mol
c) Liều tiêu chuẩn trinitroglycerin để giảm đau thắt ngực là 0,60 mg. Trong điều kiện chuẩn, nếu toàn bộ
lượng thuốc của một liều tiêu chuẩn được dùng để giảm đau thắt ngực thì năng lượng được giải phóng là
4,1 J (Làm tròn kết quả đến hàng phần mười). Biết trinitroglycerin phân hủy thành khí nitrogen, khí
carbon dioxide, nước lỏng và khí oxygen trong động mạch.
d) Để sản xuất 1 tấn thuốc nổ (chứa 90,8% trinitroglycerin, còn lại là tạp chất trơ) với hiệu suất cả quá
trình 80% cần 460 kg glycerol.
Câu 40: Hệ đệm bicarbonate là một cơ chế cân bằng acid - base, đóng vai trò quan trọng trong hệ đệm của máu.
Cơ chế này giúp điều hòa độ pH của máu, giữ nó trong khoảng an toàn để các cơ quan trong cơ thể hoạt động bình
thường. Dưới sự xúc tác của enzyme carbonic anhydrase, khí carbon dioxide phản ứng với nước để tạo thành
carbonic acid. Acid này sau đó nhanh chóng phân ly thành ion bicarbonate và ion hydrogen (H+). Quá trình này
được biểu diễn như sơ đồ phản ứng sau: CO -
2 + H2O ⇌ H2CO3 ⇌ HCO3 + H+
a) Tăng nồng độ carbon dioxide trong máu sẽ làm cân bằng chuyển dịch về phía tạo ra nhiều H+ và HCO - 3
b) Giảm nồng độ carbon dioxide trong máu sẽ làm cân bằng chuyển dịch về phía tạo ra nhiều carbonic acid.
c) Khi carbon dioxide được thở ra ở phổi, cân bằng chuyển dịch về phía tạo ra nhiều carbonic acid.
d) Khi cơ thể hoạt động mạnh và liên tục, nồng độ carbon dioxide trong máu sẽ tăng, để bù đắp cho sự gia
tăng carbon dioxide, cơ thể sẽ kích thích hô hấp để thải carbon dioxide ra ngoài. 14



