Preview text:
BÀI TẬP HÓA 9 BÀI 10: MỘT SỐ MUỐI QUAN TRỌNG
Bài tập 1. Hãy nêu những ví dụ một dung dịch muối khi tác dụng với một dung dịch khác tạo ra: a) Chất khí b) Chất kết tủa
Viết các phương trình hóa học
Hướng dẫn giải bài tập
a) Tạo ra chất khí, ví dụ muối cacbonat (CaCO3, Na2CO3, NaHCO3,...) hoặc dùng dịch
muối sunfit (Na2SO3) tác dụng với axit (HCl, H2SO4 loãng).
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Na2SO3 + 2HCl → 2NaCl + SO2 + H2O
b) Tạo chất kết tủa, thí dụ dung dịch muối (BaCl2, Ba(NO3)2....) tác dụng với dung dịch
H2SO4 tạo kết tủa BaSO4, hoặc dung dịch muối CuCl2, AlCl3,... tác dụng với kiềm. BaCl2 + H2SO4 → BaSO4 + HCl
CuCl2 + 2NaOH → 2NaCl + Cu(OH)2
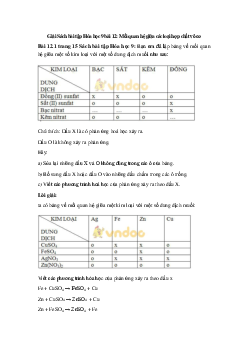
Bài tập 2. Chỉ dùng quỳ tím, nhận biết các dung dịch không màu: NaCl, H2SO4, BaCl2,
KOH được đựng riêng biệt trong các lọ
Hướng dẫn giải bài tập
Trích mẫu thử và đánh số thứ tự
Nhúng quỳ tìm vào 4 dung dịch trên:
Chất làm quỳ tím chuyển màu xanh là KOH
Chất làm quỳ tím chuyển sang màu đỏ là H2SO4
Chất không làm đổi màu quỳ tím là NaCl và BaCl2
Nhỏ dung dịch H2SO4 dã nhận biết được ở trên vào 2 dung dịch NaCl và BaCl2, chất
nào phản ứng tạo kết tủa trắng là BaCl2, còn lại là NaCl không phản ứng với dung dịch H2SO4.
BaCl2 + H2SO4 → BaSO4↓ trắng + HCl
Bài tập 3. Trộn 30 ml dung dịch có chứa 4,44 gam CaCl2 với 70 ml dung dịch có chứa 3,4 gam AgNO3.
a) Tính khối lượng chất rắn sinh ra
b) Tính nồng độ mol của chất còn lại trong dung dịch sau phản ứng. Cho rằng thể tích
của dung dịch thay đổi không đáng kể.
Hướng dẫn giải bài tập
nCaCl2 = 4,44/111 = 0,04 mol; nAgNO3 = 3,4/170 = 0,02 mol Phương trình hóa học:
CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl 0,01 0,02 0,02
Xét tỉ lệ số mol 0,04/1 > 0,02/2 => CaCl2 dư, nên tính khối lượng chất rắn theo AgNO3
mAgCl = 0,01. 143,5 = 1,435 gam
b) nCaCl2 dư = 0,04 - 0,01 = 0,03 mol, nCa(NO3)2 = 0,01 mol
Thể tích của dung dịch = 30 + 70 = 100 ml => V dd= 0,1 lít
CM CaCl2 dư = 0,03/0,1 = 0,3M CM Ca(NO3)2 = 0,01/0,1 = 0,1M
Bài tập 4. Hai dung dịch tác dụng với nhau, sản phẩm thu được có MgCl2. Hãy cho biết
hai cặp dung dịch các chất ban đầu có thể đã dùng. Minh họa bằng các phương trình.
Hướng dẫn giải bài tập
Muối MgCl2 là sản phẩm của phản ứng hai dung dịch sau:
Phản ứng trung hòa HCl bằng dung dịch Mg(OH)2
2HCl + Mg(OH)2 → MgCl2 + 2H2O
Phản ứng trao đổi giữa
Muối + axit: MgCO3 + 2HCl → MgCl2 + CO2 + H2O
Muối + Muối: MgSO4 + BaCl2 → BaSO4 + MgCl2
Bài tập 5 Trong phòng thí nghiệm có thể dùng những muối KClO3 và KNO3 để điều
chế khí oxi bằng phản ứng phân hủy.
a) Nếu dùng 0,1 mol mỗi chất thì thể tích oxi thu được có khác không? Hãy tính thể tích khí oxi thu được
b) Cần điều chế 1,12 lít khí oxi, hãy tính khối lượng mỗi chất cần dùng. Các thể tích được đo ở đktc.
Hướng dẫn giải bài tập
a) Các phương trình phản ứng phân hủy o 2KClO t 3 2KCl + 3O2 (1) o 2KNO t 3 2KNO2 + O2 (2)
Theo phương trình (1): nO2 = 1/2nKNO3 = 0,05 mol VO2 = 0,05.22,4 = 1,12 lít
Theo phương trình (2): nO2 = 3/2nKClO3 = 0,15 mol VO2 = 0,15.22,4 = 3,36 lít b) nO2 = 0,05 mol
mKNO3 cần dùng = 0,1.101 = 10,1 gam
mKClO3 cần dùng = 2/3.0,05 . 122,5 = 4,08 gam
Bài tập 6. Viết phương trình phản ứng theo sơ đồ chuyển hóa sau:
a) CaCO3 → CO2 → NaHCO3 → ? → Na2SO4
b) CuSO3 → ? → CuCl2 → Cu(NO3)2
Hướng dẫn giải bài tập o a) CaCO t NaOH H SO 3 CO2 NaHCO3 NaOH Na2CO3 2 4 Na2SO4 (1:1) o b) CuCO t AgNO 3 CuO HCl CuCl2 3 Cu(NO3)2
Bài tập 7. Cho 5 dung dịch riêng biệt: K2SO4, AgNO3, NaOH, Ba(OH)2, HCl. Chỉ dùng
quỳ tím, trình bày các bước nhận biết 5 dung dịch trên. Viết các phương trình phản ứng xảy ra.
Hướng dẫn giải bài tập
Trích mẫu thử và đánh số thứ tự
Bước 1: Nhúng giấy quỳ tím vào 5 dung dịch trên
Dung dịch không làm đổi màu quỳ tím là K2SO4 và AgNO3
Dung dịch làm đổi màu quỳ tím thành xanh là: NaOH và Ba(OH)2
Bước 2: Nhỏ dung dịch HCl vừa nhận biết được vào 2 dung dịch không làm quỳ đổi màu
Dung dịch không xảy ra phản ứng là K2SO4
Xuất hiện kết tủa trắng là AgNO3
AgNO3 + HCl → AgCl↓ + HNO3
Bước 3: Nhỏ dung dịch K2SO4 vào 2 dung dịch làm quỳ tím hóa xanh
Dung dịch phản ứng tạo kết tủa trắng là Ba(OH)2
Dung dịch không xảy ra phản ứng là NaOH
K2SO4 + Ba(OH)2 → BaSO4 ↓ + 2KOH
Bài tập 8. Biết 12 gam muối hỗn hợp 2 muối CaCO3 và CaSO4 tác dụng vừa đủ với
400ml dung dịch HCl thu được 0,672 lít khí (ở đktc)
a) Tính nồng độ mol dung dịch HCl đã dùng
b) Tính thành phần % theo khối lượng mỗi muối có trong hỗn hợp ban đầu.
Hướng dẫn giải bài tập
Ở đây ta nhận thấy CaCO3 phản ứng được với HCl còn CaSO4 không phản ứng được với HCl nCO2 = 0,03 mol
Phương trình phản ứng hóa học:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
nHCl phản ứng = 2nCO2 = 2. 0,03 = 0,06 mol c) nCaCO3 = nCO2 = 0,03 mol
Bài tập 9. Cho 10,21 gam hỗn hợp 2 muối K2CO3 và KCl tác dụng vừa đủ với 50 ml
dung dịch HCl, thu được 448 ml khí ở dktc.
a) Tính nồng độ mol dung dịch HCl đã dùng
b) Tính thành phần phần trăm theo khối lượng mỗi muối trong hỗn hợp ban đầu.
Hướng dẫn giải bài tập
Phương trình phản ứng hóa học
K2CO3 + 2HCl → 2KCl + CO2 + H2O nCO2 = 0,448/22,4 = 0,02 mol
nHCl = 2nCO2 = 2.0,02 = 0,04 mol
Nồng độ mol dung dịch HCl đã dung bằng: CM HCl = 0,04/0,05 = 0,8M nK2CO3 = nCO2 = 0,02 mol
%mK2CO3 = 0,02.138/10,21.100% = 27,03%
%mKCl = 100% - 27,03% = 72,97%
..............................................