Preview text:
BÀI TẬP HÓA HỌC 9 BÀI 9: TÍNH CHẤT HÓA HỌC CỦA MUỐI
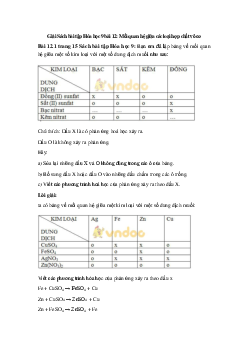
Bài tập 1. Ghép công thức muối thích hợp ở cột (I) với tính chất nêu ở cột (II) cho phù hợp. Công thức muối (I) Tính chất (II)
A. Dung dịch có màu xanh lam 1. BaSO4 B. Dung dịch có màu tím 2. CaCO3
C. Tác dụng với dung dịch Na2SO4 tạo kết tủa 3. CuSO4
D. Phản ứng với axit HCl tạo chất khí không màu 4. KMnO4
E. Chất rắn màu trắng, không tan trong dung dịch HCl Hướng dẫn giải 1-E 2-D 3-A 4-B
Bài tập 2. Hãy ghép thí nghiệm ghi ở cột (I) với hiện tượng ghi ở cột (II) cho phù hợp. Thí nghiệm (I) Hiện tượng (II)
A. Cho dung dịch NaOH vào ống nghiệm (1) Chất rắn màu trắng tạo thành, dung đựng dung dịch FeCl3
dịch thu được không màu
B. Cho dây Al vào ống nghiệm đựng dung (2) Chất rắn màu nâu đỏ tạo thành, dung dịch CuSO4.
dịch thu được không màu
(3) Chất rắn màu đỏ tạo thành bám vào
C. Cho dung dịch BaCl2 vào ống nghiệm
thanh kim loại, màu xanh của dung dịch đựng dung dịch Na2SO4. nhạt dần
D. Cho dung dịch HCl vào ống nghiệm
(4) Chất rắn màu nâu đỏ tạo thành, dung đựng Cu(OH)2
dịch thu được màu trắng
(5) Chất rắn tan dần, dung dịch tạo thành màu xanh Hướng dẫn giải A-2 B-3 C-1 D-5
Bài tập 3. Cho a gam Na2CO3 vào dung dịch HCl, sau phản ứng thu được 3,36 lít khí ở
đktc. Tính giá trị của a. Hướng dẫn giải Phương trình hóa học:
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O 0,15 0,15 nCO2=3,36/22,4 = 0,15mol
Theo phương trình hóa học: nNa2CO3 = nCO2 = 0,15mol nNa2CO3 = nCO2 = 0,15mol
=>a = mNa2CO3 = 0,15.106 = 15,9 gam
Bài tập 4. Khi cho 200 gam dung dịch Na2CO3 10,6% vào dung dịch HCl dư, khối lượng khí sinh ra là Hướng dẫn giải
mNa2CO3 = (200.10,6)/100 = 21,2gam =>nNa2CO3 = 0,2 mol
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O 0,2 mol → 0,2 mol => mCO2 = 0,2.44 = 8,8 gam
Bài tập 5. Khi phân hủy bằng nhiệt 14,2 gam CaCO3 và MgCO3 ta thu được 3,36 lít CO2
ở đktc. Thành phần phần trăm về khối lượng các chất trong hỗn hợp đầu lần lượt là: Hướng dẫn giải nCO2 = 3,36/22,4 = 0,15mol
Gọi số mol của CaCO3 và MgCO3 lần lượt là x và y mol
=> mhỗn hợp = 100x + 84y = 14,2 (1) Phương trình hóa học: o CaCO t 3 CaO + CO2 x mol → x mol o MgCO t 3 MgO + CO2 y mol → y mol =>nCO2 = x+y = 0,15mol (2)
Từ (1) và (2) => x = 0,1 mol; y = 0,05 mol 100.0,1 =>%mCaCO3 = .100% 70, 42% 14, 2 %mMgCO3 = 29,58%
Bài tập 6. Trộn một dung dịch có chứa 11,2 gam KOH với một dung dịch có chứa 32
gam CuSO4. Lọc lấy kết tủa đem nung nóng đến khối lượng không đổi. Khối lượng chất
rắn thu được sau khi nung là bao nhiêu?
Hướng dẫn giải.
nKOH = 11,2/56 = 0,2 mol, nCuSO4 = 0,2 mol
2KOH + CuSO4 → Cu(OH)2 + K2SO4 0,2 0,1 0,1 0,1
nCuSO4 dư = 0,2- 0,1 = 0,1 mol
Kết tủa Cu(OH)2 bị phân hủy khi nung nóng: o Cu(OH) t 2 CuO + H2O 0,1 0,1
Chất rắn có khối lượng không đổi mCuO = 0,1 . 80 = 8 gam
Bài tập 7. Nhiệt phân hoàn toàn 12,6 gam muối cacbonat của kim loại M (hóa trị II).
Dẫn khí thu được vào dung dịch Ca(OH)2 dư tạo ra 15 gam kết tủa. Kim loại M là Hướng dẫn giải
Gọi công thức hóa học của muối cacbonat là MCO3 o MCO t 3 MO + CO2 CO2 + Ca(OH)2 → CaCO3 + H2O
Chất kết tủa là CaCO3, nCaCO3 = 15/100 = 0,15 (mol)
Từ (1), (2) => mMCO3 = nCaCO3 = 0,15 mol
=> MMCO3 = 12,6/0,15 = 84 (g/mol); MM = 84 - 60 = 24 (g/mol) Vậy kim loại M là Mg
Bài tập 8. Cho 24,3 gam hỗn hợp gồm K2CO3 và K2SO4 tác dụng với dung dịch BaCl2 dư
tạo ra a gam kết tủa. Cho a gam kết tủa trên tác dụng với dung dịch Hướng dẫn giải
K2CO3 + BaCl2 → BaCO3 + 2KCl
K2SO4 + BaCl2 → BaSO4 + 2KCl
Chất kết tủa gồm BaCO3 và BaSO4. Cho kết tủa tác dụng với dung dịch HCl chỉ có
BaCO3 phản ứng, chất rắn còn lại là BaSO4.
BaCO3 + 2HCl → BaCl2 + H2O + CO2 nCO2 = 1,12/22,4 = 0,05 mol
Theo (3): nBaCO3 = nCO2 = 0,05 mol
Theo phương trình (1): nK2CO3 = nBaCO3 = 0,05 mol mK2CO3 = 0,05.138 = 6,9 gam
mK2SO4 = 24,3 - 6,9 = 17,4 gam nK2SO4 = 0,1 mol
Theo phương trình (2): nBaSO4 = nK2SO4 = 0,1 mol
mBaSO4 = b = 0,1.233 = 23,3 gam