







Preview text:
BÀI 1: ĐỊNH TÍNH NHÓM CHỨC HỮU CƠ ĐỒNG PHÂN CIS-TRAS
B1: dùng fecl3 (1 giọt ) tạo phức màu xanh đen là phenol ( mỗi hóa chất ban đầu cho 10 giọt )
3C6H5OH + FeCl3 → Fe(C6H5O)3 + 3HCl
B2: cho KmnO4 ( vài giọt ) vào các ống nghiệm đã ngâm lạnh lắc đều ( mỗi ống
cho 10 giọt hóa chất ban đầu )
Ko có hiện tượng là cyclohexan
Làm cho dd mất màu nhanh rồi có chất rắn màu đen xuất hiện là cyclohexen (nhanh)
3C6H10 + 8KMnO4 + 4H2O → 3C6H10O4 + 8KOH + 8MnO2
Làm dd mất màu chậm hơn rồi có chất rắn màu đen xuất hiện là cyclohexanol (chậm)
3C6H11OH + 2KMnO4 → 3C6H10O + 2KOH + 2MnO2 + 2H2O
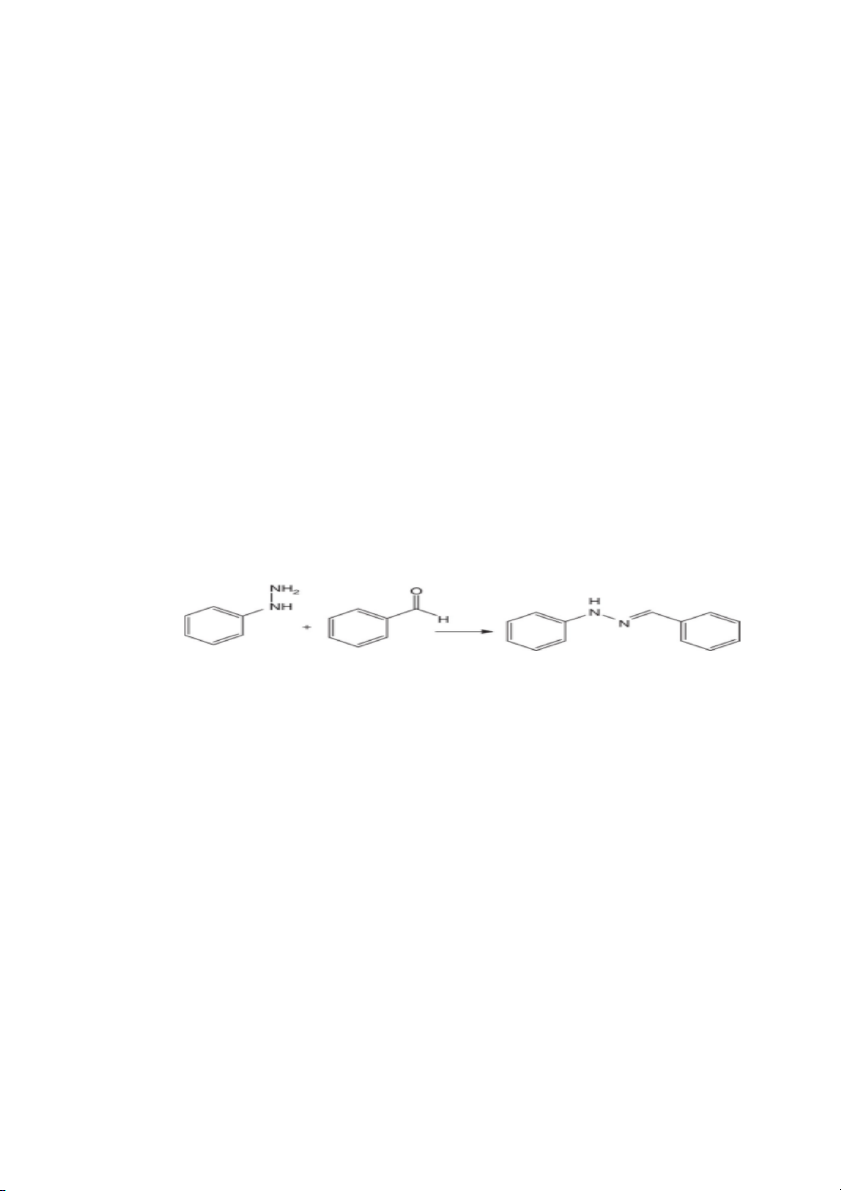
B3: dùng 1ml etanol lắc cho tan đem thêm phenilhydrazin ( thêm 1ml ) đem đun
nhẹ quan sát hiện tượng
Tạo kết tủa nâu đỏ là benzaldehyd ( cho vào ống nghiệm 10 giọt )
B4: nhận bt glucozo vs cyclohexan mỗi ố
ng 5 giọt rồi cho 15 giọt tollens đun cách thủy tráng bạc là glu
C6H12O6 + 2Ag(NH3)2OH → C5H11O5COONH4 + 2Ag + 3NH3 + H2O ĐỒNG PHÂN CIS TRANS
Lấy phần dung dịch qua lọc (còn gọi là nước cái, có chứa acid maleic hòa
tan) vào một erlen 250 ml thêm vào đó 10 ml HCl đậm đặc.
Đun hoàn lưu nhẹ hỗn hợp đến khi vừa xuất hiện tinh thể acid fumaric trong
dung dịch nóng (Chú ý: Đợi hỗn hợp nguội mới tháo hệ thống sinh hàn). Để nguội
hỗn hợp rồi lọc dưới áp suất kém bằng phễu buchner.
Có thể kết tinh lại acid fumaric trong dung dịch HCl 1M.
Lấy phần nước cái xong kết nh kết luận acid fumaric TRẢ LỜI CÂU HỎI.
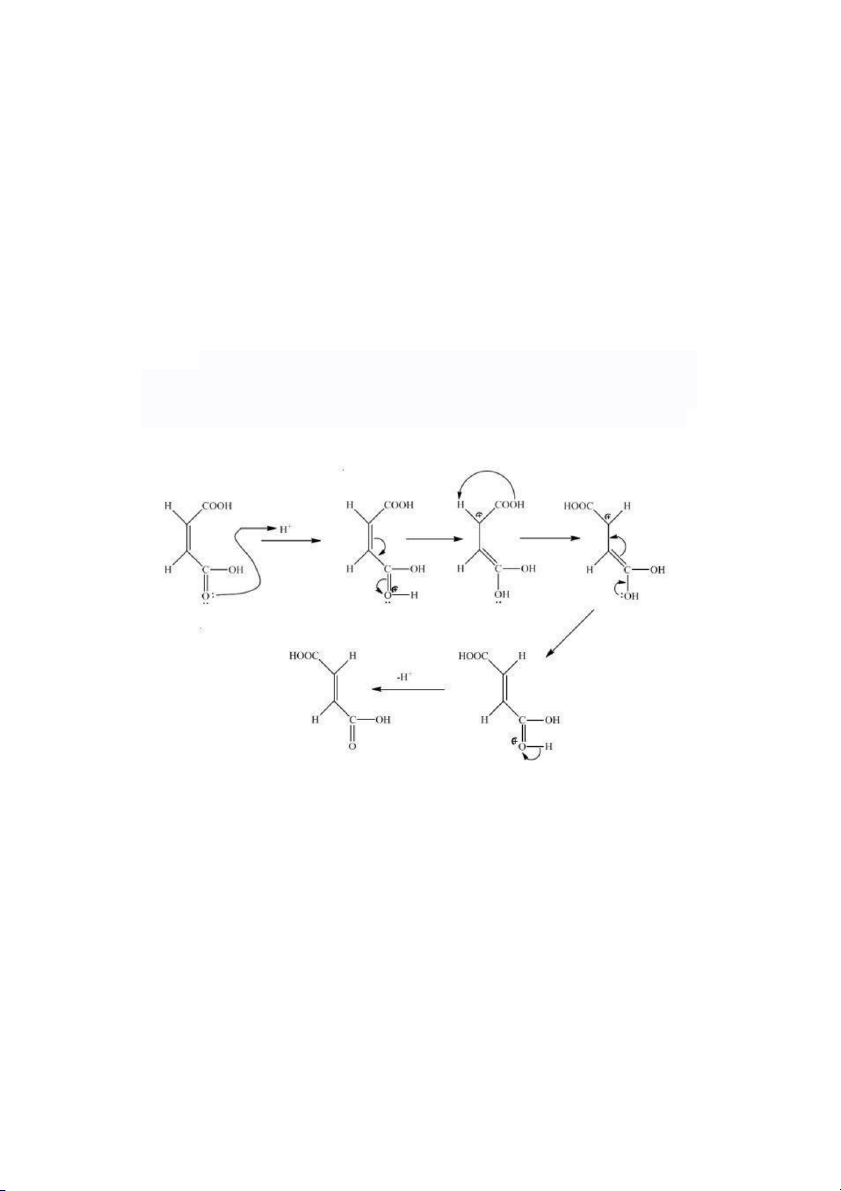
2+3. Acid fumaric bền hơn acid maleic và acid maleic tan được trong trước còn acid
fumaric không tan trong nước
Vì acid maleic là đồng phân cis nên có 2 nhóm -OH cạnh nhau, 2
nhóm CH3 cạnh nhau và 2 loại nhóm này đều đẩy e và đẩy nhau nên acid maleic linh
động hơn nên dễ dàng tan trong nước. Acid fumaric vừa có bề mặt phân tử rộng
hơn (đp trans), lực cưỡng điện lớn hơn nên acid này bền và không tan trong nước.
5. Trình bày cơ chế chuyển hóa từ acid maleic sang acid fumaric trong môi trường acid: BÀI 2: PHẢN Ứ NG ANDOL HÓA
B1: hòa tan 1g NaOH + 5g nước. Làm nguội rồi cho vào 6ml etanol và 3ml acetophenol
B2: lắc kỹ hỗn hợp và thêm vào từng lượng nhỏ ( vừa thêm vừa lắc ) benzadehyd
cho đến hết 3ml. Lắc đều tầm 1015’ c
ho đến khi có thành phẩm bám trên thành
bình rồi đem ngâm lạnh cho kết nh
(nếu chất dầu không kết tinh thì cọ thành erlen bằng đũa thủy tinh để chất dầu kết tinh hoàn toàn).
B3: Lấy cốc 250ml ngâm khoảng 150ml nước để làm nước rửa.
Lọc và rửa sản phẩm trên phễu Buchner với nước lạnh cho đến khi nước qua lọc
không làm đổi màu giấy thảo lam.
B4: Sau cùng rửa với khoảng 5ml Etanol đã ngâm lạnh và nén thật khô trên phễu. ptpu: CÂU HỎI:
1. Tại sao phải cho acetophenon vào dd NaOH lắc kỹ rồi sau đó mới cho dd benzaldehyde vào ?
Trả lời: Để OH- có thời gian để deproton (lấy Hα ) acetophenon. 2.
Sản phẩm phụ có thể thu được. Trả lời:
Tự súc hợp andol của acetophenon
Phản ứng Cannizzaro của benzaldehyde 3. Công dụng của etanol.
Trả lời: Làm dung môi hòa tan NaOH và acetophenon với nhau. 4.
Tại sao phản ứng khử nước của sản phẩm andol hóa này lại không dùng xúc
tác acid? Có phải NaOH sử dụng ở đây là chất xúc tác khử nước không?
Trả lời: NaOH là tác nhân deproton hóa. Sản phẩm tạo thành có nối đôi
C=C tiếp cách nhân thơm bền nên không cần dùng xúc tác acid thì quá trình
tách nước cũng tự diễn ra được. BÀI 3: PHẢN Ứ NG ESTER HÓA
B1: Cho hỗn hợp ester vào bình lóng đặt trên giá, thêm vào bình lóng 50ml nước
cất để rửa ester, lắc đều tay, để yên cho đến khi trong bình lóng hai lớp chất lỏng
tách lớp khỏi nhau, tách bỏ lớp nước phía dưới.
B2: Thêm vào bình lóng 30ml dung dịch NaHCO3 bão hòa ( chú ý phản ứng sinh ra
chất khí ), lắc đều bình lóng. Luôn xả khóa để đ ề
i u hòa áp suất trong bình, để yên,
khi trong bình lóng hai lớp chất lỏng tách khỏi nhau, tách bỏ lớp nước muối phía
dưới ( rửa 3 lần với dung dịch NaHCO3 bão hòa ).
Phương trình: H+ + HCO -3 CO2 + H2O
B3: Cho ester vào 1 erlen khô rồi thêm vào 1,5g Na2SO4 khan. Lắc nhẹ erlen cho đều, để yên vài phút
Câu 3: Ester tinh khiết thu được: 3,5ml
* Tính hiệu suất:
CH3COOH + CH3CH2CH2CH2OH CH3COOCH2CH2CH2CH3 + H2O H%=( 7.5/20).100= 37,5% Câu 2:
NaHCO3 dùng để trung hòa acid dư, tạo môi trường trung tính. Không thể dùng Na2CO3
hay NaOH vì chúng tạo môi trường base mạnh. ĐIỀU CHẾ ASPIRIN
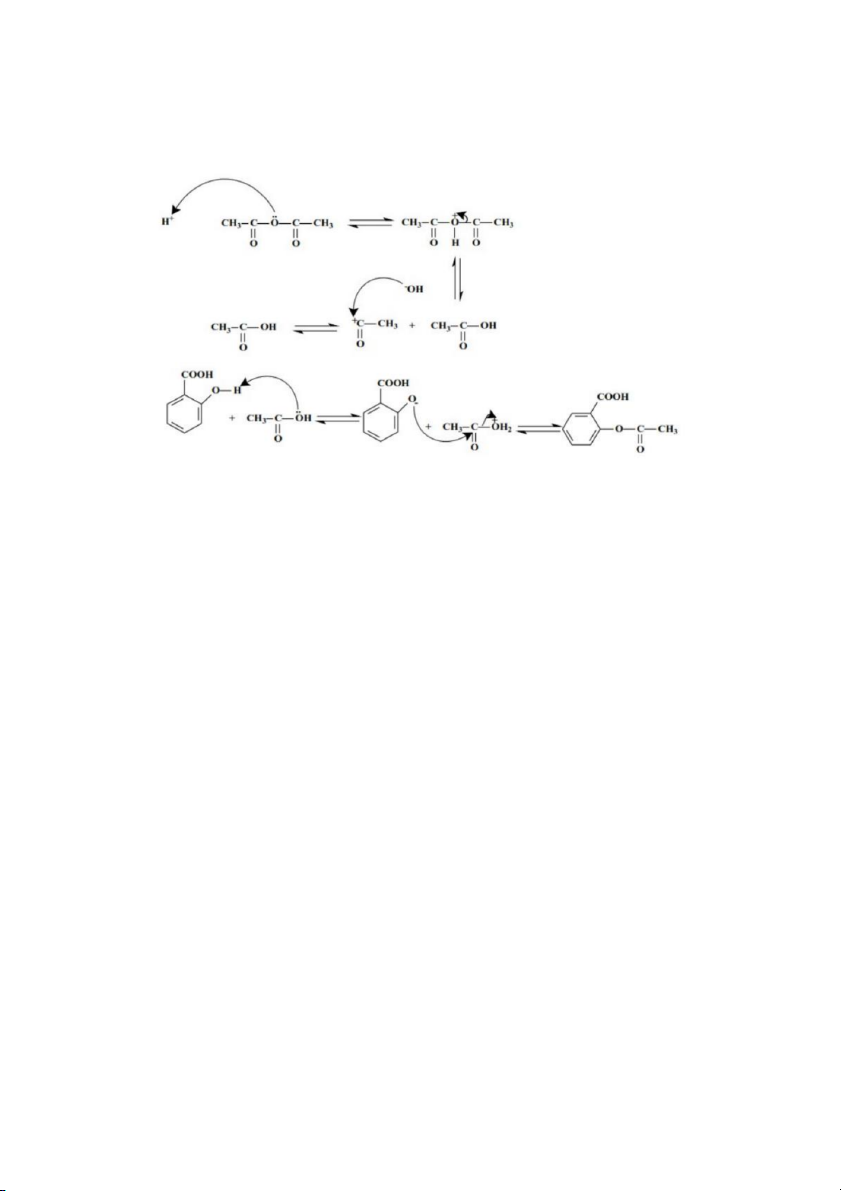
B1: cho vào bình cầu đáy phẳng 250ml: 5g acid salicylic, 7.5g (~7ml) anhidric và 3
giọt H2SO4 đđ. Đun cách thủy nhẹ trong khoảng 20’.
B2: để nguội và thêm vào bình cầu 100ml nước. Khuấy thật kĩ xong đem lọc khô dưới
áp suất kém bằng phễu sứ buchner. Thu aspirin khô. V. CÂU HỎI:
1. Viết cơ chế phản ứng: 2. kết tinh lại aspirin 3. dùng FeCl3 4. được
BÀI 4: PHẢN ỨNG XÀ PHÒNG HÓA ĐỀ 1.
B1: cho 15 dầu ăn (~17ml) vào 1 ẻlen 250ml, sau đó thêm vào erlen 25ml etanol, lắc
đều cho dầu tan hoàn toàn.
B2: thêm vào đó 20ml dd NaOH 20% và vài viên đá bọt. Lắc đều và đem dun hoàn lưu
nhẹ (1 phút lắc 1 lần ) cho đến khi dd hoàn toàn trong suốt
B3: đổ hỗn hợp còn nóng vào 1 becher chứa 100ml NaCl bão hòa, đun sôi nhẹ để đuổi etanol rồi để nguội ĐỀ 2.
B1: lọc lấy xà phòng thô trên phễu buchner
B2: kết tunh xà phòng thô bằng 300ml nước, đun cho tan rồi thêm khoảng 30g muối,
khuấy đều cho tan, để nguội, xà phòng sẽ kết tinh
B3: lọc khô bằng phễu buchner
I.TRẢ LỜI CÂU HỎI TRONG BÀI
1. Cho biết công dụng của ethanol.
Trả lời : Ethanol là dung môi phản ứng, hòa tan dầu ăn và NaOH. 2.
Cho biết công dụng của 100 ml dung dịch NaCl bão hòa.
Trả lời: NaCl bão hòa làm kết tinh xà phòng. Do cho dung dịch NaCl
làm thay đổi môi trường điện li, độ điện li muối natri của acid béo
(thành phần chủ yếu của xà phòng) giảm, hòa tan rất ít trong dung dịch và nổi lên trên.
1. Tại sao phản ứng thủy phân ester với xúc tác acid là phản ứng thuận
nghịch, còn phản ứng xavon hóa bằng dung dịch NaOH lại là phản
ứng không thuận nghịch? Trả lời:
Phản ứng thủy phân ester là phản ứng thuận nghịch
Trong môi trường base thì xảy ra phản ứng trung hòa
Phản ứng trung hòa làm giảm nồng độ acid carbocylic làm cho phản
ứng ester hóa diễn ra theo chiều sinh ra acid carbocylic và ancol (chiều thuận), nên
phản ứng thủy phân ester trong môi trường base chỉ diễn ra theo một chiều.
Trong môi trường acid thì phản ứng trung hòa không diễn ra nên phản
ứng thủy phân ester vẫn là phản ứng thuận nghịch. BÀI 5: PHẢN ỨNG OXI HÓA ĐỀ 1:
B1: cho hỗn hợp vào một becher 500ml, thêm vào hỗn hợp 100ml H2SO4 20%, khuấy
thật đều bằng đũa thủy tinh cho từng lượng nhỏ (nhỏ giọt) H2O2 vừa thêm vừa khuấy
cho đến khi dung dịch mất màu ( chuyển sang màu trắng đục) thì ngưng
3H2O2 + 2KMnO4 → 2H2O + 2KOH + 2MnO2 + 3O2
B2: để nguội và làm lạnh becher trong chậu nước, acid benzoic sẽ kết ting, lọc khô sản phẩm. ĐỀ 2:
KẾT TINH LẠI ACID BENZOIC BẰNG NƯỚC
B1: cho acid benzoic vừa lọc khô vào becher 100ml chứa một ít nước, đun nhẹ dung
dịch cho đến khi nhiệt độ nóng ( vừa sôi ), nếu acid benzoic chưa tan hết, thêm từ từ
nước nóng cho đến khi tinh thể này tan hoàn toàn (ở nhiệt độ sôi)
B2: để nguội từ từ, acidbenzoic sẽ kết tin thành tinh thể hình kim. Lọc khô sản phẩm 1. Công dụng của Na2CO3
Tạo môi trường base cho phản ứng xảy ra. 2. Công dụng của H2O2
Tác dụng khử, làm mất màu KMnO4 còn dư và MnO2 được tạo ra sau phản ứng 3.
Công dụng của bột tẩy
Bột tẩy gồm một đầu ưa nước và mộ đầu ưa dầu, sẽ kéo các phân tử lại
gần nhau giúp phản ứng xảy ra dễ dàng hơn 4.
Tính hiệu suất của sản phẩm so với toluene
C6H5CH3 + KMnO4 C6H5COOK + MnO2 + H2O
2C6H5COOK + H2SO4 2C6H5COOH + K2SO4
dtoluen = 0,87g/ml mtoluen = 0,87 x 5 = 4,35g
ntoluen =4,3592= 0,05 mol maxit benzoic (lý thuyết) = 0,05 x 122 = 6,1g
maxit benzoic (thực tế) = 2,84g H% = 2,846,1x100%=46,56%
BÀI 6: SẮC KÍ CỘT VÀ SẮC KÍ BÁN MỎNG SẮC KÍ CỘT
B1: chuẩn bị cột sắc kí: sử dụng cộng kẽm nhồi một lớp bông khoảng 1-2
mm vào đáy cột ( không nhồi cứng ), lắp cột sắc kí vào giá
B2: cho 15ml dung môi eter dầu hỏa vào becher 100ml, thêm từ từ 5g
silica gel vào và khuấy đều
B3: Cho silica gel vào cột sắc ký, mở khóa cho dung môi chảy (không
nên gõ đều cột). Lưu ý luôn để dung môi ngập trên silica gel. Sau khi
cho hết silica gel, vẫn mở khóa để dung môi chảy từng
giọt cho đến khi lớp dung môi nằm trên silica gel khoảng 1mm thì khóa cột lại. TRÍCH LY SẮC TỐ LÁ CÂY
B1:cho 5g lá cây vào cối rồi dùng chày nghiền nát, sau đó chuyển lá cây đã
nghiền nát vào erlen 250ml có chứa sẵn 50ml hỗn hợp eter dầu hỏa : aceton (
tỉ lệ 3:2 ), lắc đều trong 10 phút, lọc lấy dịch trích và cho vào becher 100ml
B2: cho dịch vừa trích ra vào bình lóng, rửa bằng ( 20ml x 2 lần ) bằng nước
cất, chuyển dịch trích vào erlen 50ml, làm khan bằng Na2SO4 khan, lọc
B3: đun cách thủy dịch đã làm khan để loại bớt dung môi, thu được một
dung dịch sắc tố đậm đặc ( khoảng 2 ml ). Dịch sắc tố này được đun để sắc
kí bán mỏng và nạp vào cột sắc tố
NẠP SẮC TỐ VÀO CỘT SẮC KÝ
B1: cho một ít mẫu sắc tố vào lọ đựng riêng để làm sắc ký bán mỏng, dùng
ống nhỏ giọt để đưa mẫu sắc tố vào đầu cột sắc ký, dùng eter dầu hỏa rửa
thành cột và ống mao quản.
B2: sau khi nạo xaong để yên 2 phút cho mẫu được cân bằng với chất hấp
phụ ( silica gel ) và dung môi giải ly ( eter dầu hỏa ) GIẢI LY CỘT
B1: Mở khóa cho dung môi chảy đến khi hh dung dịch sắc tố bằng với
lớp chất hấp phụ thì nhẹ nhàng thêm dung môi eter dầu hỏa vào
đầu cột (thêm thật nhẹ nhàng), mở khóa và hứng phần dung môi chảy ra khỏi cột.
B2: Liên tục cho dung môi eter dầu hỏa vào, sắc tố β -caroten màu vàng
sẽ di chuyển nhanh ra khỏi cột trước tiên, hứng lấy phần sắc tố đó.
B3:Liên tục cho dung môi eter dầu hỏa vào, sắc tố β -caroten màu vàng
sẽ di chuyển nhanh ra khỏi cột trước tiên, hứng lấy phần sắc tố đó. Trả lời câu hỏi
4. Tại sao hỗn hợp mẫu chất sau khi nạp lên đầu cột cần được giải ly ngay,
tránh ngưng quá trình giải ly một thời gian?
Vì nếu ngưng thì trật tự sắp xếp của các chất trong hỗn hợp sẽ bị xáo trộn
làm cho sự tách không còn hiệu quả nữa.
5. Tại sao phải làm khan dịch trích trước khi nạp lên cột sắc ký?
Vì trong quá trình chuẩn bị ta sử dụng rất nhiều dung môi hửu cơ nên
cần làm khan để loại bớt dung môi và đồng thời để thu được một sắc tô đậm đặc.
7. Dự đoán thứ tự ra khỏi cột ủ c a ba chất A, B, C
Vì bản chất hóa học của bề mặt silica gel là những nhóm silanol-
OH nên những chất phân cực hơn sẽ bị silica gel giữ chặt lại và giải ly muộn
hơn so với nhữn chất khác vì có khả năng tạo nối hydrogen mạnh.
⇒ Thứ tự ra khỏi cột là: B → A → C. SẮC KÍ BÁN MỎNG
B1: dùng bút chì đánh dấu trên mép vạch ( vạch tuyền tuyến ) 0,25 cm, dưới ( vạch xuất phát ) 0.5 cm.
B2:dùng ống vi quản chấm dd mà nhà trường cho 2.
Chuẩn bị bình triển khai
Lau thật sạch và khô bình triển khai (ly thủy tinh). Cắt một tấm giấy lọc đặt vào trong ly.
Bản 1: gải ly với hệ 5ml eterr dầu hỏa: acetat etyl (4:1)
Bản 2: giải ly với hệ 5ml eterr dầu hỏa: acetat etyl (2,5:2,5)
Cho 5ml hệ dung dịch vào bình. Đậy bình lại bằng tấm
kiếng thủy tinh và để yên cho h
ệ dung dịch thấm ướt hết giấy lọc.
Cho bản mỏng vào bình triển khai, đậy nắp lại. Khi hệ dung môi thấm ướt đến
mứt đánh dấu ở trên thì lấy bản mỏng ra.
Xa nhất là độ phân cực nhỏ nhất Trả lời câu hỏi
1. Tại sao phải đặt tờ giấy lọc vào bình sắc ký
Để kiểm tra độ bão hòa của hơi dung môi trong bình sắc ký.
2. Tại sao phải vạch lằn “mức tiền tuyến dung môi”? Để tiết kiệm (nhằm
chấm được nhiều vết) có thể chấm các vết sát lề bản mỏng được không? Tại sao?
Vạch lằn “mức tiền tuyến dung môi” để làm chổ ta lấy bản sao
cho không ảnh hưởng đến lớp silicagel trên bản, nếu không có mức tiền tuyến t
a sẽ chạm vào đường đi của bản mỏng và vô tình cung cấp
tạp chất ảnh hưởng đến hướng di chuyển của các chất.
Không thể chấm các vết sát lề bản mỏng được vì nếu chấm sát lề bản
mỏng thì lúc này diện tích tiếp xúc chính của chất là mặt bên bản mỏng.
Nó rất nhỏ nên lực hút các chất vì vậy cũng nhỏ theo làm cho các chất bên
mặt bên cao hơn chất ở trên mặt trước làm cho giá trị Rf không chính xác.




