










Preview text:
BÀI TẬP HÓA PHÂN TÍCH 20193 CHƯƠNG AXIT BAZƠ Axit-bazơ mạnh 1 Tính pH của dung dịch: a. HBr 1,0×10–3M b. KOH 1,0×10–2M ĐS. a, 3,0; b, 12 2
Tính pH của dung dịch HClO4 5,0×10–8 M
Cân bằng axit-bazơ yếu 3
Viết phản ứng hóa học của các phản ứng mà hằng số cân bằng:
a. Ka cho axit benzoic C6H5COOH
b. Kb cho ion benzoate C6H5COO– c. Kb cho aniline C6H5NH2 d. K + a cho ion anilinum C6H5NH3 4
Hãy viết quá trình phân ly của: a. H2O b. CH3COOH c. CH3NH2 d. CH3CH2OH 5
Tính pH của dung dịch NaOCl (natri hypoclorua) 0,0100M, cho biết hằng số axit của axit HOCl là 3,0×10–8M ĐS. pH = 9,76 6
Dung dịch axit benzoic 0,0450M có pH = 2,78. Tính pKa của axit ĐS. pKa = 4,20 7
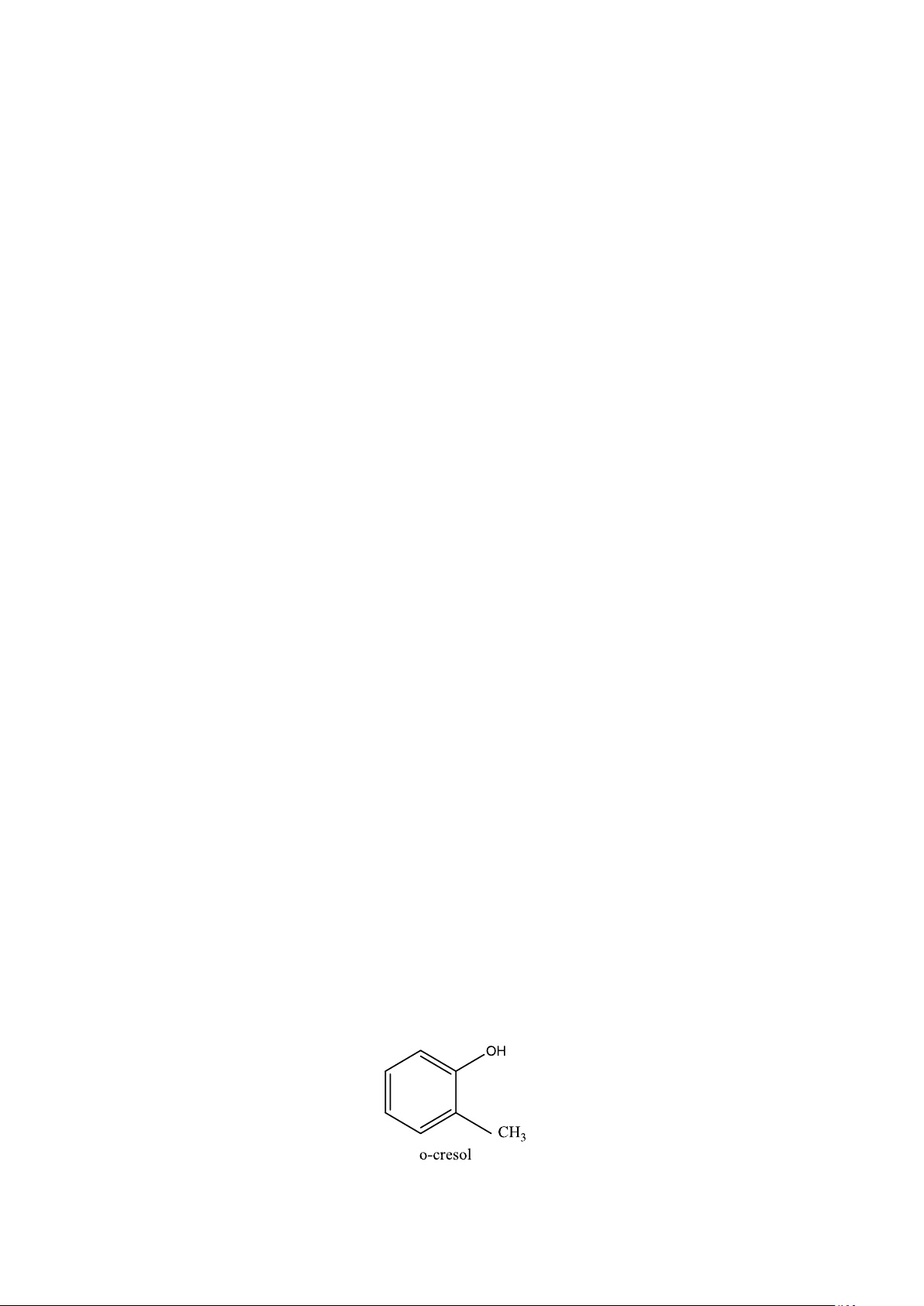
pH của dung dịch o-cresol 0,010M là 6,16. Tính pKa của dung dịch axit yếu này 1 8
Độ phân ly của dung dịch HA 0.0450M là 0,60%. Tính pKa cho axit này ĐS. pKa = 5,78 9
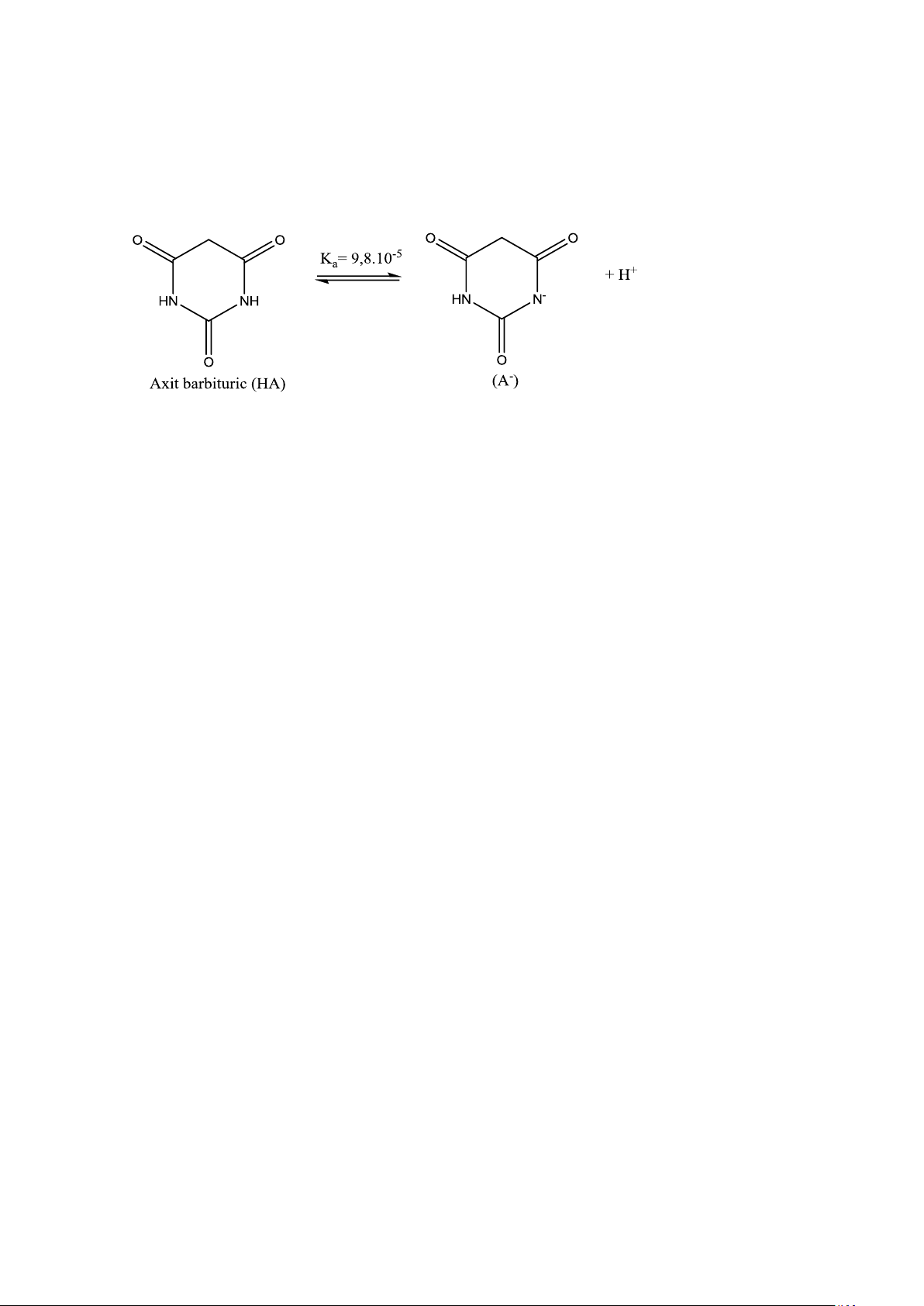
Axit barbituric phân ly như phương trình dưới đây:
Tính pH của dung dịch axit barbituric có nồng độ 10–2,00M ĐS. pH = 3,02
10 Cr3+ (và hầu hết các ion kim loại với điện tích ≥2) có tính axit do tính chất bị thủy phân
Cr3+ + H2O ⇋ Cr(OH)2+ + H+ Ka1 = 10–3,80
(Các nấc tiếp theo tạo ra Cr(OH)2+ −
2 , Cr(OH)3 và Cr(OH)4 ). Chỉ xem xét nấc phân ly
Ka1, tính pH của dung dịch Cr(ClO4)3 0,010M và hãy tính phần của crom ở dạng
Cr(OH)2+ (𝛼𝐶𝑟(𝑂𝐻)2+= ?)
ĐS. pH = 2,40 và 𝛼𝐶𝑟(𝑂𝐻)2+= 0,04
11 Dung dịch của một bazơ 0,010 M có pH = 9,28. Tính Kb của bazơ này
12 Tính pH của dung dịch natri butanat 0,10M (muối natri của axit butanoic, còn được gọi
là axit butyric). Cho biết Ka của axit butanoic (C3H7COOH có giá trị là Ka = 1,2×10–5)
13 pH của dung dịch etylamin 0,10M là 11,80 a. Tính Kb của etylamin
b. Sử dụng kết quả tính được ở phần a, tính pH của dung dịch etyl amoni clorua 0,10M
ĐS. (a) Kb = 6,298 ×10–5; (b) pH = 11,28
14 Tính pH và nồng độ của (CH3)3N và (CH3)3NH+ trong dung dịch trimetylamin 0,060M.
Cho biết Ka của (CH3)3NH+ là 1,59×10–10
ĐS. [(CH3) 3NH+] = 1,911×10–3M và [(CH3)3N] = 0,058M
15 Cho dung dịch (CH3)3N có nồng độ ban đầu là 0,05M. Tính pH của dung dịch, nồng độ 2
của (CH3)3N và (CH3)3NH+ tại thời điểm cân bằng.
Cho biết (CH3)3N có Kb = 6,29×10–5
ĐS. pH = 11,24; [(CH3)3NH+]=1,77×10–3 M; [(CH3)3N] = 0,0483M
16 Cho dung dịch CH2ClCOOH có nồng độ ban đầu là 0,05M. Tính pH của dung dịch,
nồng độ của CH2ClCOOH và CH2ClCOO– tại thời điểm cân bằng.
Cho biết: axit cloroaxetic CH2ClCOOH có Ka = 1,38×10–3
ĐS. pH = 2,12; [CH2ClCOOH]=4,23×10–2 M; [CH2ClCOO–] = 7,65×10–3 M
17 Tính pH của nước tinh khiết ở 25°C và 100°C cho biết Kw có giá trị tương ứng ở hai
nhiệt độ trên là: 1,01×10–14 và 49×10–14 Dung dịch đệm
18 Hãy giải thích tại sao pH của dung dịch đệm hầu như không phụ thuộc vào nồng độ?
19 Hãy giải thích tại sao dung lượng đệm của dung dịch tăng khi tăng nồng độ đệm?
20 Tại sao dung lượng đệm đạt cực đại khi pH = pKa?
21 Những axit nào trong số các axit cho dưới đây được cho là thích hợp nhất khi pha chế dung dịch đệm pH = 3,10 (i) Hydro peroxit, pKa = 11,65 (ii)
Propenoic axit (acrylic axit) pKa = 4,258 (iii)
Cyano axetic axit, pKa = 2,472 (iv)
4-amino benzen sunfonic axit (sunfanilic axit), pKa = 3,232
22 Một lít dung dịch đệm được pha chế bằng cách hòa tan 0,100 mol một axit yếu HA (Ka
= 1,0×10–5) và 0,050 mol bazơ yếu liên hợp của nó Na+A–. Tính pH của dung dịch này.
23 Viết phương trình Henderson cho dung dịch axit formic. Tính tỉ số [HCO−2]/[HCO2H] ở: (a) pH = 3,00 (b) pH = 3,74 (c) pH = 4,00
Cho biết pKa của axit formic là 3,74
24 a. Hòa tan 1,00g glyxin amit hydro clorua (NH+3CH2CONH2Cl, M = 110,54g/mol) với
1,00g glyxin amit (NH2CH2CONH2, M = 78,08 g/mol) trong 0,100 lit dung dịch. Tính 3
pH của dung dịch này; Cho biết pKa = 8,06
b. Tính số gam glyxin amit cần thêm vào 1,00g glyxin amit hydro clorua để thu được 100ml dung dịch pH = 8,00
c. Tính pH của dung dịch nếu thêm vào dung dịch (a) 5,00 ml dung dịch HCl 0,100M (dung dịch c)
d. Tính pH của dung dịch nếu thêm vào dung dịch (c) 10,00 ml dung dịch NaOH 0,100M
e. Tính pH của dung dịch nếu dung dịch (a) được trộn với 90,46 ml NaOH 0,100M
(đây là lượng NaOH cần thiết để phản ứng vừa đủ với glyxin amit hydro clorua).
ĐS. a, pH = 8,21; b, 0,62g; c, pH = 8,18; d, pH = 8,26; e, pH = 10,36
25 Tính số gam Na2CO3 (M=105,99g/mol) cần thiết để khi trộn với 5,00g NaHCO3
(M=84,01g/mol) có được 100ml dung dịch đệm với pH=10,00
Biết hằng số axit của H2CO3 là: Ka1 = 4.10–7, Ka2 = 5.10–11 ĐS. 3,16g
26 Một bazơ B có pKb = 5,00. a. Tính pKa của axit BH+ b. Tính pH khi [BH+]=[B]
c. Hạt nào sẽ chiếm ưu thế B hay BH+ khi pH = 7
d. Tính tỉ số [B]/[BH+] ở pH = 12,00
27 Biết hằng số axit của H2CO3 là: Ka1 = 4.10–7, Ka2 = 5.10–11
a. Tính số gam NaHCO3 (M=84,007g/mol) cần thiết để khi thêm vào 500ml dung
dịch chứa 4,00g chất tan K2CO3 (M=138,206 g/mol) pH của dung dịch sẽ là 10,80? ĐS. 0,77g
b. Tính pH của dung dịch sau khi 100ml dung dịch HCl 0,100M được thêm vào? ĐS. pH = 10,29
c. Tính số ml HNO3 0,320M cần để khi thêm vào 250ml dung dịch chứa 4,00g
chất tan K2CO3 để pH của dung dịch sẽ là 10,00 28 Cho N0− −
2 có pKb = 10,85, hãy tính tỉ số [HNO2]/[N02 ] trong dung dịch natri nitrit ở a. pH = 2,00 b. pH = 10,00
Dung dịch đa axit, đa bazơ 4
29 Cho biết đa axit H2A có Ka1 = 10–4, Ka2 = 10–8. Tính pH và nồng độ của các dạng H2A,
HA– và A2– trong các trường hợp sau: a. H2A 0,100M b. NaHA 0,100M c. Na2A 0,100M
30 Chúng ta biểu diễn axit maloic CH2(COOH)2 là H2M. Tính pH và nồng độ các dạng
H2M, HM– và M2– trong các trường hợp sau: a. H2M 0,100M b. NaHM 0,100M a. Na2M 0,100M
Cho biết axit maloic có Ka1 = 1,42×10–3, Ka2 = 2,01×10–6
31 Tính pH của dung dịch piperazin 0,300M và tính nồng độ của các dạng trong dung
dịch. Cho biết piperazin có Ka1 = 4,65×10–6, Ka2 = 1,86×10–10
32 Tính tỉ số nồng độ [H −
3PO4]/[𝐻2𝑃𝑂4 ] trong dung dịch a. KH2PO4 0,0500M b. K2HPO4 0,0500M
Cho biết H3PO4 có: Ka1 = 7,11×10–3, Ka2 = 6,34×10–8, Ka3 = 4,22×10–13
33 Hãy lựa chọn hai trong số các chất sau để pha chế dung dịch đệm có pH = 7,45:
H3PO4 (98,00 g/mol); NaH2PO4 (119,98 g/mol); Na2HPO4 (141,96 g/mol); và Na3PO4 (141,96 g/mol)?
Nếu muốn pha chế 1 lít dung dịch đệm pH = 7,45 có tổng nồng độ các dạng photphat là
0,0500M thì mỗi dạng cần cân bao nhiêu gam?
Cho biết H3PO4 có: Ka1 = 7,11×10–3, Ka2 = 6,34×10–8, Ka3 = 4,22×10–13
34 Photphat, có mặt với nồng độ khoảng 0,01M, là thành phần chính của đệm trong huyết
tương, pH của đệm là 7,45. Liệu photphat có thể vẫn còn tác dụng đệm khi pH của huyết tương là 8,5?
Chuẩn độ axit-bazơ
35 Hãy giải thích tại sao:
- Khi chuẩn độ một bazơ yếu bằng một axit mạnh, pH tại điểm tương đương <7
- Khi chuẩn độ một axit yếu bằng môt bazơ mạnh, pH tại điểm tương đương >7 5
36 Chuẩn độ 100,0ml một axit yếu HA bằng NaOH 0,09381M, thể tích tại điểm tương
đương là 27,63ml. pH tại điểm tương đương là 10,99. Tính pKa của axit này và tính pH
khi mới thêm được 19,47ml NaOH. ĐS. pKb = 4,31; pH = 10,07;
37 Chuẩn độ 100ml HA 0,100M (pKa = 5,00) bằng KOH1,00M. Tính pH của dung dịch
tại các thời điểm thể tích V(KOH) = 0; 1; 5; 9; 9,9; 10; 10,1 và 12ml.
38 Chuẩn độ 100ml một bazơ yếu B 0,100M (pKb = 5,00) bằng HClO4 1,00M. Tính pH
của dung dịch tại các thời điểm thể tích V(HClO4) = 0; 1; 5; 9; 9,9; 10; 10,1 và 12mL.
39 Chuẩn độ 100ml một đa bazơ yếu B 0,100M (pKb1 = 4,00, pKb2 = 8,00) bằng axit HCl
1,0000M. Tính pH của dung dịch tại các thời điểm thể tích V(HCl) = 0; 1; 5; 9; 9,9; 10;
10,1; 11; 15; 19, 20 và 22mL.
40 Chuẩn độ 100ml một đa axit yếu H2A 0,100M (pKa1 = 4,00, pKa2 = 8,00) bằng axit
NaOH 1,00M. Tính pH của dung dịch tại các thời điểm thể tích V(NaOH) = 0; 1; 5; 9;
9,9; 10; 10,1; 11; 15; 19, 20 và 22mL.
41 Chuẩn độ 40,00 ml một axit yếu HA bằng NaOH 0,1000M, thể tích tại điểm tương
đương là 20,00 ml, pH tại điểm tương đương là 8,36.
a.Tính pH của dung dịch khi chưa thêm NaOH
b.Tính pH của dung dịch khi thêm được 10,00 và 22,00 ml NaOH
c. Nếu dừng chuẩn độ ở pH = 7,00 thì sai số của phép chuẩn độ sẽ là bao nhiêu?
d. Chất chỉ thị nào trong số các chất chỉ thị cho dưới đây có thể được sử dụng để xác
định điểm tương đương với sai số ±0,1%
Metyl đỏ (pT = 5); Metyl da cam (pT = 4); Phenol đỏ (pT = 7); Phenol phtalein (pT = 9)
ĐS. (a) pKa = 4,20; pKb = 9,80; pH = 2,75; (b) pH = 4,20; pH = 11,51; (c) –0,16%
42 Chuẩn độ 40,00 ml một bazơ yếu B bằng HCl 0,1000M, thể tích tại điểm tương đương
là 20,00 ml, pH tại điểm tương đương là 5,64.
a. Tính pH của dung dịch khi chưa thêm HCl
b. Tính pH của dung dịch khi thêm được 10,00 và 22,00 ml HCl
c. Nếu dừng chuẩn độ ở pH = 8,20 thì sai số của phép chuẩn độ sẽ là bao nhiêu?
d. Chất chỉ thị nào trong số các chất chỉ thị cho dưới đây có thể được sử dụng để xác 6
định điểm tương đương với sai số ±0,1%
Metyl đỏ (pT = 5); Metyl da cam (pT = 4); Phenol đỏ (pT = 7); Phenol phtalein (pT = 9)
ĐS. pKb = 4,20; a, pH = 11,24; b, pH = 9,80 và 2,49; c, Vx = 19,51 và ss = –2,45%
d, Bước nhảy pH 6,80 đến 4,48, chọn chất chỉ thị metyl đỏ;
43 Chuẩn độ 50,00 ml HCOOH (pKa = 3,74) 0,02000M bằng NaOH 0,1000M.
a. Tính pH của dung dịch tại thời điểm VNaOH = 0,00; 3,00; 5,00; 9,99; 10,00; 10,01 ml.
b. Tính các sai số của quá trình chuẩn độ nếu dừng chuẩn độ ở pH = 6,00 và 9,50;
44 Chuẩn độ 20,00 ml NH3 (pKb = 4,756) 0,05000M bằng HCl 0,10000M.
a. Tính pH của dung dịch tại thời điểm VHCl = 0,00; 3,00; 5,00; 9,99; 10,00; 10,01 ml.
b. Tính các sai số của quá trình chuẩn độ nếu dừng chuẩn độ ở pH = 6,50 và 4,00;
ĐS. (a) pH = 10,70; 9,61; 9,24; 6,24; 5,36; 4,48 (b)19,98 ml; –0,18%; 10,03 ml, +0,3% CHƯƠNG PHỨC CHẤT 1
Xác định nồng độ [Fe3+] trong dung dịch FeY– nồng độ 0,1000M tại pH = 4 và pH = 10
Cho biết hằng số bền của phức giữa Fe3+ và EDTA là β –
FeY = 1025,1, tỉ số giữa nồng độ
tự do của Y4– với tổng nồng độ tự do của tất cả các dạng của EDTA, αY4−= 3,0.10–9 và 0,30 tại pH = 4 và 10 2
Tính pMg2+ (pMg2+ = –log[Mg2+]) khi chuẩn độ 40,00ml dung dịch Mg2+ 0,0500M
bằng dung dịch EDTA 0,1000M trong dung dịch đệm pH = 10,0 ở các thời điểm khi thêm được: a. 10,00 ml EDTA b. 20,00 ml EDTA c. 30,00ml EDTA
Cho biết hằng số bền có điều kiện (pH = 10,0) của phức tạo bởi Mg2+ và EDTA β’ = 2,2.108
ĐS. (a) pMg = 1,70; (b) pMg = 4,90; (c) pMg = 8,04 3
Trộn hai dung dịch Fe3+ 0,0010M và SCN– có nồng độ 0,10M. Phức [Fe(SCN)]2+ (có
hằng số bền βFe(SCN)2+ =102,1) có màu đỏ khi nồng độ của ion phức là 10–5,5M. Nồng độ
của F– cần thêm là bao nhiêu để làm mất màu đỏ cho biết ion phức [Fe(F)]2+ tạo bởi
Fe3+ và F– có hằng số bền β 2+ FeF = 105,5; 4
Tính nồng độ tự do của Ni2+ ở trạng thái không tạo phức khi trộn
a, 10,00 ml Ni2+ nồng độ 0,0200M với 10,00 ml dung dịch EDTA nồng độ 0,0200M
trong môi trường đệm (NH4Cl+NH3) pH = 10,00, nồng độ NH3 không bị proton hóa là 0,10M
ĐS. [ Ni2+] = 11,83×10–13M; pNi = 11,93
b, 10,00 ml Ni2+ nồng độ 0,0200M với 12,00 ml dung dịch EDTA nồng độ 0,0200M
trong môi trường đệm (NH4Cl+NH3) pH = 10,00, nồng độ NH3 không bị proton hóa là 7 0,10M ĐS. [ Ni2+] = 4×10–18M;
Cho biết ở pH = 10,0, 𝛼𝑌4− = 0,30, (là tỉ số giữa nồng độ tự do của Y4- với tổng nồng
độ tự do của tất cả các dạng của EDTA). Hằng số tạo phức giữa Ni2+ và EDTA là 𝛽 2+
𝑁𝑖𝑌2−= 1018,62. Phức [Ni(NH3)4 ] có β1=102,7; β1,2 = 104,8; β1,2,3 = 106,4; β1,2,3,4 = 107,4; 5
Độ tan của I2 trong nước tinh khiết là 0,0279g/100g nước. Trong dung dịch KI
0,1000M, độ tan của I2 có thể đạt tối đa là 1,14g/100g nước. Hãy tính hằng số bền tạo
phức của phản ứng sau: I − 2(dung dịch) + I– ⇋ I3 ĐS. 709 6
Chuẩn độ 50,00 ml Zn2+ 1,00.10-3M với EDTA 1,00.10-3M trong môi trường pH = 10,00 với sự có mặt NH +
3 0,10M (đây là nồng độ NH3, cũng có NH4 trong dung dịch).
Thể tích tại điểm tương đương là 50,00 ml. Hãy tính pZn (pZn = – log[Zn2+] sau khi
thêm 20,00; 50,00 và 60,00 ml EDTA.
Cho biết: 𝛼𝑍𝑛2+= 1,8.10-5 (là tỉ số giữa nồng độ tự do của Zn2+ với tổng nồng độ tự do
của tất cả các dạng của chứa kẽm). 𝛼𝑌4− = 0,30, (là tỉ số giữa nồng độ tự do của Y4-
với tổng nồng độ tự do của tất cả các dạng của EDTA). Hằng số tạo phức giữa Zn2+
và EDTA là 𝛽𝑍𝑛𝑌2−= 1016,50. 7
Hằng số bền tạo phức giữa Ca2+ và EDTA là 1010,65. Hãy xác định nồng độ tự do của
Ca2+ ở pH = 6,0 và 10,0 trong dung dịch CaY2– 0,10M. Cho biết tỉ số giữa nồng độ tự
do của Y4– với tổng nồng độ tự do của tất cả các dạng của EDTA, αY4−= 1,8.10–5 và 0,30 tại pH = 6,0 và 10,0.
ĐS. 3,5. 10–4 ở pH = 6,0 và 2,7. 10–6M ở pH = 10,0 8
Ni2+ có thể được xác định bằng kỹ thuật chuẩn độ ngược với dung dịch chuẩn Zn2+ ở
pH = 5,5 sử dụng chất chỉ thị xylenol da cam. 25,00 ml dung dịch Ni2+ được pha loãng
bằng HCl sau đó thêm vào 25,00 ml Na2EDTA 0,05283M. Dung dịch này sau đó được
trung hòa bằng NaOH, pH được điều chỉnh đến 5,5 bằng dung dịch đệm axetat. Dung
dịch chuyển màu vàng khi chất chỉ thị xylenol da cam được thêm vào. Thể tích Zn2+
0,02299M tiêu tốn tại điểm cuối của quá trình chuẩn độ là 17,61 ml. Hãy xác định
nồng độ của Ni2+ ban đầu? ĐS. 0,03664M 9
Chuẩn độ 25,00 ml dung dịch hỗn hợp Cu2+ và Fe3+ hết 16,06 ml dung dịch EDTA
0,05083M. 50,00 ml dung dịch cần xác định nồng độ được cho phản ứng với NH4F để
bảo vệ Fe3+. Sau đó Cu2+ được khử và bảo vệ bằng thiorê. Thêm 25,00 ml EDTA
0,05083M để giải phóng Fe3+ khỏi dạng phức FeF2+. Lượng EDTA dư sau đó được
chuẩn lại bằng dung dịch Pb2+ 0,01883M sử dụng chất chỉ thị xylenol da cam. Thể tích
Pb2+ tiêu tốn là 19,77 ml. Hãy xác định nồng độ của Cu2+ và Fe3+ trong hỗn hợp.
ĐS. Nồng độ của Cu2+ và Fe3+ trong hỗn hợp tương ứng là 0,01468M và 0,017968M
10 Chuẩn độ 50,00 ml EDTA 0,0400M với Cu(NO3)2 0,0800M ở pH = 5,00. Tính pCu tại
các thời điểm thêm được 0,1; 5,0; 10,0; 15,0; 24,0; 25,0; 26,0; 30,0 ml Cu2+. Xây dựng
đường chuẩn độ giữa thể tích Cu2+ và pCu.
Cho biết: ở pH = 5,00, αY4− = 2,9 × 10−7, (là tỉ số giữa nồng độ tự do của Y4- với
tổng nồng độ tự do của tất cả các dạng của EDTA). Hằng số tạo phức giữa Cu2+ và EDTA là βCuY2−= 1018,78. ĐS. 8
11 Chuẩn độ 20,00 ml dung dịch Mg(NO3)2 bằng dung dịch complexon (EDTA, Na2H2Y,
H2Y2–) cùng nồng độ 0,1N trong môi trường pH thích hợp. Hãy xác định pMg (pMg =
–log[Mg2+]) tại điểm tương đương và bước nhảy pMg với sai số ± 0,1%.
Cho biết hằng số bền của phức magie complexonat tại môi trường trên β’ = 4,99.108
ĐS. Tại điểm tương đương pMg = 5,15; bước nhảy pMg từ 4,60 đến 5,69
12 Chuẩn độ 20,00 ml dung dịch Ca(NO3)2 bằng dung dịch complexon (EDTA, Na2H2Y,
H2Y2–) cùng nồng độ 0,1N trong môi trường pH thích hợp. Hãy xác định pCa (pCa = –
log[Ca2+]) tại điểm tương đương và bước nhảy pMg với sai số ± 0,1%.
Cho biết hằng số bền của phức canxi complexonat tại môi trường trên β’ = 3,92.1010
ĐS. Tại điểm tương đương pCa = 6,10; bước nhảy pMg từ 4,60 đến 7,59
CHƯƠNG OXY HÓA KHỬ 1
Từ các thế khử của các cặp oxy-hóa khử sau đây: I2(dung dịch) + 2e– ⇋ 2I– E° = 0,620V I− 3 + 2e– ⇋ 3I– E° = 0,535V
Tính hằng số cân bằng cho phản ứng I − 2(dung dịch) + I– ⇋ I3 ĐS. Kcb = 7×102 2
Tính bước nhảy điện thế và điện thế dung dịch tại điểm tương đương khi định phân
20,00 ml dung dịch Fe2+ 0,1000N bằng dung dịch KMnO4 0,1000N trong môi trường pH = 1.
Cho biết thế oxy hóa-khử tiêu chuẩn: 𝐸𝑜 𝑜 𝑀𝑛𝑂− = 1,51𝑉; 𝐸 = 0,77𝑉; 4 /𝑀𝑛2+ 𝐹𝑒3+/𝐹𝑒2+ 3
Chuẩn độ 100,00 ml dung dịch FeSO4 0,1000N bằng K2Cr2O7 0,1000N, pH của dung
dịch luôn bằng không (pH=0,00). Tính điện thế của dung dịch tại thời điểm thêm được
a. 50,00 ml dung dịch K2Cr2O7
b. 101,00 ml dung dịch K2Cr2O7
c. Tính bước nhảy điện thế trong quá trình chuẩn độ trên với sai số ±0,1%
d. Tính điện thế của dung dịch tại điểm tương đương Cho biết 𝐸𝑜 = 1,36𝑉 𝑜 = 0,77𝑉 𝐶𝑟 2− ; 𝐸 2𝑂7 /𝐶𝑟3+ 𝐹𝑒3+/𝐹𝑒2+ 4
Chuẩn độ 60,00 ml dung dịch Ce4+ 0,1000N bằng Sn2+ 0,1000N trong môi trường axit
mạnh có mặt chất chỉ thị phenylantranilic. Tính điện thế của dung dịch tại thời điểm thêm được a. 30,00 ml dung dịch Sn2+ b. 59,94 ml dung dịch Sn2+ c. 60,00 ml dung dịch Sn2+ d. 60,06 ml dung dịch Sn2+
Tại các thời điểm đó dung dịch có màu gì? Cho biết 𝐸𝑜 𝑜
𝐶𝑒4+/𝐶𝑒3+ = 1,45𝑉; 𝐸𝑆𝑛4+/𝑆𝑛2+ = 0,15𝑉; 9
E° chỉ thị = 1,08V (dạng oxy hóa của chất chỉ thị có màu đỏ, dạng khử của chất chỉ thị không màu) 5
50,00 mL mẫu dung dịch chứa La3+ được phản ứng với với Na2C2O4 để thu được kết
tủa dạng La2(C2O4)3. Sau khi lọc, rửa kết tủa, kết tủa được hòa tan trong axit mạnh,
dung dịch sau đó cho tác dụng với KmnO4 0,006363M hết 18,04mL. Tính nồng độ
La3+ trong dung dịch ban đầu. Tính bước nhảy điện thế và điện thế dung dịch tại điểm
tương đương khi định phân 20,00 ml. 6
Chuẩn độ 50,00 ml dung dịch FeSO4 0,0100 N bằng KMnO4 0,0100 N, pH của dung
dịch luôn bằng không (pH=0,00).
a, Viết phương trình phản ứng chuẩn độ, tính thể tích dung dịch KMnO4 tại điểm tương đương
b, Tính điện thế của dung dịch tại thời điểm thêm được:
b1, 25,00 ml dung dịch KMnO4
b2, 49,95 ml dung dịch KMnO4
b3, 50,00 ml dung dịch KMnO4
b4, 50,05 ml dung dịch KMnO4
c, Nếu trong quá trình chuẩn độ H3PO4 được thêm vào và tạo phức với ion Fe3+. Giả sử
ở điều kiện pH chuẩn độ nồng độ 𝛼𝐹𝑒3+= 10–4 (phần nồng độ tự do của Fe3+ trong dung
dịch trên tổng nồng độ các dạng chứa Fe3+). Hãy tính lại bước nhảy điện thế của dung
dịch với sai số chuẩn độ là ± 0,1% Cho biết: 𝐸𝑜 = 1,51𝑉; 𝑜 = 0,77𝑉; 𝑀𝑛𝑂− 𝐸 4 /𝑀𝑛2+ 𝐹𝑒3+/𝐹𝑒2+ 7
Chuẩn độ 100,00 ml Ce4+ 0,05000M bằng Fe2+ 0,1000M trong môi trường HClO4 1M.
a. Viết phương trình phản ứng chuẩn độ và tính hằng số cân bằng của phản ứng (Kcb)
và tính thể tích Fe2+ tại điểm tương đương (Ve).
b. Hãy tính bước nhảy điện thế của quá trình chuẩn độ với sai số ±0,2%
c. Tính điện thế của dung dịch tại điểm tương đương (nêu cách tính và các điều kiện về
nồng độ tại điểm tương đương). Cho biết 𝐸𝑜 = 1,44𝑉; 𝑜 = 0,77𝑉; 𝐶𝑒4+/𝐶𝑒3+
𝐸𝐹𝑒3+/𝐹𝑒2+ 8
Khí CO trong 20,3 lít mẫu được chuyển hóa thành CO2 khi đi qua dòng hơi I2O5 ở 150°C:
I2O5(rắn) + 5CO(khí) → 5CO2 (khí) + I2(khí)
I2 sau đó được chưng ở nhiệt độ trên và thu hồi bằng chất hấp thụ chứa 8,25 ml Na2S2O3 0,01101M: I 2− 2−
2(dung dịch) + 2𝑆203 (dung dịch) → 2I– (dung dịch) + 𝑆406 (dung dịch)
Lượng dư Na2S2O3 sau đó được chuẩn độ với dung dịch I2 0,00947M hết 2,16 ml. Hãy
tính số mg CO (M = 28,01 g/mol) trong 1 lít mẫu khí ban đầu. ĐS. 0,172 mgCO/l 9
a, 0,3147 g chất chuẩn gốc Na2C2O4 được hòa tan trong H2SO4 và chuẩn độ vừa đủ với 31,672 ml dung dịch KMnO4. 2𝑀𝑛0− 2−
4 + 5𝐶204 + 16H+ → 2Mn2+ +10CO2 (khí) + 8H2O
Hãy tính nồng độ mol/l của dung dịch KMnO4
b, 0,6656g mẫu quặng sắt được khử định lượng về đến Fe2+ sau đó chuẩn độ hết 26,753
ml dung dịch KMnO4. Tính % Fe trong quặng. ĐS. a, 0,02966M, b, 31,68% 10
10 Tính hằng số cân bằng cho phản ứng:
2Fe3+ + 3I– ⇋ 2Fe2+ + 𝐼− 3
Cho biết: Fe3+ + e– ⇋ Fe2+ 0,771V 𝐼− 3 + 2e– ⇋ 3I– 0,536V ĐS. 8,7×107
11 Tính hằng số cân bằng cho phản ứng:
2𝑀𝑛0−4 + 3Mn2+ + 2H2O ⇋ 5MnO2 + 4H+
Cho biết: 𝑀𝑛0−4 + 4H+ + 3e– ⇋ 2MnO2 + 2H2O 1,695V
MnO2+ 4H+ + 2e– ⇋ Mn2+ + 2H2O 1,23V ĐS. 1×1047
12 Chuẩn độ 50,00 ml dung dịch U4+ 0,02500M với Ce4+ 0,1000M, môi trường H2SO4 có
[ H+] = 1M được duy trì trong suốt quá trình chuẩn độ. Phản ứng chuẩn độ: U4+ + 2H 2+
2O + 2Ce4+ → 𝑈02 + 2Ce3+ + 4H+
Cho biết: Ce4++ 1e– ⇋ Ce3+ 1,44𝑉 𝑈02+
2 + 4H+ + 2e– ⇋ U4+ + 2H2O 0,334V
Hãy tính điện thế của dung dịch tại các thời điểm thêm được 5,00 ml Ce4+; 25,10 ml
Ce4+ và điện thế tại điểm tương đương.
ĐS. 0,316V; 1,30V; tại điểm tương đương: 0,782V;
13 Chuẩn độ 50,00 ml dung dịch KMnO4 0,0500 N bằng FeSO4 0,100 N trong môi trường
H2SO4, pH của dung dịch luôn bằng 1 (pH=1,00). Hãy thiết lập công thức và tính thể
tích dung dịch tại điểm tương đương và bước nhảy điện thế với sai số ± 0,1%. Nếu sử
dụng chất chỉ thị feroin có E° chỉ thị = 1,11V (dạng oxy hóa của chất chỉ thị có màu
đỏ, dạng khử của chất chỉ thị không màu) thì phép chuẩn độ mắc sai số bằng bao nhiêu
và khi đó dung dịch có màu gì? Cho biết: 𝐸𝑜 = 1,51𝑉; 𝑜 = 0,77𝑉; 𝑀𝑛𝑂− 𝐸 4 /𝑀𝑛2+ 𝐹𝑒3+/𝐹𝑒2+
ĐS. Tại điểm tương đương E = 1,31V; bước nhảy điện thế từ 1,38 đến 0,95V; sai số
của phép chuẩn độ là +1,74×10–4;
14 Chuẩn độ 25,00 ml dung dịch FeSO4 0,100 N bằng KMnO4 0,0500 N trong môi trường
H2SO4, pH của dung dịch luôn bằng 1 (pH=1,00). Hãy thiết lập công thức và tính thể
tích dung dịch tại điểm tương đương và bước nhảy điện thế với sai số ± 0,1%. Nếu sử
dụng chất chỉ thị phenyltranilic có E° chỉ thị = 1,08V thì khi chất chỉ thị đổi màu phép
chuẩn độ mắc sai số bằng bao nhiêu? Cho biết: 𝐸𝑜 = 1,51𝑉; 𝑜 = 0,77𝑉; 𝑀𝑛𝑂− 𝐸 4 /𝑀𝑛2+ 𝐹𝑒3+/𝐹𝑒2+
ĐS. Tại điểm tương đương E = 1,31V; bước nhảy điện thế từ 1,95 đến 1,38V; sai số
của phép chuẩn độ là –5,63×10–4 %;
CHƯƠNG KẾT TỦA 1
Tính độ tan của AgBr trong dung dịch NaBr 0,10M và [NH3] = 0,10M (không kể lực ion). Cho biết T +
AgBr = 10–13; phức [Ag(NH3)2 ] có β1=103,31; β1,2 = 107,22 11 2
Bỏ qua ảnh hưởng của pH hãy tính độ tan của NiS trong dung dịch [NH3] = 0,10M. Cho biết T 2+
NiS = 3,6.10–19; phức [Ni(NH3)4 ] có β1=102,7; β1,2 = 104,8; β1,2,3 = 106,4; β1,2,3,4 = 107,4. 3
Tính độ tan của CaC2O4 trong dung dịch CaCl2 0,10M và pH = 3,00 (không kể ảnh
hưởng của lực ion). Cho biết TCaC = 10–9; axit H 2O4
2C2O4 có Ka1 = 5,4×10–2, Ka2 = 5,42×10–5 4
Tính độ tan của AgCl trong nước và trong dung dịch NH4Cl 0,12M + NH3 0,10M
(nồng độ NH3 không bị proton hóa là 0,10M). Cho biết . Cho biết TAgCl = 2. 10–10; phức [Ag(NH +
3)2 ] có β1=103,2; β1,2 = 107,0.
ĐS. Trong nước: s = 1,41.10–5M; trong dung dịch đệm s = 1,67×10–4 (mol/l) 5
Bỏ qua ảnh hưởng của pH, tính độ tan của ZnS trong dung dịch dịch [NH3] = 0,10M. Cho biết T 2+
ZnS = 10–24; phức [Zn(NH3)4 ] có β1=102,2; β1,2 = 104,4; β1,2,3 = 106,7; β1,2,3,4 = 108,7. 6
Tính nồng độ của Fe3+ sử dụng để xác định điểm cuối của quá trình chuẩn độ theo
phương pháp Volhard: Thực nghiệm chỉ ra rằng màu đỏ của phức Fe(SCN)2+ vẫn còn
thấy được khi nồng độ của nó là 6,4.10-6M. Chuẩn độ 50,00 ml dung dịch Ag+
0,0500M với 0,1000M KSCN. Nồng độ của Fe3+ là bao nhiêu để sai số của phép chuẩn
độ là 0%. Cho biết hằng số bền của phức Fe(SCN)2+ là 1,05.103. Tích số tan của AgSCN là 1,1.10-12. ĐS. [Fe3+] = 0,036M 7
Liệu có khả năng kết tủa 99,0% Ce3+ trong hỗn hợp Ce3+ 0,010M và Ca2+ 0,010M bằng cách thêm oxalat (𝐶 2−
204 ) mà không làm kết tủa CaC2O4 hay không?
Cho biết: tích số tan của CaC2O4 là 1,3×10–8 và Ce2(C2O4)3 là 3×10–29
ĐS. Ca2+ không bị kết tủa 8
Tính nồng độ của Cu2+ trong dung dịch chứa Br– 0,10M và chất ít tan CuBr. Cho biết
tích số tan của CuBr là: 5×10–9 ĐS. 5×10–8M 9
Một dung dịch chứa Ca2+ 0,0500M và Ag+ 0,0300M. Có thể sử dụng dung dịch
sunphat để kết tủa 99% Ca2+ mà Ag+ chưa bị kết tủa hay không? Với nồng độ nào của
Ca2+ thì Ag2SO4 bắt đầu kết tủa?
Cho biết: tích số tan của CaSO4 là 2,4×10–5 và Ag2SO4 là 1,5×10–5
ĐS. Ag+ bị kết tủa; với nồng độ 0,0014M
10 Một dung dịch chứa Ba2+ 0,010M và Ag+ 0,010M. Có thể kết tủa 99,90% một ion bằng Cr02−
4 mà ion kia không bị kết tủa hay không?
Cho biết: tích số tan của BaCrO4 là 2,1×10–10 và Ag2CrO4 là 1,2×10–12 ĐS. Không thể
11 Trộn 75,0 ml dung dịch AgNO3 với 25,0 ml dung dịch Na2CrO4 cùng nồng độ 0,15M
trong môi trường pH ổn định bằng 3. Hãy cho biết ion 𝐶𝑟𝑂2−
4 đã kết tủa hoàn toàn hay
chưa? Cho biết Tích số tan của Ag2CrO4 là 1,0.10–12, axit H2CrO4 có Ka1 = 8.10–1, Ka2 = 3,2.10–7.
ĐS. Chưa kết tủa hoàn toàn
12 Trộn 75,0 ml dung dịch AgNO3 với 25,0 ml dung dịch Na2C2O4 cùng nồng độ 0,15M 12
trong môi trường pH ổn định bằng 4. Hãy cho biết ion 𝐶 2−
2𝑂4 đã kết tủa hoàn toàn hay
chưa? Cho biết Tích số tan của Ag2C2O4 là 1,0.10–11, axit H2C2O4 có Ka1 = 8,8.10–2, Ka2 = 5,1.10–5.
ĐS. Đã kết tủa hoàn toàn
13 Trộn 20,0 ml dung dịch CaCl2 0,02M với 30,0 ml dung dịch Na2C2O4 0,22M. Hỏi có
kết tủa hoàn toàn được ion Ca2+ hay không? Tại sao? Biết tích số tan của CaC2O4 là 2,3×10–9.
14 Tính độ tan của kết tủa FeCO3 trong dung dịch pH = 3. Cho biết tích số tan của FeCO3
= 2,1x10–11 và axit H2CO3 có pKa1 = 6,35; pKa2 = 10,33.
15 Tính độ tan của kết tủa ZnCO3 trong dung dịch đệm NH4Cl 0,01M + NH3 0,1M. Biết
NH3 có pKb = 4,75. Tích số tan của ZnCO3 là 1,2x10–10 và axit H2CO3 có pKa1 = 6,35; pK 2+
a2 = 10,33; phức [Zn(NH3)4 ] có β1=102,2; β1,2 = 104,4; β1,2,3 = 106,7; β1,2,3,4 = 108,7.
16 Tính độ tan của kết tủa Ag2CrO4 trong dung dịch AgNO3 0,1M có môi trường pH = 3.
Cho biết: tích số tan của Ag2CrO4 là 1,0x10–12; axít H2CrO4 có Ka1 = 8.10–1, Ka2 = 3,2.10–7.
17 Chuẩn độ 50,0 ml dung dịch NaCl 0,1M bằng dung dịch AgNO3 0,1M. Điểm kết thúc
chuẩn được nhận biết bằng cách thêm vào dung dịch định phân 1 ml dung dịch
K2CrO4. Tính nồng độ K2CrO4 cần dùng để sai số của phép chuẩn độ trong khoảng ±
0,1%. Cho biết tích số tan của AgCl là 1,8×10–10; tích số tan của Ag2CrO4 là 1,2×10–
12; Khối lượng mol của K2CrO4 là 194 g/mol.
18 Chuẩn độ 60,0 ml dung dịch NaCl 0,1N bằng dung dịch AgNO3 0,05N. TAgCl =
1,8×10–10. Tính pAg tại điểm tương đương và tại thời điểm sai số của phép chuẩn độ ± 0,1%.
19 Chuẩn độ 50,0 ml dung dịch AgNO3 0,05M bằng dung dịch KSCN 0,1M. TAgSCN =
1,0×10–12. Tính pSCN tại điểm tương đương và tại thời điểm sai số của phép chuẩn độ ± 0,2%.
20 Chuẩn độ 50,0 ml dung dịch hỗn hợp của I– 0,08M và Cl– 0,1M bằng dung dịch
AgNO3 0,1M. Hỏi khi thêm 25,0 ml AgNO3 0,1M thì bao nhiêu % I- đã được chuẩn
độ? Cho biết: TAgI = 8,5×10–17, TAgCl = 1,8×10–10. 21 Tính độ tan của AgCl a. Trong nước
b. Trong dung dịch NH3 0,10M và NaCl 0,010M. Cho biết . Cho biết tích số tan TAgCl = 1.8.10–10; phức [Ag(NH +
3)2 ] có β1=103,2; β1,2 = 107,0, NH3 có Kb = 10–4.75 22 Tính độ tan của AgBr a. Trong nước
b. Trong dung dịch NH3 0,10M và NaBr 0,010M. Cho biết . Cho biết tích số tan TAgBr = 5,0.10–13; phức [Ag(NH +
3)2 ] có β1=103,2; β1,2 = 107,0, NH3 có Kb = 10–4.75 13



