

Preview text:
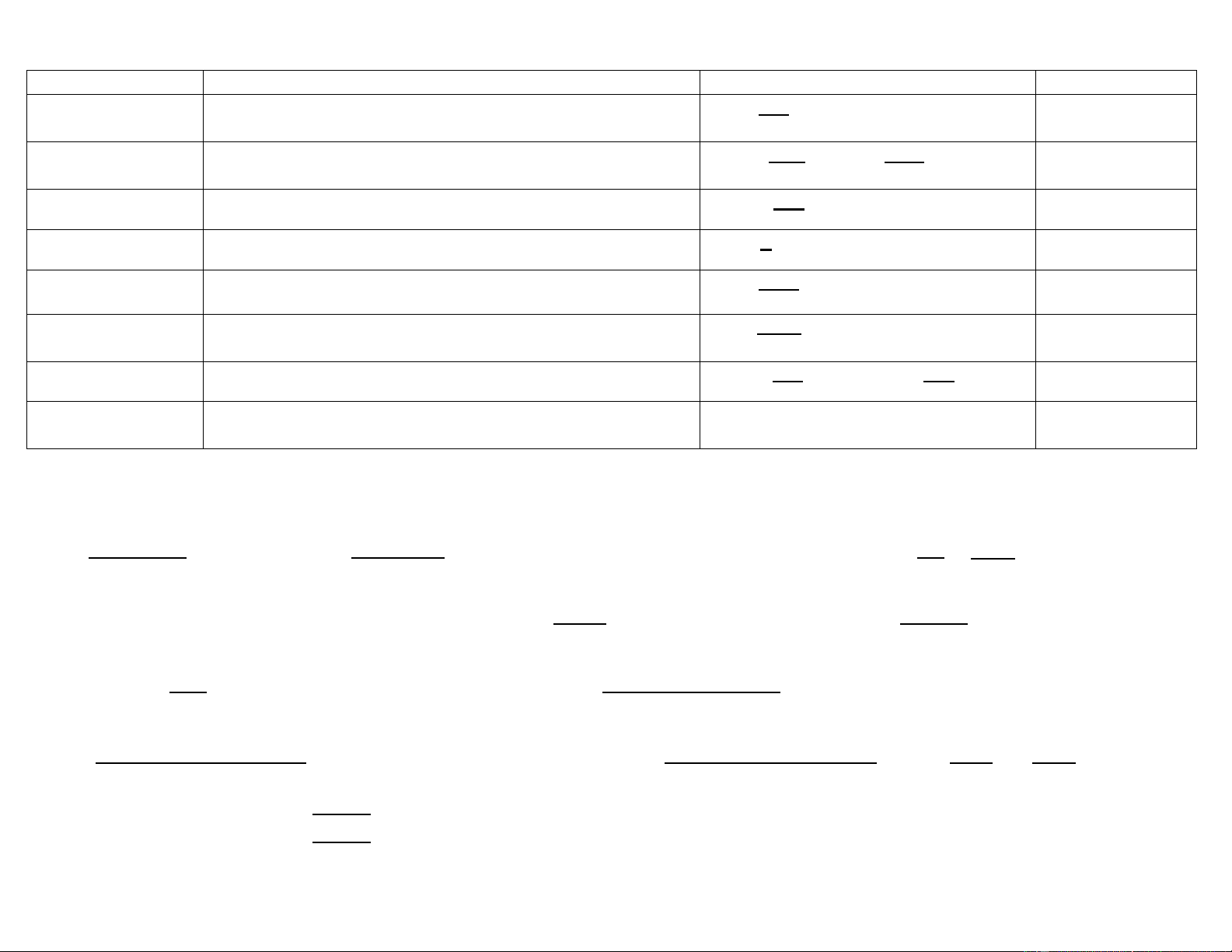
BẢNG TÓM TẮT CÔNG THỨC CÁC LOẠI NỒNG ĐỘ DUNG DỊCH CÁC LOẠI KHÁI NIỆM CÔNG THỨC ĐƠN VỊ Nồng độ khối
Số gam chất tan có trong 1 lít dung dịch. C × 1000 g/l lƣợ g/l = ng (nồng độ g/l)
Nồng độ phần trăm Số gam chất tan có trong 100g dung dịch. C% = × 100 = × 100 % (theo khối lƣợng)
Nồng độ phần triệu Khối lƣợng cấu tử trong 106lần khối lƣợng mẫu. ppm = mg/l hay Nồng độ mol C M
Số mol chất tan có trong 1 lít dung dịch. CM = × 1000 M Nồng độ molan C m
Số mol chất tan có trong 1000g dung môi. Cm = × 1000 Molan Nồng độ đƣơng
Số đƣơng lƣợng chất tan có trong 1 lít dung dịch. C × 1000 N lƣợ N = ng C N Độ chuẩn T
Số gam hay miligam chất tan có trong 1ml dung dịch. T g/ml = hay T × 1000 g/ml mg/l =
Độ chuẩn theo chất Số gam hay miligam chất X tác dụng vừa đủ với 1 ml dung T × Đ C/X = NC X ml xác định TC/X dịch chuẩn X.
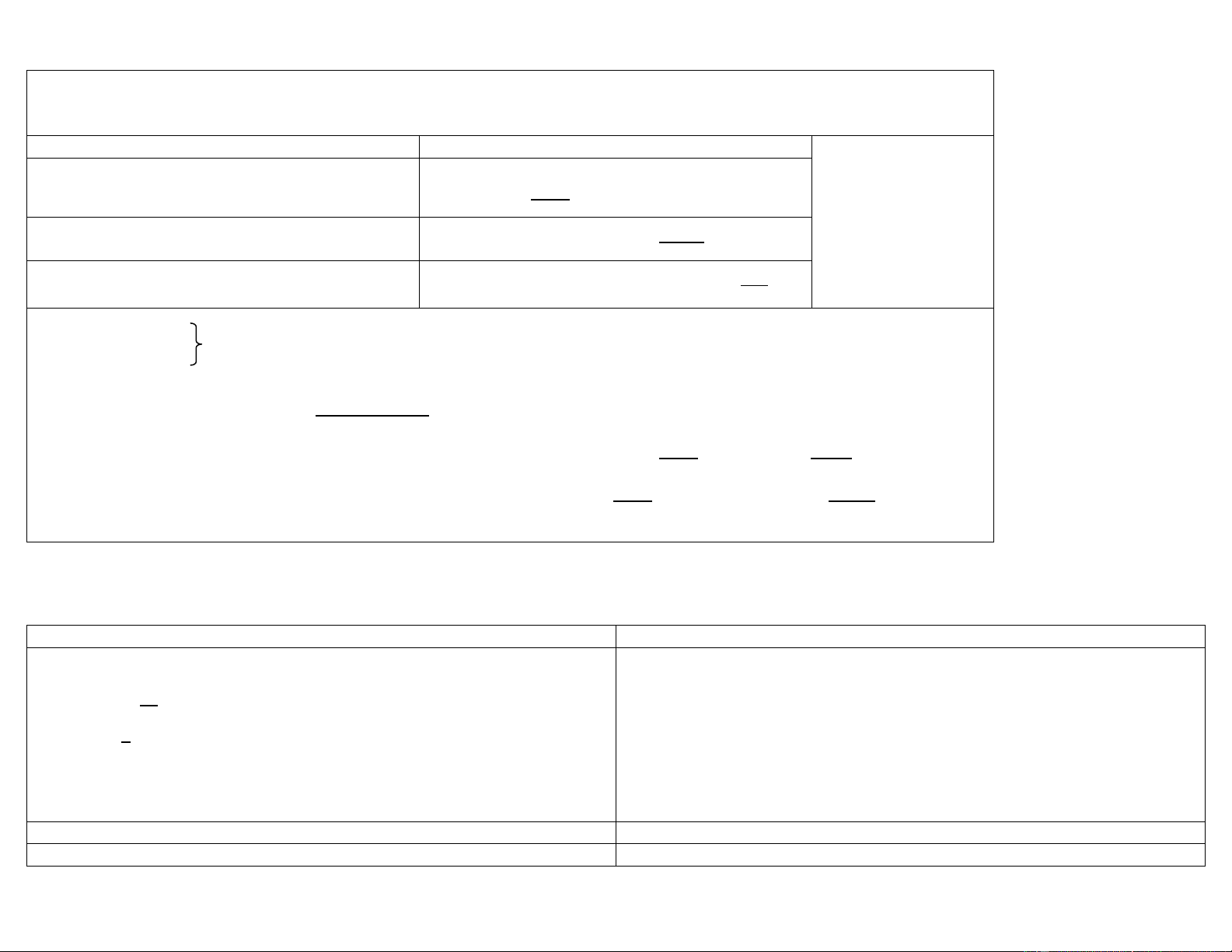
MỘT VÀI CÔNG THỨC CẦN NHỚ CM = N = N = C =
M × z (NV)A = (NV)B hay
m = N × V × Đ (khối lƣợng đƣơng lƣợng) m =
(khối lƣợng cân) V(ml) = (thể tích pha) m + A = mA ×
(tính có ppm) m cân(ion) = X% =
(f hàm lƣợng pha loãng) X f = g/l = KAmBn = nnmmSm+n S = √ Dung dịch Công thức Đơn axit mạnh Ca ≥ 10-6 pH = -lg Ca
Đơn bazơ mạnh Cb ≥ 10-6
pOH = -lg Cb hay pH = 14 + lg Cb Đơn axit yếu [H+] = √ ‒‒ hay pK lg C a a Đơn bazơ yếu
[OH-] = √ hay pH = 7 + pK lgC (pK a + b hay pOH = b + pCb) Đa axit với K1 ≥ 104K2 Như đơn axit Đa bazơ với K1 ≥ 104K2 Như đơn bazơ Muối lƣỡng tính NaHA
[H+] = √ hay pH = (pK 1 + pK2) Dung dịch đệm pH = pKa - log
PHƢƠNG PHÁP CHUẨN ĐỘ OXI – KHỬ
Một vài điểm chú ý: - Nếu dạng oxy hóa hay khử là chất rắn thì chấp nhận hoạt độ bằng đơn vị (bằng 1). Nồng độ của dung môi (H O) đƣợ 2
c coi là hằng số đã đƣa vào trị số E0, do đó không có trong biểu thức logarit. Nếu chất phản ứng là chất khí, tat
hay nồng độ trong biểu thức logarit là áp suất 0’
THẾ OXI HÓA CHUẨN ĐIỀU KIỆN E CÔNG THỨC
Tham gia vào phản ứng trao đổi proton
Ox + ne- + mH+ Kh + m/2H2O 0’ E = E0 [ ] ox/kh -
Tham gia vào phản ứng tạo tủa
Tham gia vào phản ứng tạo phức Ox1 + n1e- Kh1
n2Ox1 + n1Kh2 n2Kh1 + n1Ox2 Ox2 + n2e- Kh2
Hằng số cân bằng của cân bằng trên trong trên trong trƣờng hợp dung dịch loãng: [ ] [ ] K = [ ] [ ]
Nếu không có sự tham gia của phản ứng phụ: lgK = ’
Nếu có sự tham gia của phản ứng phụ: lgK =
PHƢƠNG PHÁP PHÂN TÍCH KHỐI LƢỢNG TÊN CÔNG THỨC CHÚ THÍCH Hệ số chuyển F:
ag : khối lƣợng mẫu đem phân tích
- Nếu dạng cân cũng là dạng cần tính hàm lƣợng: %X =
P: phân tử lƣợng dạng cân - F =
G: khối lƣợng dạng xác định ứng với 1 phân tử gam dạng cân. a. Mẫu ở dạng rắn
- Nếu dạng cân cũng là dạng cần tính hàm lƣợng: %X =



