





Preview text:
Bài thực hành
RỐI LOẠN TIẾT NIỆU VÀ SỐC MẤT MÁU THỰC NGHIỆM 1. Mục tiêu: 1.1.
Nhận định được sự thay đổi mạch, huyết áp, hô hấp và số lượng
nước tiểutrong các thực nghiệm. 1.2.
Giải thích được cơ chế các biểu hiện trong rối loạn tiết niệu và
sốc mất máuthực nghiệm. 1.3.
Liên hệ lâm sàng với các trường hợp rối loạn tiết niệu và sốc mất máu. 1.4.
Thể hiện được tính nghiêm túc, tích cực, khả năng tư duy trong
quá trìnhthực hành. 2. Chuẩn bị
2.1. Súc vật: 01 con chó khỏe mạnh trên 10 kg.
2.2. Hóa chất: - Adrenalin 1/10.000; Adrenalin 1/100.000. - Glucose 5%, 30%. - Heparin, novocain 3%.
2.3. Dụng cụ: - Máy Kimographe, bộ ghi huyết áp
- Canuyn luồn động mạch, tĩnh mạch.
- Bơm tiêm các loại: 5ml, 2ml, 1ml.
-Bộ dụng cụ để mổ chó, bộ dây truyền máu, cốc chia độ, 2 ống sonde niệu quản chó.
3.Tiến hành thí nghiệm
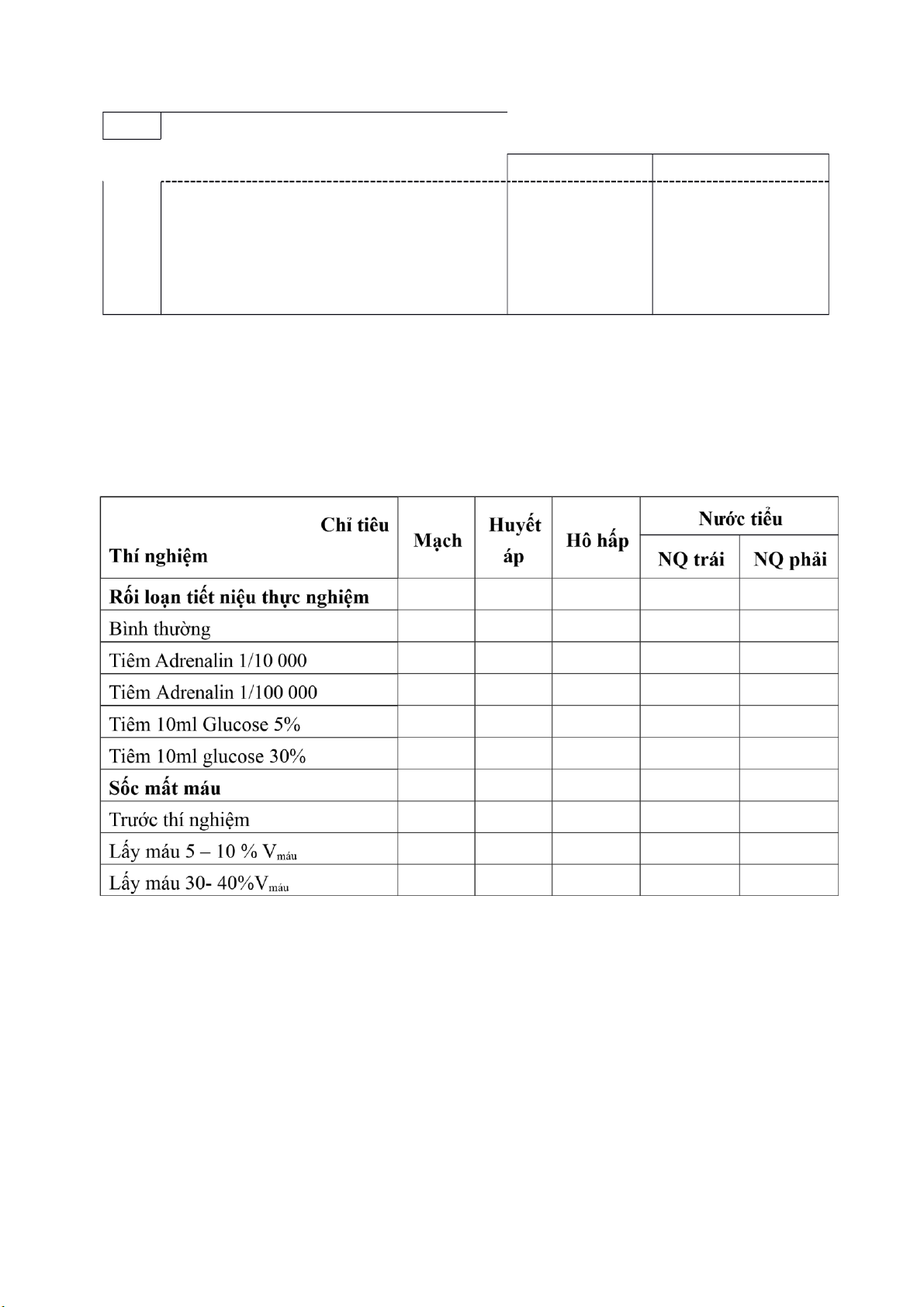
3.1. Thí nghiệm rối loạn tiết niệu thực nghiệm STT
Các bước thực hiện Ý nghĩa
Yêu cầu phải đạt
Chuẩn bị súc vật thí nghiệm: Cố định Chuẩn bị Đảm bảo cho tiến chó lên bàn mổ,
bộc lộ động mạch cảnh, cho kỹ thuật hành thí nghiệm thành 1
nối với bộ ghi HA, bộc lộ động mạch, thí nghiệm công.
tĩnh mạch đùi, bộc lộ niệu quản 2 bên, đặt sonde niệu quản
Ghi chỉ tiêu bình thường của chó: Theo dõi các Theo dõi và ghi lại + Mạch (nhịp/phút): chỉ tiêu bình chính xác
+ Huyết áp (tối đa/tối thiểu) thường để so
+ Hô hấp (tần số: nhịp/phút; biên độ: sánh với sự 2 nông hay sâu) thay đổi của
+Nước tiểu 2 niệu quản (giọt/phút) chúng khi làm thí nghiệm.
3 Tiến hành tiêm 10 ml Glucose 5% qua Tiêm vị trí chính xác tĩnh mạch đùi chó. Ý nghĩa
Yêu cầu phải đạt
Ghi các chỉ tiêu: Mạch, huyết áp, hô hấp và nước tiểu
Tiến hành tiêm 10 ml Glucose 30% qua Tiêm vị trí chính xác tĩnh mạch đùi chó. 4
Ghi các chỉ tiêu: Mạch, huyết áp, hô hấp và nước tiểu
Tiêm 2ml Adrenalin 1/100.000 vào tĩnh Thay đổi Tiêm vị trí chính xác mạch đùi chó. các chỉ tiêu sinh tồn sau khi tiêm Adrenalin 1/100.000
5 Theo dõi và ghi chỉ tiêu sau khi tiêm So sánh sự Theo dõi và nhận Adrenalin
1/100.000 thay đổi các định kết quả chính + Mạch (nhịp/phút): chỉ tiêu với xác
+ Huyết áp (tối đa/tối thiểu) bình thường + Hô hấp (tần
số: nhịp/phút; biên độ: nông hay sâu)
+Nước tiểu 2 niệu quản (giọt/phút)
Khi các chỉ tiêu trở về bình thường tiến Thay đổi Tiêm vị trí chính xác hành
tiêm 2ml Adrenalin 1/10.000 vào các chỉ tiêu tĩnh mạch chó. sinh tồn sau khi tiêm Adrenalin 1/10.000
Theo dõi và ghi chỉ tiêu sau khi tiêm So sánh sự Theo dõi và nhận 4 Adrenalin 1/10.000 thay đổi các định kết quả chính + Mạch (nhịp/phút): chỉ tiêu với xác
+ Huyết áp (tối đa/tối thiểu) bình thường + Hô hấp
(tần số: nhịp/phút; biên độ: và so sánh nông hay sâu) với tiêm
+Nước tiểu 2 niệu quản (giọt/phút) adrenalin nồng độ 1/100.000. 6 Thảo luận: Sinh viên có Giải thích được cơ
- Giải thích cơ chế sự thay đổi các chỉ số khả năng tư chế sự thay đổi các khi tiêm
Glucose 5%, 30%. Adrenalin duy và giải chỉ số đặc biệt số 1/100.000, 1/10.000.
thích được lượng nước tiểu. Liên - Liên hệ lâm sàng. cơ chế sự hệ được với lâm sàng. Ý nghĩa
Yêu cầu phải đạt thay đổi các chỉ tiêu sinh tồn
3.2. Thí nghiệm sốc mất máu STT
Các bước thực hiện Ý nghĩa
Yêu cầu phải đạt
Chuẩn bị súc vật thí nghiệm: Cố định chó lên
bàn mổ, bộc lộ động mạch cảnh,
1 nối với bộ ghi HA, bộc lộ động mạch, tĩnh mạch
đùi, bộc lộ niệu quản 2 bên, đặt sonde niệu quản
Ghi chỉ tiêu bình thường của chó:
Theo dõi các chỉ Theo dõi và ghi lại + Mạch (nhịp/phút):
tiêu bình thường chính xác
+ Huyết áp (tối đa/tối thiểu) để so sánh với sự 2
+ Hô hấp (tần số: nhịp/phút; biên độ: thay đổi của nông hay sâu) chúng khi làm
+Nước tiểu 2 niệu quản (giọt/phút) thí nghiệm. Gây mất
máu giai đoạn I: tháo 5 – 10 % Gây mất máu thể tích máu chó ra ngoài giai đoạn I
Theo dõi và ghi chỉ tiêu khi mất 5-10% So sánh sự thay Theo dõi và nhận thể tích
máu: đổi các chỉ tiêu định kết quả đúng 3
+ Mạch (nhịp/phút): với
bình thời điểm và chính
+ Huyết áp (tối đa/tối thiểu) thường và đánh xác + Hô hấp (tần
số: nhịp/phút; biên độ: giá khả năng nông hay sâu) thích nghi của
+Nước tiểu 2 niệu quản (giọt/phút) con vật.
Gây mất máu giai đoạn II: tháo tiếp đến Gây mất máu Tháo đến khi huyết
30 – 40 % thể tích máu chó ra ngoài. giai đoạn II áp đạt 50/40mmHg Theo dõi và
ghi chỉ tiêu khi mất 30-40% So sánh sự thay Theo dõi và nhận thể tích máu: đổi
các chỉ tiêu định kết quả đúng 4
+ Mạch (nhịp/phút): so với bình thời điểm và chính
+ Huyết áp (tối đa/tối thiểu) thường và với xác + Hô
hấp (tần số: nhịp/phút; biên độ: giai đoạn đầu nông hay sâu) của sốc mất
+Nước tiểu 2 niệu quản (giọt/phút) máu. 5
Truyền trả lại máu chó: Máu chảy ra Sinh viên có Giải thích được cơ được chống
đông và lọc kỹ rồi truyền khả năng tư chế sự thay đổi các trả lại vào tĩnh mạch
chó. Theo dõi và duy và giải chỉ số. Liên hệ ghi chỉ tiêu khi truyền trả lại máu:
thích được cơ được với lâm sàng. lOMoARcPSD| 51038363 STT
Các bước thực hiện Ý nghĩa
Yêu cầu phải đạt + Mạch (nhịp/phút): chế các giai
+ Huyết áp (tối đa/tối thiểu)
đoạn sốc mất + Hô hấp
(tần số: nhịp/phút; biên độ: máu và truyền nông hay sâu) máu cấp cứu
+Nước tiểu 2 niệu quản (giọt/phút) kịp thời.
*Chú thích: Chó > 10kg lượng máu bằng 1/13 trọng lượng cơ thể, chó ≤ 10 kg lượng
máu bằng 1/15 trọng lượng cơ thể).
4. Trình bày kết quả thí nghiệm
Sinh viên được chia nhóm, phân công quan sát các chỉ tiêu và ghi kết quả vào bảng nghiên cứu sau:
Phân tích và giải thích kết quả (Lưu ý tùy vào tình trạng của con vật và điều kiện
tiến hành thí nghiệm kết quả của từng ngày có thể không hoàn toàn giống nhau).
KỸ THUẬT CẤY NƯỚC TIỂU TRONG XÁC ĐỊNH NHIỄM TRÙNG TIẾT NIỆU Mục tiêu: 1.
Mô tả được phương pháp lấy nước tiểu giữa dòng, cách vận chuyển và bảo quảnbệnh phẩm 2.
Nhận định được được kết quả cấy đếm mẫu nước tiểu. Nội dung:
Downloaded by Nguy?n Th?o Ly (lytoet0807@gmail.com) l
Nước tiểu chiếm tỷ lệ cao trong số các bệnh phẩm gửi tới phòng xét nghiệm vi sinh lâm
sàng. Những vị trí trên đường tiết niệu hay bị nhiễm trùng nhất là niệu đạo và bàng quang, từ
đó nhiễm trùng ngược dòng lan lên niệu quản, đài bể thận. Bệnh viêm đường tiết niệu có thể
biểu hiện dưới dạng cấp tính, mạn tính hoặc không có biểu hiện triệu chứng lâm sàng.
Bình thường đường tiết niệu vô khuẩn, trừ phần niệu đạo trước có thể gặp một số vi khuẩn
là thành viên của hệ vi khuẩn chí bình thường trên vùng da lân cận.
Căn nguyên gây viêm đường tiết niệu có thể do nhiều vi sinh vật khác nhau, ở đây chúng
ta chỉ đề cập đến căn nguyên vi khuẩn. Phần lớn vi khuẩn gây viêm đường tiết niệu là vi khuẩn
đường ruột, trong đó E. coli là vi khuẩn đứng đầu, chiếm tới hơn 90% các trường hợp. Ngoài
ra có thể gặp do Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus
sprophyticus, Enterococcus faecalis, Klebsiella pneumoniae, Proteus spp., Providencia spp.,
Pseudomonas aeruginosa, Enterobacter spp., Serratia spp., Mycobacterium tuberculosis.
Thông thường thì thủ phạm gây viêm đường tiết niệu chỉ do một loại vi khuẩn, rất hiếm
khi gặp các trường hợp do 2 loại vi khuẩn gây nên.
1. Kỹ thuật lấy nước tiểu -
Trừ những trường hợp đặc biệt, bệnh phẩm được lấy khi tiến hành các thủ thuật như
thôngtiểu, nội soi bàng quang, chọc hút trên xương mu; còn trong đa số các trường hợp, bệnh
phẩm được lấy theo phương pháp lấy nước tiểu giữa dòng, lấy bằng phương pháp vô trùng,
trong đó quan trọng là phải rửa sạch bộ phận sinh dục ngoài trước khi hứng lấy nước tiểu giữa dòng. -
Dụng cụ đựng nước tiểu để làm xét nghiệm vi sinh lâm sàng cũng phải phù hợp, nghĩa
làphải dùng các lọ vô trùng và có thể hứng lấy nước tiểu dễ dàng cũng như không chảy, thấm
ra ngoài trong quá trình chuyên chở đến phòng xét nghiệm. Thích hợp nhất là các lọ dung tích
50-100ml, vô trùng, miệng rộng, có nắp vặn chặt và có nhãn để ghi tên bệnh nhân cũng như
các thông tin tối thiểu khác về bệnh phẩm. -
Trên thực tế lâm sàng, dụng cụ lấy nước tiểu rất ít khi được sử dụng đúng, rất nhiều nơi
chỉdùng các lọ thủy tinh kiểu chai đựng thuốc được rửa sạch, nhét bông hay các ống thủy tinh
nhét bông rồi sấy hay hấp vô trùng. Các dụng cụ và vật liệu như vậy không chỉ rất khó hứng
nước tiểu giữa dòng mà nước tiểu còn dễ bị thấm ra miệng lọ hay ống gây nguy cơ ngoại nhiễm
cho mẫu và còn có thể nguy hiểm cho người xét nghiệm. -
Ngoài ra cũng có nhiều nơi, lâm sàng không quan tâm hướng dẫn hay giúp bệnh nhân
lấyđúng nước tiểu giữa dòng và lấy vô trùng, thậm chí có khi bệnh nhân lại lấy nước tiểu trong
bô để đưa đi xét nghiệm. Chính vì vậy mẫu nước tiểu gửi đến phòng xét nghiệm có thể bị ngoại
nhiễm và gây sai lệch kết quả. -
Nước tiểu cần được lấy trước khi bệnh nhân dùng kháng sinh, nếu bệnh nhân đang
dùng kháng sinh, cần dừng sử dụng kháng sinh ít nhất 24 giờ trước khi lấy nước tiểu. Thời
điểm lấy nước tiểu tốt nhất là buổi sáng sớm, trong đêm bệnh nhân cố nhịn tiểu tới khi lấy mẫu. -
Nước tiểu sau khi lấy cần được chuyển ngay tới phòng xét nghiệm. Nếu chưa xét
nghiệmđược ngay, mẫu nước tiểu cần được giữ trong tủ lạnh 40C nhưng không được quá 4 giờ.
Sau đây là các phương pháp lấy nước tiểu từ bệnh nhân:
* Đối với bệnh nhân nữ:
- Rửa tay kỹ bằng xà phòng, lau khô bằng khăn/gạc sạch.
- Bệnh nhân cởi quần, ngồi dạng chân, rửa bộ phận sinh dục ngoài bằng xà phòng,
thấmkhô bằng gạc vô trùng từ trong ra ngoài, giữ cho các môi của âm hộ tách biệt. l
- Đi tiểu bỏ phần nước tiểu đầu dòng, lấy phần nước tiểu còn lại vào lọ hoặc ống
vôtrùng, nắp kín, gửi ngay đến phòng xét nghiệm.
* Đối với bệnh nhân nam:
- Rửa tay kỹ bằng xà phòng, lau khô bằng khăn/gạc sạch.
- Kéo bao quy đầu tụt ra sau (nếu đầu dương vật bị phủ kín).
- Rửa bộ phận sinh dục bằng xà phòng, thấm khô bằng khăn/gạc sạch.
- Đi tiểu bỏ phần nước tiểu đầu dòng, lấy phần nước tiểu còn lại vào lọ hoặc ống
vôtrùng, nắp kín, gửi ngay đến phòng xét nghiệm.
* Đối với trẻ nhỏ: cho trẻ uống nhiều nước trước khi lấy nước tiểu. Để trẻ ngồi trên đùi mẹ,
rửa sạch bộ phận sinh dục ngoài rồi xi bé tiểu, hứng lấy nước tiểu vào lọ hoặc ống vô trùng.
* Cách thu thập mẫu nước tiểu:
+ Nước tiểu giữa dòng:
Đây là loại nước tiểu thường thu thập gửi đến phòng xét nghiệm nhất. Thời điểm lấy tốt
nhất là vào buổi sáng, lúc này vi khuẩn đã có thời gian sinh sôi trong đêm tại bàng quang. Lưu
ý cần phải loại bỏ (khoảng 30 ml) phần nước tiểu đầu dòng vì phần này thường bị ngoại nhiễm
các vi khuẩn thường trú tại vùng niệu-sinh dục. Lượng nước tiểu 30 ml sau đó được lấy vào lọ
vô trùng miệng rộng (thể tích khoảng 50ml). Đậy chặt nắp lọ sau khi lấy xong.
+ Lấy nước tiểu qua ống dẫn lưu:
Bệnh nhân có ống dẫn lưu nước tiểu là đối tượng có nguy cơ cao mắc nhiễm trùng đường tiết niệu.
Để tránh ngoại nhiễm, cần sát trùng vùng catheter rút nước tiểu bằng alcohol 900,rút nước
tiểu bằng kim tiêm vô trùng.
Lưu ý: không thu thập nước tiểu trong túi chứa nước tiểu và đầu catheter ống dẫn lưu nước tiểu
để nuôi cấy thường có nhiều vi khuẩn thường trú tăng sinh.
Lấy nước tiểu qua chọc hút trên xương mu, từ thận, niệu quản, bàng quang qua can thiệp phẫu
thuật, thủ thuật: Đây là các phương pháp khá xâm lấn để thu thập nước tiểu mà không bị ngoại
nhiễm. Kết quả nuôi cấy từ bệnh phẩm này phản ánh khá chính xác tình trạng nhiễm trùng tiểu.
* Vận chuyển và bảo quản mẫu
- Mẫu nước tiểu cần được đưa xuống phòng xét nghiệm ngay trong vòng 2 giờ để nuôi cấy.
- Nếu không thể vận chuyển được ngay đến phòng xét nghiệm thì giữ trong ngăn mát tủ lạnh40 C trong vòng 18 giờ.
Tiêu chuẩn từ chối mẫu:
- Bệnh phẩm không có dán nhãn thông tin.
- Bệnh phẩm rò rỉ, chảy ra khỏi dụng cụ chứa bệnh phẩm.
- Bệnh phẩm là đầu catheter ống dẫn lưu nước tiểu.
- Nước tiểu đựng trong môi trường tăng sinh.
- Nước tiểu trên 48 giờ (nếu không bảo quản trong môi trường acid boric)
2. Xét nghiệm trực tiếp (nhuộm soi nước tiểu)
Xét nghiệm trực tiếp vừa giúp sớm có chẩn đoán sơ bộ vừa giúp ra quyết định có cần
nuôi cấy mẫu nước tiểu hay không.
* Nhuộm soi nước tiểu chưa quay ly tâm:
Trộn đều nước tiểu rồi nhỏ 1 giọt trực tiếp trên lam kính. Chờ khô tự nhiên sau đó nhuộm
gram và quan sát trên kính hiển vi dưới vật kính dầu. l -
Nếu có ít nhất 1 tế bào vi khuẩn và /hay bạch cầu hiện diện trên một vi trường, có thể
nghingờ bệnh nhân bị nhiễm trùng tiết niệu. Trường hợp này có thể làm kháng sinh đồ trực tiếp
từ mẫu nước tiểu này. -
Nếu toàn phết nhuộm không có hay phát hiện được rất ít tế bào vi khuẩn hay bạch cầu,
bệnhnhân chắc chắn không bị nhiễm trùng tiết niệu.
* Ly tâm nước tiểu, nhuộm soi cặn lắng -
Hiện nay vẫn có một số phòng xét nghiệm làm tiêu bản nhuộm gram cặn lắng nước tiểu
sauly tâm và trả lời cho lâm sàng các hình ảnh vi khuẩn gram quan sát được. Thật sự kết quả
này không có ý nghĩa gì trong việc cho biết bệnh nhân có hay không bị nhiễm trùng tiết niệu
và bị nhiễm trùng do vi khuẩn gram nào vì đa số các cặn lắng nước tiểu dù không bị nhiễm
trùng tiết niệu vẫn có chứa một ít vi khuẩn do kết quả của sự tạp nhiễm khi nước tiểu đi qua đường sinh dục ngoài. -
Tuy nhiên nhuộm gram cặn lắng nước tiểu sau ly tâm lại rất có giá trị để phát hiện vi
khuẩnlậu (Neisseria gonorrhoeae), đó là các song cầu gram (-) hình hạt cà phê nằm trong hay
ngoài bạch cầu đa nhân trung tính.
Lưu ý: Nếu nghi ngờ bệnh nhân bị lao đường tiết niệu thì phải lấy lượng nước tiểu nhiều hơn,
ly tâm với tốc độ cao hơn và thời gian dài hơn, sau đó lấy cặn lắng nhuộm Ziehl-Neelsen phát hiện AFB.
1. Kỹ thuật cấy nước tiểu định lượng xác định mật độ vi khuẩn 1.1. Kỹ thuật:
Dùng que cấy 1µl để lấy nước tiểu và thực hiện nuôi cấy định lượng trên môi
trường Blood agar và MacConkey agar.
- Lắc nhẹ mẫu nước tiểu cho đều, cho que cấy 1 µl chạm vào mẫu nước
tiểutheo chiều thẳng đứng. Lưu ý không nhúng cả que cấy vào sâu trong mẫu nước tiểu.
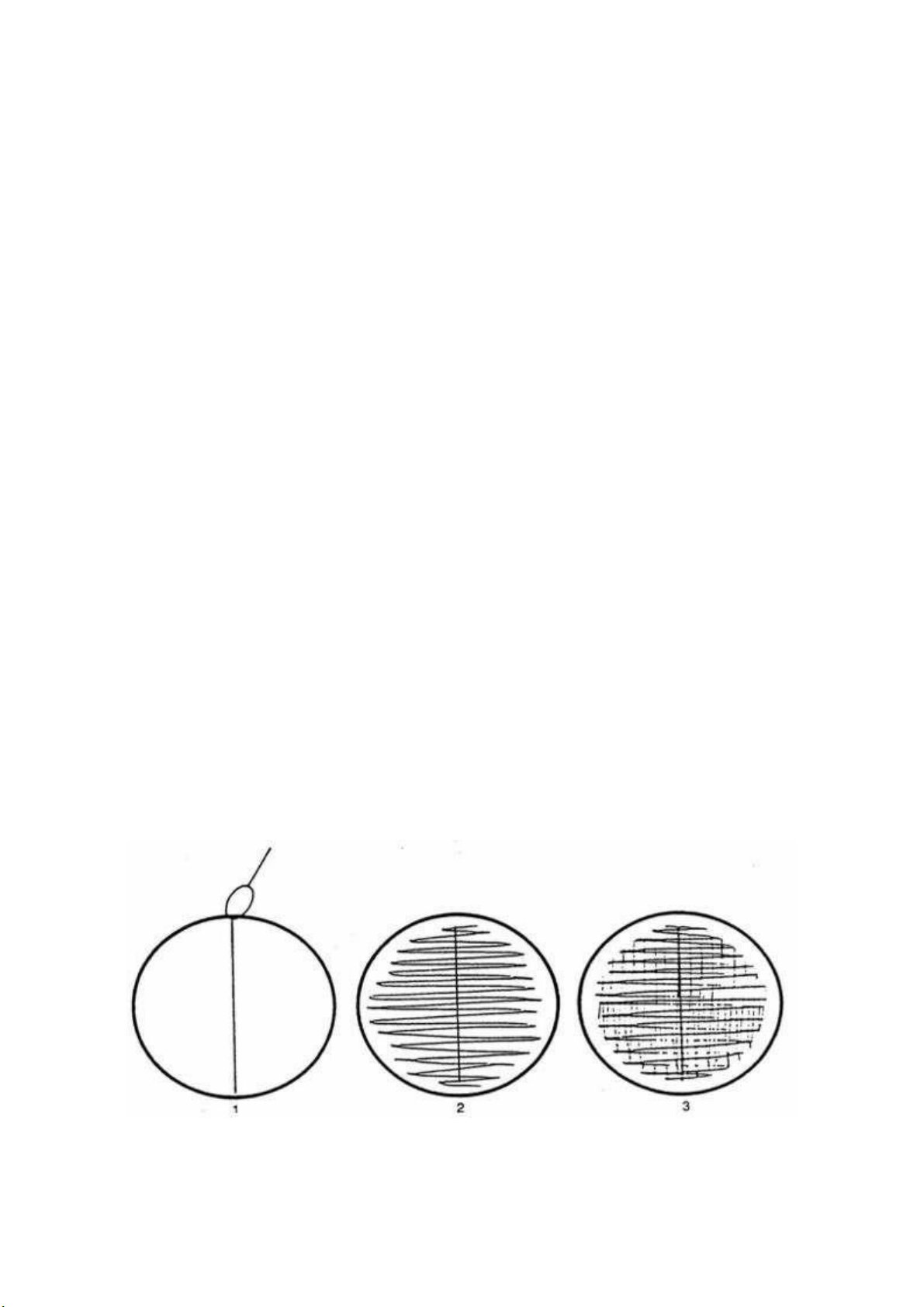
- Dùng que cấy đã lấy nước tiểu vạch 1 đường giữa đĩa thạch (hình 1),
riađường zig-zag gần nhau cắt ngang qua đường giữa (hình 2), vạch những đường
vuông góc với đường zig-zag (hình 3)
- Tiến hành tương tự cấy trên thạch MacConkey. l
- Ủ các đĩa cấy ở 35°C qua đêm.
- Lưu ý: Có thể thay thế môi trường nuôi cấy blood agar và MacConkey
bằng môi trường chọn lọc cho nước tiểu (ví dụ như CLED agar, …)
1.2. Biện luận kết quả cấy nước tiểu định lượng
Nếu không có khuẩn lạc mọc trên các môi trường thạch: Trả kết quả Nuôi cấy nước tiểu âm tính.
- Nếu có vi khuẩn mọc trên thạch, biện luận kết quả như sau:
Trường hợp 1:
+ Vi khuẩn nuôi cấy < 10 CFU/đĩa: lượng vi khuẩn tương đương < 104 CFU/ml:
Trả kết quả Không phát hiện vi khuẩn gây nhiễm trùng tiểu.
+ Ngoại lệ: Thực hiện định danh và kháng sinh đồ cho vi khuẩn < 104 CFU/ml
ở những trường hợp sau: mẫu nước tiểu lấy từ bàng quang qua sinh thiết trên xương
mu, qua nội soi bàng quang, trên bệnh nhân nữ có triệu chứng nhiễm trùng tiểu rõ,
mẫu nước tiểu có tế bào mủ.
Trường hợp 2:
+ Vi khuẩn nuôi cấy có lượng từ 10-100 khuẩn lạc/đĩa tương đương với 104105
CFU/ml. Biện luận như sau:
+ Nếu bệnh nhân không có triệu chứng nhiễm trùng tiết niệu: đề nghị lấy 1 mẫu
nước tiểu nữa và tiến hành nuôi cấy định lượng lại.
+ Nếu bệnh nhân có triệu chứng nhiễm trùng tiết niệu + mẫu cấy có 1 hay 2 loại
vi khuẩn: tiến hành định danh và làm kháng sinh đồ.
+ Nếu bệnh nhân không có triệu chứng nhiễm trùng tiết niệu, hay triệu chứng
không rõ ràng, kết quả soi đếm bạch cầu, vi khuẩn ít: trả kết quả số lượng CFU + đề
nghị lấy 1 mẫu nước tiểu nữa và tiến hành nuôi cấy định lượng lại.
Trường hợp 3: Số lượng vi khuẩn > 105 CFU/ml + mẫu cấy có 1-2 loại vi khuẩn:
Thông báo số lượng và hội chẩn với bác sĩ điều trị, từ đó có thể tiến hành định danh và
làm kháng sinh đồ khi có yêu cầu.
Trường hợp 4: Nếu mẫu cấy có có trên 2 loại vi khuẩn ở trường hợp 2 và 3: báo cáo
kết quả: “Mẫu tạp nhiễm, yêu cầu lấy lại mẫu nước tiểu đúng cách.”
2. Xác định tên vi khuẩn (định danh) và làm kháng sinh đồ
Chọn khuẩn lạc vi khuẩn xác định tính chất sinh vật hoá học và làm phản ứng với kháng
huyết thanh mẫu để xác định loại vi khuẩn gây nhiễm trùng tiết niệu.
Sử dụng kỹ thuật kháng sinh đồ để xác định độ nhạy cảm của vi khuẩn được định danh
với các kháng sinh được khuyến cáo.




