












Preview text:
NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG] Bài 2: NHIỆT PHẢN ỨNG
Phần I: Xử lý số liệu:
1. TN1: X|c định nhiệt dung của nhiệt lượng kế
Cách tiến hành: Dùng ống đong lấy 50 ml nước nóng ( t0=70 ± 5 oC) cho vào nhiệt
lượng kế (NLK), để yên, sau 2ph, đọc t2. Tiếp tục cho v{o NLK 50 ml nước lạnh (t1),
để yên, sau 2ph, đọc t3. ( ) ( ) , ớ 50 ( ) 1 ( ) ( ) đ ( 0 ̅̅ ̅ ̅̅ ̅̅ 10 ) * Kết quả TN1: ̅̅̅̅̅̅̅̅̅ ̅̅ ̅ ̅̅ ̅̅ 6,335 2,443 ( ) đ Nhiệt đ oC Lần 1 Lần 2 Lần 3 31 31 31 64 64 67 49 48 50 10 3,125 5,88 ̅̅ ̅ ̅̅ ̅̅ 6,335 3,665 3,21 0,455 ̅ ̅̅̅̅̅̅̅̅ 2,443 ( ) ( ) 50 1 ( ) ( ) 10 ( ) ( ) ( ) đ 1 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG]
2. TN2: X|c định hiệu ứng nhiệt của Phản ứng trung hòa {
Cách tiến hành: Lấy 25ml HCl cho v{o NLK, sau 1ph, đọc t2. Tiếp tục cho vào NTL 25
ml NaOH (t1), lắc nhẹ, để yên, sau 1ph, đọc t3. ( ) ( ) ( ) 2 *Kết quả TN2: ̅ ̅̅̅ ̅ ̅̅ ̅̅̅ 13895,97 500,76 ( ) Nhiệt đ oC Lần 1 Lần 2 Lần3 31 31 30 33 33 32 38 38 37 ( ) 338,01 338,01 366,178 ( ) -13520,4 -13520,4 -14647,12 ̅ ̅̅̅ -13895,97 | ̅ ̅̅̅ | 375,57 375,57 751,15 ̅ ̅̅ ̅̅̅ 500,76 2 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG]
3. TN3: X|c định nhiệt hòa tan CuSO4 khan
Cách tiến hành: Dùng ống đong lấy 50ml H2O lạnh, cho vòa NLK, để yên, sau 1ph, đọc
t1. Cân nhanh ~4 (g) CuSO4, cho vào NLK, lắc đều, sau 2ph, đọc t2. ( )( ) *Kết quả TN3: ̅ ̅̅̅ ̅ ̅̅ ̅̅̅ 1608,933 1072,622( ) Nhiệt đ oC Lần 1 Lần 2 Lần 3 33 33 33 34 34 33 ( ) 60,335 60,335 0 ( ) -2413,4 -2413,4 0 ̅ ̅̅̅ -1608,933 | ̅ ̅̅̅ | 804,467 804,467 1608,933 ̅ ̅̅ ̅̅̅ 1072,622 3 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG]
4. TN4: X|c định nhiệt h hòa tan NH4Cl
Cách tiến hành: L{m tương tự TN3: thay CuSO4 NH4Cl ( )( ) *Kết quả TN4: ̅ ̅̅̅ ̅ ̅̅ ̅̅̅ 4303,698 358,592( ) Nhiệt đ oC Lần 1 Lần 2 Lần 3 33 33 33 28 27 28 ( ) -301,675 -362,01 -301,675 ( ) 4034,903 4841,883 4034,903 ̅ ̅̅̅ 4303,698 | ̅ ̅̅̅ | 268,795 538,185 268,795 ̅ ̅̅ ̅̅̅ 358,592 4 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG]
Phần 2: Trả lời c}u hỏi
th của phản ứng HCl NaOH NaCl + H2O sẽ được tính theo số mol HCl hay
NaOH khi cho 25 ml dd HCl 2M t|c dụng với 25 ml dd NaOH 1M Tại sao? HCl + NaOH NaCl + H2O Ban đầu: 0,05 0,025 (mol) Phản ứng: 0,025 0,025 Còn lại: 0,025 0
Ta thấy NaOH hết v{ HCl còn dư, nên th của phản ứng tính theo NaOH Vì lượng
HCl dư không tham gia phản ứng nên không sinh nhiệt
2 Nếu thay HCl 1M bằng HNO3 1M thì kết quả thí nghiệm 2 có thay đổi hay không?
Kết quả của thí nghiệm sẽ thay đổi Vì:
Lúc n{y muối thu được l{ NaN , có nhiệt dung riêng kh|c, nhiệt lượng phản
ứng tỏa ra cũng sẽ kh|c do năng lượng liên kết trong HN khác HCl, NaN khác
NaCl , từ đó l{m cho t thay đổi dẫn đến kết quả thay đổi
3. Tính 3 bằng lý thuyết theo định luật Hess So s|nh với kết quả thí nghiệm H~y
xem 6 nguyên nh}n có thể g}y ra sai số trong thí nghiệm n{y:
-Mất nhiệt do nhiệt lượng kế -Do nhiệt kế
-Do dụng cụ đo thể tích hóa chất -Do cân
-Do sunphat đồng bị hút ẩm
-Do lấy nhiệt dung riêng dung dịch sunphat đồng bằng 1 cal mol đ 5 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG]
Theo em sai số n{o l{ quan trọng nhất, giải thích? Còn nguyên nh}n n{o kh|c không?
Theo định luật Hess: = -18,7+2,8 = -15,94 (kcal/mol) Theo thực nghiệm: 3 0 ( )
Trong 6 nguyên nh}n trên, theo nhóm em nguyên nh}n quan trọng nhất
CuS bị hút ẩm Vì ở điều kiện thường đ ẩm cũng kh| cao, CuS chúng ta sử dụng
ở dạng khan nên ngay khi tiếp xúc không khí nó sẽ hút ẩm ngay lập tức v{ tỏa ra m t
nhiệt lượng đ|ng kể, đủ để l{m lệch đi gi| trị t2 chúng ta đo ở mỗi lần thí nghiệm
Theo nhóm em còn hai nguyên nh}n kh|c l{m cho kết quả sai kh|c nhau:
* C}n điện tử chính x|c, tuy nhiên lượng chất mỗi lần chúng ta lấy l{
kh|c nhau cũng g}y ra sự biến đổi nhiệt đ|ng kể
* Lượng CuS trong phản ứng có thể không tan hết l{m mất đi m t
lượng đ|ng kể phải được sinh ra trong qu| trình hòa tan 6 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG]
BÀI 4 : XÁC ĐỊNH BẬC PHẢN ỨNG
Phần I: Xử lý số liệu:
1. TN1: X|c định bậc phản ứng theo Na2S2O3 Ống nghiệm H Erlen 2SO4 TN 0,4M (ml) Na2S2O3 0,1M (ml) H2O (ml) 1 8 4 28 2 8 8 24 3 8 16 16 C|ch tiến h{nh:
Dùng pipet vạch lấy axit cho v{o ống nghiệm
Dùng puret cho nước v{o 3 erlen
Sau đó tr|ng buret bằng Na2S2O3 0,1M rồi tiếp tục dùng puret cho Na2S2O3 vào 3 erlen.
Lần lượt cho phản ứng từng cặp ống nghiệm v{ erlen như sau:
Đổ nhanh axit trong ống nghiệm v{o erlen
Bấm đồng hồ (khi 2 dung dịch tiếp xúc nhau).
Lắc nhẹ sau đó để yên quan s|t, khi vừa thấy dung dịch chuyển sang đục thì bấm đồng hồ
Lặp lại TN lấy gi| trị trung bình 7 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG] *Kết quả TN1: (Tìm n) ̅ ̅ ̅̅̅ 1,096 0,002 Nồng đ ban đầu (M) TN Δt1 Δt2 ΔtTB Na2S2O3 H2SO4 1 0,1 0,4 95 97 96 2 0,1 0,4 46 44 45 3 0,1 0,4 20 22 21 log 96 log 45 1,093 log 2 log 2 log 45 log 21 1,0995 log 2 log 2 1,093 1,0995 ̅ 1,096 2 2 | ̅ | |1,096 1,093| 0,003 | ̅ | |1,096 1,095| 0,001 0,003 0,001 ̅ ̅̅̅ 0,002 2 2 8 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG]
2. TN2: X|c định bậc phản ứng theo H2SO4
C|ch tiến h{nh: L{m tương tự thí nghiệm 1 với lượng axit v{ Na2S2O3 theo bảng sau: Erlen TN Ống nghiệm H2SO4 0,4M (ml) Na2S2O3 0,1M (ml) H2O (ml) 1 4 8 28 2 8 8 24 3 16 8 16 *Kết quả TN2: (tìm m): ̅ ̅ ̅̅̅̅ 0,007 0,082 Nồng đ ban đầu (M) TN Δt1 Δt2 ΔtTB Na2S2O3 H2SO4 1 0,1 0,4 49 51 50 2 0,1 0,4 46 48 47 3 0,1 0,4 49 50 49,5 log 50 log 47 0,089 log 2 log 2 log 47 log 49,5 0,075 log 2 log 2 0,089 0,075 ̅ 0,007 2 2 | ̅ | |0,007 0,089| 0,082 | ̅ | |0,007 0,075| 0,082 0,082 0,082 ̅ ̅̅̅̅ 0,082 2 2 9 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG]
Phần II: Trả lời câu hỏi
1. Trong TN trên nồng đ của Na2S2O3 (A) và của H2SO4(B) đ~ ảnh hưởng thế nào lên
vận tốc phản ứng. Viết lại biểu thức tính tốc đ phản ứng X|c định bậc của phản ứng.
+Nồng đ của Na2S2O3 tỉ lệ thuận với tốc đ phản ứng.
+Nồng đ của H2SO4 hầu như không ảnh hưởng đến tốc đ phản ứng.
+Biểu thức tính tốc đ phản ứng v = k [Na2S2O3]m[H2SO4]n trong đó: m, n l{ hằng số
dương x|c định bằng thực nghiệm. Bậc phản ứng: m+ n.
2. Cơ chế của phản ứng trên có thể được viết lại như sau:
H2SO4 + Na2S2O3 Na2SO4 + H2S2O3 (1) H2S2O3 H2SO3 S↓ (2)
Dựa vào kết quả TN có thể kết luận phản ứng (1) hay (2) là phản ứng quyết định vận
tốc phản ứng là phản ứng xảy ra chậm nhất không? Tại sao? Lưu ý trong c|c thi nghiệm
trên, lượng axit H2SO4 luôn luôn dư so với Na2S2O3.
+Phản ứng (1) là phản ứng trao đổi ion nên tốc đ phản ứng xảy ra nhanh.
+Phản ứng (2) xảy ra chậm hơn
=> Phản ứng (2) quyết định tốc đ phản ứng, là phản ứng xảy ra chậm nhất. Vì bậc
của phản ứng là bậc 1.
3. Dựa trên cơ sở của phương ph|p TN thì vận tốc x|c định được trong các TN trên
được xem là vận tốc trung bình hay vận tốc tức thời?
Dựa trên cơ sở của phương ph|p TN thì vận tốc x|c định được trong các TN trên
được xem là vận tốc tức thời vì vận tốc phản ứng được x|c định bằng tỉ số C t Vì C
≈ 0 (do lưu huỳnh thay đổi không đ|ng kể nên C ≈ dC)
4. Thay đổi thứ tự cho H2SO4 và Na2S2O3 thì bậc phản ứng có thay đổi không? Tại sao?
Bậc phản ứng không thay đổi vì bậc phản ứng chỉ phụ thu c vào nhiệt đ và bản
chất của phản ứng mà không phụ thu c vào quá trình tiến hành. 10 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG]
BÀI 8: PHÂN TÍCH THỂ TÍCH
Phần I: Xử lý số liệu:
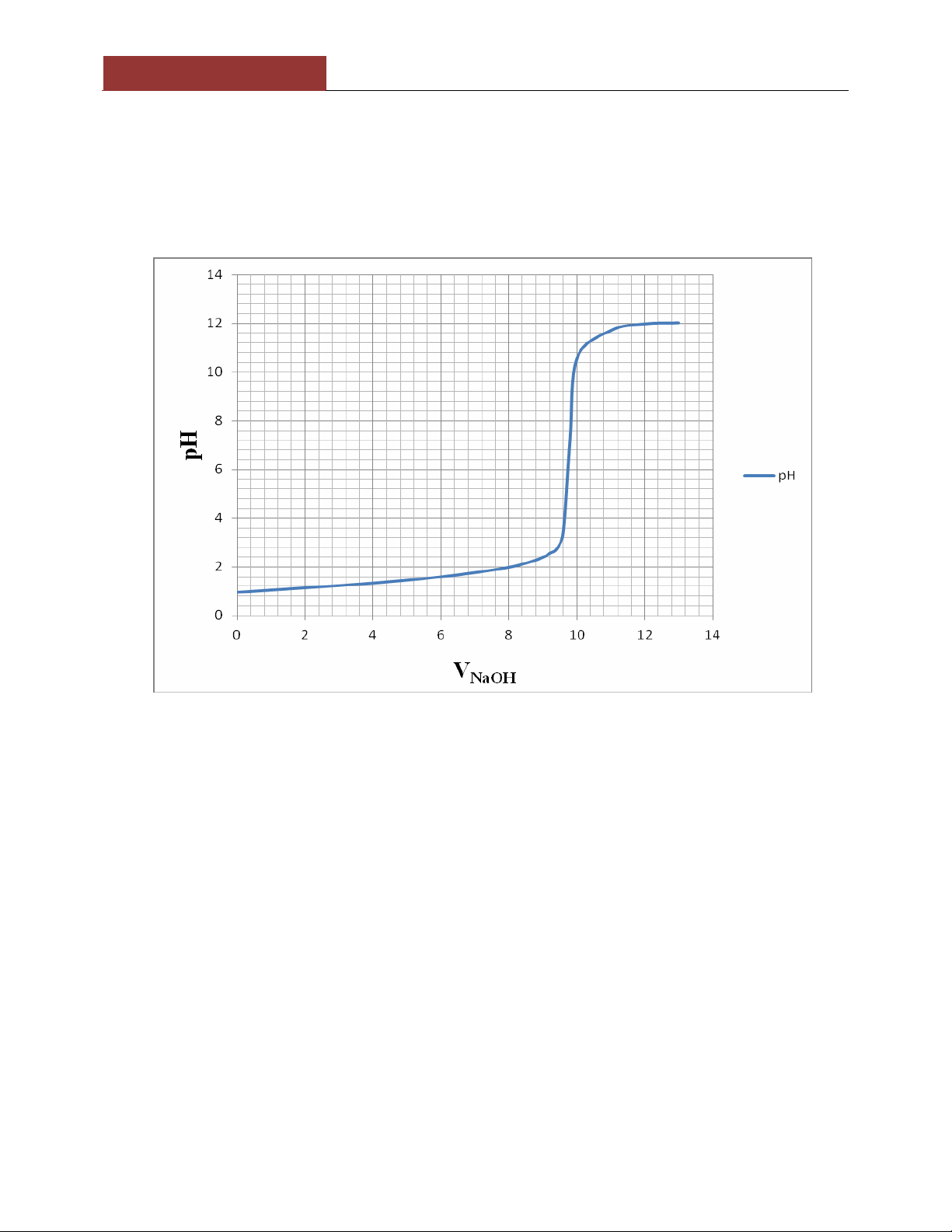
1. TN1: Xây dựng đường cong chuẩn đ X|c định:
pH điểm tương đương: 7,26
Bước nhảy pH: từ pH 3,36 đến pH 10,56
Chất chỉ thị thích hợp: phenolphthalein 2. TN2:
- Chuẩn đ axit – bazo với thuốc thử phenol phtalein.
- Tr|ng buret bằng NaOH 0,1N, cho NaOH 0,1N v{o buret
- Dùng pipet 10ml lấy 10ml dd HCl cho v{o erlen 150ml, thêm 10ml nước cất 2 giọt phenol phtalein 11 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG] - Tiến h{nh chuẩn đ *Kết quả TN2: ̅̅̅̅̅̅ ̅̅̅̅̅̅̅ 0,1037 0,0004 ( ) Lần ( ) ( ) ( ) ( ) Sai số 1 10 10,40 0,10 0,104 0,0003 2 10 10,40 0,10 0,104 0,0003 3 10 10,30 0,10 0,103 0,0007 10,40 0,10 ( ) 0,104( ) 10 10,40 0,10 ( ) 0,104( ) 10 10,30 0,10 ( ) 0,103( ) 10 0,104 0,104 0,103 ̅̅̅̅̅̅ ( ) ( ) ( ) 0,1037 ( ) 3 3 0,0003 0,0003 0,0007 ̅ ̅̅̅̅̅̅ 0,0004 ( ) 3 12 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG]
3. TN3: L{m tương tự TN2, thay phenolphthalein metyl da cam (Đỏ => cam) *Kết quả TN3: ̅̅̅̅̅̅ ̅̅̅̅̅̅̅ 0,101 0,0008 ( ) Lần ( ) ( ) ( ) ( ) Sai số 1 10 10,30 0,10 0,103 0,0008 2 10 10,25 0,10 0,1025 0,0003 3 10 10,10 0,10 0,101 0,0012 10,30 0,10 ( ) 0,103( ) 10 10,25 0,10 ( ) 0,1025( ) 10 10,10 0,10 ( ) 0,101( ) 10 0,103 0,1025 0,101 ̅̅̅̅̅̅ ( ) ( ) ( ) 0,1022 ( ) 3 3 0,0008 0,0003 0,0012 ̅ ̅̅̅̅̅̅ 0,0008 ( ) 3 13 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG]
4. TN4: L{m tương tự TN2, thay HCl= CH3COOH *Kết quả TN4: Phenolphtalein: ̅̅̅̅̅̅̅̅̅̅̅̅ ̅̅̅̅̅̅̅̅̅̅̅̅̅ 0,0928 0,0002 ( ) Mety da cam: ̅̅̅̅̅̅̅̅̅̅̅̅ ̅̅̅̅̅̅̅̅̅̅̅̅̅ 0,0263 0,0006 ( ) Lần Chất chỉ thị ( ) ( ) ( ) ( ) 1 10 9,30 0,1 0,093 2 Phenol 10 9,25 0,1 0,0925 phtalein 3 10 9,30 0,1 0,093 1 10 2,70 0,1 0,027 Metyl da 2 10 2,65 0,1 0,0265 cam 3 10 2,55 0,1 0,0255
Phần II: Tră lời câu hỏi
1. Khi thay đổi nồng đ HCl v{ NaOH, đường cong chuẩn đ có thay đổi hay không, tại sao?
Khi thay đổi nồng đ HCl v{ NaOH đường cong chuẩn đ sẽ thay đổi vì khi
thay đổi nồng đ thì thể tích thay đổi Đồ thị sẽ mở r ng ra hoặc thu hẹp lại. Tuy
nhiên điểm tương đương của hệ không thay đổi.
2. Việc x|c định nồng đ axit HCl trong các thí nghiệm 2 và 3 cho kết quả nào chính x|c hơn, tại sao?
Phenol phtalein giúp ta x|c định chính x|c hơn vì bước nhảy pH của phenol
phtalein khoảng từ 8 -10 Bước nhảy của metyl orange là 3.1- 4 4 m{ điểm tương
đương của hệ là 7(do axit mạnh tác dụng với bazơ mạnh) nên thí nghiệm 2 (Phenol
phtalein) sẽ cho kết quả chính xác hơn
3. Từ kết quả thí nghiệm 4, việc x|c định nồng đ dung dịch axit acetic bằng chỉ 14 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG]
thị m{u n{o chính x|c hơn, tại sao?
Phenol phtalein giúp ta x|c định chính x|c hơn vì bước nhảy pH của phenol
phtalein khoảng từ 8-10 Bước nhảy của metyl orange là 3.1 - 4 4 m{ điểm tương
đương của hệ là >7 (do axit yếu tác dụng với bazơ mạnh).
4. Trong phép phân tích thể tích nếu đổi vị trí của NaOH và axit thì kết quả có thay đổi không, tại sao?
Trong phép phân tích thể tích nếu đổi vị trí NaOH và axit thỉ kết quả vẫn
không thay đổi vì bản chất phản ứng không thay đổi, vẫn là phản ứng trung hòa. 15 NHÓM 12-L26
[BÁO CÁO THÍ NGHIỆM HÓA ĐẠI CƯƠNG] Tài liệu tham khảo:
[1] Nguyễn Thùy Đoan, Bùi Thị Hồng Gấm, Nhóm 5, Lớp CK17HT02, Khoa Cơ Khí,
ĐH B|ch Khoa TP HCM, B|o c|o TN Hóa đại cương, GVHD Đỗ Thị Minh Hiếu.
[2] Nguyễn Trung Tính, Nguyễn Văn To{n, Nhóm 13, Lớp L37, ĐH B|ch Khoa
TP.HCM, Báo cáo thí nghiệm Hóa Đại cương, GVHD Võ Nguyễn Lam Uyên. 16




