
















































































Preview text:
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TR ỜNG ĐẠI HỌC S PHẠM THÀNH PHỐ HỒ CHÍ MINH KHOA HÓA HỌC
BÁO CÁO THÍ NGHIỆM HÓA VÔ C
Sinh viên: Nguyễn Kim Thành Mã sinh viên: 46.01.401.240
Lớp thực hành: Sáng thứ 2 (tuần 4 – 9)
Mã lớp học phần: SCIE141603
Giảng viên giảng dạy: TS. Trần Thị Tố Nga
THÀNH PHỐ HỒ CHÍ MINH - 2022
Downloaded by VietJack TV Official (vietjackvideos@gmail.com) MỤC LỤC
BÀI 1. CÁC KIM LOẠI NHÓM IA, IIA VÀ NHÔM .......................................... 1
Thí nghiệm 1: Tác dụng Lithium, Sodium, Potassium với n ớc. .......................... 1
Thí nghiệm 2: Màu ngọn lửa của các ions kiêm loại kiềm .............. ............ ........ 2
Thí nghiệm 3: Tính chất của Na2CO3. .............. ............ ............ ............ .............. 3
Thí nghiệm 4: Tác dụng của Mg với n ớc, khí O2, khả năng hòa tan của MgO. .. 4
Thí nghiệm 5: Tác dụng của Mg với các acid. .............. ............ ............ ............ . 6
Thí nghiệm 6: Điều chế và tính chất của Mg(OH)2. .............. ............ ............ ..... 7
Thí nghiệm 7: Tác dụng của Ca với n ớc .............................................................. 8
Thí nghiệm 8: Màu của ngọn lửa các ion kim loại kiềm thổ. .............. ............ .... 8
Thí nghiệm 9: Tác dụng của Al với O2 và n ớc .............. ............ ............ ........... 9
Thí nghiệm 10: Tác dụng của Al với các dung dịch acid............... ............ ........11
Thí nghiệm 11: Tác dụng của Al với các dung dịch NaOH. .............. ............ ....13
Thí nghiệm 12: Điều chế và tính chất của Al(OH)3. .............. ............ ............ ...13
BÀI 2. HALOGEN VÀ HỢP CHẤT .............. ............ ............ ............ ............. 15
Thí nghiệm 1: Điều chế Chlorine (Cl2) .............. ............ ............ ............ ..........15
Thí nghiệm 2: Điều chế Bromine (Br2) .............. ............ ............ ............ ..........15
Thí nghiệm 3: Điều chế Iodine (I2) .............. ............ ............ ............ ............. ...17
Thí nghiệm 4: Khả năng hòa tan của Br2 và I2 trong n ớc và dung môi hữu c .18
Thí nghiệm 5: Tác dụng của Halogen với các kim loại .............. ............ ...........20
Thí nghiệm 6: Tác dụng của Cl2 với P và H2. ........................... ............ ............ 21
Thí nghiệm 7: Tác dụng của Iodine với hồ tinh bột .............. ............ ............ ....22
Thí nghiệm 8: So sánh tính hoạt động của Cl2, Br2 và I2. .............. ............ ........23
Thí nghiệm 9: Điều chế khí HCl bằng cách cho NaCl(s) tác dụng với dung dịch
H2SO4(đ). .............. ............ ............. ............ ............ ............ ............ ............. ....24
Thí nghiệm 10: Khả năng hòa tan của khí HCl trong n ớc. ........................... ....24
Thí nghiệm 11: Tính acid của dung dịch HCl, nhận biết khí HCl. .............. .......25
Thí nghiệm 12: Thuốc thử Halide ions............... ............ ............ ............ ..........26
Thí nghiệm 13: So sánh tính khử của các Halide ion (X-) ........................... .......27
Thí nghiệm 14: Điều chế và tính tẩy màu của n ớc Chlorine .............. ............ .28
Thí nghiệm 15: Điều chế và tính tẩy màu của n ớc Javen ..................................29
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 16: Phản ứng khắc thủy tinh .............. ...................................... .......29
BÀI 3. CARBON, NITROGEN, PHOSPHORUS VÀ HỢP CHẤT .............. ..31
Thí nghiệm 1: Điều chế khí N2 ................................................................... .........31
Thí nghiệm 2: Điều chế khí NH3 từ dung dịch NH3 đậm đặc và thử khả năng hòa
tan. .............. ............ ............ ............ ............. ......................... ............ ............ 31
Thí nghiệm 3: Sự dịch chuyển cân bằng trong dung dịch n ớc NH3 .............. ...33
Thí nghiệm 4: Tác dụng của khí Ammonia với CuO (Copper (II) oxide) ...........34
Thí nghiệm 5: Nhiệt phân các muối NH3. .............. ...................................... ......35
Thí nghiệm 6: Tác dụng của HNO3 với đồng .......................................................37
Thí nghiệm 7: Tác dụng của AgNO3 (Silver nitrate) nóng chảy lên giấy lọc. .....38
Thí nghiệm 8: Quan sát sự biến đổi giữa Phosphorus đỏ và Phosphorus trắng.
Tác dụng của Ptrắng với O2. .............. ............ ............ ............ ............. ............ ...39
Thí nghiệm 9: Nhận biết ion PO 3-
4 (Phosphate ion) .............. ......................... ....40
Thí nghiệm 10: Khả năng hấp thụ màu của than hoạt tính (Active charcoal) .....42
Thí nghiệm 11: Tác dụng của Carbon với HNO3 đặc và H2SO4 đặc. .............. ...43
Thí nghiệm 12: Điều chế khí Carbon dioxide (CO2) và các tính chất. .............. .44
BÀI 4. OXYGEN, SULFUR VÀ HỢP CHẤT .............. ............ ............ ............46
Thí nghiệm 1: Điều chế và nhận biết khí O2 .............. ............ ............ ............ ..46
Thí nghiệm 2: O2 phản ứng với than, Sulfur, Phosphorus và Sắt. .............. ........47
Thí nghiệm 3: Điều chế và tính chất của Ozone (O3) .............. ............ ..............47
Thí nghiệm 4: Tính chất của H2O2. .............. ............ ............ ............ ................49
Thí nghiệm 5: Điều chế l u huỳnh kim và l u huỳnh dẻo (Amorphous Sulfur) –
S8 .............. ............ ............ ............ ............. ............ ............ ............ ............ ...51
Thí nghiệm 6: Phản ứng của L u huỳnh với HNO3 đặc và H2SO4 đặc. ..............53
Thí nghiệm 7: Điều chế khí H2S và đốt cháy. ........................... ............ ............ 55
Thí nghiệm 8: Điều chế và quan sát muối sulfide ít tan – thuốc thử ion S2 ....56
Thí nghiệm 9: Tác dụng của H2S với các chất oxi hóa. .............. ............ ...........57
Thí nghiệm 10: Điều chế khí SO2 .............. ............ .............................................58
Thí nghiệm 11: Tác dụng của SO2 với các chất oxi hóa. .............. ............ .........59
Thí nghiệm 12: Tác dụng của SO2 với dung dịch H2S. .............. ............ ............60
Thí nghiệm 13: Tác dụng của Na2SO3 với dung dịch KMnO4............... ............ 61
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 14: Tác dụng của Sulfuric acid loãng (H2SO4) với kim loại. ...........61
Thí nghiệm 15: Tác dụng của Sulfuric acid đặc (H2SO4) với hợp chất hữu c . ..62
Thí nghiệm 16: Tác dụng của Sulfuric acid đặc (H2SO4) với kim loại .............. .63
BÀI 5. CÁC NGUYÊN TỐ CHUYỂN TUYẾN HỌ 3d ......................................65
Thí nghiệm 1: Điều chế kim loại đồng từ kẽm kim loại với muối Copper (II)
Sulfate ................................................................... ............ .......................... .......65
Thí nghiệm 2: Tác dụng của đồng với các acid. ............. ............ .......................66
Thí nghiệm 3: Điều chế và tính chất của Cu(OH)2. .............. ..............................68
Thí nghiệm 4: Tính chất của Cr(OH)3 ........................... ............ ............ ............70
Thí nghiệm 5: Phản ứng của muối Cr(III) với các chất oxi hóa trong môi tr ờng
kiềm. ......................................... ............ ............ ............ .......................... .........71
Thí nghiệm 6: Tính oxi hóa của K2Cr2O7. .............. ............ ............ ............ ......72
Thí nghiệm 7: Điều chế và tính chất của Mn(OH)2. .............. ............ ............ ...74
Thí nghiệm 8: Tính chất của muối Manganese (II). .............. ............ ............ ....75
Thí nghiệm 9: Tính oxi hóa của KMnO4 trong các môi tr ờng khác nhau. ........76
Thí nghiệm 10: Tác dụng của sắt với các acid. .............. .....................................78
Thí nghiệm 11: Điều chế và tính chất của Fe(OH)2. .............. ............ ............ ...80
Thí nghiệm 12: Tính chất của muối sắt (III) .............. ............ ............ ............ ..81
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
BÀI 1. CÁC KIM LOẠI NHÓM IA, IIA VÀ NHÔM
Thí nghiệm 1: Tác dụng Lithium, Sodium, Potassium với n ớc. A. Các b ớc thực hiện:
Dùng cặp sắt gắp Na ngâm trong lọ dầu hỏa, đặt lên tấm kính, dùng dao
khô cắt một mẫu nhỏ. Quan sát bề mặt kim loại Na lúc vừa mới cắt và
sau khi để ngoài không khí một thời gian ngắn (3 – 5 phút).
Dùng cốc thủy tinh dung tích 1 lít chứa khoảng 1/3 thể tích n ớc có pha
sẵn vài giọt phenolphthalein. Gắp mẫu Na bỏ vào cốc và quan sát hiện t ợng xảy ra.
Lần l ợt làm thí nghiệm nh trên đối với K.
B. Hiện t ợng và giải thích: 1. Khi cắt kim loại:
- Tính hoạt động của các kim loại kiềm: K hoạt động mạnh nhất
- K dễ bị oxi hóa ngoài không khí (trong kk có chứa O2, N2 và H2O)
=> chuyển thành màu đen trong khi Na ít bị chuyển h n (màu ánh)
Ph ng trình phản ứng: 4M( ) O ( ) ⟶ 2M O( ) 6M( ) N ( ) ⟶ 2M N( ) (Li) 1 M( ) H O( ) ⟶ MOH( ) H 2 ( )
2. Khi cho lần l ợt các kim loại vào dung dịch n ớc có chứa phenolphtalein:
- Khi phản ứng với n ớc, Na nóng chảy thành hạt tròn nổi và chạy
trên mặt n ớc, hạt lớn có thể bốc cháy, do Na phản ứng với n ớc
và tỏa ra một nhiệt l ợng rất lớn, làm viên Na nóng chảy, rồi viên
Na bị vo tròn lại do sức căng bề mặt (hoặc do áp suất bên ngoài tác
động, khiến nó có xu h ớng vo tròn lại thành hình cầu giống nh
giọt n ớc trong chân không)
- K bốc cháy ngay khi vừa đ ợc thả vào trong n ớc. Ph ng trình phản ứng: 1
Downloaded by VietJack TV Official (vietjackvideos@gmail.com) 1 M( ) H O( ) ⟶ MOH( ) H 2 ( )
K hoạt động mạnh nhất trong 3 kim loại Li, Na, K.
Càng đi xuống d ới => kim loại hoạt động mạnh (đặc biệt với n ớc)
3. Tại sao cần bảo quản các kim loại kiềm trong dầu hỏa?
- Các kim loại kiềm chỉ có 1 electron lớp ngoài cùng nên hoạt động
hóa học rất mạnh để trở về cấu hình bền. Mà trong môi tr ờng
không khí có chứa O2, N2 và H2O, nên kim loại kiềm rất dễ bị oxh trong không khí.
- Dầu hỏa (kerosene) đóng vai trò nh là một lớp bảo vệ (đặc biệt là
ngăn không cho phản ứng với n ớc tạo H2 gây nổ).
Thí nghiệm 2: Màu ngọn lửa của các ions kiêm loại kiềm A. Các b ớc thực hiện:
Dùng đ a thủy tinh nhúng vào dung dịch HCl đặc, sau đó đốt trên ngọn
lửa đèn khí và quan sát, nếu ngọn lửa còn màu thì lặp lại thí nghiệm
nhiều lần cho đến khi ngọn lửa trở thành không màu.
Nhúng các đ a thủy tinh lần l ợt vào các cốc chứa dung dịch bão hòa
các muối LiCl, NaCl, KCl, sau đó đốt trên ngọn lửa đèn khí hay đèn cồn.
B. Hiện t ợng và giải thích:
1. Các kim loại kiềm tự do c ng nh hợp chất của chúng khi bị đốt sẽ
cháy cho ngọn lửa có màu đặc tr ng:
- Liti cho ngọn lửa màu đỏ tía.
- Natri cho ngọn lửa màu vàng.
- Kali cho ngọn lửa màu tím. (tím hoa cà)
- Rubidi cho ngọn lửa màu tím hồng.
- Xesi cho ngọn lửa màu xanh lam.
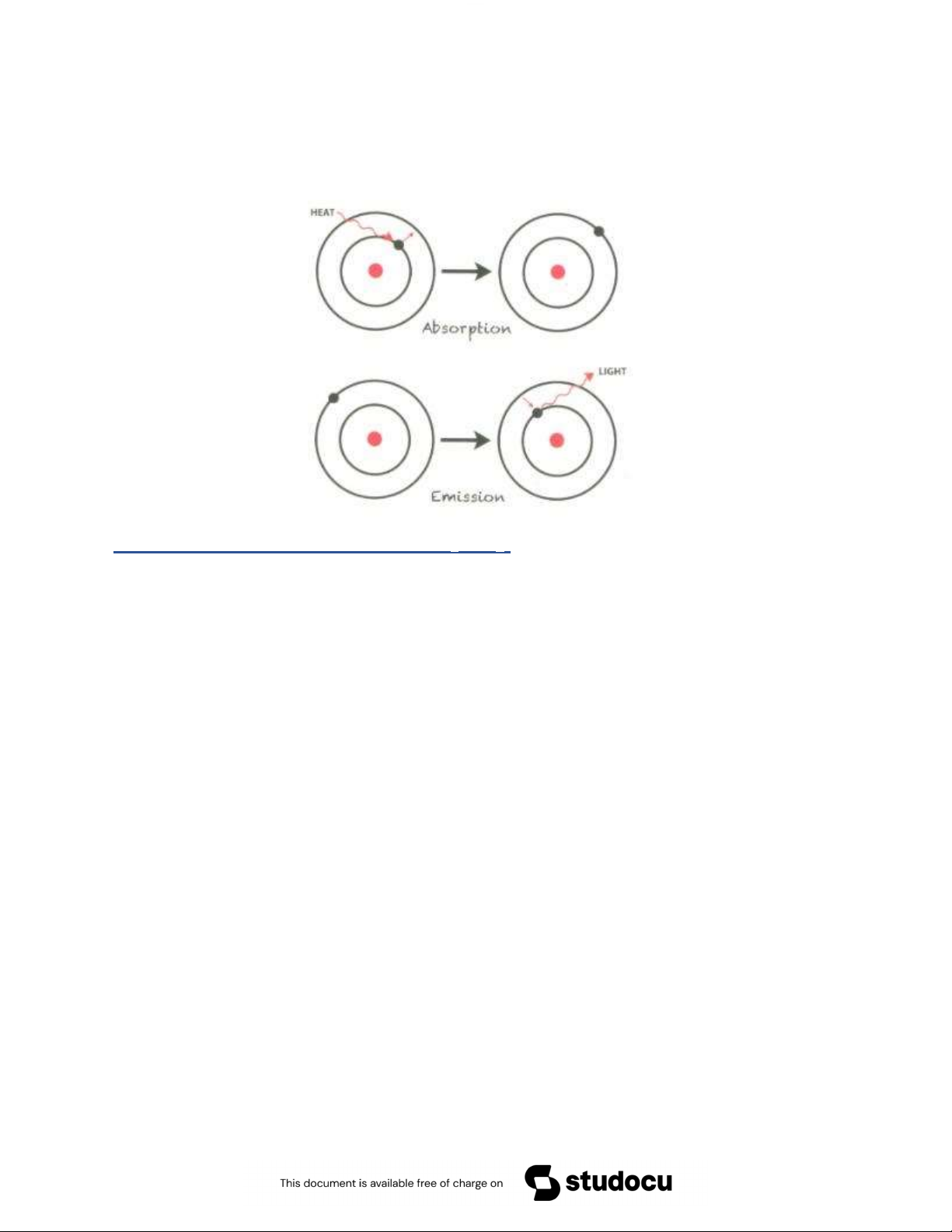
Giải thích: Khi bị đốt, những electron của nguyên tử hoặc ion kim loại
kiềm bị kích thích nhảy lên những mức năng l ợng cao h n. Khi những 2
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
electron đó trở về trạng thái ban đầu, chúng hoàn trả lại những năng
l ợng đã hấp thụ d ới dạng bức xạ vùng khả kiến. Vì vậy ta thấy đ ợc màu của ngọn lửa.
Thí nghiệm 3: Tính chất của Na2CO3. A. Các b ớc thực hiện:
Cho vào hai ống nghiệm, mỗi ống một ít tinh thể Na2CO3, thêm vào mỗi
ống khoảng 3-5 ml n ớc cất. Lắc đều cho muối tan hết. Thử môi tr ờng
dung dịch bằng vài giọt dung dịch phenolphtalein và metyl da cam.
B. Hiện t ợng và giải thích:
S l ợc về các chất chỉ thị màu: a. Phenolphtalein (C20H14O4):
- Dung dịch không màu trong n ớc với pH = 7
- Dung dịch không màu với trong môi tr ờng acid (pH < 7)
- Dung dịch hóa hồng trong môi tr ờng base base (pH > 7)
b. Methyl organe (C14H14N3NaO3S):
- Dung dịch có màu vàng ứng với môi tr ờng có pH ≥ 4.4
- Dung dịch đổi màu từ màu vàng sang màu đỏ tía trong môi
tr ờng acid (pH: 3.1 – 4.4) Quan sát:
- Ống 1: chứa Phenolphtalein
• Dung dịch đổi sang màu hồng 3
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
- Ống 2: chứa Methyl da cam
• Dung dịch không đổi màu Giải thích:
- Ống 1 đổi màu do chất chỉ thị màu phenolphtalein sẽ đổi sang màu
hồng khi ở trong môi tr ờng base
- Ống 2 không đổi màu do Methyl da cam chỉ đổi màu với môi
tr ờng acid (pH: 3.1 – 4.4)
Thí nghiệm 4: Tác dụng của Mg với n ớc, khí O2, khả năng hòa tan của MgO. A. Các b ớc thực hiện:
Cho vào hai ống nghiệm, mỗi ống một ít tinh thể Na2CO3, thêm vào mỗi
ống khoảng 3-5 ml n ớc cất. Lắc đều cho muối tan hết. Thử môi tr ờng
dung dịch bằng vài giọt dung dịch phenolphtalein và metyl da cam.
a) Tác dụng của MgO với H2O
Lấy 2 mẫu kim loại Mg đã đánh sạch lớp vỏ ngoài bằng giấy nhám, cho
vào 2 ống nghiệm đựng khoảng 2 ml n ớc cất có sẵn vài giọt phenolphthalein. Ống 1. Để so sánh. Ống 2. Đun nóng.
Quan sát hiện t ợng ở cả hai ống nghiệm
b) Tác dụng của Mg với O2
Dùng cặp sắt cặp một đoạn băng Mg (dài khoảng 5 cm) đã đ ợc đánh
sạch bằng giấy nhám và đốt trên ngọn lửa đèn cồn.
Khi Mg bắt đầu cháy, đ a nhanh vào một chén sứ khô đã đ ợc chuẩn bị từ tr ớc.
Theo dõi hiện t ợng cháy của Mg trong không khí. Quan sát màu sắc của sản phẩm cháy
c) Khả năng hòa tan của MgO trong n ớc
Cho 2 ml n ớc cất vào chén sứ đựng sản phẩm cháy ở trên, dùng đ a
thủy tinh khuấy đều. Quan sát khả năng hòa tan của MgO trong n ớc. 4
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thử dung dịch bằng giấy quỳ đỏ hoặc gạn dung dịch sang một ống
nghiệm khác rồi thử dung dịch bằng vài giọt phenolphtalein.
B. Hiện t ợng và giải thích:
1. Tác dụng của Mg với H2O:
- Ống nghiệm đầu tiên:
• Dung dịch gần nh không đổi màu. - Ống nghiệm thứ hai:
• Ở giai đoạn đầu bắt đầu xuất hiện xủi bọt khí (h i n ớc H2O)
• Dung dịch từ từ chuyển màu thành màu hồng nhạt. Giải thích:
- Các kim loại nhóm II th ờng chìm xuống n ớc do có chúng nặng
h n so với n ớc và các kim loại nhóm II c ng có mức năng l ợng
ion hóa cao h n so với các kim loại nhóm I nên khả năng phản ứng
thấp h n. Nên ống 1 phản ứng xảy ra rất rất chậm và gần nh
không phản ứng. (Mg không tan trong n ớc lạnh).
- Khi đun nóng ống 2, trong ống sẽ bắt đầu có hiện t ợng sủi bọt khí
(dung dịch vẫn không màu). Sủi bọt khí này không phải là khí H2
thoát ra mà là do n ớc bắt đầu sôi và xuất hiện h i n ớc. Lúc này
Mg sẽ tác dụng với n ớc tạo ra Mg(OH)2 và khí H2. Ph ng trình phản ứng: Mg( ) 2H O( ) ⟶ Mg(OH) ( ) H ( )
2. Tác dụng của Mg với O2:
- Mg cháy với ngọn lửa màu trắng sáng.
- Sản phẩm là một chất bột có màu trắng Ph ng trình phản ứng: 1 Mg( ) 2O ( ) ⟶ MgO( )
- Mg tạo liên kết ion với nguyên tử oxygen tạo sản phẩm là magnesium oxide (MgO) 5
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
3. Khả năng hòa tan của MgO trong n ớc:
Xét màu sắc của giấy quỳ tím: Sau khi quan sát, ta thấy:
- Giấy quỳ đỏ chuyển màu xanh Nhận xét:
- MgO rất ít tan (gần nh không tan) trong n ớc ở nhiệt độ th ờng
và chỉ phản ứng khi đ ợc đun nóng. (Tất cả các oxide kim loại
kiềm và kiểm thổ trừ Na và K đều gần nh không tan trong n ớc). - Ph ng trình phản ứng: MgO( ) H O( ) ↛ Mg(OH) ( )
Thí nghiệm 5: Tác dụng của Mg với các acid. A. Các b ớc thực hiện:
Cho vào 4 ống nghiệm lần l ợt các dung dịch HCl 1M, H2SO4 1M,
HNO3 1M, CH3COOH 1M. Cho vào mỗi ống một mẫu kim loại Mg.
B. Hiện t ợng và giải thích:
Đánh thứ tự cho các ống:
- Ống 1: Mg tác dụng với dung dịch HCl 1M:
• Hiện t ợng: Mg tan dần trong dung dịch acid, tạo thành dung
dịch không màu, có khí không màu thoát ra (H2).
• Ph ng trình phản ứng:
Mg( ) 2HCl( ) ⟶ MgCl ( ) H ( )
- Ống 2: Mg tác dụng với dung dịch H2SO4 1M:
• Hiện t ợng: Mg tan dần trong dung dịch acid, tạo thành dung
dịch không màu, có khí không màu thoát ra (H2).
• Ph ng trình phản ứng:
Mg( ) H SO ( ) ⟶ MgSO ( ) H ( )
- Ống 3: Mg tác dụng với dung dịch HNO3 1M: 6
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
• Hiện t ợng: Mg tan dần trong dung dịch acid, tạo thành dung
dịch không màu, có khí màu nâu đỏ thoát ra (NO2).
• Ph ng trình phản ứng:
Mg( ) 4HNO ( ) ⟶ Mg(NO ) ( ) 2NO ( , â đỏ) 2H O( )
- Ống 4: Mg tác dụng với dung dịch CH3COOH 1M:
• Hiện t ợng: Mg tan dần trong dung dịch acid, tạo thành dung
dịch không màu, có khí không màu thoát ra (H2).
• Ph ng trình phản ứng:
Mg( ) 2CH COOH( ) ⟶ (CH COO) Mg( ) H ( )
Thí nghiệm 6: Điều chế và tính chất của Mg(OH)2. A. Các b ớc thực hiện:
Trong một cốc thủy tinh dung tích 100 ml chứa khoảng 10 – 15 ml dung
dịch MgCl2, thêm từ từ từng giọt dung dịch NaOH cho đến khi kết tủa
hoàn toàn. Thêm khoảng 10 ml n ớc cất, dùng đ a thủy tinh khuấy đều
kết tủa. Chia thể tích thu đ ợc vào 4 ống nghiệm.
Ống 1. Thêm vài giọt dung dịch phenolphthalein.
Ống 2. Thêm từ từ từng giọt dung dịch HCl 1M.
Ống 3. Thêm từ từ từng giọt dung dịch NH4Cl.
Ống 4. Thêm từ từ từng giọt dung dịch NaOH.
B. Hiện t ợng và giải thích: 1. Quan sát hiện t ợng:
❖ Khi cho NaOH vào MgCl2 thì dung dịch bắt đầu xuất hiện kết tủa
trắng Mg(OH)2 (Magnesium hydroxyde).
• Ống 1: Dung dịch chuyển sang màu hồng do có môi tr ờng base
• Ống 2: Kết tủa trắng tan dần, dung dịch dần trở thành trong suốt
• Ống 3: Kết tủa trắng tan dần, xuất hiện khí bốc h i (NH3)
• Ống 4: Kết tủa trắng không tan, không có hiện t ợng xảy ra 2. Ph ng trình phản ứng:
MgCl ( ) 2NaOH( ) ⟶ Mg(OH) ( ) ↓ 2NaCl( )
Mg(OH) ( ) 2HCl( ) ⟶ MgCl ( ) 2H O( )
Mg(OH) ( ) 2NH Cl( ) ⟶ MgCl ( ) 2NH ( ) 2H O( ) 7
Downloaded by VietJack TV Official (vietjackvideos@gmail.com) Mg(OH) ( ) NaOH( ) ↛
Thí nghiệm 7: Tác dụng của Ca với n ớc A. Các b ớc thực hiện:
Cho một mẫu kim loại Ca vào ống nghiệm chứa sẵn 2 ml n ớc cất. Quan
sát phản ứng. Sau khi phản ứng kết thúc, cho vài giọt dung dịch phenolphtalein.
B. Hiện t ợng và giải thích: Quan sát:
- Ca phản ứng mạnh với n ớc (tan dần) tạo dung dịch không màu và
xuất hiện khí H2 (Ca phản ứng mạnh h n so với Mg)
- Sau khi cho phenolphtalein thì dung dịch dần chuyển màu thành
màu hồng do có môi tr ờng base. Ph ng trình phản ứng: Ca( ) 2H O( ) ⟶ Ca(OH) ( ) H ( )
Thí nghiệm 8: Màu của ngọn lửa các ion kim loại kiềm thổ. A. Các b ớc thực hiện:
Dùng đ a thủy tinh nhúng vào dung dịch HCl đặc, sau đó đốt trên ngọn
lửa đèn khí và quan sát, nếu ngọn lửa còn màu thì lặp lại thí nghiệm
nhiều lần cho đến khi ngọn lửa trở thành không màu. Nhúng các đ a
thủy tinh lần l ợt vào các cốc chứa dung dịch bão hòa các muối MgCl2,
CaCl2, SrCl2, BaCl2, sau đó đốt trên ngọn lửa đèn khí hay đèn cồn.
B. Hiện t ợng và giải thích:
Các kim loại kiềm thổ tự do c ng nh hợp chất của chúng khi bị đốt sẽ
cháy cho ngọn lửa có màu đặc tr ng:
Mg cho ngọn lửa không màu!
Ca cho ngọn lửa màu đỏ da cam.
Sr cho ngọn lửa màu đỏ son.
Ba cho ngọn lửa màu lục h i vàng. 8
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Giải thích: T ng tự nh ở kim loại kiềm, ion kim loại của muối kiềm
thổ hấp thụ năng l ợng từ ngọn lửa, các electron lớp ngoài cùng bị kích
thích lên mức năng l ợng cao h n nên khi trở về trạng thái c bản chúng
sẽ phát ra bức xạ có b ớc sóng trong vùng khả kiến đặc tr ng cho mỗi
ion kim loại và có màu sắc khác nhau.
Thí nghiệm 9: Tác dụng của Al với O2 và n ớc A. Các b ớc thực hiện:
Dùng giấy nhám đánh sạch lớp oxit trên bề mặt 6 miếng nhôm, sau đó
cho vào một chiếc cốc nhỏ đựng cồn tuyệt đối để rửa sạch các vết dầu
mỡ, lau khô bằng giấy lọc.
Miếng thứ 1: để yên ngoài không khí, quan sát bề mặt của miếng nhôm
lúc ban đầu và sau một thời gian để ngoài không khí (khoảng 20 – 30 phút).
Miếng thứ 2: cho vào một cốc n ớc nóng.
Đặt miếng nhôm thứ 3 và thứ 4 lên tấm kính, rồi nhỏ vài giọt dung dịch
HgCl2 lên mỗi miếng. Sau khoảng 5 – 7 phút, rửa sạch bằng n ớc cất.
Để miếng thứ 3 lên tấm kính, còn miếng thứ 4 cho vào cốc n ớc nóng.
Miếng nhôm thứ 5 và thứ 6 tiến hành t ng tự nh miếng thứ 3 và thứ 4,
nh ng thay dung dịch HgCl2 bằng dung dịch CuCl2.
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
- Miếng 1: Không có hiện t ợng xảy ra
- Miếng 2: Gần nh phản ứng không xảy ra (xảy ra rất chậm)
Khi nhỏ dung dịch HgCl2 vào miếng nhôm, ta thấy dung dịch HgCl2 từ
không màu chuyển thành màu xám đen.
- Miếng 3: Miếng nhôm để ngoài không khí có một lớp màu trắng
xám hình kim phồng dần lên
- Miếng 4: Miếng nhôm ngâm trong n ớc có sủi bọt khí nh ng sau
đó thì hết đồng thời xuất hiện màng keo kết tủa tại n i phản ứng.
- Miếng 5,6: t ng tự miếng 3 và 4 nh ng xuất hiện kim loại màu đỏ bám lên miếng nhôm 9
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
2. Giải thích và ph ng trình phản ứng - Miếng 3:
Khi cho dung dịch HgCl2 vào nhôm:
2Al( ) 3HgCl ( ) ⟶ 2AlCl ( ) 3Hg( ,đ )
Ag sinh ra làm cho dung dịch HgCl2 chuyển thành màu đen.
Tại n i nhỏ của muối Hg2+, miếng nhôm tạo thành hỗn hợp Al – Hg (Aluminium amalgam). Al Hg ⟶ Al ∙ Hg
Khi hỗn hợp này tiếp xúc với Oxygen – không khí: Al ∙ Hg O ⟶ Al O Hg( ,đ )
Lớp oxide mới đ ợc hình thành và bong ra, Hg tạo thành tiếp tục
tác dụng với Al rồi lại tác dụng với oxygen Lớp oxide cao dần - Miếng 4:
Do không còn lớp Oxide bảo vệ nên nhôm tác dụng với n ớc tạo thành
Nhôm oxide (Aluminium Oxide) và khí Hydrogen (H2):
2Al( ) 3H O( ) ⟶ Al O ( ) 3H ( )
Al có thể phản ứng với O2 và H2O khi không có lớp oxide hoặc hydroxide bao quanh. - Miếng 5: Khi cho CuCl2 và nhôm:
2Al( ) 3CuCl ( ) ⟶ 2AlCl ( ) 3Cu( ,đỏ)
Xuất hiện kim loại Cu màu đỏ bám lên trên miếng nhôm - Miếng 6:
Do không còn lớp Oxide bảo vệ nên nhôm tác dụng với n ớc tạo thành
Nhôm oxide (Aluminium Oxide) và khí Hydrogen (H2): 10
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
2Al( ) 3H O( ) ⟶ Al O ( ) 3H ( )
Al có thể phản ứng với O2 và H2O khi không có lớp oxide hoặc hydroxide bao quanh.
Thí nghiệm 10: Tác dụng của Al với các dung dịch acid. A. Các b ớc thực hiện:
a) Cho vào 3 ống nghiệm lần l ợt mỗi ống khoảng 2 ml dung dịch
HCl 1M, H2SO4 0.5M, HNO3 1M. Thêm vào mỗi ống một miếng
nhôm hoặc 3 hạt nhôm. Đun nóng ống nghiệm
b) Lặp lại thí nghiệm nh phần a, nh ng thay bằng các dung dịch axit đậm đặc
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
a) Ống 1: HCl, Ống 2: H2SO4, Ống 3: HNO3, toàn bộ là dung dịch loãng
1. Khi ch a đun nóng, thấy:
• Ống 1: Phản ứng xảy ra chậm, có bọt khí trên bề mặt Al (H2)
• Ống 2: Phản ứng xảy ra chậm, có bọt khí trên bề mặt Al (H2)
• Ống 3: Không có hiện t ợng 2. Khi đun nóng, thấy:
• Ống 1: Phản ứng xảy ra mạnh, khí thoát ra rất nhiều (H2)
• Ống 2: Phản ứng xảy ra mạnh, khí thoát ra rất nhiều (H2)
• Ống 3: Phản ứng xảy ra nhanh h n, có khí màu nâu đỏ thoát ra (NO2)
2. Giải thích và ph ờng trình phản ứng:
2Al( ) 6HCl( ) ⟶ 2AlCl ( ) 3H ( )
2Al( ) 3H SO ( ) ⟶ Al (SO ) ( ) 3H ( )
Al( ) 6HNO ( ) ⟶ Al(NO ) ( ) 3NO ( , â đỏ) 3H O( ) ( °)
b) Ống 1: HCl, Ống 2: H2SO4, Ống 3: HNO3, toàn bộ là dung dịch đậm đặc
1. Khi ch a đun nóng, thấy: 11
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
• Ống 1: Phản ứng xảy mạnh, tạo bọt khí, tạo dung dịch trong suốt
• Ống 2: Không có hiện t ợng
• Ống 3: Không có hiện t ợng 2. Khi đun nóng, thấy:
• Ống 1: Phản ứng xảy mạnh, tạo bọt khí, tạo dung dịch trong suốt
• Ống 2: Phản ứng xảy ra mạnh, có khí không màu thoát ra
• Ống 3: Phản ứng xảy ra nhanh h n, có khí màu nâu đỏ thoát ra (NO2)
Khi phản ứng xảy ra, nhôm bị chuyển dạng thù hình nên xuất hiện chất
rắn màu đen, sau đó tan dần tạo dung dịch trong suốt 2Al( ) 6HCl( , ) ⟶ 2AlCl ( ) 3H ( ) 2Al( ) 6H SO ( , ) ⟶ Al (SO ) ( ) 3SO ( ) 3H ( ) Al( ) 6HNO ( , ) ⟶ Al(NO ) ( )
3NO ( , â đỏ) 3H O( ) ( °)
Al phản ứng trong dung dịch kiềm mạnh nhất khi đun nóng. Ở
nhiệt độ th ờng thì Al sẽ bị thụ động hóa. => Nên dùng Acid đậm đặc 12
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 11: Tác dụng của Al với các dung dịch NaOH. A. Các b ớc thực hiện:
Cho một miếng nhôm (hoặc 2-3 hạt nhôm) vào ống nghiệm chứa sẵn 3 ml dung dịch NaOH 2M.
B. Hiện t ợng và giải thích:
Quan sát: Phản ứng xảy ra mạnh, có khí thoát ra, tạo dần thành dung dịch trong suốt.
Giải thích và viết ptpu:
Khi cho nhôm vào dung dịch base (NaOH), đầu tiên nhôm sẽ phản ứng
với n ớc tạo thành Al(OH)3 và có khí H2 bay ra., sau đó Al(OH)3 tiếp
tục tác dụng với dung dịch NaOH tạo thành NaAlO2 (Sodium Aluminate).
2Al( ) 6H O( ) ⟶ 2Al(OH) ( ) 3H ( ) (1)
Al(OH) ( ) NaOH( ) ⟶ NaAlO ( ) 2H O( ) (2) 3
(1), (2) => Al( ) H O( ) NaOH( ) ⟶ NaAlO ( ) H 2 ( )
Thí nghiệm 12: Điều chế và tính chất của Al(OH)3. A. Các b ớc thực hiện:
Cho vào lần l ợt 4 ống nghiệm mỗi ống 2 ml dung dịch Al2(SO4)3 1M
hoặc AlCl3 1M. Thêm từ từ vào mỗi ống từng giọt dung dịch NH3 10%
cho đến khi xuất hiện kết tủa. Quan sát màu sắc và trạng thái của kết tủa. Ống 1: để so sánh.
Ống 2: thêm vào từng giọt dung dịch HCl 2M cho đến d .Ống 3: thêm
vào từng giọt dung dịch NaOH 2M cho đến d .
Ống 4: thêm vào từng giọt dung dịch NH4Cl 2M cho đến d
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
• Ống 1: Kết tủa trắng xuất hiện: Al(OH)3
• Ống 2: Kết tủa trắng tan dần
• Ống 3: Kết tủa trắng tan dần
• Ống 4: Không có hiện t ợng 13
Downloaded by VietJack TV Official (vietjackvideos@gmail.com) 2. Ph ng trình phản ứng:
Khi cho NH3 d vào trong dung dịch Al3+:
AlCl ( ) 3NH ( ) 3H O( ) ⟶ Al(OH) ( ) 3NH Cl( )
Al (SO ) ( ) 6NH ( ) 6H O( ) ⟶ 2Al(OH) ( ) 3(NH ) SO ( )
Ống 2: 2Al(OH) ( ) 6HCl( ) ⟶ 2AlCl ( ) 3H O( )
Ống 3: Al(OH) ( ) NaOH( ) ⟶ NaAlO ( ) 2H O( ) Ống 4: Al(OH) ( ) NH Cl( ) ↛ 14
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
BÀI 2. HALOGEN VÀ HỢP CHẤT
Thí nghiệm 1: Điều chế Chlorine (Cl2) A. Các b ớc thực hiện:
Lấy 1 ống nghiệm khô, cho vào một ít tinh thể MnO2.
Cho vào ống vài giọt dung dịch HCl 36%, đun nhẹ trong tủ hút.
Dùng giấy có tẩm KI và hồ tinh bột (có thể dùng giấy quỳ xanh tẩm ớt)
đặt vào miệng ống nghiệm để thử khí bay ra.
B. Hiện t ợng và giải thích 1. Hiện t ợng:
MnO2 màu đen tan dần, xuất hiện sủi bọt khí màu vàng lục (Cl2). Khí độc có mùi sốc. 2. Ph ng trình phản ứng:
MnO ( ) 4HCl( ) ⟶ MnCl ( ) Cl ( ) 2H O( )
3. Khi để mảnh giấy có chứa KI– Hồ tinh bột vào thì ta thấy giấy chuyển sang màu xanh
Do: 2KI( ) Cl ( ) ⟶ I ( ) 2KCl( ), I2 khi tác dụng với hồ tinh bột
sẽ tạo phức màu xanh tím.
Thí nghiệm 2: Điều chế Bromine (Br2) A. Các b ớc thực hiện: a)
Cho vào ống nghiệm khô một ít tinh thể KBr trộn đều với một ít bột
MnO2. Nhỏ từ từ vào hỗn hợp này 3-5 giọt dung dịch H2SO4 đặc.
Quan sát màu của h i thoát ra.
Dùng giấy tẩm KI và hồ tinh bột để thử h i bay ra (thí nghiệm thực hiện trong tủ hút). b)
Cho vào ống nghiệm 5 giọt dung dịch KBr, thêm từ từ từng giọt dung
dịch n ớc chlorine. Lắc cẩn thận ống nghiệm và quan sát sự thay đổi
màu sắc của dung dịch. Cho thêm vào 1 ml benzene và lắc cẩn thận, tiếp 15
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
tục quan sát sự thay đổi màu sắc của dung dịch. Trong một ống nghiệm
khác, cho vào 5 giọt dung dịch KBr, thêm từ từ n ớc chlorine đến d .
Quan sát sự thay đổi màu sắc của dung dịch
B. Hiện t ợng và giải thích: a) 1. Hiện t ợng:
Các tinh thể tan dần, xuất hiện sủi bọt khí, khí màu nâu đỏ (Br2) bay lên.
Nếu dùng giấy tẩm KI và hồ tinh bột thì ta sẽ thấy giấy chuyển màu xanh.
Do: 2KI( ) Br ( ) ⟶ I ( ) 2KBr( ), I2 khi tác dụng với hồ tinh
bột sẽ cho dung dịch màu xanh. 2. Ph ng trình phản ứng: 2KBr( ) MnO ( ) 2H SO ( )
⟶ Br ( ) 2H O( ) MnSO ( ) 2K SO ( ) b) Ống 1: 1. Hiện t ợng:
Ống 1: Khi cho dung dịch n ớc Cl2 vào trong dung dịch KBr thì dung
dịch từ trong suốt chuyển thành màu vàng
Khi nhỏ thêm dung dịch Benzene vào trong ống nghiệm và lắc nhẹ ta
thấy đ ợc có một lớp dung dịch màu nâu đỏ nổi lên trên (dung dịch
Benzene) lớp dung dịch màu vàng
Do khí Br2 tạo thành tan trong dung dịch benzene và nổi lên trên mặt n ớc.
Ống 2: Khi cho dung dịch n ớc Chlorine vào trong dung dịch KBr thì
dung dịch từ trong suốt chuyển thành màu vàng 2. Ph ng trình phản ứng
2KBr( ) Cl ( ) ⟶ Br ( ) 2KCl( ) c) Câu hỏi:
1. Tại sao Bromide tan trong benzene nhiều h n trong n ớc? 16
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Do Br2 là chất tan không phân cực nên tan nhiều trong các dung môi
không phân cực. Còn n ớc là dung môi phân cực nên Br2 ít tan trong n ớc.
2. Có thể thay luồng khí Chlorine trực tiếp tác dụng với dung dịch KBr đ ợc không?
Có thể dẫn luồng khí Cl2 vào dung dịch KBr.
Thí nghiệm 3: Điều chế Iodine (I2) A. Các b ớc thực hiện: a)
Cho vào chén sứ khô một ít tinh thể KI, trộn đều với một ít bột MnO2.
Thêm vào đó khoảng 3-5 giọt dung dịch H2SO4 đặc. Đậy chén bằng mặt
kính đồng hồ. Đặt chén lên giá tam giác và đun nhẹ bằng ngọn lửa đèn cồn.
Quan sát phản ứng qua mắt kính đồng hồ. Khi có h i màu tím thoát ra,
tắt đèn, để nguội chén. Quan sát tinh thể Iodine b)
Cho vào ống nghiệm 5 giọt dung dịch KI, thêm từ từ từng giọt dung dịch
n ớc chlorine đến khi dung dịch có màu vàng rõ rệt. Cho thêm vào 1 ml
benzene và lắc cẩn thận. Quan sát sự thay đổi màu sắc của dung dịch.
B. Hiện t ợng và giải thích: a)
Hiện t ợng: khí màu tím thoát ra (I2) Ph ng trình hóa học:
2KI( ) MnO ( ) 2H SO ( ) ⟶ I ( ) 2H O( ) MnSO ( ) 2K SO ( ) b)
Hiện t ợng: Chất lỏng đ ợc phân làm 2 lớp, lớp phía d ới chất lỏng
không màu còn lớp phía trên màu tím đen do I2 tan trong benzene t ng tự nh với Br2 Ph ng trình hóa học:
2KI( ) Cl ( ) ⟶ Cl ( ) 2KCl( ) 17
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 4: Khả năng hòa tan của Br2 và I2 trong n ớc và dung môi hữu c A. Các b ớc thực hiện:
a) Dung dịch Bromide và Iodine bão hòa trong n ớc.
Cho vài giọt brom vào 2 ml n ớc trong một ống nghiệm và lắc đều (còn
lại một ít brom d ới đáy ống nghiệm không tan).
Cho vài tinh thể iodine vào 2 ml n ớc trong một ống nghiệm và lắc đều
khoảng 15 phút. Nếu có máy lắc thì đặt trên máy. Vì I2 tan chậm trong
n ớc nên có thể lắc lâu h n.
b) Khả năng hòa tan của Br2 và I2 trong dung môi hữu c
Cho 0,5 ml dung dịch bão hòa (ở phần a) vào một ống nghiệm, thêm vào
2 ml n ớc cất. Nh vậy, có 4 ống nghiệm chứa dung dịch brom (1, 2, 3,
4) và 4 ống nghiệm đựng dung dịch n ớc iodine (5, 6, 7, 8). Cho vào
mỗi cặp ống nghiệm lần l ợt các dung môi: benzene, carbon disulfide, Me2O, Tetrachloro methane
B. Hiện t ợng và giải thích:
a) Dung dịch Bromide và Iodine bão hòa trong n ớc.
- Ống 1: dung dịch n ớc Bromide
Br2 ít tan trong n ớc, tạo dung dịch có màu vàng – nâu.
- Ống 2: dung dịch n ớc Iodine
I2 ít tan trong n ớc, tạo dung dịch màu hồng cánh sen – tím
b) Khả năng hòa tan của Br2 và I2 trong dung môi hữu c
1. Ống 1: chứa Benzene và Bromide
Ống nghiệm đ ợc chia làm 2 lớp, lớp ở trên là benzene (màu vàng), lớp
ở d ới là n ớc (trong h n phía trên) do benzene không tan trong n ớc
và nhẹ h n n ớc do có khối l ợng riêng nhỏ h n n ớc. Bromide đ ợc
chuyển từ lớp d ới sang lớp trên => Bromide tan trong benzene nhiều h n.
2. Ống 2: chứa CS2 và Bromide
Ống nghiệm đ ợc chia làm 2 lớp, lớp ở trên là n ớc (trong h n lớp
d ới), lớp ở d ới là CS2 (màu đục cam) do CS2 không tan và nặng h n 18
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
n ớc. Bromide đ ợc chuyển từ lớp trên sang lớp d ới => Bromide tan trong CS2 nhiều h n
3. Ống 3: chứa Ether và Bromide
Ở khoảng thời gian đầu, ống nghiệm đ ợc chia làm 2 lớp, lớp ở trên là
Ether (màu đục vàng), lớp ở d ới là n ớc (trong h n lớp trên) do CS2
không tan và nhẹ h n n ớc. Bromide đ ợc chuyển từ lớp d ới sang lớp
trên => Bromide tan trong Ether nhiều h n.
Để một khoảng thời gian thì dung dịch mất màu vàng do có phản ứng giữa Br2 và ether.
4. Ống 4: chứa CCl4 và Bromide
Ống nghiệm đ ợc chia làm 2 lớp, lớp ở trên là n ớc (trong h n lớp
d ới), lớp ở d ới là CCl4 (màu đục) do CCl4 không tan và nặng h n
n ớc. Bromide đ ợc chuyển từ lớp trên sang lớp d ới => Bromide tan trong CCl4 nhiều h n
T ng tự với các ống nghiệm của dung dịch n ớc I2
5. Ống 1: chứa Benzene và Iodine
Ống nghiệm đ ợc chia làm 2 lớp, lớp ở trên là benzene (đỏ hồng nhạt),
lớp ở d ới là n ớc (vàng trong h n phía trên) do benzene không tan
trong n ớc và nhẹ h n n ớc do có khối l ợng riêng nhỏ h n n ớc.
Iodine đ ợc chuyển từ lớp d ới sang lớp trên => Iodine tan trong benzene nhiều h n.
6. Ống 2: chứa CS2 và Iodine
Ống nghiệm đ ợc chia làm 2 lớp, lớp ở trên là n ớc (vàng trong h n lớp
d ới), lớp ở d ới là CS2 (màu hồng tím nhạt) do CS2 không tan và nặng
h n n ớc. Iodine đ ợc chuyển từ lớp trên sang lớp d ới => Iodine tan trong CS2 nhiều h n
7. Ống 3: chứa Ether và Iodine
Ở khoảng thời gian đầu, ống nghiệm đ ợc chia làm 2 lớp, lớp ở trên là
Ether (màu đục vàng), lớp ở d ới là n ớc (trắng h i đục) do CS2 không
tan và nhẹ h n n ớc. Iodine đ ợc chuyển từ lớp d ới sang lớp trên =>
Iodine tan trong Ether nhiều h n. 19
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Để một khoảng thời gian thì dung dịch mất màu vàng do có phản ứng giữa I2 và ether.
8. Ống 4: chứa CCl4 và Iodine
Ống nghiệm đ ợc chia làm 2 lớp, lớp ở trên là n ớc (gần nh không
màu), lớp ở d ới là CCl4 (màu hồng tím nhạt) do CCl4 không tan và
nặng h n n ớc. Iodine đ ợc chuyển từ lớp trên sang lớp d ới => Iodine tan trong CCl4 nhiều h n
Thí nghiệm 5: Tác dụng của Halogen với các kim loại A. Các b ớc thực hiện:
a) Tác dụng của Cl2 với là đồng
Dùng một trong các phản ứng điều chế khí chlorine ở thí nghiệm 1. Thu
đầy khí Cl2 vào lọ khô, phía d ới đáy lọ có một lớp cát mỏng.
Dùng cặp kẹp lá đồng đã đ ợc nung đỏ trên ngọn lửa đèn cồn, đ a
nhanh vào lọ chứa khí Cl2. Chú ý phải giữ chặt lá đồng trong cặp, không
để r i lá đồng xuống đáy lọ hoặc chạm vào thành lọ, nếu không lọ sẽ vỡ
do nhiệt tỏa ra của phản ứng rất lớn.
Quan sát hiện t ợng lá đồng cháy trong khí Cl2. Khi lá đồng đã cháy
xong, để nguội và cho vào vài ml n ớc, lắc cho khói trong lọ tan hết
b) Tác dụng của I2 và bột nhôm
Cho vào cối sứ khô một ít tinh thể I2 và một ít bột nhôm. Nghiền trộn
đều hỗn hợp trong cối sứ. Quan sát hiện t ợng.
Cho vào cối sứ vài giọt n ớc. Quan sát hiện t ợng.
B. Hiện t ợng và giải thích:
a) Tác dụng của Cl2 với lá đồng (Cu). 1. Hiện t ợng:
Đồng cháy sáng trong bình Cl2, nồng nóng chảy rớt xuống đáy bình (bột màu đen, CuCl2(s))
Sau khi để nguội và cho n ớc cất vào bình ta thu đ ợc dung dịch có màu xanh lam (CuCl2(aq)). 2. Ph ng trình hóa học: Cu( ) Cl ( ) ⟶ CuCl ( ) 20
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
b) Tác dụng của Iodine với nhôm (Al). 1. Hiện t ợng:
Phản ứng xảy ra rất mạnh, có khí màu tím đậm thoát ra (I2) do phần I2
thăng hoa. Bột nhôm dần tan và tạo thành muối AlI3
2. Giải thích và ph ng trình phản ứng:
Do phản ứng xảy ra rất mạnh và tỏa nhiều nhiệt nên khiến phần I2(s) rắn
thăng hóa thành thể khí I2(g) 2Al( ) 3I ( ) ⟶ 2AlI ( )
Thí nghiệm 6: Tác dụng của Cl2 với P và H2. A. Các b ớc thực hiện:
a) Tác dụng của Cl2 và P.
Dùng thìa thủy tinh lấy một ít phosphorus đỏ (bằng hạt đậu đen) cho vào
môi đốt bằng kim loại, h nóng trên ngọn đèn cồn và đ a nhanh vào lọ
đựng khí chlorine. Quan sát hiện t ợng. Sau khi photpho cháy xong, đổ
vào lọ một ít n ớc và lắc đều. Thử tính axit của dung dịch thu đ ợc.
b) Tác dụng của Cl2 và H2.
Lấy một ống nghiệm dày thu một nửa thế tích khí chlorine, sau đó tiếp
tục thu khi hidro đến khi đầy ống nghiệm. Cả hai khí đều thu bằng
ph ng pháp dời chổ n ớc.
Dùng ngón tay cái bịt miệng ống nghiệm và dùng vải lót tay cầm ngang
ống nghiệm, đ a miệng ống nghiệm lại gần ngọn lửa đèn cồn, mở ngón
tay cái ra để đốt hỗn hợp khí (có hiện t ợng nổ).
B. Hiện t ợng và giải thích:
a) Tác dụng của Cl2 với P. 1. Hiện t ợng:
Phosphorus đỏ phản ứng với Cl2 ở nhiệt độ phòng, Pđỏ cháy nhẹ
Phản ứng của P với các halogen nh Cl2, Br2, F2 là phản ứng tỏa nhiệt
rất mạnh, tất cả đều có thể gây nổ khi tác dụng với Ptrắng
Sau khi Phosphorus cháy xong, bỏ n ớc vào trong lọ và thử bằng giấy
quỳ tím thì ta sẽ thấy đ ợc giấy quỳ chuyển màu đỏ do trong lọ chứa môi tr ờng acid 21
Downloaded by VietJack TV Official (vietjackvideos@gmail.com) 2. Ph ng trình phản ứng: 4P( ) 10Cl ( ) ⟶ 4PCl ( )
PCl ( ) 4H O( ) ⟶ HCl( ) H PO ( )
b) Tác dụng của Cl2 và H2. 1. Hiện t ợng:
Có hiện t ợng nổ xảy ra 2. Giải thích:
Ta cần đặt ống nghiệm nằm ngang để cho Cl2 và H2 phân tán đều ra giúp
phản ứng dễ xảy ra h n.
Khi đ a đến gần ngọn lửa đèn cồn (hoặc là thêm tia lửa) có thể làm cho
phản ứng xảy ra cực mạnh tới mức gây nổ.
(có thể thực tế là do H2 tác dụng với O2 trong không khí gây nổ h n là tác dụng với Cl2) 3. Ph ng trình phản ứng: H ( ) Cl ( ) ⟶ 2HCl( ) 2H ( ) O ( ) ⟶ 2H O( )
Thí nghiệm 7: Tác dụng của Iodine với hồ tinh bột A. Các b ớc thực hiện:
Trong một ống nghiệm chứa khoảng 0,5 ml dung dịch n ớc I2 (thực tế là
I2 trong KI), thêm vào đó vài giọt hồ tinh bột.
Thực hiện thí nghiệm trên với n ớc Cl2 và n ớc Br2 để so sánh
B. Hiện t ợng và giải thích: 1. Hiện t ợng
Ống 1: Dung dịch n ớc I2 chuyển màu xanh
Ống 2: Dung dịch n ớc Cl2 mất màu
Ống 3: Dung dịch n ớc Br2 chuyển màu xanh
2. Giải thích và ph ng trình phản ứng
Ống 1: I2 tác dụng với dung dịch hồ tinh bột tạo phức màu xanh
Ống 2: Cl2 tác dụng với KI tạo ra khí I2, làm mất màu vàng của dung
dịch n ớc Cl2, sau I2 tác dụng với dung dịch hồ tinh bột tạo phức màu 22
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
xanh lam. Nếu n ớc Cl2 d thì Cl2 tác dụng với n ớc tạo ra HClO có
tính oxi hóa và tẩy màu rất mạnh làm mất màu xanh của phức.
2KI( ) Cl ( ) ⟶ I ( ) 2KCl( )
Cl ( ) H O( ) ⟶ HClO( ) HCl( )
Ống 3: Br2 tác dụng với KI tạo ra khí I2, làm mất màu vàng của dung
dịch n ớc Cl2, sau I2 tác dụng với dung dịch hồ tinh bột tạo phức màu xanh lam.
2KI( ) Br ( ) ⟶ I ( ) 2KBr( )
Thí nghiệm 8: So sánh tính hoạt động của Cl2, Br2 và I2. A. Các b ớc thực hiện: a)
Trong ống nghiệm đựng khoảng 1 ml dung dịch KBr, nhỏ từ từ vài giọt
dung dịch n ớc chlorine rồi lắc mạnh. Tiếp tục thêm n ớc Cl2 rồi lắc mạnh. b)
Trong ống nghiệm đựng 1 ml dung dịch KI, nhỏ vào đó từng giọt n ớc
Br2. Sau đó cho vào dung dịch vài giọt hồ tinh bột.
B. Hiện t ợng và giải thích: a)
Khi cho dung dịch n ớc Cl2 vào trong dung dịch KBr thì dung dịch từ
trong suốt chuyển thành màu vàng
2KBr( ) Cl ( ) ⟶ Br ( ) 2KCl( ) b)
Br2 tác dụng với KI tạo ra khí I2, làm mất màu vàng của dung dịch n ớc
Cl2, sau I2 tác dụng với dung dịch hồ tinh bột tạo phức màu xanh lam.
2KI( ) Cl ( ) ⟶ I ( ) 2KCl( ) 23
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 9: Điều chế khí HCl bằng cách cho NaCl(s) tác dụng với dung dịch H2SO4(đ). A. Các b ớc thực hiện:
Cho vào bình cầu có nhánh với dung tích 250 ml khoảng 10 gam tinh thể
NaCl. Dùng phễu rót vào phễu nhỏ giọt khoảng 20 ml dung dịch H2SO4
98% (d = 1,84 g. ml− ). Mở khóa phễu cho từng giọt H2SO4 chảy
xuống bình cầu. Dùng đèn cồn đun nhẹ bình cầu. Dùng bình tam giác
khô thu khí thoát ra, khi nào khí đầy bình thì đậy lại bằng miếng thủy
tinh, không cho khí thoát ra ngoài. Khi thu khí xong phải cắm ống dẫn
khí vào cốc đựng dung dịch NaOH, đồng thời khóa phễu nhỏ giọt không
cho H2SO4 đặc chảy xuống bình cầu.
B. Hiện t ợng và giải thích: 1. Hiện t ợng
Phản ứng xảy ra mãnh liệt, khí HCl không màu thoát ra theo ống dẫn khí.
Có thể sử dụng giấy quỳ (hóa đỏ) để kiểm tra xem bình đã đầy khí ch a
hoặc quan sát l ợng khí thoát ra ở bình. 2. Ph ng trình phản ứng:
2NaCl( ) H SO ( ) ⟶ 2HCl( ) Na SO ( )
Thí nghiệm 10: Khả năng hòa tan của khí HCl trong n ớc. A. Các b ớc thực hiện:
Lấy một chậu thủy tinh chứa khoảng 2/3 n ớc, (thêm vào chậu vài giọt
dung dịch NaOH và vài giọt dung dịch phenolphtalein.)
Dùng bình tam giác đã thu đầy khí trong thí nghiệm 1 ở trên, nút bình
tam giác bằng nút có cắm ống thủy tinh vuốt nhọn, phần vuốt nhọn
h ớng vào trong bình tam giác.
Úp ng ợc bình tam giác vào chậu thủy tinh đựng n ớc đã chuẩn bị sẵn ở trên.
B. Hiện t ợng và giải thích: 1. Hiện t ợng: 24
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Ta thấy n ớc từ bên d ới chậu thủy tinh trào ng ợc lên bình khí HCl tạo
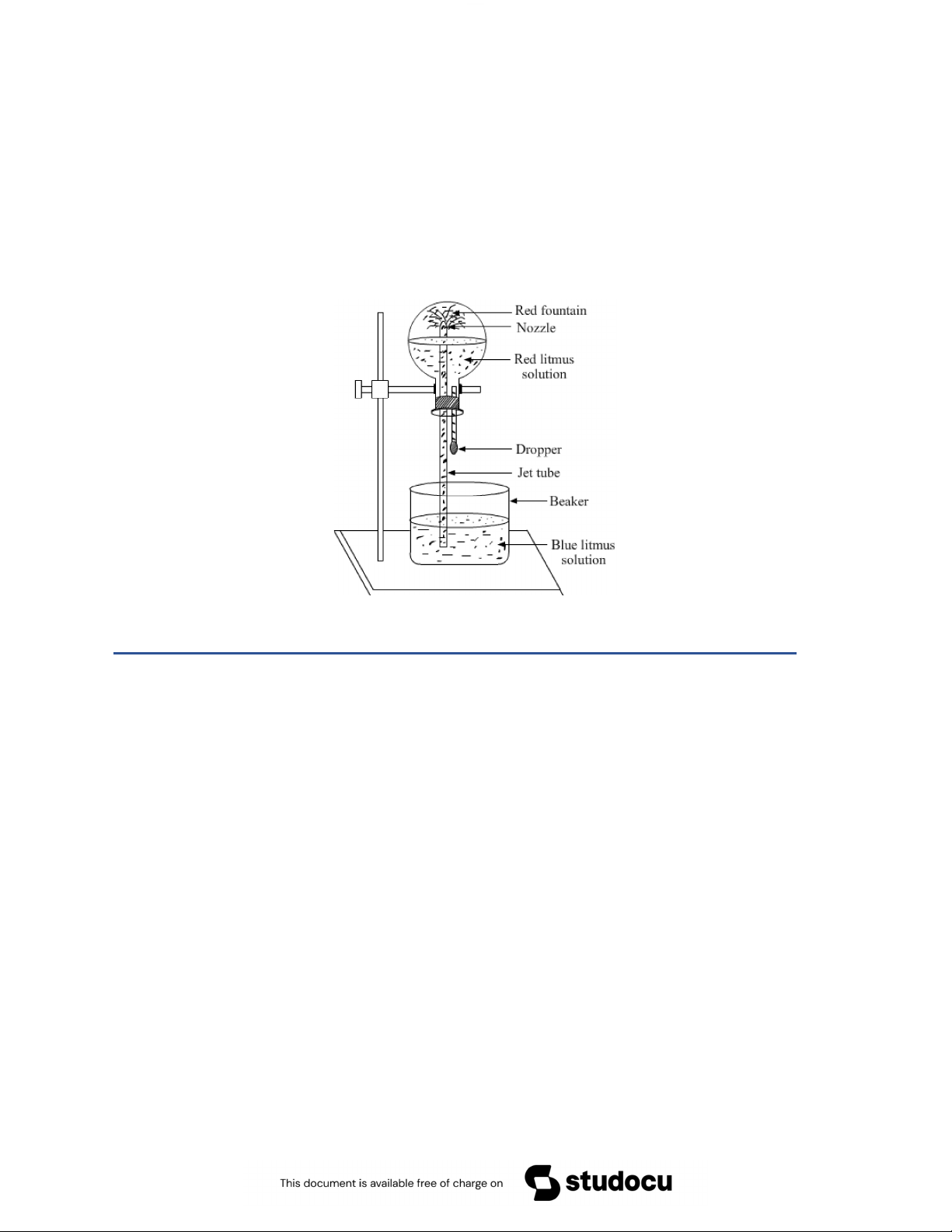
thành một đài phun n ớc (HCl Fountain) 2. Giải thích
Giải thích: Do khí HCl tan rất tốt trong n ớc nên khi khí bắt đầu tan thì
sẽ tạo ra sự chênh lệch áp suất (áp suất trong bình thấp) nên áp suất khí
quyển (bên ngoài) đã đẩy n ớc chảy ng ợc vào bình.
Thí nghiệm 11: Tính acid của dung dịch HCl, nhận biết khí HCl. A. Các b ớc thực hiện:
Cho vào bình tam giác đựng đầy khí HCl khoảng 10 ml n ớc, lắc mạnh.
Cho dung dịch vào 2 ống nghiệm.
Ống 1: Nhúng giấy quỳ tím để thử môi tr ờng axit của dung dịch HCl,
sau đó cho thêm vài giọt dung dịch AgNO3.
Ống 2: Cho vào một lá kim loại Mg.
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
Ống 1: Giấy quỳ tím hóa hồng. Sau khi cho AgNO3 vào thì bắt đầu xuất
hiện kết tủa trắng (AgCl)
Ống 2: Mg tan chậm trong dung dịch HCl, sủi bọt khí H2. 2. Ph ng trình phản ứng:
Ống 1: AgNO ( ) HCl( ) ⟶ AgCl( , ắ ) HNO ( )
Ống 2: Mg( ) 2HCl( ) ⟶ MgCl ( , ) H ( ) 25
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 12: Thuốc thử Halide ions. A. Các b ớc thực hiện:
Lấy 4 ống nghiệm, cho vào mỗi ống 1 ml dung dịch, CaF2, NaCl, NaBr,
KI. Thêm vào mỗi ống 2-3 giọt dung dịch AgNO3.
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
Ống 1: Không có hiện t ợng
Ống 2: Kết tủa trắng (AgCl) (white)
Ống 3: Kết tủa vàng nhạt (AgBr) (yellowish)
Ống 4: Kết tủa vàng (AgI) (yellow) 2. Ph ng trình phản ứng Ống 1: AgNO ( ) CaF ( ) ↛
Ống 2: AgNO ( ) NaCl( ) ⟶ AgCl( , ắ ) NaNO ( )
Ag+( ) Cl−( ) ⟶ AgCl( , ắ )
Ống 3: AgNO ( ) NaBr( ) ⟶ AgBr( , à ℎạ ) NaNO ( )
Ag+( ) Br−( ) ⟶ AgBr( , à ℎạ )) Ống 4:
AgNO ( ) KI( ) ⟶ AgI( , à ) KNO ( )
Ag+( ) I−( ) ⟶ AgI( , à ) 26
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 13: So sánh tính khử của các Halide ion (X-) A. Các b ớc thực hiện:
Lấy 3 ống nghiệm, cho vào mỗi ống 1 ml dung dịch NaCl, NaBr, KI.
Thêm vào mỗi ống khoảng 0.5 ml benzene và 5 giọt dung dịch FeCl3.
Lắc đều các ống nghiệm.
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
Ống 1: không có hiện t ợng xảy ra, dung dịch phân lớp 1 lớp benzene
nhẹ h n nằm trên trong suốt, lớp ở d ới là NaCl => không có Cl2 đ ợc
tạo thành do benzene không hấp thụ đ ợc Cl2
Ống 2: không có hiện t ợng xảy ra, dung dịch phân lớp 1 lớp benzene
nhẹ h n nằm trên trong suốt, lớp ở d ới là NaBr => không có Br2 đ ợc
tạo thành do benzene không hấp thụ đ ợc Br2
Ống 3: dung dịch phân lớp, lớp trên là lớp Benzene nhẹ h n màu tím
đen, lớp d ới màu nâu nhạt. => Benzene hấp thụ I2 (tím) 2. Ph ng trình phản ứng: Ống 1: FeCl ( ) 2NaCl( ) ↛ Ống 2: FeCl ( ) NaBr( ) ↛ Ống 3:
2FeCl ( ) 2NaI( ) ⟶ 2FeCl ( ) I ( ) 2NaCl( ) 2I−( ) ⟶ I ( ) 2e− ( ) Fe +( ) e− ⟶ Fe +( ,) ( )
( ), ( ) => 2I−( ) 2Fe +( ) ⟶ 2Fe +( ,) I ( )
3. Bằng cách nào để chứng minh ion Fe3+ bị khử thành Fe2+?
Ta có thể nhận biết qua màu sắc của benzene và dung dịch muối.
Ở 2 ống nghiệm đầu ta không thấy benzene đổi màu chứng tỏ không có
Br2 và I2 tan trong dung dịch => phản ứng không xảy ra. 27
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Ở ống 3 ta có thể thấy benzene đổi màu và dung dịch muối ở d ới nhạt
màu dần => tạo ra I2 và tan trong Benzene.
Ngoài ra ta có thể nhận biết qua màu sắc của muối sắt trong dung dịch:
Dung dịch Fe3+ có màu nâu đỏ
Dung dịch Fe2+ có màu xanh lục nhạt
Thí nghiệm 14: Điều chế và tính tẩy màu của n ớc Chlorine A. Các b ớc thực hiện:
Dùng một ống nghiệm lớn chứa khoảng 10 ml n ớc cất, cho dòng khí
chlorine (điều chế từ BÀI 3) lội từ từ qua n ớc trong ống nghiệm cho
đến bão hòa (khoảng 7 – 10 phút).
Chia dung dịch vào 2 ống nghiệm: cho vào ống 1 một mẫu giấy màu;
ống 2 cho vào một giọt mực màu.
B. Hiện t ợng và giải thích: 1. Hiện t ợng: Ống 1: Giấy mất màu
Ống 2: giọt mực c ng mất màu 2. Ph ng trình phản ứng
Cl ( ) H O( ) ⟶ HClO( ) HCl( )
3. Hãy cho biết thành phần của n ớc Cl2, vì sao dung dịch n ớc
Chlorine có tính tẩy màu?
Dung dịch n ớc Chlorine gồm Cl2, dung dịch HClO và dung dịch HCl.
Dung dịch có tính tẩy màu là do có chứa HClO là một acid yếu, kém bền
và có tính oxi hóa rất mạnh, khi HClO tác dụng với n ớc tạo thành [O−]
(nascent oxygen), [O−] phản ứng với các dung dịch màu khiến chúng mất màu.
Cl ( ) H O( ) ⟶ HClO( ) HCl( ) HClO( ) ⟶ HCl( ) [O−]
colored subtance [O−] ⟶ colorless subtance 28
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 15: Điều chế và tính tẩy màu của n ớc Javen A. Các b ớc thực hiện:
Lấy một ống nghiệm lớn, cho vào khoảng 5 ml dung dịch NaOH 2M, đặt
vào cốc n ớc lạnh và sục khí chlorine vào dung dịch NaOH khoảng 5 –
7 phút (làm nh thí nghiệm 6).
Dùng dung dịch n ớc Javen thu đ ợc thử tính tẩy màu của mực xanh.
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
Dung dịch n ớc Javen làm mất màu mực xanh 2. Ph ng trình phản ứng:
Cl ( ) 2NaOH( ) ⟶ NaClO( ) NaCl( ) H O( )
T ng tự với n ớc Chlorine, NaClO (Sodium hypochlorite) c ng là một
chất oxi hóa mạnh và dễ phân hủy tạo thành [O−] NaClO( ) ⟶ NaCl( ) [O−]
Thí nghiệm 16: Phản ứng khắc thủy tinh A. Các b ớc thực hiện:
Dùng chổi lông quét một lớp mỏng paraffin nóng chảy trên miếng kính
đã rửa sạch, lau khô, dung đinh nhọn hoặc bút bi hết mực kẻ hàng chữ
tùy ý lên lớp paraffin này sao cho nét chữ làm lộ mặt kính ra. Phủ một
lớp mỏng bột CaF2 lên các nét chữ vừa kẻ, sau đó nhỏ từng giọt dung
dịch H2SO4 đặc lên lớp phủ CaF2. Nhanh chóng dùng miếng kính khác
chồng lên miếng kính đang làm thí nghiệm.
Sau 45 – 60 phút, dùng dao cạo và rửa sạch lớp Paraffin wax.
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
Sau khi phản ứng kết thúc và cạo lớp sáp ra, ta thấy lớp thủy tinh sẽ hiện
mặt chữ mà ta đã khắc lên. 2. Giải thích: 29
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Khi CaF2 (Calcium fluoride) tác dụng với dung dịch H2SO4 đặc sẽ tạo ra
khí HF (Hydrogen fluoride) bốc h i lên và đ ợc tấm kính chặn lại.
Khi đó phản ứng giữa SiO2 (Silicon dioxide) (thành phần chính của mặt
kính) và HF diễn ra và thủy tinh sẽ bị ăn mòn dần.
Ta sử dụng lớp paraffin để phết lên tấm kính do paraffin không tác dụng
với dung dịch H2SO4 đặc. 3. Ph ng trình phản ứng: Khi đổ H2SO4 vào CaF2:
2H SO ( ) CaF ( ) ⟶ CaSO ( ) 2HF( ) Sau đó:
SiO ( ) HF( ) ⟶ SiF ( ) 2H O( ) 30
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
BÀI 3. CARBON, NITROGEN, PHOSPHORUS VÀ HỢP CHẤT
Thí nghiệm 1: Điều chế khí N2 A. Các b ớc thực hiện
Dùng ống nghiệm lớn có gắn hệ thống dẫn khí, cho vào 3 ml dung dịch
NH4Cl bão hòa và 3 ml dung dịch NaNO2 bão hòa. Đun nóng nhẹ bằng
ngọn lửa đèn cồn cho đến khi phản ứng xảy ra. Thử sự cháy của
Nitrogen bằng cách cho một miếng gỗ đang bị đốt cháy vào bình.
B. Hiện t ợng và giải thích 4. Hiện t ợng:
Xuất hiện sủi bọt khí N2, thu khí N2 bằng ph ng pháp dời chỗ n ớc.
Miếng gỗ đang cháy thì bị tắt. => Khí N2 không duy trì sự cháy 5. Ph ng trình phản ứng:
NaNO ( ) NH Cl( ) ⟶ NaCl( ) N ( ) 2H O( )
Thí nghiệm 2: Điều chế khí NH3 từ dung dịch NH3 đậm đặc và thử khả năng hòa tan. A. Các b ớc thực hiện
Trong bình cầu cổ tròn chứa khoảng 1/3 thể tích dung dịch ammonia
đậm đặc, đậy kín bình bằng nút có gắn ống dẫn khí. Lắp bình cầu lên giá
kẹp chặt, đun nhẹ bình cho khí thoát ra.
Thu khí ammonia thoát ra vào bình tam giác có gắn ống thủy tinh vuốt
nhọn. Úp ng ợc bình vào chậu n ớc đã pha sẵn vài giọt dung dịch phenolphtalein.
B. Hiện t ợng và giải thích 3. Hiện t ợng:
Đầu tiên ta thấy dung dịch NH3 cạn dần và có khí bay lên.
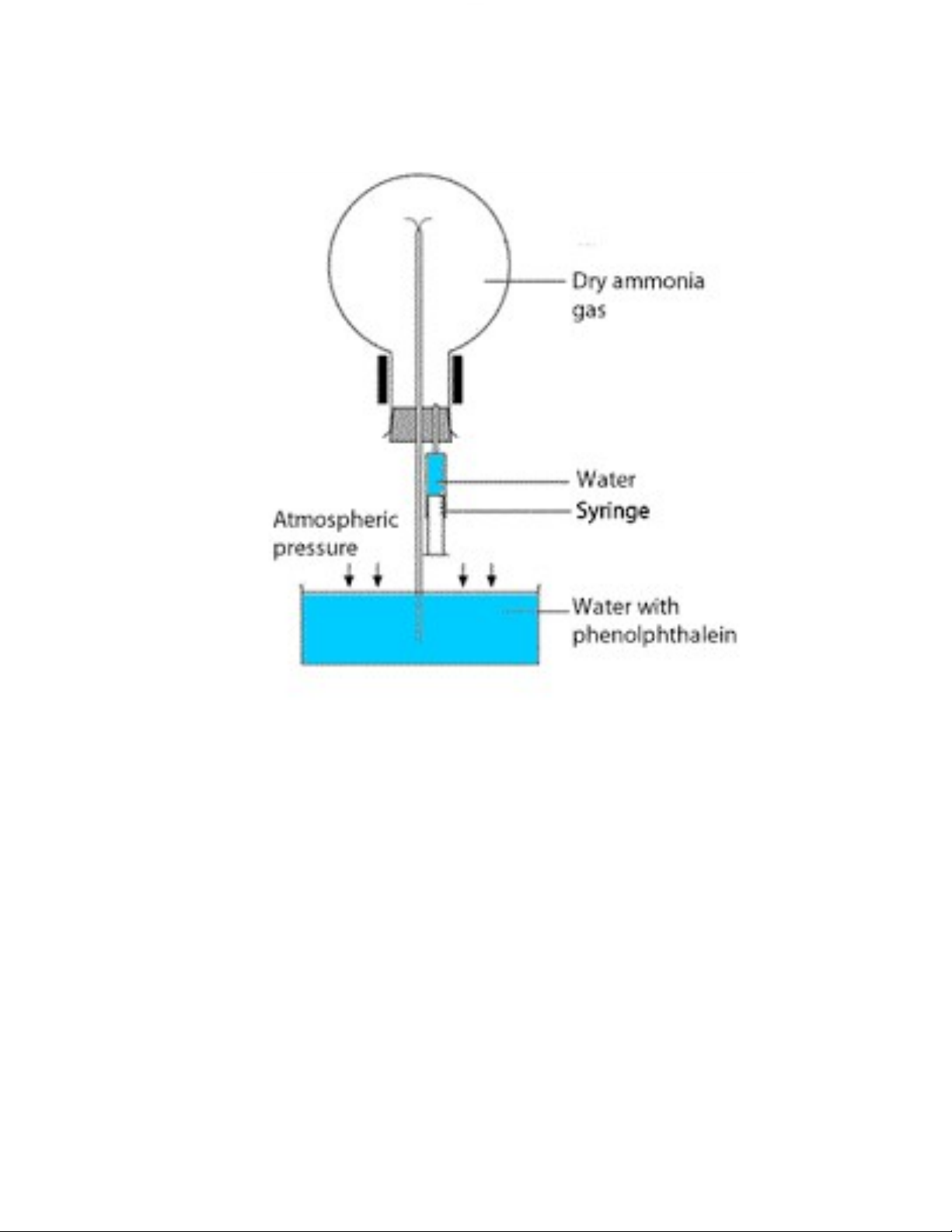
Sau đó khi úp ng ợc bình NH3 vào chậu n ớc, ta thấy n ớc từ bên d ới
chậu thủy tinh trào ng ợc lên bình khí NH3 tạo thành một đài phun n ớc 31
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
(Ammonia Fountain) và dung dịch n ớc sẽ đổi màu hồng do NH3 là một base yếu. 4. Giải thích:
Giải thích: Do khí HCl tan rất tốt trong n ớc nên khi khí bắt đầu tan thì
sẽ tạo ra sự chênh lệch áp suất (áp suất trong bình thấp) nên áp suất khí
quyển (bên ngoài) đã đẩy n ớc chảy ng ợc vào bình
3. So sánh giữa thí nghiệm Đài phun n ớc HCl và NH3. a. Hiện t ợng
Ở thí nghiệm đài phun n ớc HCl, ta thấy n ớc rút vào bình nhanh h n
so với thí nghiệm của NH3.
Tuy nhiên sau đó thì l ợng dung dịch mà thí nghiệm HCl thu đ ợc chỉ
bằng 1/3 tới 1/2 bình ống nghiệp trong khi ở thí nghiệm NH3 thì thu
đ ợc l ợng dung dịch lớn h n (gần đẩy bình) b. Giải thích 32
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Ở cả 2 thí nghiệm, ta đều thấy n ớc dâng lên do sự giảm áp suất bên
trong giảm khi bình nguội lại nên n ớc sẽ chảy từ ngoài (n i có áp suất
cao h n) vào bên trong bình
Ở bình HCl, do khí HCl nặng h n không khí nên sẽ chìm xuống bình và
hòa tan trong n ớc tr ớc làm cho áp suất giảm mạnh nên n ớc càng hút nhanh h n
Ở bình NH3, do khí NH3 nhẹ h n kk nên sẽ nằm ở phía trên của bình nên
chỉ một l ợng nhỏ NH3 hòa tan đ ợc trong n ớc nên n ớc lên chậm h n.
Ta thấy NH3 hút n ớc mạnh h n so với HCl do NH3 có độ tan mạnh h n
so với HCl trong n ớc ở nhiệt độ phòng.
Thí nghiệm 3: Sự dịch chuyển cân bằng trong dung dịch n ớc NH3 A. Các b ớc thực hiện
Lấy dung dịch ammonia trong bình tam giác vừa điều chế đ ợc ở thí
nghiệm 3 cho vào 5 ống nghiệm (khoảng ½ thể tích ống nghiệm). Ống 1. Để so sánh. Ống 2. Đem đun sôi.
Ống 3. Cho vào một ít tinh thể NH4Cl.
Ống 4. Cho thêm vài giọt dung dịch H2SO4 loãng (2M).
Ống 5. Cho vào vài giọt dung dịch Al2(SO4)3
Nhỏ vài giọt dung dịch phenolphtalein vào các bình trên và so sánh màu của các bình.
B. Hiện t ợng và giải thích 1. Hiện t ợng
Ống 1: dung dịch hóa hồng
Ống 2: đun nhẹ ống ta thấy màu hồng nhạt dần nh ng không mất hẳn
Ống 3: thêm một ít tinh thể NH4Cl và lắc cho tan ra, thấy màu hồng nhạt
dần. Cho đến d thì màu hồng không mất hẳn.
Ống 4: thêm từ từ H2SO4 loãng đến d ta thấy màu hồng nhạt dần rồi mất hẳn.
Ống 5: thêm từ từ dung dịch Al2(SO4)3 ta thấy màu hồng nhạt dần rồi
mất hẳn, xuất hiện kết tủa keo trắng (Al(OH)3)
2. Giải thích và ph ng trình phản ứng 33
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Ống 1: Dung dịch phenolphtalein hóa hồng do có OH− sinh ra do NH3 tan mạnh trong n ớc.
NH ( ) H O( ) ⇄ NH +( ) OH−( ) ( )
Ống 2: Khi đun nóng thì NH3 bay h i làm cân bằng phản ứng (1) chuyển
dịch theo h ớng giảm l ợng OH− do đó màu dung dịch nhạt dần
Ống 3: Khi cho tinh thể NH4Cl vào thì phản ứng (2) sẽ làm tăng nồng độ
của NH + làm cho phản ứng chuyển dịch theo h ớng giảm nồng độ
OH− vì vậy mà màu hồng nhạt dần nh ng không mất màu hẳn do bản
chất vẫn là phản ứng thuận nghịch
NH Cl( ) ⇄ NH +( ) Cl−( ) ( )
Ống 4: Khi cho H2SO4 loãng vào thì l ợng H+trong acid sẽ trung hòa
với l ợng OH− trong dung dịch nên dung dịch nhạt màu dần. Khi cho tới
d thì l ợng OH− hoàn toàn hết dẫn tới dung dịch mất màu hoàn toàn. H+( ) OH−( ) ⟶ H O( )
Ống 5: Khi cho Al2(SO4)3 vào trong dung dịch NH3 thì l ợng Al +tác
dụng với l ợng OH− tạo kết tủa Al(OH)3 keo trắng và là một base l ỡng
tính nên dung dịch mất màu hồng dần.
Al +( ) 3OH−( ) ⟶ Al(OH) ( )
Thí nghiệm 4: Tác dụng của khí Ammonia với CuO (Copper (II) oxide) A. Các b ớc thực hiện
Dùng ống nghiệm khô chịu nhiệt cho vào một ít bột CuO. Dẫn khí NH3
vừa điều chế đ ợc ở thí nghiệm 3 vào ống nghiệm chứa bột CuO, dùng
kẹp sắt đun nhẹ ống nghiệm (chỗ CuO), sau đó đun nhẹ bình cầu cho khí ammonia thoát ra.
B. Hiện t ợng và giải thích 1. Hiện t ợng:
Bột CuO màu đen dần chuyển sang màu đỏ gạch (Cu) và có khí N2 bốc h i lên 2. Ph ng trình phản ứng:
3CuO( ) 2NH ( ) ⟶ 3Cu( ) 3H O( ) N ( ) 34
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 5: Nhiệt phân các muối NH3. A. Các b ớc thực hiện
Lấy 6 ống nghiệm cho vào mỗi ống một ít tinh thể các muối sau đây:
NH4Cl, NH4NO3, NH4NO2, (NH4)2CO3, (NH4)2SO4, (NH4)2Cr2O7. Dùng
cặp sắt cặp ống nghiệm và đun nhẹ từng ống nghiệm trên ngọn lửa đèn cồn.
B. Hiện t ợng và giải thích 1. Hiện t ợng:
Ống 1: NH4Cl (Ammonium chloride)
- Ta thấy muối NH4Cl màu trắng tan dần và có khí không màu bốc lên.
- Ở đầu thành ống nghiệm ta thấy đ ợc có những hạt muối kết tinh lại.
Ống 2: NH4NO3 (Ammonium nitrate)
- Ta thấy muối NH4NO3 màu trắng tan dần và có khí bốc lên
- Ở cuối phản ứng ta thấy có nổ nhẹ và xuất hiện hỗn hợp khí màu nâu đỏ (NO -> NO2)
Ống 3: NH4NO2 (Ammonium nitrite)
- Ta thấy muối NH4NO2 tan dần và có khí bốc lên (N2) (đây là phản ứng oxi – hóa khử)
Ống 4: (NH4)2CO3 (Ammonium carbonate)
- Ta thấy muối (NH4)2CO3 màu trắng tan dần và có khí bốc lên
- Nếu thử dung dịch bằng giấy quỳ tím ta có thể thấy giấy chuyển
màu xanh do NH3 bốc h i lên
Ống 5: (NH4)2SO4 (Ammonium sulfate)
- Ta thấy muối (NH4)2SO4 màu trắng tan dần và có khí bốc lên
- Nếu thử dung dịch bằng giấy quỳ tím ta có thể thấy giấy chuyển
màu xanh do NH3 bốc h i lên
Ống 6: (NH4)2Cr2O7 (Ammonium dichromate) 35
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
- Ta thấy muối (NH4)2Cr2O7 màu đỏ tan dần và có khí bốc lên. Cuối
cùng sau phản ứng là kết tủa Cr2O3 (Chromium (III) oxide) màu
xanh lá xẫm. (đây là phản ứng oxi – hóa khử)
- Nếu đốt trực tiếp muối này ở ngoài bằng diêm thì phản ứng xảy ra
mãnh liệt và rất đẹp, trông nh một ngọn núi lửa (Ammonium dichromate volcano) 2. Ph ng trình hóa học: Ống 1: NH Cl( ) ⟶ HCl( ) NH ( )
Ống 2: 8NH NO ( ) ⟶ 5N ( ) 2NO ( ) 4NO( ) 16H O( ) Ống 3: NH NO ( ) ⟶ N ( ) 2H O( ) Ống 4:
(NH ) CO ( ) ⟶ CO ( ) 2NH ( ) H O( ) Ống 5:
(NH ) SO ( ) ⟶ H SO ( ) 2NH ( ) Ống 6:
(NH ) Cr O ( ) ⟶ Cr O ( ) N ( ) 4H O( ) 3. Giải thích:
Từ thí nghiệm trên ta thấy các muối ammonium đều kém bền nhiệt và sẽ
bị phân hủy khi bị đun nóng. Nguyên nhân là do cấu trúc ion không bền
Sản phẩm của phản ứng nhiệt phân phụ thuộc vào bản chất của muối
ammonium (gốc acid của chúng: có tính oxi hóa hoặc không)
Các muối nh NH4Cl và (NH4)2CO3 là muối của các acid không có tính
oxi hóa nên khi nhiệt phân luôn tạo ra NH3.
Ống 1 sau khi NH3 và HCl bay đến thành ống nghiệm gặp h i ẩm sẽ kết
tinh lại bám ở trên thành ống nghiệm HCl( ) NH ( ) ⟶ NH Cl( ) 36
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Các muối NH4NO3, NH4NO2, (NH4)2Cr2O7 là muối của các acid có tính
oxi hóa mạnh nên khi NH3 đ ợc tạo ra sẽ bị oxi hóa thành N2 hoặc N2O
tùy vào nhiệt độ phản ứng
Muối (NH4)2SO4 là hiện t ợng thăng hoa hóa học vì (NH4)2SO4 bị phân
hủy tạo thành chất mới, không thể kết hợp lại với nhau.
Thí nghiệm 6: Tác dụng của HNO3 với đồng A. Các b ớc thực hiện Lấy 2 ống nghiệm:
Ống 1. Đựng khoảng 1 ml dung dịch HNO3 đặc (65%), cho vào vài
mảnh phôi đồng hay lá đồng cắt nhỏ. Quan sát hiện t ợng.
Ống 2. Đựng khoản 1 ml dung dịch HNO3 30%, thêm vào vài mảnh phôi đồng.
Đậy chặt miệng ống nghiệm, sau vài phút mở nút ra. Quan sát hiện t ợng
B. Hiện t ợng và giải thích 1. Hiện t ợng: Ống 1: Cu + HNO3(đ) (65%)
- Đồng phản ứng mạnh với dung dịch HNO3(đ) tạo dung dịch màu
xanh lá (Cu(NO3)2), lá đồng tan dần và có khí màu nâu đỏ bốc lên (NO2). (khí độc) Ống 2: Cu + HNO3(l) (35%)
- Phản ứng xảy ra chậm, nếu đ a lên trên ngọn lửa đèn cồn thì phản
ứng xảy ra nhanh h n, tạo dung dịch màu xanh lam (Cu(NO3)2) và
sủi bọt khí không màu hóa nâu trong không khí trên đầu thành ống nghiệm(NO).
2. Giải thích và ph ng trình phản ứng: Ống 1: Cu + HNO3(đ) (65%)
Cu( ) 4HNO ( ,đ) ⟶ Cu(NO ) ( ) 2NO ( ) 2H O( ) 37
Downloaded by VietJack TV Official (vietjackvideos@gmail.com) Ống 2: Cu + HNO3(l) (35%)
3Cu( ) 8HNO ( , ) ⟶ 3Cu(NO ) ( ) 2NO( ) 4H O( )
Sản phẩm khí tạo thành chủ yếu do nồng độ của acid quyết định. Sản
phẩm chủ yếu lúc đầu của quá trình kim loại khử HNO3 là HNO2 (acid
nitrous). Acid này không bền và phân hủy thành NO, NO2 và H2O.
2HNO ( ) ⟶ NO ( ) NO( ) H O( )
H O( ) 3NO ( ) ⇄ 2HNO ( ) NO( )
Khi nồng độ acid tăng lên, cân bằng sẽ chuyển dịch về phía tạo thành
NO2. Khi nồng độ acid giảm (HNO3 loãng) cần bằng chuyển dịch về phía tạo thành NO.
Ở ống 1: Dung dịch có màu xanh lá do nồng độ HNO3 cao h n tạo NO2
màu nâu, và khí màu nâu khi hòa quyện với dung dịch màu xanh lam sẽ
tạo ra đ ợc dung dịch có màu xanh lá xẫm.
Thí nghiệm 7: Tác dụng của AgNO3 (Silver nitrate) nóng chảy lên giấy lọc. A. Các b ớc thực hiện
Lấy một tờ giấy lọc đặt lên miệng chiếc bát sứ. Cho khoảng 1 gam
AgNO3 vào một ống nghiệm khô nhỏ, chịu nhiệt. Dùng cặp đun ống
nghiệm trên ngọn lửa đèn cồn cho đến khi AgNO3 nóng chảy chuyển
thành chất lỏng màu xanh nhạt ở 421K.
Rót từ từ chất lỏng lên tờ giấy lọc, giấy lọc sẽ bốc cháy. Khối nóng chảy
sẽ r i xuống đáy bát, đọng lại ở dạng chất rắn màu xám.
B. Hiện t ợng và giải thích 1. Hiện t ợng
AgNO3 tan dần, xuất hiện kết tủa trắng (xanh) bạc và có khí màu nâu đỏ
bốc lên. Đồng thời khi tiếp xúc với giấy lọc thì giấy lọc bốc cháy.
2. Giải thích và ph ng trình phản ứng
2AgNO ( ) ⟶ 2Ag( ) 2NO ( ) O ( )
Giấy lọc bị bốc cháy do có khí O2 và nhiệt độ hệ xung quanh cao dẫn
đến cellulose trong giấy bị đốt cháy. 38
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 8: Quan sát sự biến đổi giữa Phosphorus đỏ và
Phosphorus trắng. Tác dụng của Ptrắng với O2. A. Các b ớc thực hiện
Cho vào ống nghiệm khô một ít photpho đỏ (cho photpho xuống tận đáy
ống nghiệm, không để dính vào bình). Dùng bông gòn đậy kín miệng
ống nghiệm và kẹp một mảnh giấy lọc dài xuống ½ ống nghiệm).
Dùng kẹp sắt kẹp ống nghiệm và đun nhẹ trên ngọn lửa đèn cồn cho
photpho đỏ thăng hoa chậm. Đ a ống nghiệm vào chỗ tối để quan sát sự
phát quang của photpho trắng trên thành ống nghiệm. Rút từ từ mảnh
giấy lọc, không cho miếng bông r i ra.
B. Hiện t ợng và giải thích 1. Hiện t ợng:
Pđỏ dần thăng hoa lên thể khí màu đỏ. Từ từ chuyển dần sang màu vàng
nhạt – trắng bám trên thành ống nghiệm: P4 (tetraphosphorus) (Ptrắng)
Ptrắng có thể phát quang khi tiếp xúc với không khí bên ngoài dựa trên
một hiện t ợng gọi là Chemiluminescence – Phát quang hóa học
Phản ứng của Ptrắng và O2 xảy ra rất mạnh và có thể gây nổ 2. Ph ng trình phản ứng: P ( ) 5O ( ) ⟶ P O ( ) 39
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 9: Nhận biết ion PO 3- 4 (Phosphate ion) A. Các b ớc thực hiện a) Lấy 2 ống nghiệm:
Ống 1. Đựng khoảng 1 ml dung dịch H3PO4 loãng.
Ống 2. Đựng khoảng 1 ml dung dịch Na3PO4 loãng.
Cho vào mỗi ống vài giọt dung dịch AgNO3 và quan sát.
b) Cho vào 2 ống nghiệm mỗi ống 3 – 5 giọt dung dịch (NH4)2MoO4
bão hòa, thêm vào vài giọt dung dịch HNO3 đặc
Ống 1. Thêm 5 giọt dung dịch H3PO4 loãng.
Ống 2. Thêm 5 giọt dung dịch Na3PO4 loãng.
Ngâm cả hai ống nghiệm trong cốc n ớc ấm (khoảng 50°C) và quan sát.
B. Hiện t ợng và giải thích 1. Hiện t ợng:
a) Nhỏ dung dịch AgNO3 vào từng ống nghiệm
Ống 1 – chứa H3PO4(l) (Phosphoric acid): không có hiện t ợng gì xảy ra.
Ống 2 – chứa Na3PO4(l) (Sodium phosphates): Dung dịch từ không màu
xuất hiện kết tủa màu vàng
b) Nhỏ dung dịch (NH4)2MoO4 (Ammonium orthomolybdate) vào từng ống nghiệm.
Ống 1 – chứa H3PO4(l) (Phosphoric acid): xuất hiện kết tủa màu vàng:
(NH4)3H4[P(Mo2O7)6] (Ammonium phosphomolybdate)
Ống 2 – chứa Na3PO4(l) (Sodium phosphates): xuất hiện kết tủa màu
vàng: (NH4)3H4[P(Mo2O7)6] (Ammonium phosphomolybdate) 2. Ph ng trình phản ứng: a) Ống 1: AgNO ( ) H PO ( , ) ↛
Ống 2: 3AgNO ( ) Na PO ( , ) ⟶ Ag PO ( ) 3NaNO ( ) b) Ống 1: 40
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
H PO ( , ) 12(NH ) MoO ( ) 21HNO ( ,đ)
⟶ (NH ) H [P(Mo O ) ]( ) 21NH NO ( ) 10H O( ) Ống 2:
Na PO ( , ) 12(NH ) MoO ( ) 24HNO ( ,đ)
⟶ (NH ) H [P(Mo O ) ]( ) 21NH NO ( ) 12H O( ) 3NaNO ( ) 3. Giải thích:
Ống 1: ta không thấy hiện t ợng gì xảy ra do Ag3PO4 sinh ra lại tan
trong dung dịch acid HNO3 tạo thành nên coi nh phản ứng không xảy ra.
AgNO ( ) H PO ( , ) ⇄ Ag PO ( ) 3HNO ( )
Ống 2: Ta thấy kết tủa vàng Ag3PO4 tạo thành.
3Ag+( ) PO −( ) ⟶ Ag PO ( )
Ống 3: ta thấy kết tủa vàng (NH4)3H4[P(Mo2O7)6] tạo thành
3NH +( ) 12MoO −( ) 24H+( ) PO −( )
⟶ (NH ) H [P(Mo O ) ]( ) 12H O( )
Để nhận biết ion PO − ta có thể sử dụng dung dịch AgNO3 hoặc
dung dịch Ammonium orthomolybdate (tạo kết tủa). 41
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 10: Khả năng hấp thụ màu của than hoạt tính (Active charcoal) A. Các b ớc thực hiện
Cho vào ống nghiệm nhỏ một ít than hoạt tính, rồi thêm vào 2 ml dung
dịch mực xanh hoặc tím. Dùng ngón tay cái bịt miệng ống nghiệm và lắc
mạnh trong 1 phút. Sau đó để nguyên ống nghiệm trong từ 1 – 2 phút.
Quan sát sự thay đổi màu của dung dịch mực
B. Hiện t ợng và giải thích 1. Hiện t ợng:
Sau khi để nguyên ống nghiệp ta thấy đ ợc màu mực từ màu xanh đã
chuyển thành màu trắng. Nếu sử dụng giấy lọc để thu n ớc ta sẽ đ ợc
một l ợng n ớc trong suốt và chỉ còn lớp carbon ở d ới đáy ống nghiệm. 2. Giải thích
Than hoạt tính chính là carbon xét về mặt hóa học thì than hoạt tính chủ
yếu là carbon vô định hình dạng bột và một phần là dạng tinh thể vụn Graphite.
Than hoạt tính là một dạng carbon và đ ợc tạo ra bằng cách xử lý hoạt
hóa d ới nhiệt độ rất cao trong điều kiện yếm khí để tạo cấu trúc lỗ xốp và rỗng.
Nhắc đến than hoạt tính ta th ờng ngh ngay đến khả năng hấp phụ cực
tốt của nó, khả năng đó có đ ợc là do trên bề mặt than hoạt tính có rất
nhiều lỗ xốp và rỗng nên diện tích bề mặt cực lớn.
Do đó than hoạt tính có tác dụng khử màu, khử mùi, các chất hữu c và
kể các các ô nhiễm vi l ợng và các kim loại nặng.
Thời gian tiếp xúc của n ớc với than hoạt tính càng lâu, việc hấp thụ
càng tốt, sẽ khử hết màu trong thuốc nhuộm đồng thời tẩy hết các chất bẩn vi l ợng. 42
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 11: Tác dụng của Carbon với HNO3 đặc và H2SO4 đặc. A. Các b ớc thực hiện
Trong hai ống nghiệm, mỗi ống đựng khoảng 3 ml dung dịch HNO3
65% và dung dịch H2SO4 98%. Thêm vào mỗi ống một mẫu than gỗ.
Đun nóng cả 2 ống nghiệm trên ngọn lửa đèn cồn.
B. Hiện t ợng và giải thích 1. Hiện t ợng
Ống 1: chứa C và HNO3 đặc.
Mẫu than gỗ tan dần, có khí màu nâu đỏ thoát ra (NO2) và một khí
không màu thoát ra (CO2) nếu sục khí không màu này qua Ba(OH)2 thì
dung dịch sẽ bị vẩn đục kết tủa trắng (BaCO3).
Ống 2: chứa C và H2SO4 đặc.
Mẫu than gỗ tan dần, có khí không màu thoát ra (SO2 và CO2), nếu sục
khí không màu này qua Ba(OH)2 thì dung dịch sẽ bị vẩn đục kết tủa trắng (BaCO3). 2. Ph ng trình phản ứng Ống 1:
C( ) 4HNO ( ,đ) ⟶ CO ( ) 4NO ( ) 2H O( ) Ống 2:
C( ) 2H SO ( ,đ) ⟶ CO ( ) 2SO ( ) 2H O( ) 43
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 12: Điều chế khí Carbon dioxide (CO2) và các tính chất. A. Các b ớc thực hiện a) Điều chế khí CO2.
Đập nhỏ một vài viên đá vôi rồi cho vào bình cầu lớn, từ từ đổ dung dịch
HClđ vào trong bình cầu. Nhanh chóng đẩy nắp bình cầu với 1 ống dẫn
khí vào trong các bình chứa khí để thu khí CO2 cho các thí nghiệm sau.
b) Tính không duy trì sự cháy của CO2
Dùng que gỗ đang cháy cho vào bình chứa CO2.
c) Tác dụng của CO2 với Mg.
Dùng cặp sắt cặp chặt một lá Mg, đốt cháy Mg cho đến khi bắt đầu phát
sáng rồi thả nhanh vào lọ đựng khí CO2.
d) Tác dụng của CO2 với n ớc vôi trong (Ca(OH)2)
Cho luống khí CO2 đ ợc điều chế từ bình kíp đi qua ống nghiệm đựng
n ớc vôi trong 2 – 3 phút, quan sát.
Tiếp tục sục khí CO2 vào ống nghiệm, quan sát.
e) Thử tính acid của Carbon dioxide
Đun sôi một thể tích n ớc trong cốc dung tích 50 ml, để nguội rồi chia
vào 2 ống nghiệm. Cho vào mỗi ống nghiệm một mẫu giấy quỳ tím. Ống 1. Để so sánh.
Ống 2. Sục dòng khí CO2 từ bình Kíp vào.
So sánh sự đổi màu của quỳ tím
B. Hiện t ợng và giải thích a) Điều chế khí CO2.
Phản ứng xảy ra mạnh, các viên đá nhỏ tan dần tạo dung dịch trong suốt,
có khí không màu thoát ra. Ph ng trình phản ứng:
CaCO ( ) 2HCl( ,đ) ⟶ CO ( ) CaCl ( ) H O( )
b) Tính không duy trì sự cháy của CO2
Khi cho que gỗ đang cháy vào trong bình chứa CO2 thì ngọn lửa từ que
củi ngay lập tức bị dập tắt => CO2 không duy trì sự cháy. 44
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
c) Tác dụng của CO2 với Mg
Mg cháy sáng trong bình khí CO2, nếu để lâu thì ta có thể thấy đ ợc 2
loại bột màu trắng (MgO) và bột màu đen (C) trong bình.
Các đám cháy Mg không dập đc bằng CO2 Ph ng trình phản ứng:
2Mg( ) CO ( ) ⟶ 2MgO( ) C( )
d) Tác dụng của CO2 với n ớc vôi trong.
Khi cho CO2 tác dụng với dung dịch n ớc vôi trong kết tủa trắng tạo ra làm vẩn đục dung dịch
Ca(OH) ( ) CO ( ) ⟶ CaCO ( ) H O( )
Sau đó, kết tủa tăng đến tối đa, nếu thêm tiếp CO2 tới d vào thì kết tủa
lại dần bị hòa tan và trở lại dung dịch trong suốt.
CaCO ( ) CO ( ) H O( ) ⟶ Ca(HCO ) ( )
e) Thử tính acid của Carbon dioxide
Ống 1: Quỳ tím không đổi màu
Ống 2: Quỳ tím đổi sang màu đỏ do CO2 tác dụng với H2O tạo ra acid
yếu H2CO3 làm quỳ tím hóa đỏ. CO ( ) H O( ) ⟷ H CO ( ) 45
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
BÀI 4. OXYGEN, SULFUR VÀ HỢP CHẤT
Thí nghiệm 1: Điều chế và nhận biết khí O2 A. Các b ớc thực hiện:
Lấy 3 ống nghiệm khô, cho vào mỗi ống một ít tinh thể các chất oxi hóa
sau: ống 1 – KClO3 có trộn một ít tinh thể MnO2; ống 2 – KMnO4, ống 3 – KNO3.
Dùng cặp gỗ (hoặc cặp sắt) giữ chặt và nung nóng đáy ống nghiệm
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
Ống 1 – chứa hỗn hợp KClO3 và MnO2: có khí O2 bốc lên.
Ống 2 – chứa KMnO4 bột KMnO4 màu tím tan dần chuyển thành dung
dịch màu xanh lục – lam thẫm (K2MnO4): có khí O2 bốc lên
Ống 3 – chứa KNO3: KNO3 nóng chảy tạo ra dd không màu KNO2 và có khí O2 bốc lên.
Nhận biết khí O2 bằng cách đ a một que diêm (hoặc gỗ) cháy đầu đỏ
vào đầu bình, nếu que diêm bùng cháy thì khí O2 đã đầy bình 2. Ph ng trình phản ứng: Ống 1: Ống 2:
2KMnO ( ) ⟶ K MnO ( ) O ( ) MnO ( ) Ống 3: 2KNO ( ) ⟶ 2KNO ( ) O ( )
3. Vai trò của MnO2 trong thí nghiệm trên.
Khi nhiệt phân trực tiếp tinh thể KClO3 thì phản ứng xảy ra rất chậm và
cần nhiệt độ rất cao (400 – 500oC).
Khi cho 1 ít tinh thể MnO2 làm xúc tác thì có thể làm tăng tốc độ phản
ứng c ng nh giảm nhiệt độ ng ỡng phân hủy của KClO3. 46
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 2: O2 phản ứng với than, Sulfur, Phosphorus và Sắt. A. Các b ớc thực hiện:
Thu đầy khí oxi vào 4 lọ đựng khí (thử bằng que đóm có tàn đỏ) bằng
cách nhiệt phân hỗn hợp đã trộn sẵn (KClO3 + MnO2), đậy lọ thu khí bằng miếng thủy tinh.
Dùng môi đốt lần l ợt lấy một ít bột than, l u huỳnh, photpho đỏ rồi đốt
cháy trên ngọn lửa đèn cồn và đ a nhanh vào lọ chứa khí O2, đậy nắp lọ.
Dùng một đoạn dây thép nhỏ nung đỏ trên ngọn lửa đèn cồn rồi đ a
nhanh vào lọ đựng khí O2.
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
Ống 1 – chứa than: Than cháy nhẹ với ngọn lửa màu đỏ cam trong bình
O2 , có khí không màu thoát ra (CO2)
Ống 2 – chứa Sulfur: L u huỳnh cháy mạnh trong O2 cho ngọn lửa màu
xanh – tím, có khí không màu – đục thoát ra (SO2)
Ống 3 – chứa Phosphorus: Pđỏ cháy mạnh trong O2 cho ngọn lửa màu
vàng cam, có khói trắng tạo thành (P4O10 – P2O5) 2. Ph ng trình phản ứng: Ống 1: C( ) O ( ) ⟶ CO ( ) Ống 2: S( ) O ( ) ⟶ CO ( ) Ống 3: P ( ) O ( ) ⟶ P O ( )
Thí nghiệm 3: Điều chế và tính chất của Ozone (O3) A. Các b ớc thực hiện:
a) Lấy một ống nghiệm lớn cho vào khoảng 3 – 5 gam tinh thể
(NH4)2S2O8, dùng phễu rót vào khoảng 10 ml dung dịch HNO3
65%, nút ống nghiệm bằng hệ thống dẫn khí, đồng thời đun nóng nhẹ đáy ống nghiệm.
Khi có khí thoát ra thì lấy que đóm còn tàn đỏ đặt vào đầu ống dẫn
khí, que đóm sẽ bùng cháy. 47
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
b) Lấy một ống nghiệm nhỏ đựng khoảng 1 ml dung dịch KI rồi
nhúng ống dẫn khí vừa điều chế ở trên vào. Dung dịch từ không
màu chuyển sang màu xanh đen.
c) Lấy miếng giấy lọc tẩm dung dịch KI rồi nhỏ vào hai chỗ khác
nhau một chỗ 1 giọt dung dịch hồ tinh bột, chỗ kia là 1 giọt dung dịch phenolphtalein.
d) Lấy một ống nghiệm khác, cho vào khoảng 1 ml dung dịch MnSO4
rồi sục dòng khí ozone lội qua. Trong tr ờng hợp này, Mn +bị oxi hóa thành Mn + (MnO2).
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
a) Tinh thể (NH4)2S2O8 tan dần, ta thấy sủi bọt khí không màu thoát
ra, khi cho ngọn đóm vào thí ngọn đóm bùng cháy
b) Dung dịch hóa nâu và Dung làm xanh đen hồ tinh bột do có khí I2 sinh ra.
c) Chỗ đầu tiên hóa xanh đen do có I2 sinh ra. Chỗ thứ hai hóa hồng do có base KOH sinh ra.
d) Dung dịch chuyển màu vàng nâu, xuất hiện kết tủa đen MnO2 nếu nồng độ MnSO4 lớn.
2. Giải thích và Ph ng trình phản ứng:
a) (NH ) S O ( ) 2HNO ( ,đ) ⟶ H S O ( ) 2NH NO ( )
H S O ( ) H O( ) ⟶ [O]−( ) 2H SO ( ) [O]−( ) O ( ) ⟶ O ( )
b) Dung dịch hồ tinh bột chuyển màu xanh do hấp thụ khí I2 sinh ra.
(Màu nâu đất có do KI tạo phức với I2)
O ( ) 2KI( ) H O( ) ⟶ I ( ) 2KOH( ) O ( ) KI( ) I ( ) ⇆ KI ( , â ) 48
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
c) Chỗ đầu tiên hóa xanh đen do có I2 sinh ra. Chỗ thứ hai hóa hồng do có base KOH sinh ra.
O ( ) 2KI( ) H O( ) ⟶ I ( ) 2KOH( ) O ( )
d) Dung dịch chuyển màu vàng nâu, xuất hiện kết tủa đen MnO2 nếu nồng độ MnSO4 lớn.
MnSO ( ) O ( ) H O( ) ⟶ MnO ( ) H SO ( ) O ( )
Thí nghiệm 4: Tính chất của H2O2. A. Các b ớc thực hiện:
a) Tính bền của dung dịch H2O2:
Cho vào ống nghiệm 2 ml dung dịch H2O2 vừa điều chế đ ợc ở trên (đã
trung hòa acid d ), thêm vào một ít bột MnO2.
b) Tác dụng của dung dich H2O2 với dung dịch KMnO4:
Cho vào ống nghiệm khoảng 1 ml dung dịch KMnO4, vài giọt dung dịch
H2SO4 loãng. Nhỏ từ từ từng giọt dung dịch H2O2 vừa điều chế ở trên.
Theo dõi sự thay đổi màu sắc của dung dịch.
c) Tác dụng của dung dịch H2O2 với PbS:
Lấy 5 giọt dung dịch Pb(NO3)2 cho tác dụng với 5 giọt dung dịch
(NH4)2S hoặc Na2S trong một ống nghiệm. Đun sôi nhẹ, để kết tủa lắng
xuống rồi gạn lấy kết tủa.
Nhỏ từ từ dung dịch H2O2 vào kết tủa PbS, nếu phản ứng chậm thì có thể đun nhẹ.
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
a) Tính bền của dung dịch H2O2:
Dung dịch sủi bọt khí mạnh. Đ a đóm than vào gần ta thấy đóm than
sáng h n (có thể tắt do có h i n ớc sinh ra). Chứng tỏ đó là khí O2.
b) Tác dụng của dung dịch H2O2 với KMnO4:
Dung dịch màu tím dần mất màu và chuyển sang không màu, đồng thời
xuất hiện sủi bọt khí. T ng tự ta c ng có thể nhận thấy đó là khí O2 bằng cách thử. 49
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
c) Tác dụng của dung dịch H2O2 với PbS:
Khi cho Pb(NO3)2 vào dd Na2S ta thấy xuất hiện kết tủa đen.
Lọc lấy kết tủa và cho dung dịch H2O2 vào ta thấy kết tủa tan, tạo kết tủa mới có màu trắng.
2. Giải thích và Ph ng trình phản ứng:
a) Tính bền của dung dịch H2O2:
H2O2 rất dễ bị phân hủy bởi nhiệt, MnO2, KI, ion của các kim loại nặng,…
b) Tác dụng của dung dịch H2O2 với KMnO4 2KMnO ( ) 3H SO ( ) 5H O ( )
⟶ 2MnSO ( ) 8H O( ) K SO ( ) 5O ( )
Ta cần một môi tr ờng acid mạnh (dùng H2SO4 loãng), ở phản ứng này,
KMnO4 và H2O2 đóng vai trò phản ứng chính, ngoài ra H+ c ng tham
gia phản ứng để tạo thành n ớc, hoàn thành quá trình trao đổi điện tích
(phản ứng oxi hóa – khử). Ngoài ra thì ta không thể sử dụng HCl thay
cho H2SO4 vì Mn + là một chất oxi hóa rất mạnh mà sẽ oxi hóa Cl− thành Cl2.
c) Tác dụng của dung dịch H2O2 với PbS:
PbS( ,đ ) 4H O ( ) ⟶ PbSO ( , ắ ) 4H O( )
Trong dung dịch có thể có bọt khí thoát ra do H2O2 bị phân hủy với xúc tác Pb +
H2O2 thể hiện tính oxi hóa khi tác dụng với PbS: S − ⟶ S +
H2O2 thể hiện tính khử khi tác dụng với dung dịch KMnO4: Mn + ⟶ Mn +
H2O2 vừa có tính oxi hóa vừa có tính khử. 50
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 5: Điều chế l u huỳnh kim và l u huỳnh dẻo (Amorphous Sulfur) – S8 A. Các b ớc thực hiện:
a) Điều chế l u huỳnh hình kim:
Cho bột l u huỳnh vào ½ ống nghiệm rồi nung chảy trên ngọn đèn cồn,
khi l u huỳnh đã nóng chảy hết sẽ có màu vàng linh động, nhiệt độ đạt khoảng 112°C.
Xếp tờ giấy lọc thành chiếc phểu (hình nón) và rót l u huỳnh nóng chảy
vào. Khi mặt chất lỏng bắt đầu đóng váng, dùng đ a thủy tinh chọc ngay
giữa mặt váng một lỗ nhỏ, xong rút đ a thủy tinh ra và xòe ngay tờ giấy
lọc. Quan sát các tinh thể hình kim của l u huỳnh tạo thành.
b) Điều chế l u huỳnh dẻo:
Cho bột l u huỳnh vào ½ ống nghiệm rồi nung nóng chảy trên ngọn đèn
cồn cho đến khi chất lỏng ngã sang màu nâu xẫm (nhiệt độ đạt khoảng
200°C), rót nhanh chất lỏng này ra chậu n ớc đã chuẩn bị sẵn.
Vớt l u huỳnh ra, dùng tay kiểm tra tính dẻo của l u huỳnh khi vừa mới
cho vào chậu n ớc và cuối buổi thực hành (khoảng 1,5 – 2 giờ).
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
a) Điều chế l u huỳnh hình kim.
Bột l u huỳnh màu vàng tan chảy dần thành dạng lỏng có màu vàng ánh cam.
Sau khi đổ lên phễu đợi 20 – 30s thì ta thấy đ ợc những tinh thể l u
huỳnh có dạng các chiếc kim h ớng lên.
b) Điều chế l u huỳnh dẻo
Bột l u huỳnh màu vàng tan chảy hoàn toàn thành dạng lỏng có màu
nâu sẫm – đỏ. Nếu tăng nhiệt độ ta có thể thấy đ ợc l u huỳnh thăng
hoa cháy trong không khí với ngọn lửa màu xanh. Lúc này l u huỳnh sẽ đặc sếnh lại nh kẹo.
Khi đổ l u huỳnh lỏng vào chậu n ớc ta có thể cầm và kéo sợi l u
huỳnh bởi tính dẻo của nó. 51
Downloaded by VietJack TV Official (vietjackvideos@gmail.com) 2. Giải thích:
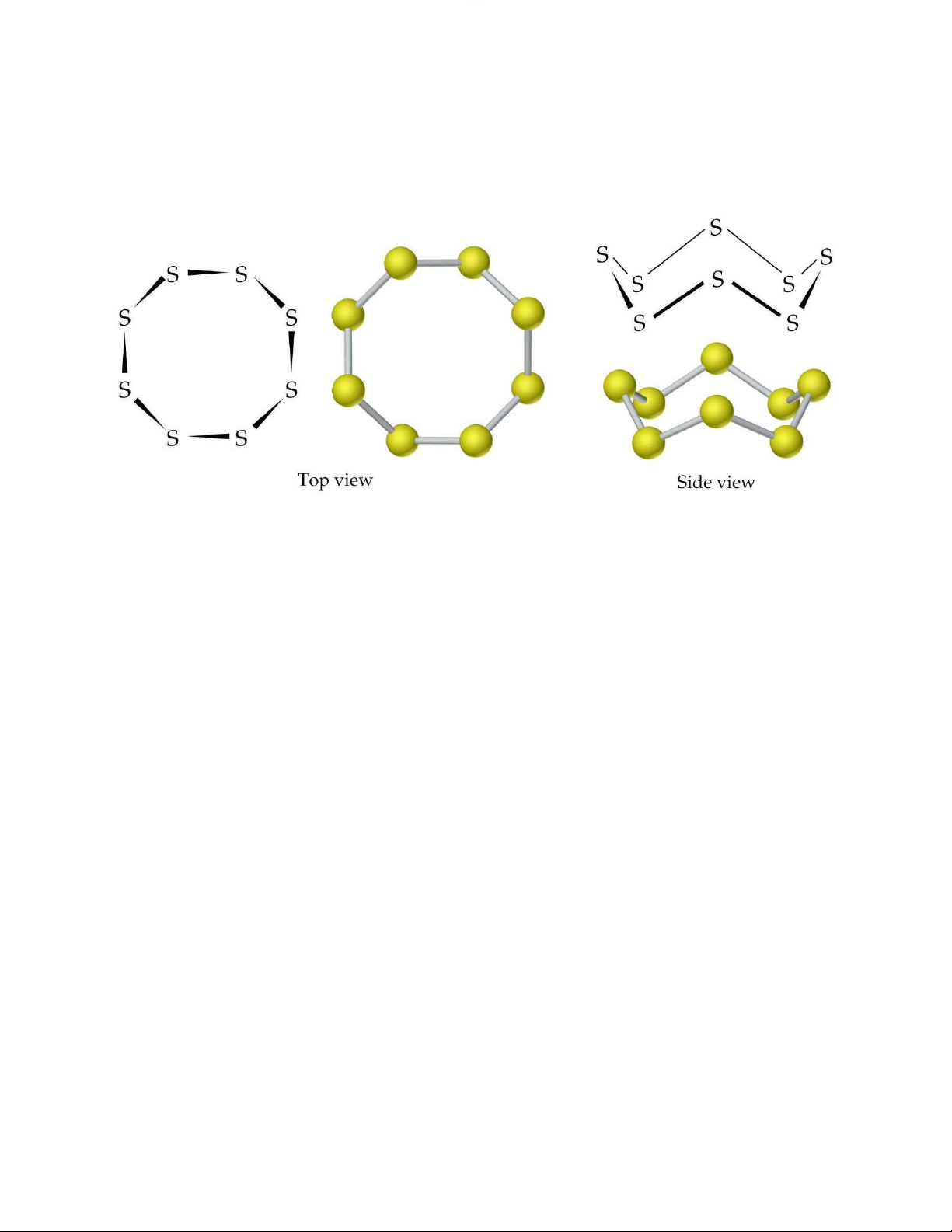
Ở nhiệt độ phòng, l u huỳnh là chất rắn màu vàng. Cấu trúc mỗi phân tử
l u huỳnh gồm 8 nguyên tử khép thành một vòng kín (S8).
a) Điều chế l u huỳnh hình kim
Khi đun nóng đến nhiệt độ 112,8°C, bột l u huỳnh trong cốc bắt đầu
chảy ra. Ở nhiệt độ này, các phân tử l u huỳnh linh động ở xa nhau h n
so với thể rắn và chuyển động t ng đối tự do.
Khi đổ l u huỳnh lên phễu thì l u huỳnh sẽ chuyển ng ợc lại dạng kết tinh.
Ta sử dụng đ a thủy tinh để tạo mầm tinh thể nhanh và đẹp h n do khi
chọc đ a thủy tinh vào sẽ tạo một ngoại lực đóng vai trò xúc tác làm
tăng tốc độ lên mầm tinh thể.
b) Điều chế l u huỳnh dẻo
Khi đun nóng đến 180°C, l u huỳnh sẽ có màu nâu sẫm, đặc quánh gọi
là l u huỳnh dẻo. Lúc này, các liên kết trong phân tử l u huỳnh bị phá
vỡ tạo nên phân tử l u huỳnh có cấu tạo mạch dài dạng các chuỗi polymer.
Tăng tiếp nhiệt độ lên 200°C, l u huỳnh trở về dạng lỏng. Do liên kết
S S bị bẻ gẫy tạo thành các chuỗi liên kết S S ngắn h n và rất linh động.
(Khi tăng nhiệt độ lên 445°C, l u huỳnh thăng hoa, h i l u huỳnh bốc
cháy trong không khí cho ngọn lửa màu xanh.) 52
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Khi rót l u huỳnh lỏng vào cốc n ớc, l u huỳnh bị làm lạnh đột ngột
nên đông đặc lại thành thể rắn, lúc này l u huỳnh có độ nhớt lớn. L u
huỳnh ở dạng này rất dẻo, dễ kéo dài thành sợi mảnh và có thể kết tinh
lại thành tinh thể trong từ vài giờ tới vài ngày.
Thí nghiệm 6: Phản ứng của L u huỳnh với HNO3 đặc và H2SO4 đặc. A. Các b ớc thực hiện:
a) Tác dụng của l u huỳnh với HNO3 đặc:
Cho một ít bột l u huỳnh vào ống nghiệm đã chứa sẵn 2 ml dung dịch
HNO3 đặc. Đun sôi dung dịch khoảng 2 – 3 phút. Quan sát hiện t ợng
tr ớc và sau khi đun sôi.
Để nguội ống nghiệm rồi cho vào một giọt dung dịch BaCl2.
b) Tác dụng của l u huỳnh với H2SO4 đặc:
Cho một ít bột l u huỳnh vào ống nghiệm đã chứa sẵn 2 ml dung dịch
H2SO4 98%. Đun nóng ống nghiệm
B. Hiện t ợng và giải thích: 3. Hiện t ợng:
a) Tác dụng của l u huỳnh với HNO3 đặc: • Tr ớc khi đun sôi:
Bột l u huỳnh tan chậm trong dung dịch acid, xuất hiện sủi bọt khí
không màu (SO2) và khí màu nâu (NO2). • Sau khi đun sôi:
Bột l u huỳnh tan mạnh trong dung dịch acid, xuất hiện sủi bọt khí
không màu và màu nâu nhiều h n, dung dịch c ng dần đổi thành màu
vàng do bị nhiễm màu nâu của NO2.
Khi cho dung dịch BaCl2 (Barium Chloride) vào dung dịch sau đó thì ta
thấy có kết tủa trắng (BaSO4).
b) Tác dụng của l u huỳnh với H2SO4 đặc:
L u huỳnh tan dần, tạo dung dịch trong suốt, có sủi bọt khí không màu (SO2). 53
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Để thử khí SO2 ta có thể cho lội qua n ớc Br2 (mất màu nâu) hoặc KMnO4 (mất màu tím)
Hoặc thử bằng cánh hoa hồng, khí SO2 khi tác dụng với red rose
pigment trong hoa hồng sẽ bị oxi hóa thành reduce pigment màu trắng
4. Giải thích và ph ng trình phản ứng:
a) Tác dụng của l u huỳnh với HNO3 đặc: Tr ớc khi đun sôi:
S( ) 4HNO ( ,đ) ⟶ SO ( ) 4NO ( ) 2H O( ) Sau khi đun sôi:
S( ) 6HNO ( ,đ, °) ⟶ H SO ( ) 6NO ( ) 2H O( )
Khi cho BaCl2 vào dung dịch trên:
BaCl ( ) H SO ( ) ⟶ BaSO ( ) 2HCl( )
Nếu S d thì dung dịch sẽ không kết tủa do S phản ứng với SO − tạo ra khí SO2.
S( ) 2H SO ( ,đ) ⟶ 3SO ( ) 2H O( )
b) Tác dụng của l u huỳnh với H2SO4 đặc:
S( ) 2H SO ( ,đ) ⟶ 3SO ( ) 2H O( )
Thử khí SO2 bằng dd Br2: => mất màu nâu của n ớc Bromide
SO ( ) Br ( ) 2H O( ) ⟶ H SO ( ) 2HBr( )
Thử khí SO2 bằng dd KMnO4 => mất màu hồng của dd KMnO4: 5SO ( ) 2KMnO ( ) 2H O( )
⟶ 2H SO ( ) 2MnSO ( ) K SO ( ) 54
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 7: Điều chế khí H2S và đốt cháy. A. Các b ớc thực hiện:
Lấy một ống nghiệm cho vào một ít FeS vừa điều chế ở trên, sau đó cho
vào khoảng 2 ml dung dịch H2SO4 loãng (2M). Đậy ống nghiệm bằng
nút có gắn ống thủy tinh vuốt nhọn. Đun nhẹ trên ngọn lửa đèn cồn.
Ngửi mùi khí thoát ra bằng cách lấy tay phẩy nhẹ khí đến m i (không ngửi trực tiếp).
Dùng giấy quỳ tím ẩm đặt trên đầu ống thủy tinh vuốt nhọn để thử tính acid của dung dịch H2S.
Dùng que đóm đốt trên đầu ống thủy tinh vuốt nhọn. Quan sát màu ngọn
lửa. B. Hiện t ợng và giải thích: 1. Hiện t ợng:
FeS màu đen tan dần, dung dịch chuyển màu xanh (FeSO4) và có khí
không màu mùi trứng thôi thoát lên.
Khi đốt que cháy ta thấy đ ợc ngọn lửa màu xanh. 2. Ph ng trình phản ứng:
FeS( ) H SO ( , ) ⟶ FeSO ( ) H S( ) 3. Câu hỏi:
a) Có thể thay dung dịch H2SO4 loãng bằng dung dịch HCl loãng đ ợc không?
Có thể thay thế H2SO4 loãng bằng dung dịch HCl loãng.
FeS( ) 2HCl( , ) ⟶ FeCl ( ) H S( )
b) Có thể thay dung dịch H2SO4 loãng bằng dung dịch H2SO4 đặc đ ợc không?
Không thể thay thế đ ợc do H2SO4 đặc có tính oxi hóa mạnh h n so với
dung dịch loãng nên phản ứng sẽ trở thành phản ứng oxi hóa khử.
2FeS( ) 10H SO ( ,đ) ⟶ Fe (SO ) ( ) 9SO ( ) 10H O( ) 55
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 8: Điều chế và quan sát muối sulfide ít tan – thuốc thử ion − A. Các b ớc thực hiện:
Lấy 6 ống nghiệm khô, cho vào mỗi ống 1 ml các dung dịch sau đây:
Ống 1. Dung dịch MnSO4 (Manganese (II) Sulfate).
Ống 2. Dung dịch ZnSO4 (Zinc Sulfate).
Ống 3. Dung dịch PbNO3 (Lead (II) Nitrate).
Ống 4. Dung dịch CuSO4 (Copper (II) Sulfate).
Ống 5. Dung dịch Cd(NO3)2 (Cadmium Nitrate).
Ống 6. Dung dịch CaCl2 (Calcium Chloride).
Thêm vào mỗi ống lần l ợt 2 – 3 giọt dung dịch H2S hoặc (NH4)2S.
Để kết tủa lắng xuống, gạn lấy kết tủa rồi rửa 2 lần bằng n ớc cất. Sau
đó cho vào vài giọt dung dịch HCl loãng hoặc H2SO4 loãng.
B. Hiện t ợng và giải thích:
3. Hiện t ợng và ph ng trình phản ứng:
a) Hòa tan (NH4)2S (Ammonium Sulfide) vào các ống nghiệm.
Ống 1: MnSO4 (Manganese (II) Sulfate): Dung dịch không đổi màu
MnSO ( ) H S( ) ⟶ MnS( ) H SO ( )
Ống 2: ZnSO4 (Zinc Sulfate): xuất hiện kết tủa trắng ZnS
ZnSO ( ) H S( ) ⟶ ZnS( , ắ ) H SO ( )
Zn +( ) S −( ) ⟶ ZnS( , ắ )
Ống 3: Pb(NO3)2 (Lead (II) Nitrate): Xuất hiện kết tủa đen PbS
Pb(NO ) ( ) H S( ) ⟶ PbS( ,đ ) 2HNO ( )
Pb +( ) S −( ) ⟶ PbS( ,đ )
Ống 4: CuSO4 (Copper (II) Sulfate): Xuất hiện kết tủa đen CuS
CuSO ( ) H S( ) ⟶ CuS( ,đ ) H SO ( )
Mn +( ) S −( ) ⟶ CuS( ,đ )
Ống 5: Cd(NO3)2 (Cadmium Nitrate): Xuất hiện kết tủa vàng CdS
Cd(NO ) ( ) H S( ) ⟶ CdS( , à ) 2HNO ( )
Cd +( ) S −( ) ⟶ CdS( , à ) 56
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Ống 6: CaCl2 (Calcium Chloride): Dung dịch không đổi màu
CaCl ( ) H S( ) ⟶ CaS( ) 2HCl( )
b) Lọc kết tủa và hòa tan trong dung dịch acid.
Một số kết tủa nh MnS, ZnS, … tan đ ợc trong dung dịch acid.
Các sunfua kim loại đ ợc chia thành 3 loại:
• Muối sulfide tan trong n ớc nh Na2S, K2S, BaS, CaS, Al2S3, Cr2S3, … (1)
• Muối sulfide không tan trong n ớc nh ng tan trong acid nh MnS, FeS, CoS, NiS, ZnS, … (2)
• Muối sulfide không tan trong n ớc và không tan trong acid nh
CuS, PbS, CdS, HgS, SnS, SnS2, Ag2S, … (3)
Nếu thay dung dịch H2S bằng (NH4)2S thì l ợng kết tủa ở một số ống
nghiệm nh ống 1 và 2 (chứa Mn +và Zn +) nhiều h n so với các ống
khác. Khi sục khí H2S vào các dung dịch muối, ngoài tạo ra kết tủa
sulfide kim loại còn tạo ra các acid, các acid này lại hòa tan một phần
kết tủa ở nhóm (2), làm cho l ợng kết tủa ít đi.
Thí nghiệm 9: Tác dụng của H2S với các chất oxi hóa. A. Các b ớc thực hiện:
Trong 4 ống nghiệm khô lần l ợt chứa 1 – 2 ml các dung dịch sau đây:
Ống 1. Dung dịch n ớc brom.
Ống 2. Dung dịch KMnO4 có thêm vài giọt dung dịch H2SO4 loãng.
Ống 3. Dung dịch K2Cr2O7 có thêm vài giọt dung dịch H2SO4 loãng. Ống 4. Dung dịch H2O2 3%.
Thêm từ từ từng giọt dung dịch H2S (điều chế ở trên) vào từng ống
nghiệm cho đến khi màu của dung dịch thay đổi và xuất hiện kết tủa trắng.
B. Hiện t ợng và giải thích: 2. Hiện t ợng:
Ống 1 – chứa dung dịch n ớc Bromide: dung dịch mất màu nâu, trở lại
trong suốt, xuất hiện kết tủa trắng. 57
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Ống 2 – chứa dung dịch KMnO4 và H2SO4: Dung dịch mất màu tím, trở
lại trong suốt và xuất hiện kết tủa trắng.
Ống 3 – chứa dung dịch K2Cr2O7 và H2SO4: Dung dịch chuyển từ màu
da cam của K2Cr2O7 sang màu xanh lục của dd muối Cr +, đồng thời
trong dd xuất hiện vẩn màu vàng chanh – nhạt (trắng) (kết tủa)
Ống 4 – Chứa dung dịch H2O2: Xuất hiện kết tủa trắng. 3. Ph ng trình phản ứng: Ống 1:
Br ( ) H S( ) ⟶ S( ) 2HBr( )
Ống 2: 2KMnO ( ) 3H SO ( ) 5H S( )
⟶ 2S( ) 2MnSO ( ) K SO ( ) 8H O( ) Ống 3: K Cr O ( ) 4H SO ( ) 3H S( )
⟶ 3S( ) Cr (SO ) ( ) K SO ( ) 7H O( ) Ống 4:
H S( ) H O ( ) ⟶ S( ) 2H O( )
Thí nghiệm 10: Điều chế khí SO2 A. Các b ớc thực hiện:
Cho khoảng 1 gam Na2SO3(s) vào một ống nghiệm lớn có gắn hệ thống
dẫn khí để trên giá đỡ, sau đó nhỏ từ từ dung dịch H2SO4 10%. Tìm cách thử khí SO2 thoát ra.
Lấy một lọ nhỏ đựng khoảng 20 ml n ớc cất, cho dòng khí SO2 đi qua
n ớc khoảng 10 – 15 phút. Lấy lọ ra, đậy nút để thực hiện các thí nghiệm tiếp theo.
Lấy 1 ml dung dịch trên cho vào ống nghiệm để thứ tính acid của dung dịch
B. Hiện t ợng và giải thích: 1. Hiện t ợng: 58
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Bột Na2CO3 tan dần, tạo dung dịch trong suốt, sủi bọt khí không màu có mùi hắc (SO2).
Khi cho khí SO2 hòa tan vào dung dịch n ớc ta thu đ ợc dung dịch Acid
yếu H2SO3, thử bằng quỳ tím ta thấy đổi màu đỏ 2. Ph ng trình phản ứng:
Na SO ( ) H SO ( ) ⟶ SO ( ) Na SO ( ) H O( ) SO ( ) H O( ) ⟶ H SO ( )
Thí nghiệm 11: Tác dụng của SO2 với các chất oxi hóa. A. Các b ớc thực hiện:
Cho vào 5 ống nghiệm khô lần l ợt mỗi ống 1 ml các dung dịch sau đây:
Ống 1. Dung dịch n ớc bromide.
Ống 2. Dung dịch n ớc iodine. Ống 3. Dung dịch FeCl3.
Ống 4. Dung dịch KMnO4 + vài giọt dung dịch H2SO4 10%.
Ống 5. Dung dịch K2Cr2O7 + vài giọt dung dịch H2SO4 10%.
Cho vào cả 5 ống nghiệm từng giọt dung dịch SO2 cho đến khi dung
dịch đổi màu hoặc mất màu hoàn toàn.
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
Ống 1 – chứa dung dịch n ớc Br2: dung dịch mất màu vàng, trở về trong suốt
Ống 2 – chứa dung dịch n ớc I2: dung dịch mất màu nâu – vàng, trở về trong suốt
Ống 3 – chứa dung dịch FeCl3: Ban đầu, dung dịch từ màu nâu đỏ
chuyển thành màu vàng đậm do phản ứng tạo ra Fe2(SO3)3, sau một thời
gian dung dịch nhạt màu đi do phản ứng oxi hóa – khử tạo ra muối Fe +
Ống 4 – chứa dung dịch KMnO4/H2SO4: dung dịch mất màu tím – vàng, trở về trong suốt
Ống 5– chứa dung dịch K2Cr2O7/H2SO4: Dung dịch chuyển từ màu da
cam của K2Cr2O7 sang màu xanh lục của dd muối Cr +. 2. Ph ng trình phản ứng: 59
Downloaded by VietJack TV Official (vietjackvideos@gmail.com) Ống 1:
SO ( ) Br ( ) 2H O( ) ⟶ H SO ( ) 2HBr( ) Ống 2:
SO ( ) I ( ) 2H O( ) ⟶ H SO ( ) 2HI( )
Ống 3: 2FeCl ( ) 3SO ( ) 3H O( ) ⟶ Fe (SO ) ( ) 6HCl( ) Nâu đỏ Vàng đậm
2Fe +( ) SO ( ) 2H O( ) ⟶ 2Fe +( ) 4H+( ) SO −( ) Vàng Xanh
Ống 4: 5SO ( ) 2KMnO ( ) 2H O( )
⟶ 2H SO ( ) 2MnSO ( ) K SO ( ) Ống 5:
K Cr O ( ) 3H SO ( ) SO ( ) ⟶ Cr (SO ) ( ) K SO ( ) 3H O( )
Thí nghiệm 12: Tác dụng của SO2 với dung dịch H2S. A. Các b ớc thực hiện:
Trong một ống nghiệm chứa 1 ml dung dịch H2S, cho vào vài giọt dung dịch SO2.
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
Dung dịch trong suốt chuyển sang trắng đục (kết tủa S) và nếu cho d
thì sẽ dần chuyển thành màu vàng nhạt 2. Ph ng trình phản ứng:
SO ( ) 2H S( ) ⟶ 3S( ) 2H O( ) 60
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 13: Tác dụng của Na2SO3 với dung dịch KMnO4. A. Các b ớc thực hiện:
Trong một ống nghiệm đựng khoảng 1 ml dung dịch KMnO4 rất loãng,
thêm vào vài giọt dung dịch H2SO4 tạo môi tr ờng.
Nhỏ từ từ từng giọt dung dịch Na2SO3 (Sodium Sulfite) cho đến khi màu
tím hồng của dung dịch KMnO4 mất hẳn.
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
Dung dịch mất màu tím, chuyển sang trong suốt không màu do ion
Mn +(ℎồ − í ) bị khử về Mn +(ℎồ ℎạ − ℎô à ). 2. Ph ng trình phản ứng: 5N SO ( ) 2KMnO ( ) 3H SO ( )
⟶ 2MnSO ( ) 5N SO ( ) K SO ( ) 3H O( )
Thí nghiệm 14: Tác dụng của Sulfuric acid loãng (H2SO4) với kim loại. A. Các b ớc thực hiện:
Trong 3 ống nghiệm, mỗi ống đựng khoảng 1 ml dung dịch H2SO4 10%.
Cho vào các ống nghiệm lần l ợt. Ống 1. Một viên kẽm.
Ống 2. Một mãnh phôi sắt. Ống 3. Một lá đồng.
Đun nóng nhẹ các ống nghiệm trên ngọn lửa đèn cồn.
B. Hiện t ợng và giải thích: 1. Hiện t ợng: • Tr ớc khi đun:
Ống 1 – chứa kẽm: Phản ứng xảy ra chậm, viên kẽm tan dần, xuất hiện ít
sủi bọt khí không màu (H2)
Ống 2 – chứa sắt: Phản ứng xảy ra chậm, sắt tan dần trong dung dịch
acid, xuất hiện ít sủi bọt khí không màu (H2).
Ống 3 – chứa đồng: Không có phản ứng xảy ra. 61
Downloaded by VietJack TV Official (vietjackvideos@gmail.com) • Sau khi đun:
Ống 1 – chứa kẽm: Phản ứng xảy ra mạnh, viên kẽm tan dần, xuất hiện
sủi bọt khí không màu (H2)
Ống 2 – chứa sắt: Phản ứng xảy ra mạnh, sắt tan dần trong dung dịch
acid, có sủi bọt khí không màu (H2).
Ống 3 – chứa đồng: Không có phản ứng xảy ra. 2. Ph ng trình phản ứng: Ống 1:
Zn( ) H SO ( , ) ⟶ ZnSO ( ) H ( ) Ống 2:
Fe( ) H SO ( , ) ⟶ FeSO ( ) H ( )
Ống 3 – chứa đồng: Không có phản ứng xảy ra. Cu( ) H SO ( , ) ↛
Acid Sulfuric không phản ứng với các kim loại đứng sau H trên dãy điện hóa.
Thí nghiệm 15: Tác dụng của Sulfuric acid đặc (H2SO4) với hợp chất hữu c . A. Các b ớc thực hiện:
a) Đặt một mẫu giấy trắng lên tấm kính, dùng đ a thủy tinh nhúng
vào dung dịch H2SO4 98%, cẩn thận vẽ tên của mình lên tờ giấy.
b) Cho vào ống nghiệm chịu nhiệt thể tích đ ờng kính, nhỏ vài giọt
H2SO4 98% vào đ ờng. Dùng đ a thủy tinh khuấy đều hỗn hợp.
Để yên đ a thủy tinh trong ống nghiệm, đặt ống nghiệm vào giá.
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
a) Trên mảnh giấy xuất hiện bột màu đen ở n i mà ta viết lên.
b) Ta thấy đ ờng nhanh chóng tan dần và hóa đen trong dung dịch acid.
Sau từ 1 – 2 phút, ta thấy khối chất màu đen (Carbon) dâng lên khỏi miệng cốc. 62
Downloaded by VietJack TV Official (vietjackvideos@gmail.com) 2. Giải thích:
a) Thành phần chủ yếu của giấy là Cellulose nên khi tiếp xúc với acid
đặc sẽ bị phân hủy thành Carbon tạo màu kết tủa đen ở chỗ ta vẽ và các loại khí khác.
b) Do H2SO4 đặc có tính háo n ớc nên khi nhỏ vào đ ờng thì acid sẽ
rút hết n ớc trong đ ờng nên đ ờng sẽ hóa than màu đen.
Sau một phần than sinh ra tiếp tục phản ứng với H2SO4 tạo thành khí
CO2 và SO2 gây sủi bọt trong ống nghiệm, làm cho than dâng lên khỏi miệng cốc 3. Ph ng trình phản ứng: a)
b) Khi đ ờng bắt đầu phân hủy:
Sau đó C sinh ra phản ứng với H2SO4:
C( ) 2H SO ( ,đ) ⟶ CO ( ) 2SO ( ) 2H O( )
Thí nghiệm 16: Tác dụng của Sulfuric acid đặc (H2SO4) với kim loại A. Các b ớc thực hiện:
Trong 3 ống nghiệm, mỗi ống đựng khoảng 1 ml dung dịch H2SO4 đặc.
Cho vào các ống nghiệm lần l ợt. Ống 1. Một viên kẽm. Ống 2. Một lá đồng
Ống 3. Một chiếc đinh sắt.
Đun nóng nhẹ các ống nghiệm trên ngọn lửa đèn cồn.
B. Hiện t ợng và giải thích 1. Hiện t ợng: • Tr ớc khi đun:
Ống 1 – chứa Kẽm: Các viên kẽm gần nh không tan, phản ứng xảy ra
chậm, xuất hiện kết tủa trắng, có khí không màu mùi hắc thoát ra (SO2). 63
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Ống 2 – chứa Đồng: Phản ứng không xảy ra.
Ống 3 – chứa Sắt: Phản ứng không xảy ra. • Sau khi đun:
Ống 1 – chứa Kẽm: Các viên kẽm tan dần, phản ứng xảy nhanh h n,
xuất hiện kết tủa trắng, có khí không màu mùi hắc thoát ra (SO2).
Ống 2 – chứa Đồng: Miếng đồng tan dần, dung dịch chuyển thành màu
xanh (CuSO4), có khí không màu mùi hắc thoát ra (SO2). Nếu có quá
nhiều acid thì dung dịch sẽ chuyển thành màu đen do H2SO4 hút có tính
hút n ớc mạnh làm mất màu xanh của dung dịch.
Ống 3 – chứa Sắt: Miếng đồng tan dần, dung dịch chuyển thành nâu đỏ
(Fe2(SO4)3), có khí không màu mùi hắc thoát ra (SO2). 2. Ph ng trình phản ứng:
Na SO ( ) H SO ( ) ⟶ SO ( ) Na SO ( ) H O( ) SO ( ) H O( ) ⟶ H SO ( )
Ống 1: Zn( ) 2H SO ( ,đ) ⟶ ZnSO ( ) SO ( ) 2H O( )
Ống 2: Cu( ) 2H SO ( ,đ) ⟶ CuSO ( ) SO ( ) 2H O( ) Ống 3:
2Fe( ) 6H SO ( ,đ) ⟶ Fe (SO ) ( ) 3SO ( ) 6H O( ) 64
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
BÀI 5. CÁC NGUYÊN TỐ CHUYỂN TUYẾN HỌ 3d
Thí nghiệm 1: Điều chế kim loại đồng từ kẽm kim loại với muối Copper (II) Sulfate A. Các b ớc thực hiện:
Lấy 2 gam kẽm bột cho vào đống nghiệm lớn hoặc một chiếc cốc nhỏ
dung tích 25 ml, sau đó cho 10 ml dung dịch bão hòa CuSO4 (dung dịch
bão hòa CuSO4 pha bằng cách hoàn tan CuSO4.5H2O trong n ớc cất,
dung dịch bão hòa có nồng độ khoảng 17,2%, d = 1,1965 g/ml).
Đun nóng ống nghiệm ở nhiệt độ khoảng 70 – 80°C trong 10 phút. Sau
đó, rót dung dịch ra, gạn rửa kết tủa bằng dung dịch HCl 5%, sau đó rửa lại bằng n ớc cất.
Lọc kết tủa bằng giấy lọc, rửa bằng n ớc cất ngay trên phểu lọc và làm
khô giữa hai mảnh giấy lọc. Sản phẩm khô đem rắc thành lớp mỏng trên tấm kính thủy tinh.
B. Hiện t ợng và giải thích: 1. Hiện t ợng:
Hòa tan bột CuSO4.5H2O vào n ớc ta đ ợc dung dịch có màu xanh lam
đặc tr ng của muối đồng.
Khi cho bột kẽm vào dung dịch. Ta thấy bột Kẽm màu đen tan dần, dung
dịch bắt đầu sủi bọt khí mạnh và ở đấy ống nghiệm xuất hiện kết tủa đỏ gạch.
Sau khi lọc kết tủa và để ở ngoài không khí, ta thấy những vụn đồng dần
hóa đen và nếu để lâu trong không khí (th ờng là rất lâu) thì đồng sẽ
bám một lớp xanh do bị oxi hóa ở ngoài không khí.
2. Giải thích và Ph ng trình phản ứng:
Khi kẽm tác dụng với dung dịch Cu +
CuSO ( ) Zn( ) ⟶ ZnSO ( ) Cu( )
Để miếng đồng ở ngoài không khí thì đồng sẽ bị oxi hóa thành CuO có màu đen. 2Cu( ) O ( ) ⟶ 2CuO( ) 4Cu( ) O ( ) ⟶ 2Cu O( ) 65
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Nếu để lâu ở ngoài không khí thì miếng đồng sẽ bám một lớp màu xanh
lục. Do trong không khí có chứa CO2 nên sẽ phản ứng tạo thành CuCO3.Cu(OH)2 màu xanh lục
4Cu( ) O ( ) H O( ) CO ( ) ⟶ Cu CO (OH) ( )
3. Tại sao phải rửa kết tủa bằng dung dịch HCl 5%?
Ta rửa kết tủa đồng do trên kết tủa sẽ còn bám những vụn kẽm ch a
phản ứng hết bám trên miếng đồng sau khi hình thành. Ta rửa bằng dung
dịch HCl loãng do Zn là kim loại đứng tr ớc H trong dãy điện hóa còn
Cu đứng sau H nên Zn sẽ tác dụng với HCl tạo dung dịch muối (dung
môi n ớc) và khí Hydrogen còn đồng sẽ không tác dụng. Nên sau khi
rửa lại bằng n ớc thì sẽ trôi đi dung dịch muối và còn giữ lại miếng đồng. Cu( ) HCl( ) ↛
Zn( ) 2HCl( ) ⟶ ZnCl ( ) H ( )
Thí nghiệm 2: Tác dụng của đồng với các acid. A. Các b ớc thực hiện:
Lấy 2 gam kẽm bột cho vào đống nghiệm lớn hoặc một chiếc cốc nhỏ
dung tích 25 ml, sau đó cho 10 ml dung dịch bão hòa CuSO4 (dung dịch
bão hòa CuSO4 pha bằng cách hoàn tan CuSO4.5H2O trong n ớc cất,
dung dịch bão hòa có nồng độ khoảng 17,2%, d = 1,1965 g/ml).
Đun nóng ống nghiệm ở nhiệt độ khoảng 70 – 80°C trong 10 phút. Sau
đó, rót dung dịch ra, gạn rửa kết tủa bằng dung dịch HCl 5%, sau đó rửa lại bằng n ớc cất.
Lọc kết tủa bằng giấy lọc, rửa bằng n ớc cất ngay trên phểu lọc và làm
khô giữa hai mảnh giấy lọc. Sản phẩm khô đem rắc thành lớp mỏng trên tấm kính thủy tinh.
B. Hiện t ợng và giải thích:
Lấy 6 ống nghiệm, cho vào mỗi ống 1 ml lần l ợt các dung dịch axit
sau: HCl 2M, HCl 36%, H2SO4 2M, H2SO4 98%, HNO3 2M, HNO3
65%. Sau đó cho vào mỗi ống nghiệm một miếng đồng.
Thực hiện thí nghiệm ở nhiệt độ phòng và khi đun nóng. 1. Hiện t ợng: 66
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Khi lần l ợt cho miếng đồng có chứa các dụng dịch sau: a) Tr ớc khi đun nóng.
Ống 1 – HCl(loãng) 2M : Không xảy ra phản ứng
Ống 2 – HCl(đặc) 36,5%: Không xảy ra phản ứng
Ống 3 – H2SO4(loãng) 2M: Không xảy ra phản ứng
Ống 4 – H2SO4(đặc) 98%: Không xảy ra phản ứng
Ống 5 – HNO3(loãng) 2M: Không xảy ra phản ứng
Ống 6 – HNO3(đặc) 65%: Không xảy ra phản ứng 2. Sau khi đun nóng.
Ống 1 – HCl(loãng) 2M : Không xảy ra phản ứng
Ống 2 – HCl(đặc) 36,5%: Miếng đồng tan dần, dung dịch dần chuyển
thành màu vàng nâu, có khí không màu thoát ra.
Ống 3 – H2SO4(loãng) 2M: Không xảy ra phản ứng
Ống 4 – H2SO4(đặc) 98%: Miếng đồng tan dần, dung dịch chuyển thành
màu xanh (CuSO4), có khí không màu thoát ra (SO2). Nếu có quá nhiều
acid thì dung dịch sẽ chuyển thành màu đen do H2SO4 hút có tính hút
n ớc mạnh làm mất màu xanh của dung dịch.
Ống 5 – HNO3(loãng) 2M: Đồng tan dần tạo dung dịch màu xanh lam và
sủi bọt khí không màu hóa nâu trong không khí trên đầu thành ống nghiệm (NO).
Ống 6 – HNO3(đặc) 65%: Đồng phản ứng mạnh với dd HNO3(đ) tạo dung
dịch màu xanh lá (Cu(NO3)2), lá đồng tan dần và có khí màu nâu đỏ bốc lên (NO2).
3. Giải thích và Ph ng trình phản ứng:
Tr ớc khi đun sôi: ở nhiệt độ phòng Cu khá kém hoạt động và không tác dụng với các acid
Sau khi đun sôi: Cu không phản ứng với các acid loãng và chỉ phản ứng với các acid đặc nóng.
Ống 2: Cu tan dần trong dung dịch acid tạo dung dịch màu vàng nâu đặc
tr ng của phức CuCl −, có sủi bọt khí H2.
Cu( ) 2HCl( ,đ) ⟶ CuCl ( ) H ( )
Cu( ) 2Cl−( ) ⟶ [CuCl ] − ( , â ) 67
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Ống 4: Cu tan dần tạo dung dịch màu xanh lam đặc tr ng của
Cu(H O) +, sủi bọt khí có mùi hắc.
Cu( ) 2H SO ( ,đ) ⟶ CuSO ( ) SO ( ) 2H O( )
Ống 5: Cu tan dần tạo dung dịch màu xanh lam đặc tr ng của
Cu(H O) +, ta thấy đầu ống nghiệm xuất hiện khí màu nâu đỏ do NO
tiếp xúc với không khí tạo thành NO2
3Cu( ) 8HNO ( , ) ⟶ 3Cu(NO ) ( ) 2NO( ) 4H O( )
Ống 6: Cu tan dần tạo dung dịch màu xanh lục. Và ta thấy đ ợc khí màu
nâu đỏ xuất hiện bên trong ống nghiệp.
Cu( ) 4HNO ( ,đ) ⟶ Cu(NO ) ( ) 2NO ( ) 2H O( )
T ng tự nh thí nghiệm ở Bài thực hành số 3:
Sản phẩm khí tạo thành chủ yếu do nồng độ của acid quyết định. Sản
phẩm chủ yếu lúc đầu của quá trình kim loại khử HNO3 là HNO2 (acid
nitrous). Acid này không bền và phân hủy thành NO, NO2 và H2O.
2HNO ( ) ⟶ NO ( ) NO( ) H O( )
H O( ) 3NO ( ) ⇄ 2HNO ( ) NO( )
Khi nồng độ acid tăng lên, cân bằng sẽ chuyển dịch về phía tạo thành
NO2. Khi nồng độ acid giảm (HNO3 loãng) cần bằng chuyển dịch về phía tạo thành NO.
Và màu xanh lục của ống số 6 đ ợc tạo ra do sự pha màu giữa màu xanh
lam của dung dịch muối đồng và màu nâu đỏ của NO2.
Thí nghiệm 3: Điều chế và tính chất của Cu(OH)2. A. Các b ớc thực hiện: a) Điều chế Cu(OH)2
Cho 5 ml dung dịch CuSO4 bão hòa vào chiếc cốc dung tích 100 ml.
Thêm từ từ từng giọt dung dịch NaOH 2M cho đến khi kết tủa hoàn
toàn. Gạn lấy kết tủa, rửa kết tủa 3 lần bằng n ớc cất. b) Tính chất của Cu(OH)2
Chia kết tủa vào 3 ống nghiệm:
Ống 1. Cho từ từ từng giọt dung dịch HCl 2M. Nhận xét hiện t ợng. 68
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Ống 2. Cho từ từ từng giọt dung dịch NaOH 2M. Nhận xét hiện t ợng.
Ống 3. Cho từ từ từng giọt dung dịch NH3 2M cho đến d . Nhận xét hiện t ợng
B. Hiện t ợng và giải thích: 3. Hiện t ợng: a) Điều chế Cu(OH)2:
Khi nhỏ NaOH vào CuSO4, ta thấy dung dịch muối đồng màu xanh nhạt
màu dần chuyển thành không màu, đồng thời xuất hiện kết tủa xanh d ng (đậm).
b) Tính chất của Cu(OH)2:
Ống 1 – nhỏ dung dịch HCl 2M: ta thấy kết tủa xanh tan dần, dung dịch
trong suốt trở thành màu xanh lục (nhạt).
Ống 2 – nhỏ dung dịch NH3 2M: Ta thấy kết tủa tan dần, tạo dung dịch màu xanh lam
Ống 3 – nhỏ dung dịch NaOH 2M đến d : kết tủa tan dần tạo dung dịch màu xanh tím
4. Giải thích và Ph ng trình phản ứng: e) Điều chế Cu(OH)2:
2NaOH( ) CuSO ( ) ⟶ Cu(OH) ( ) Na SO ( )
b) Tính chất của Cu(OH)2:
Ống 1: Cu(OH) ( ) 2HCl( ) ⟶ CuCl ( ) H O( )
CuCl ( ) 2Cl−( ) ⟶ [CuCl ] − ( , â ) Ống 2:
4NH ( ) Cu(OH) ( ) ⟶ [Cu(NH ) ](OH) ( , ℎ ) Ống 3:
2NaOH( ) Cu(OH) ( ) ⟶ Na [Cu(OH) ]( , ℎ í ) 69
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
• Cu(OH)2 có tính l ỡng tính (yếu) 3. Giải thích:
Ống 1: ion Cu + tạo phức với Cl− tạo ra [CuCl ] − có màu nâu kết hợp
với dung dịch [Cu(H O) ] + màu xanh lam tạo ra dung dịch có màu xanh lục.
Ống 2: Cu(OH)2 tan trong dung dịch NH3 đậm đặc tạo phức
[Cu(NH ) ] + có màu xanh lam.
Ống 3: Cu(OH)2 tan trong dung dịch NaOH 40% khi đ ợc đun nóng tạo
phức [Cu(OH) ] − có màu xanh tím với Na.
Thí nghiệm 4: Tính chất của Cr(OH)3 A. Các b ớc thực hiện: a) Điều chế Cr(OH)3
Cho vào ống nghiệm 2 ml dung dịch Cr2(SO4)3, thêm từ từ từng giọt
dung dịch NH3 10% cho đến khi xuất hiện kết tủa. b) Tính chất của Cr(OH)3
Chia kết tủa vào 2 ống nghiệm.
Ống 1. Thêm từ từ từng giọt dung dịch NaOH 2M. Quan sát hiện t ợng
và màu sắc của dung dịch sau phản ứng.
Ống 2. Cho từ từ từng giọt dung dịch HCl 2M. Quan sát hiện t ợng và
màu sắc của dung dịch sau phản ứng.
B. Hiện t ợng và giải thích: 3. Hiện t ợng: d) Điều chế Cr(OH)3:
Dung dịch Cr2(SO4)3 màu hồng – tím nhạt màu dần, xuất hiện kết tủa
màu xanh lục – xám (Cr(OH)3), nếu có NH3 d thì dung dịch sẽ chuyển
sang màu tím đậm, kết tủa đọng ở đáy.
e) Tính chất của Cr(OH)3:
Ống 1 – chứa dung dịch NaOH 2M: Kết tủa tan dần và dung dịch
chuyển dần thành màu xanh lục nhạt – vàng.
Ống 2 – chứa dung dịch HCl 2M: Kết tủa tan dần và dung dịch chuyển dần thành màu xanh lục. 70
Downloaded by VietJack TV Official (vietjackvideos@gmail.com) 4. Ph ng trình phản ứng: d) Điều chế Cr(OH)3:
Cr (SO ) ( ) 6NH ( ) 6H O( ) ⟶ 2Cr(OH) ( ) 3(NH ) SO ( )
e) Tính chất của Cr(OH)3:
Ống 1: Cr(OH) ( ) 3NaOH( ) ⟶ Na [Cr(OH) ]( ,ụ − à ) Ống 2:
Cr(OH) ( ) 3HCl( ) ⟶ CrCl ( ) 3H O( )
(Cr[(H O) (OH) ]( ) 3H+( ) ⟶ [Cr(H O) ] + ( )) 5. Giải thích: a) Điều chế Cr(OH)3:
Cr +ngậm n ớc [Cr(H O) ] + có màu hồng – tím khi tác dụng với NH3
sẽ tạo phức [Cr(NH ) ] + màu tím đậm.
[Cr(H O) ] +( ) 6NH ( ) ⟶ [Cr(NH ) ] +( ) 6H O( )
b) Tính chất của Cr(OH)3:
Ống 1: Cr(OH)3 tan dần trong dung dịch NaOH và tạo phức
[Cr(OH) ] − có màu xanh lục. Cr(OH) ( )
3OH−( ) ⟶ [Cr(OH) ] −( , ℎ ụ )
Ống 2: Cr(OH)3 tan dần trong dung dịch HCl tạo muối Cr +ngậm n ớc có màu xanh lục.
(Cr[(H O) (OH) ]( ) 3H+( ) ⟶ [Cr(H O) ] + ( ))
Thí nghiệm 5: Phản ứng của muối Cr(III) với các chất oxi hóa trong môi tr ờng kiềm. A. Các b ớc thực hiện: Lấy 2 ống nghiệm.
Ống 1. Cho 1 ml dung dịch Br2 và 1 ml dung dịch NaOH 40%.
Ống 2. Cho một ít bột PbO2 (bằng hạt gạo) và 2 ml dung dịch NaOH 40%. 71
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Nhỏ 2 ml dung dịch CrCl3 vào từng ống nghiệm, đồng thời đun nóng.
B. Hiện t ợng và giải thích: 4. Hiện t ợng:
Ống 1: Dung dịch ban đầu xuất hiện kết tủa xanh lục nh ng sau đó tan
dần và dung dịch chuyển thành màu vàng đậm.
Ống 2: Dung dịch ban đầu xuất hiện kết tủa xanh lục nh ng sau đó tan
dần và dung dịch chuyển màu xanh lam sẫm, xuất hiện kết tủa trắng trong ống nghiệm 5. Ph ng trình hóa học: Ống 1: 2CrCl ( ) 16NaOH( ) 3Br ( )
⟶ 2Na CrO ( ) 6NaCl( ) 6NaBr( ) 8H O( ) Ống 2:
2CrCl ( ) 4NaOH( ) 3PbO ( ) ⟶ 2Na CrO ( ) 2PbCl ( ) 2H O( ) 6. Giải thích:
Ống 1: Ban đầu xuất hiện kết tủa xanh lục, sau đó kết tủa tan dần tạo dung dịch xanh lục.
CrCl ( ) 3NaOH( ) ⟶ Cr(OH) ( ) 3NaCl( )
Cr(OH) ( ) NaOH( ) ⟶ Na [Cr(OH) ]( )
Khi có mặt của dung dịch n ớc bromine thì dung dịch chuyển sang màu vàng.
2Na [Cr(OH) ]( ) 4NaOH( ) 3Br ( )
⟶ 2Na CrO ( ) 6NaBr( ) 8H O( )
Ống 2: t ng tự nh ống số 1
Thí nghiệm 6: Tính oxi hóa của K2Cr2O7. A. Các b ớc thực hiện:
Trong 2 ống nghiệm, mỗi ống đựng 2 ml dung dịch K2Cr2O7, thêm vào
mỗi ống vài giọt dung dịch H2SO4 2M. Cho từ từ từng giọt dung dịch KI 72
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
vào ống nghiệm thứ nhất và dung dịch H2S (hoặc sục trực tiếp khí đ ợc
điều chế) vào ống nghiệm thứ 2.
B. Hiện t ợng và giải thích: 5. Hiện t ợng:
Khi cho H2SO4 vào K2Cr2O7, dung dịch trở nên sẫm màu h n.
Ống 1: Dung dịch dần chuyển thành màu xanh lục rồi chuyển hẳn thành
màu xanh lam (sẫm) (có thể là màu tím do mix giữa I2(tím) và màu xanh)
Ống 2: Dung dịch chuyển từ màu da cam của K2Cr2O7 sang màu xanh
lục của dd muối Cr + (sẫm), đồng thời trong dd xuất hiện vẩn màu trắng. 6. Ph ng trình phản ứng: Ống 1: K Cr O ( ) 7H SO ( ) 6KI( )
⟶ Cr (SO ) ( ) 3I ( ) K SO ( ) 7H O( )
Ống 2: K Cr O ( ) 4H SO ( ) 3H S( )
⟶ 3S( ) Cr (SO ) ( ) K SO ( ) 7H O( ) 7. Giải thích
Ống 1: Dung dịch Cr O − có màu da cam bị khử về Cr + và có màu
xanh lục xẫm đặc tr ng của phức [Cr(H O) ] +.
Cr O − ( ) 14H+ ( ) 2I− ( ) ⟶ 2Cr +( ) I ( ) 7H O( )
Cr +( ) 6H O( ) ⟶ [Cr(H O) ] + ( , ℎ ẫ )
Ống 2: Dung dịch Cr O − có màu da cam bị khử về Cr + và có màu
xanh lục xẫm đặc tr ng của phức [Cr(H O) ] +, đồng thời xuất hiện kết tủa S(trắng).
Cr O − ( ) 14H+ ( ) S − ( ) ⟶ 2Cr +( ) S( ) 7H O( )
Cr +( ) 6H O( ) ⟶ [Cr(H O) ] + ( , ℎ ẫ ) 73
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 7: Điều chế và tính chất của Mn(OH)2. A. Các b ớc thực hiện: a) Điều chế Mn(OH)2
Trong 3 ống nghiệm, mỗi ống đựng 1 ml dung dịch MnSO4 1M, sau đó
thêm vào mỗi ống 1 ml dung dịch NaOH 2M. b) Tính chất của Mn(OH)2
Ống 1. Gạn phần dung dịch, đổ kết tủa ra miếng kính thủy tinh rồi để
yên ngoài không khí. Theo dõi sự thay đổi màu sắc của kết tủa.
Ống 2. Cho vào từ từ từng giọt dung dịch HCl 2M. Nhận xét hiện t ợng.
Ống 3. Cho vào từ từ từng giọt dung dịch n ớc brom rồi lắc đều. Quan sát hiện t ợng.
B. Hiện t ợng và giải thích: 4. Hiện t ợng: a) Điều chế Mn(OH)2
Khi cho dung dịch NaOH vào dung dịch MnSO4 (Manganese (II)
Sulfate) thì dung dịch xuất hiện kết tủa trắng. b) Tính chất của Mn(OH)2
Ống 1: Sau một thời gian ở ngoài không khí, ta thấy kết tủa chuyển một phần thành màu nâu đen.
Ống 2: Ở giai đoạn đầu thì kết tủa tan, nh ng sau đó lại tạo kết tủa mịn có màu nâu đen.
Ống 3: Dung dịch có vẩn màu nâu.
5. Giải thích và Ph ng trình phản ứng: a) Điều chế Mn(OH)2 Khi cho NaOH vào MnSO4:
MnSO ( ) 2NaOH( ) ⟶ Mn(OH) ( ) Na SO ( ) b) Tính chất của Mn(OH)2
Ống 1: Do Mn(OH)2 dễ bị oxi hóa ở ngoài không khí tạo thành
Manganite (MnO(OH)) và Manganese dioxide (MnO2) có màu nâu – đen.
4Mn(OH) ( ) O ( ) ⟶ 4MnO(OH)( ) 2H O( ) 74
Downloaded by VietJack TV Official (vietjackvideos@gmail.com) 2Mn(OH) ( ) O ( ) ⟶ 2MnO ( ) H O( )
Ống 2: Giai đoạn đầu kết tủa tan ra do Mn(OH)2 là base phản ứng với acid tạo muối MnCl2.
Mn(OH) ( ) 2HCl( ) ⟶ MnCl ( ) 2 H O( )
Nh ng sau đó lại tạo kết tủa mịn màu đen là MnO(OH) và MnO2 theo
c chế ở trên. MnCl ( ) 2H O( ) ⇄ Mn(OH) ( ) 2HCl( )
Ống 3: Dung dịch có vẫn màu nâu – đen do có MnO2 đ ợc hình thành. MnSO ( ) 4NaOH( ) Br ( )
⟶ Mn(OH) ( ) Na SO ( ) 2NaBr( ) 2H O( )
6. Tính chất của Mn(OH)2:
Từ các thí nghiệm trên ta có thể thấy đ ợc rằng:
• Mn(OH)2 kém bền và dễ bị oxi hóa.
• Mn(OH)2 có tính base yếu.
Thí nghiệm 8: Tính chất của muối Manganese (II). A. Các b ớc thực hiện:
Lấy 2 ống nghiệm, cho vào mỗi ống 2 ml dung dịch MnSO4 2M.
Cho vào ống nghiệm 1 một ít bột PbO2 (bằng hạt gạo), thêm 1 ml HNO3 2M, đun sôi dung dịch.
Quan sát sự thay đổi màu của dung dịch trong quá trình phản ứng.
Nhỏ vào ống nghiệm 2 vài giọt dung dịch NaOH 2M, sau đó thêm 1 ml dung dịch H2O2 3%.
B. Hiện t ợng và giải thích: 4. Hiện t ợng:
Ống 1: Dung dịch màu hồng nhạt chuyển dần thành không màu, xuất hiện kết tủa trắng.
Ống 2: Khi cho NaOH vào MnSO4 ta thấy xuất hiện kết tủa màu trắng
nh ng sau đó hóa nâu một phần trong không khí. Khi thêm vào vài giọt
H2O2 3% thì ta thấy có kết tủa nâu đen tạo thành và có bọt khí xuất hiện. 75
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
5. Giải thích và ph ng trình phản ứng: Ống 1: 2MnSO ( ) 5PbO ( ) 6HNO ( )
⟶ 2HMnO ( ) 3Pb(NO ) ( ) 2PbSO ( ) 2H O( )
Ống 2: Cho NaOH vào MnSO4 ta thấy kết tủa trắng Mn(OH)2.
MnSO ( ) 2NaOH( ) ⟶ Mn(OH) ( ) Na SO ( )
Sau đó hóa nâu một phần trong không khí do Mn(OH)2 bị oxi hóa trong không khí. 2Mn(OH) ( ) O ( ) ⟶ 2MnO ( ) H O( )
Khi cho H2O2 3% vào thì xuất hiện kết tủa đen MnO2 và sủi bọt khí O2
do sự phân hủy của H2O2. H O ( ) ⟶ H O( ) [O−] 2[O−] ⟶ O ( ) 2Mn(OH) ( ) O ( ) H O( ) ⟶ 2Mn(OH) ( , â ) Mn(OH) ( ) ⟶ MnO ( ) H O( )
Thí nghiệm 9: Tính oxi hóa của KMnO4 trong các môi tr ờng khác nhau. A. Các b ớc thực hiện:
a) Trong 3 ống nghiệm, mỗi ống chứa 2 ml dung dịch KMnO4 rất loãng.
Ống 1. Thêm 0.5 ml dung dịch H2SO4 1M.
Ống 2. Thêm 0.5 ml n ớc cất.
Ống 3. Thêm 0.5 ml dung dịch NaOH 2M.
Cho thêm vào mỗi ống 1 ml dung dịch K2SO3 10%.
b) Trong 2 ống nghiệm khác, mỗi ống đựng 2 ml dung dịch KBr 1M.
Ống 1. Thêm 2 ml dung dịch H2SO4 1M.
Ống 2. Thêm 2 ml dung dịch CH3COOH loãng.
Cho vào 2 ống nghiệm trên, mỗi ống 1 ml dung dịch KMnO4 rất loãng.
B. Hiện t ợng và giải thích: 76
Downloaded by VietJack TV Official (vietjackvideos@gmail.com) 4. Hiện t ợng:
a) Trong 3 ống nghiệm mỗi ống chứa dung dịch KMnO4 loãng.
Ống 1 – chứa dung dịch H2SO4 1M: Dung dịch mất màu tím, chuyển
sang trong suốt không màu.
Ống 2 – chứa n ớc cất: Dung dịch dần chuyển thành màu vàng nâu, xuất
hiện kết tủa màu nâu đen MnO2.
Ống 3 – chứa dung dịch NaOH 2M: Dung dịch chuyển thành màu xanh
lam, lúc sau có thể chuyển thành màu xanh lá đục.
b) Trong 2 ống nghiệm, mỗi ống chứa dung dịch KBr 1M
Ống 1 – chứa dung dịch H2SO4 1M: Dung dịch mất màu tím, dung dịch
chuyển thành màu vàng nâu.
Ống 2 – chứa dung dịch CH3COOH loãng: dung dịch mất màu tím,
chuyển dần về trong suốt. 5. Ph ng trình phản ứng: a)
• Ống 1: Trong môi tr ờng acid: 5K SO ( ) 2KMnO ( ) 3H SO ( )
⟶ 2MnSO ( ) 6K SO ( ) 3H O( )
• Ống 2: Trong môi tr ờng trung tính: 3K SO ( ) 2KMnO ( ) H O( )
⟶ 2MnO ( ) 3K SO ( ) 2KOH( )
• Ống 3: Trong môi tr ờng base: K SO ( ) 2KMnO ( ) 2NaOH( )
⟶ K MnO ( ) K SO ( ) N MnO ( ) H O( ) b)
• Ống 1: Trong môi tr ờng acid mạnh: 10KBr( ) 2KMnO ( ) 8H SO ( )
⟶ 2MnSO ( ) 6K SO ( ) 5Br ( ) 8H O( )
• Ống 2: Trong môi tr ờng acid yếu: 77
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
10KBr( ) 2KMnO ( ) 16CH COOH( )
⟶ 2(CH COO) Mn( ) 12CH COOK( ) 5Br ( ) 8H O( )
Thí nghiệm 10: Tác dụng của sắt với các acid. A. Các b ớc thực hiện:
Trong 4 ống nghiệm, mỗi ống chứa 2 ml dung dịch lần l ợt các axit sau:
HCl 2M, H2SO4 2M, H2SO4 98%, HNO3 65%. Sau đó cho vào mỗi ống
một ít phôi sắt. Theo dõi quá trình thí nghiệm và sự đổi màu của dung
dịch. Đun nóng ống nghiệm chứa H2SO4 đặc và HNO3 đặc, tiếp tục quan
sát thí nghiệm. Gạn lấy một ít dung dịch sang 4 ống nghiệm khác, thêm
từ từ từng giọt dung dịch NaOH 2M.
B. Hiện t ợng và giải thích: 3. Hiện t ợng:
Ống 1 – chứa HCl 2M: sắt tan chậm trong dung dịch acid, xuất hiện sủi
bọt khí không màu (và cả xung quanh đinh). Khi cho dung dịch NaOH
vào dung dịch trên thì ta thấy xuất hiện kết tủa trắng xanh (Fe(OH)2).
Ống 2 – chứa H2SO4 2M: sắt tan chậm trong dung dịch acid, xuất hiện
sủi bọt khí không màu (và cả xung quanh đinh). Khi cho dung dịch
NaOH vào dung dịch trên thì ta thấy xuất hiện kết tủa trắng xanh (Fe(OH)2). Ống 3 – chứa H2SO4 98%:
• Tr ớc khi đun: Sắt không tan, phản ứng không xảy ra.
• Sau khi đun: Sắt tan mạnh trong dung dịch acid, xuất hiện sủi bọt
khí không màu có mùi hắc, dung dịch đổi màu thành màu nâu đỏ.
• Khi cho dung dịch NaOH vào dung dịch trên thì ta thấy xuất hiện
kết tủa nâu đỏ (Fe(OH)3). Ống 4 – chứa HNO3 65%:
• Tr ớc khi đun: Sắt không tan, phản ứng không xảy ra.
• Sau khi đun: Sắt tan mạnh trong dung dịch acid, có khí màu nâu đỏ
bốc lên, dung dịch đổi màu thành màu nâu đỏ. 78
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
• Khi cho dung dịch NaOH vào dung dịch trên thì ta thấy xuất hiện
kết tủa nâu đỏ (Fe(OH)3). 4. Ph ng trình phản ứng: Ống 1:
Fe( ) 2HCl( , ) ⟶ FeCl ( ) H ( )
FeCl ( ) 2NaOH( ) ⟶ Fe(OH) ( ) 2NaCl( ) Ống 2:
Fe( ) H SO ( , ) ⟶ FeSO ( ) H ( )
FeSO ( ) 2NaOH( ) ⟶ Fe(OH) ( ) Na SO ( ) Ống 3:
• Tr ớc khi đun: Sắt bị thụ động trong H2SO4 đặc nguội Fe( ) H SO ( ,đ, ) ↛ • Sau khi đun:
2Fe( ) 6H SO ( ,đ,ℎ ) ⟶ Fe (SO ) ( ) 3SO ( ) 6H O( )
Fe (SO ) ( ) 6NaOH( ) ⟶ 2Fe(OH) ( ) 3Na SO ( ) Ống 4:
• Tr ớc khi đun: Sắt bị thụ động trong HNO3 đặc nguội Fe( ) HNO ( ,đ, ) ↛ • Sau khi đun:
Fe( ) 6HNO ( ,đ,ℎ ) ⟶ Fe(NO ) ( ) 3NO ( ) 3H O( )
Fe(NO ) ( ) 3NaOH( ) ⟶ Fe(OH) ( ) 3NaNO ( ) 79
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 11: Điều chế và tính chất của Fe(OH)2. A. Các b ớc thực hiện: a) Điều chế Fe(OH)2
Cho vào ống nghiệm 2 ml dung dịch muối Morh, cho thêm từng giọt
dung dịch NaOH 2M. Quan sát màu sắc của kết tủa. b) Tính chất của Fe(OH)2
Gạn lấy phần kết tủa, đổ ra tấm giấy lọc rồi đặt trên tấm kính thủy tinh
và để yên ngoài không khí.
B. Hiện t ợng và giải thích: 3. Hiện t ợng: a) Điều chế Fe(OH)2
Xuất hiện kết tủa xanh lục (nhạt) trong dung dịch. b) Tính chất của Fe(OH)2
Để kết tủa ở ngoài không khí ta thấy kết tủa hóa nâu.
4. Giải thích và Ph ng trình phản ứng: a) Điều chế Fe(OH)2
Muối Mohr là muối kép của muối ammonium sulfate và iron (II) sulfate
và có công thức là (NH ) SO ∙ FeSO ∙ 6H O.
Muối Mohr ở trong dung dịch sẽ phân ly tạo thành muối ammonium sulfate và iron (II) sulfate
(NH ) SO ∙ FeSO ∙ 6H O( ) ⟶ (NH ) SO ( ) FeSO ( ) 6H O( )
Khi nhỏ dung dịch NaOH vào muối mohr thì sẽ xảy ra phản ứng trao đổi
giữa FeSO4 và NaOH tạo kết tủa xanh lục Fe(OH)2
FeSO ( ) 2NaOH( ) ⟶ Fe(OH) ( , ℎ ụ ) Na SO ( ) b) Tính chất của Fe(OH)2
Nếu để kết tủa ở ngoài không khí một thời gian thì ta thấy kết tủa hóa
nâu vì Fe(OH)2 dễ bị oxi hóa ở ngoài không khí tạo Fe(OH)3.
4Fe(OH) ( , ℎ ụ ) O ( ) H O( ) ⟶ 4Fe(OH) ( , â đỏ) Fe + dễ bị oxi hóa 80
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)
Thí nghiệm 12: Tính chất của muối sắt (III) A. Các b ớc thực hiện:
a) Trong 3 ống nghiệm, mỗi ống chứa 1 ml dung dịch FeCl3. Ống 1. Để so sánh.
Ống 2. Thêm vài giọt dung dịch HCl 2M.
Ống 3. Thêm 1 ml n ớc cất rồi đun nóng.
Quan sát sự thay đổi màu sắc của dung dịch trong 3 ống nghiệm.
b) Lấy 1 ống nghiệm khác cho vào 1 ml dung dịch FeCl3. Thêm từ từ
từng giọt dung dịch Na2CO3. Nhận xét hiện t ợng xảy ra.
c) Lấy 2 ống nghiệm khác, cho vào mỗi ống 1 ml dung dịch FeCl3.
Thêm vào ống nghiệm thứ nhất vài giọt dung dịch NH4SCN.
Thêm vào ống nghiệm thứ 2 vài giọt dung dịch K4[Fe(CN)6].
B. Hiện t ợng và giải thích: 3. Hiện t ợng: a) Ống 1: để so sánh
Ống 2: Không có hiện t ợng xảy ra
Ống 3: Xuất hiện kết tủa nâu đỏ trong dung dịch b)
Xuất hiện kết tủa nâu đỏ, dung dịch trở thành trong suốt đồng thời có sủi bọt khí không màu. c)
Ống 1 – chứa NH4SCN: Xuất hiện kết tủa đỏ máu trong dung dịch.
Ống 2 – chứa K4[Fe(CN)6]: Xuất hiện kết tủa xanh phổ (xanh berlin) 4. Ph ng trình phản ứng: a) Ống 3:
FeCl ( ) 3H O( ) ⟶ Fe(OH) ( ) 3HCl( ) b) 81
Downloaded by VietJack TV Official (vietjackvideos@gmail.com) 2FeCl ( ) 3Na CO ( ) 3H O( )
⟶ 2Fe(OH) ( ) 6NaCl( ) 3CO ( ) c) Ống 1:
FeCl ( ) K [Fe(CN) ]( ) ⟶ KFe[Fe(CN) ]( , ℎ) 3KCl( )
Ống 2: FeCl ( ) 3KSCN( ) ⟶ Fe(SCN) ( ,đỏ á ) 3KCl( ) 82
Downloaded by VietJack TV Official (vietjackvideos@gmail.com)

