



Preview text:
lOMoAR cPSD| 61622878 CHƯƠNG 2 NGUYÊN TỬ - CẤU TRÚC NGUYÊN TỬ
TS Nguyễn Thanh Bình
Th.S TRẦN BỮU ĐĂNG KHOA HÓA HỌC
TRƯỜNG ĐẠI HỌC SƯ PHẠM Tp. HỒ CHÍ MINH lOMoAR cPSD| 61622878
Hạt nhân nguyên tử
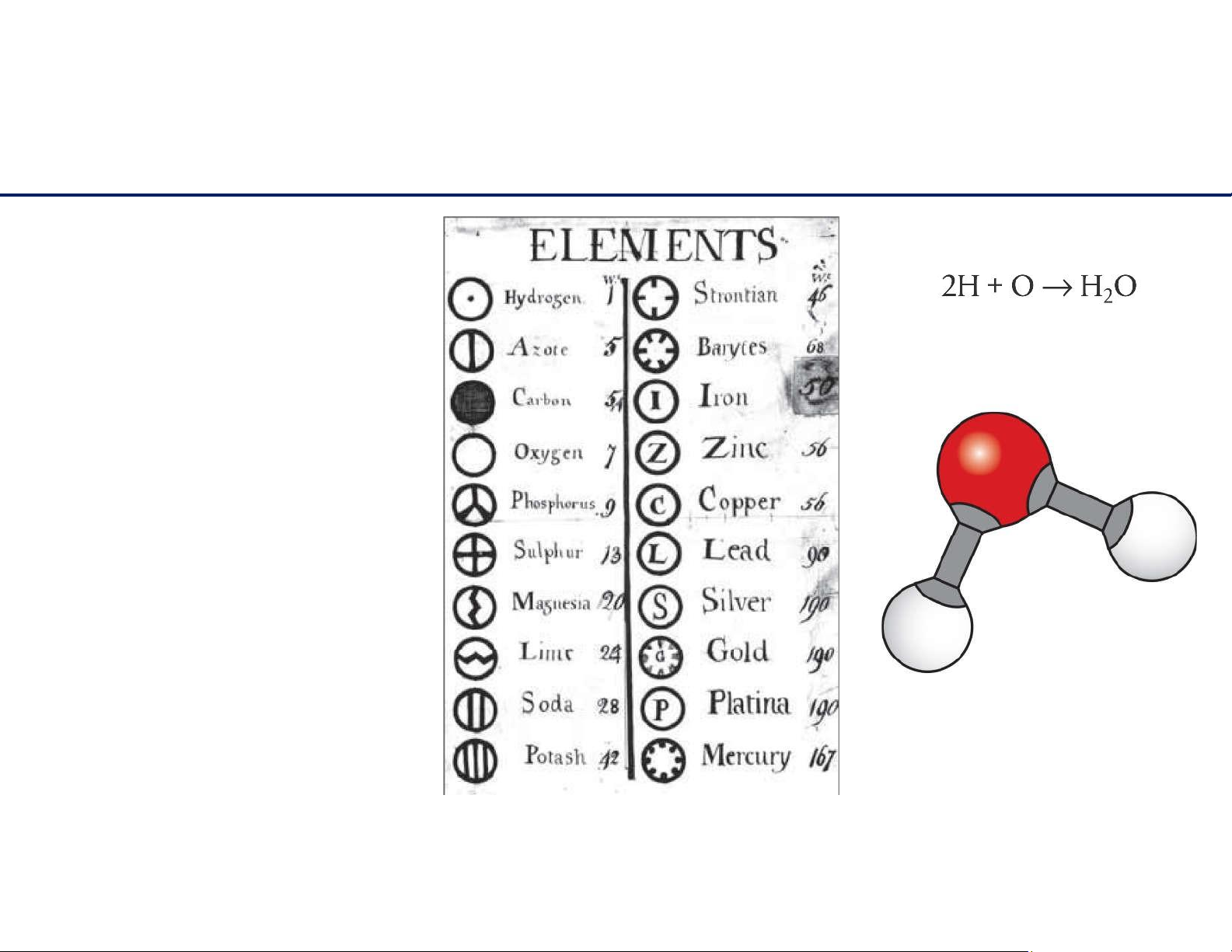
MôhìnhnguyêntửDalton
• Tấtcảvậtchấtđượctạothànhtừ
nhữngphầntửkhôngphânchia
đượcnữa, gọilànguyêntử.
• Nguyêntửkhôngtựsinhra vàmất đi;
• Nhữngnguyêntửcủacùngnguyên
tốthìcótínhchấtgiốngnhau;
• Nhữngnguyêntửcủacácnguyên tốkhácnhauthìkhácnhau;
• Nhữngnguyêntửcóthểkếthợp
vớinhautheotỉlệnhấtđịnhtạo thànhhợpchất.
➔ Khôngmôtảđượccấutrúc bêntrongnguyêntử. 2 lOMoAR cPSD| 61622878
Hạt nhân nguyên tử
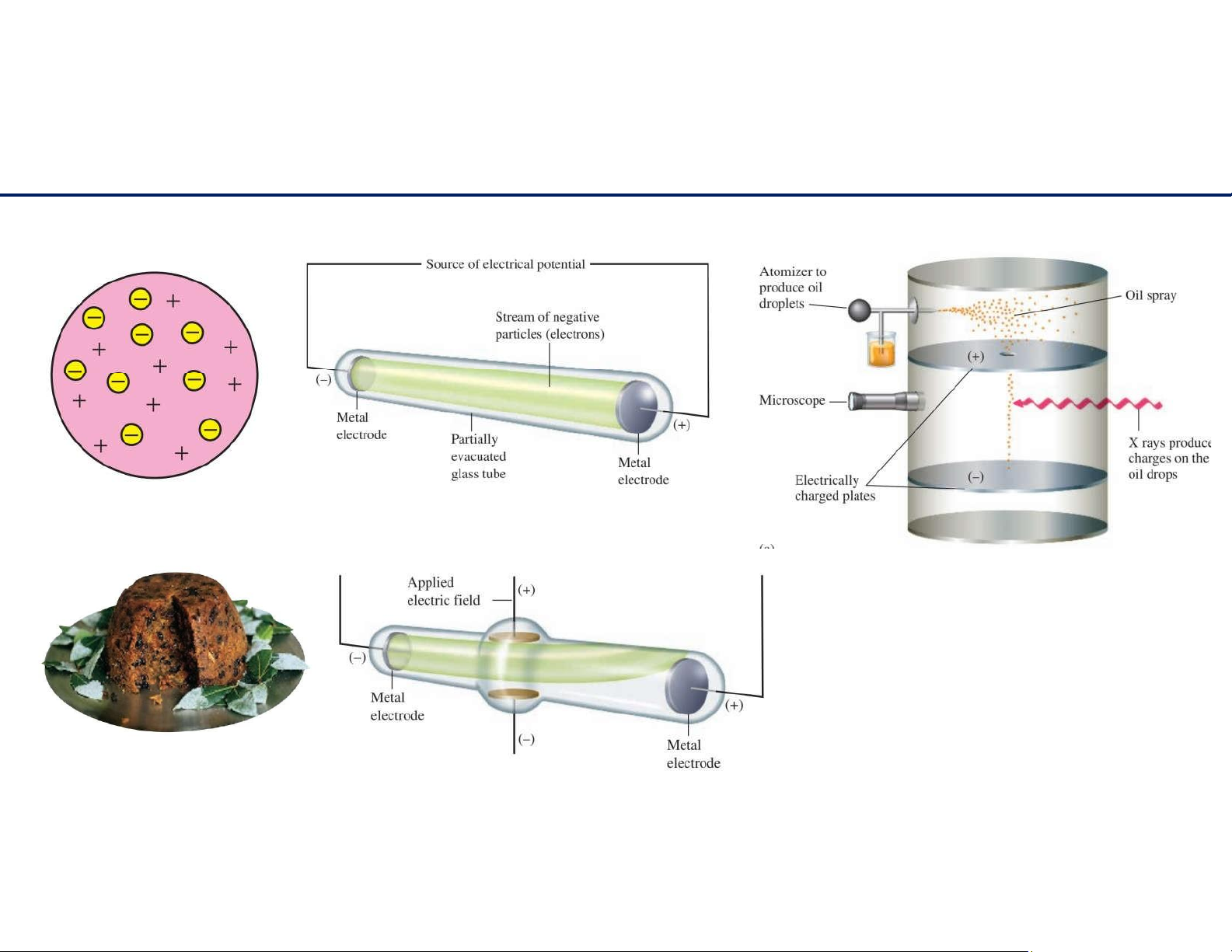
Mô hình nguyên tử Thomson
ThínghiệmRobert Millikan m -31 e = kg 9.11 x 10 3 lOMoAR cPSD| 61622878
Hạt nhân nguyên tử
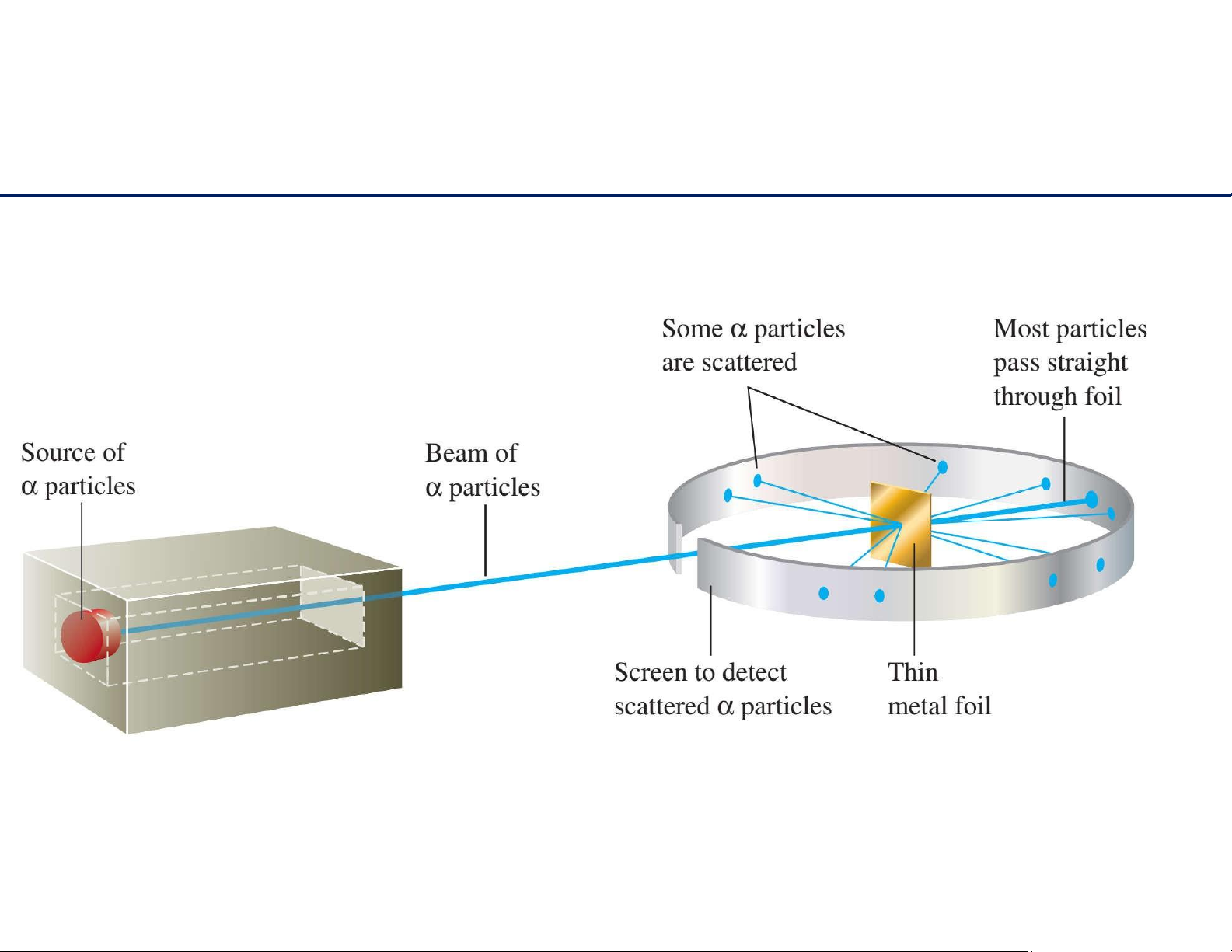
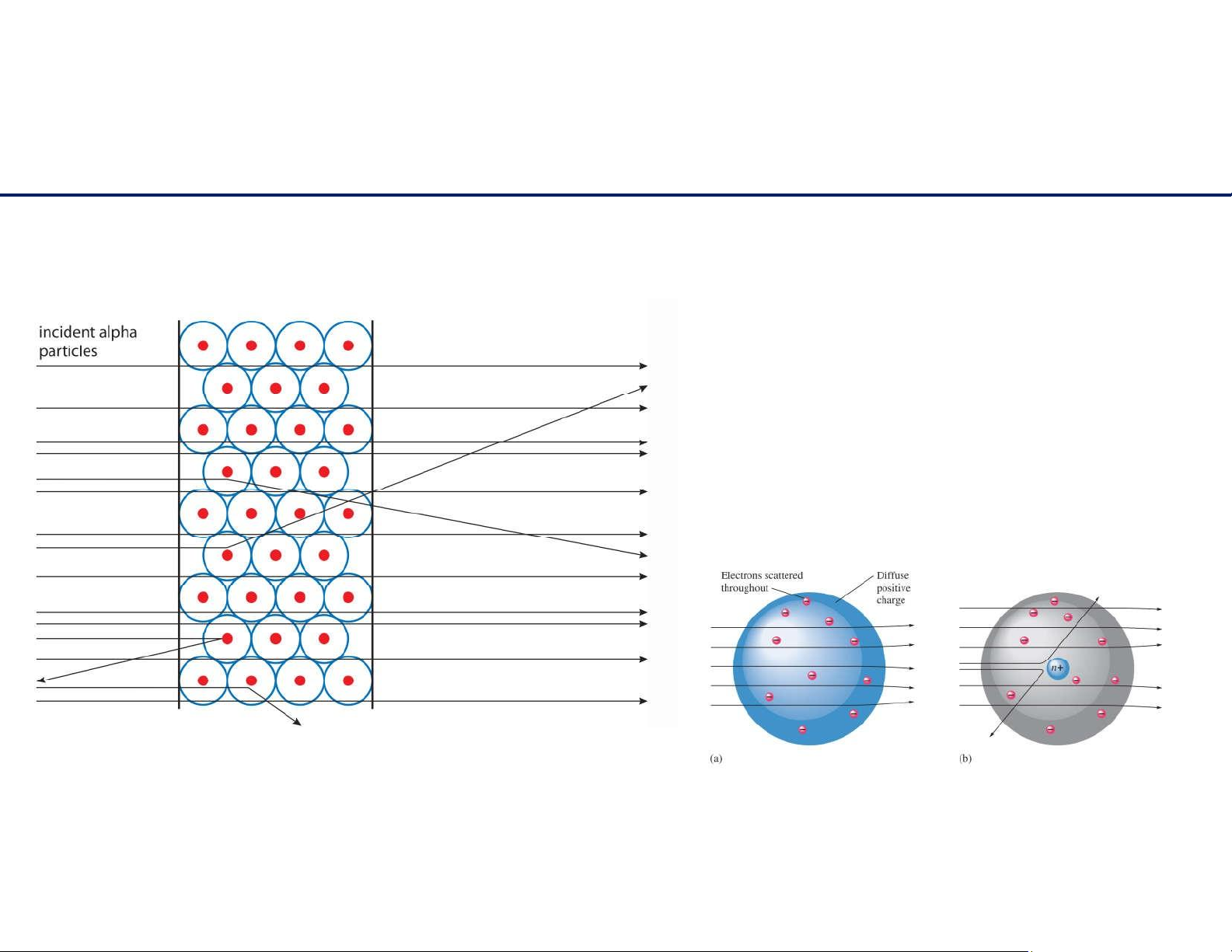
Mô hình nguyên tử Rutherford 4 lOMoAR cPSD| 61622878
Hạt nhân nguyên tử
Mô hình nguyên tử Rutherford
- Phần lớn các tia truyền thẳng: cấu trúcrỗng - Cáctiaphảnxạ: cónhữngđiểm
tíchđiệndươngtrongkhônggian nguyêntử .
- Cáctialólệchhướngdichuyển:
cáchạtelectronmangđiệntíchâm
hútdòngđiệntíchdươngtiatới lOMoAR cPSD| 61622878 5 lOMoAR cPSD| 61622878
Hạt nhân nguyên tử
Môhìnhnguyêntửhiệnđại 6 lOMoAR cPSD| 61622878
Mô hình Bohr : nguyên tử hydrogen
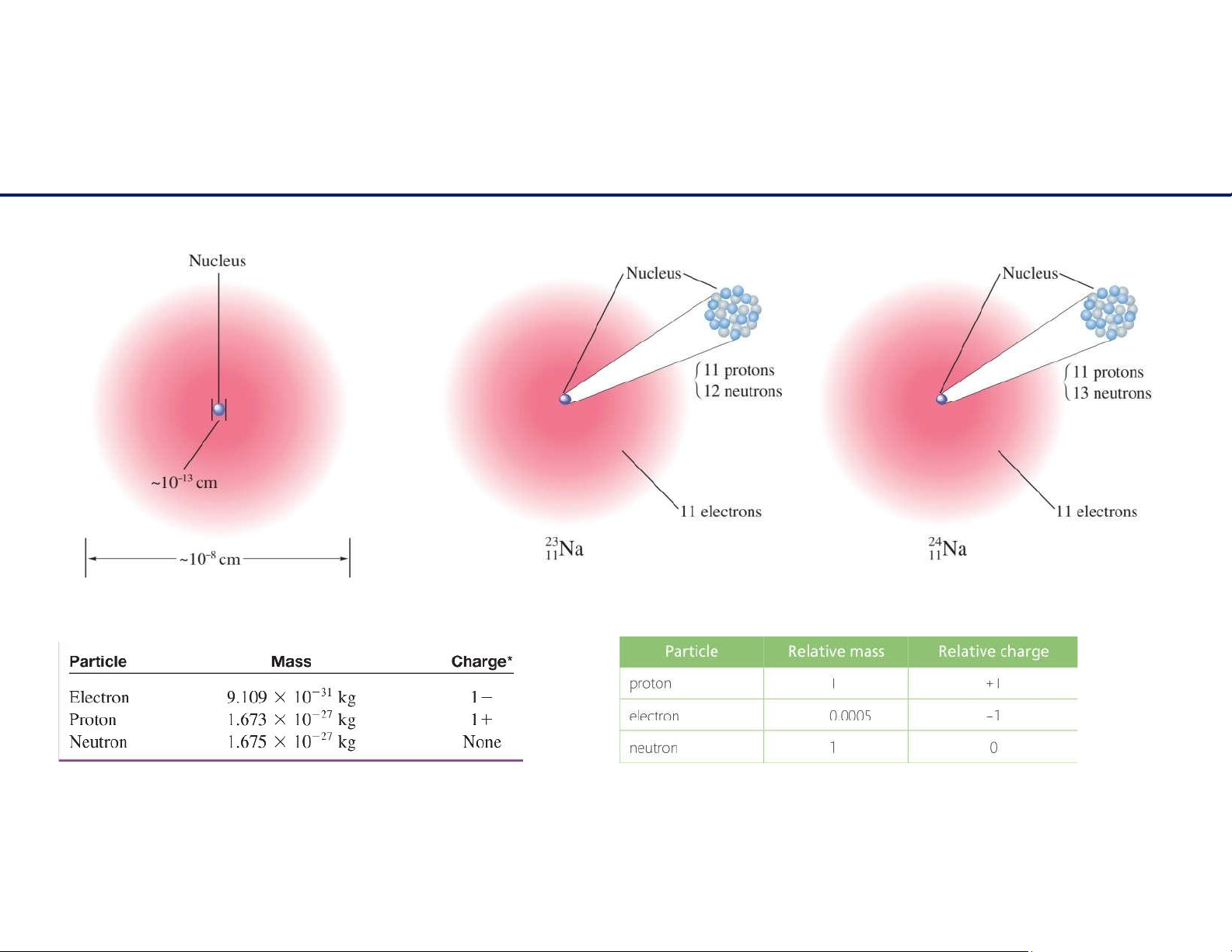
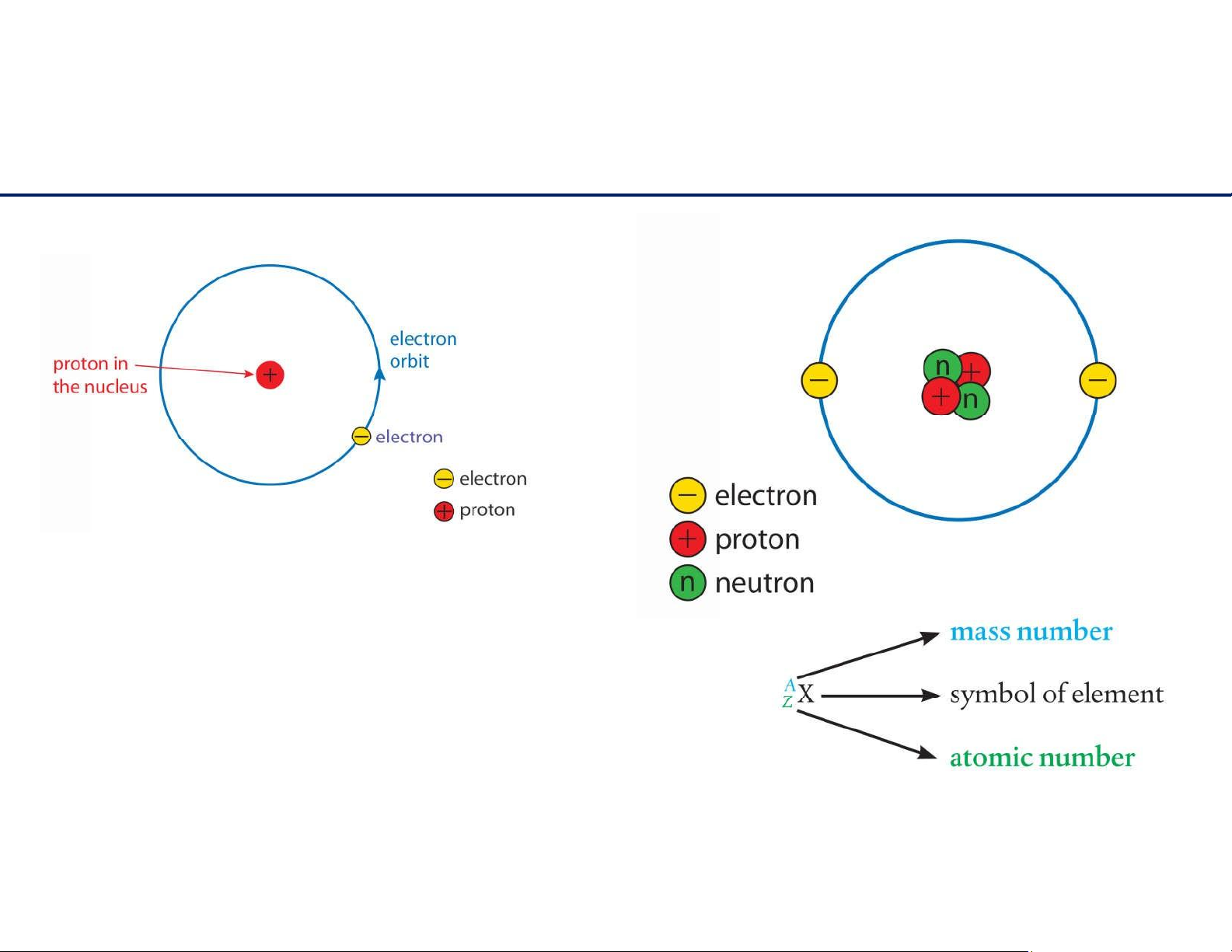
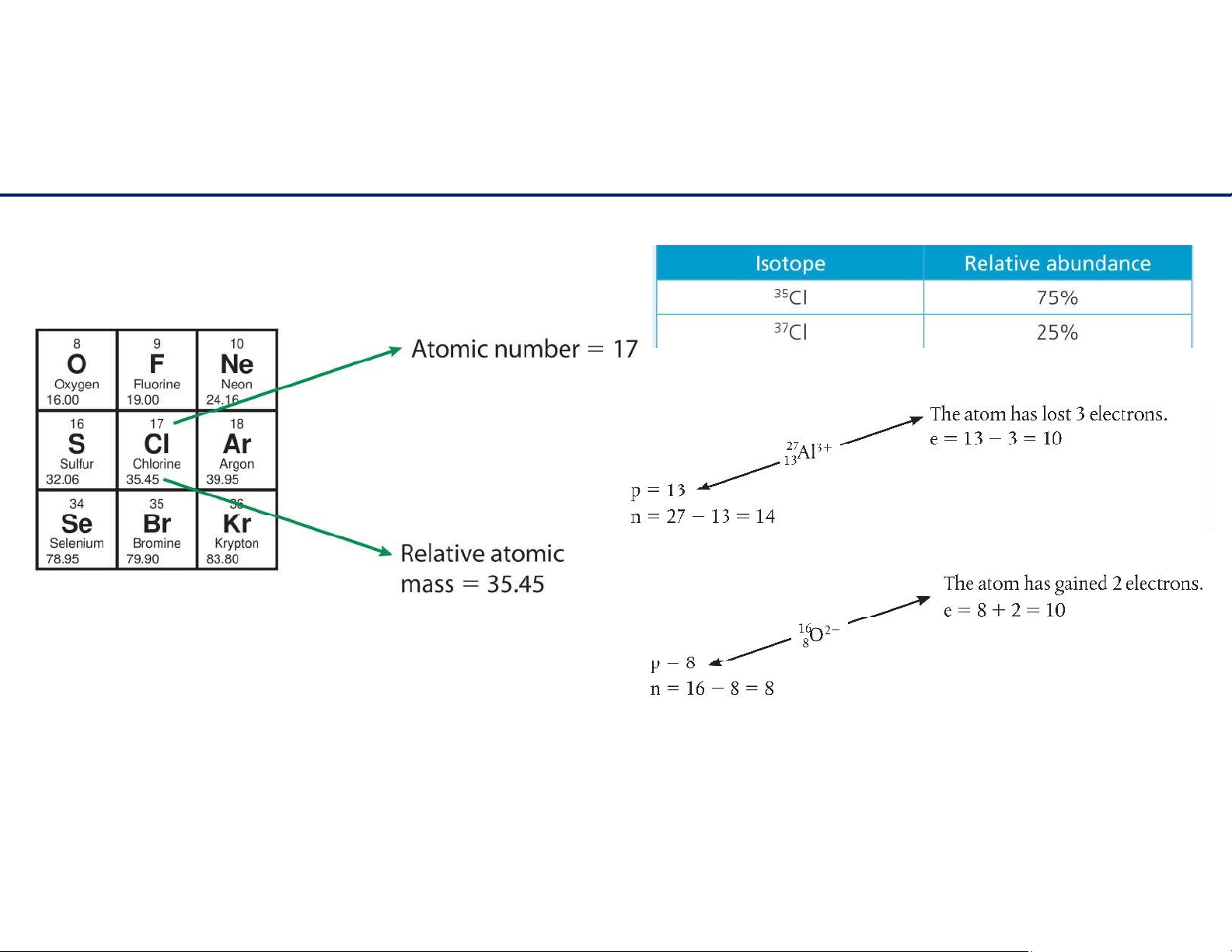
- Sốhiệunguyêntử(Z)=tổngsốprotontronghạtnhân.
- Sốkhối(A)=sốprotons+sốneutrons
- Nguyêntửtrunghòavềđiện:sốprotons=sốelectrons 7 lOMoAR cPSD| 61622878 Đồng vị - Ions
Đồng vị (isotope) là những nguyên tử của cùng một nguyên tố nhưng khác nhau về số neutrons.
Nguyêntửchoelectron tạothànhion dương(cation)
Nguyêntửnhậnelectron tạothànhion âm(anion) 8 lOMoAR cPSD| 61622878 Đồng vị - Ions
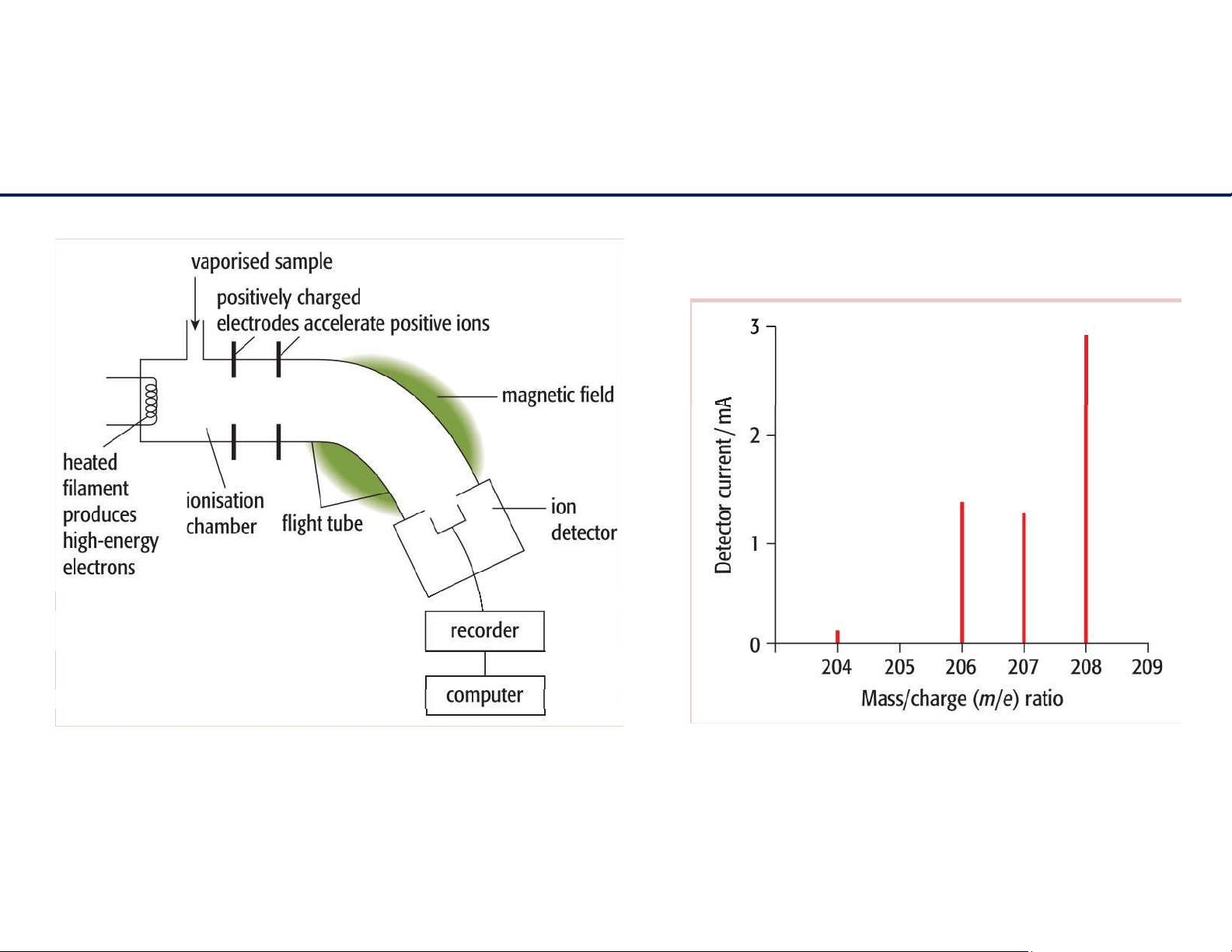
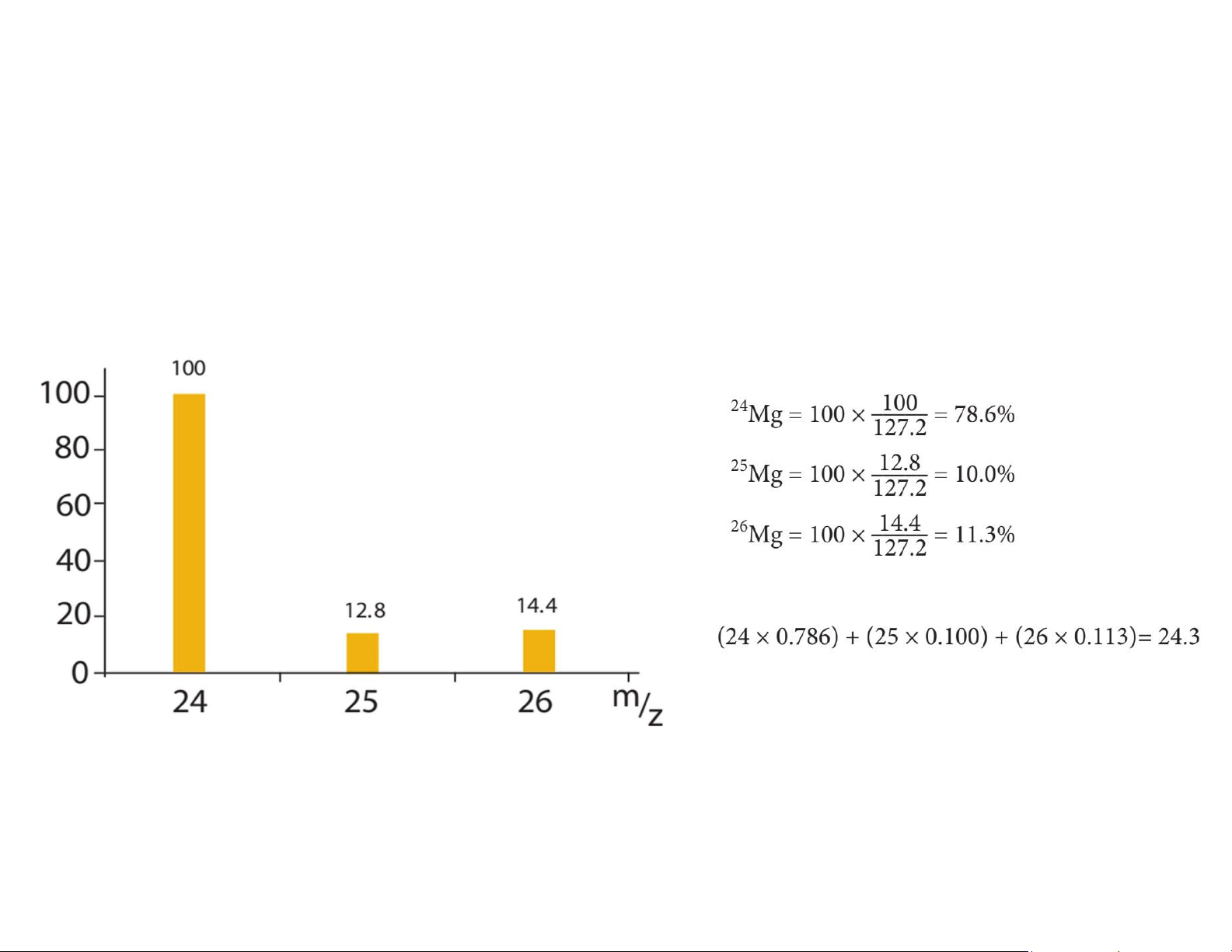
Phổ khối lượng (Mass Spectroscopy) xác định đồng vị 9 lOMoAR cPSD| 61622878
Phổ khối lượng (mass spectrum)
Ví dụ: Từ kết quả phân tích khối phổ của một mẫu kim loại magnesium tinh khiết (phổ đồ bên
dưới), hãy tính khối lượng nguyên tử tương đối trung bình của nguyên tố magnesium
khốilượngnguyêntửtươngđốitrungbình
Phổ khối lượng của nguyên tố magnesium 10 lOMoAR cPSD| 61622878 Cấu hình electron
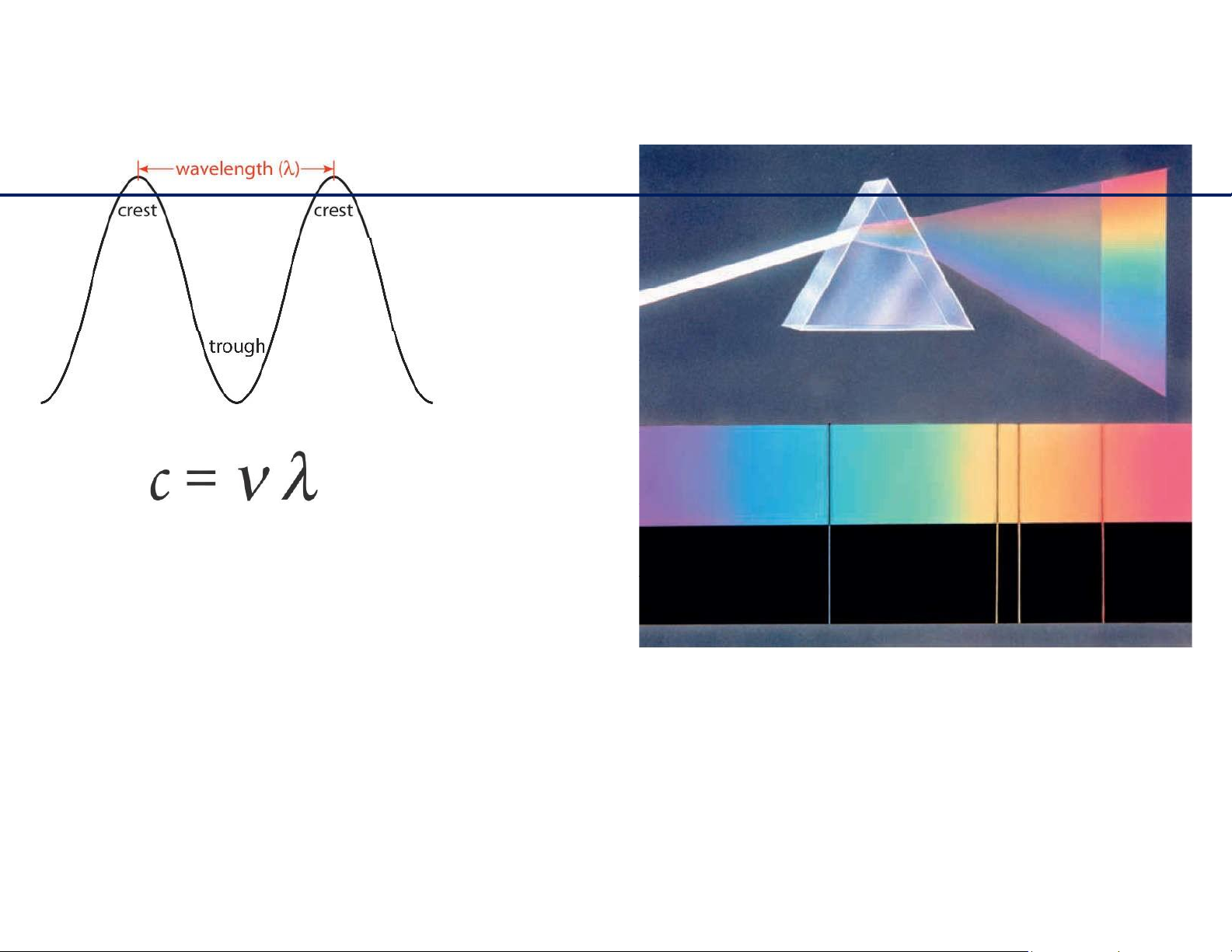
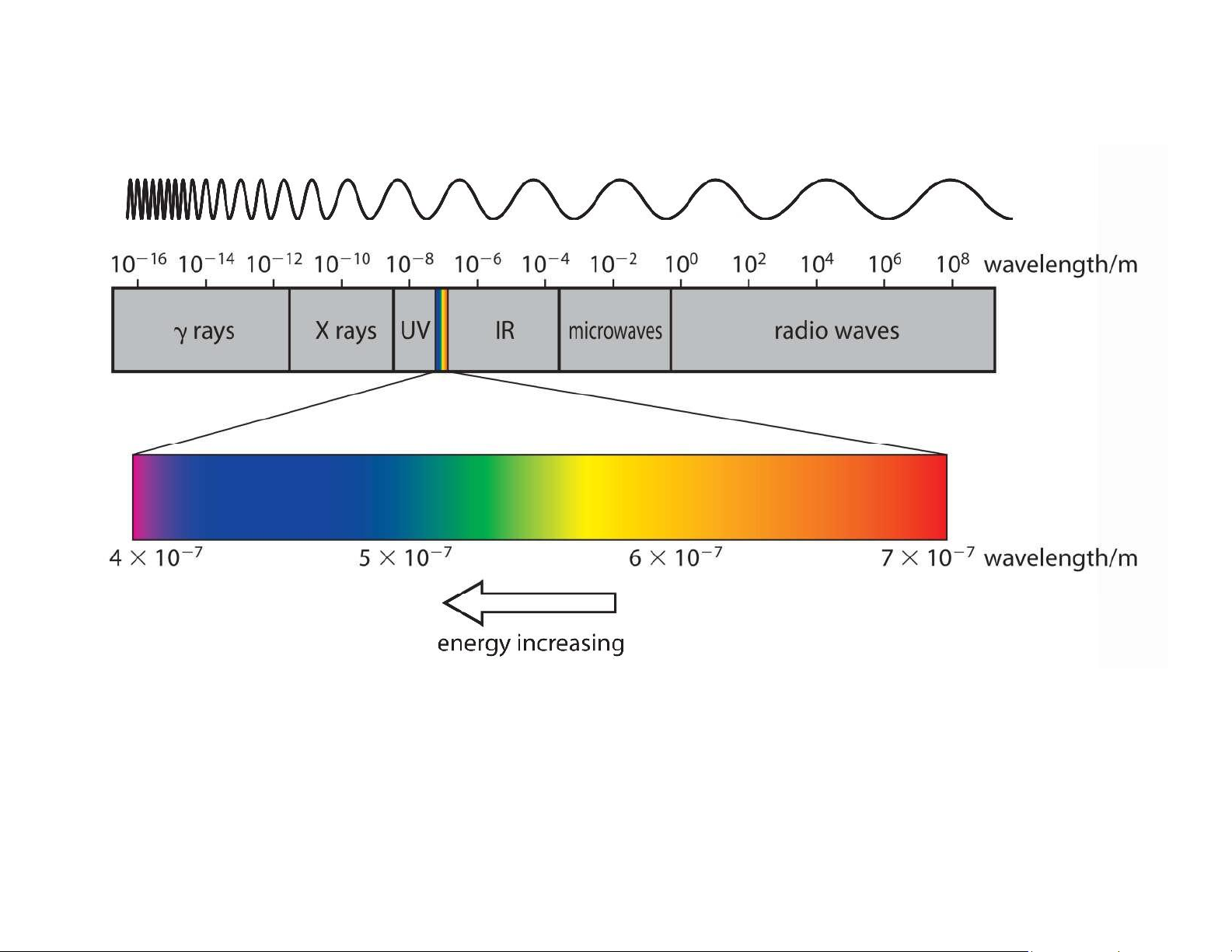
Tại sao đốt nóng hợp chất của (a) sodium; (b) potassium và (c) copper lại cho màu sắc khác nhau? lOMoAR cPSD| 61622878 11 Cấu hình electron Phổ điện từ lOMoAR cPSD| 61622878 Phổ liên tục Phổ vạch 12 Cấu hình electron Phổ điện từ lOMoAR cPSD| 61622878 13 lOMoAR cPSD| 61622878 Cấu hình electron
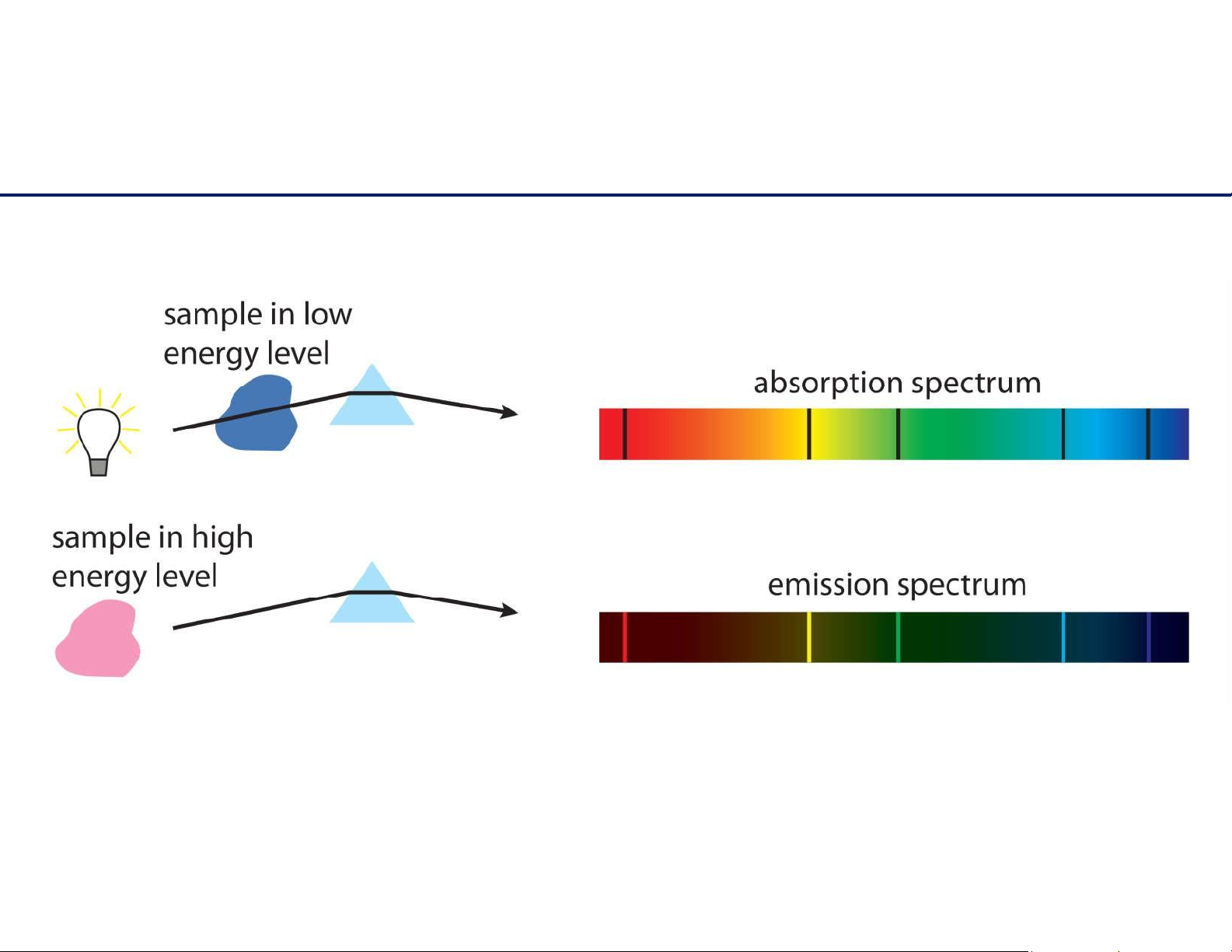
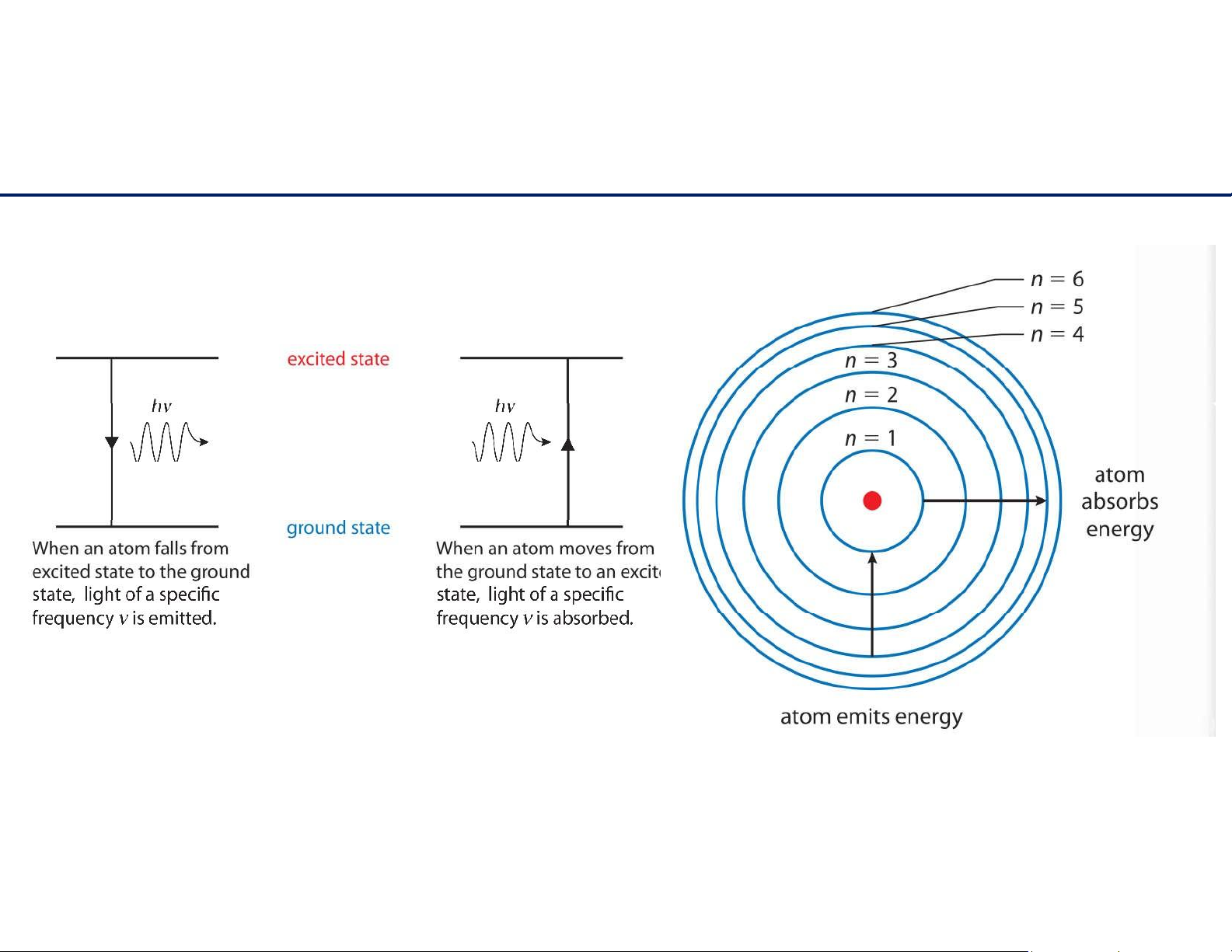
Phổ hấp thu và phổ phát xạ 14 lOMoAR cPSD| 61622878 Cấu hình electron
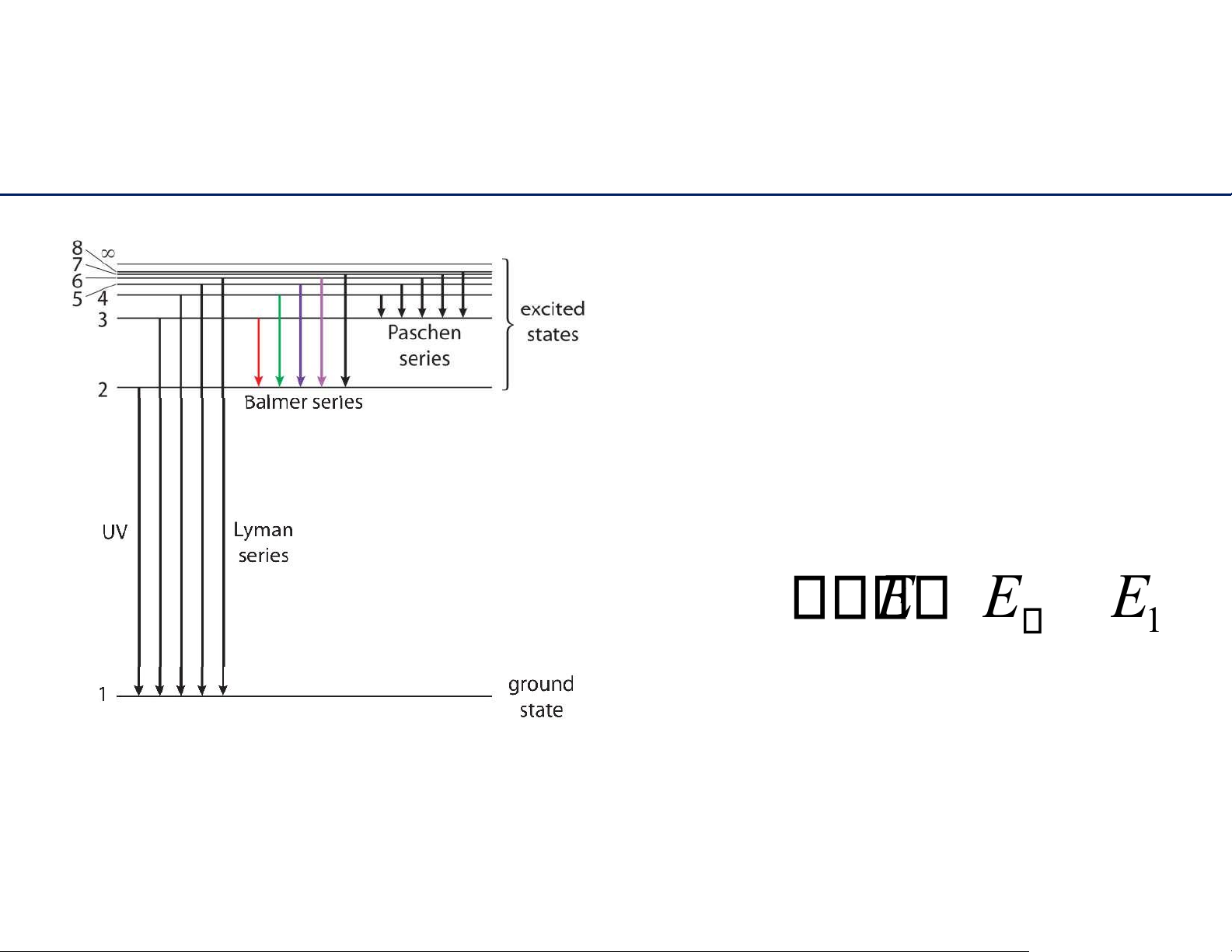
Năng lượng bị lượng tử hóa ➔ Bằng chứng mô hình Bohr về nguyên tử hydrogen 15 lOMoAR cPSD| 61622878 Cấuhìnhelectron
Nănglượngionhóathứnhất của
nguyêntửhydrogenlànănglượngnhỏ
nhất,cầnthiếtđểtách1electronrakhỏi
nguyêntửhydrogenởtrạngtháicơ bản. H(g) + → H ( g) + e I E E E 1 1 16 lOMoAR cPSD| 61622878 Cấu hình electron
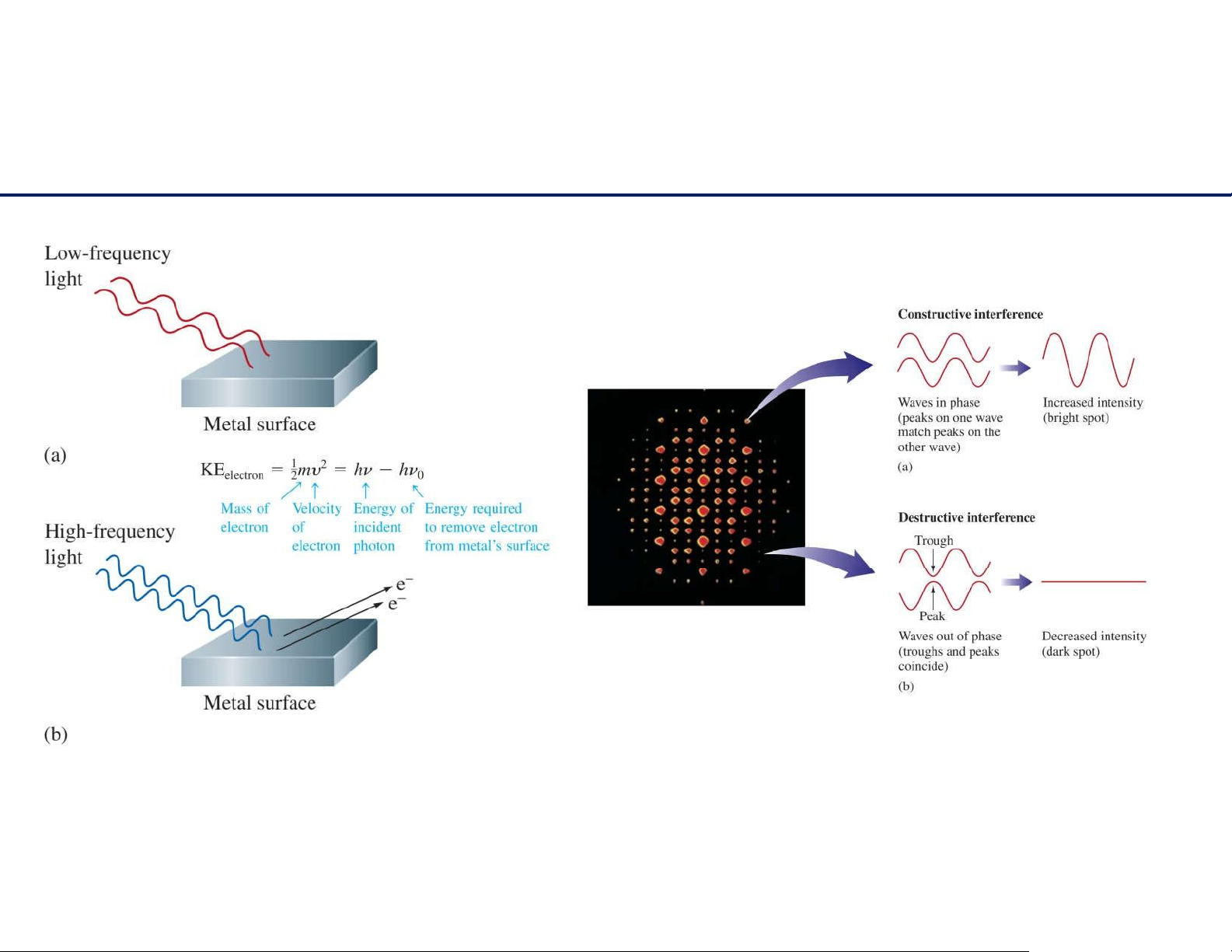
Môhìnhlưỡngtínhsóng–hạt Giao thoa Triệttiêu
Hiệntượngnhiễuxạ
Hiệntượngquangđiện 17 lOMoAR cPSD| 61622878 Cấu hình electron
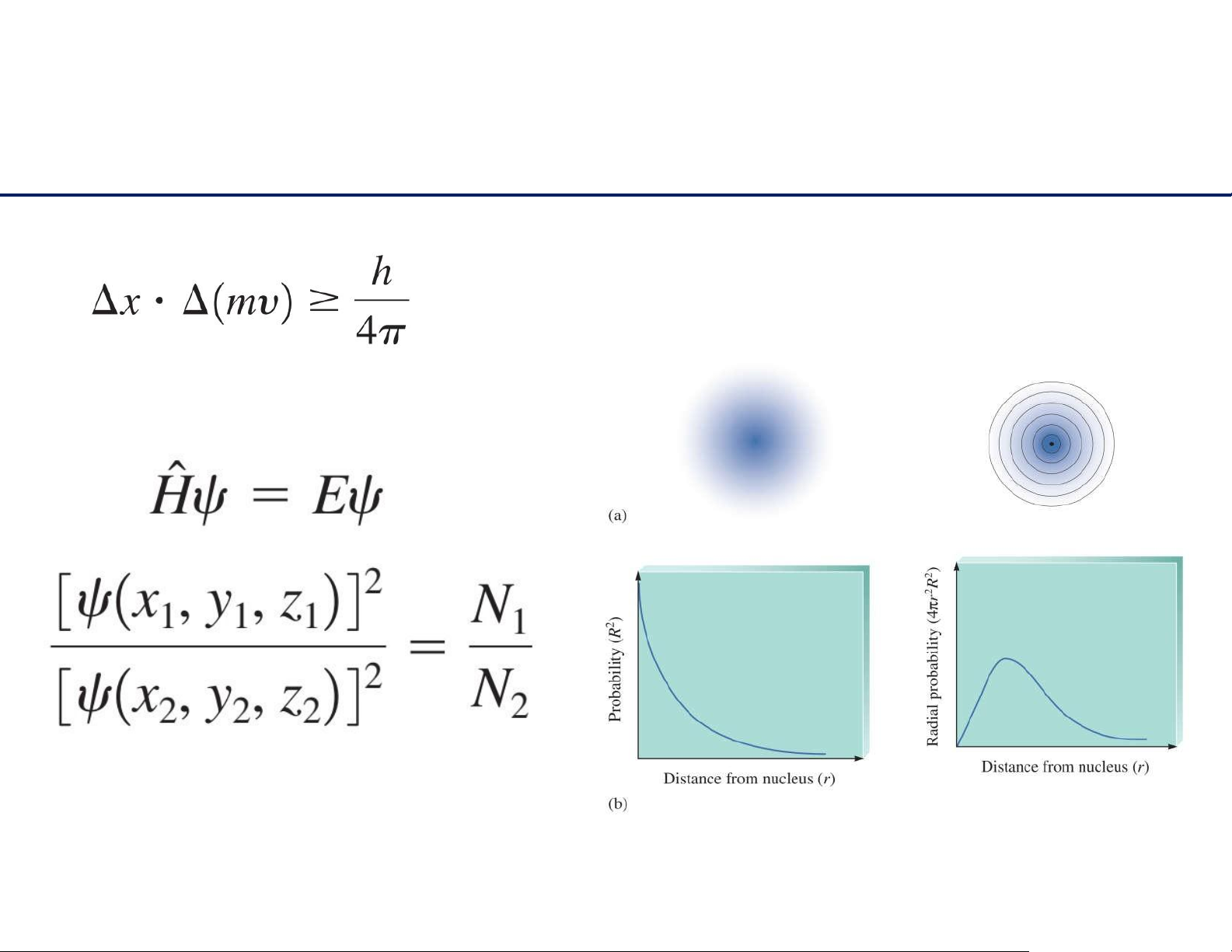
Nguyên lý bất định Heisenberg
Khôngthểxácđịnhchínhxácđồngthờivịtrívàđộnglượng
củahạttrongcùngmộtthờiđiểm.
➔ Xácsuấttìmthấyelectron tạimộtđiểmbằngbao nhiêu?
MôhìnhSchrödinger vềnguyêntửHydrogen 18
