













Preview text:
Chương trình đào tạo
Kỹ sư chất lượng cao tại Việt Nam P . F . I . E . V
Báo cáo thí nghiệm
Học phần: Hóa học PFIEV
Họ và tên sinh viên :……………………………
Lớp :……………………………………………
Mã số sinh viên :………………………………. Tháng năm 2023 1 Chương trình đào tạo
Kỹ sư chất lượng cao tại Việt Nam P . F . I . E . V HOÁ HỌC BÀI 0 MỞ ĐẦU
MỘT VÀI QUY TẮC LÀM VIỆC
SAI SỐ CỦA THIẾT BỊ
KIỂM ĐỊNH CÁC DUNG DỊCH AXÍT MẠNH VÀ BAZƠ MẠNH 1. QUY TẮC LÀM VIỆC 1.1 TỔ CHỨC CHUNG 1.1.1 Chỗ làm việc
Chỗ làm việc phải luôn sạch sẽ. Phải sẵn có khăn lau. 1.1.2 Các dung dịch
Mỗi một dung dịch cần có nhãn với tên gọi và nồng độ.
1.2 SỬ DỤNG TỐT DỤNG CỤ THUỶ TINH
Các quy tắc sử dụng là đơn giản, có giá trị trong từng giai đoạn và cho toàn bộ thao tác hóa học. Cần nhớ: 1.2.1 Sạch sẽ
Đồ thủytinh được rửa thường xuyên bằng nước ở vòi. Phân biệt hai mức độ sạch:
a) súc rửa bằng nước cất
b) súc rửa bàng chính dung dịch sẽ được chứa trong dụng cụ
1.2.2 Sự chảy của pipette
Pipette được giữ thẳng đứng.
Thành bình đựng để nghiêng 45o
Đầu của pipette tiếp xúc với thành bình
1.2.3 Đọc thể tích
Trên các pipette và bình định mức, thể tích được đánh dấu bằng vạch. Cần nhìn theo phương
nằm ngang tiếp tuyến với đáy mặt cong trùng với vạch xác định thể tích.
✓ Bình định mức được sử dụng để chuẩn bị dung dịch cho chuẩn độ hoặc hoà tan theo tỷ
lệ cho trước. Mức chuẩn của bình định mức là bình chứa một thể tích xác định của chất
lỏng. Khôngđược sử dụng bình định mức dể lấy một thể tích xác định vì sai số sẽ bằng
lượng chất lỏng còn bám trên thành bình.
✓ Pipette và burette được chuẩn hoá sao cho thể tích đã lấy là thể tích xác định.
Lưu ý: Bài thí nghiệm số 0 sẽ làm cùng một buổi với bài thí nghiệm số 2 / Bài 1 và 3 sẽ làm cùng một buổi 2
SAI SỐ CỦA ĐỒ THUỶ TINH 1.2 PIPETTE
Sai số bằng ‘x” ml: là sai số đối với thể tích tiêu thụ / sử dụng Dung tích, ml 0,01 vµ 0,05 0,1 0,2 0,5 1 Loại A 0,003 0,001 0,002 0,006 0,010 Loại B 0,0045 0,0015 0,003 0,009 0,015 Dung tích, ml 2 5 10 20 25 Loại A 0,010 0,020 0,040 0,060 0,0060 Loại B 0,015 0,030 0,060 0,090 0,090 2.2 BURETTE
Sai số bằng ‘x” ml: là sai số đối với thể tích tiêu thụ / sử dụng Dung tích, ml 10 10 10 25 25 50 100 Chia độ, ml/ độ 1/10 1/20 1/50 1/10 1/20 1/10 1/5 Loại A 0,02 0,02 0,02 0,03 0,03 0,05 0,08 Loại B 0,03 0,03 0,03 0,045 0,045 0,075 0,12
1.3 BÌNH ĐỊNH MỨC
Sai số bằng ‘x” ml: là sai số đối với thể tích chứa Dung tích, ml 5 vµ 10 20 vµ 25 50 100 250 500 1000 Loại A 0,02 0,03 0,06 0,10 0,20 0,25 0,40 Loại B 0,04 0,06 0,09 0,15 0,30 0,40 0,60
2. KIỂM ĐỊNH DUNG DỊCH AXÍT VÀ BAZƠ MẠNH Đồ thuỷ tinh: loại B
Độ chính xác của mẫu cân: 1/ 100 g (trong điều kiện này, cân ít hơn một gam sẽ không chính xác )
3.1 Kiểm định dung dịch axít mạnh
Trong trường hợp không có KHCO3 thì sử dụng dung dịch NaOH (xút) được chuẩn ở mục 3.2 để thay cho
dung dịch hydrocabonat kali (KHCO3)
Các dung dịch axít clohydric hoặc sulfuric được chuẩn bị từ các dung dịch thương phẩm đậm đặc không
có nồng độ chính xác. Do đó cần sử dụng một chất chuẩn: Hydrocabonat Kali (KHCO3), khan,
tinh khiết phân tích (Analytical Reagent – AR).
• Khối lượng mol: M = 100,1 g.mol-1 • HCO - 3 / CO2 . H2O pKa = 6,4
3.1.1 Chuẩn bị 100 ml dung dịch chuẩn KHCO -1 3 0,1 mol.l
• Cân chính xác 1,00 g KHCO3
• Cho lượng tinh thể đó vào bình định mức 100 ml
• Đổ nước cất vào tới một nửa bình • Hoà tan
• Cho nước đầy đến vạch 100 ml • Lắc cho đều 3
3.1.2 Chuẩn độ dung dịch HCl nồng độ vào khoảng 0,1 mol.l -1 • Phản ứng: HCO -
3 + H3O + → (CO2 , H2O ) + H2O •
Lắp thiết bị: burette 25 ml, máy khuấy từ, bình 100 ml •
Chỉ thị màu: hélianthine •
Điều kiện: Chuẩn độ nguội với Méthyl Da cam (Hélianthine), khi tới điểm tương đương
thì chuyển từ màu vàng sang màu hồng (có nghĩa là khi phản ứng kết thúc) • Tính toán: Đặt
HCl Ve: thể tích tại điểm tương đương và CHCl: nồng độ HCO - -2
3 Thể tích là Vb và nồng độ là Cb = 10 mol.L-1
Biểu thức tỷ lượng tại điểm tương đương: CHCl Ve = Cb Vb Kết quả: 10−2. 𝑉 𝐶 𝑏 𝐻𝐶𝑙 =
𝑚𝑜𝑙. 𝐿−1 ± 0,003 𝑚𝑜𝑙. 𝐿−1 𝑉𝑒
Ghi kết quả của nồng độ dung dịch chuẩn NaOH:…………. mol.l-1
3.2 CHUẨN ĐỘ DUNG DỊCH BAZƠ MẠNH •
Dung dịch xút được chuẩn bị từ xút dạng viên được rửa bằng nước cất đun sôi để nguội
(để loại trừ cacbonat natri) hoặc từ nước xút thương phẩm không có nồng độ chính xác.
Cần phải chuẩn độ để xác định nồng độ của chúng bằng dung dịch chuẩn axít oxalic H2C2O4 .2 H2O • Khối lượng mol: M = 126,08 g. mol - 1 • H - 2- 2C2O4 / HC2O - 4 pKa1 = 1,2;
HC2O4 / C2O4 pKa2 = 4,3
3.2.1 Chuẩn bị 100 ml dung dịch chuẩn H -1 2C2O4 0,1 mol.l •
Cân thật chính xác 1,26 g axít oxalic •
Cho lượng tinh thể đó vào bình định mức 100ml •
Đổ nước cất vào tới một nửa bình • Hoà tan •
Cho nước đầy tới vạch 100 ml • Lắc đều
3.2.2 Chuẩn độ dung dịch NaOH nồng độ vào khoảng 0,1 mol.l-1 • Phản ứng: H 12,8 2C2O4 + OH - - → HC2O4 + H2O K = 10 phản ứng hoàn toàn HC - - 2O4 + OH → C2O 2-
4 + H2O K = 10 9,7 phản ứng hoàn toàn •
Lắp thiết bị: Burette 25 ml, bình 100 ml, máy khuấy từ, pipette 10 ml, phenolphtalein •
Điều kiện: Chuẩn độ nguội •
Điểm tương đương (kết thúc phản ứng) đạt được khi phenolphtalein chuyển từ không màu sang màu hồng • Tính toán: Đặt
Na +OH - Ve: thể tích tại điểm tương đương và COH - là nồng độ NaOH H -2 -1
2C2O4 Thể tích VA và nồng độ Ca = 10 mol.L
Biểu thức tỷ lượng tại điểm tương đương COH - Ve = 2 Ca Va Kết quả: −2 𝐶 𝑎
𝑂𝐻− = 2ì10 .𝑉 𝑚𝑜𝑙. 𝐿−1 ± 0,003 𝑚𝑜𝑙. 𝐿−1 𝑉𝑒
Ghi kết quả của nồng độ dung dịch chuẩn NaOH:…………. mol.l-1 4 Chương trình đào tạo
Kỹ sư chất lượng cao tại Việt Nam P . F . I . E . V ho¸ häc Bµi 1
Nghiªn cøu ®éng häc b»ng phÐp ®o ®é dÉn
Phản ứng nghiên cứu là phản ứng xà phòng hoá axêtat êtyl.
CH3COOC2H5 + Na+ OH- → CH3COO- + Na+ + C2H5OH
axêtat êtyl xút axêtat natri êtanol
Mục đích của bài thực hành là chứng minh rằng phản ứng là bậc một đối với từng chất bằng cách theo
dõi sự thay đổi của tính dẫn hay độ dẫn theo thời gian. 1. Lý thuyÕt
Xuất phát từ các chất theo tỷ lệ phù hợp với phương trình tỷ lượng. Đặt C0 là nồng độ ban đầu
chung cho các chất và C0 - x(t) là nồng độ của chúng tại thời điểm t.
Chứng minh rằng quy luật của vận tốc tuân theo công thức 𝑥 = 𝑘𝑡 𝐶0(𝐶0−𝑥)
Đặt 0, t, là độ dẫn của dung dịch tại thời điểm 0, t và Chứng minh rằng 𝜎 𝜎 = 0 − 𝜎 + 𝜎 𝑘𝐶 ∞ 0𝑡
Khi đó là một hàm tuyến tính theo (0 - )/t với độ dốc là 1/ kC0 và tung độ xuất phát điểm là . 2. THỰC HÀNH
2.1. Bố trí thiết bị thực hành và cách vận hành
Sử dụng các bình định mức. Tuân thủ cách làm sạch và đọc thể tích. Để sử dụng phần tử đo của
máy hãy đọc tài liệu về phép đo độ dẫn.
Bình chứa hỗn hợp ban đầu các chất Phần tử đo Máy đo độ dẫn
Thỏi nam châm (Con từ để khuấy) Máy khuấy từ 5
Bình định mức được sử dụng để nhúng vào chậu làm lạnh và trộn lẫn nhanh chóng các chất lúc phản ứng
bắt đầu để giảm thiểu sự bất định của thời điểm t = 0.
Thực tế là thể tích không cần chính xác.
2.2. Tiến hành thực hành Nhiệt kế Bình định mức
Hổn hợp nước - nước đá Dung dịch A Dung dịch B
☞ Đo nhiệt độ của môi trường a
☞ Đổ vào một bình định mức 50 ml dung dịch A, vào một bình khác dung dịch B, ở nhiệt độ a.
☞ Nhúng các bình định mức vào hỗn hợp nước và nước đá để đưa nhiệt độ của các dung dịch tới giá
trị a - 10 0 C. Điều này được giải thích trong chú thích sau đây
Chú thích về kiểm soát nhiệt độ:
• Phản ứng được thực hiện bằng cách trộn lẫn hai dung dịch A và B
• Dung dịch A: 50 ml xút 4.10 -2mol.l -1 trong dung môi nước
• Dung dịch B: 50 ml axêtat êtyl 4.10 -2mol.l-1 trong dung môi là êtanol tuyệt đối để tránh phản ứng thuỷ phân
2. Sự trộn lẫn các dung môi toả nhiệt và làm cho nhiệt độ tăng ngay lập tức lên khoảng 10oC.
3. Nếu các dung dịch A và B trước khi trộn lẫn được đưa xuống nhiệt độ a - 10 0 C bằng cách nhúng
vào chậu nước đá - nước thì sau đó nhiệt độ của nơi phản ứng sẽ được giữ không đổi bằng
a 10 C trong suốt quá trình đó. Do đó không cần thiết phải ổn định nhiệt.
4. Các bước tiến hành
☞ Lấy các bình ra khỏi chậu làm lạnh. Nhiệt độ lúc này là 0 a - 10 C
☞ Rót dung dịch B vào bình đo
☞ Đưa phần tử đo vào bình và khuấy dung dịch
☞ Đặt máy đo độ dẫn ở thang + 5mS cm -1
☞ Rót dung dịch A rồi bật máy đo thời gian
☞ Ghi giá trị ban đầu 0 của Làm nhanh ☞ Ngừng khuấy
☞ Đo các giá trị độ dẫn trong vòng một giờ tại các thời điểm khác nhau 6
2.3. Xử lý kết quả
Lập bảng các giá trị đo được T, phút 0 (0 - )/ t
Vẽ đồ thị phụ thuộc vào (0 - )/ t.
• Kết luận về sự phù hợp của quy luật vận tốc đã đề xuất
• Tính giá trị của k ở nhiệt độ a
• Tính tỷ số 𝜎0 để so sánh với bảng độ dẫn tương đương - giới hạn 𝜎∞
• Còn phải so sánh giá trị đó với tỷ số nào của độ dẫn mol ion tương đưong giới hạn ?
3. KẾT QUẢ THỰC NGHIỆM
3.1. Bảng các giá trị đo -1
a = ……………oC o =……….. mS.cm t, phút 0 8 10 15 20 25 30 35 40 , mS. cm-1 t, phút 45 50 55 60 65 70 75 80 85 , mS cm-1 3.2. Đồ thị
Vẽ đồ thị biểu diễn sự phụ thuộc của vào (0 - )/ t.
phụ thuộc vào (0 - )/t 7 3.3. Kết luận
• Mô hình bậc 1 theo từng chất tham gia phản ứng có đáp ứng hay không?
........................ ........................................................ ..................................................................................
........................ ........................................................ ................................................................ .................
........................ ........................................................ ..................................................................................
• Các giá trị đo được của hằng số vận tốc k :
........................ ........................................................ ..................................................................................
........................ ........................................................................................ ..................................................
........................ ........................................................ ..................................................................................
• So sánh tỷ số 𝜎0 với giá trị lý thuyết 𝜎∞
𝜎0 = 𝐶0(𝜆𝑜𝑁𝑎++𝜆𝑜𝑂𝐻−) = 𝐶 50.1 + 199.1 /1000 S.cm-1 1000 0( ) 𝜎∞ = 𝐶0(𝜆𝑜 𝑜 𝑁𝑎+ + 𝜆 𝐶𝐻 50.1 + 40.9 /1000 S.cm-1.
3𝐶𝑂𝑂−)/1000 = 𝐶0( )
Do đó 𝜎0 = 2,78 trong nước ở 250C 𝜎∞
........................ ........................................................ ..................................................................................
........................ ...........................................................................................................................................
4. DANH MỤC THIẾT BỊ VÀ HOÁ CHẤT
4.1 Thiết bị cho từng bàn của thí nghiệm của sinh viên • 1 máy đo độ dẫn •
1 phần tử đo và giá đỡ •
1 máy khuấy từ và thỏi nam châm • 1 nhiệt kế • 1 cốc kết tinh • 2 bình định mức 50 ml • 1 máy đo thời gian • 2 pipette không chia độ • 1 bình 150 ml cổ rộng •
1 bình 50 ml đựng nước cất và màng chất dẻo • 1 bình tia nước cất •
giấy Joseph được cắt sẵn
4.2 Hoá chất cho từng bàn thí nghiệm •
1 lọ 100 ml xút 4.10 -2 mol.l -1 trong nước •
1 lọ 100ml axêtat ethyl 4.10 -2 mol.l -1 trong êtanol tuỵệt đối 8 Chương trình đào tạo
Kỹ sư chất lượng cao tại Việt Nam P . F . I . E . V HOÁ HỌC BÀI 2
CHUẨN ĐỘ CÁC AXÍT BẰNG PHÉP ĐO PH
Mục đích của bài thực hành là xác định nồng độ của một dung dịch axít bằng cách sử dụng sự thay
đổi pH của nó trước và sau điểm tương đương trong quá trình chuẩn độ bằng một dung dịch xút có
nồng độ đã biết. Một axít mạnh, axít clohydric và một axít yếu etanoic sẽ được chuẩn độ.
Đặt A là axít (HCl hoặc CH3COOH) với nồng độ CA và B là xút với nồng độ đã biết là CB. 1. LÝ THUYẾT
Trong bài thực hành này, việc xác định nồng độ chưa biết CA được thực hiện bằng phép đo pH. Cần
quan tâm trước tiên tới phản ứng chuẩn độ và sau đó là việc xác định điểm tương đương.
1.1. Các phản ứng chuẩn độ
Viết các phương trình phản ứng
Cho biết giá trị K, hằng số của từng phản ứng. Kết luận về mặt định lượng của phản ứng
(phản ứng được coi là hoàn tòan, theo ước tính sơ bộ, nếu như K > 10 3)
Viết biểu thức tỷ lượng tại điểm tương đương.
Rút ra biểu thức tính của CA.
1.2. Xác định điểm tương đương trong phép đo pH
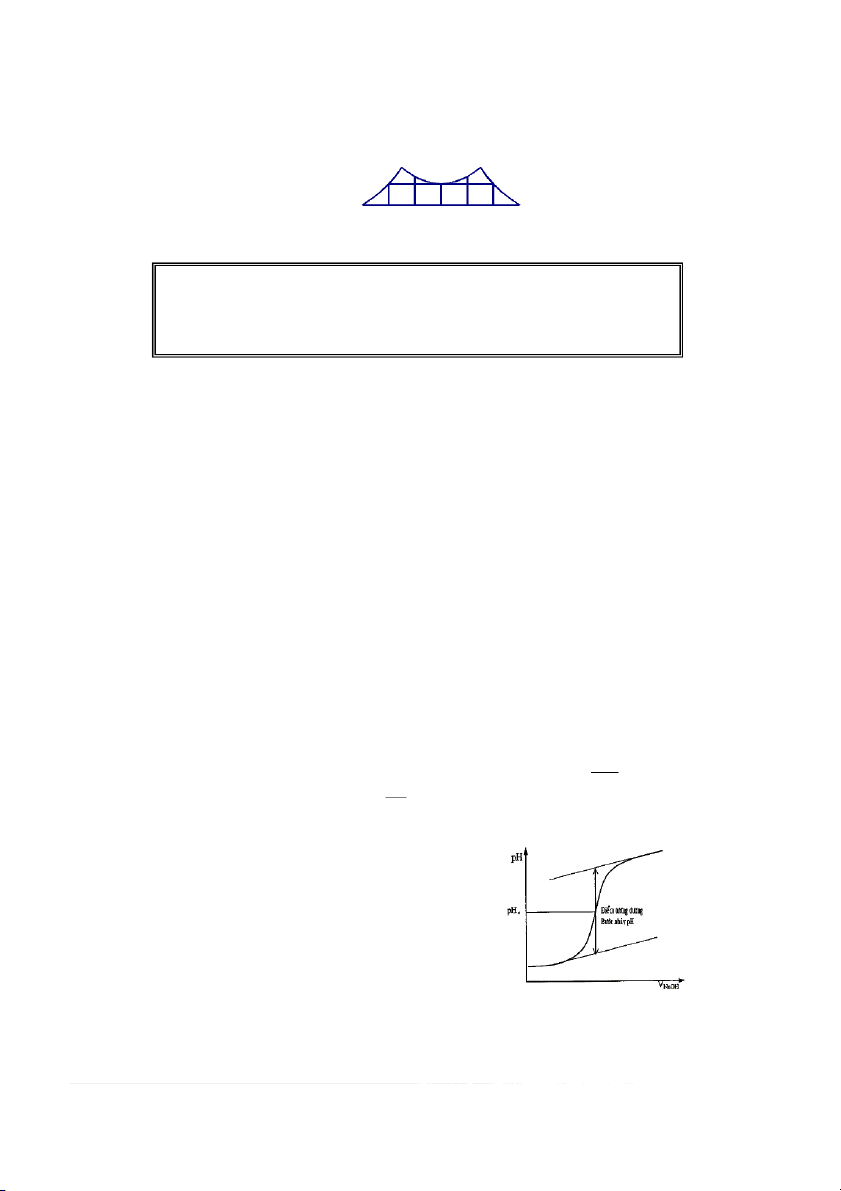
Việc nghiên cứu đường cong pH = f (v) chỉ ra rằng điểm tương đương là : • một điểm uốn •
tâm đối xứng trong chuẩn độ một axít mạnh bằng một bazơ mạnh
Việc xác định điểm tương đương có thể được thực hiện bằng hai cách :
• Nghiên cứu tiếp tuyến uốn bằng cách tính đạo hàm bậc hai𝑑2𝑝𝐻 hoặc theo cực 𝑑𝑣2
trị của đạo hàm bậc nhất 𝑑𝑝𝐻. Công việc này được hỗ trợ bằng việc sử dụng phần 𝑑𝑣
mềm SOLWIN (không thực hiện). •
Sử dụng cách xác định bằng đồ thị :
Phương pháp tiếp tuyến.
Phương pháp này phù hợp với đường cong đối
xứng trong trường hợp chuẩn độ axít mạnh bằng bazơ
mạnh. Tuy nhiên, nếu đường cong gần như đối xứng
thì cũng có thể áp dụng phương pháp này. 9 2.THỰC HÀNH
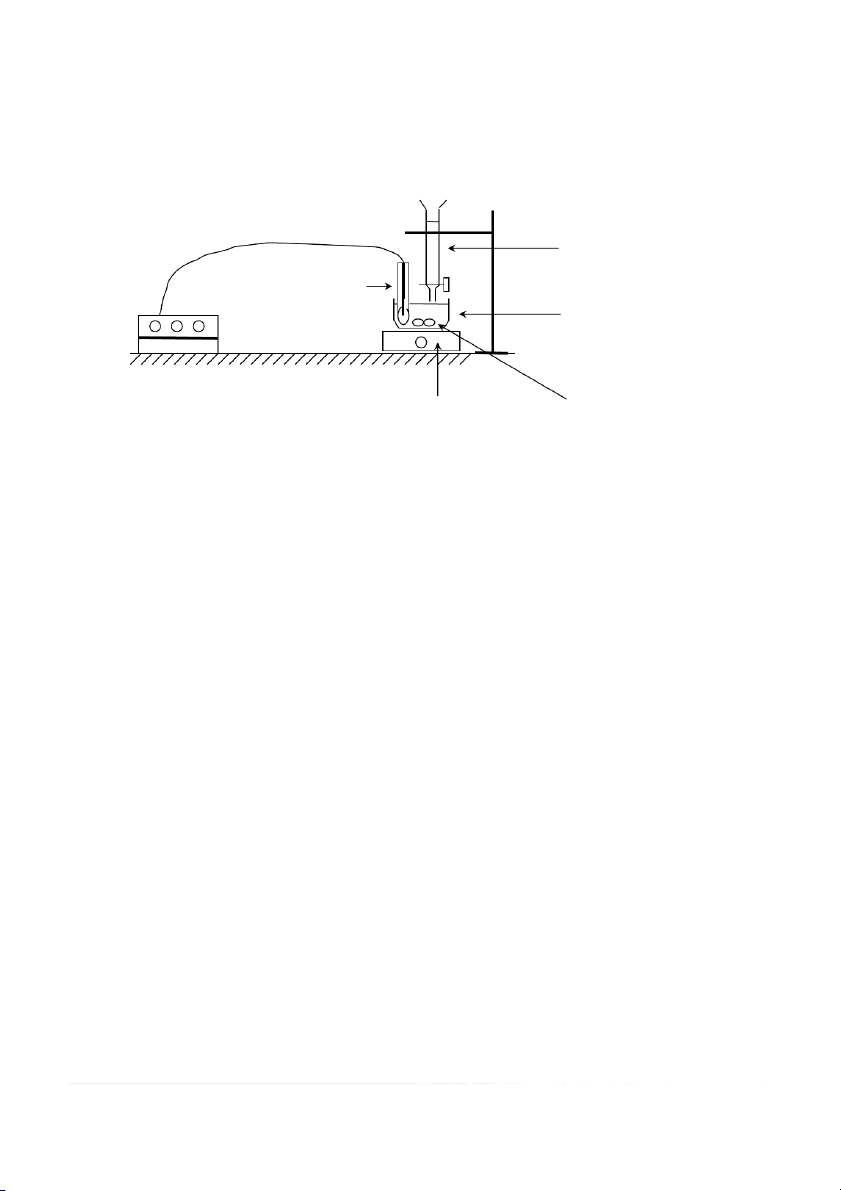
2.1. Thiết bị thí nghiệm Chất chuẩn độ B
Điện cực so sánh thuỷ tinh
Chất được chuẩn độ A Millivonmet
Máy khuấy từ Thỏi nam châm (Con từ để khuấy)
2.2. Ghi nhớ về vận hành
• Sử dụng đồ thuỷ tinh :
Đồ thuỷ tinh chính xác dùng trong bài này : pipette và burette tuân thủ các ghi nhớ về
việc lấy chất lỏng và đọc thể tích.
• Sử dụng điện cực thuỷ tinh làm điện cực so sánh 2.3. Nhận xét sơ bộ
• Mục đích của chuẩn độ là xác định thể tích tương đương Ve. Giá trị chính xác của độ
pH là không cần thiết, quan trọng là sự biến đổi của nó. Có thể bỏ qua việc kiểm định các
điện cực ở pH = 9. Ngược lại, điều này lại cần thiết cho việc khai thác các đường cong như
việc lựa chọn chỉ thị màu hoặc việc đo pKa của một số axít yếu.
• Việc xác định điểm tương đương trong phép đo pH đòi hỏi đo trong khoảng thể tích rất
nhỏ xung quanh thể tích tại điểm tương đương Ve chưa biết. Do đó cần thực hiện chuẩn độ
đo màu nhanh sơ bộ để đinh vị thể tích Ve trong khoảng V1, V2 tương ứng với sự đổi màu
của chất chỉ thị. Việc chuẩn độ lần sau chỉ thu hẹp các thể tích để đo pH trong khoảng V1 - 0,5 ml và V2 + 0,5 ml.
2.3. Chuẩn độ axít clohydric
2.3.1. Chuẩn độ lần đầu : đo màu nhanh
☞ Rót vào bình 10 ml axít clohydric (pipette định mức) và 2 giọt chỉ thị methyl da cam.
Dung dịch chuyển sang màu đỏ.
☞ Rót dần từng ml xút không cần chính xác về thể tích, lắc dung dịch.
☞ Ghi lại khoảng đổi màu từ màu đỏ sang màu vàng:
dung dịch có màu vàng tới V1 = ml
dung dịch có màu xanh bắt đầu từ thể tích V2 trở đi 10
2.3.2. Chuẩn độ lần hai: phép đo pH chính xác
☞ Tiến hành kiểm định các điện cực (xem chỉ dẫn trên máy).
☞ Lấy vào bình 10 ml axít clohydric (pipette định mức), thêm vào 40 ml nước (ống đong)
để cho các điện cực được nhúng vào trong dung dịch.
☞ Thêm vào từng ml xút cho tới (V1 - 0,5) ml. Sau đó làm việc với từng 0,2 ml cho tới
V2 + 0,5 ml. Xung quanh thể tích Ve,, các giá trị của pH không ổn định.
Đợi cho pH ổn định trước khi đọc giá trị . Tiếp theo lại thêm từng ml xút cho tới 𝑣 = 3𝑉𝑒 2
☞ Lập bảng các giá trị đo được
☞ Vẽ đường cong pH = f (v).
☞ Xác định điểm tương đương
☞ Chỉ ra trên đồ thị, cho từng phần của đường cong ( V < Ve và V > Ve) các cặp axít bazơ định ra độ pH
☞ Xác định điểm tương đương của chuẩn độ. Chỉ ra toạ độ .
☞ Khẳng định việc sử dụng chỉ thị màu của chuẩn độ đo màu.
☞ Xác định giá trị của nồng độ axít clohydric ?
2.4. Chuẩn độ axít êtanoic
☞ Tiến hành tương tự như trong phần 2.4, có điều khác là sử dụng chỉ thị màu
phenolphtalein, dung dịch sẽ chuyển từ không màu sang màu hồng.
☞ Vẽ đường cong pH = f (v ), xác định giá trị pKa của axít êtanoic
3. KẾT QUẢ THỰC NGHIỆM
3.1 Chuẩn độ axít clohydric
• Phản ứng hoá học : H+ + OH- → H 14 2O K = 10
phản ứng là hoàn toàn
• Tương quan tại điểm tương đương : CA E = CB Ve
• Bảng các giá trị đo được: V, ml 0 1 2 3 4 5 6 7 8 9 pH V, ml 9,2 9,4 9,6 9,8 10 10,2 10,4 10,6 10,8 11 PH V, ml 12 13 14 15 16 17 18 19 20 pH 11
Vẽ đường cong pH = f (v).
pH PHỤ THUỘC VÀO THỂ TÍCH XÚT TRONG CHUẨN ĐỘ AXÍT CLOHYDRIC
3.2. Chuẩn độ axít êtanoic (Axetic)
• Phản ứng hoá học : CH - 3COOH + OH → CH3COO- + H2O • K = K 9,2 a / Ke = 10
do đó phản ứng là hoàn toàn
• Tương quan tại điểm tương đương : CA E = CB Ve
• Bảng các giá trị đo được V, ml 0 1 2 3 4 5 6 7 8 9 pH V, ml 9,7 9,9
10,10 10,30 10,50 10,70 10,90 11,10 11,30 12 PH V, ml 13 14 15 16 17 18 19 20 pH 12
Vẽ đường cong pH = f (V).
pH PHỤ THUỘC VÀO THỂ TÍCH XÚT TRONG CHUẨN ĐỘ AXÍT ETANOIC (AXÍT AXETIC)
4. SO SÁNH VÀ ĐÁNH GIÁ CÁC ĐƯỜNG CONG CHUẨN ĐỘ ĐO ĐƯỢC
........................ ........................................................ ..................................................................................
........................ ........................................................ ................................................................ .................
........................ ........................................................ ..................................................................................
....................................................................................................................................................................
........................ ........................................................ ..................................................................................
........................ ........................................................ ..................................................................................
........................ ................................ ..........................................................................................................
........................ ........................................................ ..................................................................................
........................ ........................................................ .................................................................................. 13
5. DANH MỤC THIẾT BỊ VÀ HOÁ CHẤT
5.1. Thiết bị cho từng bàn sinh viên
• 1 burette 25 ml có vạch chia độ 1/ 10 ml + giá đỡ • 1 pipette 10 ml • 1 giá đặt pipette • 1 máy khuấy từ • 1 thỏi nam châm • 1 bình 100 ml dạng cao • 3 bình plastic 50 ml • 1 ống đong 50 ml • 1 bình tia nước cất • giấy lọc cắt sẵn
• 1 máy đo pH + hướng dẫn kiểm định điện cực
• 1 giá đỡ các điện cực : 1 điện cực kết hợp bằng thuỷ tinh so sánh nhúng vào trong dung dịch
5.2. Danh mục hoá chất cho từng bàn sinh viên
• Lọ đựng 100 ml xút 0,100 mol.l -1
• Lọ đựng 100 ml axít clohydric khoảng 0,1 mol.l -1
• Lọ đựng 100 ml axít êtanoic khoảng 0,1 mol.l -1
• Dung dịch đệm pH = 7 và pH = 9 để hiệu chuẩn máy pH
• Các chỉ thị màu trong lọ với côngtơgut :
a) Methyl da cam (Hêlianthine) 0,1 gam cho 100 gam nước
b) Bromocres xanh 0,1 gam cho 100 ml êtanol
c) Mêthyl đỏ 0,2 gam cho 100 ml êtanol
d) Bromothynol xanh lơ 0,1 gam trong 100 ml êtanol
e) Phenolphtalein 0,1 gam trong 100 ml êtanol
5.3. Danh mục các vật dụng cho phòng thí nghiệm • 1 nhiệt kế • parafin • găng tay • kính 5.4. Bảo quản 14 Chương trình đào tạo
Kỹ sư chất lượng cao tại Việt Nam P . F . I . E . V HOÁ HỌC BÀI 3
NGHIÊN CỨU QUANG TRẮC PHỔ PHẨM MÀU METHYLENE XANH
CHUẨN ĐỘ QUANG TRẮC PHỔ METHYLEN XANH
Mục đích của bài thực hành này là sử dụng máy phổ quang kế để:
• Vẽ phổ hấp thụ của một chất màu, Methylen xanh trong dung dịch
• Xác định khoảng nồng độ trong đó áp dụng định luật BEER LAMBERT
• Chuẩn độ Methylen xanh trong dung dịch chưa biết nồng độ
Phẩm màu Methylen xanh là phẩm màu có thể có trong một sản phẩm trong cuộc sống thường ngày: nước rửa thuỷ tinh.
Công thức nguyên của Methylen xanh là C16H18ClN3S. Khối lượng mol là M = 319,85 g.mol-1.
Lưu ý: Trong thí nghiệm này sẽ sử dụng chất màu có sẵn ở phòng thí nghiệm 1. LÝ THUYẾT
1.1. Giới thiệu về định luật Beer – Lambert
Cơ sở lý thuyết của bài thực hành này, là định luật hấp thụ
quang Beer-Lambert hay Lambert-Beer, đây là một định luật có
nhiều ứng dụng trong hoá học và vật lý.
Định luật này được dựa trên hiện tượng hấp thụ bức xạ điện
từ chọn lọc, đó là bức xạ điện từ được hấp thụ mạnh nhất (max)
của hợp chất nghiên cứu có mặt trong dung dịch.
Định luật này được sử dụng nhiều trong hoá phân tích hóa
hữu cơ và vật lý quang học. Định luật này đ ợc ư tìm ra lần đầu
bởi nhà khoa học người Pháp Pierre Bouguer, tuy nhiên những
đóng góp quan trọng lại thuộc về Johann Heinrich Lambert và August Beer.
1.2. Phát biểu của định luật Beer – Lambert:
Độ hấp thụ quang (A) của một dung dịch tỷ lệ với nồng độ và chiều dày của lớp dung dịch mà nó đi qua.
☞ Khi một chùm tia đơn sắc, song song, có cường độ I0 chiếu qua vuông góc lên bề dày l của một môi
trường hấp thụ, thì sau khi đi qua lớp chất hấp thụ này cường độ chùm tia đo được là I (I☞ Công thức của định luật Beer Lambert: 𝐴 = −𝑙𝑔𝑇 = 𝑙𝑔 𝐼0 = 𝜀. 𝑙. 𝐶 𝐼 15 Với:
A: Độ hấp thụ quang (hay Mật độ quang); T: Độ truyền qua;
ε: Hệ số hấp thụ phân tử phụ thuộc vào bản chất của chất hấp thụ;
l: chiều dày của lớp dung dịch hấp thụ;
C: Nồng độ của chất hấp thụ. 2. THỰC HÀNH:
2.1. Thiết bị thí nghiệm
PHỔ QUANG KẾ (UV-VIS)
Đèn và máy lọc đơn sắc Cuvette Tế bào quang điện
2.2. Chỉ dẫn và thực hành:
Sử dụng đồ thuỷ tinh:
✓ Đồ thuỷ tinh chính xác sử dụng trong bài này bao gồm các burette và pipette có chia độ.
✓ Tuân thủ các chỉ dẫn về việc lấy chất lỏng và đọc thể tích.
✓ Sử dụng cuvette và thực hiện đo đạc trên quang phổ kế theo hướng dẫn của giảng viên.
Lưu ý: Không được di chuyển phổ quang kế khi bóng đèn còn nóng (nguy cơ nổ bóng ).
2.3. Quang phổ hấp thụ của một dung dịch Methylene xanh 20mg.l-1 .
☞ Đo độ hấp thụ A của dung dịch của các bức xạ có từ = 400 nm tới = 700 nm, từng 20 nm.
☞ Thu hẹp sự thay đổi bước sóng các bức xạ của phép đo trong từng 5 - 10 nm ở gần max
Vẽ đường cong A = f().
Từ đó rút ra giá trị max .
2.3.1. Bảng giá trị đo được : ☞ , nm
400 420 440 460 480 500 520 540 560 580 600 620 640 650 655 660 665 670 680 690 700 A Methylen xanh 103 16