





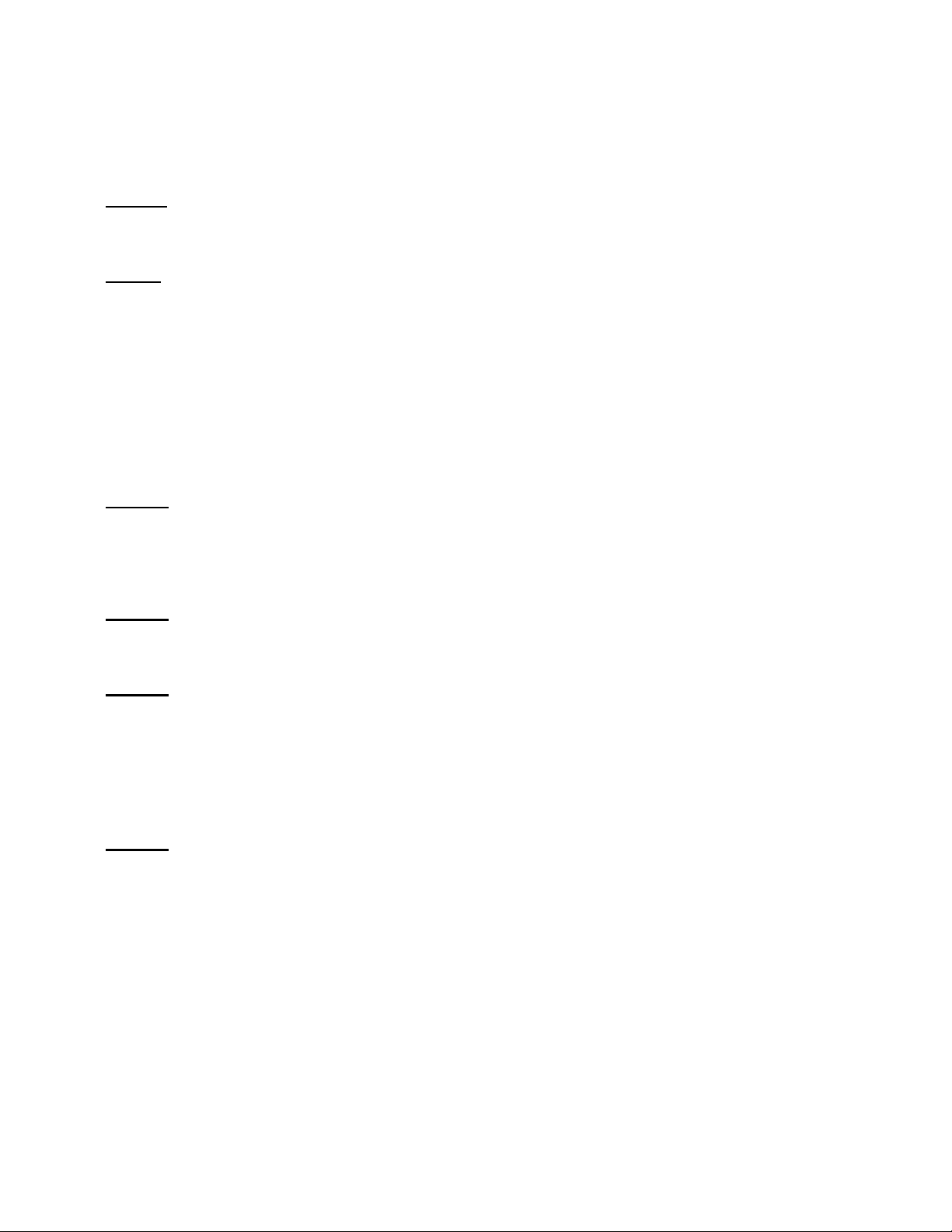










Preview text:
1 TR
NG Đ I H C CỌNG NGH TP. H CHệ MINH
KHOA CN SINH H C ậ MỌI TR NG ậ THỰC PH M L p 12DSH02 BÁO CÁO
THỰC HẨNH HịA SINH GVHD: Nguy n Th Hai
Sinh viên: Tr ng Th Th o MSSV:1211100186
Ngô Lê H ng Duyên MSSV: 1211100062 Cao Th Nhơm MSSV:1211100142 ĐoƠn Ng c Kiểng MSSV:1211100293
Võ Nguy n Anh Th MSSV:1211100192 Phan Th Thúy Vy MSSV: 1211100283 2
BẨI 1: GI I THI U PHọNG THệ HịA SINH, CÁCH PHA
CH CÁC DUNG D CH DỐNG TRONG PHọNG THệ NGHI M HịA SINH Lý thuy t I.
Quy t c lƠm vi c trong phòng thí nghi m hóa sinh
a. An toƠn khi lƠm vi c v i axit vƠ kiềm
An toàn khi làm việc với axit
- Phải làm vi c trong tủ hút bất cứ khi nào đun nóng axit hoặc thực hi n phản ứng với các axit tự do
- Khi pha loãng luôn phải cho axit vào nước .
An toàn khi làm việc với kiềm
- Ki m có th làm cháy da
- Mang găng tay , kh u trang khi làm vi c với dung dịch ki m
- Thao tác trong tủ hút, mang mặc nạ ch ng độc đ phòng ngừa bụi và hơi ki m
b. Quy t c lƠm vi c v i hóa ch t thí nghi m
Hóa chất thí nghiệm:
- Các hóa chất dùng đ phân tích, làm tiêu bản, tiến hành phản ứng, trong phòng thí
nghi m được gọi là hóa chất thí nghi m.
Nhãn hiệu hóa chất :
- Hóa chất được bảo quản trong chai lọ, thủy tinh hoặc nhựa đóng kín có nhãn ghi
tên hóa chất, công thức hóa hoc, mức độ sạch, tạp chất, kh i lượng tịnh, kh i lượng phân
tử, nơi sản xuất , đi u ki n bảo quản.
Cách sử dụng và bảo quản hóa chất:
- Khi làm vi c với hóa chất , nhân viên phòng thí nghi m cũng như sinh viên cần hết
sức c n thận tráng gậy những tai nạn đáng tiếc cho mình cũng như cho ngư i khác. 3
- Bao gi cũng đ axit hay bazơ vào nước khi pha loãng .
- Không hút axit hay bazơ bằng mi ng mà phải dùng các dụng cụ ri ng như: ng bóp cao su. II.
Cách pha ch các dung d ch trong thí nghi m hóa sinh: Dung d ch :
- Dung dịch là hỗn hợp của hai hay nhi u chất tác động tương h với nhau v mặt
vật lí và hóa học. Trong dung dịch g m có chất hòa tan và dung môi .
Các đ n v n ng đ dung d ch:
N ng độ phần trăm, (% )
N ng độ phần trăm – kh i lượng, % (w/w): là s gam chất tan có trong 100g dung dịch.
N ng độ trăm kh i lượng th tích (w/v): là s g chất tan có trong 100ml dung dịch.
N ng độ phần trăm th tích – th tích , % (v/v): là s ml dung chất có trong 100ml dung dịch.
N ng độ gam – lít, (g/L): là s g chất tan có trong 1 lít dung dịch.
N ng độ phân tử g hay n ng độ mol, (mol/L): là s phân tử g ( hay s mol) chất tan trong 1 lít dung dịch.
N ng độ đương lượng (N); là s đương lượng gam (đlg) chất tan có trong 1 lít dung dịch.
S đương lương chất tan = s mol (n) x h s đương lượng (z)
- H s đương lượng (z) : phụ thuộc vào bản chất của chất đó và phản ứng mà chất đó tham gia.
N ng đ dung d ch bưo hòa: lƠ n ng đ dung d ch khi t i đa ch t hòa tan có m t trong dung d ch.
Đ n v n ng đ dùng trong các phép phơn tích vi l ng :
- N ng độ mg/mL : s mg chất tan trong 1mL dung dịch 4
- Miligam phần trăm , mg% : mg chất tan trong 100g dung dịch
- Phần nghìn ,0/00 : s gam chất hòa tan trong 1000g dung dịch
- Phần tri u , ppn : s mg chất hòa tan trong 1kg hay 1 lịt dung dịch
- Phần tỷ , ppb : s µg chất hòa tan có trong 1kg hay 1 lít dung dịch
Cách pha dung dịch có n ng độ xác định
a. Pha dung d ch có n ng đ theo kh i l ng ,% (w/w)
- Chất tan là chất rắn khan
- Chất tan là chất rắn ngậm nước ( CuS04.5H2O..)
Khi pha dung dịch cần phải tính thêm lượng nước kết tinh có sẵn.
b. Pha dung d ch loưng t m t dung d ch đ m đ c h n
c. Pha dung d ch bưo hòa :
Lấy chất tan cần pha vào becher , thêm một ít nước cất và khuấy cho tan . Nếu sau
khi khuấy , chất tan không tan hết lắng xu ng thì phần dung dịch phía trên là dung dịch
bão hòa. Nếu chất tan tan hết , thêm chất tan và tiếp tục khuấy , cứ như thế cho đến khi
chất tan không còn tan được nào.
d. Pha dung d ch có n ng đ % theo thể tích :
- Chất tan là chất rắn khan
Cân lượng chất tan cần thiết , chuy n sang bình định mức , dùng nước cất hòa tan và định mức đến th tích đúng.
- Chất tan là chất rắn ngậm nước
Khi pha dung dịch ta cần phải tính lượng kết tinh có sẵn gi ng như phần a
- Chất tan dạng l ng : một s chất tan dạng l ng như HCl, H … 2S04
Ngày nay đa s các dung dịch thí nghi m được pha chế theo n ng độ khới lượng- th tích (w/v). i.
Pha dung d ch n ng đ phơn t gam:
- Chất tan là chất rắn khan : 5
Mu n pha dung dịch n ng độ 1M của một chất nào đó , ta tính kh i lượng phân tử chất
đó theo đơn vị gam. Cân chính xác lượng chất tan , qua ph u cho vào bình định mức có
dung tích 1 lít . Cho vào từng lượng nước cất nh , lắc đ hòa tan hoàn toàn và đưa nước
cất tới mức . Chuy n dunh dịch sang bình chứa, lác đ trộn đ u đ ng nhất.
Khi phải đun dung dịch đ hòa tan, hoặc quá trình hòa tan có t a nhi t thì phải ch
nhi t độ tr lại bình thư ng (nhi t độ không khí) r i mới thêm nước tới vạch định mức.
- Chất tan là chất rắn ngậm nước : khi tính lượng chất tan cần cân phải tính luôn cả
kh i lượng các phân tử nước.
- Chất tan dạng l ng: nếu chất tan là dung dịch, ta phải tính toán dựa vào n ng độ dung dịch đó.
Hi u ch nh n ng đ dung d ch.
a. Dung dịch chuẩn.
Dung dịch chu n là các dung dịch được chu n bị sẵn, đảm bảo chính xác và được
dùng đ định chu n các dung dịch tự pha chế khi làm thí nghi m.
Cách pha dung d ch t ng chu n:
- Dùng đinh thủy tinh chọc thủng ampun, hứng lên ph u vào bình định mức, dùng
bình tia rửa sạch chất tan có trong ampun vào bình định mức 1 lit, vừa thêm nước cất vừa
lắc và đưa nước cất tới vạch mức.
- Đ i với các hợp chất b n vững, có thành phần không thay đ i như NaCl, AgNO3,
acid oxalic,.. có th pha dung dịch chu n trực tiếp bằng cách cân chính xác chất cần pha,
pha loãng và định mức tới th tích đúng.
- Đ i với các chất như NaOH, HCl, Na2S2O3,..không th pha ngay được dung dịch
chu n, do các chất này thư ng không b n vững và d thay đ i thành phần, vì vậy sau khi
pha phải hi u chỉnh lại n ng độ.
b. Phương pháp hiệu chỉnh nồng độ dung dịch 6
Đ i với các chất d thay đ i thành phần khi dạng rắn, nếu mu n pha dung dịch có
n ng độ chính xác, ta pha dung dịch có n ng độ gần đúng, sau đó hi u chỉnh n ng độ của
dung dịch dựa vào phản ứng với một dung dịch chu n thích hợp.
Đ i với các dung dịch d thay đ i trong quá trình bảo quản, mỗi lần sử dụng lại
phải xác định lại h s hi u chỉnh n ng độ dung dịch
Xét một phản ứng trung hòa acid – base, 1 ion gam H+ sẽ phản ứng với 1 ion gam OH-. Do đó: C1V1 =C2V2
Nếu gọi Cp là n ng độ dung dịch định pha và Ct là n ng độ thực của dung dịch ta có h s hi u chỉnh K: K = Cp/Ct = Vp/Vt III. Dung d ch đ m
a. Định nghĩa dung dịch đệm
Dung dịch đ m là dung dịch có pH không thay đ i nhi u lắm khi 1 lượng axit (H+ )
hoặc bazơ (OH-) . Vậy, dung dịch đ m g m 1 cặp axit bazơ liên hợp ( axit yếu và mu i
của axit yếu này hoặc bazơ yếu và mu i của bazơ này) và tỉ l của chúng sẽ quyết định pH dung dịch.
Trong cơ th s ng, dung dịch đ m đóng vai trò quan trọng ví dụ như n định pH
của máu bằng các h đ m cacbonat và phosphat.
b. Cách pha một số dung dịch đệm thường dùng - Dung dịch đ m borat
- Dung dịch đ m citrate (pH = 3,0 – 3,6)
- Dung dịch đ m phosphate( pH = 5,7 – 8,0)
- Dung dịch đ m Na2HPO4 – KH2PO4 (Ph = 5,0 – 8,0)
- Dung dịch đ m glycine – HCl (pH = 2,2 – 3,6)
- Dung dịch đ m Glycine – NaOH (pH = 8,6 – 10,6)
- Dung dịch đ m axetat (pH = 3,6 – 5,6)
- Dung dịch đ m vạn năng 0.1 M 7 CÂU H I ỌN T P Cơu 1:
Pha 1L dung dịch NaOH 40% (w/v): cân X=(40x1000)/100=400(g) NaOH khô. Cơu 2:
N ng độ mol của H2SO4 đđ là:
CM = (10.d.C%)/M = (10x97x1.84)/98 = 18.2 (mol)
Th tích H2SO4 cần sử dụng là:
VH2SO4 = (VH2SO4 2M. CMH2SO4)/CMH2SO4 đđ = (2x500)/18.2 = 54.91(ml)
Lượng nước cần b sung là: 500 – 54.91 = 445.09 (ml) Cơu 3:
Pha 250ml dung dịch CuSO4 1M, cân m = n.M = 0.25 x 250 = 62.5 (g) CuSO4.5H2O
Cơu 4:H2SO4 2M = H2SO4 4N
C1.V1 = C2.V2 V2 = (1000 x 0.1)/4 = 25 (ml) Cơu 5:
- Lượng NaOH cần đ pha dung dịch 10% là: X= ( 10x500)/100 = 50 (g)
- Lượng dung dịch NaOH 40% cần dùng là: Y = (100x50)/40 = 125 (g)
- Lượng nước cất thêm vào: 500 – 125 = 375 (g) Cơu 6:
- Lượng HCl cần đ pha dung dịch 2% là: X = (2x500)/100 =10 (g)
- Lượng dung dịch HCl 37% cần dùng là: Y = (100 * 10)/37 = 27.03 (g)
=> 27.03 /1.19 = 22.71 (ml)
- Lượng nước cất thêm vào : 500 – 22.71 = 477.29 (ml) 8 BẨI 2 : Đ NH L NG Đ NG KH B NG PH NG
PHÁP ACID DINITRO-SALICYLIC (DNS) Lụ THUY T Nguyên t c
Phương pháp này dựa trên cơ s phản ứng tạo màu giữa đư ng khử với thu c thử
acid dinitrosalicylic (DNS) .Cư ng độ màu của hỗn hợp phản tỉ l thuận với n ng độ
đư ng khử trong một phạm vi nhất định. THỰC HẨNH I. D ng c -Hóa ch t: 1. Dụng cụ - Máy đo màu - Cuvette d = 1 cm, V = 4ml -
ng nghi m có nắp và các dụng cụ thủy tinh khác - Bếp đi n 2. Hóa chất
- M u rau quả chứa đư ng (dứa) - -Thu c thử DNS
- -Dung dịch glucose chu n 1mg/ml (bảo quản lạnh) II. Ti n hƠnh
1. Chiết xuất đư ng trong thực vật - Chu n bị m u thơm 20g - Giã nh
- Vắt lấy nước cho vào bình định mức
- Thêm nước cất đủ 100ml
- Pha loãng m u h s n (20,50,100,200 lần) 9
2. Dựng đư ng chu n và xác định hàm lượng đư ng Hóa chất ng1 ng2 ng3 ng ng5 ng6 ng7 4 Glucose 1mg/ml 0 0.2 0.4 0.6 0.8 1 0 Nước cất(ml) 1 0.8 0.6 0.4 0.2 0 0 M u pha loãng(ml) 0 0.2 0.4 0.6 0.8 1 ? DNS (mol) 3 3 3 3 3 3 3 OD540nm 0 0.333 0.712 1.233 1.469 1.623 0.179 - Đo bước sóng 540nm
- CHÚ Ý : tiến hành các m u dựng đư ng chu n và thí nghi m đ ng th i
Đ ng chu n n ng đ đ ng kh (mg/ml)
v i m t đ quang OD540nm 2 1,8 1,6 1,4 1,2 1 540nm OD y = 1,7206x + 0,0347 0,8 R² = 0,9 0,6 0,4 0,2 0 0 0,2 0,4 0,6 0,8 1 1,2 C 10 Tính k t qu :
Từ phương trình đ thị đư ng cong chu n tính được mg/ml đư ng khử trong dung dịch đư ng pha loãng.
Nhân với h s pha loãng n đ được lượng đư ng trong 1 ml dung dịch g c
Chọn h s pha loãng n sao cho OD nằm trong giới hạn đư ng chu n
Dựa vào phương trình đư ng tuyến tính giữa n ng độ đư ng khử (mg/ml) với mật độ
quang OD540 trên ta tính được hàm lượng đư ng khử P trong m u phân tích X. y = , x + , ⟹ x = �− , = , 9− , = . , ,
Tính hàm lượng đư ng trong nguyên li u (mg/g) = X * n * V/m = 0.084 * 25 * 100/20 = 10.5 11 CÂU H I ỌN T P
Cơu 1: Đư ng khử là các đư ng chứa nhóm aldehyde (-CHO) hoặc ketone (-CO) như
glucose , fructose ,arabinose , maltose , lactose (saccharose , trehalose không phải đư ng khử.
Cơu 2: Áp dụng phương pháp đo đư ng khử trong trư ng hợp phân tích n ng độ
đư ng khử trong dung dịch.
Cơu 3 : Sai s h th ng do những lý do:
- Hóa chất chu n bị cho thí nghi m không được chu n.
- Do vận chuy n m u không đúng cách
- Thao tác đo không chính xác
- Ghi không chính xác chỉ s -
dụng cụ cuvete khi đo OD
- Hút hóa chất không chính xác
Cơu 4 : Khi đo OD máy báo over là do m u quá đậm đặc cần phải pha loãng lại.
Gía trị OD nằm trong khoảng từ 1 đến 5 .Vì nếu cao quá hoặc thấp quá đư ng chu n sẽ bị l ch.
Cơu 5: Trong bài thực hành chọn đư ng glucose đ dựng đư ng chu n .đi u này
không luôn đúng .vì đư ng khử có nhi u loại như fructose, maltose….. 12 BẨI 3: Đ NH L NG NIT T NG S B NG PH NG PHÁP KJELDAHL 1. Đ nh nghĩa:
- Tất cả các dạng nitơ có trong cơ th hay trong các mô được gọi là nitơ t ng s .
Nitơ có trong các thành phần amino acid của protein là nitơ protein. Nitơ không có trong
thành phần protein như của các mu i NH4+, các amino acid tự do, các peptide, urea và
các d n xuất của urea, các alkaloid, các base purin và pyrimidine,….. là nitơ phi protein
Nitơ t ng s = Nitơ protein + Nitơ phi protein
- Đạm t ng s hay protein t ng s là nitơ t ng s nhân với h s chuy n đ i. H s
này phụ thuộc vào hàm lượng nito trong protein. Thông thư ng nito chiếm 16% protein
nên h s chuy n đ i thư ng sử dụng là 100/16 = 6.25
- Đạm t ng s = Nito t ng s X h s chuy n đ i
- Bảng dưới đây bi u di n h s chuy n đ i cụ th cho nhi u đ i tượng m u khác nhau. M U H S CHUY N Đ I Ngu n g c động vật 6.25 Hạt bông 5.30 Đậu phộng 5.46 Đậu nành 5.71 Hạt hướng dương 5.3 Cơm dừa 5.3 Hạt mè 5.3 Bắp 6.25 Gạo 5.95 Lúa mì 5.83 2. Nguyên t c: a) Vô cơ hóa mẫu.
- Trước tiên m u được vô cơ hóa bằng H2SO4 đặc nhi t độ cao và có chất xúc tác.
Các phản ứng của quá trình vô cơ hóa xảy ra như sau: 2H2SO4 2H20 + 2SO2 + O2 13
- Oxi tạo thành trong phản ứng lại oxi hóa các nguyên t khác. Các phân tử chứa
nito dưới tác dụng của H . Ví dụ 2SO4 tạo thành NH3
các protein bị thủy phân thành amini
acid, cacbon và hidro của acid amine tạo thành CO O, còn nito đượ 2 và H2 c giải phóng
dưới dạng NH3 kết hợp với H2SO4 dư tạo thành (NH4)2SO4 tan trong dung dịch. 2NH3 + H2SO4 (NH4)2SO4
- Các nguyên t P, K, Ca, Mg,……chuy n thành dạng oxide: P2O5, K2O, CaO, MgO,…… b) Chưng cất đạm:
- Đu i NH3 ra kh i dung dịch bằng NaOH
(NH4)2SO4 + 2NaOH Na2SO4 + H2O + 2NH3 - NH bay ra được làm lạ
OH rơi vào bình hứng, bình hứ 3 nh biến đ i thành NH4 ng chứa H2SO4 0.1N
2NH4OH + H2SO4 (NH4)2SO4 + 2H2O + H2SO4 (dư)
c) Chuẩn độ H2SO4 dư
Chu n độ H2SO4 dư bằng NaOH 0.1N
H2SO4 (dư) + NaOH Na2SO4 + H2O
d) Tính kết quả
Hàm lượng % nito t ng s được tính theo công thức:
N(%) = {1.42/1000*(V1 – V2)*100/m}*n Trong đó: - V cho vào trong bình 1: s ml H2SO4
- V2: s ml NaOH 0.1N đã chu n độ
- m: s gam m u hay ml m u sau khi chu n độ lại
- n: h s pha loãng m u khi vô cơ hóa m u đ đưa vào chưng cất
1.42: h s nito, cứ 1ml H OH thì t ng đ ng v
2SO4 dùng để trung hòa NH4 i 1.42mg nito
Bài tập: pha loãng 50 lần sữa tươi nguyên chất Vinamilk bằng bình định mức
100ml, sau đó chưng cất đạm với lượng H2SO4 cho vào bình là 20ml và chu n độ bằng
NaOH 0.1N. Tính hàm lượng N t ng s trong m u, tính ra protein t ng s . Vô cơ hóa m u 14
2NH3 + H2SO4 + (2g xúc tác) + to (NH4)2SO4 2ml m u 5ml dd trong su t Chưng cất đạm
(NH4)2SO4 + 2NaOH Na2SO4 + H2O + 2NH3 100ml 35ml NH3 + H2O NH4OH 2NH (dư)
4OH + H2SO4 (NH4)2SO4 + 2H2O + H2SO4 20ml Chu n độ H2SO4 dư H (xanh lá mạ
2SO4 (dư) + NaOH + 3 giọt Tashiro Na2SO4 ) + H2O 14,25ml
Chu n độ cho thấy lượng NaOH 0.1N phản ứng là V2= 14.25ml
Ta có: V1 = 20ml, m = 100ml, n = 50 lần
Áp d ng công thức ta tính đ c:
N(%) = {1.42/1000*(V1 – V2)*100/m}*n = {1.42/1000*(20 – 14.25}*100/100}*50 = 0.40825%
Nito (t ng s ) = Nito t ng s X h s chuy n đ i = 0.40825 x 6.25 = 2.5515625 Dd trước chu n độ Dd sau chu n độ 15 CÂU H I ỌN T P
Cơu 1) Giải thích ý nghĩa các bước trong thí nghi m a) Vô cơ hóa m u.
- Oxi tạo thành trong phản ứng lại oxi hóa các nguyên t khác. Các phân tử chứa
nito dưới tác dụng của H2SO4 tạo thành NH3.NH3 kết hợp với H2SO4 dư tạo thành
(NH4)2SO4 tan trong dung dịch. 2NH3 + H2SO4 (NH4)2SO4 b) Chưng cất đạm:
- Đu i NH3 ra kh i dung dịch bằng NaOH
- (NH4)2SO4 + 2NaOH Na2SO4 + H2O + 2NH3 - NH
OH rơi vào bình hứng, bình hứ
3 bay ra được làm lạnh biến đ i thành NH4 ng chứa H2SO4 0.1N
- 2NH4OH + H2SO4 (NH4)2SO4 + 2H2O + H2SO4 (dư) c) Chu n độ H2SO4 dư
- Chu n độ H2SO4 dư bằng NaOH 0.1N
- H2SO4 (dư) + NaOH Na2SO4 + H2O
Cơu 2. Thảo luận các yếu t d n đến sai s .
Hút không chính xác m u
Chu n độ không chính xác
Sai s của máy chưng cất
Cơu 3. Vì sao phải bảo đảm NaOH trong bình chưng cất đạm dư?
Vì NaOH dư thì sẽ chuy n tất cả (NH4)2SO4 thành NH3 Cơu 4. Nếu thay H ) thì kế
2SO4 trong bình hứng bằng acid boric (H3BO3 t quả có thay đ i gì không?
Ta có: 0.1N H2SO4 = 0.05M H2SO4
Ta chuy n qua phương trình và 1.42 là h s nito, cứ 1ml H2SO4 dùng đ trung hòa
NH OH thì tương đương với 1.42mg nito. Vì lấy 1ml nên nhân thêm cho 10-3 4
2NH4OH + H2SO4 (NH4)2SO4 + 2H2O + H2SO4 (dư) 0.1*10-3 0.05*10-3 mN=0.1*10-3 * 14.2 16
3NH4OH + H3BO3 (NH4)3BO3 + 3H2O + H3BO3 Dư 0.15*10-3*14.2 0.05*10-3
mN=0.15*10-3 * 14.2= 2.13*10-3
Vì vậy nếu thay thành acid boric thì h s sẽ là 2.13
Cơu 5. Nếu chu n độ bằng NaOH 0.05N thì kết quả N t ng s thay đ i thế nào?
Áp dụng công thức: C1V1 = C2V2
V1, C1 c định và V2 phải chu n độ
Mà C2 giảm 1 nữa thì V2 tăng th tích gấp đôi Công thức thay đ i BẨI 4. Đ NH L NG PROTEIN B NG PH NG PHÁP BRADFORD Lý thuy t 1. Nguyên t c
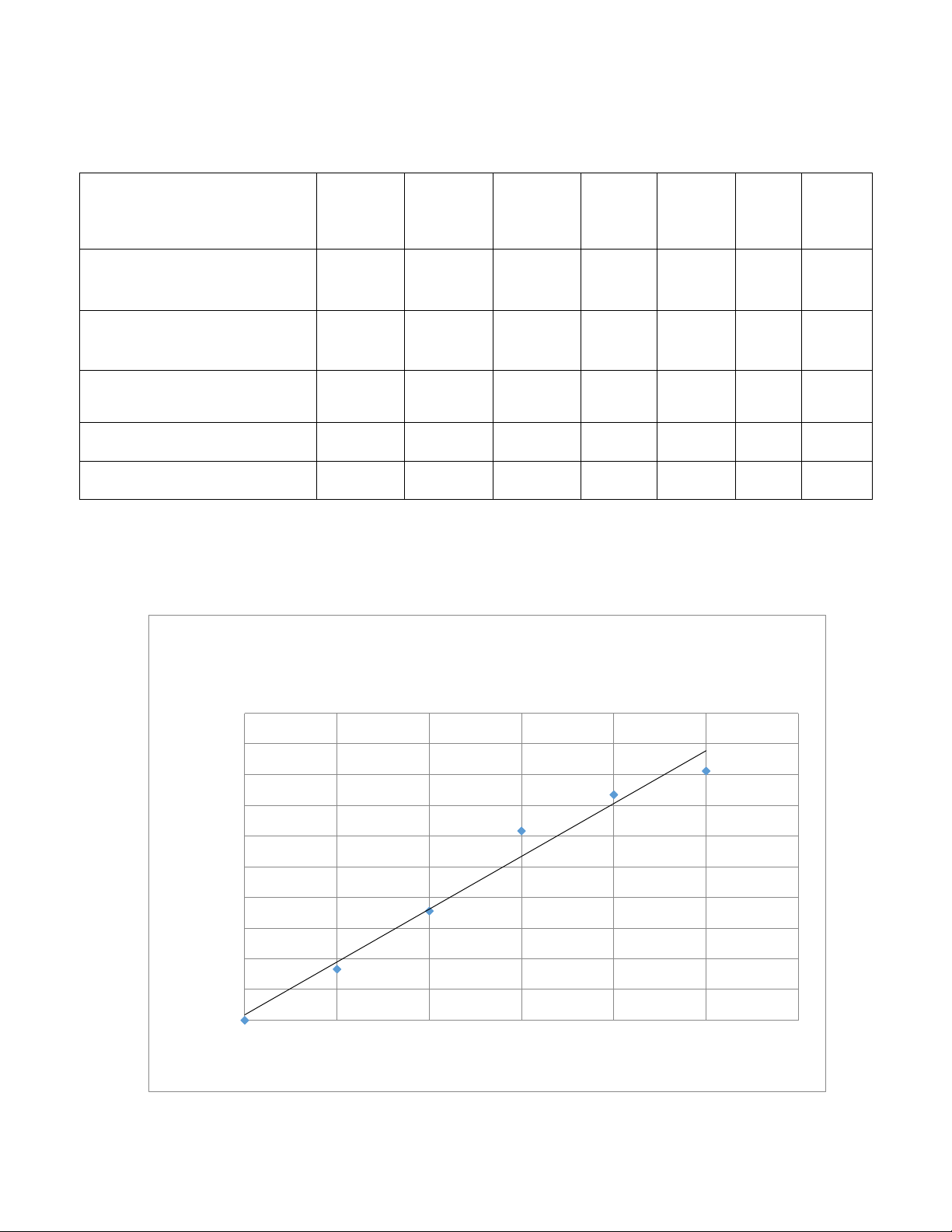
Phương pháp này dựa trên sự thay đ i bước sóng hấp thu cực đại của thu c nhuộm
Coomassie Brilliant Blue khi tạo phức hợp với protein. Trong dung dịch mang tính acid,
khi chưa kết n i với protein thì thu c nhuộm có bước sóng hấp thu cực đại 465 nm; khi
kết hợp với protein thì thu c nhuộm hấp thu cực đại bước sóng 595 nm. Độ hấp thụ
bước sóng 595 nm có liên h một cách trực tiếp tới n ng độ protein.
Đ xác định protein trong m u, đầu tiên ta xây dựng một đư ng chu n với dung
dịch protein chu n đã biết trước n ng độ. Dung dịch protein chu n thư ng là bovine
serum albumin (BSA) . Sau khi cho dung dịch protein vào dung dịch thu c nhuộm, màu
sẽ xuất hi n sau 2 phút và b n tới 1 gi . Tiến hành đo dung dịch bằng máy quang ph kế ta được OD , độ x
hấp thụ sẽ tỷ l với lượng trong m u. Thực hi n một đ i chứng với nước cất (OD . Lượ
0). Lấy giá trị OD = ODx - OD0
ng protein m u trong dung dịch đo được xác
định bằng cách chấm trên đư ng chu n theo OD, lấy giá trị của đi m đó trên trục hoành.
Đó chính là lượng protein m u trong dung dịch đo. 17
Công thức phân tử của Coomasie Brilliant Blue G-250 THỰC HẨNH 1. D ng c - hóa ch t 1. Dụng cụ - Máy đo quang ph - ng nghi m (14)
- Pipette 5ml, 1ml (có th thay bằng pipetteman) - Đ ng h bấm giây - Giấy thấm - Giá đ ng nghi m
- Bình tia đựng c n 2. Hóa chất - C n 900
- Dung dịch protein chu n: cân 10 mg albumin bằng cân phân tích, pha trong 1 ml
nước cất, lắc đ u cho tan. Giữ -200C. Khi dùng pha loãng ra 100 lần, được dung dịch có n ng độ 0,1 mg/ml.
- Dung dịch thu c thử Bradford: dd thu c thử có thành phần trong 100ml như sau:
Coomassie Brilliant Blue: 0,005g 18 Methanol: 4,7g
Phosphoric acid 85%: 8,5g
Phẩm màu Coomasie Brilliant Blue được làm tan trong ethanol trong một chai
đựng màu tối có nắp. Bổ sung phosphoric acid và chỉnh tới 100ml bằng nước cất. Lắc
đều, giữ ở 40C
- Dung dịch cần xác định hàm lượng protein (phòng thí nghi m cung cấp) 2. Ti n hƠnh
- Thu dịch trích ly protein như trong bài enzyme (5 g malt trích ly bằng nước thu
được V = 100 ml). Pha loãng m u với h s pha loãng n lần đ được m u phân tích (m u X).
- Lập một loạt 6 ng theo s thứ tự 0, 1, 2, 3, 4, 5 và 1 ng nghi m chứa m u cần phân tích X
- Dùng đ ng h bấm giây, canh th i gian 0 phút cho 5ml thu c thử vào ng nghi m
0, lắc đ u đ yên. th i đi m 1 phút cho 5ml thu c thử vào ng nghi m 1, lắc đ u đ
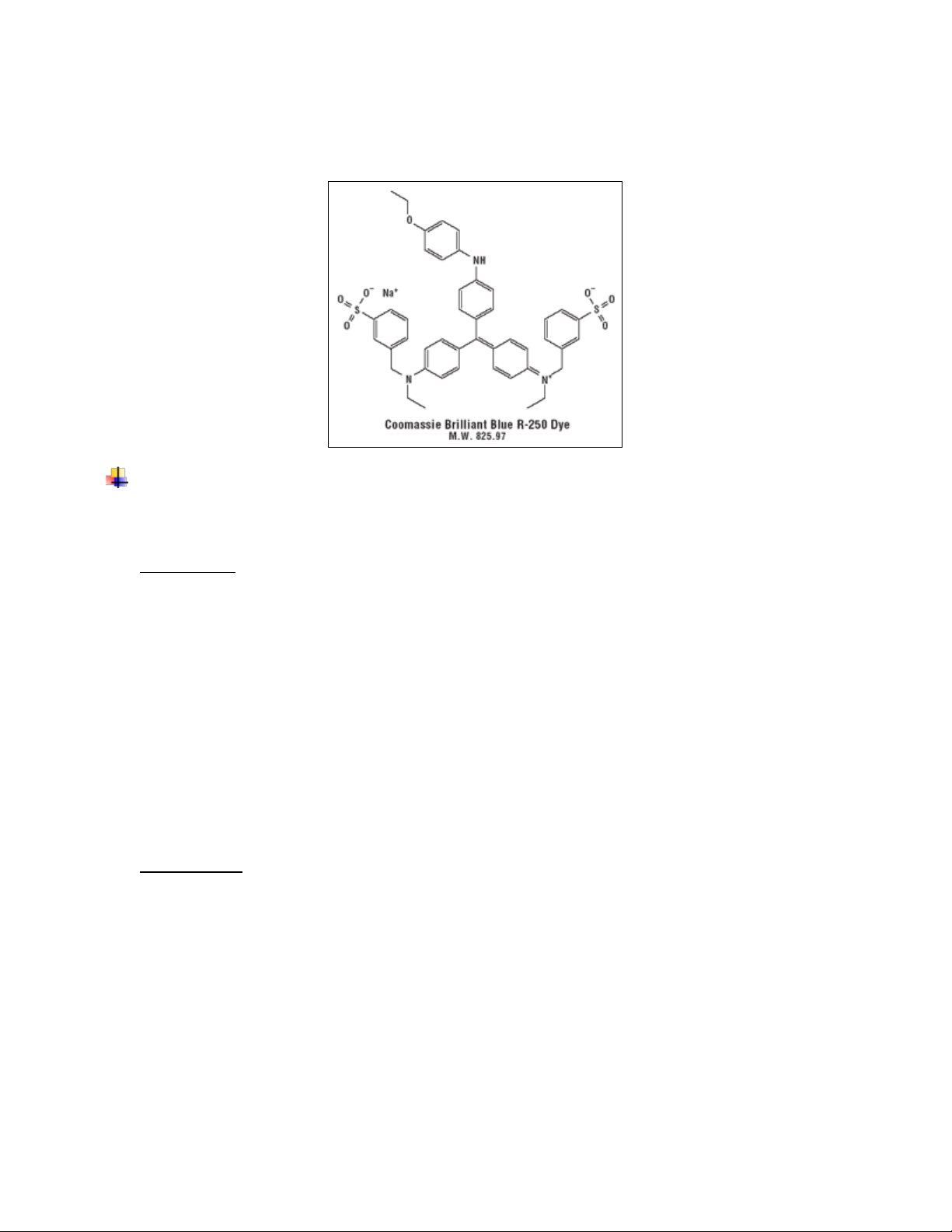
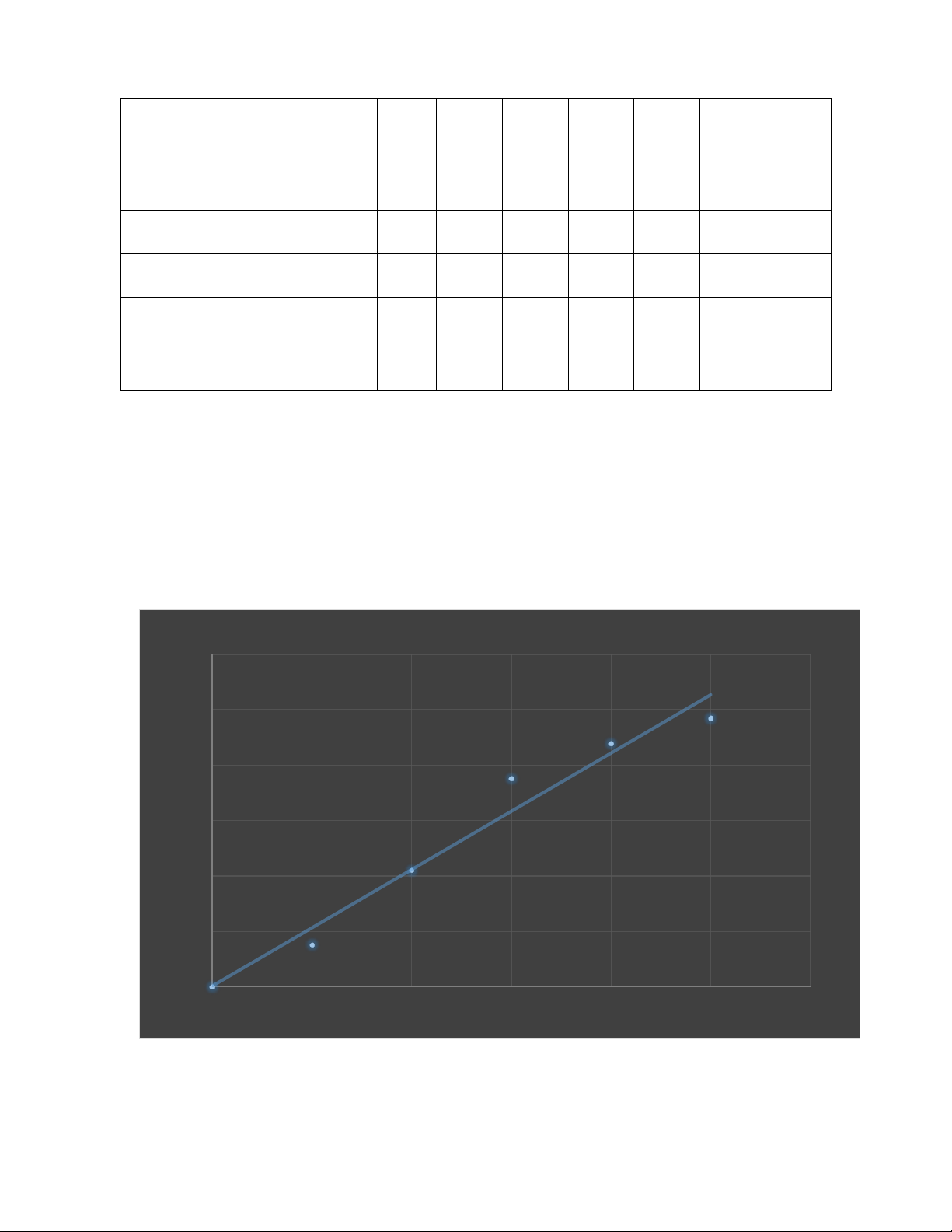
yên,... cứ tiếp tục cho đến hết. 19 ng nghi m 0 1 2 3 4 5 X Nước cất (ml) 1 0.9 0.9 0.7 0.6 0.5 -
Albumin chu n (0,1mg/ml) 0 0.1 0.2 0.3 0.4 0.5 - TT Bradford 5 5 5 5 5 5 5
N ng độ Albumin (µg /ml) 0 10 20 30 40 50 4.14 OD595nm 0
0.076 0.210 0.376 0.439 0.485 0.045
- Tính th i gian ng 0 được 20 phút, tiến hành đo độ hấp thu của dung dịch bước
sóng 595 nm. Ta có giá trị OD ),... tương tự
0, th i đi m 21 phút đo ng 1 (OD1 cứ
cách một phút đo cho hết các ng. Ghi lại giá trị OD. 3. Tính k t qu :
- Vẽ đư ng tuyến tính giữa n ng độ protein (µg/ml) với mật độ quang OD595nm
ĐƯỜNG CHUẨN BSC PHƯƠNG PHÁP BRADFORD 0,6 0,5 0,4 nm 5 9 0,3 D 5 O 0,2 y = 10,514x + 0,0015 R² = 0,9 0,1 0 C µg /ml 0 10 20 30 40 50 60
- Dựa vào phương trình đư ng tuyến tính giữa n ng độ protein (µg/ml) với mật độ
quang OD595 trên ta tính được hàm lượng protein P trong m u phân tích X. 20 − , , − , = , + . = , = , = , . − � = . = , . − . = ,
Đ tính tóan hàm lượng protein trong 1g m u cân:
Protein (µg/g) = � ∗ � = , ∗ = . � CÂU H I ỌN T P:
1. Giải thích ý nghĩa các bước trong thí nghi m.
- Pha loãng m u với h s pha loãng n lần đ được m u phân tích
Phải giảm bớt n ng độ protein trong m u, đ khi đo n ng độ quang không bị vượt
quá giới hạn cho phép.
- Lập một loạt 6 ng theo s thứ tự 0, 1, 2, 3, 4, 5 và 1 ng nghi m chứa m u cần phân tích X.
Phải pha các n ng độ khác nhau đ lập đư ng chu n. Đ xác định protein trong m u.
- Dùng đ ng h bấm giây, canh th i gian 0 phút cho 5ml thu c thử vào ng
nghi m 0, lắc đ u đ yên. th i đi m 1 phút cho 5ml thu c thử vào ng
nghi m 1, lắc đ u đ yên,... cứ tiếp tục cho đến hết.
Phương pháp này dựa trên sự thay đ i bước sóng hấp thu cực đại của thu c nhuộm
Coomassie Brilliant Blue khi tạo phức hợp với protein.
- Tính th i gian ng 0 được 20 phút, tiến hành đo độ hấp thu của dung dịch
bước sóng 595 nm. Ta có giá trị OD0, th i đi m 21 phút đo ng 1 (OD1),...
tương tự cứ cách một phút đo cho hết các ng. Ghi lại giá trị OD
Trong 20 phút thu c nhuộm kết hợp với protein khi đó thu c nhuộm hấp thu cực
đại bước sóng 595 nm.

