





Preview text:
ĐỀ KIỂM TRA GIỮA KÌ 1 NĂM HỌC 2022-2023 (ĐỀ 1)
Môn: Hóa học - Lớp 10
Thời gian làm bài: 45 phút (không tính thời gian phát đề) I. PHẦN TRẮC NGHIỆM:
Câu 1. Các hạt cấu tạo nên hầu hết các nguyên tử là
A. electron, proton và neutron.
B. electron và neutron.
C. proton và neutron.
D. electron và proton.
Câu 2. Hạt mang điện trong hạt nhân nguyên tử là A. electron. B. proton. C. neutron.
D. neutron và electron.
Câu 3. Trong nguyên tử, giá trị khối lượng −31 9,109.10
kg là của hạt nào dưới đây? A. Electron. B. Neutron. C. Proton. D. Hạt nhân.
Câu 4. Nguyên tố hóa học là tập hợp các nguyên tử có cùng
A. khối lượng.
B. số đơn vị điện tích hạt nhân.
C. kích thước. D. số neutron.
Câu 5. Cặp nguyên tử nào sau đây là đồng vị của cùng một nguyên tố hóa học? A. 16 17 X; Y . B. 14 14 X; Y . C. 3 1 X; Y . D. 19 20 X; Y . 8 8 6 7 2 1 9 10
Câu 6. Số khối của nguyên tử 65 C ulà 29 A. 65 . B. 29 . C. 36 . D. 94 .
Câu 7. Trong nguyên tử, các electron chuyển động
A. theo một quỹ đạo xác định hình tròn.
B. rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định tạo thành vỏ nguyên tử.
C. xung quanh hạt nhân không theo một quỹ đạo xác định tạo thành đám mây electron.
D. theo một quỹ đạo xác định hình bầu dục.
Câu 8. Theo nguyên lí loại trừ Pau-li, trong 1 orbital
A. chỉ chứa 1 electron và biểu diễn bằng mũi tên đi lên.
B. chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
C. chỉ chứa tối đa 2 electron có chiều tự quay giống nhau.
D. có thể chứa nhiều electron có chiều tự quay ngược nhau.
Câu 9. Các phân lớp electron có trong lớp L là: A. 1 s . B. 2 s, 2p . C. 3 s,3p,3 d . D. 4 s, 4p, 4 d, 4f .
Câu 10. Số orbital có trong phân lớp p là A. 1 . B. 3 . C. 5 . D. 7 .
Câu 11. Số electron tối đa có trong phân lớp d là A. 2 . B. 6 . C. 10 . D. 14 .
Câu 12. Mức năng lượng của lớp nào sau đây là thấp nhất? A. L. B. K . C. M. D. N.
Câu 13. Hầu hết các nguyên tử nguyên tố phi kim có số electron ở lớp ngoài cùng là A. 1, 2,3 . B. 3, 4,5 . C. 5, 6, 7 . D. 6, 7,8 .
Câu 14. Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo chiều tăng dần
A. khối lượng nguyên tử.
B. kích thước nguyên tử.
C. điện tích hạt nhân.
D. giá trị độ âm điện.
Câu 15. Ô nguyên tố không cho biết thông tin nào sau đây?
A. Kí hiệu nguyên tố. B. Tên nguyên tố.
C. Số hiệu nguyên tử.
D. Số khối hạt nhân.
Câu 16. Số chu kì có trong bảng tuần hoàn hiện nay là A. 4 . B. 5 . C. 6 . D. 7 .
Câu 17. Khối lượng của nguyên tử Calcium là 26 6, 657288 10−
kg . Khối lượng của calcium theo amu là (biết 27 1amu 1, 661.10− = kg) A. 73,084 . B. 40,08 . C. 39,79 . D. 39,74 .
Câu 18. Nguyên tử fluorine có 9 proton, 9 electron và 10 neutron. Số khối của nguyên tử fluorine là A. 9 . B. 10 . C. 19 . D. 28 .
Câu 19. Nguyên tố carbon có hai đồng vị bền: 12 C chiếm 98,89% và 13 C chiếm 1,11% . 6 6
Nguyên tử khối trung bình của nguyên tố carbon là A. 12,022 . B. 12,011 . C. 12,055 . D. 12,500 .
Câu 20. Nguyên tử O có cấu tạo từ 8 hạt proton, 9 hạt neutron và 8 hạt electron. Kí hiệu nguyên tử O là A. 16 O . B. 17 O . C. 17 O . D. 16 O . 8 9 8 9
Câu 21. Trong tự nhiên, Hydrogen có 3 đồng vị 1 2 3
H, H, H . Có bao nhiêu loại phân tử H ? 2 A. 3 . B. 6 . C. 9 . D. 12 .
Câu 22. Dãy các phân lớp được sắp xếp theo thứ tự phân mức năng lượng tăng dần là
A. 1 s, 2 s,3p,3 s .
B. 2 s,1 s,3p,3 d .
C. 1 s, 2 s, 2p,3 s . D. 3 s,3p,3 d, 4 s .
Câu 23. Cấu hình electron nào sau đây không đúng? A. 2 2 5
1s 2s 2 p . B. 2 2 6 2
1s 2s 2 p 3s . C. 2 2 6 2 5
1s 2s 2 p 3s 3 p . D. 2 2 6 2 3 2
1s 2s 2 p 3s 3 p 4s .
Câu 24. Nguyên tử Mg có Z = 12 . Mg thuộc loại nguyên tố A. s . B. p. C. d. D. f.
Câu 25. Cấu hình electron lớp ngoài cùng của nguyên tố X là 5
2p . Số hiệu nguyên tử của X là A. 5 . B. 7 . C. 9 . D. 11 .
Câu 26. Nguyên tử của nguyên tố K có 19 electron. Ở trạng thái cơ bản, K có số orbital chứa electron là A. 8 . B. 9 . C. 10 . D. 11 .
Câu 27. Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố X là 2 1
3 s 3 p . Vị trí (chu kì, nhóm) của X trong bảng tuần hoàn các nguyên tố hóa học là
A. chu kì 3, nhóm IIIB.
B. chu kì 3, nhóm IA.
C. chu kì 4, nhóm IB.
D. chu kì 3, nhóm IIIA.
Câu 28. Nguyên tử của các nguyên tố trong cùng một nhóm A (trừ He) có cùng
A. số electron.
B. số electron hóa trị.
C. số lớp electron.
D. số electron ở lớp ngoài cùng. II. PHẦN TỰ LUẬN:
Câu 29. (1,0 điểm) Cho nguyên tố X có 3 lớp electron, lớp thứ 3 có 5 electron.
a) Viết cấu hình electron nguyên tử nguyên tố X .
b) Xác định vị trí của nguyên tố X trong bảng tuần hoàn (ô, chu kì, nhóm).
Câu 30. (1,0 điểm) Tổng số hạt proton, neutron và electron trong nguyên tử nguyên tố X là
16 . Số khối của nguyên tử nguyên tố X là 11 . Viết kí hiệu của nguyên tử nguyên tố X .
Câu 31. (1,0 điểm) Trong tự nhiên, Bromine có 2 đồng vị là 79 Br và 81 Br với nguyên tử khối trung bình là 79,92 .
a) Xác định phần trăm số nguyên tử của mỗi đồng vị. b) Tính số nguyên tử 81
Br trong 35,676 gam KBr . (Cho K = 39 , số Avogađro có giá trị 23
6, 023.10 và xem nguyên tử khối mỗi đồng vị có giá trị bằng số khối).
ĐỀ KIỂM TRA GIỮA KÌ 1 NĂM HỌC 2022-2023 (ĐỀ 2)
Môn: Hóa học - Lớp 10
Thời gian làm bài: 45 phút (không tính thời gian phát đề) I. PHẦN TRẮC NGHIỆM:
Câu 1. Hạt nhân nguyên tử chứa hạt mang điện là A. proton. B. proton và neutron.
C. proton và electron. D. electron.
Câu 2. Khối lượng của nguyên tử tập trung hầu hết ở
A. hạt proton.
B. vỏ nguyên tử. C. hạt nhân. D. hạt neutron.
Câu 3. Nguyên tử oxygen (O) có 8 electron. Điện tích hạt nhân của nguyên tử oxygen là A. 8 − . B. 8 + . C. −16 . D. +16 .
Câu 4. Nguyên tố hóa học là những nguyên tử có cùng
A. số khối. B. số proton.
C. số neutron.
D. số proton và số neutron.
Câu 5. Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của nguyên tố hóa học vì cho biết
A. số khối.
B. số hiệu nguyên tử.
C. nguyên tử khối.
D. số khối và số hiệu nguyên tử.
Câu 6. Đồng vị của cùng một nguyên tố hóa học là những nguyên tử có
A. cùng số khối.
B. số proton khác nhau.
C. cùng số neutron.
D. số khối khác nhau.
Câu 7. Phát biểu nào sau đây không đúng?
A. Các electron trên cùng một lớp có mức năng lượng bằng nhau.
B. Các electron chuyển động rất nhanh xung quanh hạt nhân.
C. Các electron chuyển động xung quanh hạt nhân không theo quỹ đạo.
D. Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
Câu 8. Lớp L có bao nhiêu phân lớp? A. 2 . B. 1. C. 3 . D. 4 .
Câu 9. Số AO trong một phân lớp p là A. 1 . B. 4 . C. 6. D. 3 .
Câu 10. Nguyên tử X có 8 electron lớp ngoài cùng. X là nguyên tử của nguyên tố A. phi kim. B. kim loại.
C. khí hiếm.
D. phi kim hoặc kim loại.
Câu 11. Phân mức năng lượng của phân lớp nào sau đây cao nhất? A. 1 s . B. 2p . C. 4 s . D. 3 d .
Câu 12. Dựa vào sự khác nhau về hình dạng và định hướng của các orbital trong nguyên tử để
phân thành các orbital s, p, d, f. Các orbital s có dạng
A. hình tròn. B. hình cầu.
C. hình số 8 nổi. D. hình elip.
Câu 13. Khi biểu diễn cấu hình electron nguyên tử dưới dạng ô lượng tử (các ô vuông), theo
nguyên lí Pauli mỗi ô lượng tử chứa tối đa bao nhiêu electron? A. 2 . B. 3 . C. 6 . D. 1 .
Câu 14. Trong bảng tuần hoàn nguyên tố hóa học, chu kỳ nào sau đây có 18 nguyên tố? A. Chu kì 1 . B. Chu kì 3. C. Chu kì 4. D. Chu kì 6 .
Câu 15. Phát biểu nào sau đây không đúng về bảng tuần hoàn các nguyên tố hóa học?
A. Gồm các ô nguyên tố, các chu kỳ và các nhóm nguyên tố.
B. Có 7 chu kỳ gồm 3 chu kỳ nhỏ và 4 chu kỳ lớn.
C. Có 8 nhóm A và 8 nhóm B .
D. Các nguyên tố sắp xếp theo chiều tăng của khối lượng nguyên tử.
Câu 16. Các nguyên tố thuộc cùng một nhóm A có
A. cùng số electron trong nguyên tử.
B. số lớp electron trong nguyên tử bằng nhau.
C. số electron ở lớp ngoài cùng bằng nhau.
D. cùng nguyên tử khối. Câu 17: Beryllium (Be) có khối lượng nguyên tử là 9, 012amu ( biết 27 1amu 1, 661.10− =
kg ). Khối lượng 1 nguyên tử beryllium tính theo đơn vị gam là E. 24 14, 969.10− gam. F. 23 1, 4694.10− gam. G. 24 14, 649.10− gam. H. 24 14, 464.10− gam .
Câu 17. Kí hiệu nguyên tử photpho 31 P . Trong nguyên tử P có 15
A. 15 proton, 16 neutron, 15 electron.
B. 15 proton, 15 neutron, 15 electron.
C. 15 proton, 16 neutron, 31 electron.
D. 16 proton, 16 neutron, 15 electron.
Câu 18. Trong tự nhiên, Boron (B) có hai đồng vị là 10 B chiếm 19% và 11 B . Nguyên tử 5 5
khối trung bình của Boron là A. 11,90 . B. 10,50 . C. 10,81 . D. 10,19 .
Câu 19. Cho các đồng vị sau 1 2 35 37
H; H; Cl; Cl . Số phân tử HCl được tạo nên từ các đồng vị là 1 1 17 17 A. 3 B. 4 C. 5 D. 2
Câu 20. Trong dãy kí hiệu nguyên tử các nguyên tố sau: 14 17 15 20 20
A; B; D; E; G . Số nguyên tố 6 8 6 10 10 hóa học trong dãy là A. 2 . B. 3 . C. 4 . D. 5 .
Câu 21. Cấu hình electron nào sau đây viết đúng? A. 2 2 6 1 6
1s 2s 2 p 3s 3 p . B. 2 6 2 2 6
1s 2 p 2s 3s 3 p . C. 2 2 6 2 6
1s 2s 2 p 3s 3 p . D. 2 2 6 8
1s 2s 2 p 3 p .
Câu 22. Nguyên tử Silicon (Z = 14) có bao nhiêu electron lớp ngoài cùng? A. 6 . B. 8 . C. 2 . D. 4 .
Câu 23. Nguyên tố nào sau đây thuộc nguyên tố s?
A. X (Z = 4) . B. Y (Z = 7) . C. R (Z = 9) . D. T (Z = ) 21 .
Câu 24. Nguyên tử X có tổng số electron ở các phân lớp s là 6 và tổng số electron lớp ngoài
cùng là 7 . X là nguyên tố
A. oxygen (Z = 8) .
B. chlorine (Z = 17) .
C. fluorine (Z = 9) . D. sulfur (Z = 16) .
Câu 25. Nguyên tử của nguyên tố X có tổng số electron trên phân lớp p là 10 . Cách biểu
diễn cấu hình electron của nguyên tử X theo OA nào sau đây là đúng? A. B. C. D.
Câu 26. Cho các nguyên tố sau: Be (Z = 4),O(Z = 8), Mg (Z = 12),Ca (Z = 20) . Nguyên tố nào
sau đây không thuộc cùng một nhóm với các nguyên tố khác? A. Be. B. Mg . C. Ca. D. O.
Câu 27. Nguyên tố X ở chu kì 3, nhóm VA trong bảng tuần hoàn. Phát biểu nào sau đây về X không đúng?
A. X thuộc nguyên tố p
B. Nguyên tử X có 3 lớp electron.
C. Nguyên tử X có 5 electron độc thân.
D. Là nguyên tố phi kim. II. PHẦN TỰ LUẬN:
Câu 29. (1,0 điểm) Nguyên tử của nguyên tố Oxygen có tổng số hạt trong hạt nhân là 18 hạt
và điện tích hạt nhân của nguyên tử là 8 + .
1. Viết kí hiệu nguyên tử của Oxygen.
2. Viết cấu hình electron nguyên tữ và biểu diễn cấu hình electron theo ô orbital
3. Oxygen là kim loại, phi kim, khí hiếm? Giải thích.
Câu 30. (1,0 điểm) Cho biết một số thông tin sau: (1) Cấu hình electron của nguyên tử X là 2 2 6 2 4
1s 2s 2 p 3s 3 p , (2) Nguyên tố Y có Z = 9 ; (3) Nguyên tố T thuộc chu kỳ 2, nhóm VIA.
Hãy trình bày lập luận cho biết các nguyên tố trên nguyên tố nào cùng thuộc 1 chu kỳ hoặc 1 nhóm.
Câu 31. (1,0 điểm) Trong tự nhiên, Sliver có hai đồng vị là 109
Ag (44%) và A Ag , biết nguyên
tử khối trung bình của Ag là 107,88 .
1. Xác định đồng vị A Ag .
2. Tính khối lượng đồng vị A
Ag trong 23,176 gAg O M = 16 . 2 ( O )
ĐỀ KIỂM TRA GIỮA KÌ 1 NĂM HỌC 2022-2023 (ĐỀ 3)
Môn: Hóa học - Lớp 10
Thời gian làm bài: 45 phút (không tính thời gian phát đề)
I. PHẦN TRẮC NGHIỆM:
Câu 1. Có các loại hạt sau: electron, photon, neutron, boron, proton. Số các loại hạt cấu tạo nên nguyên tử là A. 2 . B. 3 . C. 4 . D. 1 .
Câu 2. Trong nguyên tử, số hiệu nguyên tử bằng
A. số neutron.
B. điện tích hạt nhân.
C. số đơn vị điện tích hạt nhân. D. số khối.
Câu 3. Trong nguyên tử, số khối của hạt nhân bằng
A. tổng số neutron và electron.
B. tổng số proton và neutron.
C. tổng số proton và electron.
D. tổng số neutron và điện tích hạt nhân .
Câu 4. Nguyên tố hóa học là tập hợp những nguyên tử có cùng
A. số neutron.
B. điện tích hạt nhân.
C. số khối. D. số proton.
Câu 5. Kí hiệu nguyên tử nào sau đây viết đúng? A. 14 N . B. 16 O . C. S . D. 23 Na . 7 16 11
Câu 6. Dãy nào sau đây gồm các đồng vị của cùng một nguyên tố hóa học? A. 14 14 14 X, Y, Z B. 20 20 20 X, Y, Z . C. 23 24 25 X, Y, Z . D. 56 57 56 X, Y, Z . 7 6 8 9 10 10 12 12 12 26 26 25
Câu 7. Cho các nguyên lý, quy tắc sau: (a) nguyên lí vững bền. (b) quy tắc Hund. (c) nguyên lí
pauli. Sự phân bố electron trong một orbital dựa vào nguyên lí và quy tắc nào? A. Chỉ a. B. Chỉ c. C. Chỉ b. D. Cả a, b, c.
Câu 8. Số electron chứa tối đa trong mỗi orbital nguyên tử là A. 1 . B. 2 . C. 3 . D. 4 .
Câu 9. Tổng số orbital trong các phân lớp s và d là A. 6 . B. 7 . C. 4 . D. 5 .
Câu 10. Những electron có mức năng lượng thấp nhất ở lớp nào? A. Lớp M. B. Lớp N. C. Lớp Q . D. Lớp K.
Câu 11. Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái thường là A. s, p, d, g. B. s, p, d, e. C. s, p, d, f. D. s, p, d, h.
Câu 12. Các nguyên tố mà nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng thường là nguyên tố
A. khí hiếm. B. phi kim. C. kim loại. D. khí trơ.
Câu 13. Số electron tối đa trong kí hiệu của phân lớp nào sau đây không đúng? A. 2 s . B. 6 p . C. 10 d . D. 12 f .
Câu 14. Theo nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn thì các nguyên tố mà có
cùng số lớp electron trong nguyên tử được xếp thành A. hai hàng. B. một hàng. C. một cột. D. một ô.
Câu 15. Bảng tuần hoàn hiện nay có số chu kì và số cột lần lượt là A. 7 và 18 . B. 7 và 16. C. 6 và 18 . D. 7 và 15 .
Câu 16. Nguyên tố sulfur (S) có Z = 16 thuộc nhóm VIA, có số electron hóa trị là A. 3 . B. 6. C. 7. D. 4 .
Câu 17. Khối lượng của nguyên tử sodium ( Na ) là 27 38,1864 10−
kg . Khối lượng theo amu của sodium là A. 27 1, 661.10− . B. 23,01 . C. 22,99 . D. 27 22, 99.10− .
Câu 18. Hợp kim chứa aluminium nhẹ và bền, dùng chế tạo vỏ máy bay, tên lửa. Nguyên tố
aluminium còn được sử dụng trong xây dựng, ngành điện và đồ gia dụng... Nguyên tử
aluminium chứa 13 electron và có số neutron là 14 . Tổng số hạt proton, electron, neutron
trong nguyên tử aluminium là A. 40 . B. 14 . C. 45 . D. 27 .
Câu 19. Cho kí hiệu các nguyên tử sau: 16 12 17 20 21 23
X, Y, Z, T, G, Q . Trong các nguyên tử trên, có 8 6 8 10 10 11
bao nhiêu nguyên tố hóa học? A. 6 . B. 3 . C. 4 . D. 5 .
Câu 20. Nguyên tử iron (Fe) có 26 hạt electron và 30 hạt neutron. Kí hiệu nguyên tử nào sau đây của iron là đúng? A. 30 Fe . B. 26 Fe . C. 56 Fe . D. 56 Fe . 26 30 26 30
Câu 21. Trong tự nhiên nguyên tố R có hai đồng vị bền là 10
R chiếm 19% . Nguyên tử khối
trung bình của R là 10,81 . Nguyên tử khối của đồng vị thứ 2 là A. 9 . B. 13 . C. 11 . D. 12 .
Câu 22. Cho ba nguyên tử có kí hiệu là 24 25 26
Mg, Mg, Mg . Phát biểu nào sau đây là sai ? 12 12 12
A. Đây là 3 đồng vị.
B. Số hạt electron của các nguyên tử lần lượt là: 12,13,14 .
C. Ba nguyên tử trên đều thuộc nguyên tố Mg .
D. Hạt nhân của mỗi nguyên tử đều có 12 proton.
Câu 23. Nguyên tử silicon ( 14Si) , có bao nhiêu electron ở lớp ngoài cùng? A. 6 . B. 3 . C. 5 . D. 4 .
Câu 24. Nguyên tử của nguyên tố X có 3 lớp electron và lớp ngoài cùng có 2 electron. Số
hiệu nguyên tử của nguyên tố X là A. 14 . B. 4 . C. 20 . D. 12 .
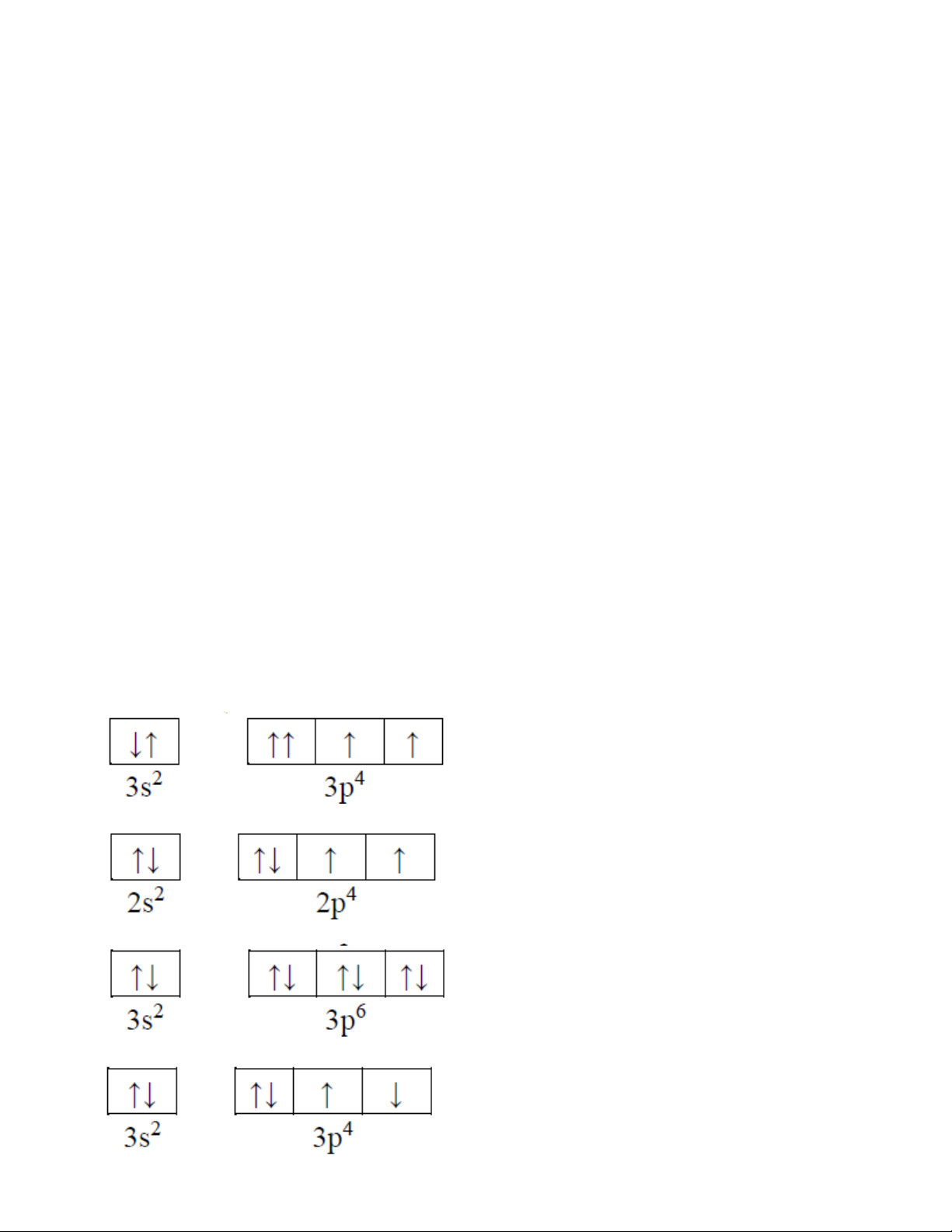
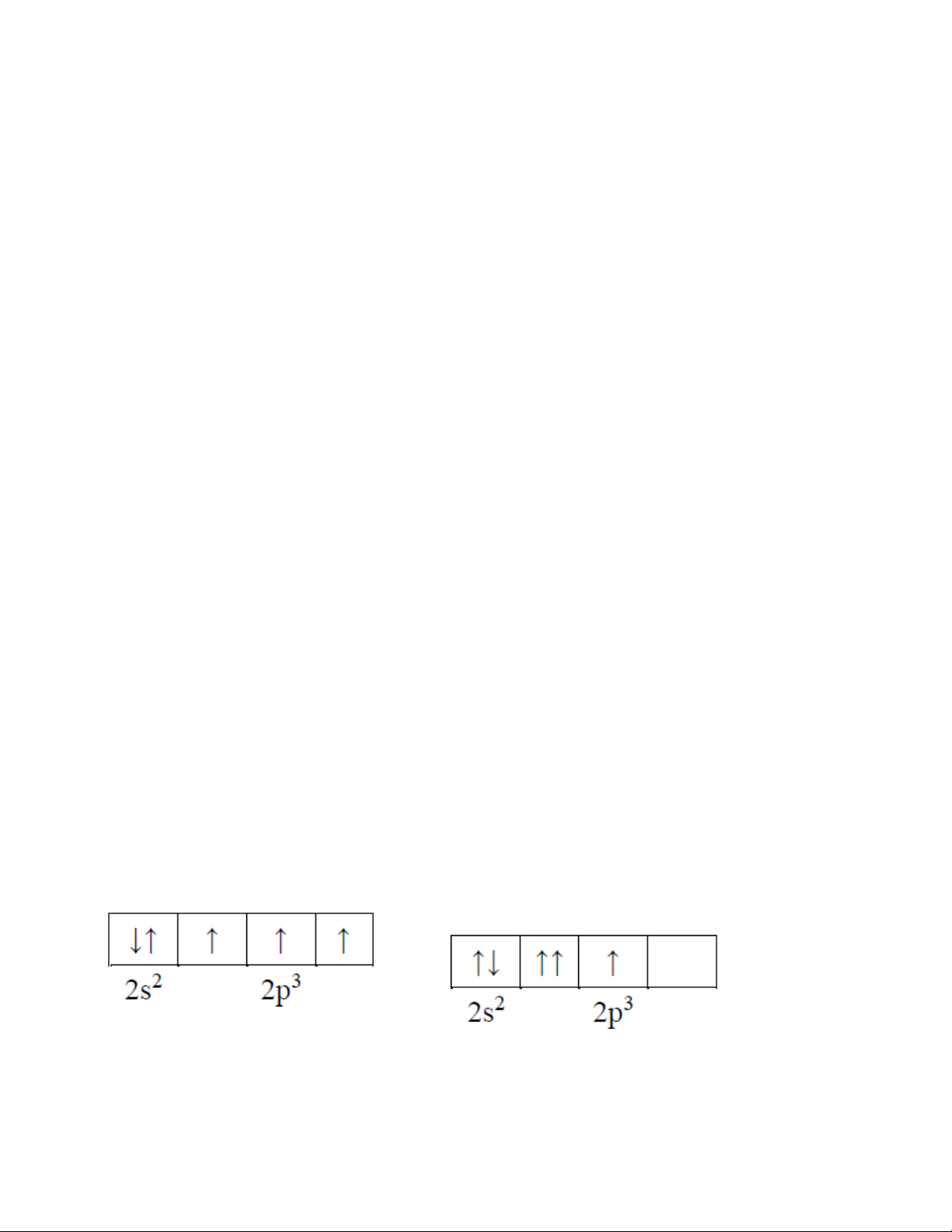
Câu 25. Cách biểu diễn electron trong OA của nguyên tử phosphorus ( P có cấu hình electron 15 ) lớp ngoài cùng là 2 3
3 s 3p nào sau đây là đúng? A. B. C. D.
Câu 26. Nguyên tử của nguyên tố X có 2 lớp electron, lớp L có 6 electron. Số electron độc thân của M là A. 3 . B. 2 . C. 1 . D. 0 .
Câu 27. Sự phân bố electron trong nguyên tử của 4 nguyên tố như sau: X (2,8, ) 1 ; Y (2, 7); Z(2,8,8, ) 1 ; T (2, )
1 . Những nguyên tố thuộc cùng nhóm là A. X; Y. B. X; Z . C. Y;T . D. X; Z; T . Câu 28. Anion −
X có cấu hình electron lớp ngoài cùng là 2 6
3s 3 p . Vị trí của nguyên tố X trong bảng tuần hoàn là
A. chu kì 3, nhóm VIIA.
B. chu kì 3, nhóm VIIIA.
C. chu kì 4, nhóm VIIA.
D. chu kì 3, nhóm VIA. II. PHẦN TỰ LUẬN:
Câu 29. (1,0 điểm) Nguyên tử R có tổng số hạt mang điện và không mang điện là 34 . Trong
đó số hạt mang điện gấp 1,833 lần số hạt không mang điện.
a. Xác định số lượng từng loại hạt trong nguyên tử R .
b. Viết kí hiệu nguyên tử R .
Câu 30. (1,0 điểm) Nguyên tử của nguyên tố X có điện tích hạt nhân là +15 .
a. Viết cấu hình electron nguyên tử X .
b. X thuộc loại nguyên tố s, p, d, hay f? Giải thích?
c. X thuộc loại nguyên tố kim loại, phi kim hay khí hiếm? Giải thích?
Câu 31. (1,0 điểm) X và Y là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp
trong bảng tuần hoàn. Tổng số proton trong hai hạt nhân nguyên tử của X và Y bằng 32 .
a. Xác định vị trí của X và Y trong bảng tuần hoàn.
b. Mỗi nguyên tử X và Y có bao nhiêu lớp electron và bao nhiêu phân lớp electron.
ĐỀ KIỂM TRA GIỮA KÌ 1 NĂM HỌC 2022-2023 (ĐỀ 4)
Môn: Hóa học - Lớp 10
Thời gian làm bài: 45 phút (không tính thời gian phát đề) I. PHẦN TRẮC NGHIỆM:
Câu 1. Kí hiệu của electron là A. e. B. n . C. p. D. q.
Câu 2. Hạt nhân của hầu hết các nguyên tử đều tạo bởi hạt nào sau đây?
A. Electron và neutron.
B. Electron và proton.
C. Neutron và proton.
D. Neutron, proton và electron.
Câu 3. Nguyên tử nguyên tố F có 9 proton, 9 electron và 10 neutron. Điện tích hạt nhân nguyên tử F là A. 9 + . B. 9 − . C. +10 . D. −10 .
Câu 4. Đồng vị của cùng một nguyên tố hóa học là những nguyên tử có
A. cùng số proton, khác số neutron.
B. cùng số electron và số neutron.
C. cùng neutron, khác nhau số proton.
D. cùng electron khác nhau proton.
Câu 5. Nguyên tố hóa học là tập hợp các nguyên tử có cùng
A. số khối.
B. điện tích hạt nhân.
C. số electron.
D. tổng số proton và neutron.
Câu 6. Nguyên tử khối của nguyên tử là
A. khối lượng tương đối của nguyên tử.
B. khối lượng tính theo đơn vị kilogam.
C. khối lượng tuyệt đối của nguyên tử.
D. khối lượng tính theo đơn vị gam.
Câu 7. Lớp M có bao nhiêu phân lớp? A. 2 . B. 4 . C. 1 . D. 3 .
Câu 8. Phát biểu nào đúng khi nói về các orbital trong một phân lớp electron?
A. Có cùng sự định hướng không gian.
B. Có cùng mức năng lượng.
C. Khác nhau về mức năng lượng.
D. Có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
Câu 9. Phát biểu nào sau đây không đúng?
A. Lớp M có 9 phân lớp.
B. Phân lớp p có 3 orbital.
C. Lớp L có 4 orbital.
D. Năng lượng của electron trên lớp K là thấp nhất.
Câu 10. Phát biểu nào sau đây đúng?
A. Lớp K là lớp xa hạt nhân nhất.
B. Các electron trong cùng một lớp có mức năng lượng bằng nhau.
C. Các electron trên cùng phân lớp có mức năng lượng bằng nhau.
D. Lớp N có 4 orbital.
Câu 11. Theo mô hình hiện đại, trong nguyên tử, electron chuyển động rất nhanh trong khu
vực không gian xung quanh hạt nhân và
A. theo quỹ đạo tròn.
B. theo những quỹ đạo xác định.
C. theo quỹ đạo bầu dục.
D. không theo những quỹ đạo xác định.
Câu 12. Nguyên tử X có 7 electron lớp ngoài cùng. X là nguyên tử của nguyên tố A. phi kim. B. kim loại. C. khí hiếm. D. hiđro.
Câu 13. Mức năng lượng của phân lớp nào sau đây thấp nhất? A. 1 s . B. 2 s . C. 2p . D. 3s.
Câu 14. Trong bảng tuần hoàn, có bao nhiêu chu kì nhỏ? A. 4 . B. 3 . C. 2 . D. 1 .
Câu 15. Trong bảng tuần hoàn, các nguyên tố có cùng số lớp electron trong nguyên tử được xếp
A. cùng một hàng.
B. cùng một cột.
C. cùng một ô. D. thành hai cột.
Câu 16. Các nguyên tố thuộc cùng một nhóm A có
A. cùng số electron trong nguyên tử.
B. số lớp electron trong nguyên tử bằng nhau.
C. số electron ở lớp ngoài cùng bằng nhau.
D. cùng nguyên tử khối.
Câu 17. Kích thước của nguyên tử chủ yếu là
A. kích thước của hạt proton.
B. kích thước của lớp vỏ.
C. kích thước của hạt electron.
D. kích thước của hạt nhân.
Câu 18. Số hiệu nguyên tử cho biết
A. số proton trong hạt nhân nguyên tử.
B. số electron và neutron của nguyên tử.
C. số khối của nguyên tử đó.
D. số neutron trong hạt nhân nguyên tử.
Câu 19. Nguyên tử của nguyên tố P có 15 proton, 16 neutron, 15 electron được kí hiệu là A. 16 P . B. 31 P . C. 31 P . D. 30 P . 15 15 16 16
Câu 20. Copper là hỗn hợp của hai đồng vị bền 63 Cu chiếm 73% và 65 Cu chiếm 27% tổng 29 29
số nguyên tử copper trong tự nhiên. Nguyên tử khối trung bình của copper là bao nhiêu? A. 63,54 . B. 64,46 . C. 64,54 . D. 63,46 .
Câu 21. Trong tự nhiên, oxygen có 3 đồng vị là 16 17 18
O, O, O . Có bao nhiêu loại phân tử O ? 2 A. 3 . B. 6 . C. 9. D. 12 .
Câu 22. Nguyên tử O (Z = 8) có bao nhiêu lớp electron? A. 1 lớp. B. 2 lớp. C. 3 lớp. D. 4 lớp.
Câu 23. Cấu hình electron nguyên tử Al là 2 2 6 2 1
1s 2s 2 p 3s 3 p . Số electron lớp ngoài cùng của
nguyên tử Al là bao nhiêu? A. 1 . B. 2 . C. 3 . D. 4 .
Câu 24. Cấu hình electron của nguyên tử Mg là 2 2 6 2
1 s 2 s 2p 3 s . Mg thuộc loại nguyên tố nào?
A. Nguyên tố s.
B. Nguyên tố p.
C. Nguyên tố d.
D. Nguyên tố f .
Câu 25. Cho cấu hình electron nguyên tử các nguyên tố: ( 2 1 s s ) ( 2 2 6 2 s s p s ) C ( 2 2 2 Li 1 2 , Mg 1 2 2 3 ,
1s 2s 2 p ) . Nguyên tố nào cùng thuộc chu kì 2 ? A. Li, Mg, C . B. Li, Mg . C. Li, C. D. Mg, C .
Câu 26. Cấu hình electron nguyên tử X là 2 2 6
1 s 2 s 2p . Nguyên tố X ở vị trí nào trong bảng tuần hoàn?
A. Chu kì 3, nhóm VIA.
B. Chu kì 3, nhóm VIIIA.
C. Chu kì 2 nhóm VIA.
D. Chu kì 2, nhóm VIIIA.
Câu 27. Trong bảng tuần hoàn, nguyên tố X ở chu kì 2, nhóm VA. Cấu hình electron lớp
ngoài cùng của nguyên tử nguyên tố X là A. 2 3 2s 2 p . B. 2 5 2s 2 p . C. 2 1 2s 2 p . D. 2 6 2s 2 p .
Câu 28. Sulfur dạng kem bôi được sử dụng để điều trị mụn trứng cá. Nguyên tử sulfur có phân
lớp electron ngoài cùng là 4
3 p . Phát biểu nào sau đây sai khi nói về nguyên tử sulfur?
A. Lớp ngoài cùng của sulfur có 6 electron.
B. Trong bảng tuần hoàn sulfur nằm ở chu kì 3 .
C. Hạt nhân nguyên tử sulfur có 16 electron. II. PHẦN TỰ LUẬN:
Câu 29. (1 điểm) Cho hai nguyên tố sau: Li (Z = 3);Cl(Z = 17) .
a) Viết cấu hình electron nguyên tử của nguyên tố Li, Cl .
b) Li, Cl là nguyên tố s, p hay d? Giải thích.
Câu 30. (1 điểm) Nguyên tố X thuộc chu kì 3, nhóm VIA trong bảng tuần hoàn.
a) Viết cấu hình electron nguyên tử X .
b) Nguyên tố X là kim loại, phi kim hay khí hiếm? Giải thích.
Câu 31. (1 điểm) Hiđro có nguyên tử khối trung bình là 1,008 . Hỏi có bao nhiêu nguyên tử
của đồng vị 2 H trong 1ml nước? Biết: Trong nước chỉ có hai đồng vị 1 H và 2 H ; khối lượng 1 1 1
riêng của nước là 1 g / ml ; nguyên tử khối của oxi bằng 16 ; số Avogadro 23 N = 6, 02.10 .