














Preview text:
Họ và tên: ……………………………………………SBD: ………………… SỞ GD&ĐT. . …
ĐỀ KIỂM TRA CHẤT LƯỢNG ĐẦU NĂM LỚP 11
TRƯỜNG THPT. . . . . . . . . . .
NĂM HỌC 20. . - 20. . ---***--- Môn: Hóa học
Thời gian làm bài: 60 phút;(40 câu trắc nghiệm)
Cho khối lượng nguyên tử của các nguyên tố: H: 1; C: 12; N: 14; O: 16; Na: 23; S: 32; Cl: 35,5;
K: 39; Br: 80; Ba: 137; Ag: 108; Fe: 56; Cu: 64; I: 127.
Câu 1: Từ muối biển người ta điều chế nước Giaven bằng phương pháp nào?
A. Điện phân dung dịch muối ăn không có màng ngăn xốp.
B. Điện phân nóng chảy thu lấy clo và Na. Hòa tan Na rồi sục khí clo vào.
C. Điện phân dung dịch muối ăn có màng ngăn xốp.
D. Không phải A, B, C.
Câu 2: Muối iot dùng làm muối ăn là gì?
A. Muối có công thức NaI.
B. Muối ăn trộn thêm I2.
C. Muối ăn có trộn thêm I2 với tỉ lệ nhất định. D. Muối ăn có trộn thêm một lượng nhỏ KI hoặc KIO3.
Câu 3: Tầng ozon có tác dụng như thế nào?
A. Làm không khí sạch hơn.
B. Có khả năng sát khuẩn.
C. Ngăn chặn hiệu ứng nhà kính.
D. Hấp thu các tia cực tím gây hại.
Câu 4: Để pha loãng dung dịch H2SO4 đậm đặc, trong phòng thí nghiệm, có thể tiến hành theo cách nào sau đây?
A. Cho nhanh nước vào axit.
B. Cho từ từ nước vào axit và khuấy đều.
C. Cho nhanh axit vào nước và khuấy đều.
D. Cho từ từ axit vào nước và khuấy đều.
Câu 5: Trong phòng thí nghiệm, dung dịch HF được bảo quản trong bình bằng: A. Nhựa. B. Kim loại. C. Thủy tinh. D. Gốm sứ.
Câu 6: Khí nào sau đây gây ra hiện tượng mưa axit? A. CO2. B. CH4. C. SO2. D. NH3.
Câu 7: Không khí trong phòng thí nghiệm bị nhiễm bẩn bởi khí Cl2. Để khử độc có thể xịt vào
không khí dung dịch nào sau đây? A. Dung dịch HCl. B. Dung dịch NH3. C. Dung dịch NaOH. D. Dung dịch HCl.
Câu 8: Cho phương trình hóa học:
a FeSO4 + b KMnO4 + c NaHSO4 → x Fe2(SO4)3 + y K2SO4 + z MnSO4 + t Na2SO4 + u H2O
với a,b,c,x,y,z,t,u là các số nguyên tối giản.
Tổng hệ số các chất trong phương trình hóa học trên là: A. 28. B. 46. C. 50. D. 52.
Câu 9: Một hợp chất ion Y được cấu tạo từ ion M+ và ion X-. Tổng số hạt electron trong Y bằng
36. Số hạt proton trong M+ nhiều hơn trong X- là 2. Vị trí của nguyên tố M và X trong bảng HTTH
các nguyên tố hóa học là
A. M: chu kì 3, nhóm IA; X: chu kì 3, nhóm VIIA.
B. M: chu kì 3, nhóm IB; X: chu kì 3, nhóm VIIA.
C. M: chu kì 4, nhóm IA; X: chu kì 4, nhóm VIIA.
D. M: chu kì 4, nhóm IA; X: chu kì 3, nhóm VIIA.
Câu 10: Cho các thí nghiệm sau: Trang 1/21 - Mã đề thi 132
1) Cho Mg vào dd H2SO4(loãng).
2) Cho Fe3O4 vào dd H2SO4(loãng).
3) Cho FeSO4 vào dd H2SO4(đặc ,nóng). 4) Cho Al(OH)3 vào dd H2SO4(đặc ,nóng).
5) Cho BaCl2 vào dd H2SO4(đặc ,nóng). 6) Cho Al(OH)3 vào dd H2SO4(loãng)
Trong các thí nghiêm trên số thí nghiệm xảy ra phản ứng mà H2SO4 đóng vai trò là chất oxi hóa là:A.2. B. 3. C. 4. D. 5.
Câu 11: Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 7. Nguyên tử của
nguyên tố Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8. Cấu hình
electron lớp ngoài cùng của Y là A. 3s23p5 B. 2s22p4. C. 3s23p4. D. 3s23p3.
Câu 12: Cho các hạt vi mô: O2- (Z = 8); F – (Z = 9); Na, Na+ (Z = 11), Mg, Mg2+ (Z = 12), Al (Z =
13). Thứ tự giảm dần bán kính hạt là
A. Na, Mg, Al, Na+, Mg2+, O2-, F -
B. Na, Mg, Al, O2-, F - , Na+, Mg2+.
C. O2-, F -, Na, Na+, Mg, Mg2+, Al.
D. Na+, Mg2+, O2-, F -, Na, Mg, Al
Câu 13: Nguyên tắc nào để sắp xếp các nguyên tố trong bảng tuần hoàn sau đây là sai ?
A. Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành một cột.
B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
C. Các nguyên tố được sắp xếp theo chiều tăng dần của khối lượng nguyên tử.
D. Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
Câu 14: Cho các nguyên tố X (Z = 11); Y(Z = 13); T(Z=17). Nhận xét nào sau đây là đúng?
A. Oxit và hiđroxit của X, Y, T đều là chất lưỡng tính.
B. Nguyên tử các nguyên tố X, Y, T ở trạng thái cơ bản đều có 1 electron độc thân.
C. Các hợp chất tạo bởi X với T và Y với T đều là hợp chất ion.
D. Theo chiều X, Y, T bán kính của các nguyên tử tương ứng tăng dần.
Câu 15: Nguyên tử R tạo được cation R+. Cấu hình electron ở phân lớp ngoài cùng của R+ (ở trạng
thái cơ bản) là 3p6. Tổng số hạt mang điện trong R+ là: A. 37. B. 19. C. 38 D. 18.
Câu 16: Ion M3+ có cấu hình e của khí hiếm Ne. Vị trí của M trong bảng hệ thống tuần hoàn là :
A. Chu kỳ 2, nhóm VIIIA.
B. Chu kỳ 2, nhóm VA.
C. Chu kỳ 3, nhóm IIIA.
D. Chu kỳ 3, nhóm IVA.
Câu 17: Cho phương trình hóa học của phản ứng X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ
của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của
phản ứng tính theo chất Y trong khoảng thời gian trên là: A. 2,0. 10-4 mol/(l.s). B. 1,0. 10-4 mol/(l.s). C. 4,0. 10-4 mol/(l.s). D. 8,0. 10-4 mol/(l.s).
Câu 18: Cho các cân bằng sau:
(1)H2(k) I2(k) 2HI (k); (2)HI (k) 1 / 2H2(k) 1 / 2I2(k)
Ở nhiệt độ xác định nếu KC của cân bằng (1)bằng 64 thì KC của cân bằng (2) là: A. 4 B. 0,5 C. 0,25 D. 0,125.
Câu 19: Biết độ tan của NaCl trong 100 gam nước ở 900C là 50 gam và ở 00C là 35 gam. Khi làm
lạnh 600 gam dung dịch NaCl bão hòa ở 900C về 00C làm thoát ra bao nhiêu gam tinh thể NaCl? A. 45 gam. B. 55 gam. C. 50 gam. D. 60 gam.
Câu 20: Hòa tan hoàn toàn hỗn hợp X gồm 0,002 mol FeS2 và 0,003 mol FeS vào lượng dư dung
dịch H2SO4 đặc nóng thu được khí X. Hấp thụ toàn bộ khí X bằng lượng vừa đủ V ml dung dịch
KMnO4 0,05M. V có giá trị là: A. 280 ml B.172ml C.188ml D. 228 ml. Trang 2/21 - Mã đề thi 132
Câu 21: Dung dịch X chứa 0,1 mol NaCl và 0,15 mol NaF. Cho dung dịch X tác dụng với dung
dịch AgNO3 dư. Kết tủa sinh ra có khối lượng là: A. 19,05 gam B. 14,35 gam C. 28,7 gam D. 33,4 gam
Câu 22: Cho 21,4 gam một muối clorua tác dụng với dung dịch AgNO3 dư thu được 57,4 g kết tủa.
Mặt khác cho 10,7 gam muối clorua trên tác dụng với 500ml dung dịch KOH 1M, đến phản ứng
hoàn toàn, cô cạn dung dịch thu được m gam chất rắn khan.Tính m: A. 38,7g B. 28,7g C. 31,7 g D. 23,7 g
Câu 23:Nung 32,4 gam chất rắn X gồm FeCO3, FeS, FeS2 có tỷ lệ số mol là 1:1:1 trong hỗn hợp
khí Y gồm O2 và O3 có tỷ lệ số mol là 1:1.Biết các phản ứng xảy ra hoàn toàn. Số mol Y tham gia phản ứng là : A. 0,38. B. 0,48. C. 0,24. D. 0,26.
Câu 24: Hòa tan hoàn toàn 8,4 gam Fe bằng dung dịch H2SO4 loãng (dư), thu được dung dịch X.
Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là: A. 60. B. 30. C. 120. D. 90.
Câu 25: Hòa tan hết 0,02 mol KClO3 trong lượng dư dung dịch HCl đặc, thu được dung dịch Y và
khí Cl2. Hấp thụ hết toàn bộ lượng khí Cl2 vào dung dịch chứa 0,06 mol NaBr, thu được m gam
Br2 (giả thiết Cl2 và Br2 đều phản ứng không đáng kể với H2O). Các phản ứng đều xảy ra hoàn toàn. Giá trị của m là: A. 4,80. B. 3,20. C. 3,84. D. 4,16. dd H2SO4 đặc
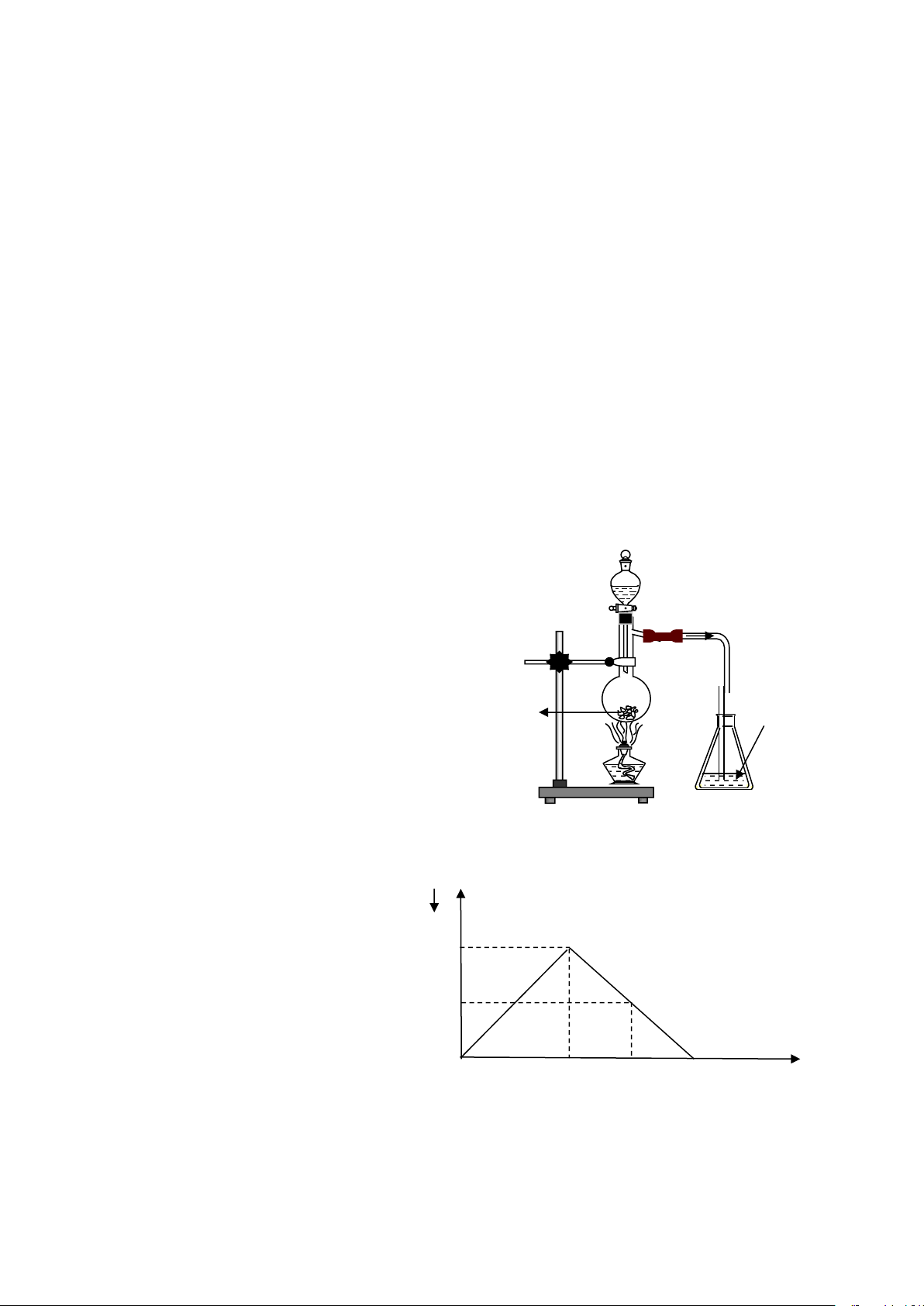
Câu 26: Cho hình vẽ sau:
Hiện tượng xảy ra trong bình eclen chứa Br2:
A. Có kết tủa xuất hiện.
B. Dung dịch Br2 bị mất màu.
C. Vừa có kết tủa vừa mất màu dung dịch dd Br2 Na2SO3 tt
Br2. D.Khôngcóphảnứngxảyra.
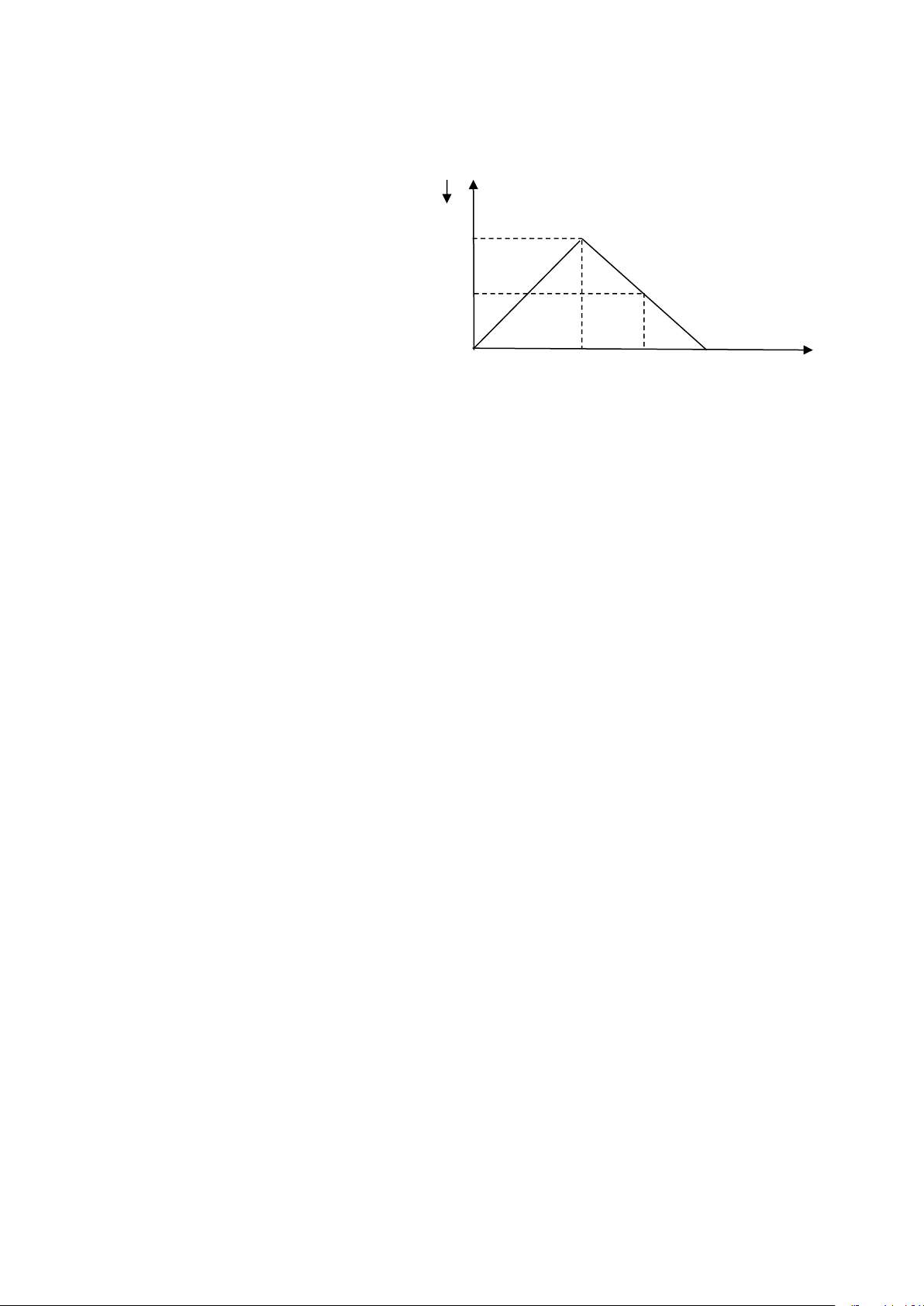
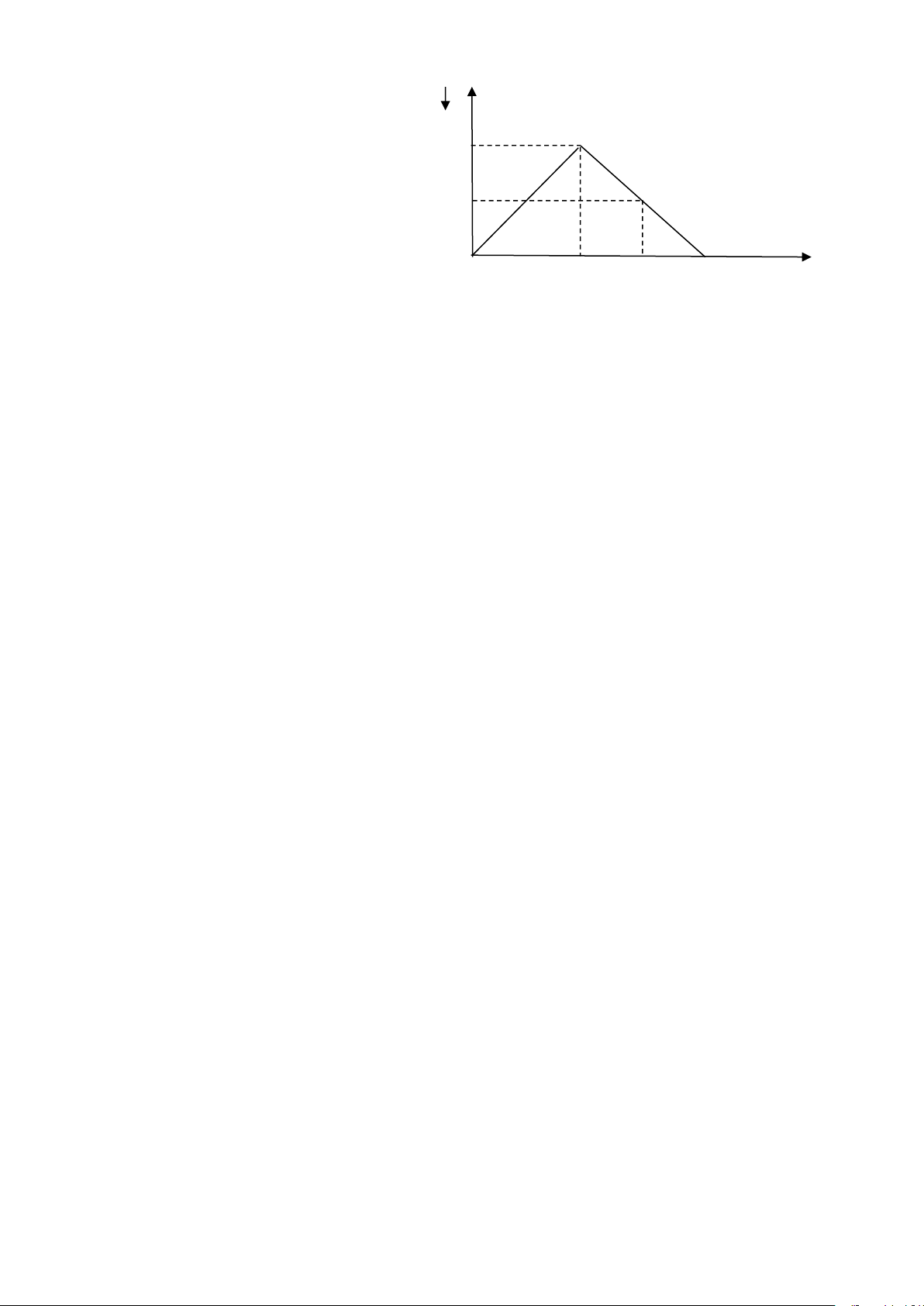
Câu 27: Sục SO2 vào dung dịch Ba(OH) n
2 ta quan sát hiện tượng theo đồ
thị hình bên (số liệu tính theo đơn vị mol).Giá trị của x là : a A. 1,8(mol). B. 2,2(mol). 0,5a C. 2,5(mol). D. 2,0(mol). 1,5 x nSO2
Câu 28: Nung nóng 22,12 gam KMnO4 và 18,375 gam KClO3, sau một thời gian thu được chất
rắn X gồm 6 chất có khối lượng 37,295 gam. Cho X tác dụng với dung dịch HCl đặc dư, đun nóng.
Toàn bộ lượng khí clo thu được cho phản ứng hết với m gam bột Fe đốt nóng được chất nóng Y. Trang 3/21 - Mã đề thi 132
Hòa tan hoàn toàn Y vào nước được dung dịch Z. thêm AgNO3 dư vào dung dịch Z đến khi phản
ứng hoàn toàn được 204,6 gam kết tủa. Giá trị m là: A. 22,44. B. 28,0. C. 33,6. D. 25,2.
Câu 29: Cho hỗn hợp A gồm FeS, FeS2 tác dụng hết với m gam dung dịch H2SO4 98%. Sau phản
ứng thu được dung dịch X và khí Y. Dẫn khí Y vào dung dịch nước vôi trong thu được 10,8 gam
kết tủa và dung dịch Z, đun nóng dung dịch Z thu được tối đa 18 gam kết tủa. Dung dịch X có khối
lượng giảm so với khối lượng dung dịch H2SO4 ban đầu là 18,4 gam. Biết dung dịch H2SO4 đã
20% so với lượng cần thiết. Giá trị gần đúng nhất của m là: A. 46. B. 35. C. 38. D. 40.
Câu 30: Một hỗn hợp X gồm 2 muối sunfit và hiđrosunfit của cùng một kim loại kiềm.
Thực hiện ba thí nghiệm sau:
Thí nghiệm 1: Cho 21,800 gam X tác dụng với dung dịch H2SO4 loãng dư.Sau phản ứng thu được
V lít khí A.Biết V lít khí A làm mất màu vừa đủ 400 ml dung dịch KMnO4 0,15M.
Thí nghiệm 2: 54,500 gam X cũng tác dụng vừa đủ với 100ml dung dịch NaOH 1,25M.
Thí nghiệm 3: Cho V lít khí A hấp thụ vào 250 gam dung dịch Ba(OH)2 6,84% .Sau phản ứng thu
được dung dịch B.Kim loại kiềm và nồng độ phần trăm của dung dịch B : A. Na và 4,603%. B.Na và 9,206%. C. K và 6,010%. D.K và 9,206%.
Câu 31: Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2. Số hiệu
nguyên tử của nguyên tố X là: A. 12. B. 13. C. 11. D. 14.
Câu 32: Cho các nguyên tố với số hiệu nguyên tử sau: X (Z = 1); Y (Z = 7); E (Z = 12); T (Z =
19). Dãy gồm các nguyên tố kim loại là: A. X, Y, E. B. X, Y, E, T. C. E, T. D. Y, T.
Câu 33: Chất nào sau đây là hợp chất ion? A. SO2. B. K2O . C. CO2. D. HCl.
Câu 34: Cho phản ứng : NaX(rắn) + H2SO4(đặc) NaHSO4 + HX(khí). Các hidro halogenua (HX) có
thể điều chế theo phản ứng trên là : A. HBr và HI. B. HCl, HBr và HI. C. HF và HCl. D. HF, HCl, HBr và HI.
Câu 35: Một chất A được cấu tạo từ cation M2+ và anion X-. Trong phân tử MX2 có tổng số proton,
nowtron, electron là 186 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 54
hạt. Số khối của M2+ lớn hơn số khối của X- là 21. Tổng số hạt trong cation M2+ nhiều hơn tổng số
hạt trong anion X- là 27. Nhận xét nào sau đây đúng:
A. M thuộc nhóm A trong bảng tuần hoàn.
B. M và X cùng thuộc một chu kỳ.
C. M là nguyên tố có nhiều số Oxi hóa trong hợp chất.
D. X thuộc nhóm VIA trong bảng tuần hoàn.
Câu 36: Hỗn hợp khí A gồm Cl2 và O2. Cho A phản ứng vừa đủ với 1 hỗn hợp gồm 4,8 gam Mg
và 8,1 gam Al thu được 37,05 gam hỗn hợp các muối clorua và các oxit của 2 kim loại. Thành
phần % theo khối lượng của các khí trong A là: A. 90% và 10%. B. 73,5% và 26,5%. C. 15,5% và 84,5%. D. 56% và 35%.
Câu 37: Cho cân bằng (trong bình kín): CO (k) + H2O (k) ↔ CO2 (k) + H2 (k) ∆H < 0 Trang 4/21 - Mã đề thi 132
Trong các yếu tố: (1) tăng nhiệt độ; (2) Thêm một lượng hơi nước; (3) thêm một lượng H2 ;
(4) Tăng áp suất chung của hệ; (5) dùng chất xúc tác.
Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là: A. (1), (2), (3). B. (1), (4), (5). C. (2), (3), (4). D. (1), (2), (4).
Câu 38: Trong tự nhiên, nguyên tố brom có 2 đồng vị là 79 35 Br và 81
35 Br. Nếu nguyên tử khối trung
bình là brom là 79,91 thì phần trăm của 2 đồng vị này lần lượt là
A. 45,5% và 54,5%. B. 61,8% và 38,2%. C. 54,5% và 45,5%. D. 35% và 65%.
Câu 39: Khối lượng riêng của canxi kim loại là 1,55 g/cm3. Giả thiết rằng, trong tinh thể canxi các
nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Bán kính
nguyên tử canxi tính theo lí thuyết là A. 0,155nm. B. 0,185 nm. C. 0,196 nm. D. 0,168 nm.
Câu 40: Hòa tan 200 gam SO3 vào m2 gam dung dịch H2SO4 49% ta được dung dịch H2SO4 78,4%. Giá trị của m2 là A. 133,3 gam. B. 146,9 gam. C. 272,2 gam. D. 300 gam.
(Cán bộ coi thi không giải thích gì thêm, thí sinh không được sử dụng Bảng tuần hoàn các nguyên tố hóa học) ------- HẾT ------- Trang 5/21 - Mã đề thi 132 ĐỀ SỐ 2
SỞ GD&ĐT. . . .TRƯỜNG
ĐỀ KIỂM TRA CHẤT LƯỢNG ĐẦU NĂM LỚP 11
THPT. . . . . . . . . . .
NĂM HỌC 20. . - 20. . ---***--- Môn: Hóa học
Thời gian làm bài: 60 phút;(40 câu trắc nghiệm)
Họ và tên: ……………………………………………SBD: …………………
Cho khối lượng nguyên tử của các nguyên tố: H: 1; C: 12; N: 14; O: 16; Na: 23; S: 32; Cl: 35,5;
K: 39; Br: 80; Ba: 137; Ag: 108; Fe: 56; Cu: 64; I: 127.
Câu 1: Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2. Số hiệu
nguyên tử của nguyên tố X là: A. 13. B. 12. C. 11. D. 14.
Câu 2: Không khí trong phòng thí nghiệm bị nhiễm bẩn bởi khí Cl2. Để khử độc có thể xịt vào
không khí dung dịch nào sau đây? A. Dung dịch NH3. B. Dung dịch HCl. C. Dung dịch NaOH. D. Dung dịch HCl.
Câu 3: Một hợp chất ion Y được cấu tạo từ ion M+ và ion X-. Tổng số hạt electron trong Y bằng
36. Số hạt proton trong M+ nhiều hơn trong X- là 2. Vị trí của nguyên tố M và X trong bảng HTTH
các nguyên tố hóa học là
A. M: chu kì 3, nhóm IA; X: chu kì 3, nhóm VIIA.
B. M: chu kì 4, nhóm IA; X: chu kì 3, nhóm VIIA.
C. M: chu kì 3, nhóm IB; X: chu kì 3, nhóm VIIA.
D. M: chu kì 4, nhóm IA; X: chu kì 4, nhóm VIIA.
Câu 4: Nguyên tử R tạo được cation R+. Cấu hình electron ở phân lớp ngoài cùng của R+ (ở trạng
thái cơ bản) là 3p6. Tổng số hạt mang điện trong R+ là: A. 19. B. 38 C. 37. D. 18.
Câu 5: Từ muối biển người ta điều chế nước Giaven bằng phương pháp nào?
E. Điện phân nóng chảy thu lấy clo và Na. Hòa tan Na rồi sục khí clo vào.
F. Điện phân dung dịch muối ăn không có màng ngăn xốp.
G. Điện phân dung dịch muối ăn có màng ngăn xốp.
D. Không phải A, B, C.
Câu 6: Cho cân bằng (trong bình kín): CO (k) + H2O (k) ↔ CO2 (k) + H2 (k) ∆H < 0
Trong các yếu tố: (1) tăng nhiệt độ; (2) Thêm một lượng hơi nước; (3) thêm một lượng H2 ;
(4) Tăng áp suất chung của hệ; (5) dùng chất xúc tác.
Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là: A. (1), (4), (5). B. (2), (3), (4). C. (1), (2), (4). D. (1), (2), (3).
Câu 7: Khí nào sau đây gây ra hiện tượng mưa axit? A. SO2. B. CO2. C. CH4. D. NH3.
Câu 8: Ion M3+ có cấu hình e của khí hiếm Ne. Vị trí của M trong bảng hệ thống tuần hoàn là
A. Chu kỳ 3, nhóm IIIA.
B. Chu kỳ 2, nhóm VIIIA.
C. Chu kỳ 2, nhóm VA.
D. Chu kỳ 3, nhóm IVA. Trang 6/21 - Mã đề thi 132
Câu 9: Cho các cân bằng sau:
(1)H2(k) I2(k) 2HI(k); (2)HI(k) 1/ 2H2(k) 1/ 2I2(k)
Ở nhiệt độ xác định nếu KC của cân bằng (1)bằng 64 thì KC của cân bằng (2) là: A. 4. B. 0,125. C. 0,5. D. 0,25.
Câu 10: Cho phản ứng : NaX(rắn) + H2SO4(đặc) NaHSO4 + HX(khí). Các hidro halogenua (HX) có
thể điều chế theo phản ứng trên là : A. HBr và HI. B. HCl, HBr và HI. C. HF, HCl, HBr và HI. D. HF và HCl.
Câu 11: Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 7. Nguyên tử của
nguyên tố Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8. Cấu hình
electron lớp ngoài cùng của Y là: A. 2s22p4. B. 3s23p4. C. 3s23p3. D. 3s23p5
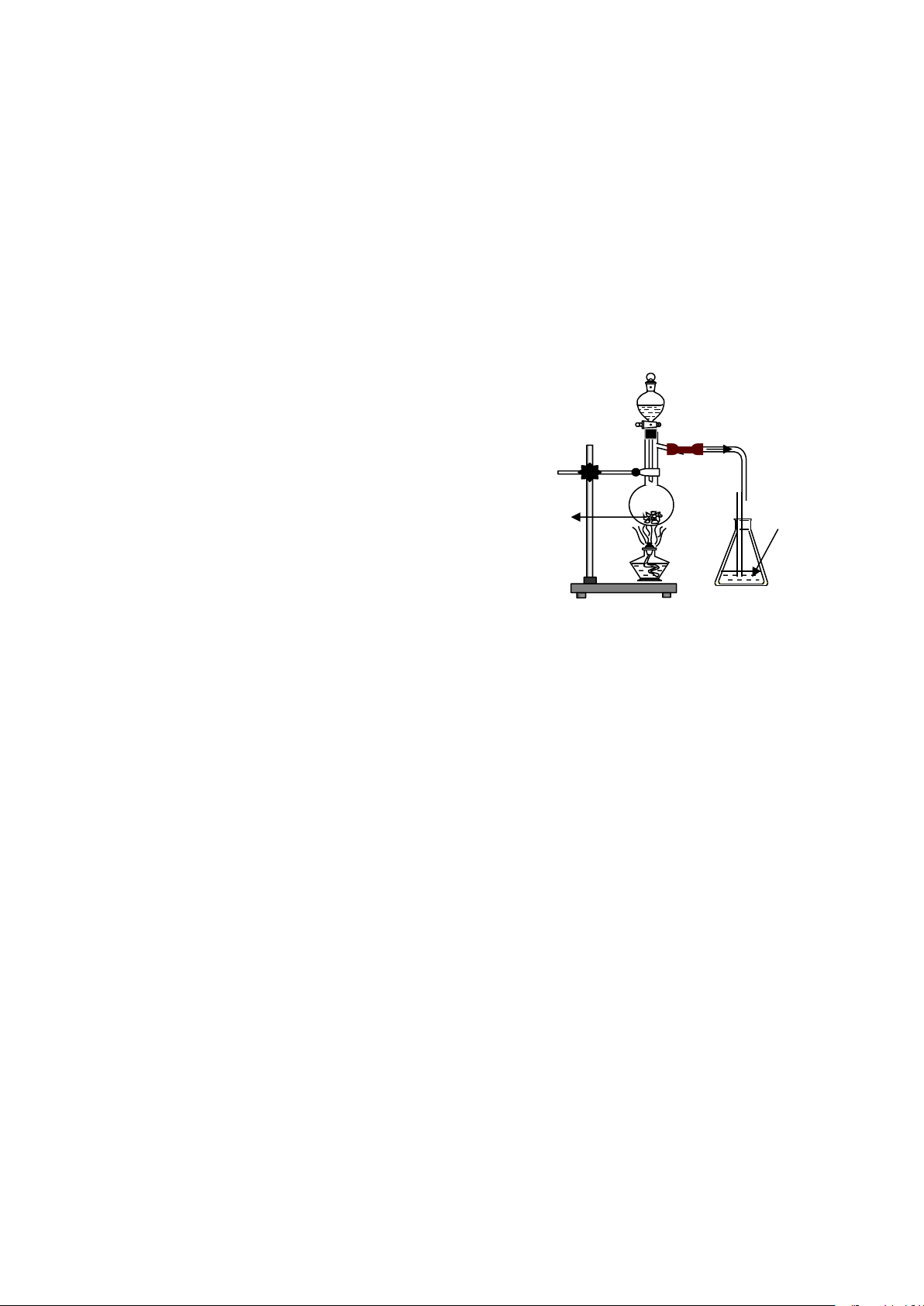
Câu 12: Cho hình vẽ bên: dd H2SO4 đặc
Hiện tượng xảy ra trong bình eclen chứa Br2:
A. Có kết tủa xuất hiện.
B. Vừa có kết tủa vừa mất màu dung dịch Br2. dd Br2 Na C. Dung dịch Br 2SO3 tt 2 bị mất màu.
D. Không có phản ứng xảy ra.
Câu 13: Biết độ tan của NaCl trong 100 gam nước ở 900C là 50 gam và ở 00C là 35 gam. Khi làm
lạnh 600 gam dung dịch NaCl bão hòa ở 900C về 00C làm thoát ra bao nhiêu gam tinh thể NaCl? A. 60 gam. B. 45 gam. C. 55 gam. D. 50 gam.
Câu 14: Trong phòng thí nghiệm, dung dịch HF được bảo quản trong bình bằng: A. Kim loại. B. Nhựa. C. Thủy tinh. D. Gốm sứ.
Câu 15: Tầng ozon có tác dụng như thế nào?
A. Làm không khí sạch hơn.
B. Có khả năng sát khuẩn.
C. Hấp thu các tia cực tím gây hại.
D. Ngăn chặn hiệu ứng nhà kính.
Câu 16: Cho các nguyên tố với số hiệu nguyên tử sau: X (Z = 1); Y (Z = 7); E (Z = 12); T (Z =
19). Dãy gồm các nguyên tố kim loại là: A. X, Y, E. B. X, Y, E, T. C. E, T. D. Y, T.
Câu 17: Một chất A được cấu tạo từ cation M2+ và anion X-. Trong phân tử MX2 có tổng số proton,
nowtron, electron là 186 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 54
hạt. Số khối của M2+ lớn hơn số khối của X- là 21. Tổng số hạt trong cation M2+ nhiều hơn tổng số
hạt trong anion X- là 27. Nhận xét nào sau đây đúng:
A. M thuộc nhóm A trong bảng tuần hoàn.
B. M và X cùng thuộc một chu kỳ.
C. X thuộc nhóm VIA trong bảng tuần hoàn.
D. M là nguyên tố có nhiều số Oxi hóa trong hợp chất.
Câu 18: Chất nào sau đây là hợp chất ion? A. SO2. B. CO2. C. HCl. D. K2O . Trang 7/21 - Mã đề thi 132
Câu 19: Cho các hạt vi mô: O2- (Z = 8); F – (Z = 9); Na, Na+ (Z = 11), Mg, Mg2+ (Z = 12), Al (Z =
13). Thứ tự giảm dần bán kính hạt là:
A. Na, Mg, Al, O2-, F - , Na+, Mg2+.
B. Na, Mg, Al, Na+, Mg2+, O2-, F -.
C. O2-, F -, Na, Na+, Mg, Mg2+, Al.
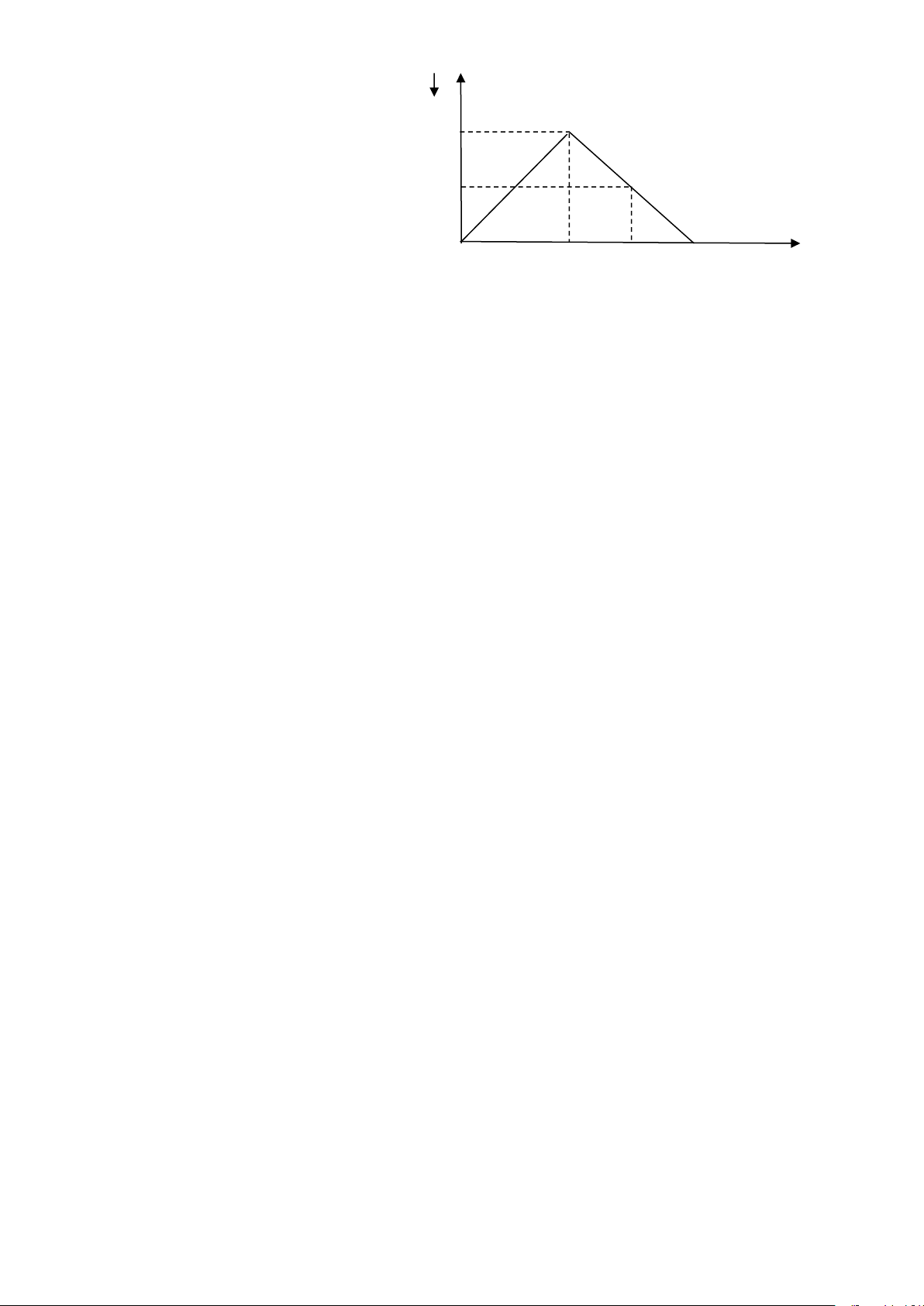
D. Na+, Mg2+, O2-, F -, Na, Mg, Al. Câu 20: Sục SO n 2 vào dung dịch
Ba(OH)2 ta quan sát hiện tượng theo đồ
thị hình bên (số liệu tính theo đơn vị a mol). Giá trị của x là : A. 2,0(mol). B. 1,8(mol). 0,5a C. 2,2(mol). D. 2,5(mol). 1,5 x nSO2
Câu 21: Cho phương trình hóa học:
a FeSO4 + b KMnO4 + c NaHSO4 → x Fe2(SO4)3 + y K2SO4 + z MnSO4 + t Na2SO4 + u H2O
với a,b,c,x,y,z,t,u là các số nguyên tối giản.
Tổng hệ số các chất trong phương trình hóa học trên là: A. 28. B. 52. C. 46. D. 50.
Câu 22: Cho 21,4 gam một muối clorua tác dụng với dung dịch AgNO3 dư thu được 57,4 g kết tủa.
Mặt khác cho 10,7 gam muối clorua trên tác dụng với 500ml dung dịch KOH 1M, đến phản ứng
hoàn toàn, cô cạn dung dịch thu được m gam chất rắn khan.Tính m: A. 38,7g. B. 28,7g. C. 23,7 g. D. 31,7 g.
Câu 23: Cho phương trình hóa học của phản ứng X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ
của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của
phản ứng tính theo chất Y trong khoảng thời gian trên là: A. 2,0. 10-4 mol/(l.s). B. 1,0. 10-4 mol/(l.s). C. 4,0. 10-4 mol/(l.s). D. 8,0. 10-4 mol/(l.s).
Câu 24: Hòa tan hết 0,02 mol KClO3 trong lượng dư dung dịch HCl đặc, thu được dung dịch Y và
khí Cl2. Hấp thụ hết toàn bộ lượng khí Cl2 vào dung dịch chứa 0,06 mol NaBr, thu được m gam
Br2 (giả thiết Cl2 và Br2 đều phản ứng không đáng kể với H2O). Các phản ứng đều xảy ra hoàn toàn. Giá trị của m là: A. 3,84. B. 4,80. C. 3,20. D. 4,16.
Câu 25: Hòa tan hoàn toàn hỗn hợp X gồm 0,002 mol FeS2 và 0,003 mol FeS vào lượng dư dung
dịch H2SO4 đặc nóng thu được khí X. Hấp thụ toàn bộ khí X bằng lượng vừa đủ V ml dung dịch
KMnO4 0,05M. V có giá trị là: A. 280 ml. B.172ml. C. 228 ml. D.188ml.
Câu 26: Muối iot dùng làm muối ăn là gì?
A. Muối có công thức NaI.
B. Muối ăn trộn thêm I2.
C. Muối ăn có trộn thêm I2 với tỉ lệ nhất định. D. Muối ăn có trộn thêm một lượng nhỏ KI hoặc KIO3.
Câu 27: Nung 32,4 gam chất rắn X gồm FeCO3,FeS,FeS2 có tỷ lệ số mol là 1:1:1 trong hỗn hợp
khí Y gồm O2 và O3 có tỷ lệ số mol là 1:1.Biết các phản ứng xảy ra hoàn toàn.Số mol Y tham gia phản ứng là : A. 0,48. B. 0,38. C. 0,24. D. 0,26.
Câu 28: Hòa tan 200 gam SO3 vào m2 gam dung dịch H2SO4 49% ta được dung dịch H2SO4 78,4%. Giá trị của m2 là: Trang 8/21 - Mã đề thi 132 A. 133,3 gam. B. 300 gam. C. 146,9 gam. D. 272,2 gam.
Câu 29: Một hỗn hợp X gồm 2 muối sunfit và hiđrosunfit của cùng một kim loại kiềm.
Thực hiện ba thí nghiệm sau:
Thí nghiệm 1: Cho 21,800 gam X tác dụng với dung dịch H2SO4 loãng dư.Sau phản ứng thu được
V lít khí A. Biết V lít khí A làm mất màu vừa đủ 400 ml dung dịch KMnO4 0,15M.
Thí nghiệm 2: 54,500 gam X cũng tác dụng vừa đủ với 100ml dung dịch NaOH 1,25M.
Thí nghiệm 3: Cho V lít khí A hấp thụ vào 250 gam dung dịch Ba(OH)2 6,84% . Sau phản ứng thu
được dung dịch B. Kim loại kiềm và nồng độ phần trăm của dung dịch B : A. Na và 4,603%. B. Na và 9,206%. C. K và 9,206%. D. K và 6,010%.
Câu 30: Hòa tan hoàn toàn 8,4 gam Fe bằng dung dịch H2SO4 loãng (dư), thu được dung dịch X.
Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là: A. 30. B. 120. C. 90. D. 60.
Câu 31: Khối lượng riêng của canxi kim loại là 1,55 g/cm3. Giả thiết rằng, trong tinh thể canxi các
nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Bán kính
nguyên tử canxi tính theo lí thuyết là: A. 0,196 nm. B. 0,155nm. C. 0,185 nm. D. 0,168 nm.
Câu 32: Nung nóng 22,12 gam KMnO4 và 18,375 gam KClO3, sau một thời gian thu được chất
rắn X gồm 6 chất có khối lượng 37,295 gam. Cho X tác dụng với dung dịch HCl đặc dư, đun
nóng. Toàn bộ lượng khí clo thu được cho phản ứng hết với m gam bột Fe đốt nóng được chất
nóng Y. Hòa tan hoàn toàn Y vào nước được dung dịch Z. thêm AgNO3 dư vào dung dịch Z đến
khi phản ứng hoàn toàn được 204,6 gam kết tủa. Giá trị m là: A. 28,0. B. 22,44. C. 33,6. D. 25,2.
Câu 33: Dung dịch X chứa 0,1 mol NaCl và 0,15 mol NaF. Cho dung dịch X tác dụng với dung
dịch AgNO3 dư. Kết tủa sinh ra có khối lượng là: A. 19,05 gam. B. 28,7 gam. C. 14,35 gam. D. 33,4 gam.
Câu 34: Cho hỗn hợp A gồm FeS, FeS2 tác dụng hết với m gam dung dịch H2SO4 98%. Sau phản
ứng thu được dung dịch X và khí Y. Dẫn khí Y vào dung dịch nước vôi trong thu được 10,8 gam
kết tủa và dung dịch Z, đun nóng dung dịch Z thu được tối đa 18 gam kết tủa. Dung dịch X có khối
lượng giảm so với khối lượng dung dịch H2SO4 ban đầu là 18,4 gam. Biết dung dịch H2SO4 đã
20% so với lượng cần thiết. Giá trị gần đúng nhất của m là: A. 35. B. 38. C. 46. D. 40.
Câu 35: Cho các nguyên tố X (Z = 11); Y(Z = 13); T(Z=17). Nhận xét nào sau đây là đúng?
A. Oxit và hiđroxit của X, Y, T đều là chất lưỡng tính.
B. Nguyên tử các nguyên tố X, Y, T ở trạng thái cơ bản đều có 1 electron độc thân.
C. Các hợp chất tạo bởi X với T và Y với T đều là hợp chất ion.
D. Theo chiều X, Y, T bán kính của các nguyên tử tương ứng tăng dần.
Câu 36: Trong tự nhiên, nguyên tố brom có 2 đồng vị là 79 35 Br và 81
35 Br. Nếu nguyên tử khối trung
bình là brom là 79,91 thì phần trăm của 2 đồng vị này lần lượt là: A. 45,5% và 54,5%. B. 61,8% và 38,2%. C. 35% và 65%. D. 54,5% và 45,5%.
Câu 37: Hỗn hợp khí A gồm Cl2 và O2. Cho A phản ứng vừa đủ với 1 hỗn hợp gồm 4,8 gam Mg
và 8,1 gam Al thu được 37,05 gam hỗn hợp các muối clorua và các oxit của 2 kim loại. Thành
phần % theo khối lượng của các khí trong A là: A. 73,5% và 26,5%. B. 90% và 10%. Trang 9/21 - Mã đề thi 132 C. 15,5% và 84,5%. D. 56% và 35%.
Câu 38: Nguyên tắc nào để sắp xếp các nguyên tố trong bảng tuần hoàn sau đây là sai ?
A. Các nguyên tố được sắp xếp theo chiều tăng dần của khối lượng nguyên tử.
B. Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành một cột.
C. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
D. Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
Câu 39: Để pha loãng dung dịch H2SO4 đậm đặc, trong phòng thí nghiệm, có thể tiến hành theo cách nào sau đây?
A. Cho nhanh nước vào axit.
B. Cho từ từ nước vào axit và khuấy đều.
C. Cho từ từ axit vào nước và khuấy đều.
D. Cho nhanh axit vào nước và khuấy đều.
Câu 40: Cho các thí nghiệm sau:
1) Cho Mg vào dd H2SO4(loãng).
2) Cho Fe3O4 vào dd H2SO4(loãng).
3) Cho FeSO4 vào dd H2SO4(đặc ,nóng). 4) Cho Al(OH)3 vào dd H2SO4(đặc ,nóng).
5) Cho BaCl2 vào dd H2SO4(đặc ,nóng). 6) Cho Al(OH)3 vào dd H2SO4(loãng)
Trong các thí nghiêm trên số thí nghiệm xảy ra phản ứng mà H2SO4 đóng vai trò là chất oxi hóa là: A. 3. B. 4. C. 2. D. 5.
(Cán bộ coi thi không giải thích gì thêm, thí sinh không được sử dụng Bảng tuần hoàn các nguyên tố hóa học) ------- HẾT -------
Trang 10/21 - Mã đề thi 132 ĐỀ SỐ 3
SỞ GD&ĐT. . . .TRƯỜNG
ĐỀ KIỂM TRA CHẤT LƯỢNG ĐẦU NĂM LỚP 11
THPT. . . . . . . . . . .
NĂM HỌC 20. . - 20. . ---***--- Môn: Hóa học
Thời gian làm bài: 60 phút;(40 câu trắc nghiệm)
Họ và tên: ……………………………………………SBD: …………………
Cho khối lượng nguyên tử của các nguyên tố: H: 1; C: 12; N: 14; O: 16; Na: 23; S: 32; Cl: 35,5;
K: 39; Br: 80; Ba: 137; Ag: 108; Fe: 56; Cu: 64; I: 127. dd H
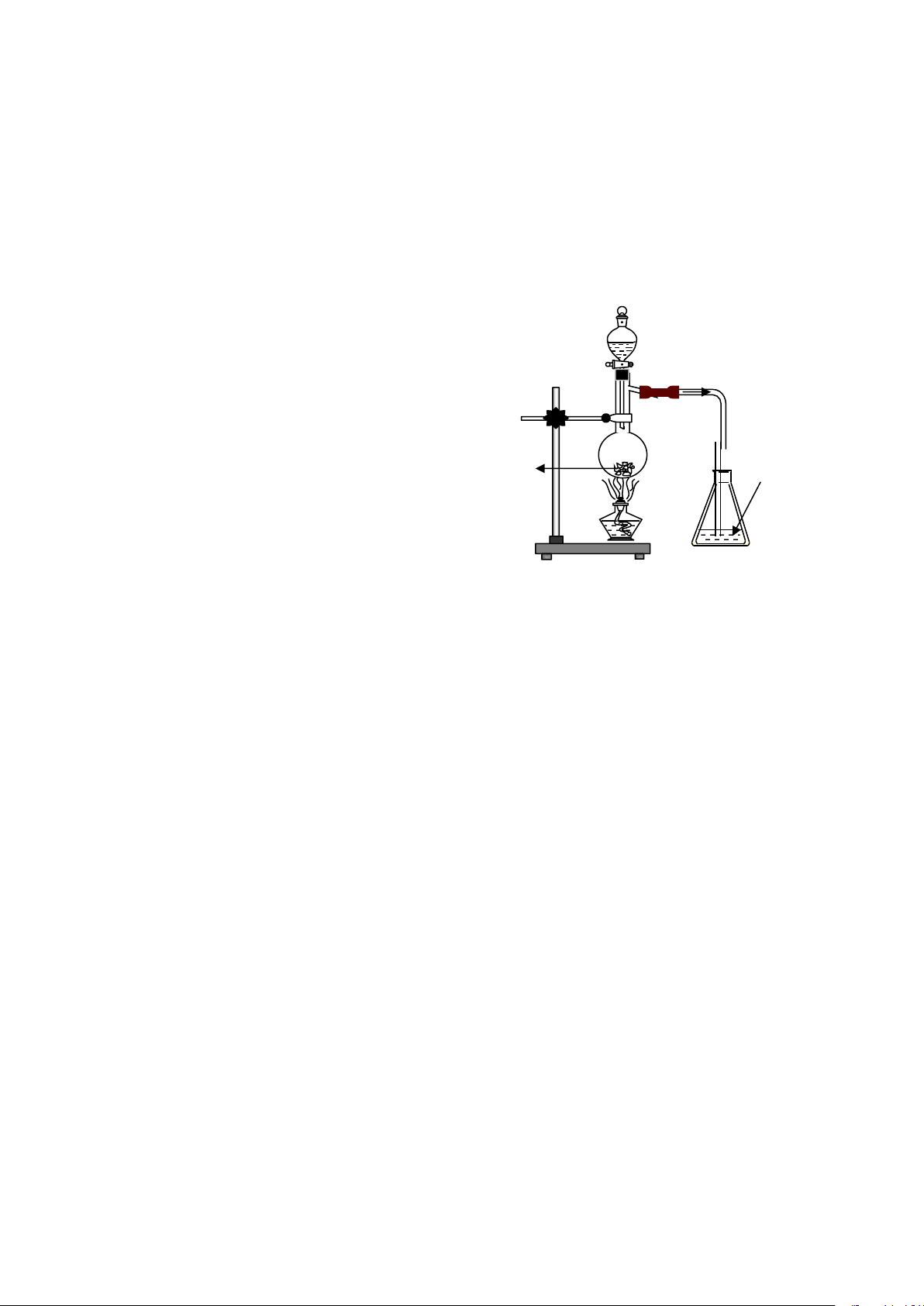
Câu 1: Cho hình vẽ bên: 2SO4 đặc
Hiện tượng xảy ra trong bình eclen chứa Br2:
A. Dung dịch Br2 bị mất màu.
B. Có kết tủa xuất hiện.
C. Vừa có kết tủa vừa mất màu dung dịch dd Br2 Br Na 2. 2SO3 tt
D. Không có phản ứng xảy ra.
Câu 2: Hòa tan hoàn toàn hỗn hợp X gồm 0,002 mol FeS2 và 0,003 mol FeS vào lượng dư dung
dịch H2SO4 đặc nóng thu được khí X. Hấp thụ toàn bộ khí X bằng lượng vừa đủ V ml dung dịch
KMnO4 0,05M. V có giá trị là: A. 280 ml B. 228 ml. C.172ml D.188ml
Câu 3: Nguyên tử R tạo được cation R+. Cấu hình electron ở phân lớp ngoài cùng của R+ (ở trạng
thái cơ bản) là 3p6. Tổng số hạt mang điện trong R+ là: A. 19. B. 38 C. 18. D. 37.
Câu 4: Cho 21,4 gam một muối clorua tác dụng với dung dịch AgNO3 dư thu được 57,4 g kết tủa.
Mặt khác cho 10,7 gam muối clorua trên tác dụng với 500ml dung dịch KOH 1M, đến phản ứng
hoàn toàn, cô cạn dung dịch thu được m gam chất rắn khan.Tính m: A. 31,7 g B. 38,7g C. 28,7g D. 23,7 g
Câu 5: Cho phương trình hóa học:
a FeSO4 + b KMnO4 + c NaHSO4 → x Fe2(SO4)3 + y K2SO4 + z MnSO4 + t Na2SO4 + u H2O
với a,b,c,x,y,z,t,u là các số nguyên tối giản.
Tổng hệ số các chất trong phương trình hóa học trên là: A. 28. B. 46. C. 52. D. 50.
Câu 6: Khối lượng riêng của canxi kim loại là 1,55 g/cm3. Giả thiết rằng, trong tinh thể canxi các
nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Bán kính
nguyên tử canxi tính theo lí thuyết là: A. 0,196 nm. B. 0,155nm. C. 0,185 nm. D. 0,168 nm.
Trang 11/21 - Mã đề thi 132
Câu 7: Sục SO2 vào dung dịch n
Ba(OH)2 ta quan sát hiện tượng theo đồ
thị hình bên (số liệu tính theo đơn vị a mol).Giá trị của x là : A. 1,8(mol). B. 2,2(mol). 0,5a C. 2,0(mol). D. 2,5(mol). 1,5 x nSO2
Câu 8: Trong phòng thí nghiệm, dung dịch HF được bảo quản trong bình bằng: A. Kim loại. B. Thủy tinh. C. Nhựa. D. Gốm sứ.
Câu 9: Dung dịch X chứa 0,1 mol NaCl và 0,15 mol NaF. Cho dung dịch X tác dụng với dung
dịch AgNO3 dư. Kết tủa sinh ra có khối lượng là: A. 14,35 gam. B. 19,05 gam. C. 28,7 gam. D. 33,4 gam.
Câu 10: Cho cân bằng (trong bình kín): CO (k) + H2O (k) ↔ CO2 (k) + H2 (k) ∆H < 0
Trong các yếu tố: (1) tăng nhiệt độ; (2) Thêm một lượng hơi nước; (3) thêm một lượng H2 ;
(4) Tăng áp suất chung của hệ; (5) dùng chất xúc tác.
Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là: A. (1), (4), (5). B. (1), (2), (3). C. (2), (3), (4). D. (1), (2), (4).
Câu 11: Ion M3+ có cấu hình e của khí hiếm Ne. Vị trí của M trong bảng hệ thống tuần hoàn là :
A. Chu kỳ 2, nhóm VIIIA.
B. Chu kỳ 3, nhóm IIIA.
C. Chu kỳ 2, nhóm VA.
D. Chu kỳ 3, nhóm IVA.
Câu 12:Nung 32,4 gam chất rắn X gồm FeCO3, FeS, FeS2 có tỷ lệ số mol là 1:1:1 trong hỗn hợp
khí Y gồm O2 và O3 có tỷ lệ số mol là 1:1.Biết các phản ứng xảy ra hoàn toàn.Số mol Y tham gia phản ứng là : A. 0,48. B. 0,24. C. 0,38. D. 0,26.
Câu 13: Tầng ozon có tác dụng như thế nào?
A. Làm không khí sạch hơn.
B. Hấp thu các tia cực tím gây hại.
C. Có khả năng sát khuẩn.
D. Ngăn chặn hiệu ứng nhà kính.
Câu 14: Nguyên tắc nào để sắp xếp các nguyên tố trong bảng tuần hoàn sau đây là sai ?
A. Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành một cột.
B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
C. Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
D. Các nguyên tố được sắp xếp theo chiều tăng dần của khối lượng nguyên tử.
Câu 15: Một hợp chất ion Y được cấu tạo từ ion M+ và ion X-. Tổng số hạt electron trong Y bằng
36. Số hạt proton trong M+ nhiều hơn trong X- là 2. Vị trí của nguyên tố M và X trong bảng HTTH
các nguyên tố hóa học là
A. M: chu kì 4, nhóm IA; X: chu kì 3, nhóm VIIA.
B. M: chu kì 3, nhóm IA; X: chu kì 3, nhóm VIIA.
C. M: chu kì 3, nhóm IB; X: chu kì 3, nhóm VIIA.
D. M: chu kì 4, nhóm IA; X: chu kì 4, nhóm VIIA.
Câu 16: Cho phản ứng : NaX(rắn) + H2SO4(đặc) NaHSO4 + HX(khí). Các hidro halogenua (HX) có
Trang 12/21 - Mã đề thi 132
thể điều chế theo phản ứng trên là : A. HF và HCl. B. HBr và HI. C. HCl, HBr và HI. D. HF, HCl, HBr và HI.
Câu 17: Biết độ tan của NaCl trong 100 gam nước ở 900C là 50 gam và ở 00C là 35 gam. Khi làm
lạnh 600 gam dung dịch NaCl bão hòa ở 900C về 00C làm thoát ra bao nhiêu gam tinh thể NaCl? A. 45 gam. B. 60 gam. C. 55 gam. D. 50 gam.
Câu 18: Hòa tan hết 0,02 mol KClO3 trong lượng dư dung dịch HCl đặc, thu được dung dịch Y và
khí Cl2. Hấp thụ hết toàn bộ lượng khí Cl2 vào dung dịch chứa 0,06 mol NaBr, thu được m gam
Br2 (giả thiết Cl2 và Br2 đều phản ứng không đáng kể với H2O). Các phản ứng đều xảy ra hoàn toàn. Giá trị của m là: A. 4,80. B. 3,20. C. 4,16. D. 3,84.
Câu 19: Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 7. Nguyên tử của
nguyên tố Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8. Cấu hình
electron lớp ngoài cùng của Y là: A. 2s22p4. B. 3s23p5. C. 3s23p4. D. 3s23p3.
Câu 20: Muối iot dùng làm muối ăn là gì?
A. Muối ăn có trộn thêm một lượng nhỏ KI hoặc KIO3.B. Muối có công thức NaI.
C. Muối ăn trộn thêm I2.
D. Muối ăn có trộn thêm I2 với tỉ lệ nhất định.
Câu 21: Khí nào sau đây gây ra hiện tượng mưa axit? A. CO2. B. SO2. C. CH4. D. NH3.
Câu 22: Cho phương trình hóa học của phản ứng X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ
của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của
phản ứng tính theo chất Y trong khoảng thời gian trên là: A. 2,0. 10-4 mol/(l.s). B. 4,0. 10-4 mol/(l.s). C. 1,0. 10-4 mol/(l.s). D. 8,0. 10-4 mol/(l.s).
Câu 23: Để pha loãng dung dịch H2SO4 đậm đặc, trong phòng thí nghiệm, có thể tiến hành theo cách nào sau đây?
A. Cho nhanh nước vào axit.
B. Cho từ từ nước vào axit và khuấy đều.
C. Cho từ từ axit vào nước và khuấy đều.
D. Cho nhanh axit vào nước và khuấy đều.
Câu 24: Không khí trong phòng thí nghiệm bị nhiễm bẩn bởi khí Cl2. Để khử độc có thể xịt vào
không khí dung dịch nào sau đây? A. Dung dịch HCl. B. Dung dịch NaOH. C. Dung dịch HCl. D. Dung dịch NH3.
Câu 25: Một hỗn hợp X gồm 2 muối sunfit và hiđrosunfit của cùng một kim loại kiềm.
Thực hiện ba thí nghiệm sau:
Thí nghiệm 1: Cho 21,800 gam X tác dụng với dung dịch H2SO4 loãng dư.Sau phản ứng thu được
V lít khí A. Biết V lít khí A làm mất màu vừa đủ 400 ml dung dịch KMnO4 0,15M.
Thí nghiệm 2: 54,500 gam X cũng tác dụng vừa đủ với 100ml dung dịch NaOH 1,25M.
Thí nghiệm 3: Cho V lít khí A hấp thụ vào 250 gam dung dịch Ba(OH)2 6,84% .Sau phản ứng thu
được dung dịch B. Kim loại kiềm và nồng độ phần trăm của dung dịch B là: A. K và 6,010%. B. Na và 4,603%. C. Na và 9,206%. D. K và 9,206%.
Câu 26: Cho các nguyên tố X (Z = 11); Y(Z = 13); T(Z=17). Nhận xét nào sau đây là đúng?
A. Nguyên tử các nguyên tố X, Y, T ở trạng thái cơ bản đều có 1 electron độc thân.
Trang 13/21 - Mã đề thi 132
B. Oxit và hiđroxit của X, Y, T đều là chất lưỡng tính.
C. Các hợp chất tạo bởi X với T và Y với T đều là hợp chất ion.
D. Theo chiều X, Y, T bán kính của các nguyên tử tương ứng tăng dần.
Câu 27: Cho các thí nghiệm sau:
1) Cho Mg vào dd H2SO4(loãng).
2) Cho Fe3O4 vào dd H2SO4(loãng).
3) Cho FeSO4 vào dd H2SO4(đặc ,nóng). 4) Cho Al(OH)3 vào dd H2SO4(đặc ,nóng).
5) Cho BaCl2 vào dd H2SO4(đặc ,nóng). 6) Cho Al(OH)3 vào dd H2SO4(loãng)
Trong các thí nghiêm trên số thí nghiệm xảy ra phản ứng mà H2SO4 đóng vai trò là chất oxi hóa là:A.3. B. 2. C. 4. D. 5.
Câu 28: Cho các nguyên tố với số hiệu nguyên tử sau: X (Z = 1); Y (Z = 7); E (Z = 12); T (Z =
19). Dãy gồm các nguyên tố kim loại là: A. X, Y, E. B. E, T. C. X, Y, E, T. D. Y, T.
Câu 29: Cho hỗn hợp A gồm FeS, FeS2 tác dụng hết với m gam dung dịch H2SO4 98%. Sau phản
ứng thu được dung dịch X và khí Y. Dẫn khí Y vào dung dịch nước vôi trong thu được 10,8 gam
kết tủa và dung dịch Z, đun nóng dung dịch Z thu được tối đa 18 gam kết tủa. Dung dịch X có khối
lượng giảm so với khối lượng dung dịch H2SO4 ban đầu là 18,4 gam. Biết dung dịch H2SO4 đã
20% so với lượng cần thiết. Giá trị gần đúng nhất của m là: A. 35. B. 38. C. 40. D. 46.
Câu 30: Một chất A được cấu tạo từ cation M2+ và anion X-. Trong phân tử MX2 có tổng số proton,
nowtron, electron là 186 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 54
hạt. Số khối của M2+ lớn hơn số khối của X- là 21. Tổng số hạt trong cation M2+ nhiều hơn tổng số
hạt trong anion X- là 27. Nhận xét nào sau đây đúng:
A. M là nguyên tố có nhiều số Oxi hóa trong hợp chất.
B. M thuộc nhóm A trong bảng tuần hoàn.
C. M và X cùng thuộc một chu kỳ.
D. X thuộc nhóm VIA trong bảng tuần hoàn.
Câu 31: Từ muối biển người ta điều chế nước Giaven bằng phương pháp nào?
H. Điện phân nóng chảy thu lấy clo và Na. Hòa tan Na rồi sục khí clo vào.
I. Điện phân dung dịch muối ăn có màng ngăn xốp.
J. Không phải A, B, C.
K. Điện phân dung dịch muối ăn không có màng ngăn xốp.
Câu 32: Cho các hạt vi mô: O2- (Z = 8); F – (Z = 9); Na, Na+ (Z = 11), Mg, Mg2+ (Z = 12), Al (Z =
13). Thứ tự giảm dần bán kính hạt là:
A. Na, Mg, Al, Na+, Mg2+, O2-, F -.
B. Na, Mg, Al, O2-, F - , Na+, Mg2+.
C. O2-, F -, Na, Na+, Mg, Mg2+, Al.
D. Na+, Mg2+, O2-, F -, Na, Mg, Al.
Câu 33: Cho các cân bằng sau:
(1)H2(k) I2(k) 2HI (k); (2)HI (k) 1 / 2H2(k) 1 / 2I2(k)
Ở nhiệt độ xác định nếu KC của cân bằng (1)bằng 64 thì KC của cân bằng (2) là: A. 0,125. B. 4 C. 0,5 D. 0,25
Câu 34: Hòa tan hoàn toàn 8,4 gam Fe bằng dung dịch H2SO4 loãng (dư), thu được dung dịch X.
Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là: A. 30. B. 60. C. 120. D. 90.
Trang 14/21 - Mã đề thi 132
Câu 35: Nung nóng 22,12 gam KMnO4 và 18,375 gam KClO3, sau một thời gian thu được chất
rắn X gồm 6 chất có khối lượng 37,295 gam. Cho X tác dụng với dung dịch HCl đặc dư, đun nóng.
Toàn bộ lượng khí clo thu được cho phản ứng hết với m gam bột Fe đốt nóng được chất nóng Y.
Hòa tan hoàn toàn Y vào nước được dung dịch Z. thêm AgNO3 dư vào dung dịch Z đến khi phản
ứng hoàn toàn được 204,6 gam kết tủa. Giá trị m là: A. 22,44. B. 33,6. C. 28,0. D. 25,2.
Câu 36: Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2. Số hiệu
nguyên tử của nguyên tố X là: B. 13. B. 11. C. 12. D. 14.
Câu 37: Chất nào sau đây là hợp chất ion? A. K2O . B. SO2. C. CO2. D. HCl.
Câu 38: Hỗn hợp khí A gồm Cl2 và O2. Cho A phản ứng vừa đủ với 1 hỗn hợp gồm 4,8 gam Mg
và 8,1 gam Al thu được 37,05 gam hỗn hợp các muối clorua và các oxit của 2 kim loại. Thành
phần % theo khối lượng của các khí trong A là: A. 90% và 10%. B. 56% và 35%. C. 73,5% và 26,5%. D. 15,5% và 84,5%.
Câu 39: Trong tự nhiên, nguyên tố brom có 2 đồng vị là 79 35 Br và 81
35 Br. Nếu nguyên tử khối trung
bình là brom là 79,91 thì phần trăm của 2 đồng vị này lần lượt là : A. 45,5% và 54,5%. B. 54,5% và 45,5%. C. 61,8% và 38,2%. D. 35% và 65%.
Câu 40: Hòa tan 200 gam SO3 vào m2 gam dung dịch H2SO4 49% ta được dung dịch H2SO4 78,4%. Giá trị của m2 là: A. 300 gam. B. 133,3 gam. C. 146,9 gam. D. 272,2 gam.
(Cán bộ coi thi không giải thích gì thêm, thí sinh không được sử dụng Bảng tuần hoàn các nguyên tố hóa học) ------- HẾT -------
Trang 15/21 - Mã đề thi 132 ĐỀ SỐ 4
SỞ GD&ĐT. . . .TRƯỜNG
ĐỀ KIỂM TRA CHẤT LƯỢNG ĐẦU NĂM LỚP 11
THPT. . . . . . . . . . .
NĂM HỌC 20. . - 20. . ---***--- Môn: Hóa học
Thời gian làm bài: 60 phút;(40 câu trắc nghiệm)
Họ và tên: ……………………………………………SBD: …………………
Cho khối lượng nguyên tử của các nguyên tố: H: 1; C: 12; N: 14; O: 16; Na: 23; S: 32; Cl: 35,5;
K: 39; Br: 80; Ba: 137; Ag: 108; Fe: 56; Cu: 64; I: 127.
Câu 1: Hỗn hợp khí A gồm Cl2 và O2. Cho A phản ứng vừa đủ với 1 hỗn hợp gồm 4,8 gam Mg và
8,1 gam Al thu được 37,05 gam hỗn hợp các muối clorua và các oxit của 2 kim loại. Thành phần %
theo khối lượng của các khí trong A là: A. 90% và 10%. B. 56% và 35%. C. 15,5% và 84,5%. D. 73,5% và 26,5%.
Câu 2: Hòa tan hết 0,02 mol KClO3 trong lượng dư dung dịch HCl đặc, thu được dung dịch Y và
khí Cl2. Hấp thụ hết toàn bộ lượng khí Cl2 vào dung dịch chứa 0,06 mol NaBr, thu được m gam
Br2 (giả thiết Cl2 và Br2 đều phản ứng không đáng kể với H2O). Các phản ứng đều xảy ra hoàn toàn. Giá trị của m là: A. 4,80. B. 3,84. C. 3,20. D. 4,16.
Câu 3: Cho các nguyên tố X (Z = 11); Y(Z = 13); T(Z=17). Nhận xét nào sau đây là đúng?
A. Oxit và hiđroxit của X, Y, T đều là chất lưỡng tính.
B. Các hợp chất tạo bởi X với T và Y với T đều là hợp chất ion.
C. Nguyên tử các nguyên tố X, Y, T ở trạng thái cơ bản đều có 1 electron độc thân.
D. Theo chiều X, Y, T bán kính của các nguyên tử tương ứng tăng dần.
Câu 4: Không khí trong phòng thí nghiệm bị nhiễm bẩn bởi khí Cl2. Để khử độc có thể xịt vào
không khí dung dịch nào sau đây? A. Dung dịch HCl. B. Dung dịch HCl. C. Dung dịch NH3. D. Dung dịch NaOH.
Câu 5: Cho phương trình hóa học của phản ứng X + 2Y → Z + T. Ở thời điểm ban đầu, nồng độ
của chất X là 0,01 mol/l. Sau 20 giây, nồng độ của chất X là 0,008 mol/l. Tốc độ trung bình của
phản ứng tính theo chất Y trong khoảng thời gian trên là: A. 1,0. 10-4 mol/(l.s). B. 8,0. 10-4 mol/(l.s). C. 2,0. 10-4 mol/(l.s). D. 4,0. 10-4 mol/(l.s).
Câu 6: Chất nào sau đây là hợp chất ion? A. SO2. B. CO2. C. K2O . D. HCl.
Câu 7: Khí nào sau đây gây ra hiện tượng mưa axit? A. CO2. B. CH4. C. NH3. D. SO2.
Câu 8: Khối lượng riêng của canxi kim loại là 1,55 g/cm3. Giả thiết rằng, trong tinh thể canxi các
nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Bán kính
nguyên tử canxi tính theo lí thuyết là: A. 0,155nm. B. 0,196 nm. C. 0,185 nm. D. 0,168 nm.
Câu 9: Từ muối biển người ta điều chế nước Giaven bằng phương pháp nào?
L. Điện phân dung dịch muối ăn không có màng ngăn xốp.
M. Điện phân nóng chảy thu lấy clo và Na. Hòa tan Na rồi sục khí clo vào.
Trang 16/21 - Mã đề thi 132
N. Điện phân dung dịch muối ăn có màng ngăn xốp.
O. Không phải A, B, C. dd H2SO4 đặc
Câu 10: Cho hình vẽ (bên):
Hiện tượng xảy ra trong bình eclen chứa Br2:
A. Có kết tủa xuất hiện.
B. Vừa có kết tủa vừa mất màu dung dịch dd Br2 Br Na2SO3 tt 2.
C. Không có phản ứng xảy ra.
D. Dung dịch Br2 bị mất màu.
Câu 11: Cho phương trình hóa học:
a FeSO4 + b KMnO4 + c NaHSO4 → x Fe2(SO4)3 + y K2SO4 + z MnSO4 + t Na2SO4 + u H2O
với a,b,c,x,y,z,t,u là các số nguyên tối giản.
Tổng hệ số các chất trong phương trình hóa học trên là: A. 52. B. 28. C. 46. D. 50.
Câu 12: Hòa tan 200 gam SO3 vào m2 gam dung dịch H2SO4 49% ta được dung dịch H2SO4 78,4%. Giá trị của m2 là: A. 133,3 gam. B. 146,9 gam. C. 300 gam. D. 272,2 gam.
Câu 13: Biết độ tan của NaCl trong 100 gam nước ở 900C là 50 gam và ở 00C là 35 gam. Khi làm
lạnh 600 gam dung dịch NaCl bão hòa ở 900C về 00C làm thoát ra bao nhiêu gam tinh thể NaCl? A. 45 gam. B. 55 gam. C. 50 gam. D. 60 gam.
Câu 14: Hòa tan hoàn toàn hỗn hợp X gồm 0,002 mol FeS2 và 0,003 mol FeS vào lượng dư dung
dịch H2SO4 đặc nóng thu được khí X. Hấp thụ toàn bộ khí X bằng lượng vừa đủ V ml dung dịch
KMnO4 0,05M. V có giá trị là: A. 228 ml. B. 280 ml. C.172ml. D.188ml.
Câu 15: Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2. Số hiệu
nguyên tử của nguyên tố X là: A. 13. B. 11. C. 14. D. 12.
Câu 16: Nguyên tắc nào để sắp xếp các nguyên tố trong bảng tuần hoàn sau đây là sai ?
A. Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành một cột.
B. Các nguyên tố được sắp xếp theo chiều tăng dần của khối lượng nguyên tử.
C. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
D. Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
Câu 17: Một chất A được cấu tạo từ cation M2+ và anion X-. Trong phân tử MX2 có tổng số proton,
nowtron, electron là 186 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 54
hạt. Số khối của M2+ lớn hơn số khối của X- là 21. Tổng số hạt trong cation M2+ nhiều hơn tổng số
hạt trong anion X- là 27. Nhận xét nào sau đây đúng:
A. M thuộc nhóm A trong bảng tuần hoàn.
B. M là nguyên tố có nhiều số Oxi hóa trong hợp chất.
C. M và X cùng thuộc một chu kỳ.
D. X thuộc nhóm VIA trong bảng tuần hoàn.
Câu 18: Cho 21,4 gam một muối clorua tác dụng với dung dịch AgNO3 dư thu được 57,4 g kết tủa.
Mặt khác cho 10,7 gam muối clorua trên tác dụng với 500ml dung dịch KOH 1M, đến phản ứng
hoàn toàn, cô cạn dung dịch thu được m gam chất rắn khan.Tính m: A. 38,7 g. B. 31,7 g. C. 28,7 g. D. 23,7 g.
Trang 17/21 - Mã đề thi 132
Câu 19: Trong tự nhiên, nguyên tố brom có 2 đồng vị là 79 35 Br và 81
35 Br. Nếu nguyên tử khối trung
bình là brom là 79,91 thì phần trăm của 2 đồng vị này lần lượt là :
A. 54,5% và 45,5%. B. 45,5% và 54,5%. C. 61,8% và 38,2%. D. 35% và 65%.
Câu 20: Nung nóng 22,12 gam KMnO4 và 18,375 gam KClO3, sau một thời gian thu được chất
rắn X gồm 6 chất có khối lượng 37,295 gam. Cho X tác dụng với dung dịch HCl đặc dư, đun nóng.
Toàn bộ lượng khí clo thu được cho phản ứng hết với m gam bột Fe đốt nóng được chất nóng Y.
Hòa tan hoàn toàn Y vào nước được dung dịch Z. thêm AgNO3 dư vào dung dịch Z đến khi phản
ứng hoàn toàn được 204,6 gam kết tủa. Giá trị m là: A. 22,44. B. 33,6. C. 25,2. D. 28,0.
Câu 21: Cho các hạt vi mô: O2- (Z = 8); F – (Z = 9); Na, Na+ (Z = 11), Mg, Mg2+ (Z = 12), Al (Z =
13). Thứ tự giảm dần bán kính hạt là
A. Na, Mg, Al, Na+, Mg2+, O2-, F -.
B. Na+, Mg2+, O2-, F -, Na, Mg, Al.
C. O2-, F -, Na, Na+, Mg, Mg2+, Al.
D. Na, Mg, Al, O2-, F - , Na+, Mg2+.
Câu 22: Cho hỗn hợp A gồm FeS, FeS2 tác dụng hết với m gam dung dịch H2SO4 98%. Sau phản
ứng thu được dung dịch X và khí Y. Dẫn khí Y vào dung dịch nước vôi trong thu được 10,8 gam
kết tủa và dung dịch Z, đun nóng dung dịch Z thu được tối đa 18 gam kết tủa. Dung dịch X có khối
lượng giảm so với khối lượng dung dịch H2SO4 ban đầu là 18,4 gam. Biết dung dịch H2SO4 đã
20% so với lượng cần thiết. Giá trị gần đúng nhất của m là: A. 35. B. 46. C. 38. D. 40.
Câu 23: Cho các thí nghiệm sau:
1) Cho Mg vào dd H2SO4(loãng).
2) Cho Fe3O4 vào dd H2SO4(loãng).
3) Cho FeSO4 vào dd H2SO4(đặc ,nóng). 4) Cho Al(OH)3 vào dd H2SO4(đặc ,nóng).
5) Cho BaCl2 vào dd H2SO4(đặc ,nóng). 6) Cho Al(OH)3 vào dd H2SO4(loãng)
Trong các thí nghiêm trên số thí nghiệm xảy ra phản ứng mà H2SO4 đóng vai trò là chất oxi hóa là: A. 3. B. 4. C. 5. D. 2.
Câu 24: Cho phản ứng : NaX(rắn) + H2SO4(đặc) NaHSO4 + HX(khí). Các hidro halogenua (HX) có
thể điều chế theo phản ứng trên là : A. HBr và HI. B. HF và HCl. C. HCl, HBr và HI. D. HF, HCl, HBr và HI.
Câu 25: Một hợp chất ion Y được cấu tạo từ ion M+ và ion X-. Tổng số hạt electron trong Y bằng
36. Số hạt proton trong M+ nhiều hơn trong X- là 2. Vị trí của nguyên tố M và X trong bảng HTTH
các nguyên tố hóa học là:
A. M: chu kì 4, nhóm IA; X: chu kì 3, nhóm VIIA.
B. M: chu kì 3, nhóm IA; X: chu kì 3, nhóm VIIA.
C. M: chu kì 3, nhóm IB; X: chu kì 3, nhóm VIIA.
D. M: chu kì 4, nhóm IA; X: chu kì 4, nhóm VIIA.
Câu 26: Hòa tan hoàn toàn 8,4 gam Fe bằng dung dịch H2SO4 loãng (dư), thu được dung dịch X.
Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là: A. 30. B. 120. C. 60. D. 90.
Câu 27: Để pha loãng dung dịch H2SO4 đậm đặc, trong phòng thí nghiệm, có thể tiến hành theo cách nào sau đây?
A. Cho từ từ axit vào nước và khuấy đều.
B. Cho nhanh nước vào axit.
C. Cho từ từ nước vào axit và khuấy đều.
D. Cho nhanh axit vào nước và khuấy đều.
Câu 28: Cho cân bằng (trong bình kín): CO (k) + H2O (k) ↔ CO2 (k) + H2 (k) ∆H < 0
Trang 18/21 - Mã đề thi 132
Trong các yếu tố: (1) tăng nhiệt độ; (2) Thêm một lượng hơi nước; (3) thêm một lượng H2 ;
(4) Tăng áp suất chung của hệ; (5) dùng chất xúc tác.
Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là: A. (1), (4), (5). B. (2), (3), (4). C. (1), (2), (3). D. (1), (2), (4).
Câu 29: Trong phòng thí nghiệm, dung dịch HF được bảo quản trong bình bằng: A. Kim loại. B. Thủy tinh. C. Gốm sứ. D. Nhựa.
Câu 30: Một hỗn hợp X gồm 2 muối sunfit và hiđrosunfit của cùng một kim loại kiềm.
Thực hiện ba thí nghiệm sau:
Thí nghiệm 1: Cho 21,800 gam X tác dụng với dung dịch H2SO4 loãng dư.Sau phản ứng thu được
V lít khí A. Biết V lít khí A làm mất màu vừa đủ 400 ml dung dịch KMnO4 0,15M.
Thí nghiệm 2: 54,500 gam X cũng tác dụng vừa đủ với 100ml dung dịch NaOH 1,25M.
Thí nghiệm 3: Cho V lít khí A hấp thụ vào 250 gam dung dịch Ba(OH)2 6,84% . Sau phản ứng thu
được dung dịch B. Kim loại kiềm và nồng độ phần trăm của dung dịch B : A. Na và 4,603%. B. K và 6,010%. C. Na và 9,206%. D. K và 9,206%.
Câu 31: Muối iot dùng làm muối ăn là gì?
A. Muối có công thức NaI.
B. Muối ăn trộn thêm I2.
C. Muối ăn có trộn thêm một lượng nhỏ KI hoặc KIO3.
D. Muối ăn có trộn thêm I2 với tỉ lệ nhất định.
Câu 32: Tầng ozon có tác dụng như thế nào?
A. Hấp thu các tia cực tím gây hại.
B. Làm không khí sạch hơn.
C. Có khả năng sát khuẩn.
D. Ngăn chặn hiệu ứng nhà kính.
Câu 33: Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 7. Nguyên tử của
nguyên tố Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8. Cấu hình
electron lớp ngoài cùng của Y là: A. 2s22p4. B. 3s23p4. C. 3s23p5. D. 3s23p3.
Câu 34: Nguyên tử R tạo được cation R+. Cấu hình electron ở phân lớp ngoài cùng của R+ (ở trạng
thái cơ bản) là 3p6. Tổng số hạt mang điện trong R+ là: A. 19. B. 37. C. 38 D. 18.
Câu 35: Ion M3+ có cấu hình e của khí hiếm Ne. Vị trí của M trong bảng hệ thống tuần hoàn là :
A. Chu kỳ 2, nhóm VIIIA.
B. Chu kỳ 2, nhóm VA.
C. Chu kỳ 3, nhóm IVA.
D. Chu kỳ 3, nhóm IIIA.
Câu 36: Cho các cân bằng sau:
(1)H2(k) I2(k) 2HI (k); (2)HI (k) 1 / 2H2(k) 1 / 2I2(k)
Ở nhiệt độ xác định nếu KC của cân bằng (1)bằng 64 thì KC của cân bằng (2) là: A. 4 B. 0,5 C. 0,125. D. 0,25
Câu 37: Dung dịch X chứa 0,1 mol NaCl và 0,15 mol NaF. Cho dung dịch X tác dụng với dung
dịch AgNO3 dư. Kết tủa sinh ra có khối lượng là: A. 14,35 gam B. 19,05 gam C. 28,7 gam D. 33,4 gam
Câu 38: Nung 32,4 gam chất rắn X gồm FeCO3,FeS,FeS2 có tỷ lệ số mol là 1:1:1 trong hỗn hợp
khí Y gồm O2 và O3 có tỷ lệ số mol là 1:1.Biết các phản ứng xảy ra hoàn toàn.Số mol Y tham gia phản ứng là : A. 0,48. B. 0,24. C. 0,38. D. 0,26.
Trang 19/21 - Mã đề thi 132
Câu 39: Sục SO2 vào dung dịch Ba(OH) n
2 ta quan sát hiện tượng theo đồ
thị hình bên (số liệu tính theo đơn vị mol).Giá trị của x là : a A. 1,8(mol). B. 2,2(mol). 0,5a C. 2,0(mol). D. 2,5(mol). 1,5 x nSO2
Câu 40: Cho các nguyên tố với số hiệu nguyên tử sau: X (Z = 1); Y (Z = 7); E (Z = 12); T (Z =
19). Dãy gồm các nguyên tố kim loại là: A. E, T. B. X, Y, E. C. X, Y, E, T. D. Y, T.
(Cán bộ coi thi không giải thích gì thêm, thí sinh không được sử dụng Bảng tuần hoàn các nguyên tố hóa học) ------- HẾT -------
Trang 20/21 - Mã đề thi 132
ĐÁP ÁN KỲ THI CHẤT LƯỢNG ĐẦU NĂM 11 - 20. . - 20. .
CÂU MÃ ĐÊ 1 CÂU MÃ ĐÊ 2 CÂU MÃ ĐÊ 3 CÂU MÃ ĐÊ 4 1 A 1 B 1 A 1 D 2 D 2 A 2 B 2 B 3 D 3 B 3 D 3 C 4 D 4 C 4 A 4 C 5 A 5 B 5 C 5 A 6 C 6 D 6 A 6 C 7 B 7 A 7 C 7 D 8 D 8 A 8 C 8 B 9 D 9 B 9 A 9 A 10 A 10 D 10 B 10 D 11 A 11 D 11 B 11 A 12 B 12 C 12 C 12 C 13 C 13 A 13 B 13 D 14 B 14 B 14 D 14 A 15 A 15 C 15 A 15 D 16 C 16 C 16 A 16 B 17 B 17 D 17 B 17 B 18 D 18 D 18 D 18 B 19 D 19 A 19 B 19 A 20 D 20 A 20 A 20 D 21 B 21 B 21 B 21 D 22 C 22 D 22 C 22 B 23 A 23 B 23 C 23 D 24 A 24 A 24 D 24 B 25 C 25 C 25 A 25 A 26 B 26 D 26 A 26 C 27 D 27 B 27 B 27 A 28 B 28 B 28 B 28 C 29 A 29 D 29 D 29 D 30 C 30 D 30 A 30 B 31 A 31 A 31 D 31 C 32 C 32 A 32 B 32 A 33 B 33 C 33 A 33 C 34 C 34 C 34 B 34 B 35 C 35 B 35 C 35 D 36 B 36 D 36 C 36 C 37 A 37 A 37 A 37 A 38 C 38 A 38 C 38 C 39 C 39 C 39 B 39 C 40 D 40 C 40 A 40 A
Trang 21/21 - Mã đề thi 132




