Preview text:
Các dạng bài tập về liên kết hóa học
Dạng 1: Sự hình thành liên kết ion
Cần nhớ điều kiện và dấu hiệu nhận biết phân tử có liên kết ion.
- Điều kiện hình thành liên kết ion:
+ Liên kết được hình thành giữa các nguyên tố có tính chất khác hẳn nhau (kim loại điển hình và phi kim điển hình).
+ Quy ước hiệu độ âm điện giữa hai nguyên tử liên kết ≥ 1,7 là liên kết ion (trừ một số trường hợp).
- Dấu hiệu cho thấy phân tử có liên kết ion:
+ Phân tử hợp chất được hình thành từ kim loại điển hình (kim loại nhóm IA, IIA) và phi kim
điển hình (phi kim nhóm VIIA và Oxi). Ví dụ minh họa
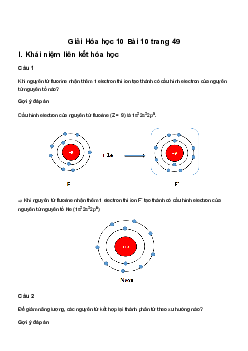
Ví dụ 1: Viết cấu hình electron của Cl (Z = 17) và Ca (Z=20). Cho biết vị trí của chúng (chu kì,
nhóm) trong bảng tuần hoàn. Liên kết giữa canxi và clo trong hợp chất CaCl2 thuộc loại liên kết
gì? Vì sao? Viết sơ đồ hình thành liên kết đó. Hướng dẫn: Cl (Z = 17) : 1s22s22p63s23p5
Ca (Z = 20) : 1s22s22p63s23p64s2
Clo nằm ở ô số 17, chu kỳ 3, nhóm VIIA.
Canxi nằm ở ô số 20, chu kỳ 4, nhóm IIA.
Liên kết trong hợp chất CaCl2 là liên kết ion vì Ca là kim loại điển hình, Cl là phi kim điển hình.
Sơ đồ hình thành liên kết: 2Cl + 21e → 2Cl- Ca → Ca2+ + 2e
Các ion Ca2+và Cl-tạo thành mang điện tích trái dấu, chúng hút nhau bằng lực hút tĩnh điện,
tạo thành hợp chất CaCl2: Ca2+ + 2Cl- → CaCl2 Ví dụ 2:
a, Viết cấu hình electron của các nguyên tử A, B biết rằng:
- Tổng số các loại hạt cơ bản trong nguyên tử A là 34. Số hạt mang điện nhiều hơn số hạt không mang điện là 10.
- Kí hiệu của nguyên tử B là B.
b, Liên kết trong hợp chất tạo thành từ A và B thuộc loại liên kết gì? Vì sao? Viết công thức của hợp chất tạo thành . Hướng dẫn:
a, Gọi tổng số hạt proton, nơtron, electron của nguyên tử A là P, N, E (trong đó P = E).
Ta có: P + N + E = 34 và P + E - N = 10.
Từ đây tìm được P = E = 11; N = 12.
Kí hiệu của nguyên tử B là B nên ZB = 9
Cấu hình electron của A, B: A (Z = 11) : 1s22s22p63s1 B (Z = 9) : 1s22s22p5
b, Liên kết trong hợp chất giữa A và B là liên kết ion vì A là kim loại điển hình (nhóm IA), B là
phi kim điển hình (nhóm VIIA).
Sơ đồ hình thành liên kết: A → A+ + 1e B + 1e → B-
Các ion A+và B- tạo thành mang điện tích trái dấu, chúng hút nhau bằng lực hút tĩnh điện, tạo thành hợp chất AB: A+ + B- → AB.
Bài tập trắc nghiệm
Câu 1. Xét các phân tử ion: LiCl, KCl, RbCl, CsCl. Liên kết trong phân tử nào mang tính chất ion nhiều nhất? A. LiCl B. KCl C. RbCl D. CsCl
Câu 2. Cho độ âm điện: Be (1,5), Al (1,5), Mg (1,2), Cl (3,0), N (3,0), H (2,1), S (2,5), O (3,5).
Chất nào sau đây có liên kết ion ? A. H2S, NH3. B. BeCl2, BeS. C. MgO, Al2O3. D. MgCl2, AlCl3.
Câu 3. Nguyên tử Al có 3 electron hóa trị. Kiểu liên kết hóa học nào được hình thành khi nó
liên kết với 3 nguyên tử flo: A. Liên kết kim loại.
B. Liên kết cộng hóa trị có cực.
C. Liên kết cộng hóa trị không cực. D. Liên kết ion.
Câu 4. Cho các hợp chất: NH3, H2O, K2S, MgCl2, Na2O, CH4, Chất có liên kết ion là: A. NH3, H2O, K2S, MgCl2 B. K2S, MgCl2, Na2O, CH4 C. NH3, H2O, Na2O, CH4 D. K2S, MgCl2, Na2O
Câu 5. Cấu hình electron của cặp nguyên tử nào sau đây có thể tạo liên kết ion: A. 1s22s22p3 và 1s22s22p5 B.1s22s1 và 1s22s22p5 C. 1s22s1 và 1s22s22p63s23p2
D.1s22s22p1 và 1s22s22p63s23p6
Câu 6. Cho 3 ion : Na+, Mg2+, F- . Tìm câu khẳng định sai .
A. 3 ion trên có cấu hình electron giống nhau .
B. 3 ion trên có số nơtron khác nhau.
C. 3 ion trên có số electron bằng nhau
D. 3 ion trên có số proton bằng nhau.
Câu 7. Trong dãy oxit sau: Na2O, MgO, Al2O3 , SiO2 , P2O5 , SO3 , Cl2O7 . Những oxit có liên kết ion là : A. Na2O , SiO2 , P2O5 . B. MgO, Al2O3 , P2O5 C. Na2O, MgO, Al2O3 . D. SO3, Cl2O3 , Na2O .
Câu 8. Cho các chất : HF, NaCl, CH4, Al2O3, K2S, MgCl2. Số chất có liên kết ion là (Độ âm
điện của K: 0,82; Al: 1,61; S: 2,58; Cl: 3,16 và O: 3,44; Mg: 1,31; H: 2,20; C: 2,55; F: 4,0) : A. 3. B. 2. C. 1. D. 4.
Dạng 2: Sự hình thành liên kết cộng hóa trị 1, Lý thuyết
- Liên kết cộng hóa trị được hình thành bằng cặp electron chung
- Khi viết công thức electron, công thức cấu tạo:
Giả sử nguyên tử A có n electron lớp ngoài cùng lúc đó A sẽ đưa ra (8 - n) electron để góp chung, nhằm
đạt đến 8 electron ở lớp ngoài cùng, có cấu hình electron bền giống khí hiếm. Lưu ý:
- Khi hai nguyên tử liên kết mà trong đó có một nguyên tử A đạt cấu hình bền còn nguyên tử B
kia chưa thì lúc này A sử dụng cặp electron của nó để cho B dùng chung → hình thành liên kết
cho nhận (hay phối trí) biểu diễn bằng → hướng vào nguyên tử nhận cặp electron đó.
- Khi có nhiều nguyên tử đều có thể đưa cặp electron ra cho nguyên tử khác dùng chung thì ưu
tiên cho nguyên tử nào có độ âm điện nhỏ hơn.
- Khi viết công thức cấu tạo (CTCT) của:
* Axit có oxi: theo thứ tự + Viết có nhóm H – O
+ Cho O của nhóm H – O liên kết với phi kim trung tâm
+ Sau đó cho phi kim trung tâm liên kết với O còn lại nếu có. * Muối:
+ Viết CTCT của axit tương ứng trước.
+ Sau đó thay H ở axit bằng kim loại. 2. Ví dụ
Ví dụ 1. Dựa vào hiệu độ âm điện các nguyên tố, hãy cho biết có loại liên kết nàotrong các chất sau đây : AlCl3, CaCl2, CaS, Al2S3? Hướng dẫn:
Hiệu dộ âm điện CaCl2 : 2, 16 → Liên kết ion.
Hiệu độ âm điện AlCl3, CaS, Al2S3lần lượt là : 1,55 ; 1,58 ; 0,97 → Liên kết cộng hóa trị có cực.
Ví dụ 2. X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và Z, Z và X. Hướng dẫn:
a) 9X : 1s22s22p5 Đây là F có độ âm điện là 3,98.
19A : 1s22s22p63s23p64s1Đây là K có độ âm điện là 0,82.
8Z: 1s22s22p4 Đây là O có độ âm điện là 3,44.
b) Cặp X và A, hiệu số độ âm điện là: 3,98 – 0,82 = 3,16 , có liên kết ion.
Cặp A và Z, hiệu số độ âm điện là: 3,44 – 0,82 = 2,62, có liên kết ion.
Cặp X và Z, hiệu số độ âm điện là: 3,98 – 3,44 = 0,54, có liên kết cộng hóa trị có cực
3. Bài tập trắc nghiệm
Câu 1. Cho các hợp chất: NH3, Na2S, CO2, CaCl2, MgO, C2H2. Hợp chất có liên kết CHT là: A. CO2, C2H2, MgO B. NH3.CO2, Na2S C. NH3 , CO2, C2H2 D. CaCl2, Na2S, MgO
Câu 2. Liên kết cộng hóa trị trong phân tử HCl có đặc điểm
A. Có hai cặp electron chung, là liên kết đôi, không phân cực.
B. Có một cặp electron chung, là liên kết đơn, không phân cực.
C. Có một cặp electron chung, là liên kết ba, có phân cực.
D. Có một cặp electron chung, là liên kết đơn, phân cực.
Câu 3. Chọn câu đúng trong các câu sau đây :
A. Trong liên kết cộng hóa trị, cặp electron chung lệch về phía nguyên tử có độ âm điện nhỏ hơn.
B. Liên kết CHT có cực được tạo thành giữa 2 nguyên tử có hiệu độ âm điện từ 0,4 đến nhỏ hơn 1,7.
C. Liên kết cộng hóa trị không cực được tạo nên từ các ngtử khác hẳn nhau về tính chất hóa học,
D. Hiệu độ âm điện giữa 2 nguyên tử lớn thì phân tử phân cực yếu.
Câu 4. Kiểu liên kết nào được tạo thành giữa 2 nguyên tử bằng một hay nhiều cặp electron chung ? A. Liên kết ion .
B. Liên kết cộng hóa trị. C. Liên kết kim loại. D. Liên kết hidro
Câu 5. Cho các phân tử : N2 ; SO2 ; H2 ; HBr. Phân tử nào trong các phân tử trên có liên kết
cộng hóa trị không phân cực ? A. N2 ; SO2 B. H2 ; HBr. C.SO2 ; HBr. D. H2 ; N2 .
Câu 6. Cho độ âm điện Cs: 0,79; Ba: 0,89; Cl: 3,16; H: 2,2; S: 2,58; F: 3,98: Te: 2,1 để xác định
liên kết trong phân tử các chất sau: H2Te , H2S, CsCl, BaF2 . Chất có liên kết cộng hóa trị không phân cực là: A. BaF2. B. CsCl C. H2Te D. H2S.
Câu 7. Cho độ âm điện Cs : 0,79 ; Ba : 0,89 ; H : 2,2 ; Cl : 3,16 ; S : 2,58 ; N : 3,04 ; O : 3,44 để
xét sự phân cực của liên kết trong phân tử các chất sau: NH3 , H2S, H2O, CsCl . Chất nào
trong các chất trên có liên kết ion ? A. NH3 B. H2O. C. CsCl. D. H2S.
Câu 8. Liên kết cộng hóa trị là:
A. Liên kết giữa các phi kim với nhau .
B. Liên kết trong đó cặp electron chung bị lệch về một nguyên tử.
C.Liên kết được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau.
D. Liên kết được tạo nên giữa 2 nguyên tử bằng những electron chung.
Câu 9. Trong các nhóm chất sau đây, nhóm nào là những hợp chất cộng hóa trị: A. NaCl, H2O, HCl B. KCl, AgNO3, NaOH C. H2O, Cl2, SO2 D. CO2, H2SO4, MgCl2
Dạng 3: Cách viết công thức cấu tạo của các phân tử 1. Lý thuyết
- Viết cấu hình e của các nguyên tử tạo hợp chất
- Tính nhẩm số e mỗi nguyên tử góp chung = 8 – số e lớp ngoài cùng
- Biểu diễn các e lớp ngoài cùng và các cặp e chung (bằng các dấu chấm) lên xung quanh kí
hiệu nguyên tử ⇒ công thức electron
- Thay mỗi cặp e chung bằng 1 gạch ngang ta được công thức cấu tạo Lưu ý:
- Khi hai nguyên tử liên kết mà trong đó có một nguyên tử A đạt cấu hình bền còn nguyên tử B
kia chưa thì lúc này A sử dụng cặp electron của nó để cho B dùng chung → hình thành liên kết
cho nhận (hay phối trí) biểu diễn bằng → hướng vào nguyên tử nhận cặp electron đó.
- Khi có nhiều nguyên tử đều có thể đưa cặp electron ra cho nguyên tử khác dùng chung thì ưu
tiên cho nguyên tử nào có độ âm điện nhỏ hơn.
- Khi viết công thức cấu tạo (CTCT) của:
* Axit có oxi: theo thứ tự + Viết có nhóm H – O
+ Cho O của nhóm H – O liên kết với phi kim trung tâm
+ Sau đó cho phi km trung tâm liên kết với O còn lại nếu có. * Muối:
+ Viết CTCT của axit tương ứng trước.
+ Sau đó thay H ở axit bằng kim loại 2. Bài tập
Câu 1. Hãy viết công thức electron và công thức cấu tạo của các phân tử sau: PH3, SO2
Câu 2. Viết công thức electron, công thức cấu tạo của HClO, HCN, HNO2.
Câu 3. Viết công thức cấu tạo của các phân tử và ion sau: H2SO3, Na2SO4, HClO4, CuSO4,
NaNO3, CH3COOH, NH4NO3, H4P2O7.
Câu 4. Viết công thức electron, công thức cấu tạo của các phân tử:NH3, C2H2, C2H4, CH4, Cl2, HCl, H2O.
Câu 5. Viết công thức cấu tạo của các phân tử và ion sau: NH + 4 , Fe3O4, KMnO4, Cl2O7
Câu 6. Viết công thức electron và công thức cấu tạo các chất sau:HNO3, Al(OH)3, K2Cr2O7, N2O5, Al2S3, H2CrO4, PCl5
Dạng 4: Bài tập hóa trị và số oxi hóa 1. Lý thuyết
Đối với hợp chất hữu cơ, số oxi hóa của C trong HCHO được tính là số oxi hóa trung bình;
hoặc xem số oxi hóa của C là tổng đại số các số oxi hóa của các nguyên tử khác mà nó liên kết.
Chẳng hạn: Trong CH3 – CH2OH:
Số oxi hóa trung bình của C là: -2
Còn số oxi hóa của C trong CH3 là: -3 và trong CH2OH là -1. 2. Ví dụ minh họa
Ví dụ 1. Số oxi hóa của nitơ trong NH + -
4 , NO2 , và HNO3 lần lượt là: A. +5, -3, +3. B. -3, +3, +5 C. +3, -3, +5 D. +3, +5, -3. Hướng dẫn:
Đặt x, y, z lần lượt là số oxi hóa của nguyên tố nitơ trong NH + - 4 , NO2 , và HNO3
Ta có: x + 4.1 = 1 ⇒ x = -3. Số OXH của N trong NH + 4 là -3
y + 2.(-2) = -1 ⇒ y = 3. Số OXH của N trong NO - 2 là +3
z + 1 + 3.(-2) = 0 ⇒ z = 5. Số OXH của N trong HNO3 là +5 ⇒ Chọn B.
Ví dụ 2. Xác định số oxi hóa của các nguyên tố trong hợp chất , đơn chất và ion sau: a) H2S, S, H2SO3, H2SO4. b) HCl, HClO, NaClO2, HClO3. c) Mn, MnCl2, MnO2, KMnO4. Hướng dẫn:
a) Số oxi hóa của S trong các chất lần lượt là: S-2, S0, S+4, S+6
b) Số oxi hóa của Cl trong các hợp chất: Cl-1, Cl+1,Cl+3, Cl+5, Cl+7.
c) Số oxi hóa của Mn trong các chất: Mn0, Mn+2, Mn+4, Mn+7
Ví dụ 3. Hóa trị và số oxi hóa của N trong phân tử NH4Cl lần lượt là A. 4 và -3 B. 3 và +5 C. 5 và +5 D. 3 và -3 Hướng dẫn:
N thuộc nhóm IVA nên có hóa trị 4
Số OXH: x + 4.1 + (-1)=0 ⇒ x = -3.
Dạng 5: Xác định trạng thái lai hóa Cách giải + Lai hóa sp
- Là sự tổ hợp 1 obitan s với 1 obitan p tạo thành 2 obitan lai hóa sp.
- 2 obitan sp này nằm thẳng hàng với nhau, hướng về 2 phía, đối xứng nhau.
- Góc liên kết bằng 180o. + Lai hóa sp2
- Là sự tổ hợp 1 obitan s với 2 obitan p tạo thành 3 obitan lai hóa sp2.
- 3 obitan sp2này nằm trong 1 mặt phẳng, định hướng từ tâm đến đỉnh của tam giác đều.
- Góc liên kết bằng 120o. + Lai hóa sp3
- Là sự tổ hợp 1 obitan s với 3 obitan p tạo thành 4 obitan lại hóa sp3.
- Định hướng từ tâm đến 4 đỉnh của hình tứ diện đều.
- Các trục đối xứng của chúng tạo với nhau 1 góc 109o28'. Ví dụ minh họa
Ví dụ 1: Cho các phân tử sau : C2H2 (1) ; BF3 (2) ; BeCl2 (3) ; C2H4 (4) ; CH4 (5) ; Cl2 (6) ; H2
(7) ; H2O (8) ; NH3 (9) ; HCl (10). Trong các phân tử trên, sự hình thành liên kết trong các phân tử nhờ :
a. Sự lai hoá sp các AO hoá trị là : A. (1), (3), (6). B. (1), (2), (3), (5). C. (1), (3), (4), (7). D. (1), (3). ⇒ Đáp án D
b. Sự lai hoá sp2 các AO hoá trị là : A. (2), (4). B. (2), (6). C. (2), (3), (4). D. A, B, C. ⇒ Đáp án A
b. Sự lai hoá sp3 các AO hoá trị là : A. (5), (6), (8), (10). B. (5), (8), (9). C. (3), (5), (8), (9). D. (5), (6), (8), (9). ⇒ Đáp án B