














Preview text:
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC NAM CẦN THƠ KHOA DƯỢC
Báo cáo môn Các hệ thống trị liệu mới CHỦ ĐỀ:
TỔNG QUAN CÁC PHƯƠNG PHÁP ĐÁNH GIÁ
SỰ GIẢI PHÓNG DƯỢC CHẤT CỦA THUỐC DÁN
GVHD: ThS.DS. VÕ DUY NHÀN LỚP: DH19DUO01 Cần Thơ, 2024
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC NAM CẦN THƠ KHOA DƯỢC
Báo cáo môn Các hệ thống trị liệu mới CHỦ ĐỀ:
TỔNG QUAN CÁC PHƯƠNG PHÁP ĐÁNH GIÁ
SỰ GIẢI PHÓNG DƯỢC CHẤT CỦA THUỐC DÁN THÀNH VIÊN NHÓM:
1. Vũ Thị Vân Anh (100%)
2. Nguyễn Lê Ánh Thi (100%)
3. Nguyễn Phi Yến (100%)
4. Nguyễn Thị Yến Vy (100%)
5. Tăng Thị Kiều Mỵ (100%)
6. Huỳnh Thị Mỹ Linh (100%)
7. Nguyễn Thị Ý Nhi (100%) Cần Thơ, 2024 LỜI CẢM ƠN
Tôi xin gửi lời cảm ơn chân thành sâu sắc nhất đến ThS.DS Võ Duy Nhàn –
Giảng viên bộ môn tại Trường Đại học Nam Cần Thơ đã trực tiếp hướng dẫn nhiệt
tình, tạo điều kiện thuận lợi, cung cấp các kiến thức bổ ích, các tài liệu tham khảo,
những cuốn sách cần thiết để giúp tôi hoàn thành bài báo cáo này.
Tôi xin cảm ơn thầy cô bộ môn Khoa Dược trường Đại học Nam Cần Thơ đã tạo
điều kiện thuận lợi để giúp tôi hoàn thành bài báo cáo này. Nhưng do thời gian thực
hành ít nên có những sai sót mong quý thầy cô bỏ qua và góp ý để giúp bài báo cáo
của tôi được hoàn thiện hơn.
Tôi xin Chân thành cảm ơn! i MỤC LỤC
LỜI CẢM ƠN...............................................................................................................i
MỤC LỤC....................................................................................................................ii
DANH MỤC HÌNH..................................................................................................iii
ĐẶT VẤN ĐỀ...............................................................................................................1 1.
KHÁI NIỆM THUỐC THẤM QUA DA............................................................2 2.
CẤU TẠO CHUNG.............................................................................................2 3.
CƠ CHẾ GIẢI PHÓNG VÀ THUỐC THẤM QUA DA...................................2 4.
GIẢI PHÓNG DƯỢC CHẤT.............................................................................3 5.
CÁC PHƯƠNG PHÁP ĐÁNH GIÁ SỰ GIẢI PHÓNG HOẠT CHẤT...........5
5.1. Phương pháp dùng thiết bị đĩa lưới inox..........................................................5 5.1.1.
Thiết bị...................................................................................................5 5.1.2.
Cách tiến hành........................................................................................5 5.1.3.
Đánh giá kết quả.....................................................................................6
5.2. Phương pháp dùng thiết bị ống trụ quay..........................................................7 5.2.1.
Thiết bị...................................................................................................7 5.2.2.
Cách tiến hành........................................................................................7 5.2.3.
Đánh giá kết quả.....................................................................................8
5.3. Phương pháp dùng thiết bị tế bào khuếch tán Franz........................................8 6.
ĐÁNH GIÁ SINH KHẢ DỤNG IN VIVO.........................................................9
TÀI LIỆU THAM KHẢO.........................................................................................13 ii DANH MỤC HÌNH
Hình 1. Thuốc dán thấm qua da.....................................................................................2
Hình 2. Cấu tạo chung của thuốc dán............................................................................2
Hình 3. Cơ chế giải phóng thuốc thấm qua da...............................................................3
Hình 4. Các con đường thuốc thấm qua da....................................................................3
Hình 5. Thiết bị kiểu giỏ quay........................................................................................4
Hình 6. Thiết bị kiểu cánh khuấy...................................................................................4
Hình 7. Bộ phận đĩa lưới inox........................................................................................5
Hình 8. Cánh khuấy và đĩa lưới inox.............................................................................6
Hình 9. Bộ phận khuấy hình ống trụ..............................................................................8
Hình 10. Thiết bị tế bào khuếch tán Franz.....................................................................9
Hình 11. Đồ thị nồng độ PAX trong huyết tương theo thời gian..................................10
Hình 12. Đồ thị nồng độ Scopolamine trong huyết tương theo thời gian.....................11 iii ĐẶT VẤN ĐỀ
Cùng với sự phát triển của khoa học kĩ thuật thì công nghệ bào chế thuốc cũng có
những bước phát triển mạnh trong thời gian qua. Nhằm đáp ứng nhu cầu ngày càng
cao của điều trị, ngày càng có nhiều dạng bào chế mới, các dược chất khác nhau ra đời.
Hệ trị liệu qua da (Transdermal Therapeutic System-TTS) với dạng bào chế là
thuốc dán (còn gọi là thuốc dán thấm qua da) là một dạng thuốc đang được chú ý
nghiên cứu bởi các ưu điểm như bảo vệ dược chất, tránh ảnh hưởng của đường tiêu
hóa. Dược chất hấp thu thẳng vào vòng tuần hoàn chung, tránh chuyển hóa lần đầu qua
gan. Thích hợp cho bệnh nhân không thể dùng đường uống, sự phóng thích dược chất có thể thay đổi v.v...
Bên cạnh các nghiên cứu phát triển công thức bào chế và kỹ thuật sản xuất, còn
có các nghiên cứu đánh giá sự giải phóng dược chất của thuốc dán làm cho phạm vi
ứng dụng của dạng thuốc ngày càng được mở rộng.
Đề tài "Tổng quan các phương pháp đánh giá sự giải phóng dược chất của thuốc
dán" được thực hiện với các mục tiêu:
Khái niệm, cấu tạo chung.
Cơ chế giải phóng và thuốc thấm qua da. Giải phóng dược chất.
Các phương pháp đánh giá sự giải phóng hoạt chất.
Đánh giá sinh khả dụng in vivo. 1
1. KHÁI NIỆM THUỐC THẤM QUA DA
Thuốc dán thấm qua da (transdermal System, transdermạl patch) là những chế
phẩm bán rắn. giải phóng dược chất có kiểm soát, được dán trên vùng da nguyên vẹn
nhằm đưa dược chất thấm qua da vào hệ tuần hoàn để gây tác dụng tại chỗ hoặc toàn thân [4].
Hình 1. Thuốc dán thấm qua da 2. CẤU TẠO CHUNG – Lớp nền.
– Lớp chứa dược chất. – Lớp nền dính. – Màng bảo vệ.
– Lớp màng kiểm soát tốc độ phóng thích dược chất [5].
Hình 2. Cấu tạo chung của thuốc dán
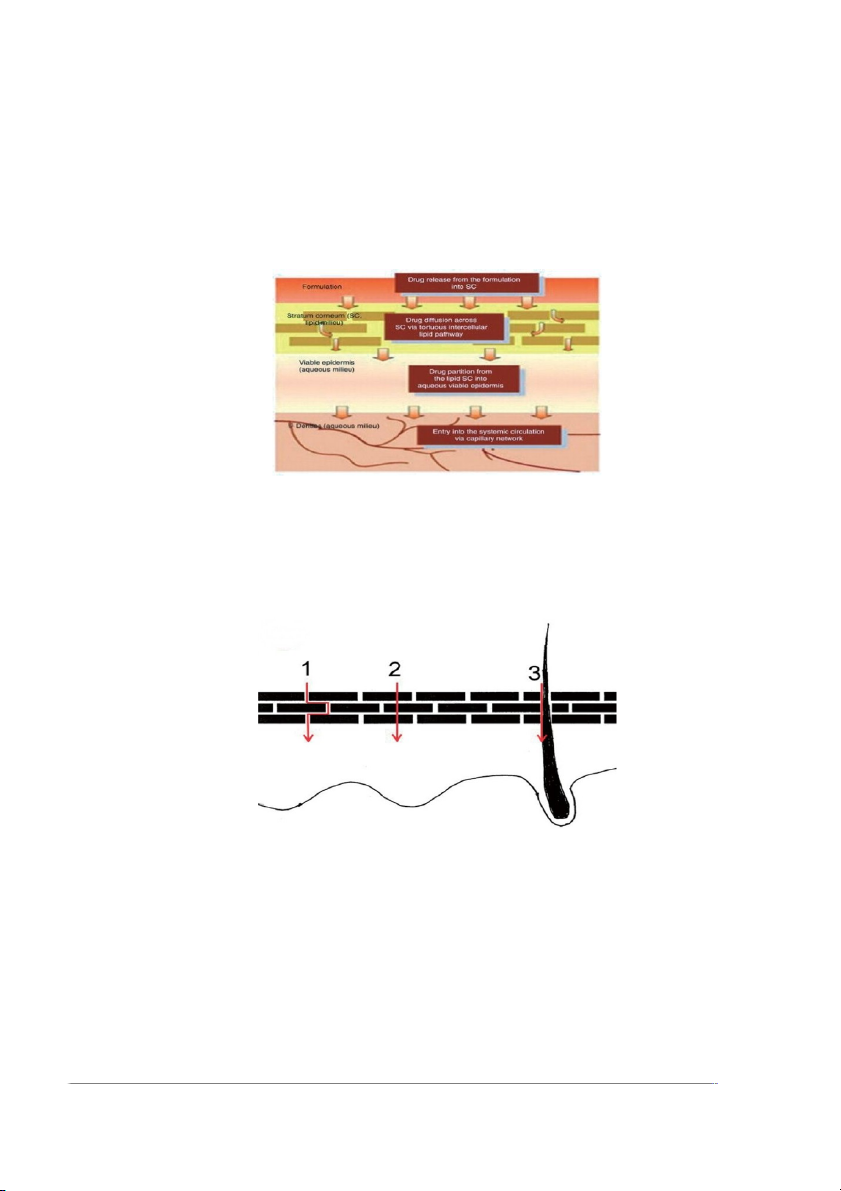
3. CƠ CHẾ GIẢI PHÓNG VÀ THUỐC THẤM QUA DA
Cơ chế giải phóng thuốc: 2
– Dược chất phóng thích khỏi dạng bào chế.
– Dược chất thấm qua lớp biểu bì (đặc biệt là lớp sừng).
– Dược chất thấm qua các lớp tiếp theo của da.
– Dược chất hấp thu vào hệ mạch tại chỗ và các vùng xung quanh, tiếp đó là đến
hệ tuần hoàn và phân bố khắp cơ thể [1].
Hình 3. Cơ chế giải phóng thuốc thấm qua da
Thuốc qua da bằng 2 con đường:
– Qua da: xuyên qua khoảng gian bào và xuyên qua các tế bào.
– Qua phần phụ của da (tuyến bã nhờn, tuyến mồ hôi) [2].
Hình 4. Các con đường thuốc thấm qua da
(1) xuyên qua khoảng gian bào, (2) xuyên qua tế bào và (3) qua phần phụ của da.
4. GIẢI PHÓNG DƯỢC CHẤT
Phương pháp thử nghiệm thích hợp được yêu cầu theo từng chuyên luận riêng để
chứng minh sự giải phóng của dược chất là phù hợp. 3
Thiết bị kiểu giỏ quay, kiểu cánh khuấy hoặc kiểu dòng chảy có thể được sử dụng
tùy theo thành phần, kích thước và hình dạng của mẫu thử.
Hình . Thiết bị kiểu giỏ quay 5 .
Hình . Thiết bị kiểu cánh khuấy 6 .
Sự giải phóng dược chất qua màng cũng được sử dụng. Màng có thể là màng
celulose hoặc màng Silicon và phải không ảnh hưởng đến động học của giải phóng
hoạt chất từ miếng thuốc dán. Màng có thể được xử lý một cách phù hợp trước khi thử
nghiệm, được lưu giữ trong môi trường thích hợp để sử dụng cho thử nghiệm trong 24
h. Đặt bề mặt giải phóng dược chất của miếng thuốc dán lên màng, tránh sự hình thành bọt khí [4]. 4
5. CÁC PHƯƠNG PHÁP ĐÁNH GIÁ SỰ GIẢI PHÓNG HOẠT CHẤT
5.1. Phương pháp dùng thiết bị đĩa lưới inox 5.1.1. Thiết bị
Dùng thiết bị thử độ hòa tan kiểu cánh khuấy như mô tả trong chuyên luận Phép
thử độ hòa tan của dạng thuốc rắn phân liều (Phụ lục 11.4) có bổ sung thêm một bộ
phận đĩa lưới inox hình tròn với lỗ mắt lưới 125 μm.
Bộ phận đĩa lưới inox giữ mẫu thử ở đáy của bình hòa tan và được thiết kế sao
cho giảm thiểu thể tích chết giữa đĩa lưới inox và đáy bình. Bộ phận này cũng giữ cho
miếng dán thử được căng phẳng, có mặt giải phóng thuốc ngửa lên trên và song song
với đáy cánh khuấy. Phải luôn duy trì khoảng cách (25 ± 2) mm giữa đáy cánh khuấy
và bề mặt đĩa lưới inox trong quá trình thử. Nhiệt độ được giữ ổn định ở (32 ± 0,5) °C.
Bình hòa tan có thể được đậy nắp để hạn chế bay hơi dung môi trong thời gian thử [3].
Hình 7. Bộ phận đĩa lưới inox
5.1.2. Cách tiến hành
Cho một thể tích môi trường hòa tan như chỉ dẫn vào bình hòa tan và làm ổn
nhiệt môi trường ở nhiệt độ quy định. 5
Đặt miếng thuốc dán cần thử lên đĩa lưới inox, giữ sao cho bề mặt giải phóng
thuốc càng phẳng càng tốt. Miếng thuốc dán có thể gắn vào đĩa inox bằng keo dính
hoặc bằng một dải băng dính hai mặt. Keo dính hoặc băng dính đều phải được thử
trước chứng tỏ không gây trở ngại cho phép định lượng và không hấp phụ hoạt chất
thuốc. Ấn nhẹ miếng thuốc dán có bề mặt giải phóng thuốc ngửa lên trên lên mặt của
đĩa lưới inox đã có chất dính. Miếng dán thử chỉ nằm trên phần lưới inox, không được phủ trùm lên vành đĩa.
Để làm được điều này, khi chế phẩm thuốc đồng nhất và được trải đều lên cốt của
thuốc dán, có thể đo chính xác và cắt lấy những mảnh thuốc dán có kích thước thích
hợp để thử. Đặt bộ phận đĩa inox đã gắn miếng thuốc dán thử nằm ngang trên đáy bình
hòa tan sao cho mặt giải phóng dược chất ngửa lên trên. Cho vận hành ngay cánh
khuấy quay ở tốc độ quy định, chẳng hạn 100 r/min. Sau từng khoảng thời gian được
định trước, rút mẫu thử ở vùng giữa của bề mặt môi trường hòa tan và mặt trên của
cánh khuấy, và ở chỗ cách thành bình không dưới 1 cm.
Tiến hành định lượng mỗi mẫu dung dịch thử theo phương pháp được chỉ dẫn ở
chuyên luận riêng, hiệu chỉnh sự giảm thể tích môi trường hòa tan nếu thấy cần thiết.
Lặp lại phép thử với những miếng dán khác [3].
Hình 8. Cánh khuấy và đĩa lưới inox
5.1.3. Đánh giá kết quả
Mẫu thử đạt yêu cầu thử độ hòa tan nếu lượng dược chất giải phóng từ miếng
thuốc dán thử, biểu thị bằng khối lượng tính trên 1 đơn vị diện tích bề mặt trong 1 đơn 6
vị thời gian (ví dụ: μg/cm2/h), phải nằm trong giới hạn quy định ở từng thời điểm lấy mẫu xác định [3].
5.2. Phương pháp dùng thiết bị ống trụ quay 5.2.1. Thiết bị
Dùng thiết bị thử độ hòa tan kiểu cánh khuấy như mô tả trong chuyên luận Phép
thử độ hòa tan của các dạng thuốc rắn phân liều (Phụ lục 11.4), thay thế trục và cánh
khuấy bằng một bộ phận khuấy hình ống trụ.
Mẫu thuốc dán đem thử được dính lên trên ống trụ khi bắt đầu mỗi phép thử.
Khoảng cách giữa đáy bình hòa tan và ống trụ được duy trì ở (25 ± 2) mm trong suốt
quá trình thử. Nhiệt độ được giữ ổn định ở (32 ± 0,5) °C. Bình hòa tan có thể được đậy
nắp để hạn chế bay hơi dung môi trong thời gian thử [3].
5.2.2. Cách tiến hành
Cho một thể tích môi trường hòa tan như chỉ dẫn vào bình hòa tan và làm ổn
nhiệt ở nhiệt độ quy định. Bỏ lớp bảo vệ miếng thuốc dán đem thử. Đặt mặt dính của
miếng thuốc dán lên một màng có lỗ bằng vật liệu trơ thích hợp, màng này có kích
thước lớn hơn miếng dán ít nhất 1 cm mỗi cạnh. Đặt màng mỏng có miếng thuốc dán
thử lên trên một bề mặt sạch, để cho màng mỏng tiếp xúc với bề mặt này. Tiếp theo,
tiến hành dán mẫu thử lên ống trụ bằng một trong hai cách sau đây:
Dùng một chất keo dính thích hợp bôi lên bờ cạnh của màng mỏng và nếu cần
thiết bôi lên cả mặt sau của miếng thuốc dán thử.
Dùng một băng dính hai mặt dính vào thành ngoài của ống trụ.
Ép nhẹ mặt không có chất dính của miếng thuốc dán lên ống trụ sao cho bề mặt
giải phóng thuốc tiếp xúc với môi trường hòa tan và trục dọc của dải thuốc dán bao vòng quanh ống trụ.
Keo dính hay băng dính đem dùng đều phải được thử trước chứng tỏ là không
gây trở ngại cho phép định lượng và không hấp phụ dược chất.
Đặt ống trụ vào thiết bị thử độ hòa tan rồi cho vận hành ngay ống trụ quay ở tốc
độ quy định, chẳng hạn ở 100r/ min. 7
Sau từng khoảng thời gian được định trước, rút mẫu thử ở vùng giữa của bề mặt
môi trường hòa tan và mặt trên của ống trụ quay, và ở chỗ cách thành bình không dưới 1 cm.
Tiến hành định lượng mỗi mẫu dung dịch như chỉ dẫn trong chuyên luận riêng,
hiệu chỉnh sự giảm thể tích môi trường hòa tan nếu thấy cần thiết. Lặp lại phép thử với
những miếng thuốc dán khác [3].
Hình 9. Bộ phận khuấy hình ống trụ
5.2.3. Đánh giá kết quả
Mẫu thử đạt yêu cầu thử độ hòa tan nếu lượng dược chất giải phóng từ miếng
thuốc dán thử, biểu thị bằng khối lượng tính trên 1 đơn vị diện tích bề mặt trong 1 đơn
vị thời gian (ví dụ: μg/cm2/h), phải nằm trong giới hạn quy định ở từng thời điểm lấy
mẫu xác định (như phương pháp dùng thiết bị có đĩa lưới inox) [3].
5.3. Phương pháp dùng thiết bị tế bào khuếch tán Franz.
Cấu tạo của mô hình tế bào khuếch tán Franz. Mô hình tế bào khuếch tán Franz
được làm từ hai phần thủy tinh borosilicate. Phần trên có thể được gọi là buồng cấp,
hoặc khoang cấp. Phần dưới thường được gọi là buồng nhận hay khoang thụ
thể.Khoang cấp được nối với khoang nhận bằng một khớp. Đặt ở giữa khớp là màng
thấm hoặc vận chuyển chất. Hệ thống thường được nối với nguồn nước, máy sấy khô, 8
hoặc môi trường có thể kiểm soát nhiệt độ. Quá trình thí nghiệm có sử dụng máy khuấy từ.
Ta lấy mẫu, ống dẫn, ống thoát nước nóng, và lưu lượng được tùy chỉnh của các
tế bào Franz tiêu chuẩn được làm bằng ống có OD (outer diameter) 6mm, có độ dày
thành 1.0mm với dung sai đường kính bên trong của ống là khoảng 4mm. Các xi lanh
với có kích thước kim tiêm OD 2mm có thể dễ dàng được sử dụng để lấy mẫu. Lượng
lấy mẫu tiêu chuẩn có thể nhỏ (mức nM) tùy theo độ nhạy của thiết bị.
– Cách hoạt động của tế bào Franz:
Thuốc thử được đặt ở khoang cấp. Màng ngăn tách khoang cấp chứa mẫu thử với
khoang nhận được đặt vào môi trường có thể điều chỉnh pH bằng đệm phosphate. Tốc
độ thấm của thuốc qua màng được theo dõi bằng cách lấy mẫu từ buồng thụ thể theo
thời gian và định lượng nồng độ. Tại các thời điểm xác định, một lương mẫu được lấy
ra từ khoang nhận để phân tích (ví dụ bằng HPLC) Môi trường sẽ được bù vào với mỗi
lần lấy mẫu như vậy. Thử nghiệm này nhằm xác định lượng thấm qua màng tại mỗi
thời điểm. Hệ thống được duy trì ở nhiệt độ không đổi 35-37 ℃ [6].
Hình 10. Thiết bị tế bào khuếch tán Franz.
6. ĐÁNH GIÁ SINH KHẢ DỤNG IN VIVO
Sử dụng thuốc dán trên da động vật (đã được xử lý sạch lông) và da người tình nguyện. 9
Lấy mẫu huyết tương các khoảng thời gian xác định, tiến hành xử lý và định
lượng theo quy trình phù hợp. Kết quả định lượng:
Đồ thị nồng độ thuốc trong huyết tương theo thời gian.
Các thông số đặc trưng của sinh khả dụng.
Mô hình thử nghiệm in vivo trên người là đáng tin cậy nhất [1]. Ví dụ 1
– Thí nghiệm trên thỏ của thuốc dán chứa paroxetine: 9 thỏ chia ngẫu nhiên thành
3 nhóm, mỗi nhóm có 3 thỏ.
Nhóm 1 dùng miếng dán chứa 20 mg paroxetine (PAX) (10 mg/kg).
Nhóm 2 dùng viên uống PAX 20 mg.
Nhóm 3 dùng miếng dán placebo không có PAX (chứng dương).
– Các mẫu máu được rút từ tĩnh mạch vành tai ở các thời điểm 2, 4, 6, 8, 12, 24
và 48 giờ đối nhóm dùng miếng dán và 1, 2, 4, 6, 8, 12 và 24 giờ đối với nhóm dùng viên uống PAX.
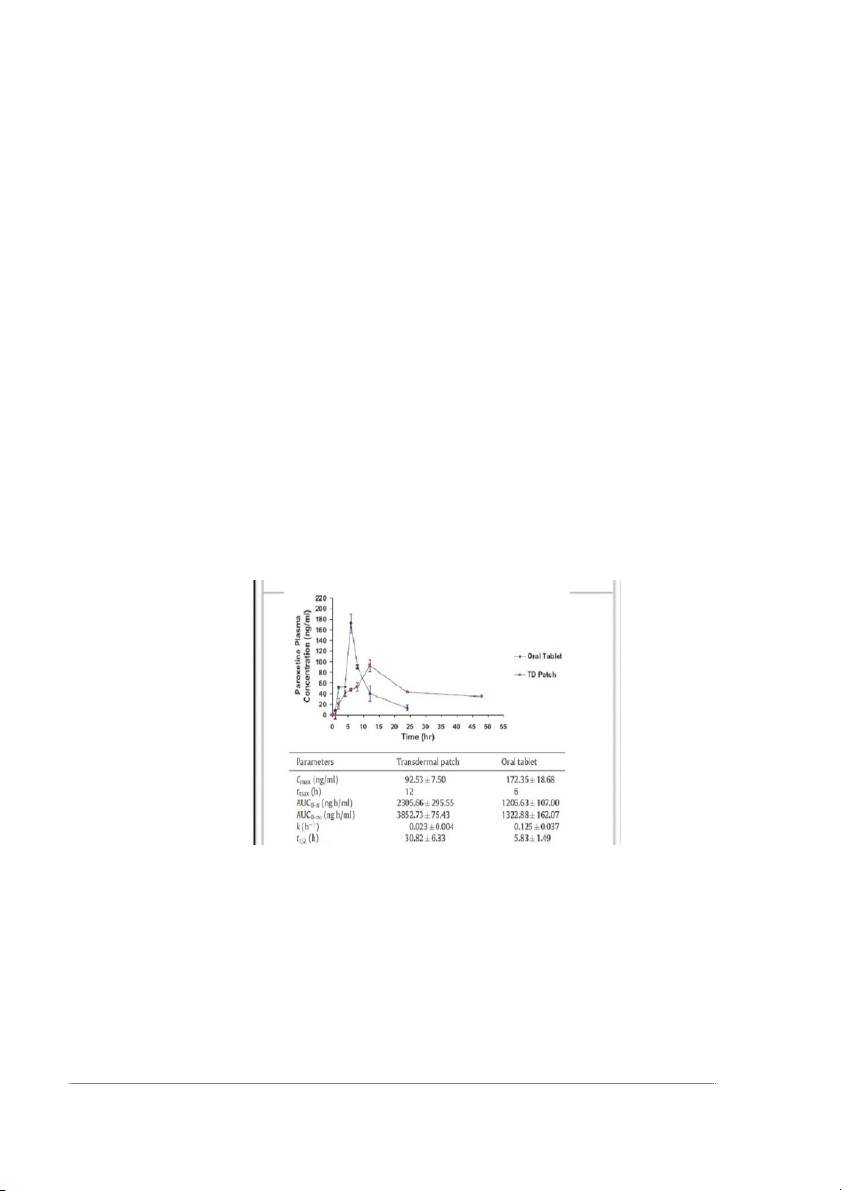
Hình 11. Đồ thị nồng độ PAX trong huyết tương theo thời gian
Kết quả: Các thông số dược động học được xác định:
Cmax của miếng dán PAX được tìm thấy là 92,53ng/ml ở thời điểm tmax 12giờ
và AUC0–48 là 2305,656 ng h/ml và AUC 0–∞ là 3852,726 ngh/ml. 10
So với Cmax là 172,35 ng/ml sau khi uống viên PAX bán trên thị trường với
tmax là 6giờ và AUC0–24 là 1206,63 ng h / ml và AUC0–∞ là 1322,878 ng h/ml.
Những kết quả này cho thấy sự cải thiện khả dụng sinh học của PAX sau khi dán
miếng dán và duy trì hiệu quả điều trị so với dùng đường uống [7]. Ví dụ 2
– Thí nghiệm trên người của thuốc dán chứa scopolamine: 25 hải quân nam, từ 18
đến 20 tuổi, chia 3 nhóm:
Nhóm 1: 9 người, sử dụng 1 miếng dán ở sau tai và 1 viên scopolamine 0,6 mg uống.
Nhóm 2: 8 người, sử dụng 1 miếng dán sau tai và 1 viên scopolamine 0,3 mg uống.
Nhóm 3: 8 người, dùng 1 miếng dán sau tai và 1 viên placebo uống.
– Các mẫu máu, mỗi mẫu 10 ml, được thu từ mỗi đối tượng trước khi điều trị và
0.5, 1, 1.5, 2.5, 3.5, 6, 8 và 22 giờ sau khi điều trị.
Hình 12. Đồ thị nồng độ Scopolamine trong huyết tương theo thời gian
Kết quả: Nồng độ scopolamine trong huyết tương cao hơn đáng kể được tìm
thấy ở nhóm 1 lúc 0,5; 1; 1,5 và 2,5 giờ và ở nhóm 2 lúc 1 và 1,5 giờ sau điều trị, so
với nhóm 3. Sau đó, nồng độ trong huyết tương không khác biệt đáng kể giữa các nhóm. 11
Sự kết hợp giữa scopolamine qua da và đường uống (0,3 hoặc 0,6 mg) cung cấp
nồng độ cần thiết trong huyết tương để ngăn ngừa say sóng, bắt đầu sớm nhất là 0,5
giờ sau điều trị mà không có tác dụng phụ đáng kể [8]. 12 TÀI LIỆU THAM KHẢO 1. Bùi Minh Hoàng (2020),
Hệ thống trị liệu qua da.
https://www.scribd.com/document/520034866/Thuoc-dan-2020 , truy cập ngày 16/2/2024.
2. Bác sĩ Hoàng Văn Tâm (2020), Cách dẫn thuốc qua da và tăng cường thuốc
thấm vào da. https://nhathuocngocanh.com/dan-thuoc-qua-da/ , truy cập ngày 16/2/2024.
3. Dược sĩ Lưu Anh (2018), Phép thử độ giải phóng dược chất của thuốc dán thấm
qua da. https://duocdienvietnam.com/phep-thu-do-giai-phong-duoc-chat-cua-
thuoc-dan-tham-qua-da/ , truy cập ngày 17/2/2024.
4. Dược sĩ Lưu Anh (2018), Phụ lục 1.9 thuốc dán thấm qua da và cao dán.
https://duocdienvietnam.com/thuoc-dan-tham-qua-da-va-cao-dan/ , truy cập ngày 17/2/2024.
5. Dược sĩ Ngọc Hân (2020), Thuốc dán thấm qua da là gì? Các thành phần và kỹ
thuật bào chế. https://nhathuocngocanh.com/thuoc-dan-tham-qua-da/ , truy cập ngày 16/2/2024.
6. Nguyễn Thị Hồng Nhiên (2019), Nghiên cứu dự đoán khả năng thẩm thấu qua
da của dược chất sử dụng mô hình GSPeR.
https://text.123docz.net/document/6000654-nghien-cuu-du-doan-kha-nang-
tham-thau-qua-da-cua-duoc-chat-su-dung-mo-hinh-qsper.htm , truy cập ngày 22/2/2024.
7. Mohamed et al. (2013), Transdermal drug delivery of paroxetine through lipid-
vesicular formulation to augment its bioavailability, International Journal of
Pharmaceutics, 443(1-2), 307-317.
8. Nachum, Z., Shahal, B., Shupak, A., Spitzer, O., Gonen, A., Beiran, I., Lavon,
H., Eynan, M., Dachir, S., & Levy, A. (2001), Scopolamine bioavailability in
combined oral and transdermal delivery, The Journal of pharmacology and
experimental therapeutics, 296(1), 121–123. 13