



Preview text:
BÁO CÁO THỰC HÀNH CÁC PHƯƠNG PHÁP PHÂN TÍCH MÔI TRƯỜNG
XÁC ĐỊNH FE3+ TRONG NƯỚC BẰNG PHƯƠNG PHÁP SO MÀU QUANG ĐIỆN Sinh viên: Bùi Đức Huy Lớp: K67 CLC CNKTMT 1. Mục tiêu:
Xác định Fe (III) trong nước bằng phương pháp so màu với thuốc thử axit sunfoxalixilic.
2. Nguyên tắc của phương pháp
Ion Fe2+ trong môi trường kiềm thành Fe3+ phản ứng với thuốc thử axit
sunphoxalixilic tạo thành phức có màu vàng. Lượng lớn Al, Cu có trong mẫu sẽ
cản trở phép xác định.
3. Hóa chất, nguyên vật liệu, thiết bị, dụng cụ - Axit sunphoxalixilic - NH3 đặc - Pipet - Dd FeSO4 nồng độ 1g/L
- Dd Fe chưa biết nồng độ
- Bình định mức 50, 100ml - Máy UV-VIS 4. Quy trình tiến hành
4.1. Pha loãng mẫu
Từ dd FeSO4 nồng độ 1g/L ban đầu, dùng 2 bình định mức 100ml ta pha loãng dd
Fe2+ ban đầu về nồng độ 10mg/L:
- Hút 10ml dd Fe2+ nồng độ 1g/L cho vào bình định mức 100ml đầu tiên rồi
dùng nước cất định mức lên 100ml, ta được dd Fe2+ nồng độ 100mg/L
- Tiếp đó ta hút 10ml dd Fe2+ nồng độ 100mg/L cho vào bình định mức
100ml thứ 2, dùng nước cất định mức lên đến 100ml, ta được dd Fe2+ nồng độ 10mg/L
4.2. Trình tự phân tích
Lấy 1 lượng mẫu nước thích hợp trong đó có chứa 10mgFe2+/L, sau đó cho vào
bình định mức 50ml, cho vào thêm 2ml axit sunphoxalixilic, tiếp đến thêm 2ml
NH3 đặc vào bình. Thêm nước cất tới vạch mức, lắc đều, sau 10-15p đo độ hấp thụ quang của dung dịch
Với dd Fe chưa biết nồng độ thì ta hút 10ml vào bình định mức 50ml, thêm 2ml
axit sunphoxalixilic, thêm 2ml NH3 đặc rồi dung nước cất định mức đến vạch.
4.3. Lập đường chuẩn
Lần lượt lấy vào mỗi cốc 0; 1; 2; 3; 4; 5; 6; 7;8 ml dung dịch có nồng độ 0,01mg
Fe/ml. Rồi tiến hành tương tự như đối với mẫu phân tích.
4.4. Phân tích bằng máy UV-VIS
Lấy dung dịch mẫu đã được chuẩn bị đem đi phân tích trên máy UV-VIS độ hấp thụ quang. 5. Kết quả
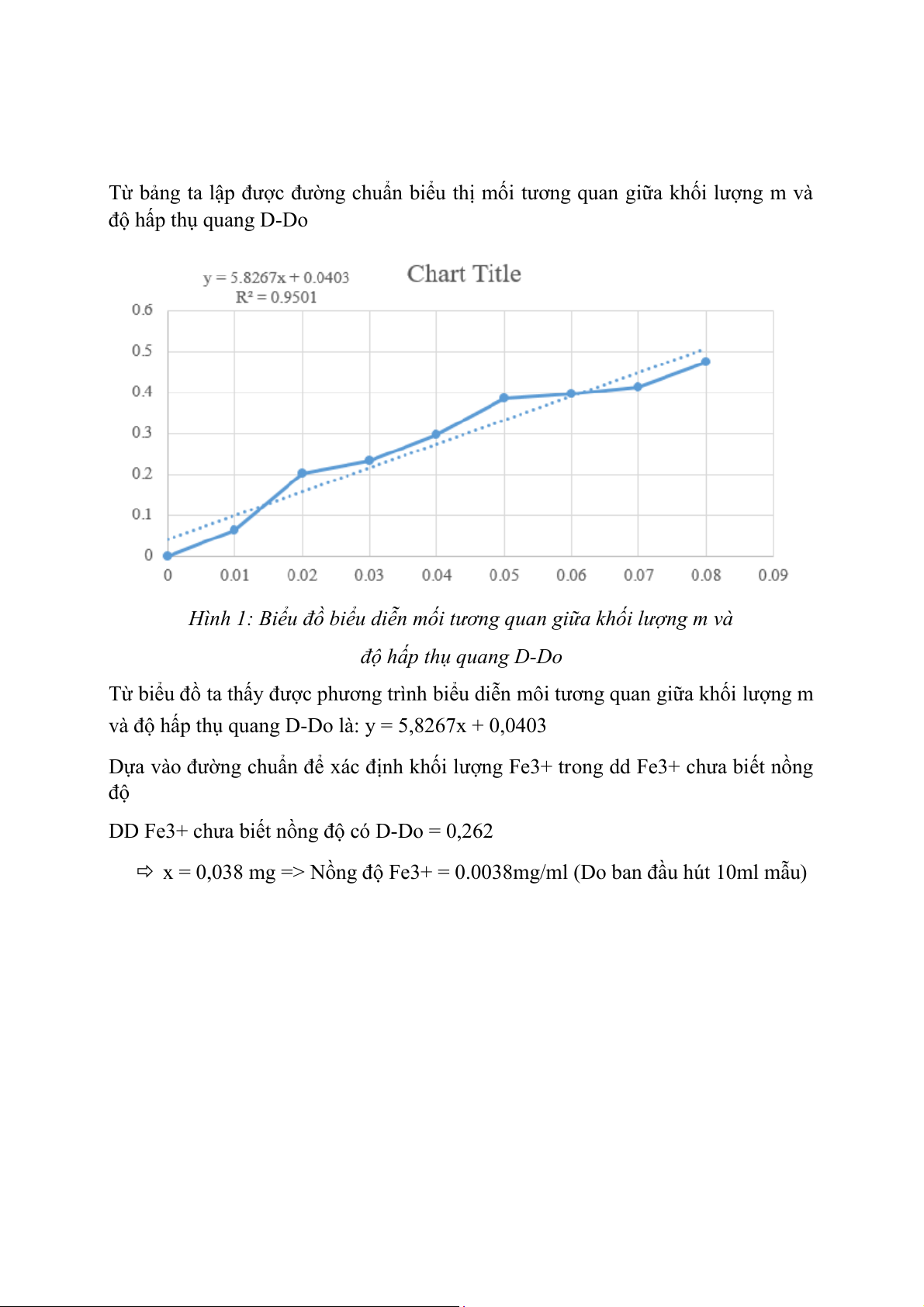
5.1. Dựa vào khối lượng m và độ hấp thụ quang D-Do Hút Khối lượng ddtc(ml) m(mg) D-Do 0 0 0 1 0.01 0.063 2 0.02 0.201 3 0.03 0.231 4 0.04 0.295 5 0.05 0.386 6 0.06 0.395 7 0.07 0.414 8 0.08 0.475
Từ bảng ta lập được đường chuẩn biểu thị mối tương quan giữa khối lượng m và độ hấp thụ quang D-Do
Hình 1: Biểu đồ biểu diễn mối tương quan giữa khối lượng m và
độ hấp thụ quang D-Do
Từ biểu đồ ta thấy được phương trình biểu diễn môi tương quan giữa khối lượng m
và độ hấp thụ quang D-Do là: y = 5,8267x + 0,0403
Dựa vào đường chuẩn để xác định khối lượng Fe3+ trong dd Fe3+ chưa biết nồng độ
DD Fe3+ chưa biết nồng độ có D-Do = 0,262
x = 0,038 mg => Nồng độ Fe3+ = 0.0038mg/ml (Do ban đầu hút 10ml mẫu)
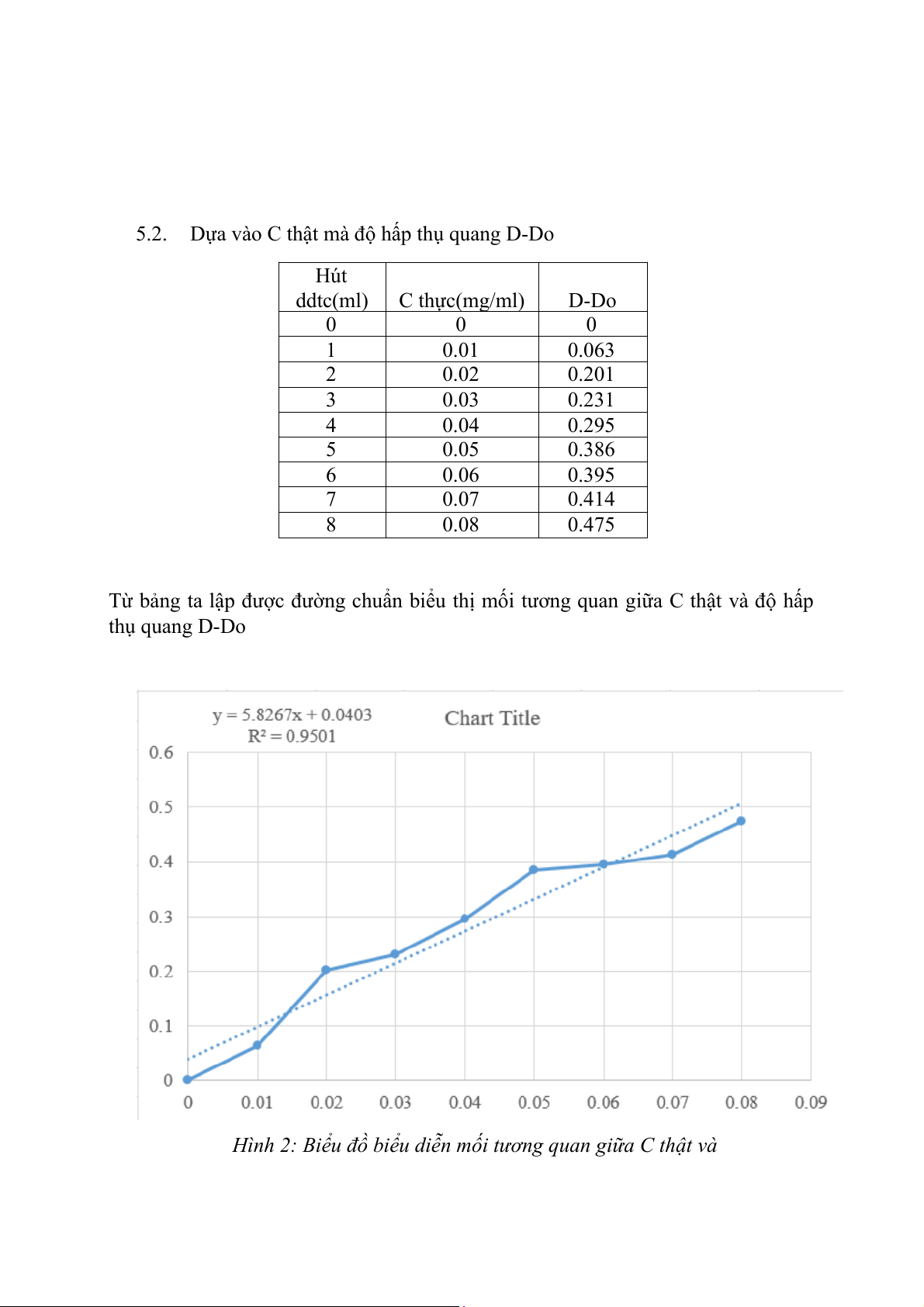
5.2. Dựa vào C thật mà độ hấp thụ quang D-Do Hút ddtc(ml) C thực(mg/ml) D-Do 0 0 0 1 0.01 0.063 2 0.02 0.201 3 0.03 0.231 4 0.04 0.295 5 0.05 0.386 6 0.06 0.395 7 0.07 0.414 8 0.08 0.475
Từ bảng ta lập được đường chuẩn biểu thị mối tương quan giữa C thật và độ hấp thụ quang D-Do
Hình 2: Biểu đồ biểu diễn mối tương quan giữa C thật và
độ hấp thụ quang D-Do
Từ biểu đồ ta thấy được phương trình biểu diễn môi tương quan giữa C thật và độ
hấp thụ quang D-Do là: y = 5,8267x + 0,0403
Dựa vào đường chuẩn để xác định C thật của dd Fe3+ trong dd Fe3+ chưa biết nồng độ
DD Fe3+ chưa biết nồng độ có D-Do = 0,262
x = 0,038 mg/10ml => Nồng độ Fe = 0.0038mg/ml (Do ban đầu hút 10ml mẫu)
5.3. Dựa theo C giả và độ hấp thụ quang D-Do Hút ddtc(ml) C giả (mg/ml) D-Do 0 0 0 1 0.02 0.063 2 0.04 0.201 3 0.06 0.231 4 0.08 0.295 5 0.1 0.386 6 0.12 0.395 7 0.14 0.414 8 0.16 0.475
Từ bảng ta lập được đường chuẩn biểu thị mối tương quan giữa C giả và độ hấp thụ quang D-Do
Hình 3: : Biểu đồ biểu diễn mối tương quan giữa C giả và
độ hấp thụ quang D-Do
Từ biểu đồ ta thấy được phương trình biểu diễn môi tương quan giữa C giả và độ
hấp thụ quang D-Do là: y = 2,9133x + 0,0403
Dựa vào đường chuẩn để xác định C giả của dd Fe3+ trong dd Fe3+ chưa biết nồng độ
DD Fe chưa biết nồng độ có D-Do = 0,262 x = 0,0761mg/ml
Thể tích dung dịch tiêu chuẩn = 0,0761mg/ml x 50ml = 3,805ml
Nồng độ Fe3+ = (3,805ml x 0,01mg/ml)/10ml = 0,0038mg/ml 6. Kết luận
Nồng độ dd Fe3+ cần tìm là 0,0038mg/ml = 3,8mg/L



