





Preview text:
Chương 8
Các phương pháp xác ịnh tốc ộ ĕn mòn kim lo i 8.1 Mở ầu
Nhằm mục ích phân lo i và ánh giá nh h ng c a môi tr ng ến ộ bền chống ĕn mòn c a vật liệu
trong iều kiện tự nhiên cũng nh iều kiện gia tốc thì việc lựa chọn phơng pháp ánh giá tốc ộ ĕn
mòn có ý nghĩa r t quan trọng.
Có r t nhiều phơng pháp ể ánh giá tốc ộ ĕn mòn.
Ng i ta dùng mắt th ng hoặc dùng kính hiển vi quan sát tr ng thái bề mặt kim lo i bị ĕn mòn
cho phép ánh giá ịnh tính và phân lo i ĕn mòn theo d ng ĕn mòn ều hoặc d ng ĕn mòn cục bộ
(ĕn mòn iểm, ĕn mòn khe…).
Bảng 8.1 Thang phân lo i ộ bền chống ĕn mòn vật liệu kim lo i
Phân lo i ộ bền chống ĕn Chỉ bền số ộ Xếp lo i mòn Pmm/nĕm Siêu bền 0,001 1 0,001 – 0,005 2 Độ bền cao 0,005 – 0,01 3 0,01 – 0,05 4 Có ộ bền trung bình 0,05 – 0,1 5 0,1 – 0,5 6 Độ bền th p 0,5 – 1,0 7 1,0 – 5,0 8 Độ bền r t th p 5,0 – 10,0 9 Hoàn toàn không bền > 10,0 10
Để ánh giá một cách ịnh lợng và phân lo i ộ bền chống ĕn mòn theo tiêu chuẩn xác ịnh
(xem b ng 8.1), việc xác ịnh tốc ộ ĕn mòn kim lo i có thể sử dụng các phơng pháp sau: – Phơng pháp trọng lợng. –
Các phơng pháp phân tích nồng ộ kim lo i bị hoà tan vào môi tr ng ĕn mòn và
suy ra tốc ộ ĕn mòn kim lo i. –
Sử dụng các phơng pháp iện hoá. 147
Sau ây sẽ trình bày một số phơng pháp cụ thể.
8.2 Các phương pháp xác ịnh tốc ộ ĕn mòn kim lo i
8.2.1 Phương pháp trọng lượng
Tốc ộ ĕn mòn kim lo i do môi tr ng gây ra ợc xác ịnh bằng phơng pháp trọng lợng, nghĩa là
tính theo lợng kim lo i (tính theo gam) bị m t i ng với một ơn vị th i gian và ơn vị diện tích mẫu
(về ơn vị theo quy ớc) theo công th c sau: mo −m1 Δm ρ= = (8.1) S.t S.t
trong ó: ρ - tốc ộ ĕn mòn; mo - trọng lợng mẫu kim lo i trớc khi thí
nghiệm (g) hoặc (mg); m1 - trọng lợng mẫu kim lo i sau thí
nghiệm (g) hoặc (mg); S - diện tích bề mặt kim lo i; t - th i gian
(gi ) hoặc (ngày, êm) hoặc nĕm.
Nếu Δm (mg), S (dm2) và t (ngày êm) ta có: [ρ] = mg/dm2.ngày êm (8.2)
Công th c (8.1) th ng áp dụng cho tr ng hợp ĕn mòn ều.
Phơng pháp này th ng gặp những sai số do phép cân gây ra, vì thế ph i dùng cân phân tích
có ộ chính xác cao. Ngoài ra việc chuẩn bị mẫu trớc và sau khi thí nghiệm cũng óng một vai trò r t quan trọng.
Các mẫu trớc khi thí nghiệm ph i ợc làm s ch hết các lớp gỉ, mài nhẵn sao cho diện tích
thực ph i gần bằng diện tích hình học S. Trớc khi nhúng mẫu vào môi tr ng ĕn mòn bề mặt mẫu
ợc làm s ch hết dầu mỡ bằng cồn hoặc bằng dung môi axeton b o m bề mặt hoàn toàn th m ớt,
s y khô và em cân ta có trọng lợng mo.
Sau th i gian t thí nghiệm tr ng thái bề mặt mẫu kim lo i bị thay ổi, hoặc t o thành các lớp
gỉ. Vì thế cần ph i làm s ch các s n phẩm ĕn mòn, song tránh sự hoà tan kim lo i (sử dụng các
TCVN hoặc ASTM ể biết cách xử lí bề mặt). Bề mặt kim lo i sau khi ợc làm s ch s n phẩm cũng
ph i xử lí bằng các dung môi hữu cơ, s y khô và em cân thu ợc m1. Sau ó tính tốc ộ ĕn mòn theo công th c (8.1).
Nếu giá trị Δm quá nhỏ thì phép o th ng dễ gặp sai số lớn, trong tr ng hợp ó cần ph i làm
thí nghiệm nhiều lần ể l y giá trị trung bình hoặc kéo dài th i gian thí nghiệm.
Đánh giá tốc ộ ĕn mòn theo tổn th t chiều sâu P (chiều dày c a kim lo i bị hao hụt) tính theo công th c: ρ Ρ= (8.3) d 148 mòn.
Vì vậy, ngoài việc dùng phơng pháp trọng lợng ánh giá tốc ộ ĕn mòn bằng sự hao tổn trọng
lợng còn có thể ánh giá tốc ộ ĕn mòn thông qua thể tích c a hi ro ợc gi i phóng ra hoặc thể tích oxi bị tiêu thụ.
8.2.2 Các phương pháp phân tích
Để xác ịnh tốc ộ ĕn mòn kim lo i ng i ta xác ịnh nồng ộ ion kim lo i bị hoà tan vào môi tr
ng xâm thực, từ ó suy ra tốc ộ ĕn mòn. Có thể dùng các phơng pháp phân tích ịnh lợng, ví dụ
phơng pháp quang phổ, phơng pháp h p phụ nguyên tử, phơng pháp cực phổ, …
8.2.3 Phương pháp iện hoá
Một u iểm quan trọng c a phơng pháp iện hoá là cho phép xác ịnh ợc tốc ộ ĕn mòn kim lo i
trong một th i gian ngắn và chính xác với iều kiện thí nghiệm ợc tiến hành một cách thận trọng
và úng quy cách. Có thể dùng phơng pháp o iện hoá ể xác ịnh tốc ộ ĕn mòn kim lo i trong iều
kiện gia tốc ể so sánh với những thí nghiệm trong iều kiện tự nhiên. Phơng pháp này sẽ em l i
kết qu khá phù hợp với iều kiện tự nhiên nếu chọn dung dịch và iều kiện mô phỏng ph n nh ợc
những yếu tố gần sát thực tế hiện tr ng. Trong tr ng hợp ngợc l i, nếu iều kiện o iện hoá không
phù hợp với iều kiện thực sẽ gây ra sự sai sót trầm trọng.
Trong quá trình ĕn mòn kim lo i x y ra chỉ gắn với sự khử ion H+ trong dung dịch hoặc là
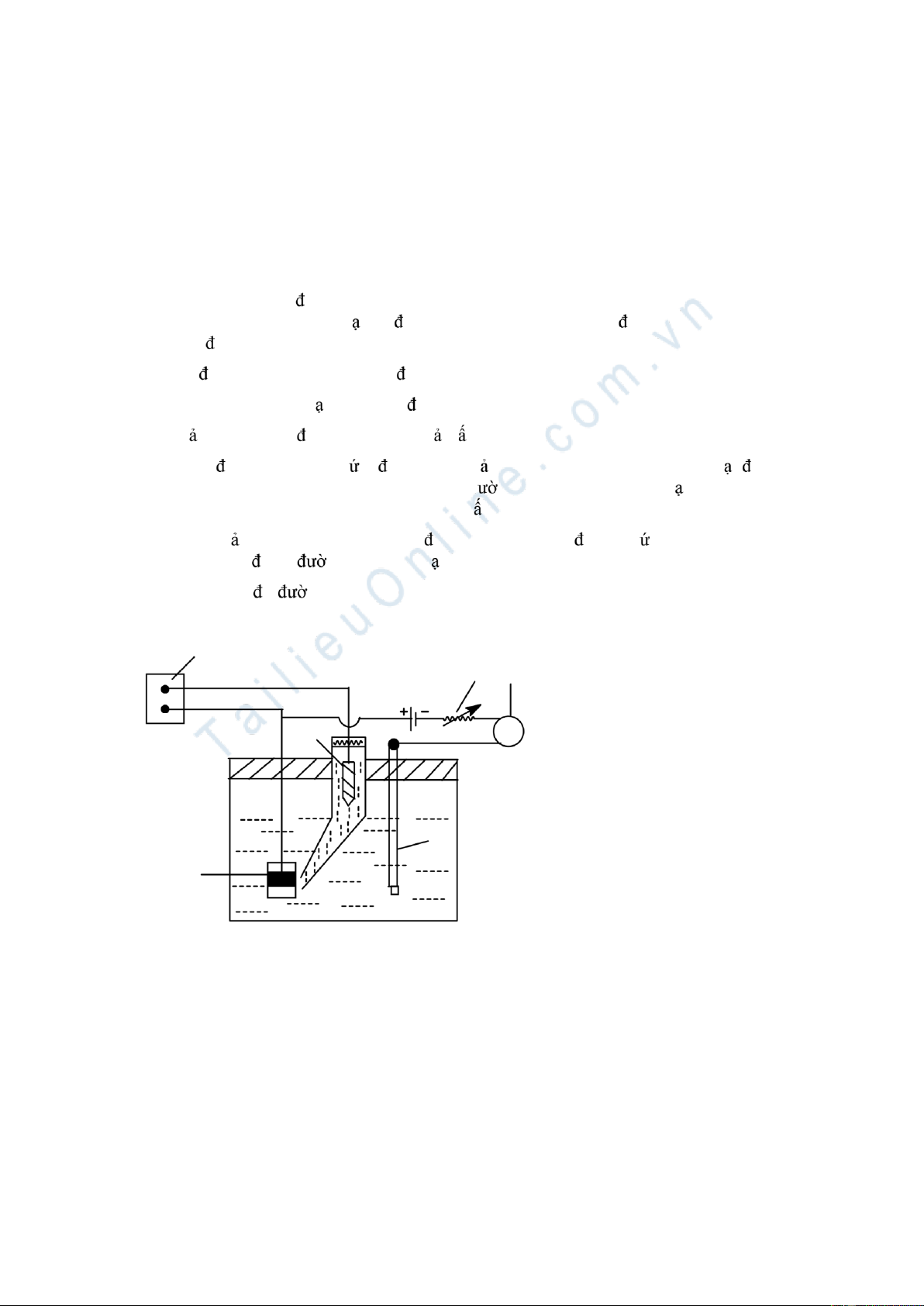
sự tiêu thụ oxi trong dung dịch, thì việc o iện hoá sẽ em l i các kết qu khá phù hợp với iều kiện thực tế. 149 1 Hình 8.1 Eĕm - f(t) 4 - Dung dịch nghiên c u
5 - Cầu nối ch a KCl (hoặc HCl)
So sánh giá trị thế ĕn mòn Eĕm o ợc với giá trị thế trên ồ thị iện thế (E) và pH c a Pourbaix
ể suy oán kh nĕng x y ra ĕn mòn trên iện cực nghiên c u.
Đo iện thế oxi hoá khử c a môi tr ng bằng cách nhúng dây Pt vào môi tr ng và ghép với iện
cực so sánh ( iện cực b c) t o ra pin iện và o su t iện ộng c a pin. Tính iện thế oxi hóa khử suy ra
kh nĕng gây ra ĕn mòn hoặc t o ra thụ ộng.
8.3.2.2 Đo ường cong phân cực - sự phụ thuộc c a mật ộ dòng iện i vào iện thế E
Phép o ng cong phân cực có thể xem là m rộng phép o iện thế ĕn mòn Eĕm mà không có
dòng phân cực từ dòng ngoài (I = 0). Vậy việc o ng phân cực có thể thực hiện bằng hai cách: 150
– Áp dòng ngoài I ≠ 0 o thế, nghĩa là ặt vào hệ một giá trị mật ộ dòng không ổi (I = const)
và o giá trị thế E ó t tr ng thái ổn ịnh và t o ra một sự phụ thuộc c a mật ộ dòng vào thế. Phơng
pháp ó gọi là phơng pháp dòng tĩnh (Galvanostatic).
– Áp một giá trị thế không ổi từ nguồn iện bên ngoài nh một máy phát thế ổn ịnh
(Potentiostatic, E = const) o giá trị dòng I khi t tr ng thái ổn ịnh và t o ra sự phụ thuộc c a dòng
vào thế hoặc thế vào dòng và ợc gọi là ng phân cực.
1. Đo ường cong phân cực theo phương pháp dòng tĩnh (Galvanostatic)
Có thể dùng thiết bị o Potentio-Galvanostatic thay cho các cụm thiết bị gồm các phần (8,
7, 6, 5) trên hình vẽ, phần còn l i ba iện cực 1, 2, 4 nối vào máy o Potentio-Galvanostatic và tiến hành o.
Những iều cần chú ý trong phép o: –
Chuẩn bị dung dịch s ch, ặt các iện cực 1 và 2 ối diện nhau. –
Kho ng cách giữa iện cực 1 và 4 ph i r t gần nhau –
Bề mặt iện cực nghiên c u, iện cực 1 ph i có diện tích chính xác (kim lo i úc
trong nhựa epoxi có một mặt làm việc với diện tích th ng là 1 cm2, phần còn l i bị che ph cách
iện), ợc làm nhẵn với ộ bóng cao và xử lí th m ớt hoàn toàn trớc khi tiến hành o. –
Chọn kho ng thế phù hợp, từ phép o thu ợc số liệu iện thế ng với thay ổi giá trị
mật ộ dòng i, sau ó vẽ ng phân cực d ng i - f(E) hoặc E - lgi (xem hình 8.4 và 8.5). Sơ ồ thiết bị o
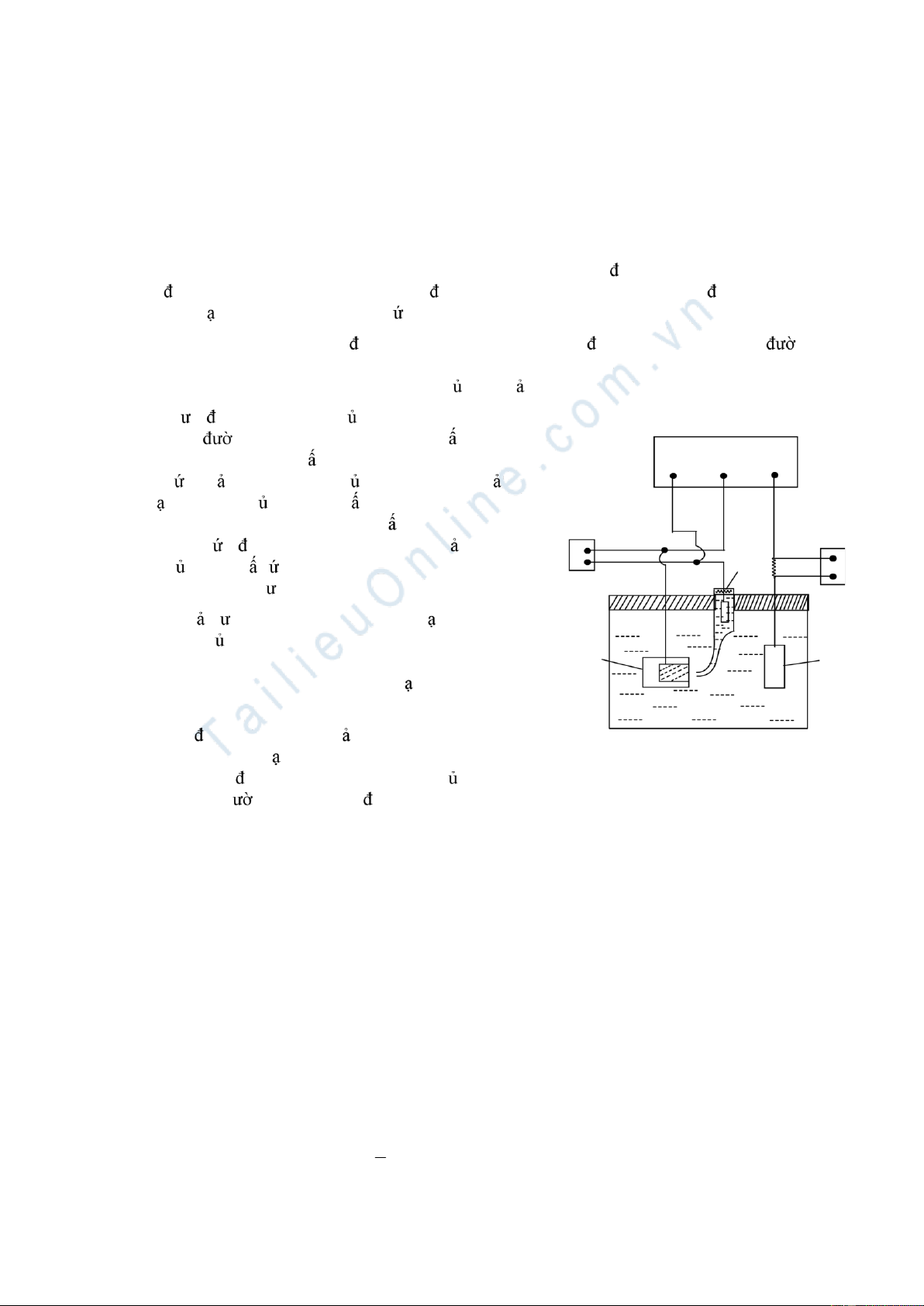
ng phân cực theo phơng pháp dòng tĩnh ợc trình bày trên hình (8.3). 8 6 5 7 A 4 2 1 3 Hình 8.3
Sơ ồ thiết bị o
ng phân cực (Galvanostatic)
1. Điện cực làm việc (WE); 2. Điện cực phụ trợ (CE) bằng Pt; 3. Dung dịch ch t iện li; 4. Điện cực so sánh (RE) -
iện cực b c; 5. Đồng hồ ampe; 6. Điện tr iều khiển; 7. Nguồn một chiều; 8. Máy o thế E(V). 151 Đ c a các 152 Hình 8.5
Đ ng cong phân cực c a kim lo i Me (ví dụ thép) trong môi tr ng axit (ví dụ HCl)
2. Đo ường cong phân cực theo phương pháp thế tĩnh (Potentiostatic) Sơ ồ o
ng cong phân cực theo phơng pháp thế tĩnh ợc trình bày trên hình (8.6).
Bằng thiết bị Potentiostat (7) duy trì giá trị thế không ổi trên iện cực làm việc (1) - WE so
với iện cực so sánh (2) – RE, áp lên iện cực làm việc những giá trị thế iện cực khác nhau và ghi
l i các giá trị dòng tơng ng.
Từ các giá trị thực nghiệm o các giá trị dòng i phụ thuộc iện thế E cho phép vẽ ng phân cực
i - f(E) (xem hình 8.4) hoặc E - lgi (xem hình 8.5). Từ các ồ thị trên các hình 8.4 và 8.5 cho
phép xác ịnh thế ĕn mòn Eĕm và iĕm c a hệ kh o sát.
Một u iểm quan trọng c a phơng pháp thế tĩnh là Potentiostat
trên ng phân cực i - f(E) có xu t hiện miền thụ ộng. RE WE CE
Điều này r t quan trọng ối với việc nghiên c u kh nĕng
thụ ộng c a các hợp kim, kh nĕng t o thụ ộng c a các
hệ ch t oxi hoá khử thêm vào dung dịch. Phơng pháp
này r t tiện lợi cho việc nghiên c u ánh giá tốc ộ ĕn 5 2 8
mòn, kh nĕng c chế c a các ch t c chế ối với thép trong môi tr
ng kiềm cũng nh gần trung tính.
Cần ph i l u ý rằng phơng pháp ngo i suy các ng 1 3
Tafel c a hai phơng pháp trên ể tính giá trị Eĕm và iĕm
chỉ chính xác ối với hệ ĕn mòn chỉ có hai hệ oxi hoá
khử (sự hoà tan kim lo i và sự khử hi ro hoặc là oxi). 4
Trong iều kiện ĕn mòn x y ra có sự phân cực nồng
ộ thì phép ngo i suy sẽ không còn chính xác nữa. Ví
dụ việc o phân cực catot và anot c a kim lo i trong môi Hình 8.6
tr ng axit yếu ể ánh giá tốc ộ ĕn mòn có ộ tin cậy kém.
Sơ ồ o ường phân cực theo phương pháp thế tĩnh
1. Điện cực làm việc (WE); 2. Điện cực so sánh
(RE); 3. Điện cực phụ trợ (CE); 4. Dung dịch chất
iện li; 5,6. Cácmilivol kế;7. Potentiostat; 8. Điện
trở mẫu ã có giá trị biết trước
8.3.2.3 Phương pháp o iện trở phân cực 7
Phơng pháp o iện tr phân cực còn ợc gọi là phơng pháp phân cực tuyến tính. Phơng pháp
này do Stern Geary ề ra nĕm 1956 và ã ợc phát triển, áp dụng tính tốc ộ ĕn mòn cho nhiều hệ
ĕn mòn có kết qu r t tốt. Trên
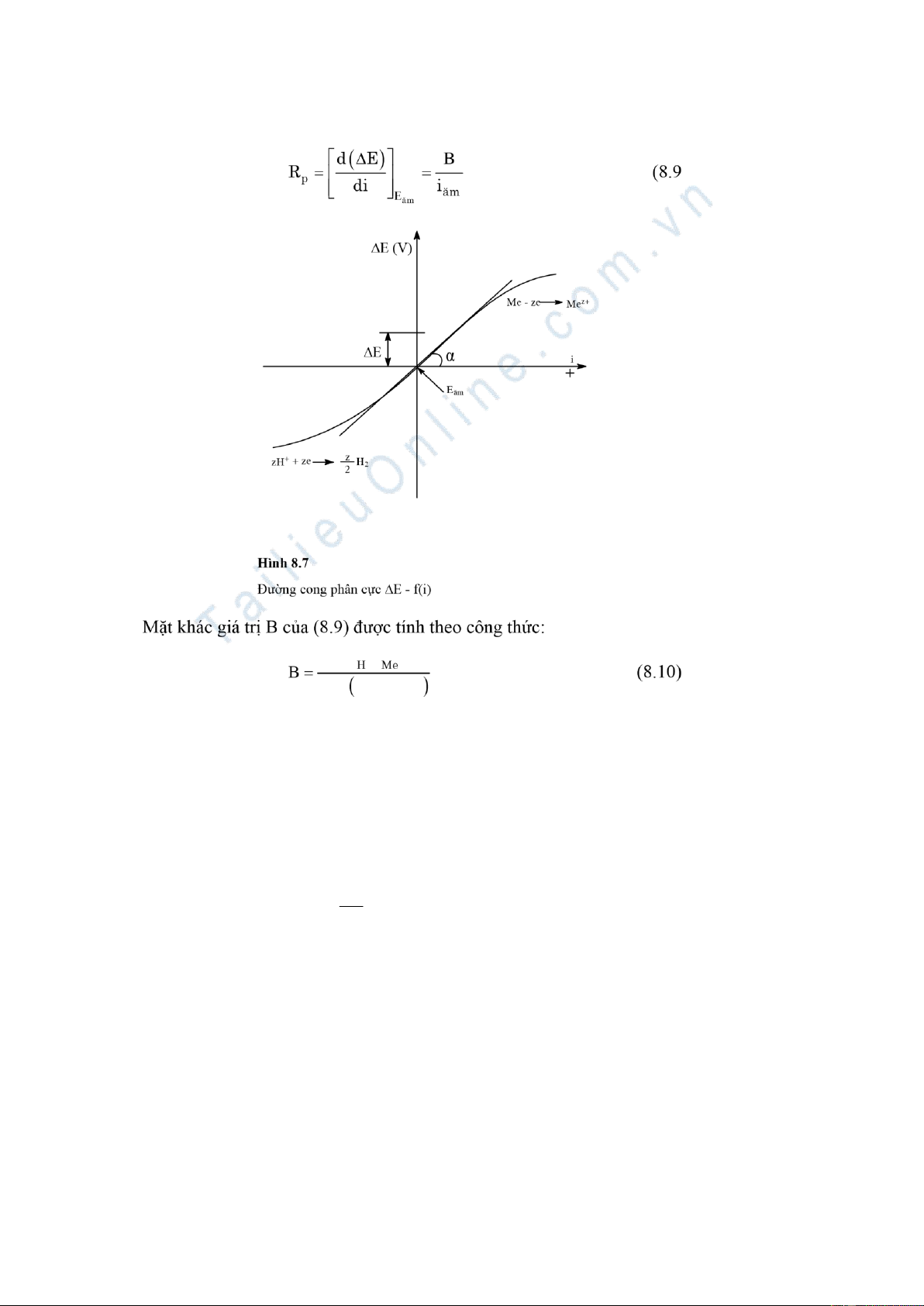
ng phân cực E - f(i) áp dụng cho hệ ĕn mòn có hai ph n ng (xem hình 8.7).
Ph n ng x y ra trên anot, kim lo i Me bị hoà tan: Me – ze → Mez+
(8.7) và trên catot x y ra ph n ng: zH+ + ze → z H2 (8.8) 2
T i kho ng thế phân cực ΔE r t nhỏ so với Eĕm, ΔE = ±10 mV, sự phụ thuộc c a ΔE vào mật
ộ dòng (thí nghiệm với iện cực có diện tích 1 cm2) là tuyến tính: 153 b .b 2,3. b( Η + bΜe
trong ó: bH - là hệ số ộ dốc o n thẳng Tafel ối với quá trình catot thoát khí hi ro thay ổi giá trị từ
0,06 V ÷ ∞; bMe - là hệ số ộ dốc o n thẳng Tafel ối với quá trình anot hoà tan kim lo i thay ổi từ 0,06 ÷ 0,12 V. Từ (8.9) ta có: Β i = ¨m (8.11) Rp
Vậy muốn xác ịnh tốc ộ ĕn mòn kim lo i theo mật ộ dòng ĕn mòn iĕm ta ph i xác ịnh B dựa
trên các giá trị hệ số ộ dốc (xác ịnh bằng thực nghiệm từ hình 8.5) c a các ng Tafel catot và anot
theo (8.10) và xác ịnh Rp - iện tr phân cực.
Xác ịnh Rp theo ồ thị (8.7), Rp chính là tgα. Rp = tgα (8.12) 154
Phơng pháp o Rp tính dòng ĕn mòn iĕm sẽ chính xác nếu Rp >> RΩ (RΩ - iện tr c a dung
dịch). Một cách gần úng ch p nhận giá trị B trong (8.1) bằng 0,026.
Dựa vào giá trị Rp ể ánh giá ộ bền chống ĕn mòn vật liệu.
Ví dụ ối với cốt thép bêtông, nếu Rp < 50 kΩ.cm2 thì nó bắt ầu bị ĕn mòn. Rp < 20 kΩ.cm2
cốt thép bị ĕn mòn nghiêm trọng.




