







Preview text:
PHƯƠNG PHÁP PHÂN TÍCH CÔNG CỤ
PHẦN II: CÁC PHƯƠNG PHÁP PHÂN TÍCH ĐIỆN HÓA
Nguyễn X. Trường – ANACHEM-SCE-HUST-2/1 II.1. Mở đầu
Các phương pháp điện hóa học dựa trên cơ sở:
- Các tính chất, quy luật và các hiện tượng điện hóa
có liên quan đến các phản ứng điện hóa học xảy ra
trên bề mặt hay trên ranh giới tiếp xúc giữa các cực
(điện cực) và dung dịch phân tích.
- Các tính chất điện hóa của dung dịch điện hóa giữa
các cực trong bình phản ứng (bình điện hóa).
Phương pháp phân tích điện hóa có các trang bị cơ sở:
- Bình chứa dung dịch chất nghiên cứu và chất điện ly (bình điện hóa). - Các điện cực
- Máy đo (thế, dòng, điện trở).
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/2
II.2. Phân loại các phương pháp phân tích điện hóa
2.2.1. Nhóm phương pháp điện hóa dựa trên quá trình điện cực
- Các phương pháp điện hóa có phản ứng điện hóa ở
điện cực trong điều kiện dòng không đổi (thường là
bằng 0): đo thế, chuẩn độ đo thế, …
- Các phương pháp điện hóa có phản ứng điện hóa ở
điện cực trong điều kiện dòng khác 0: điện phân, ...
2.2.2. Nhóm phương pháp điện hóa không có phản ứng
điện cực: đo độ dẫn, đo điện trở…
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/3
II.2. Phân loại các phương pháp phân tích điện hóa Phương pháp
Đại lượng quan hệ Đại lượng Đại lượng đo kiểm soát Phương pháp dòng E, C C E = f(C)
bằng 0 và có phản ứng điện cực Đo thế Chuẩn độ đo thế Phương pháp dòng khác 0 và có phản ứng điện cực Điện lượng (E = const) E, I, m E m Điện lượng (I = const) E, I, C I Q
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/4
II.2. Phân loại các phương pháp phân tích điện hóa Phương pháp
Đại lượng quan hệ Đại lượng kiểm Đại lượng đo soát Phương pháp dòng khác 0 và có phản ứng điện cực Von-ampe E, I, C C I = f(E) Chuẩn độ ampe E, I, C E I = f(C) Cực phổ cổ điển Cực phổ dòng xoay chiều Cực phổ xung thường
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/5
II.2. Phân loại các phương pháp phân tích điện hóa Phương pháp
Đại lượng quan hệ Đại lượng kiểm Đại lượng đo soát Phương pháp dòng khác 0 và có phản ứng điện cực Cực phổ xung vi phân Cực phổ sóng vuông Von-ampe hòa tan Phương pháp không phản ứng điện cực Đo độ dẫn và chuẩn độ đo độ dẫn Đo độ dẫn cao tần và chuẩn độ cao tần
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/6
PHƯƠNG PHÁP PHÂN TÍCH CÔNG CỤ
PHẦN II: CÁC PHƯƠNG PHÁP PHÂN TÍCH ĐIỆN HÓA
Chương 5: Phương pháp đo thế (Potentiometry)
Nguyễn X. Trường – ANACHEM-SCE-HUST-2/7
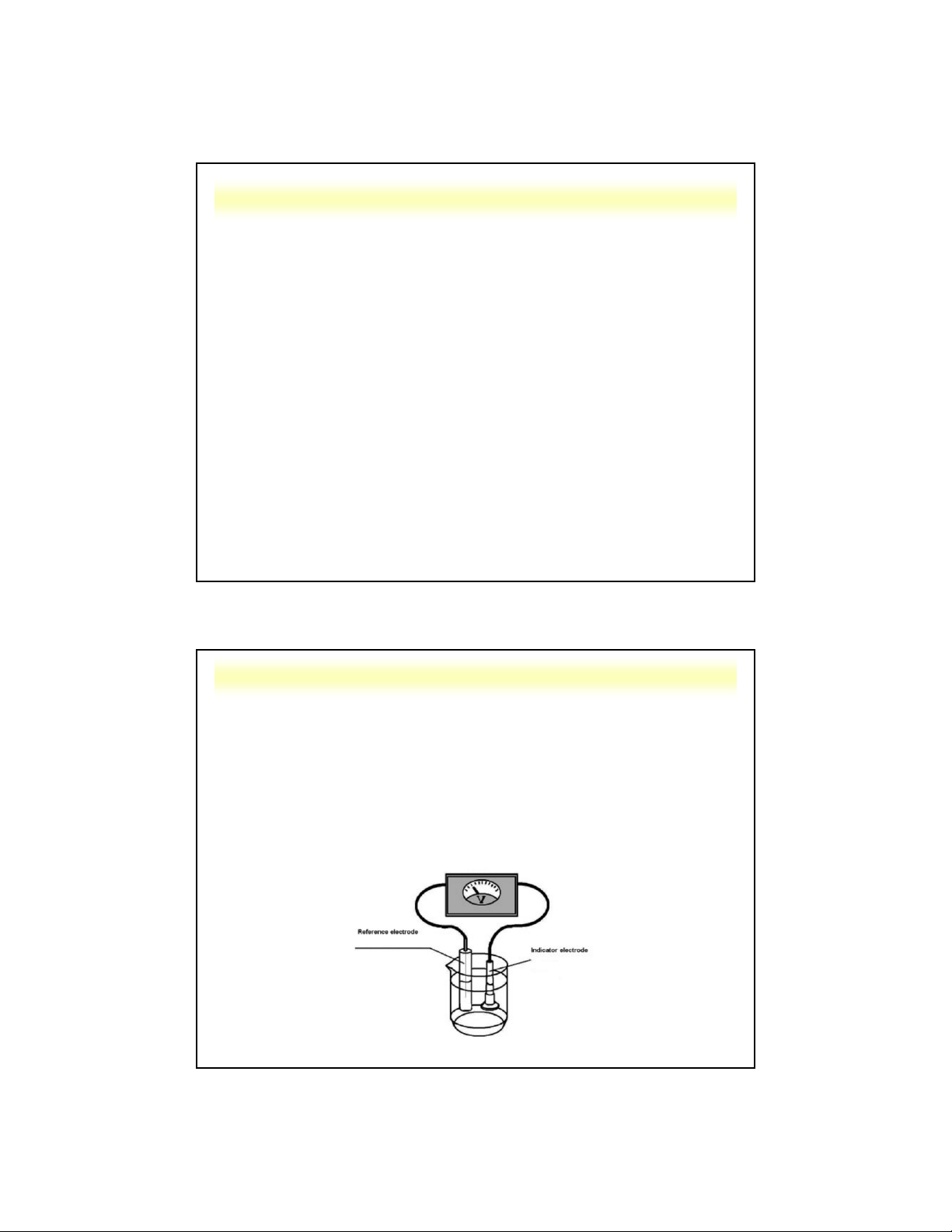
5.1. Nguyên tắc của phép đo thế Nguyên tắc:
1. Quá trình đo thế được thực hiện trong 1 bình đo (cell) có
chứa dung dịch mẫu và 2 điện cực, trong đó:
- 1 điện cực so sánh có thế không đổi (E = const) ss
- 1 điện cực chỉ thị biểu thị thế của dung dịch (E ) ind
2. Hệ điện cực được nối với một máy đo thế (potentiometer).
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/8
5.1. Nguyên tắc của phép đo thế Nguyên tắc:
3. Thế đo được của dung dịch là hiệu số của thế ở điện cực chỉ thị (E
) và điện cực so sánh (E ): ind ss E = E – E dd ind ss E = const E ~ E ss dd ind
Như vậy, đo thế là quá trình theo dõi sự biến thiên nồng độ của
một chất (ion) trong dung dịch nhờ điện cực chỉ thị mà trên đó
xảy ra các quá trình điện hóa.
Trong phương pháp đo thế, điện cực so sánh thường dùng là:
- Điện cực calomen (SCE).
- Điện cực bạc-bạc clorua (SSCE).
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/9
5.1. Nguyên tắc của phép đo thế
Điện cực chỉ thị có 3 loại khác nhau:
a. Điện cực đo pH: điện cực thủy tinh màng
b. Điện cực chọn lọc ion: điện cực chế tạo đo riêng
từng ion kim loại (K+, Cd2+, ...) và từng loại anion (F-, Cl-, I , ...) -
Hai loại điện cực chỉ thị trên là các loại điện cực màng
(rắn hoặc lỏng). Các quá trình điện hóa xảy ra trên bề
mặt tiếp xúc của màng này.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/10
5.1. Nguyên tắc của phép đo thế
c. Điện cực kim loại trơ (Ag, Pt, …): các quá trình điện
hóa xảy ra trên bề mặt điện cực. Chất phân tích có thể:
- Nhận điện tử ở điện cực (quá trình khử - catot)
- Nhường điện tử cho điện cực (quá trình oxi hóa - anot)
Bề mặt của điện cực có ảnh hưởng nên điện cực phải sạch và đồng nhất.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/11
5.2. Phương trình thế điện cực
• Nếu trên bề mặt điện cực xảy ra quá trình oxi hóa khử: Ox + ne ⇋ Kh
• Phương trình mô tả mối quan hệ giữa thế điện cực và hoạt độ (nồng
độ) các cấu tử của một hệ oxi hóa khử - phương trình Nernst như sau: RT aox E E ln 0 nF akh Trong đó,
E là thế oxi hóa khử tiêu chuẩn của hệ; 0
R là hằng số khí lý tưởng; T nhiệt độ Kenvin F hằng số Faraday;
n số electron trao đổi trong hệ điện hóa a , a
là hoạt độ của các cấu tử oxi hóa và khử. ox kh
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/12
5.2. Phương trình thế điện cực
• Ở 25oC và với các dung dịch loãng, phương trình Nernst có dạng: , 0 059 [Ox] E E lg 0 n [Kh] Trong đó,
[ox], [kh] là nồng độ của các cấu tử oxi hóa và khử.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/13
5.3. Các loại điện cực
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/14
5.3. Các loại điện cực
5.3.1. Điện cực so sánh a. Điện cực hydro
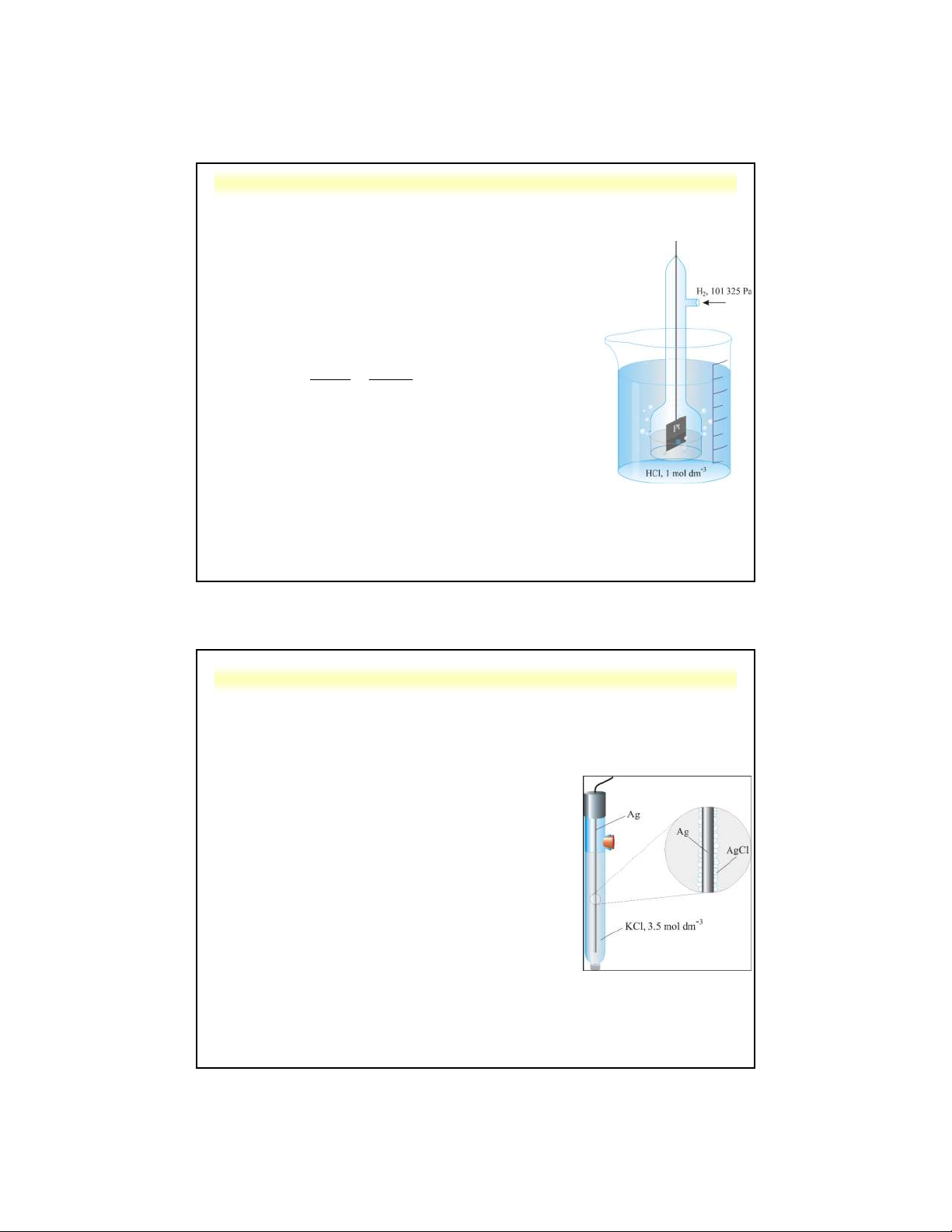
• Nguyên tắc: H hấp phụ trên bản Pt nhúng 2 trong dung dịch HCl 1M • Pt,H HCl 2 • 2H+(aq) + 2e ⇋ H (g) 2 2 0 , 0 59 [H ] 0 E E lg • Cấu tạo: 2 PH2
- 1 chuông thủy tinh gắn bản Pt, có dây dẫn nối với máy đo thế.
- 1 đường dẫn khí H vào chuông (PH = 1atm) 2 2
- Cả hệ thống nhúng trong dung dịch axit có [H+] = 1M
Ở 25oC, E = E0 = 0,000 V (quy ước)
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/15
5.3. Các loại điện cực
5.3.1. Điện cực so sánh
b. Điện cực bạc – bạc clorua (SSCE)
• Cấu tạo: Dây kim loại Ag phủ AgCl
trong dung dịch chất điện ly KCl • AgAgCl, KCl
• AgCl(s) + 1e ⇋ Ag(s) + Cl- E = E0 + 0,059lg(1/[Cl-])
• Thế điện cực phụ thuộc vào [Cl-]
Ở 25oC, với dung dịch KCl bão hòa thì E = 0,197 V
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/16
5.3. Các loại điện cực
5.3.1. Điện cực so sánh
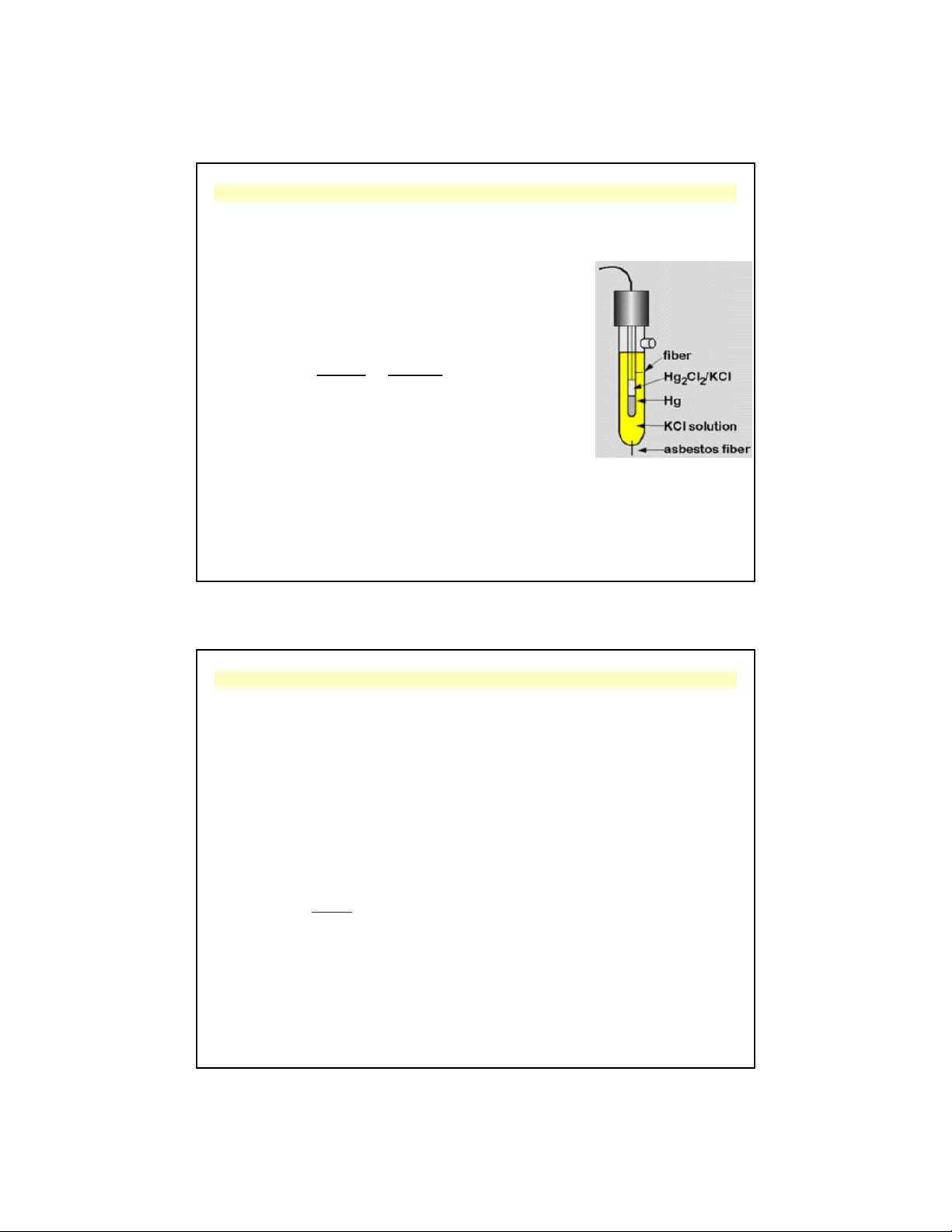
c. Điện cực calomen (SCE)
• Cấu tạo: HgHg Cl , KCl 2 2
• Hg Cl (s) + 2e ⇋ Hg(l) + 2Cl- 2 2 , 0 059 1 0 E E lg 2 2 [Cl ]
• Thế điện cực phụ thuộc vào [Cl-]
Ở 25oC, với dung dịch KCl bão hòa thì E = 0,244 V
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/17
5.3. Các loại điện cực
5.3.2. Điện cực chỉ thị
a. Điện cực kim loại loại 1
• Cấu tạo: kim loại nhúng trong dung dịch muối tan của nó • MMn+ • Mn+(aq) + ne ⇋ M(s) 0 059 , 0 E E lg[ n M ] n
• Dùng để theo dõi hay xác định nồng độ
của các ion kim loại trong dung dịch.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/18
5.3. Các loại điện cực
5.3.2. Điện cực chỉ thị
b. Điện cực kim loại loại 2
• Cấu tạo: kim loại nhúng trong dung
dịch muối khó tan của nó • MM A, An- n • M A(s) + ne ⇋ M(s) + An- n 0 059 , 0 1 E E lg n [ n A ]
• Dùng để nghiên cứu xác định các
anion tạo hợp chất khó tan hay phức bền với kim loại.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/19
5.3. Các loại điện cực
5.3.2. Điện cực chỉ thị
c. Điện cực oxi hóa khử
• Cấu tạo: kim loại trơ (Pt, Ag,…) nhúng
trong dung dịch hệ oxi hóa khử • PtOx, Kh • Ox(l) + ne ⇋ Kh(l) Ox 0 05 , 0 9 [ ] E E lg n [Kh]
• Dùng trong chuẩn độ oxi hóa khử chuẩn độ ampe.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/20
5.3. Các loại điện cực
5.3.2. Điện cực chỉ thị d. Điện cực màng -
Là loại điện cực chỉ thị pH và các điện cực chọn lọc ion -
Quá trình điện hóa xảy ra ở trên màng của điện cực
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/21
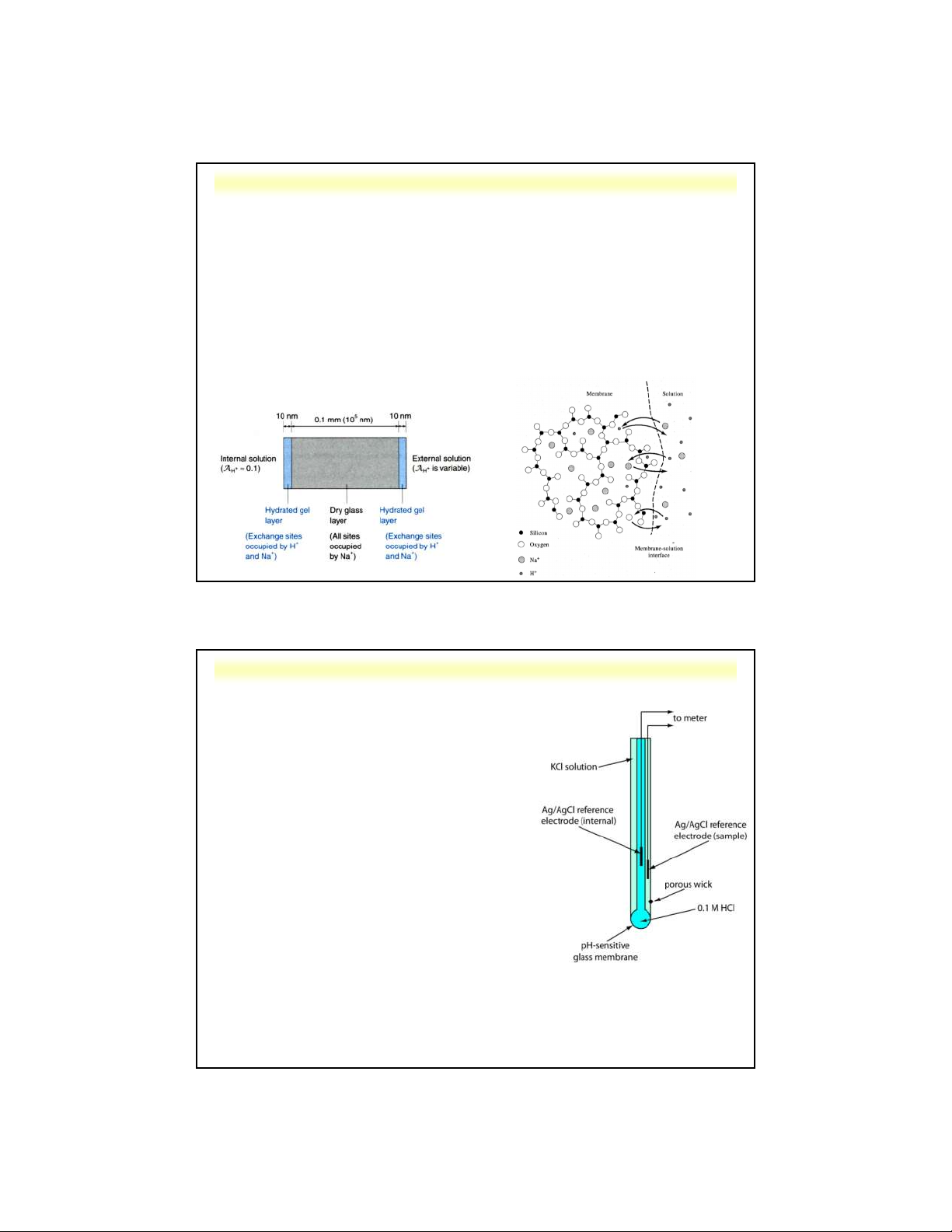
5.3. Các loại điện cực d. Điện cực màng
d . Điện cực thủy tinh 1 Cấu tạo:
Màng thủy tinh mỏng có thành
phần đặc biệt và lớp gel trên cả 2 bề mặt.
Tùy vào nơi sản xuất, thường là 22% Na O, 6% CaO, 72% 2
SiO (điện cực này có thể đáp 2 ứng đến pH 9).
Trong màng thủy tinh, cation
Na+ có thể di chuyển qua màng để dẫn điện.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/22
5.3. Các loại điện cực
d. Điện cực màng – điện cực chọn lọc ion ISE
d . Điện cực thủy tinh 1
H O+ ngoài (a )màng thủy tinhH O+ trong (a ) 3 1 3 2
H+(dd) + Na+ (màng tt) ⇋ Na+(dd) + H+ (màng tt)
Điện cực thủy tinh đáp ứng chọn lọc với do ion H+ là ion duy nhất liên
kết được lên lớp gel bị hydrat hóa.
Nghiên cứu với đồng vị 3H cho thấy rằng ion H+ không đi qua lớp màng
thủy tinh, còn ion Na+ có thể đi qua.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/23
5.3. Các loại điện cực d. Điện cực màng
d . Điện cực thủy tinh 1
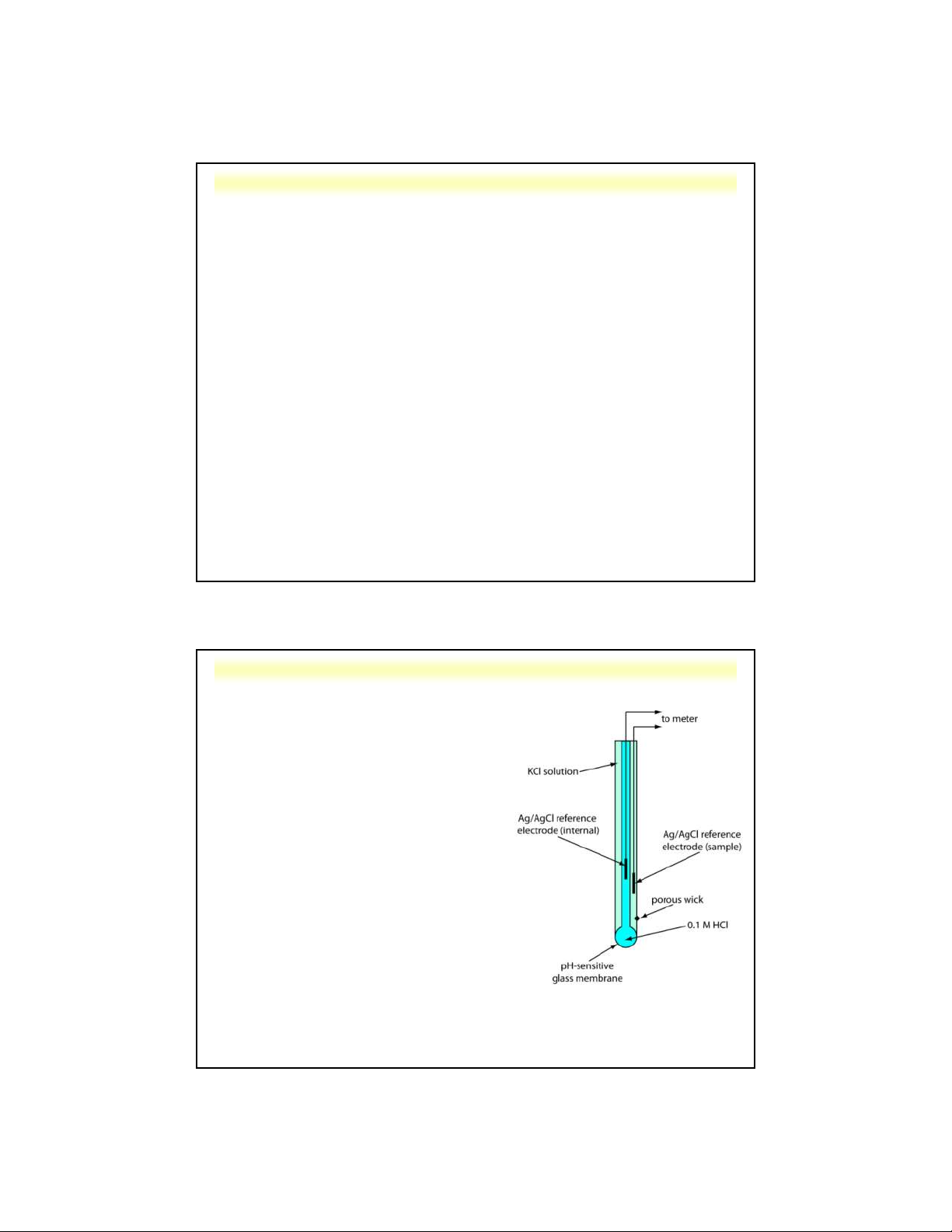
Điện cực thủy tinh đo pH:
Là điện cực thủy tinh có thêm 2 điện cực
so sánh bạc-bạc clorua (trong và ngoài)
SSCE H O+ ngoài (a ) màng thủy 3 1
tinh H O+ trong (a )SSCE 3 2
Khi cân bằng trao đổi ion được thiết lập,
sự khác nhau về thế do sự tích điện ở 2
bên lớp màng tạo nên giá trị thế Em • E = 0,059lg(a /a ) m 1 2
a , a là hoạt độ của ion H+ trong dung 1 2
dịch đo và trong bầu thủy tinh. • E = L - 0,059pH m
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/24 L là hệ số màng
5.3. Các loại điện cực d. Điện cực màng
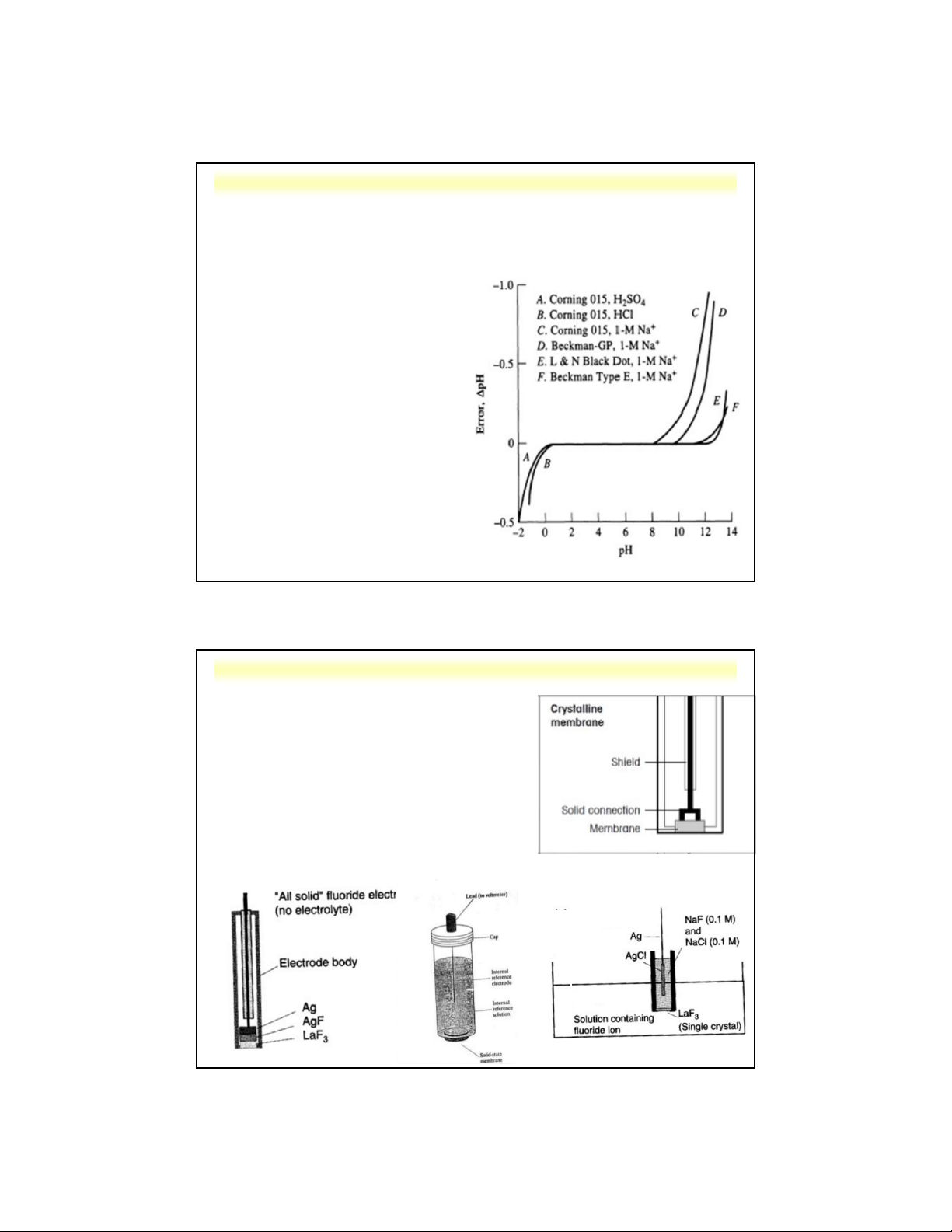
d . Điện cực thủy tinh 1
Điện cực thủy tinh đo pH:
• Sai số axit: khi đo ở pH < 0,5
• Sai số kiềm: khi đo ở pH > 9
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/25
5.3. Các loại điện cực d. Điện cực màng
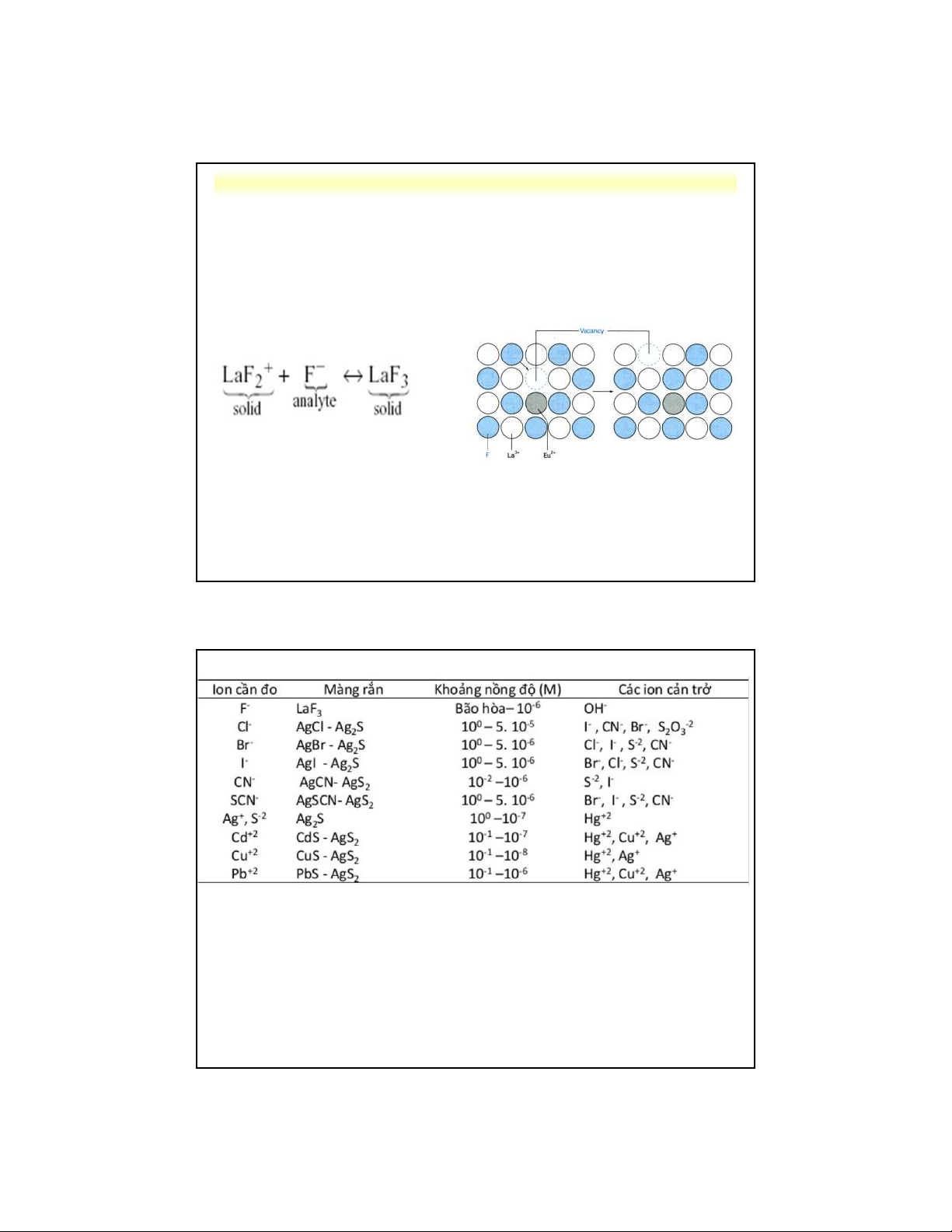
d . Điện cực màng rắn 2
Cấu tạo: màng rắn dẫn điện có chứa các
ion có khả năng cố định những ion cần đo.
Thường dùng: LaF , Ag S, AgSCN, AgI, 3 2
… có cấu trúc đơn tinh thể, đa tinh thể hay hỗn hợp.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/26
5.3. Các loại điện cực d. Điện cực màng
d . Điện cực màng rắn 2
Ví dụ: điện cực đo F-, màng rắn được tạo bởi tinh thể LaF pha tạp 3 Eu2+ • E = L + 0,059log(1/[F-]) m = L – 0,059pF
F- migrates across crystal by “jumping”
into crystal vacancies caused by Eu2+
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/27
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/28
5.3. Các loại điện cực d. Điện cực màng
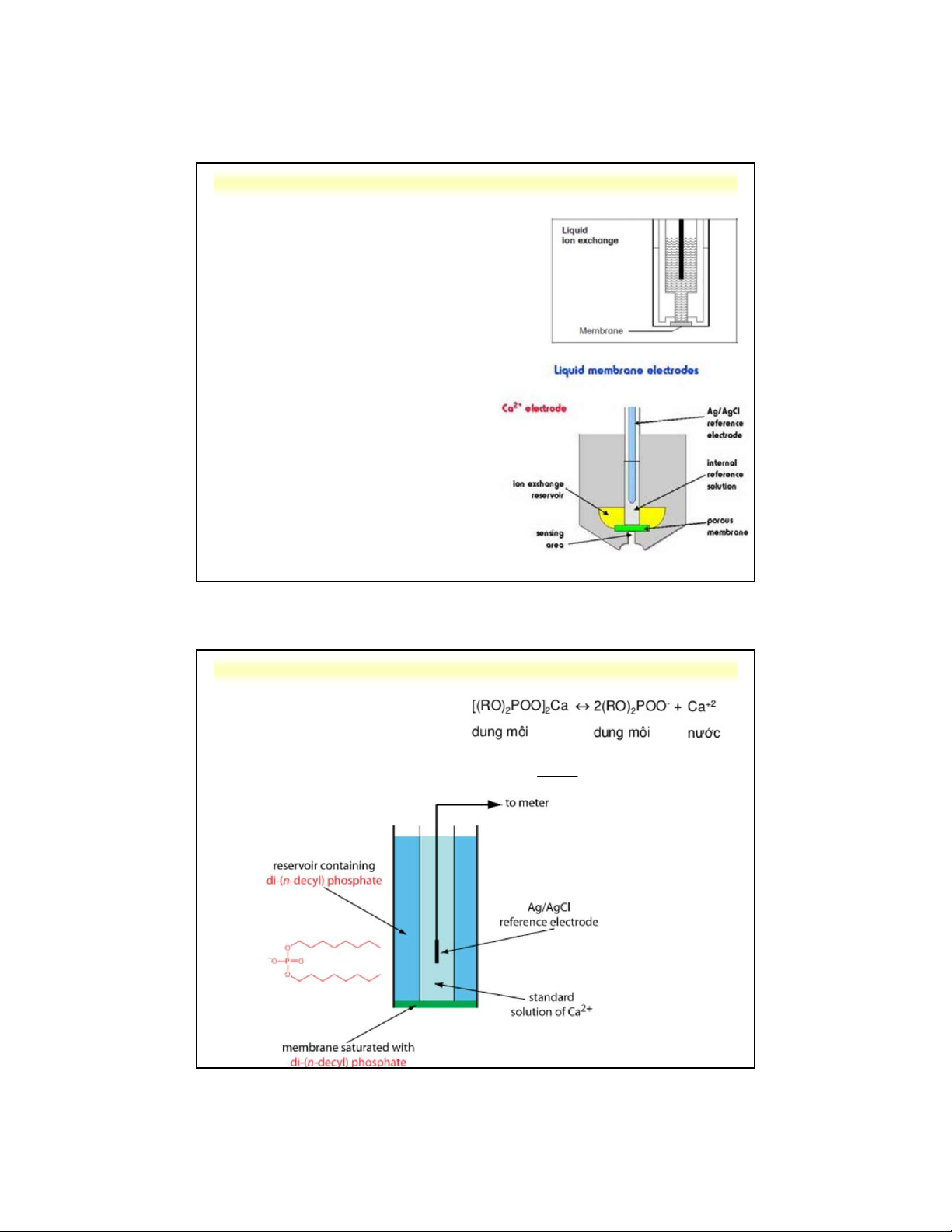
d . Điện cực màng lỏng 3 Cấu tạo:
- Màng trao đổi ion liên kết chọn
lọc với ion cần thiết (lớp chất
lỏng hữu cơ không tan trong nước)
- Màng chất dẻo giữ chất trao đổi
ion đựng giữa 2 thành ống
- Điện cực so sánh nhúng trong
dung dịch chứa ion chọn lọc (ví dụ Ca2+ dùng CaCl ) 2
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/29
5.3. Các loại điện cực d. Điện cực màng
d . Điện cực màng lỏng 3 Cân bằng qua màng: 059 , 0 E L lg[ 2 Ca ] m 2
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/30
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/31
5.3. Các loại điện cực d. Điện cực màng
d . Điện cực màng thẩm thấu khí 4 Nguyên tắc:
- Các chất khí hòa tan trong mẫu
thử khuyếch tán qua màng tạo
cân bằng với dung dịch bên
trong điện cực để tham gia phản ứng tạo thành ion.
- Các ion sau đó được phát hiện
bởi 1 điện cực chọn lọc ion bên trong điện cực màng khí
- Xuất hiện sự khác biệt về điện
thế giữa điện cực chọn lọc ion
và điện cực so sánh nội.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/32
5.3. Các loại điện cực d. Điện cực màng d . Điện cực màng 4 thẩm thấu khí Nguyên tắc: - Các chất khí hòa tan trong mẫu thử khuyếch tán qua màng tạo cân bằng với dung dịch bên trong điện cực để tham gia phản ứng tạo thành ion.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/33
5.3. Các loại điện cực d. Điện cực màng d . Điện cực màng 4 thẩm thấu khí
Ví dụ: điện cực màng thẩm thấu khí CO2
- Dung dịch trong điện cực là HCO -/H+ 3 - HCO - + H+ ⇋ 3 H CO ⇋ H O + 2 3 2 CO (g) 2 [CO ] [H ] 2 K K '[CO ] a [HCO ] 2 3 E L 059 , 0 lg[CO ] m 2
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/34
5.3. Các loại điện cực d. Điện cực màng
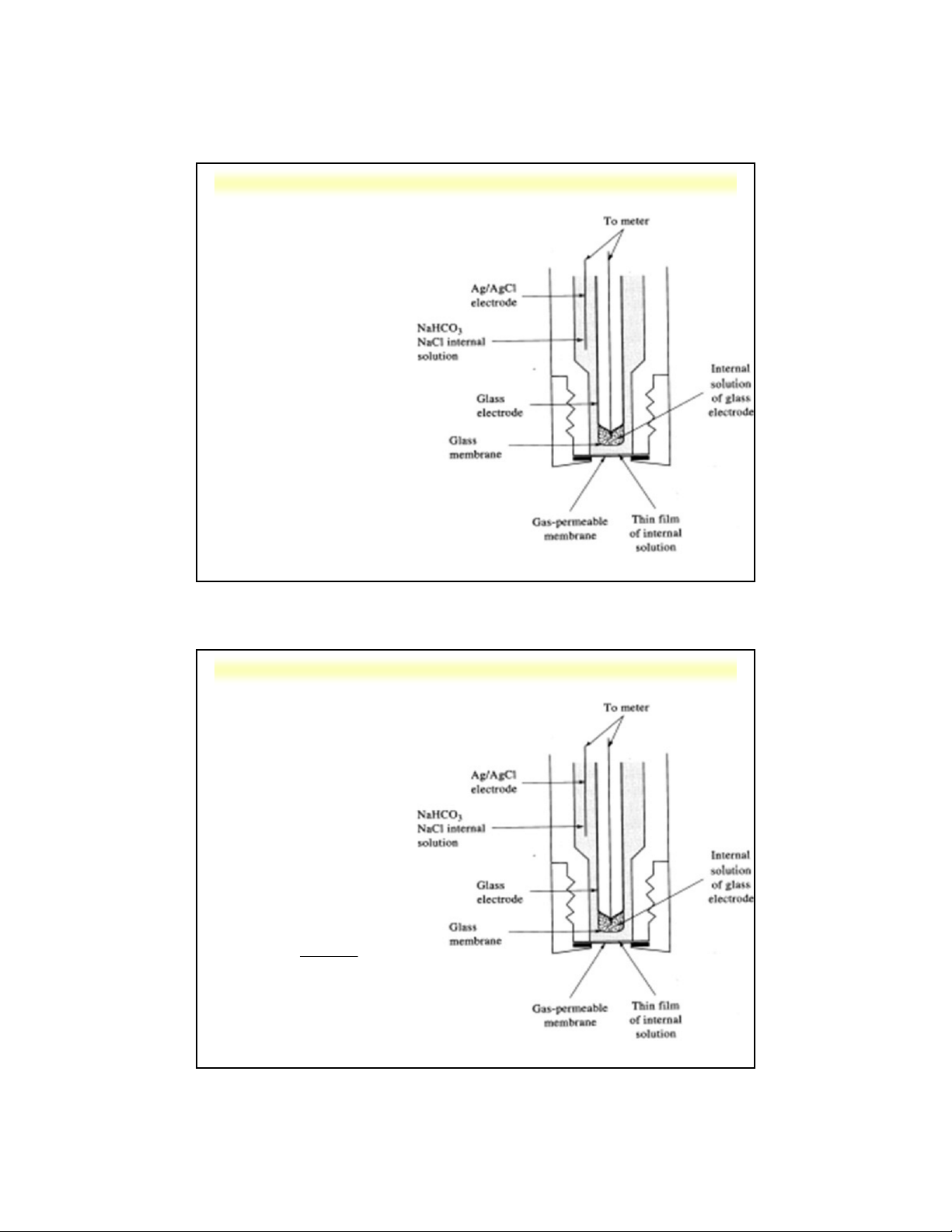
d . Điện cực màng xúc tác sinh học 5 Nguyên tắc:
- Các chất xúc tác sinh học cố định hay
không hòa tan được gắn trên bề mặt tiếp
xúc của điện cực chọn lọc ion dùng để
xác định sự giảm chất phản ứng hoặc sự
tang sản phẩm trong phản ứng sinh hóa.
- Các chất xúc tác sinh học: + enzyme đã phân lập + tế bào vi khuẩn, …
Cấu tạo: giống điện cực màng thẩm thấu khí
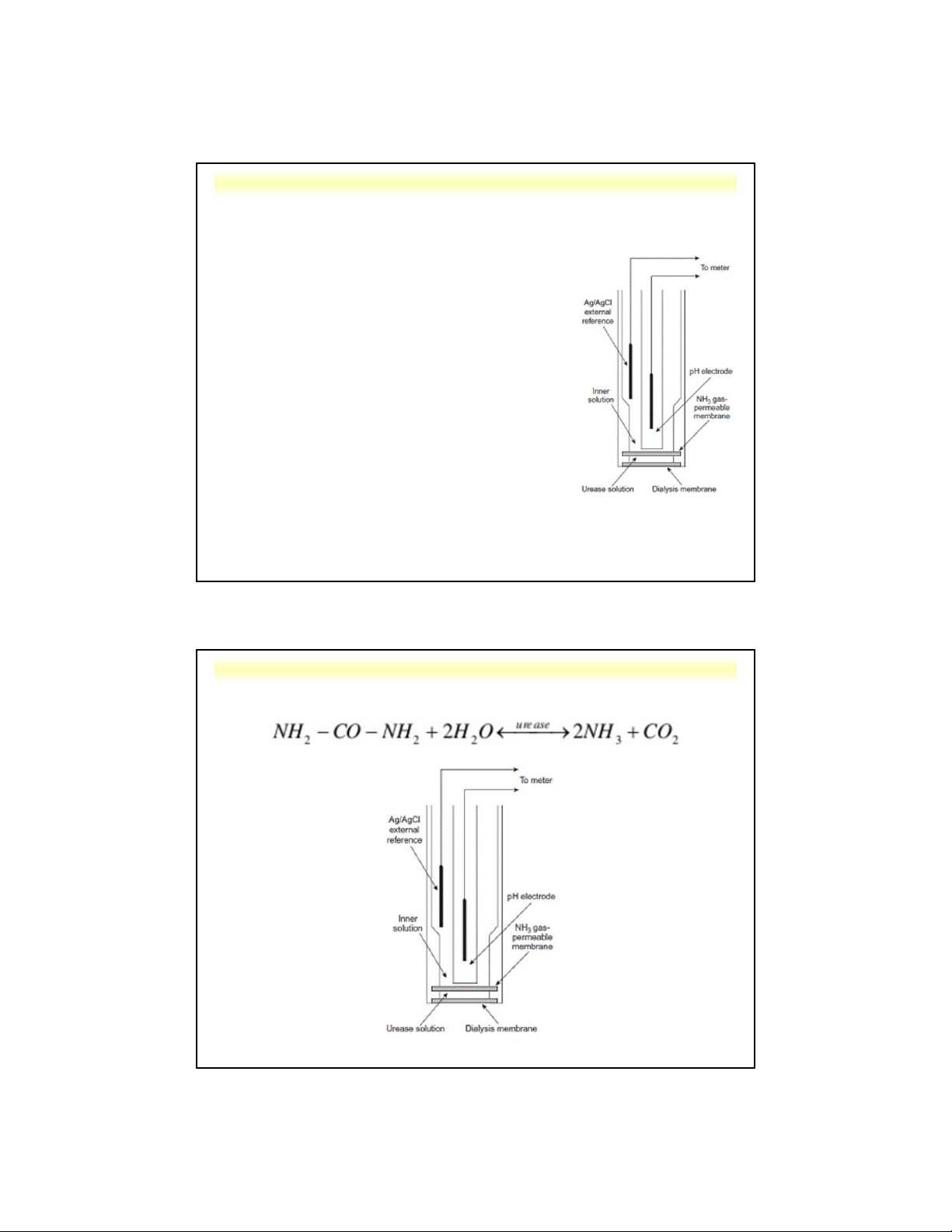
Ví dụ: điện cực đo ure
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/35
5.3. Các loại điện cực
Ví dụ: điện cực đo ure
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/36
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/37
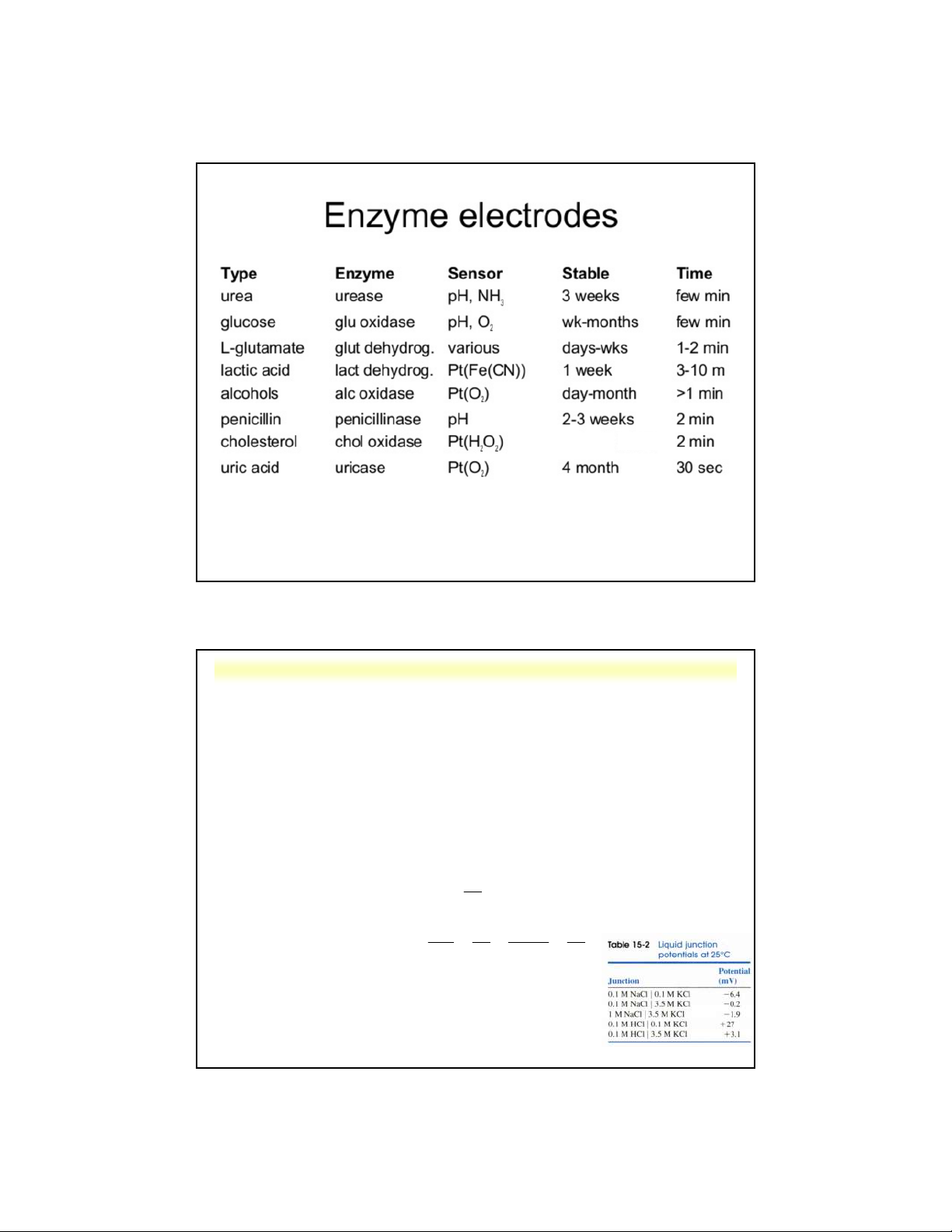
5.4. Thế tiếp xúc lỏng – thế khuyếch tán
- Xuất hiện ở bề mặt ngăn cách giữa 2 dung dịch chất điện ly
khác nhau hoặc 2 dung dịch chất điện ly có nồng độ khác nhau.
- Các ion khác nhau có tốc độ di chuyển khác nhau qua ranh
giới ngăn cách nên tại một thời điểm mật độ ion dọc theo bề
mặt ngăn cách là khác nhau.
- Ion di chuyển từ vùng có hoạt độ a tới vùng có hoạt độ a 1 2 thì: a1 G RT ln nFE a j 2 RT a 059 , 0 a 1 1 E ln lg j z. f a z a 2 2
trong đó, E là thế tiếp xúc và z là điện tích ion j
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/38
5.5. Phương pháp phân tích đo thế Nguyên tắc:
Thiết lập mạch đo (pin Galvani) gồm 2 điện cực (1 điện cực
so sánh và một điện cực chỉ thị) nhúng trong dung dịch chứa chất phân tích.
Quy ước cách viết mạch điện hóa như sau:
- Anot và các thông số liên quan viết bên trái cầu muối.
Anot xảy ra quá trình oxi hóa.
- Catot và các thông số liên quan viết bên phải cầu muối.
Quá trình khử xảy ra ở catot.
- Ranh giới hai pha mà ở đó xuất hiện thế được ký hiệu bằng hay /.
- Cầu muối được ký hiệu bằng hay //.
Ví dụ: (-) ZnZnSO CuSO Cu (+) 4 4
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/39
5.5. Phương pháp phân tích đo thế
5.5.1. Phương pháp điện thế trực tiếp
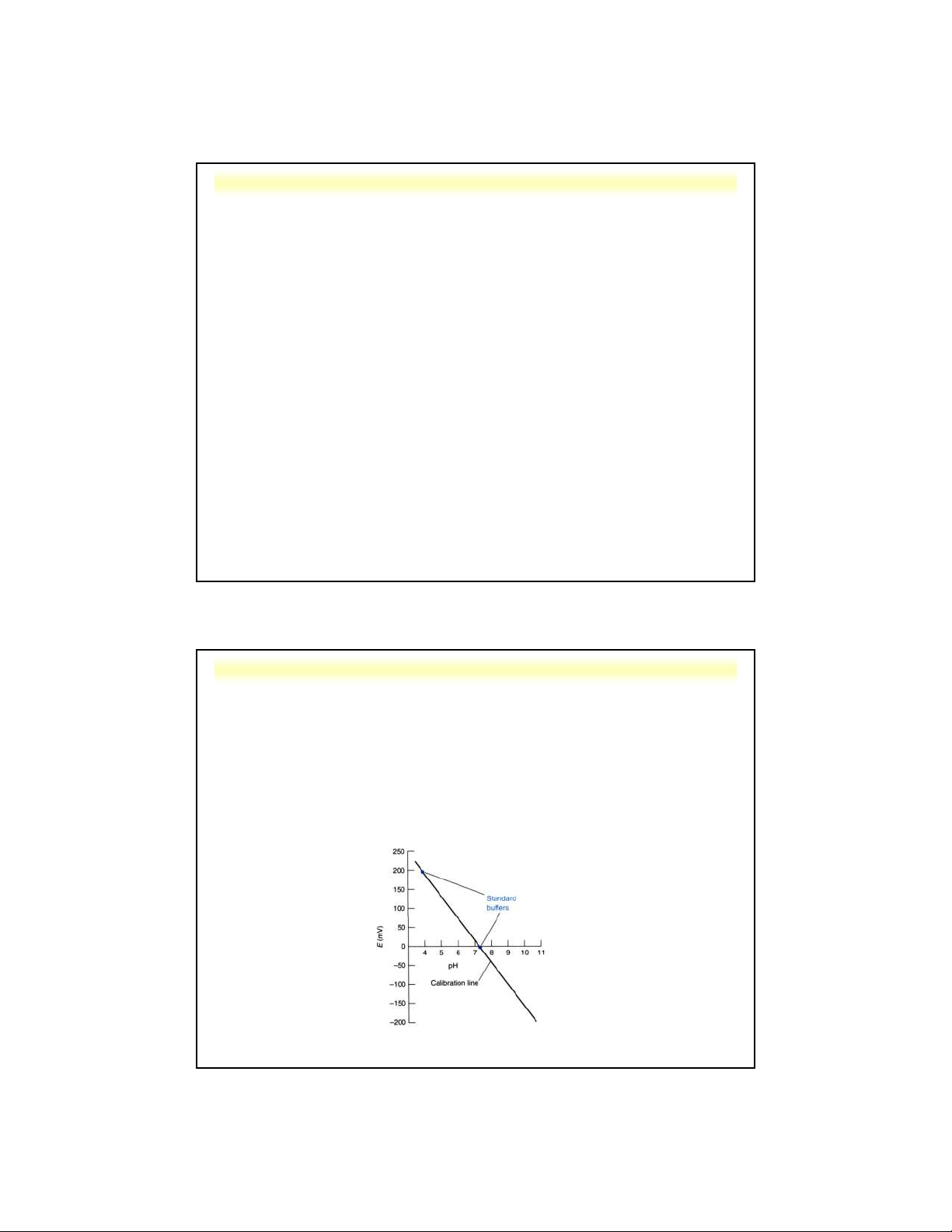
Điện cực so sánh có thể tách rời hoặc tổ hợp với điện cực chỉ thị. - Đo pH
Lưu ý: Trước khi sử dụng máy đo pH cần chuẩn hóa điện cực thủy
tinh đo pH với các dung dịch chuẩn pH thích hợp.
- Đo thế dựa vào các loại điện cực chọn lọc ion
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/40




