



Preview text:
Cách nhận biết các chất hóa học lớp 11
A. NHẬN BIẾT ION DƯƠNG (CATION) Ion Thuốc thử Hiện tượng Phản ứng Li+ Ngọn lửa màu đỏ thẫm Na+ Ngọn lửa màu vàng tươi K+ Đốt Ngọn lửa màu tím hồng trên ngọn lửa Ca2+ Ngọn lửa màu đỏ da vô sắc cam Ba2+ Ngọn lửa màu lục (hơi vàng) dd 2 SO , Ca Ca2+ + 2 2+ 4 SO CaSO CO 4 4 ;Ca2+ + 2 3 dd trắng 2 CO 3 CaCO3 dd 2 SO , 4 Ba2+ + 2 SO BaSO CO 4 4 ;Ba2+ + 2 3 Ba2+ dd 2 CO 3 trắng BaCO3 Na2CrO4 Ba2+ + 2 CrO BaCrO 4 4 HCl, HBr, HI AgCl trắng Ag+ + Cl AgCl Ag+ NaCl, NaBr, AgBr vàng nhạt Ag+ + Br AgBr NaI AgI vàng đậm Ag+ + I AgI Pb2+ PbI dd KI 2 vàng Pb2+ + 2I PbI2 Hg2+ HgI2 đỏ Hg2+ + 2I HgI2 Pb2+ Pb2+ + S2 PbS Hg2+ HgS đỏ Hg2+ + S2 HgS Fe2+ FeS đen Fe2+ + S2 FeS Na2S, H2S Cu2+ CuS đen Cu2+ + S2 CuS Cd2+ CdS vàng Cd2+ + S2 CdS Ni2+ NiS đen Ni2+ + S2 NiS Mn2+ MnS hồng nhạt Mn2+ + S2 MnS Zn2+
xanh, tan trong dd Cu(OH)2 + 4NH3 NH3 dư [Cu(NH3)4](OH)2 Cu2+ dd NH
trắng, tan trong dd Zn(OH)2 + 4NH3 3 NH3 dư [Cu(NH3)4](OH)2 Ag+
trắng, tan trong dd AgOH + 2NH3 NH3 dư [Cu(NH3)2]OH Mg2+ trắng Mg2+ + 2OH Mn(OH)2 Fe2+ + 2OH Fe(OH)2 Fe2+ trắng,
hóa nâu ngoài không khí 2Fe(OH)2 + O2 + 2H2O 2Fe(OH)3 Fe3+ nâu đỏ Fe3+ + 3OH Fe(OH)3 Al3+ + 3OH Al(OH)3 Al 3+ keo trắng tan trong kiềm dư
Al(OH)3 + OH AlO + 2H 2 2O Zn2+ + 2OH Zn(OH)2 Zn2+ dd Kiềm Zn(OH)2 + 2OH 2 ZnO + 2H 2 2O Be2+ + 2OH Be(OH) trắng 2 Be2+ tan trong kiềm dư Be(OH)2 + 2OH 2 BeO + 2H 2 2O Pb2+ + 2OH Pb(OH)2 Pb2+ Pb(OH)2 + 2OH 2 PbO + 2H 2 2O Cr3+ + 3OH Cr(OH)3 Cr3+ xám, tan trong kiềm dư Cr(OH)3 + 3OH 3 Cr(OH) 6 Cu2+ xanh Cu2+ + 2OH Cu(OH)2 NH + NH NH + OH NH 4 3 4 3 + H2O
B. NHẬN BIẾT ION DƯƠNG (CATION) Ion Thuốc thử Hiện tượng Phản ứng Li+ Ngọn lửa màu đỏ thẫm Na+ Ngọn lửa màu vàng tươi K+ Đốt Ngọn lửa màu tím hồng trên ngọn lửa Ca2+ Ngọn lửa màu đỏ da vô sắc cam Ba2+ Ngọn lửa màu lục (hơi vàng) dd 2 SO , Ca Ca2+ + 2 2+ 4 SO CaSO CO 4 4 ;Ca2+ + 2 3 dd trắng 2 CO 3 CaCO3 dd 2 SO , 4 Ba2+ + 2 SO BaSO CO 4 4 ;Ba2+ + 2 3 Ba2+ dd 2 CO 3 trắng BaCO3 Na2CrO4 Ba2+ + 2 CrO BaCrO 4 4 HCl, HBr, HI AgCl trắng Ag+ + Cl AgCl Ag+ NaCl, NaBr, AgBr vàng nhạt Ag+ + Br AgBr NaI AgI vàng đậm Ag+ + I AgI Pb2+ PbI dd KI 2 vàng Pb2+ + 2I PbI2 Hg2+ HgI2 đỏ Hg2+ + 2I HgI2 Pb2+ PbS đen Pb2+ + S2 PbS Hg2+ HgS đỏ Hg2+ + S2 HgS Fe2+ FeS đen Fe2+ + S2 FeS Na2S, H2S Cu2+ CuS đen Cu2+ + S2 CuS Cd2+ CdS vàng Cd2+ + S2 CdS Ni2+ NiS đen Ni2+ + S2 NiS Mn2+ MnS hồng nhạt Mn2+ + S2 MnS Zn2+
xanh, tan trong dd Cu(OH)2 + 4NH3 NH3 dư [Cu(NH3)4](OH)2 Cu2+ dd NH
trắng, tan trong dd Zn(OH)2 + 4NH3 3 NH3 dư [Zn(NH3)4](OH)2 Ag+
trắng, tan trong dd AgOH + 2NH3 NH3 dư [Ag(NH3)2]OH Mg2+ trắng Mg2+ + 2OH Mn(OH)2 Fe2+ + 2OH Fe(OH)2 Fe2+ trắng,
hóa nâu ngoài không khí 2Fe(OH)2 + O2 + 2H2O 2Fe(OH)3 dd Kiềm Fe3+ nâu đỏ Fe3+ + 3OH Fe(OH)3 Al3+ + 3OH Al(OH)3 Al 3+ keo trắng tan trong kiềm dư
Al(OH)3 + OH AlO + 2H 2 2O Zn2+ trắng Zn2+ + 2OH Zn(OH)2 tan trong kiềm dư Zn(OH)2 + 2OH 2 ZnO + 2H 2 2O Be2+ + 2OH Be(OH)2 Be2+ Be(OH)2 + 2OH 2 BeO + 2H 2 2O Pb2+ + 2OH Pb(OH)2 Pb2+ Pb(OH)2 + 2OH 2 PbO + 2H 2 2O Cr3+ + 3OH Cr(OH)3 Cr3+ xám, tan trong kiềm dư Cr(OH)3 + 3OH 3 Cr(OH) 6 Cu2+ xanh Cu2+ + 2OH Cu(OH)2 NH + NH NH + OH NH 4 3 4 3 + H2O
C. NHẬN BIẾT CÁC CHẤT TRONG NHÓM NITO STT Chất cần Thuốc thử
Hiện tượng xảy ra và phản ứng nhận biết 1 NH3 (khí) Quỳ tím ẩm Quỳ tím ẩm hoá xanh 2. NH4+ Dung
dịch Giải phóng khí có mùi khai: kiềm (có hơ nhẹ) NH4+ + OH- → NH3↑ + H2O 3. HNO3 Cu
Dung dịch hoá xanh, giải phóng khí không màu
và hoá nâu trong không khí:
3Cu + 8HNO3 → Cu(NO3)2 + 2NO + 4H2O 2NO + O2 → 2NO2 4. NO3- H2SO4, Cu
Dung dịch hoá xanh, giải phóng khí không màu
và hoá nâu trong không khí:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO↑+ 4H2O 2NO + O2 → 2NO2↑ 5. PO43- Dung
dịch Tạo kết tủa màu vàng AgNO3 3Ag+ + PO43- → Ag3PO4↓ Bài tập vận dụng
Câu 1: Chỉ dùng một chất khác để nhận biết từng dung dịch sau: NH4NO3, NaHCO3,
(NH4)2SO4, FeCl2 và AlCl3. Viết phương trình các phản ứng xảy ra. Hướng dẫn giải
Nhỏ từ từ đến dư Ba(OH)2 vào các dung dịch.
NH4NO3 có khí mùi khai bay ra.
2NH4NO3 + Ba(OH)2 → Ba(NO3)2 + 2NH3 + 2H2O
(NH4)2SO4 có khí mùi khai, có kết tủa trắng
(NH4)2SO4 + Ba(OH)2 → BaSO4+ 2NH3+ 2H2O MgCl2 có kết tủa trắng
NaHCO3 + Ba(OH)2 → BaCO3 + Na2CO3 + H2O
FeCl2 có kết tủa trắng xanh
FeCl2 + Ba(OH)2 → Fe(OH)2 + BaCl2
AlCl3 có kết tủa trắng keo, dư kiềm thì tan
2AlCl3 + 3Ba(OH)2 → 2Al(OH)3 + 3BaCl2
Câu 2: Mỗi cốc chứa một trong các dung dịch sau: Pb(NO3)2, NH4Cl, (NH4)2CO3, ZnSO4,
Na3PO4 và MgSO4. Nhận biết các dung dịch trên và viết phương trình hóa học.
Đáp án hướng dẫn giải
Cho từ từ dung dịch NaOH vào các mẫu thử chứa các hóa chất trên có những hiện tượng xảy ra như sau:
NH4Cl + NaOH → NH3 + H2O + NaCl
(NH4)2CO3 + NaOH → 2NH3 + 2H2O + Na2CO3
Để nhận biết hai muối này ta cho tác dụng với dung dịch HCl, mẫu thử nào cho khí bay lên
là (NH4)2CO3, còn mẫu thử không có hiện tượng gì xảy ra là NH4Cl
Có 3 kết tủa trắng Zn(OH)2, Mg(OH)2, Pb(OH)2, nếu tiếp tục cho NaOH vào: Zn(OH)2 và
Pb(OH)2 tan còn Mg(OH)2 không tan, như vậy ta biết được cốc chứa MgSO4:
ZnSO4 + 2NaOH → Zn(OH)2 + Na2SO4
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4
PbSO4 + 2NaOH → Pb(OH)2 + Na2SO4
Pb(OH)2 + 2NaOH → Na2PbO2 + 2H2O
Để nhận biết Pb(NO3)2 và ZnSO4 ta cho dung dịch HCl vào hai mẫu thử, mẫu thử nào cho
kết tủa màu trắng là Pb(NO3)2 còn mẫu thử không tác dụng là ZnSO4.
Pb(NO3)2 + 2HCl → PbCl2 + 2HNO3
Bài 3: Chỉ được dùng một kim loại, làm thế nào phân biệt những dung dịch sau đây: NaOH, NaNO3, HgCl2, HNO3, HCl.
Bài 4: Chỉ dùng 1 thuốc thử hãy nhận biết các dd:
a) Na2CO3; (NH4)3PO4; NH4Cl; NaNO3.
b) NH4Cl; (NH4)2SO4; BaCl2; KNO3.
D. NHẬN BIẾT MỘT SỐ HỢP CHẤT HỮU CƠ Hóa chất Thuốc thử Hiện tượng
Phương trình phản ứng hóa học Ankin có dung dịch
có kết tủa màu R-C≡CH + AgNO3 + NH3 → R- nối ba đầu AgNO vàng C≡CAg + NH4NO3 3/NH3 mạch (ank- 1-in) Anken dung dịch brom mất màu C2H4 + Br2 → C2H4Br2 hoặc dung dịch 3C2H4 + 2KMnO4 + thuốc tím 4H2O → 3C2H4(OH)2 + 2KOH + (KMnO4) 2MnO2
Stiren: dung dịch brom mất màu C6H5-CH=CH2 + Br2 → C6H5- (C6H5- hoặc dung dịch CHBr-CH2Br CH=CH2) thuốc tím 3C6H5-CH=CH2 + 2KMnO4 + (KMnO4) ở điều 4H2O → 3C8H8(OH)2 + 2KOH + kiện thường. 2MnO2 Toluen: dịch thuốc tím mất màu C6H5CH3 + 2KMnO4 → C6H5COOK (C6H5CH3) (KMnO4) ở điều + 2MnO2 + H2O kiện đun nóng. Benzen
hỗn hợp dung dịch tạo dung dịch C6H6 + HNO3 → C6H5NO2 + H2O HNO3/H2SO4 màu vàng, có
đặc, đun nóng. mùi hạnh nhân. kiện đun nóng. Glixerol và Cu(OH)2/OH-
tạo dung dịch 2C3H5(OH)3 + Cu(OH)2 → ancol đa
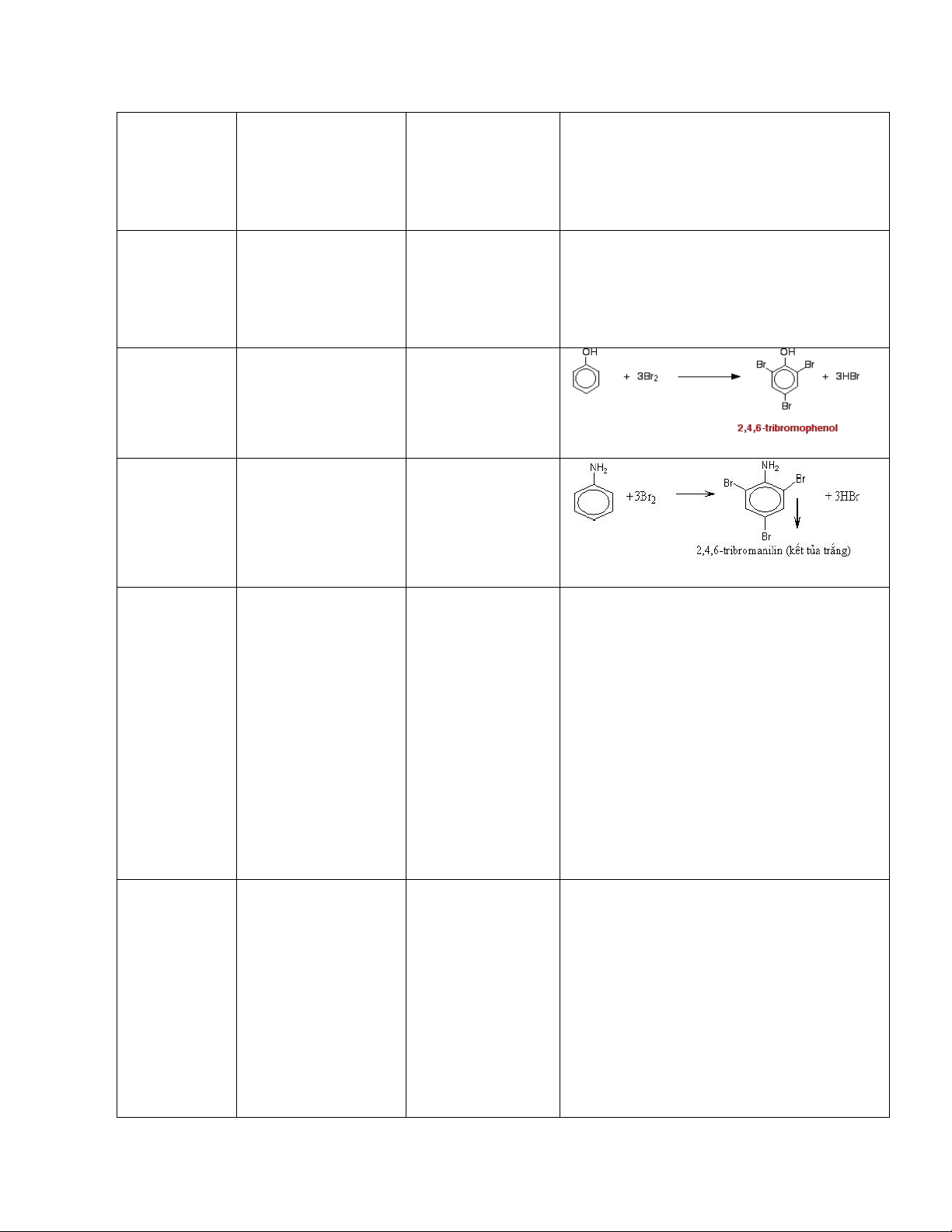
phức màu xanh (C3H5(OH)2O)2Cu + 2H2O chức có 2 nhóm -OH lam. kế tiếp nhau. Ancol đơn Na kim loại có sủi bọt khí 2ROH + 2Na → 2RONa + H2 chức Phenol dung dịch brom có kết tủa trắng Anilin dung dịch brom có kết tủa trắng Andehit - dung dịch - có kết tủa bạc
R-CHO + 2AgNO3 + 3NH3 + H2O → AgNO3/NH3 R-COONH4 + 2Ag + 2NH4NO3 Andehit
HCHO + 4AgNO3 + 6NH3 + 2H2O → fomic - Cu(OH)2/OH-
- kết tủa màu đỏ (NH4)2CO3 + 4Ag + 4NH4NO3 HCHO Đun nóng gạch. RCHO + 2Cu(OH)2 → RCOOH + Cu2O + 2H2O Axit - quỳ tím - quỳ sang màu cacboxylic đỏ. axit fomic - AgNO - kết tủa bạc 3/NH3 HCOOH + 2AgNO3 + 4NH3 + H2O (HCOOH) → (NH4)2CO3 + 2Ag + 2NH4NO3
Axit acrylic - dung dịch nước -làm mất màu brom CH2=CH-COOH + Br2 → CH2Br- CHBr-COOH BÀI TẬP VẬN DỤNG
Câu 1: Dùng một hoá chất nào sau đây để nhận biết stiren, toluen, phenol
Câu 2: Có 4 chất lỏng đựng trong 4 lọ bị mất nhãn: ancol etylic, toluen, phenol, axit fomic.
Để nhận biết 4 chất đó có thể dùng nhóm thuốc thử nào sau đây ?
Câu 3: Chỉ dùng thêm một chất nào trong các chất dưới đây để nhận biết các chất: ancol
etylic, axit axetic, glixerol, glucozơ đựng trong 4 lọ mất nhãn ?
Câu 4: Để loại bỏ SO2 có lẫn trong C2H4 người ta cho hỗn hợp khí qua dung dịch
Câu 5: Để loại bỏ tạp chất C2H2, C2H4, but-1,3-đien, CH3NH2 có lẫn trong C2H6 ta cho hỗn
hợp lần lượt đi qua dung dịch
Câu 6: Khi làm khan rượu C2H5OH có lẫn một ít nước người ta dùng cách nào sau đây ?
Câu 7: Hỗn hợp gồm benzen, phenol và anilin. Để lấy riêng từng chất nguyên chất cần dùng
Câu 8: Để tách các chất trong hh gồm ancol etylic, anđehit axetic, axit axetic cần dùng các dd
Câu 9: Để tách riêng lấy từng chất từ hỗn hợp gồm benzen, anilin, phenol, ta có thể dùng thêm các dung dịch
Câu 10: Để tách riêng từng chất benzen (ts =800C) và axit axetic (ts =1180C) nên dùng
phương pháp nào sau đây ?
Document Outline
- Cách nhận biết các chất hóa học lớp 11




