











Preview text:
CẨM NANG ÔN THI TN THPT 2025 MÔN HÓA HỌC
Học sinh: …………………………………nhất định sẽ đỗ đại học!
Tóm tắt đầy đủ lý thuyết chương trình hóa học THPT lớp 10, 11, 12
Kỹ thuật và phương pháp giải các dạng bài tập thi TN THPT 2025
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé!
DANH MỤC CÁC CHUYÊN ĐỀ LỚP CHUYÊN ĐỀ TRANG 8, 9
Chuyên đề 1: Khái niệm cơ bản và công thức thường dùng 3
Chuyên đề 2: Cấu tạo nguyên tử 8
Chuyên đề 3: Bảng tuần hoàn các nguyên tố hóa học và định 12 luật tuần hoàn
10 Chuyên đề 4: Liên kết hóa học 16
Chuyên đề 5: Phản ứng oxi hóa – khử 20
Chuyên đề 6: Năng lượng hóa học 22
Chuyên đề 7: Tốc độ phản ứng 25
Chuyên đề 8: Nguyên tố nhóm halogen 27
Chuyên đề 9: Cân bằng hóa học 31
Chuyên đề 10: Nitrogen - sulfur 36
11 Chuyên đề 11: Đại cương hóa học hữu cơ 47
Chuyên đề 12: Hydrocarbon 55
Chuyên đề 13: Dẫn xuất halogen – alcohol - phenol 64
Chuyên đề 14: Hợp chất carbonyl – carboxylic acid 72
Chuyên đề 15: Ester - lipid 78
Chuyên đề 16: Carbohydrate 85
Chuyên đề 17: Hợp chất chứa nitrogen 93
Chuyên đề 18: Polymer 102
12 Chuyên đề 19: Tổng hợp kiến thức hóa hữu cơ 110
Chuyên đề 20: Pin điện – điện phân 114
Chuyên đề 21: Đại cương kim loại 120
Chuyên đề 22: Nguyên tố nhóm IA, IIA 129
Chuyên đề 23: Sơ lược về dãy kim loại chuyển tiếp thứ nhất và 136 phức chất
2 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé!
CHUYÊN ĐỀ 1: KHÁI NIỆM CƠ BẢN VÀ
CÔNG THỨC THƯỜNG DÙNG
1. Nguyên tử, nguyên tố hóa học, phân tử, đơn chất, hợp chất Nguyên tử Nguyên tố Đơn chất Hợp chất Phân tử
- Vô cùng nhỏ, trung - Tập hợp các nguyên tử - Chỉ gồm 1 nguyên - Gồm 2 hay - Đại diện cho chất,
hòa điện (số p = số e) có cùng số p. tố. nhiều nguyên tố. gồm các nguyên tử liên kết với nhau. Z KÍ HIỆU TÊN CŨ TÊN MỚI PHIÊN ÂM VIỆT HÓA M (NTK) 1 H Hiđro Hydrogen /ˈhaɪdrədʒən/ ‘hai-đrơ-zừn 1 2 He Heli Helium /ˈhiːliəm/ ‘hít-li-ừm 4 3 Li Liti Lithium /ˈlɪθiəm/ ‘li-thi- ừm 7 4 Be Beri Beryllium /bəˈrɪliəm/ bờ-‘ri-li- ừm 9 5 B Bo Boron /ˈbɔːrɒn/ ‘bo-roon 11 6 C Cacbon Carbon /ˈkɑːbən/ ‘Ka-bừn 12 7 N Nitơ Nitrogen /ˈnaɪtrədʒən/ ‘nai-trơ zừn 14 8 O Oxi Oxygen /ˈɒksɪdʒən/ ‘óoc-xai-zừn 16 9 F Flo Fluorine /ˈflɔːriːn/ ‘phlo-rìn 19 10 Ne Neon Neon /ˈniːɒn/ ‘ni-ừn 20 11 Na Natri Sodium /ˈsəʊdiəm/ ‘sâu-đì-ừm 23 12 Mg Magie Magnesium /mæɡˈniːziəm/ Mẹg-‘ni-zi-ừm 24 13 Al Nhôm Aluminium
/ˌæljəˈmɪniəm/ a-lu-‘mi-ni-ừm 27 14 Si Silic Silicon /ˈsɪlɪkən/ ‘si-li-cừn 28 15 P Phốt pho Phosphorus /ˈfɒsfərəs/ ‘phoos-phờ-rợt 31 16 S Lưu huỳnh Sulfur /ˈsʌlfə(r)/ ‘sâu-phờ 32 17 Cl Clo Chlorine /ˈklɔːriːn/ ‘klo-rìn 35,5 18 Ar Agon Argon /ˈɑːɡɒn/ ‘a-gừn 40 19 K Kali Potassium /pəˈtæsiəm/ Pờ-‘tas-zi-ừm 39 20 Ca Canxi Calcium /ˈkælsiəm/ ‘kal-si-ừm 40 26 Fe Sắt Iron /ˈaɪən/ ‘ai-ừn 56 29 Cu Đồng Copper /ˈkɒpə(r)/ 'kóop-pờ 64 30 Zn Kẽm Zinc /zɪŋk/ zin-k 65 35 Br Brom Bromine /ˈbrəʊmiːn/ ‘brâu-mìn 80 47 Ag Bạc Silver /ˈsɪlvər/ ‘siu-vờ 108 53 I Iot Iodine /ˈaɪədaɪn/ ‘ai-ờ-đai-n 127 56 Ba Bari Barium /ˈberiəm/ ‘be-rì-ừm 137 79 Au Vàng Gold /ɡəʊld/ Gâul-đ 197 80 Hg Thủy ngân Mercury /ˈmɜːkjəri/ ‘mek-kiu-ri 201
2. Hóa trị - công thức hóa học Kim loại Phi kim Nhóm nguyên tố -OH, -NO3, -NO2, -NH4, - Hóa trị I Li, Na, K, Ag. H, F, Cl, Br, I. HSO3, -HSO4, -H2PO4. Còn lại (Ca, Ba, Mg, Hóa trị II O =SO Zn,…). 4, =SO3, =CO3, =HPO4.
3 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé! Hóa trị III Al, Au. ≡PO4. Fe (II, III); Cu (I, II); Sn C (II, IV); N (I, II, III, Nhiều hóa trị (II, IV); Pb (II, IV). IV, V); S (II, IV, VI). a b
Qui tắc hóa trị: Ax By a.x = b.y (a, b là hóa trị của A, B). 3. Phản ứng hóa học
Các bước cân bằng phương trình hóa học:
Bước 1: Viết sơ đồ phản ứng.
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố theo thứ tự: KL → PK → H → O (hoặc chẵn – lẻ).
Chú ý: Với trường hợp hệ số lẻ thì nhân với 2.
4. Dãy hoạt động hóa học của kim loại
K Na Ba Ca Mg Al Zn Fe Ni Sn Pb (H) Cu Hg Ag Pt Au
Khi Nào Bạn Cần May Áo Záp Sắt Nên Sang Phố Hỏi Cửa Hàng Á Phi Âu
(1) Dãy hoạt động hóa học sắp xếp theo chiều giảm dần tính kim loại.
(2) Các kim loại đứng trước Mg phản ứng với nước ở điều kiện thường.
(3) Các kim loại trước H tác dụng được với acid HCl, H2SO4 loãng.
(4) Từ Mg trở đi, kim loại mạnh đẩy được kim loại yếu ra khỏi muối.
5. Một số định luật bảo toàn ĐLBT khối lượng ĐLBT electron ĐLBT điện tích m =m n =n n =n chÊt ph¶n øng s¶ n phÈm e nhêng e nhËn ®iÖn tÝch(+) ®iÖn tÝch(-)
6. Phân loại và gọi tên các chất vô cơ
4 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé! GỐC TÊN GỐC PHIÊN ÂM VÍ DỤ MUỐI F -fluoride /ˈflɔːraɪd/ NaF: sodium fluoride Cl -chloride /ˈklɔːraɪd/ CuCl2: copper (II) chloride Br -bromide /ˈbrəʊmaɪd/ FeBr3: iron (III) bromide I -iodide /ˈaɪədaɪd/ AgI: silver iodide S -sulfide /ˈsʌlfaɪd/ PbS: lead sulfide C -carbide /ˈkɑːbaɪd/ Al4C3: aluminium carbide N -nitride /ˈnaɪtraɪd/ Li3N: lithium nitride P -phosphide /ˈfɒsfaɪd/ Zn3P2: zinc phosphide CN -cyanide /ˈsaɪənaɪd/ KCN: potassium cyanide SO4 -sulfate /ˈsʌlfeɪt/ Na2SO4: sodium sulfate KHSO4: potassium hydrogen HSO4 -hydrogen sulfate /ˈhaɪdrədʒən sʌlfeɪt/ sulfate SO3 -sulfite /ˈsʌlfaɪt/ CaSO3: calcium sulfite NO3 -nitrate /ˈnaɪtreɪt/ AgNO3: silver nitrate NO2 -nitrite /ˈnaɪtraɪt/ NaNO2: sodium nitrite MnO4 -permanganate /pəˈmæŋɡəˌneɪt/ KMnO4: potassium permanganate CO3 -carbonate /ˈkɑːbənət/ MgCO3: magnesium carbonate -hydrogen /ˈhaɪdrədʒən Ba(HCO3)2: barium hydrogen HCO3 carbonate ˈkɑːbənət/ carbonate PO4 -phosphate /ˈfɒsfeɪt/ Ag3PO4: silver phosphate -hydrogen (NH4)2HPO4: ammonium hydrogen HPO4
/ˈhaɪdrədʒən ˈfɒsfeɪt/ phosphate phosphate -dihydrogen /dai ˈhaɪdrədʒən
Ca(H2PO4)2: calcium dihydrogen H2PO4 phosphate ˈfɒsfeɪt/ phosphate NH4 ammonium NH4Cl: ammonium chloride
7. Tính chất hóa học của các hợp chất KIM LOẠI PHI KIM (1) PƯ với phi kim.
(1) PƯ kim loại ⟶ Muối/ Oxide
- Với oxygen ⟶ Oxide kim loại.
(2) PƯ với O2 ⟶ Oxide phi kim. VD: 2Cu + O2 ⟶ 2CuO VD: C + O2 ⟶ CO2
- Với phi kim khác ⟶ Muối.
(3) PƯ với H2 ⟶ Khí.
VD: 2Fe + 3Cl2 ⟶ 2FeCl3 VD: C + 2H2 ⟶ CH4
(2) PƯ với acid ⟶ Muối + H2.
(4) C, H2 + Oxide KL ⟶ KL + CO, H2O.
VD: Fe + 2HCl ⟶ FeCl2 + H2
VD: H2 + CuO ⟶ Cu + H2O
(3) PƯ với nước ⟶ Base + H2.
VD: 2Na + 2H2O ⟶ 2NaOH + H2 MUỐI
(4) PƯ với dung dịch muối.
(1) PƯ kim loại ⟶ Muối mới + KL mới.
VD: Fe + CuSO4 ⟶ Cu + FeSO4
(2) PƯ với acid ⟶ Muối mới + acid mới.
(5) PƯ với dung dịch kiềm.
(3) PƯ với base ⟶ Muối mới + base mới.
VD: 2Al + 2NaOH + 2H2O ⟶ 2NaAlO2 + 3H2
(4) PƯ với muối ⟶ 2 muối mới BASIC OXIDE ACIDIC OXIDE
5 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé!
(1) PƯ với nước ⟶ Base.
(1) PƯ với nước ⟶ Acid.
VD: Na2O + H2O ⟶ 2NaOH
VD: SO3 + H2O ⟶ H2SO4
(2) PƯ với acidic oxide ⟶ Muối.
(2) PƯ với basic oxide ⟶ Muối.
VD: CaO + CO2 ⟶ CaCO3
VD: CaO + CO2 ⟶ CaCO3
(3) PƯ với acid ⟶ Muối + H2O.
(3) PƯ với base ⟶ Muối + H2O.
VD: CuO + 2HCl ⟶ 2CuCl2 + H2O
VD: CO2 + 2NaOH ⟶ Na2CO3+ H2O ACID BASE
(1) Đổi màu quì tím ⟶ đỏ.
(1) Đổi màu quì tím ⟶ xanh, phenolphtalein (2) PƯ với acid ⟶ hồng.
- HCl/ H2SO4 loãng + KL ⟶ Muối + H2.
(2) PƯ với acidic oxide ⟶ Muối + H2O.
- HNO3/H2SO4 đặc ⟶ Muối + sp khử + H2O.
(3) PƯ với acid ⟶ Muối + H2O.
(3) PƯ với basic oxide ⟶ Muối + H2O.
(4) PƯ với muối ⟶ Muối mới + base mới.
(4) PƯ với base ⟶ Muối + H2O.
(5) Bị nhiệt phân ⟶ Oxide KL + H2O.
(5) PƯ với muối ⟶ Muối mới + acid mới
8. Công thức thường dùng trong hóa học
(a) Công thức tính số mol
1. Khối lượng chất
2. Thể tích khí đkc 3. Nồng độ mol m V Công thức n = n = n = C .V M 24,79 M Ý nghĩa m: khối lượng chất (g) n: số mol C
M: nồng độ mol của dd (mol/l hay M)
M: khối lượng mol (g/mol).
V: thể tích khí ở đkc (l)
V: thể tích dung dịch (l)
Chú ý công thức tính số mol theo thể tích khí: Công thức cũ Công thức mới
Ở điều kiện tiêu chuẩn (đktc):
Ở điều kiện chuẩn (đkc): Nhiệt độ: 0oC Nhiệt độ: 25oC Áp suất: 1 atm
Áp suất: 1 bar 0,986 atm
1 mol chất khí chiếm thể tích 22,4 lít.
1 mol chất khí chiếm thể tích 24,79 lít. V = n.22,4 (lít) V = n.24,79 (lít) (b) Nồng độ dung dịch 1. Nồng độ mol
2. Nồng độ phần trăm
3. Khối lượng riêng n m m ct Công thức C = C% = .100% dd D = M V m V dd dd Ý nghĩa C m
D: khối lượng riêng của dd (g/mL).
M: nồng độ mol (mol/l hay M)
ct: khối lượng chất tan (g)
V: thể tích dung dịch (l)
mdd: khối lượng dung dịch (g)
Vdd: thể tích dung dịch (mL) 10D.C% Chuyển đổi C = M và C%: C M M M
(c) Tỉ khối hơi của khí A so với khí B A d = M A / B
A, MB là khối lượng mol của A và B. MB
9. Một số dạng bài tập
DẠNG 1: TÍNH THEO CÔNG THỨC HÓA HỌC
LÍ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
Phần trăn khối lượng của nguyên tố A trong hợp chất AxByCz: m M .x A A %m = .100% = .100% A m M .x + M .y + M .z hîp chÊt A B C
6 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé! %m %m Cho hợp chất A = xBy, ta có: A B x : y :
Công thức hóa học của AxBy. M M A B
DẠNG 2: TÍNH THEO PHƯƠNG TRÌNH HÓA HỌC
LÍ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
Bước 1: Tính số mol và viết PTPƯ xảy ra.
Bước 2: Dựa vào số mol đã biết và PTPƯ Số mol của chất cần tìm.
TH1: Nếu đề bài cho số mol của 1 chất, chất còn lại vừa đủ hoặc dư thì tính số mol chất cần tìm theo
số mol chất đã biết (sử dụng nhân chéo – chia ngang).
TH2: Nếu đề bài cho số mol của từ 2 chất phản ứng trở lên phải biện luận chất hết – chất dư (so sánh sè mol tỉ lệ
; lớn – dư, nhỏ - hết) Tính theo chất hết. hÖ sè
TH3: Đối với bài toán hỗn hợp, nếu đề bài cho từ số mol của 2 chất trở lên thì đặt ẩn – lập hệ (ẩn là
số mol chất cần tìm, bao nhiêu ẩn bấy nhiêu pt) Số mol của chất cần tìm. Bướ n
c 3: Từ số mol chất cần tìm đại lượng đề bài yêu cầu (m = n.M; V = n.24,79; C = , M V mct C% = .100% , …) mdd
7 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé!
CHUYÊN ĐỀ 2: CẤU TẠO NGUYÊN TỬ CĐ1
THÀNH PHẦN NGUYÊN TỬ
KIẾN THỨC CẦN NHỚ
I. Thành phần cấu tạo của nguyên tử
H¹t nh©n :chøa proton (mang ®iÖn +) vµ neutron (kh«ng mang ®iÖn).
♦ Nguyên tử rỗng, gồm
Vá nguyª n tö :chøa c¸c electron (mang ®iÖn ©m). Khối lượng Khối lượng Điện tích Hạt Kí hiệu Điện tích (C) (kg) (amu) tương đối Hạt Proton p 1,673.10-27 1 +1,602.10-19 +1 nhân Neutron n 1,675.10-27 1 0 0 Vỏ Electron e 9,109.10-31 0,00055 -1,602.10-19 -1
♦ Nguyên tử trung hòa điện: số proton (P) = số electron (E).
♦ Khối lượng nguyên tử: m nt = mp + mn + me
mp + mn (do me rất nhỏ so với mp,n )
II. Kích thước và khối lượng nguyên tử o
♦ Nguyên tử có kích thước rất nhỏ, dùng đơn vị nm (nanomet), pm (picomet) hay A (angstrom): o
1nm = 10-9 m; 1pm = 10-12m; 1 A =10-10m. o
- Nguyên tử có đường kính khoảng 10-10 m (1 A ); đường kính hạt nhân rất nhỏ so với nguyên tử.
Đường kính nguyên tử lớn hơn đường kính hạt nhân khoảng 104 - 105 lần. ♦
Khối lượng nguyên tử rất nhỏ, dùng đơn vị khối lượng nguyên tử: amu 1 1amu =
khối lượng của một nguyên tử đồng vị carbon 12. 12
1amu = 1,6605.10-27kg = 1,6605.10-24 g
8 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé! CĐ2
NGUYÊN TỐ HÓA HỌC
KIẾN THỨC CẦN NHỚ
I. Hạt nhân nguyên tử, nguyên tố hóa học
♦ Hạt nhân nguyên tử
- Nguyên tử có Z proton thì có điện tích hạt nhân là +Z.
- Số đơn vị điện tích hạt nhân (Z) = số proton = số electron.
- Số khối: A = Số proton (Z) + số neutron (N)
♦ Nguyên tố hóa học
- Nguyên tố hóa học là tập hợp những nguyên tử có cùng điện tích hạt nhân.
- Số hiệu nguyên tử (Z) của một nguyên tố là số đơn vị điện tích hạt nhân của nguyên tố đó. A - Kí hiệu nguyên tử: X Z
(A: Số khối, Z: Số hiệu nguyên tử; X: Kí hiệu nguyên tố).
II. Đồng vị - nguyên tử khối trung bình ♦ Đồng vị
- Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton (Z) nhưng
khác nhau về số neutron (N), do đó số khối A của chúng khác nhau.
♦ Nguyên tử khối trung bình
- Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu
lần đơn vị khối lượng nguyên tử (amu). Nguyên tử khối của một nguyên tử coi như bằng số khối của nguyên tử đó. A .x + A .x + ... + A .x
- Nguyên tử khối trung bình: 1 1 2 2 n n A = 100
+ Trong đó: A là nguyên t ử khối trung bình; A1, A2, ..., An là nguyên tử khối của các đồng vị;
x1, x2, ..., xn là phần trăm số nguyên tử của các đồng vị đồng vị (x1 + x2 + ...+ xn = 100%).
+ Đối với nguyên tử có 2 đồng vị thì nguyên tử khối trung bình tính theo công thức: A .x + A .x 1 1 2 2 A = (x1 + x2 = 100) 100
9 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé! CĐ3
CẤU TRÚC LỚP VỎ ELECTRON CỦA NGUYÊN TỬ
KIẾN THỨC CẦN NHỚ
I. Sự chuyển động của electron trong nguyên tử - Orbital nguyên tử
♦ Mô hình nguyên tử
Mô hình của Rutherford – Bohr Mô hình hiện đại
- Các electron chuyển động trên những quỹ - Các electron chuyển động rất nhanh xung
đạo tròn hoặc bầu dục xác định quanh hạt quanh hạt nhân không theo một quỹ đạo xác nhân.
định tạo thành đám mây electron. ♦
Orbital nguyên tử (AO)
- Khái niệm: Orbital nguyên tử (kí hiệu AO) là khu vực không gian xung quanh hạt nhân nguyên
tử mà xác xuất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%)
- Hình dạng của một số AO: AO s hình cầu AO p hình số 8 nổi
- Ngoài ra còn có AO d, AO f có hình dạng phức tạp hơn.
II. Lớp và phân lớp electron
III. Cấu hình electron của nguyên tử
♦ Các nguyên lý và quy tắc Nguyên lý vững bền Nguyên lý Pauli Quy tắc Hund
- Ở trạng thái cơ bản, các - Mỗi AO chỉ chứa tối đa 2e và có - Các electron phân bố
electron chiếm các mức năng chiều tự quay ngược nhau. vào các AO sao cho số
lượng từ thấp đến cao: 1s 2s - AO chứa 1e ⇒ electron độc thân electron độc thân là tối
2p 3s 3p 4s 3d 4p 5s …
- AO chứa 2e ⇒ electron ghép đôi đa.
♦ Cách viết cấu hình electron nguyên tử
+ Bước 1: Xác định số electron của nguyên tử (Z).
+ Bước 2: Điền các elect ron vào các phân lớp theo mức năng lượng: 1s2s2p3s3p4s3d4p5s…
+ Bước 3: (Z > 20) Viết cấu hình electron theo thứ tự lớp, phân lớp: 1s2s2p3s3p3d4s4p5s…
+ Bước 4 (theo ô AO): Biểu diễn cấu hình e theo ô AO tuân theo các nguyên lý và quy tắc.
- Cấu hình electron của một số khí hiếm: [He]: 1s2; [Ne]: 1s22s22p6; [Ar]: 1s22s22p63s23p6.
IV. Đặc điểm của lớp electron ngoài cùng Số e lớp ngoài cùng 1, 2, 3e 4e 5, 6, 7e 8e (He, 2e) Loại nguyên tố Kim loại KL hoặc PK Phi kim Khí hiếm
10 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé!
Dạng 1: Bài toán về các loại hạt p, n, e
LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
- Các biểu thức: (1) Z = P = E; (2) A = Z + N ⇒ Kí hiệu nguyên tử A X Z
- Phương pháp: Lập hệ 2 ẩn 2 phương trình chứa Z, N ⇒ Z, N ⇒ P, E, A ⇒ Kí hiệu A X . Z
- Các đại lượng: Quy về 2 ẩn là Z và N.
+ Tổng số hạt cơ bản trong nguyên tử (p, n, e): P + N + E = 2Z + N.
+ Tổng số hạt trong hạt nhân: P + N = Z + N.
+ Hạt mang điện trong nguyên tử: P + E = 2Z.
+ Hạt mang điện trong hạt nhân: P = Z.
+ Hạt không mang điện: N.
- Nếu đề bài chỉ cho 1 dữ kiện về tổng số hạt thì dùng điều kiện bền của hạt nhân để biện luận: N
Với các nguyên tử có Z ≤ 82 (Pb) ta luôn có: 1 1,5 . THĐB: 1H. 1 Z
♦ Với bài toán p, n, e của phân tử
- Số hạt p, n, e của một phân tử bằng tổng số hạt p, n, e của các nguyên tử trong phân tử.
VD: Trong phân tử AxBy có x nguyên tử A và y nguyên tử B, như vậy trong một phân tử AxBy có
(1) Số hạt proton bằng số hạt electron và bằng: xZA + yZB.
(2) Số hạt neutron bằng: xNA + yNB.
(3) Số hạt mang điện: x.2ZA + y.2ZB.
♦ Với bài toán p, n, e của ion
- Khi nguyên tử nhường hoặc nhận electron sẽ tạo thành ion.
+ Nếu nguyên tử nhận e → anion (-): X + ne → Xn-
+ Nếu nguyên tử nhường e → cation (+): M – ne → Mn+
- Nguyên tử và ion giống nhau về Z, P, N, A chỉ khác nhau về số e (E).
Dạng 2: Bài toán về bán kính nguyên tử
LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI 4
- Nguyên tử có dạng hình cầu ⇒ Thể tích nguyên tử: 3 V = r
(r lµ b¸n kÝnh nguyª n tö) ngtö 3 m - Khối lượng riêng: 3 D = (g/ cm ) V o
- Đổi đơn vị: 1nm = 10-9 m = 10-7cm; 1 A =10-10m = 10-8cm.
Số Avogđro: N = 6,022.1023; 1amu = 1,6605.10-24 gam.
Dạng 3: Bài toán về nguyên tử khối trung bình
LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI A .x + A .x + ...+ A .x 1 1 2 2 n n
- Nguyên tử khối trung bình: A =
(x1 + x2 +....+ xn = 100) 100
- x1, x2, … là phần trăm số nguyên tử hay phần trăm số mol của mỗi đồng vị.
- A1 = Z + N1; A2 = Z + N2; …..
11 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé!
CHUYÊN ĐỀ 3: BẢNG TUẦN HOÀN CÁC NGUYÊN
TỐ HÓA HỌC VÀ ĐỊNH LUẬT TUẦN HOÀN CĐ1 CẤU TẠO BẢ NG TUẦN HOÀN
CÁC NGUYÊN TỐ HÓA HỌC
KIẾN THỨC CẦN NHỚ
I. Lịch sử phát minh bảng tuần hoàn
♦ Trước đây các nhà khoa học sắp xếp các nguyên tố theo chiều tăng dần khối lượng nguyên tử.
♦ Bảng tuần hoàn hiện đại ngày nay được sắp xếp theo chiều tăng dần điện tích hạt nhân nguyên tử.
II. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
♦ Các nguyên tố được sắp xếp theo chiều tăng dần điện tích hạt nhân nguyên tử.
♦ Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
♦ Các nguyên tố mà nguyên tử có cùng số electron hóa trị được xếp vào một cột.
Electron hóa trị là các electron có khả năng tham gia tạo thành liên kết hóa học (chúng thường
nằm ở lớp ngoài cùng hoặc ở cả phân lớp sát ngoài cùng nếu phân lớp đó chưa bão hòa).
III. Cấu tạo bảng tuần hoàn
- Mỗi nguyên tố được xếp vào một ô gọi là ô nguyên tố.
Ô nguyên tố - STT ô = Số hiệu nguyên tử (Z).
- Là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xế
p thành một hàng theo chiều tăng dần của điện tích hạt nhân. Chu kì
- STT chu kì = số lớp electron.
- Bảng tuần hoàn có 7 chu kì: 3 chu kì nhỏ (1, 2, 3) và 4 chu kì lớn (4, 5, 6, 7).
- Là tập hợp các nguyên tố mà nguyên tử của chúng có cấu hình electron tương Nhóm
tự nhau, do đó tính chất hóa học gần giống nhau và xếp thành một cột. nguyên tố
- STT nhóm A = số electron lớp ngoài cùng. ♦ Phân loại nguyên tố
Theo cấu hình electron
Theo tính chất hóa học
- Nguyên tố s, p, d, f là những ng.tố mà ng.tử có + Nhóm IA, IIA, IIIA: Kim loại (trừ H, B).
e cuối cùng được điền vào phân lớp s, p, d, f.
+ Nhóm VA, VIA, VIIA: Phi kim.
+ Nhóm A: Gồm các nguyên tố s, p. + Nhóm VIIIA: Khí hiếm.
+ Nhóm B: Gồm các nguyên tố d, f.
+ Nhóm B: Đều là các kim loại chuyển tiếp.
IV. Quan hệ giữa vị trí của nguyên tố và cấu tạo nguyên tử Vị trí nguyên tố
Cấu tạo nguyên tử
- Số thứ tự của ô nguyên tố - Số proton, số electron
- Số thứ tự của chu kì - Số lớp electron
- Số thứ tự của nhóm A
- Số electron lớp ngoài cùng
♦ Số thứ tự nhóm các nguyên tố nhóm B: Các nguyên tố nhóm B thường có dạng: (n-1)da nsb. a + b 3 → 7 8 → 10 11, 12 Nhóm IIIB → VIIB VIIIB IB và IIB 12
Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé! CĐ2
XU HƯỚNG BIẾN ĐỔ I TÍNH CHẤT
TRONG CHU KÌ VÀ NHÓM
KIẾN THỨC CẦN NHỚ
I. Cấu hình electron nguyên tử của các nguyên tố nhóm A
- Sau mỗi chu kì, cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhom A được lặp
đi lặp lại một cách tuần hoàn ⇒ Sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của
nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi
tuần hoàn tính chất của các nguyên tố.
II. Xu hướng biến đổi một số tính chất của nguyên tố và hợp chất của chúng
Biến đổi cùng chiều
Biến đổi cùng chiều
- Bán kính nguyên tử (R).
- Độ âm điện (χ). ><
- Tính kim loại (KL). - Tính phi kim (PK). (trái ngược với)
- Tính base (Bz) của oxide
- Tính acid (Ax) của oxide cao nhất/ hydroxide cao nhất/ hydroxide
- Trong một chu kì, từ trái sang phải (R, KL, Bz) giảm.
R, KL, Bz - Trong một nhóm A, từ trên xuống dưới (R, KL, Bz) tăng.
- Trong một chu kì, từ trái sang phải (χ, PK, Ax) tăng.
E, PK, Ax - Trong một nhóm A, từ trên xuống dưới (χ, PK, Ax) giảm. • R, KL, Bz giảm • χ, PK, Ax tăng IA IIA IIIA IVA VA VIA VIIA VIIIA 1 H He 2 Li Be B C N O F Ne • R, KL, Bz tăng 3 Na Mg Al Si P S Cl Ar • χ, PK, Ax giảm 4 K Ca ♦ Giải thích
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân và các
electron lớp ngoài cùng tăng ⇒ R, KL giảm; χ, PK tăng.
+ Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, số lớp e tăng – lực hút giữa hạt
nhân và electron lớp ngoài cùng giảm ⇒ R, KL tăng; χ, PK giảm.
♦ Một số phương trình hóa học của oxide và hydroxide
(1) Na2O + 2HCl → 2NaCl + H2O
(6) Al(OH)3 + NaOH → Na[Al(OH)4] (2) NaOH + HCl → NaCl + H2O (7) SO3 + KOH → KHSO4
(3) Al2O3 + 6HCl → 2AlCl3 + 3H2O
(8) SO3 + 2KOH → K2SO4 + H2O
(4) Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
(9) H2SO4 + 2NaOH → Na2SO4 + 2H2O
(5) Al(OH)3 + 3HCl → AlCl3 + 3H2O
(10) H2SO4 + KOH → KHSO4 + H2O 13
Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé! CĐ3 ĐỊNH LUẬ T TUẦN HOÀN
Ý NGHĨA BẢNG TUẦN HOÀN CÁC NTHH
KIẾN THỨC CẦN NHỚ
I. Định luật tuần hoàn
- Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo
nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng dần của điện tích hạt nhân nguyên tử.
II. Ý nghĩa bảng tuần hoàn các nguyên tố hóa học
- Khi biết vị trí của một nguyên tố trong bảng tuần hoàn hoặc cấu hình electron nguyên tử có thể
dự đoán tính chất của đơn chất cũng như hợp chất của nó. Cấu hình electron
Vị trí nguyên tố trong BTH - Số proton, số electron - STT ô nguyên tố - Số lớp electron - STT chu kì
- Số electron lớp ngoài cùng - STT nhóm A
Tính chất của nguyên tố
- Tính kim loại, tính phi kim
- Hóa trị trong oxide cao nhất ⇒ công thức oxide cao nhất
- Hóa trị trong hợp chất khí với hydrogen ⇒ công thức hợp chất khí với hydrogen
- Công thức hydroxide tương ứng
- Tính acid, base của oxide cao nhất và hydroxide tương ứng
14 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé!
MỘT SỐ DẠNG BÀI TOÁN
Dạng 1: Bài toán xác định nguyên tố thuộc hai chu kì hoặc hai nhóm liên tiếp
LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
- Nếu 2 nguyên tố A, B (ZA < ZB) thuộc cùng 1 chu kì và 2 nhóm liên tiếp thì: ZB – ZA = 1.
THĐB: Nếu A, B thuộc nhóm IIA, IIIA thì có thêm TH: ZB – ZA = 11 hoặc ZB – ZA = 25.
- Nếu 2 nguyên tố A, B (ZA < ZB) thuộc cùng 1 nhóm A và 2 chu kì liên tiếp thì: T = ZA + ZB T < 12 12 ≤ T ≤ 32 32 < T ≤ 94 T > 94 ZB – ZA H và Li
8 (thường gặp) 18 (thường gặp) 32
Dạng 2: Bài toán tìm tên nguyên tố dựa vào công thức hóa học
LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
- Hóa trị của một nguyên tố trong oxide cao nhất = STT nhóm (STT nhóm ≤ 7).
- Hóa trị của một nguyên tố trong h/chất khí với hydrogen = 8 – STT nhóm (STT nhóm ≥ 4).
⇒ Hóa trị trong oxide cao nhất = 8 – Hóa trị trong hợp chất khí với hydrogen. m %m m %m - Xét hợp chất A A A A A xBy ta luôn có: = ; = m %m m 100 B B A B x y
Dạng 3: Bài toán tìm tên nguyên tố dựa vào phương trình hóa học
LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
❖ Tính chất hóa học của kim loại
(1) Tác dụng với phi kim → oxide/muối
(2) Tác dụng với H2O → Base + H2
(3) Tác dụng với HCl, H2SO4 loãng → Muối + H2
(4) Tác dụng với muối → Muối mới + kim loại mới
❖ Để tìm kim loại thường dựa vào khối lượng mol: = m M n
- Nếu đề bài cho hỗn hợp 2 kim loại thuộc cùng một nhóm A và 2 chu kì liên tiếp thì tìm khối lượng m mol trung bình: M =
hh ⇒ 2 kim loại A, B cần tìm có: M Mhh M n A B hh
Nhóm IA (kim loại kiềm): Li = 7; Na = 23; K = 39; Rb = 85; Cs = 133.
Nhóm IIA (kim loại kiềm thổ): Be = 9; Mg = 24; Ca = 40; Sr = 88; Ba = 137.
15 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé!
CHUYÊN ĐỀ 4: LIÊN KẾT HÓA HỌC CĐ1 QUY TẮC OCTET
KIẾN THỨC CẦN NHỚ
I. Khái niệm liên kết hóa học
♦ Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững.
♦ Trong các phản ứng hóa học, chỉ có các electron hóa trị tham gia vào quá trình hình thành liên
kết. Các electron hóa trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu
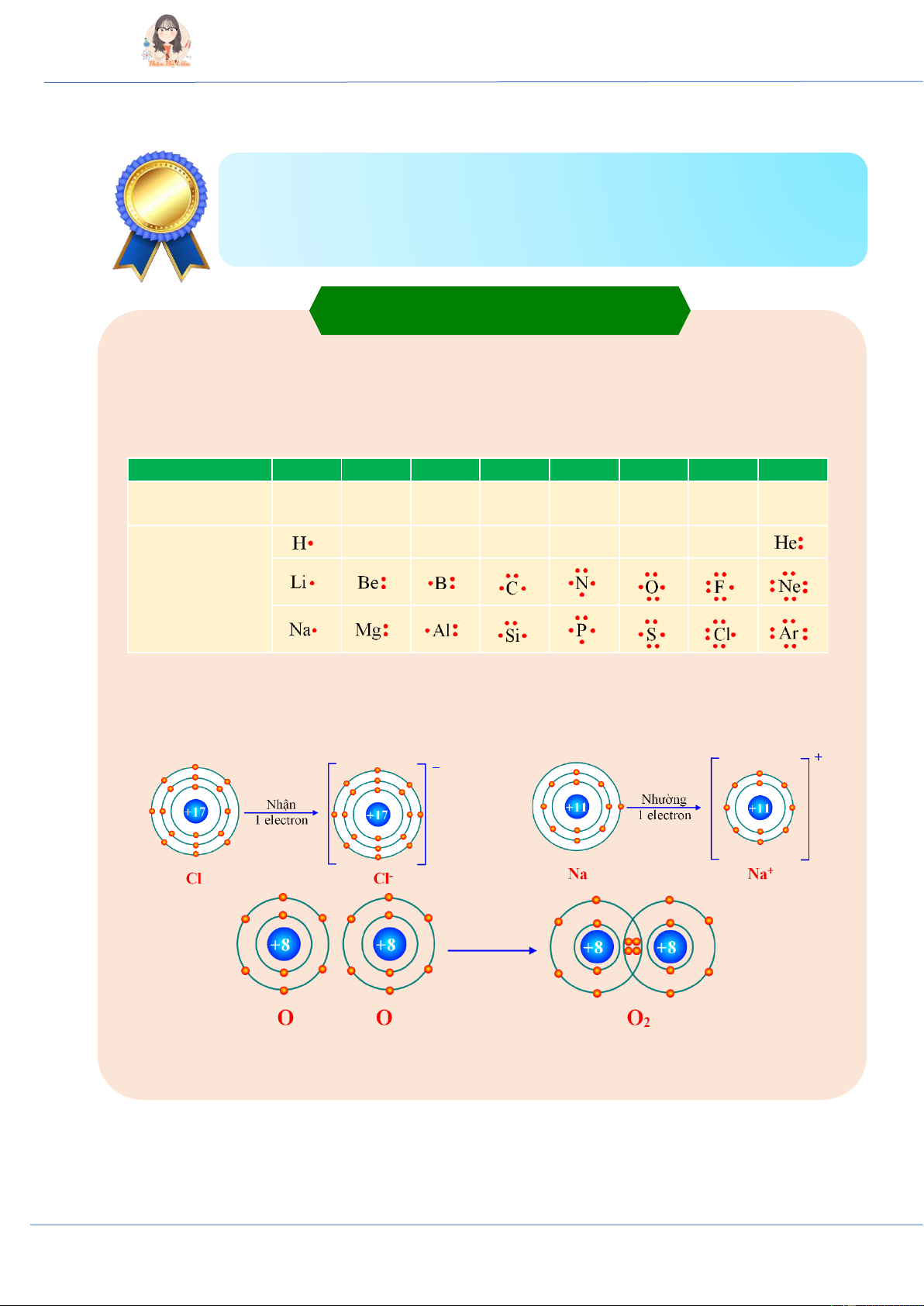
chấm đặt xung quanh kí hiệu nguyên tố. Nhóm IA IIA IIIA IVA VA VIA VIIA VIIIA Số electron 1 2 3 4 5 6 7 8 hóa trị Biểu diễn nguyên tử với electron hóa trị II. Quy tắc octet
♦ Quy tắc octet (bát tử): Khi hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A
có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của
nguyên tử khí hiếm (có 8 e lectron ở lớp ngoài cùng hoặc 2 electron như helium).
♦ Quy tắc octet thường chỉ đúng cho các nguyên tố hóa học thuộc chu kì 2 và một số các nguyên
tố kim loại, phi kim điển hình. Có một số ngoại lệ không thỏa mãn như: PCl5, BH3, SF6, …
16 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé! CĐ2 LIÊN KẾT ION
KIẾN THỨC CẦN NHỚ I. Sự tạo thành ion
♦ Nguyên tử nhường hoặc nhận electron sẽ tạo thành ion:
+ Nguyên tử nhường electron tạo thành cation (ion dương).
+ Nguyên tử nhận electron tạo thành anion (ion âm).
+ Giá trị điện tích trên cation hoặc anion bằng số electron mà nguyên tử đã nhường hoặc nhận. Ion đơn nguyên tử Ion đa nguyên tử + 2- Na+ (cation sodium), Mg2+
(cation OH- (hydroxide), NH4 (amonium), SO4
magnesium), O2- (anion oxide), Cl- (anion (sulfate), NO - 3- 3 (nitrate), PO4 (phosphate),
chloride), F- (anion fluoride), S2- (anion CO 2- -
3 (carbonate), HCO3 (hydrogen carbonate), sulfide), … SO 2- - 3 (sulfite), NO2 (nitrite)…
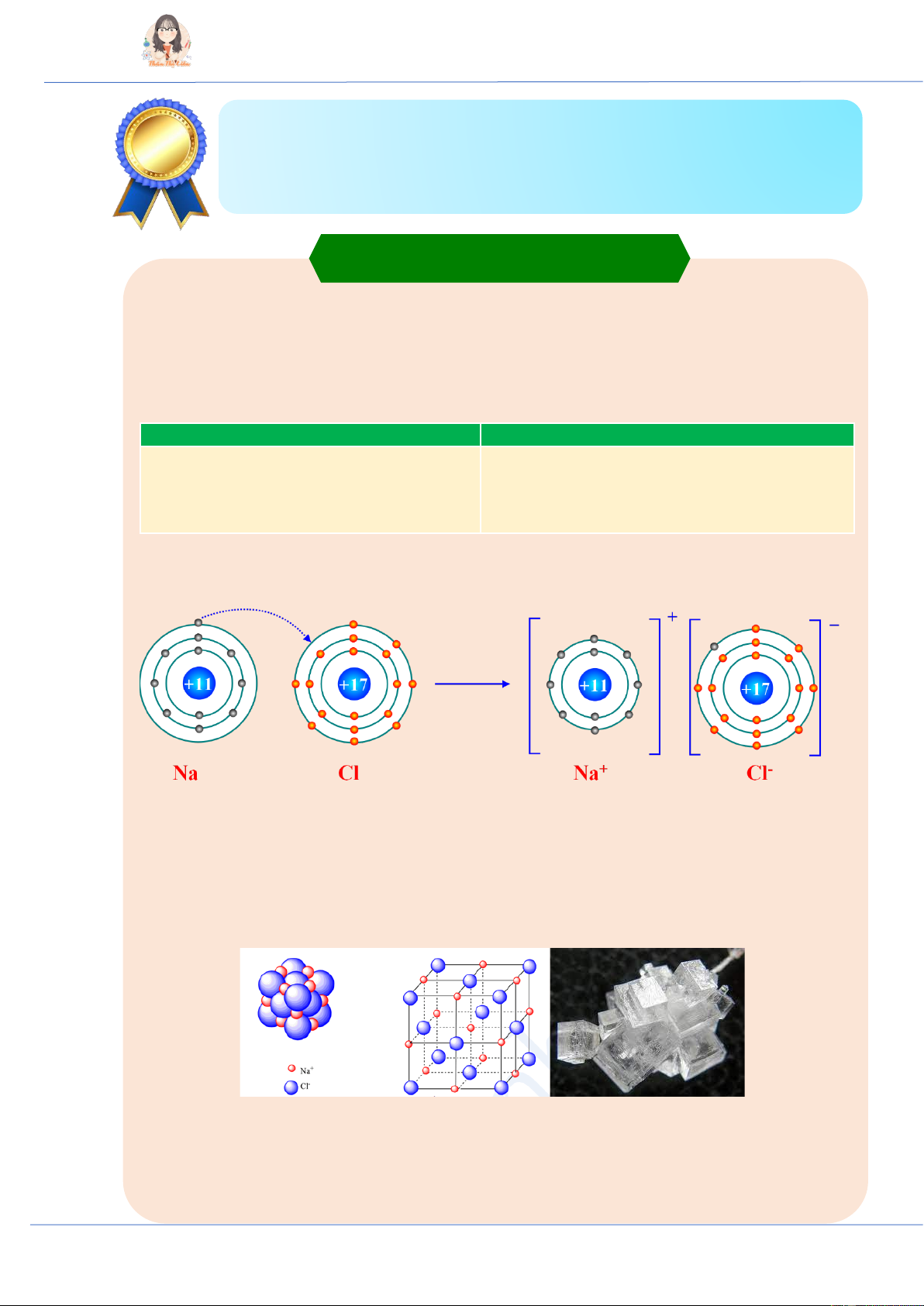
II. Sự tạo thành liên kết ion
♦ Liên kết ion là liên kết được tạo thành bằng lực hút tĩnh điện của các ion mang điện tích trái
dấu (trong phân tử hay tinh thể).
- Liên kết ion thường được tạo thành từ kim loại điển hình và phi kim điển hình, phân tử thu
được là hợp chất ion. III. Tinh thể ion
♦ Cấu trúc tinh thể ion
- Các ion được sắp xếp theo trật tự nhất định trong không gian theo kiểu mạng lưới (ở các nút
mạng là các ion dương và ion âm xếp luân phiên liên kết chặt chẽ với nhau do cân bằng lực hút và lực đẩy).
♦ Độ bền và tính chất của hợp chất ion
- Ở điều kiện thường, các hợp chất ion thường là chất rắn có nhiệt độ nóng chảy và nhiệt độ sôi cao.
- Hợp chất ion thường dễ tan trong nước, tạo thành dung dịch có khả năng dẫn diện.
17 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé! CĐ3
LIÊN KẾT CỘNG HÓA TRỊ
KIẾN THỨC CẦN NHỚ
I. Liên kết cộng hóa trị
♦ Khái niệm: Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay
nhiều cặp electron dùng c hung.
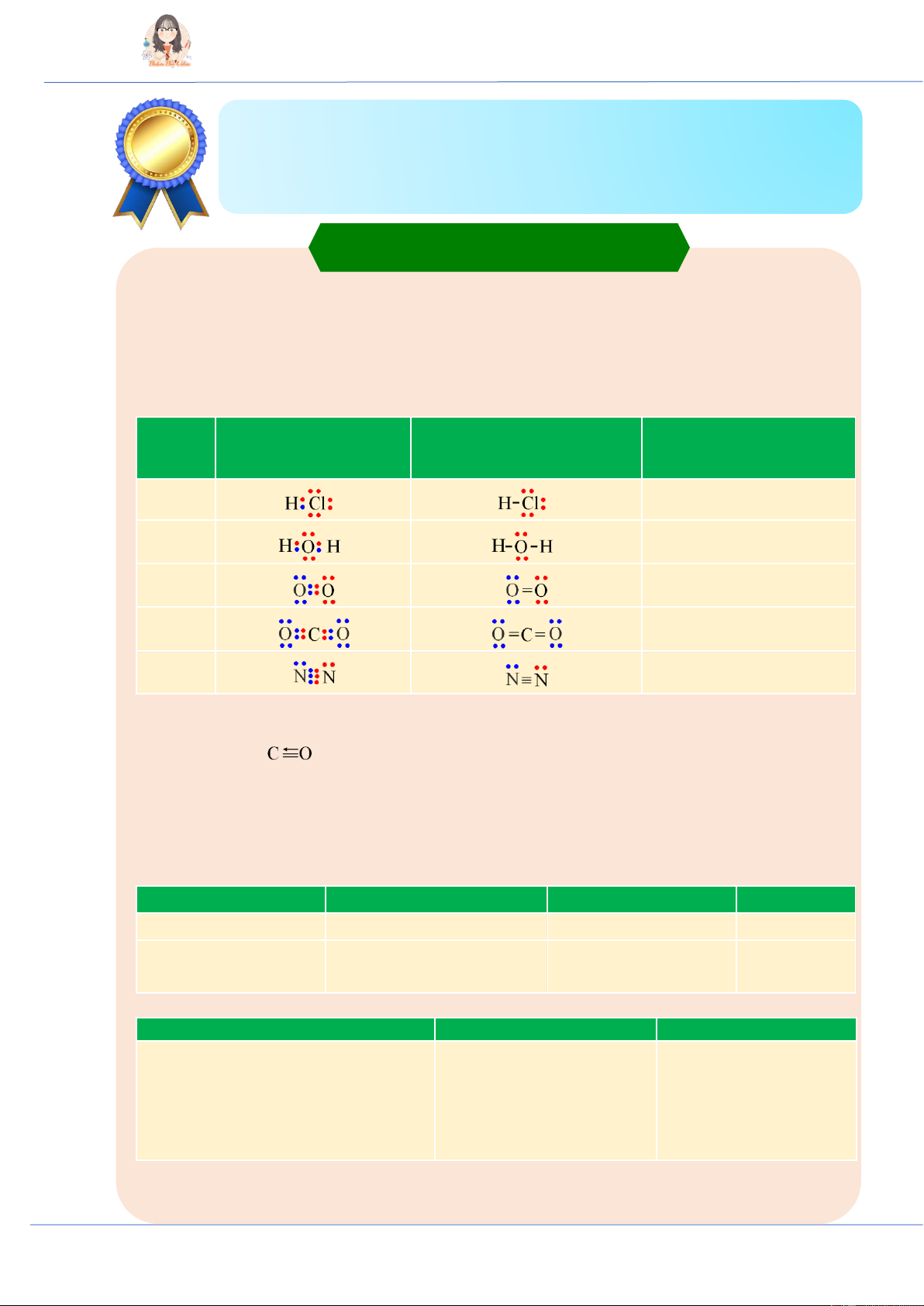
♦ Công thức electron, công thức Lewis, công thức cấu tạo một số phân tử:
- Mỗi cặp electron dùng chung được biểu diễn bằng 1 gạch nối “–” ⇒ Liên kết đơn “–”, liên kết
đôi “=”, liên kết ba “ ”. Công thức electron Công thức Lewis
Công thức cấu tạo Phân
(Biểu diễn tất cả các
(Thay mỗi cặp electron dùng
(Chỉ biểu diễn các liên kết - tử electron hóa trị)
chung bằng một gạch nối “–”)
cặp electron dùng chung) HCl H – Cl H2O H – O – H O2 O = O CO2 O = C = O N2 N N
♦ Liên kết cho – nhận là một trường hợp đặc biệt của liên kết cộng hóa trị, trong đó cặp electron
dùng chung chỉ do một nguyên tử đóng góp. Biểu diễn “→” từ nguyên tử đóng góp. VD: O = S → O; ; …
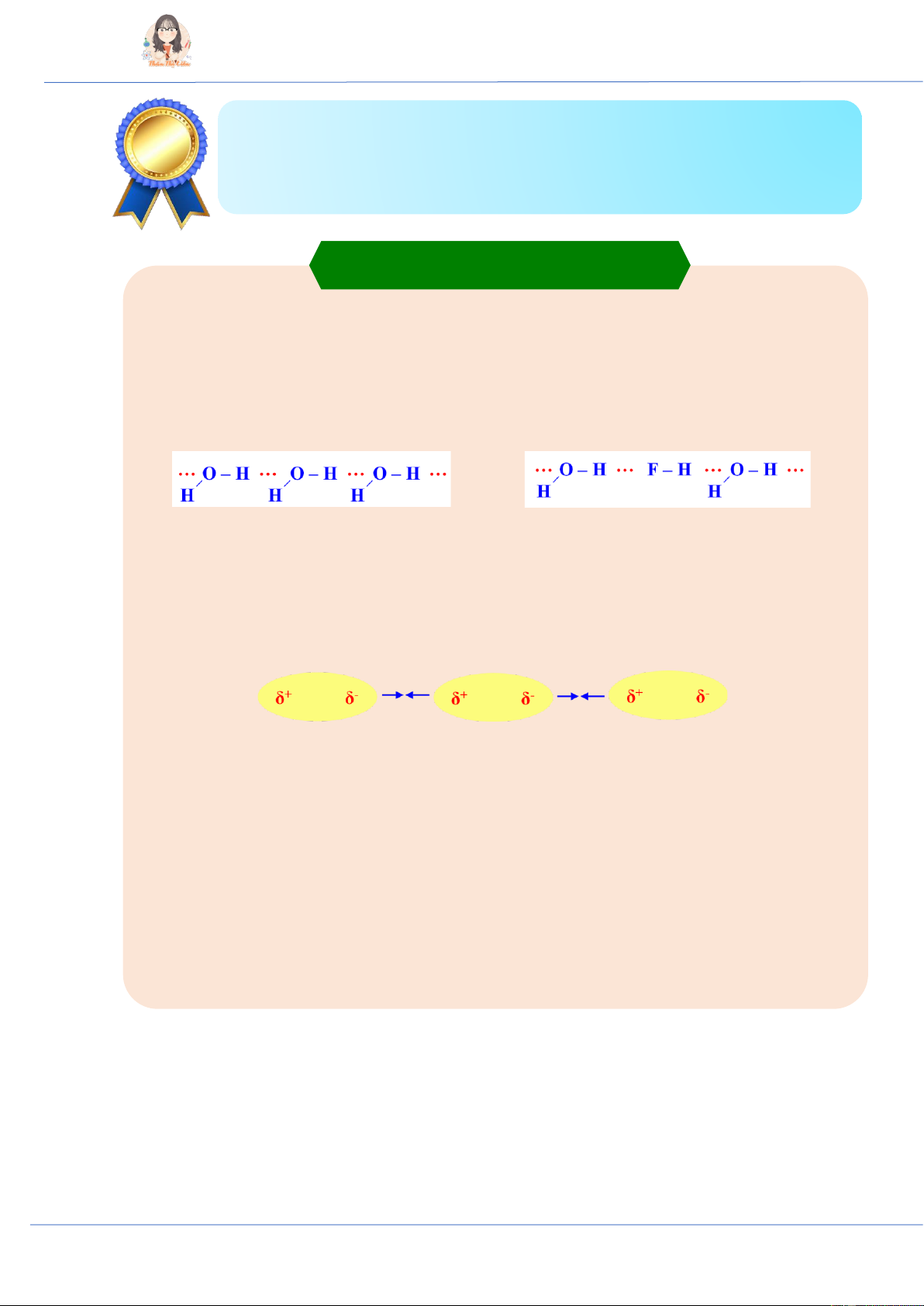
II. Độ âm điện và liên kết hóa học
♦ Liên kết cộng hóa trị không phân cực (không cực) là liên kết cộng hóa trị trong đó cặp electron
dùng chung không lệch về nguyên tử nào.
♦ Liên kết cộng hóa trị phân cực (có cực) là liên kết cộng hóa trị trong đó cặp electron dùng
chung lệch về phía nguyên tử có độ âm điện lớn hơn.
Hiệu độ âm điện (Δχ) 0 ≤ Δχ < 0,4 0,4 ≤ Δχ < 1,7 Δχ ≥ 1,7 Loại liên kết
Cộng hóa trị không phân cực Cộng hóa trị phân cực ion phi kim – phi kim phi kim – phi kim kim loại – Thông thường (giống nhau) (khác nhau) phi kim
III. Liên kết sigma (σ) và liên kết pi (π) Liên kết sigma (σ) Liên kết pi (π)
Liên kết đơn – đôi - ba
- Hình thành do sự xen phủ trục của
- Hình thành do sự xen phủ - Liên kết đơn: 1 σ hai AO. bên của hai AO.
- Liên kết đôi: 1 σ + 1 π
- Liên kết ba: 1 σ + 2 π - Liên kết σ bền vững hơn liên kết π.
IV. Năng lượng liên kết cộng hóa trị
- Năng lượng liên kết (Eb) là năng lượng cần thiết để phá vỡ một liên kết hóa học trong phân tử
ở thể khí thành các nguyên tử ở thể khí. Năng lượng liên kết đặc trưng cho độ bền liên kết. 18
Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé! CĐ4
LIÊN KẾT HYDROGEN VÀ
TƯƠNG TÁC VAN DER WAALS
KIẾN THỨC CẦN NHỚ
I. Liên kết hydrogen
♦ Khái niệm: Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H linh
động (đã liên kết với một nguyên tử có độ âm điện lớn như F, O, N) với một nguyên tử khác có
độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết (hay cặp electron hóa trị riêng).
- Kí hiệu: Liên kết hydrogen được biểu diễn bằng dấu ba chấm “…”
Liên kết hydrogen giữa các phân tử H2O Liên kết hydrogen giữa phân tử H2O và HF
♦ Ảnh hưởng của liên kết hydrogen đến tính chất vật lí của nước: Liên kết hydrogen làm tăng
nhiệt độ nóng chảy và nhiệt độ sôi của nước.
♦ Các chất tạo được liên kết hydrogen với nước có khả năng tan trong nước.
II. Tương tác van der Waals
♦ Khái niệm: Tương tác van der Waals là một loại liên kết rất yếu, được hình thành do tương
tác tĩnh điện lưỡng cực – lưỡng cực giữa các phân tử (hay nguyên tử khí hiếm).
Lực tương tác van der Waals
♦ Ảnh hưởng của tương tác van der Waals đến nhiệt độ nóng chảy, nhiệt độ sôi của các chất:
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khối
lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.
♦ Yếu tố ảnh hưởng đến nhiệt độ nóng chảy, nhiệt độ sôi các chất:
(1) Khối lượng phân tử: Khối lượng phân tử càng lớn thì càng cần nhiều động năng để chuyển
động nên nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
(2) Liên kết giữa các phân tử: Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng
mạnh thì càng cần nhiều năng lượng để phá vỡ liên kết giữa chúng nên nhiệt độ nóng chảy và nhiệt độ sôi càng cao.
♦ Độ mạnh liên kết: Liên kết ion > liên kết cộng hóa trị > liên kết hydrogen > tương tác van der Waals.
19 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694
2k7 đăng kí khóa Live Vip chinh phục 9+ hóa inbox cho Cô nhé!
CHUYÊN ĐỀ 5: PHẢN ỨNG OXI HÓA – KHỬ CĐ1
PHẢN ỨNG OXI HÓA – KHỬ
KIẾN THỨC CẦN NHỚ I. Số oxi hóa
♦ Khái niệm: Số oxi hóa của một nguyên tử trong phân tử là điện tích của nguyên tử nguyên tố
đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn.
♦ Qui tắc xác định số oxi hóa:
Qui tắc 1: Số oxi hóa của nguyên tử trong đơn chất bằng 0.
Qui tắc 2: Trong các hợp chất, số oxi hóa của O thường bằng -2 (trừ H2O2, Na2O2, OF2, …), số
oxi hóa của H thường bằng +1 (trừ NaH, BaH2, ..)
Qui tắc 3: Tổng số oxi hóa của các nguyên tử trong phân tử hợp chất bằng 0.
Qui tắc 4: Tổng số oxi hóa của các nguyên tử trong ion bằng điện tích của ion đó.
Qui tắc 5: Trong hợp chất, kim loại có hóa trị n thì có số oxi hóa là +n.
II. Phản ứng oxi hóa khử
♦ Chất khử là chất nhường e, có số oxi hóa tăng sau phản ứng.
Chất oxi hóa là chất nhận e, có số oxi hóa giảm sau phản ứng. KHỬ cho – O nhận
♦ Quá trình oxi hóa (sự oxi hóa) là quá trình chất khử nhường e. KHỬ tăng – O giảm
Quá trình khử (sự khử) là quá trình chất oxi hóa nhận e. CHẤT >< SỰ
♦ Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự nhường - nhận electron hay có sự
thay đổi số oxi hóa của một số nguyên tố.
III. Lập phương trình hóa học của phản ứng oxi hóa – khử
♦ Nguyên tắc: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
♦ Các bước lập phương tr
ình hóa học của phản ứng oxi hóa – khử theo phương pháp thăng bằng electron:
Bước 1: Xác định số oxi hóa của các nguyên tử thay đổi số oxi hóa ⇒ chất oxi hóa, chất khử.
Bước 2: Viết các quá trình oxi hóa, quá trình khử và cân bằng (nguyên tố trước, điện tích sau).
Bước 3: Xác định hệ số thích hợp sao cho “tổng số e nhường bằng tổng số e nhận”.
Bước 4: Điền hệ số vào phương trình, cân bằng và kiểm tra (thường đếm O hoặc H).
IV. Ý nghĩa của phản ứng oxi hóa – khử
Đốt cháy nhiên liệu
Quang hợp ở thực vật Luyện kim Pin – acquy
Ngoài ra, phản ứng oxi hóa – khử còn xảy ra khi kim loại bị han gỉ, trong các quá trình sản
xuất hóa chất hay chuyển hóa các chất trong tự nhiên, …
20 Cô Thân Thị Liên – giáo viên chuyên luyện thi THPT QG môn hóa - SĐT: 0933 555 694



