

















Preview text:
CÂU HỎI THÍ NGHIỆM HÓA HỮU CƠ Mục lục 1
Thầy Hà ...........................................................................................................................................................3 1.1
Tinh chết cyclohaxane ..............................................................................................................................3 1.2
Tinh chế một số sản phẩm rắn (benzoicd acid) ........................................................................................3 1.3
DBA 1 .......................................................................................................................................................4 1.4
Tổng hợp ethyl acetate .............................................................................................................................4 1.5
Tổng hợp aspirin .......................................................................................................................................5 1.6
DBA_2 ......................................................................................................................................................5 1.7
B – napthol da cam ...................................................................................................................................6 1.8
Tổng hợp Benzoicd acid ...........................................................................................................................6 1.9
Tổng hợp terpinol .....................................................................................................................................7 2
Cô Quỳnh Anh ................................................................................................................................................9 2.1
Tinh chế chất rắn ......................................................................................................................................9 2.2
Aspirin ....................................................................................................................................................10 2.3
Tổng hợp ethyl acetat .............................................................................................................................10 2.4
Benzoic acid ...........................................................................................................................................11 2.5
B – napthol da cam .................................................................................................................................11 2.6
DBA_1 ....................................................................................................................................................12 2.7
DBA_2 ....................................................................................................................................................13 3
Cô Viên..........................................................................................................................................................14 3.1
DBA ........................................................................................................................................................14 3.2
Ethyl acetate ...........................................................................................................................................17 3.3
Terpineol .................................................................................................................................................20 3.4
𝜷- napthol da cam ...................................................................................................................................22 3.5
Aspirin ....................................................................................................................................................25 1 3.6
Benzoic aicd ...........................................................................................................................................28 4
CLC ...............................................................................................................................................................31 4.1
B – napthol .............................................................................................................................................31 4.2
DBA_2 ....................................................................................................................................................31 4.3
Aspirin ....................................................................................................................................................32 4.4
Ethyl acetate ...........................................................................................................................................32 4.5
DBA_1 ....................................................................................................................................................33 4.6
Tinh chế chất rắn (Benzoic acid) ............................................................................................................33 4.7
Tách cyclohexane ...................................................................................................................................34 4.8
Benzoic acid ...........................................................................................................................................34 5
Câu hỏi ôn tập ...............................................................................................................................................36 6
Đề thi thử - 1 .................................................................................................................................................39 7
Đề thi thử - 2 .................................................................................................................................................44 2 1 Thầy Hà
1.1 Tinh chết cyclohaxane
1. Có thể thay Na2CO3 bằng NaOH được không
→ được do NaOH không phản ứng với cyclohaxane
2. Tại sao sau một khoảng thời gian nhiệt độ thay đổi thất thường
→ do không còn pha hơi, chưng cất ngưng
3. Tại sao thu phân đoạn nhỏ hơn 84℃
→ vì phân đoạn điểm đẳng phí của acid axetic và cyclohxane đi ra đầu tiên, mà Ts của cyclohexane là 80℃
< 84 ℃ nên chứa cyclohexane
1.2 Tinh chế một số sản phẩm rắn (benzoicd acid)
1. Tại sao phễu bị cục
→ tránh kết tinh trên phễu lọc
2. Không để bình tam giác lên bếp ngay
→ benzoicd acid thăng hoa được 3. Vì sao đổ nước dư
→ để dung dịch dưới bảo hòa, để không kết tinh trong giấy lọc
4. Tại sao chờ nguội mới thêm than hoạt tính
→ tạo bọt giống đá bọt
5. Vì sao không thêm than nhiều
→ hấp phụ luôn cả sản phẩm
6. Không đổ dung dịch lọc cao hơn thành giấy lọc
→ nguội kết tinh lên thành 7. Cô cạn tới mức nào
→ có tinh thể xuất hiện, nhấc nhẹ lên xem có tinh thể nhỏ hoặc đục 3 1.3 DBA 1
1. Tại sao dùng 2 dung môi enthanol và nước
→ dung mội 1 là dung môi hòa tan hoàn toàn chất rắn: ethanol ,dung môi 2 là dung môi không hòa tan chất rắn: nước
2. Tại sao không dùng dư tác chất
→ xảy ra phản ứng phụ: ngưng tự adol của acetone, phản ứng Cannizarro của benzaldehyde
3. Tại sao tách hỗn hợp tác chất và xúc tác làm 2 bình
→ nếu bỏ đồng thời thì acetone sẻ tự andol hóa, benzaldehyde tự oxi hóa
4. Tại sao chia 2 lần phản ứng mỗi lần ½
→ dễ kiểm soát tránh phản ứng phụ
5. Tại sao bước phân tán dùng nước
→ rửa NaOH bám lên sản phẩm
6. Tại sao phải làm lạnh bình chứa acetone → vì acetone dễ bay hơi
1.4 Tổng hợp ethyl acetate
1. Sau este hóa bình phản ứng có mấy chất → 5 chất
2. Làm nguội để làm gì
→ tránh sản phẩm bay hơi, để chưng cất có hiệu quả
3. Trong acid cacboxylic, anhydride, acyl cloride chất nào este hóa yếu nhất → acid cacboxylic
4. Thực tế trong giai đoạn chưng cất đầu tiên thu được gì
→ lý thuyết là loại được nước, acid acetic, H2SO4 đặc, nhưng thực tế chỉ loại được H2SO4 đặc do (Ts cao hơn nước và acid acetic) 5. Rửa để làm gì 4 → loại acid acetic 6. Làm khan để làm gì → loại nước
7. Chưng cất giai đoạn 2 để làm gì → loại 1 phần ethanol
8. Tại sao thu phân đoạn < 72 ℃ → hỗn hợp đẳng phí
9. Sản phẩm sau làm khan với sản phẩm cuối khác nhau chỗ nào
→ sản phẩm sau làm khan nhiều ethanol hơn sản phẩm cuối
1.5 Tổng hợp aspirin
1. Este hóa bài này khác este hóa bài ethyl acetate chỗ nào
→ là phản ứng của anhydride và acid salicylic 2. Tại sao dùng anhydride
→ do phenol este hóa yếu hơn rượu
3. Tại sao phản ứng tạo 60 – 75 ℃
→ do liê kết este dễ bị gãy, sản phẩm thủy phân thành acid acetic và salicylic acid mà 2 chất này không phản
ứng với nhau, bị mất luôn sản phẩm
4. Tại sao phải khuấy 5 phút
→ để phản ứng thủy phân anhydride xảy ra hoàn toàn
5. Dùng 60 ml nước để làm gì
→ rửa H2SO4 va acid axetic
6. Còn anhydride dư thì làm sao
→ bị thủy phân trong nước thành aicd axetic nên cũng bị rửa đi 1.6 DBA_2 1. Thêm cồn tới khi nào 5 → dung dịch vừa trong
2. Thêm ít hay nhiều cồn, nếu quá nhiều thì làm gì
→ thêm ít cồn đến khi dung dịch vừa trong, nếu quá nhiều cô cạn đến khi nhấc lên thấy mãng tinh thể
3. Làm nguội đến khi nào
→ xuất hiện tinh thể đầu tiên
1.7 B – napthol da cam
1. Có bao nhiêu phản ứng xảy ra tên của chúng
→ 4, diazoni hóa, ghép đôi azo, thế điện tử, điện ly
2. Tại sao phản ứng 0 – 5 ℃
→ sản phẩm không bền nhiệt
3. Tại sao hòa tan B – napthol bằng NaOH
→ vì không tan trong nước 4. Tại sao pH 9 -10
→ bé hơn sản phẩm bị phân hủy, lớn hơn muối diazoni không bền trong môi trường kiềm 5. Thêm NaCl để làm gì
→ tăng ion Na+ để cân bằng điện ly dịch chuyển theo chiều nghịch
1.8 Tổng hợp Benzoicd acid 1. Phản ứng loại gì
→ phản ứng oxi hóa khử
2. Dung dịch có màu hồng là do → KMnO4
3. Tại sao lọc lần 1 lấy pha lỏng
→ vì sản phẩm muối (C6H5COOK) tan trong nước 4. Dùng HCl để làm gì
→ để hoàn lưu ra benzoic acid 6
5. Dùng ethanol để làm gì → khử màu KMnO4
6. Vì sao lọc lần 2 dùng nước lạnh
→ vì benzoic aicd tan trong nước lạnh
7. Phản ứng dị thể hay đồng thể
→ dị thể 2 pha lỏng không tan lẫn 8. Khuấy để làm gì → để hai pha tiếp xúc
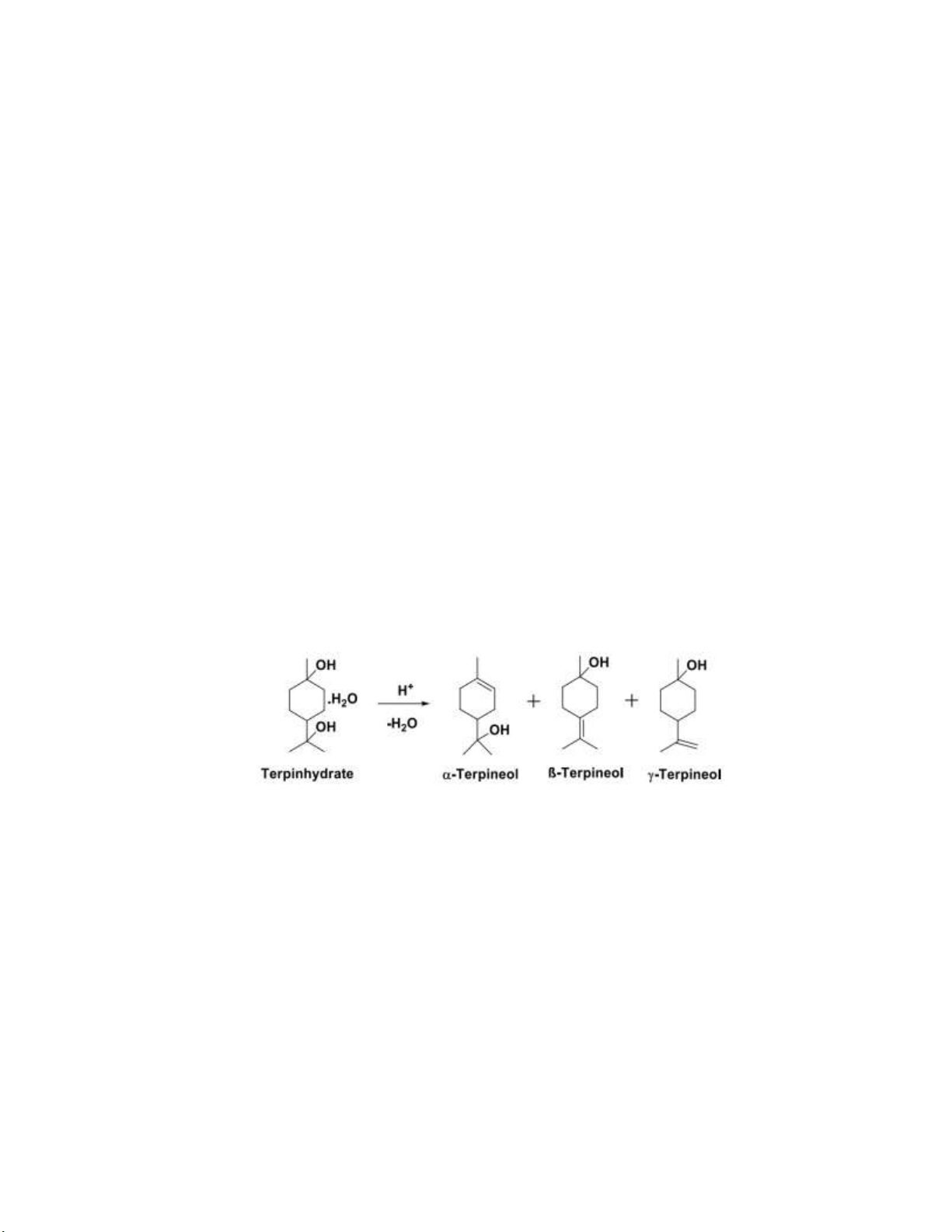
1.9 Tổng hợp terpinol
1. So sánh điều kiện phản ứng dehydrate hóa của terpin hydrate với ethanol
→ điều kiện tách nước của terpin hydrate êm diệu hơn do là rượu bậc 3 dễ tác nước hơn
2. Vì sao bỏ bước rửa 2 lần với nước
→ sản phẩm terpinol có khả năng phân tán tốt trong nước chứa H2SO4, có thể làm thất thoát sản phẩm, ngoiaf
ra chưng cất lôi cuôn hơi nước cũng đóng vai trò rửa H2SO4 3.
Vì sao terpinol phân tán được trong nước lẫn H2SO4
→ vì terpinol có khối lượng riêng gần với nước và có nhóm OH nến có ái lực với nước, có cấu trúc gần giống
chất hoạt động bề mặt
4. Thành phần của lớp ván dầu
→ hỗn hợp các polymers sản phẩm khi terpinol trùng hợp
5. Nếu chưng cất liên tục dung dịch vẫn chưa hết đục
→ do lớp polymers phân tán vào nước, không bị hơi nước lôi cuốn
6. Hỗn hợp tạo thành có dạng gì, cách khắc phục nhược điểm của hỗn hợp, vì sao
→ hỗn hợp nhũ tương terpinol – nước, khó tách và thu hồi sản phẩm, dùng dung dịch NaCl bão hòa để phá nhũ
vì NaCl làm tăng tỉ trọng của nước, làm terpinol tách ra 7.
Vì sao bước chưng cất lôi cuốn hơi nước có thể đóng vai trò là bước rửa H2SO4 7
→ vì hơi nước chỉ lôi cuốn terpinol ra khỏi dung dịch mà không lôi cuốn H2SO4
8. Vai trò của ống thủy tinh dài trong bình đun nước
→ đảm bảo an toàn vì tự điều chỉnh áp suất, nếu áo suất trong bình quá cao, cột nước sẻ được đẩy lên cao
9. Vì sao phải làm nguội hệ thông sau phản ứng dehydrate hóa
→ hạn chế bay hơi nước vì nước bay hơi sẻ lôi kéo sản phẩm 8 2 Cô Quỳnh Anh
2.1 Tinh chế chất rắn
1. Tại sao phải đánh dấu thể tích dung môi
→ có mốc ban đầu để kiểm soát được quá trình cô cạn, xác định được thời điểm dung dịch đạt bảo hòa để đảm
bảo nồng độ thích hợp cho kết tinh tránh pha loãng quá (khó kết tinh) hoặc cô cạn quá làm mất sản phẩm
2. Tại sao thêm 20 – 30 ml nước sôi
→ dung môi đang sôi giúp benzoic aicd tan hoàn toàn và lượng vừa đủ để pha lonagx dung dịch tạo thuận lợi
cho kết tinh khi làm nguội tránh cho dung dịch kết tinh sớm
3. Vai trò của than hoạt tính
→ than hoạt tính không thm gia phả ứng, giúp hấp phụ tạp chất có màu và vi tạp hữu cơ, làm tinh thể benzoic
acid trắng và sạch tạp chất
4. Tại sao phải dừng sự sôi trước khi thêm AC vào
→ vì AC có tính bề mặt xốp, khi cho vào đung dich đang sôi dễ trào, bắn mẫu, gây nguy hiểm và mất mát
5. Tại sao phải kiểm soát lượng AC
→ dùng vừa đủ nếu quá ít thì khử màu kém, thừa hấp phụ luôn cả sản phẩm
6. Tại sao phải gia nhiệt lại dung dịch thêm 5 phút
→ để than hoạt tính đạt cân bằng hấp phụ, hấp phụ màu triệt để, chuyển động nhiệt giúp than không bị vón cục
7. Điều gì xảy ra khi thực hiện quá trình lọc ở nhiệt độ thấp
→ tránh dung dịch bị nguội đột ngột, làm kết tinh sớm trong phễu/ giấy lọc, gấy tắc và mất mẫu → giảm hiệu suất
8. Tại sao phải sử dụng phễu không cuống/ cuống ngắn
→ cuống dài giữ dung dịch nóng lâu trong ống hẹp gây nguội hanh và kết tinh trong cuống, phễu không cuốn/
cuống ngắn giúp giảm vùng nguội, tránh tắc nghẽn và cho dòng chảy mạnh
9. Tại sao phải rửa giấy lọc với nước nóng
→ giúp benzoic acid không kết tinh sớm trên giấy lọc, nước nóng làm hòa tan và rửa trôi phần acid benzoic còn
sót trên giấy lọc, tránh làm thay đổi đột ngột nhiệt độ dung dịch lọc 9 2.2 Aspirin
1. Thay vì dùng anhydide axetc có thể dùng acid axetic được không
→ không, do phản ứng tạo aspirin là phản ứng thuận nghịch nên không thể tạo sản phẩm 100%, nếu dùng thì
hầu như không thu được sản phẩm do phản ứng yếu hơn
Ta có thể dùng acyl clodride, vì đều cung cấp CH3COO- , tuy nhiên acyl clodride tạo ra HCl làm sản phẩm phụ
2. Giai đoạn phân tán 60 ml nước để làm gì
→ loại acid acetic và acetic anhydride dư để dùng phản ứng, đồng thời giúp aspirin ít tan trong nước kết tinh, tách khỏi hôn hợp
3. Tại sao phải kết tinh 2 dung môi mà không phải 1 dung môi
→ vì không có dung môi nào có thể đáp ứng yêu cầu tan tốt ở nhiệt độ cao và tan kém ở nhiệt độ thấp , dùng
ethanol để hòa tan aspirin và tạp chất, dunhf nước để giúp aspirin kết tinh và hòa tan các tạp chất còn lại
4. Tại sao hòa tan lại đun cách thủy
→ để cung cấp nhiêt nhẹ và đều, tránh nhiệt cao làm phân hủy aspirin và an toàn đối với các dung môi dễ cháy như ethanol
5. Sản phẩm cuối kết tinh chưa, có lẫn gì không, nếu có là chất gì, dùng gì để nhận biết
→ sản phẩm chưa hoàn toàn kết tinh, tạp chất có thể là salicylic aicd và acetic acid, dùng mắt nếu lẫn vàng có
tạp chất (aspirin: màu trắng), FeCl3 tạo màu tím → có lẫn salicylic aicd
2.3 Tổng hợp ethyl acetat
1. Có thể Na2CO3 bằng NaOH được không
→ có thể, nhưng rất không nên vì NaOH là bazo mạnh phân hủy sản phẩm
2. Có thể thay Na2SO4 bằng
Có thể thay Na2SO4 = CaCl2 khan, MgSO4 khan
3. Dùng sinh hàn không khí được không, vì sao
→ không, vì ethyl acetat và ethanol có Ts thấp đẽ bay hơi, khó ngưng tụ → dùng sinh hàn nước
4. Vì sao không dùng nhiệt kế khi đun sôi hồi lưu
→ vì đun sôi hồi lưu cần duy trì nhiệt độ sôi ổn định không cần xác định nhiệt độ 10
5. Thay sinh hàn thẳng bằng sinh hàn bầu được không
→ không nên, vì sinh hàn bầu nằm ngang khó chảy chất lỏng xuống, dễ đọng lại
6. Tại sao phải có thau đá
→ hạn chế bay hơi thất thoát sp 2.4 Benzoic acid
1. Vai trò của KMnO4, có thể thay bằng chất khác được không
→ có vai trò là chất oxi hóa mạnh, có thể thay = K2Cr2O7, Na2Cr2O7 2. 70 ml dùng để làm gì
→ hòa tan phần rắn còn sót lại, giúp phản ứng xảy ra hoàn toàn, và sản phẩm dễ tách ra
3. Benzyl ancohol dùng để làm gì có thể thay bằng chất khác được không
→ để tạo nguồn cacbon để tạo benzoic aicd, có thể thay bằng toluene hay benzaldehyde 4. Thử màu để làm gì
→ kiểm tra sự tồn tại của KMnO4 5. Lọc nóng để làm gì
→ Loại bỏ cặn MnO2 Sinh ra do nó không tan, lọc nguội có thể muối có thể kết tinh cùng MnO2 gấy mất sản phẩm 6. Cô đặc để làm gì
→ tăng nồng độ của benzoic acid, nguội dễ kết tinh
7. Thêm Hcl để làm gì có thể tha bằng H2SO4 HNO3 đđ có được không
→ không có thể phân hủy hoặc sunful hóa nitro hóa cùng vòng benzen
2.5 B – napthol da cam
1. NaOH 5% để làm gì? Tạo môi trường gì?
→ Để hòa tan B-naphthol tạo Ion naphtholate. Tạo môi trường base nhẹ giúp quá trình tạo muối naphtholate thuận lợi.
2. Dùng đá muối để làm gì? Sao phải làm lạnh ở 0°C? 11
→ Để tạo hỗn hợp lạnh sâu dưới 0℃. Từ đó, giữ nhiệt độ thấp cho phản ứng diazoni hóa vì muối diazoni dễ phân hủy khi nóng.
3. Môi trường phản ứng diazoni hóa là gì?
→ Môi trường acid mạnh (HCl loãng) + nhiệt độ thấp (0 - 5℃)
4. Becher chứa muối diazoni và naphtholate thì cho cốc nào vào cốc nào?
→ Cho dung dịch diazoni vào naphtholate để kiểm soát tốc độ phản ứng ghép azo, tránh phân hủy muối diazoni. 5. 5g NaCl để làm gì?
→ Để muối hóa, giảm độ tan sản phẩm trong nước.
6. Rửa bằng 5ml nước lạnh để làm gì?
→ Để loại bỏ tạp chất tan trong nước, dùng nước lạnh để không làm tan sản phẩm.
7. Sản phẩm thu được có lẫn tạp chất không? Hiệu suất là bao nhiêu? Cách tinh chế tiếp?
→ Sản phẩm có lẫn tạp chất NaCl, ...,hiệu suất lớn hơn 100% do có lẫn tạp chất. Tinh chế: Rửa lại bằng nước lạnh. 2.6 DBA_1
1. Dùng 3,5g NaOH mục đích gì?
→ Được dùng làm xúc tác base để tạo enolate từ aceton và giúp phản ứng ngưng tụ aldol xảy ra, tạo ra DBA.
2. 35ml nước để làm gì?
→ Để hòa tan NaOH và tạo môi trường base giúp phản ứng xảy ra dễ dàng và kiểm soát nhiệt khi khuấy trộn. 3. 28ml EtOH để làm gì?
→ Để làm dung môi giúp hòa tan benzaldehyde và aceton tốt hơn, đồng thời tạo môi trường thuận lợi cho phản
ứng ngưng tụ xảy ra đều và nhanh.
4. Cách hạn chế phản ứng phụ?
→ Kiểm soát nhiệt độ 20 – 25℃ để tránh ngưng tụ aceton và nhựa hóa benzaldehyde. +
Dùng lượng NaOH vừa đủ và cho vào từ từ để tránh phản ứng phụ. +
Dùng benzaldehyde dư nhẹ để giảm tự ngưng tụ aceton. +
Pha loãng bằng ethanol để phản ứng diễn ra đều. 12
5. Nước dùng để làm gì ở bước rửa? Tăng giảm nước ảnh hưởng như thế nào?
→ Nước dùng để rửa nhằm loại bỏ NaOH dư và các tạp chất tan trong nước. +
Tăng nước: rửa sạch hơn nhưng lâu lọc, có thể mất sản phẩm. +
Giảm nước: rửa không sạch, sản phẩm lẫn tạp và màu xấu. 2.7 DBA_2
1. Tại sao phải đun cách thủy?
→ Do cồn cực kỳ dễ cháy gây nguy cơ cháy nổ ở nhiệt độ cao. Đồng thời giúp giảm nguy cơ phân hủy DBA.
2. Tại sao lại kết tinh trong erlen thay vì becher?
→ Vì erlen có miệng nhỏ, giúp giảm bay hơi và tránh tạp chất rơi vào, thành nghiêng của bình giúp tinh thể ít
bám thành, kết tinh đẹp và dễ thu hồi, đồng thời an toàn khi đun và xoay.
3. Tại sao dùng cồn nóng? Tăng hay giảm lượng cồn ảnh hưởng gì?
→ Vì DBA tan tốt trong cồn nóng và tan kém trong cồn lạnh. +
Nếu ít cồn: DBA không tan hết, dung dịch còn cặn → kết tinh kém sạch, hiệu suất thấp. +
Nếu dùng nhiều cồn: DBA tan tốt, khi nguội sẽ kết tinh ít hoặc không kết tinh.
4. Tại sao rửa bằng cồn lạnh?
→ Cồn lạnh thì làm DBA tan kém, rửa sẽ hạn chế mất sản phẩm, chỉ cuốn trôi tạp chất.
5. DBA thu được tinh khiết chưa? Nếu chưa phải làm gì?
→ DBA chưa hoàn toàn tinh khiết.Muốn tinh khiết cao hơn → Cần kết tinh lại thêm. 13 3 Cô Viên 3.1 DBA
Dibenzyllidencacetone hay còn được biết với tên thượng mại là dibenzalacetone (DBA). Có nhiệt độ nóng chảy từ 107oC – 113oC
DBA là một chất rắn màu vàng nhạt hoặc không tan trong nước, tan tốt trong n – hexane, toluene, benzene và
tan vừa phải trong C2H5OH, CH3COOC2H5. Trong công nghiệp cũng như phòng thí nghiệm DBA được điều
chế từ phản ứng ngưng tụ Claisen – Schmidt giữa benzaldehyde và acetone với xúc là NaOH. Phần lớn DBA
tạo thành ở dạng đồng phần trans. Bên cạnh sản phẩm chính trong quá trình tổng hợp còn có một só phản ứng phụ như:
- Cannizarro của benzaldehyde
- Ngưng tụ aldol của acetone
- Sản phẩm monobenzalacetone
Lưu ý: Benzaldehyde là hợp chất kém bền trong không khí và sánh sáng. Khi lấy benzaldehyde, không để pipet
chạm đáy chai, không đưa chai ra khỏi hợp giấy và đậy chặt nắp sau khi sử dụng.
Ứng dụng: làm kem chống nắng, là 1 ligand quan trọng trong lĩnh vực hóa học cơ kim Phản ứng chính:
1. Phương pháp lấy benzaldehyde?
Benzaldehyde là một chất dễ bị oxy hóa, rất không bền trong không khí và ánh sáng. Khi lấy không để pipet
chạm đáy chai, không đưa chai ra khỏi họp giấy và đậy nắp sau khi sử dụng. Lấy nhanh chính xác, sau khi lấy
xong phải rửa bằng cồn để tránh đóng kết tủa benzoic acid khó rửa.
2. Tại sao phải dùng dung môi là hỗn hợp nước và ethanol?
- Acetone, NaOH tan vô hạn trong nước
- Benzaldehyde tan kém trong nước nhưng lại tan được trong ethanol
Sử dụng hỗn hợp H2O và Ethanol nhằm hòa tan hết tác chất ban đầu để phản ứng diễn ra tốt.
3. Tại sao phải thực hiện phản ứng 20 – 25 o 14
Phản ứng được tiến hành ở 20 – 25 oC để hạn chế hình thành sản phẩm phụ. Ở nhiệt độ cao hơn có thể xảy ra
phản ứng canizzaro và phản ứng ngưng tụ giữa hai phân tử aceton. Nếu thực hiện ở nhiệt độ thấp thì phản ứng diễn ra chậm. 4. Phản ứng phụ? - Phản ứng canizaro
- Phản ứng adol giữa các phân tử aceton
- Phản ứng tạo monobenzalacetone
5. Các phương pháp để hạn chế phản ứng phụ
- Thực hiện ở nhiệt độ 20 -25 oC
- Tỷ lệ phản ứng giữa aceton và benzaldehyde là 1:2 (đúng tỉ lệ hợp thức)
- Chia hỗn hợp thành hai phần, phản ứng ngưng tụ là tỏa nhiệt. Chia làm hai phần để dễ khống chế
nhiệt độ của phản ứng tranh hình thành sản phẩm phụ.
6. Tại sao phản hòa tan benzaldehyde và acetone vào nhau trước rồi mới cho vào hỗn hợp phản ứng?
- Khi cho lần lược các chất vào thì sẽ gây ra phản ứng phụ, các chất tự phản ứng với nhau
(benzaldehyde cannizaro hoặc acetone sẽ ngưng tụ aldol).
7. Tai sao phải phân tán sản phẩm thô bằng nước? Thay bằng Ethanol được không?
- Mục đích của việc phân tán sản phẩm vào nước để rửa các tạp chất trong sản phẩm như NaOH, acetone dư,…
- Không thay bằng cồn được do DBA tan được trong cồn, rửa bằng cồn sẽ làm mất sản phẩm.
8. Nguyên tắc chọn dung mô kết tinh lại?
- Hòa tan chất ở nhiệt độ cao
- Tan ít ở nhiệt độ thấp
- Ở nhiệt độ thấp hòa tan được chất bẩn hoặc giữ các chất bẩn kết tinh chậm hơn các chất cần kết tinh.
- Dung môi không phản ứng hóa học với chất tan, dung môi được chọn có nhiệt độ sôi thấp hơn nhiệt 15
độ nóng chảy của chất rắn khoảng 10 – 15oC
- Dung môi dễ bay hơi, rẻ tiền, dẽ kiếm, không độc
9. Tại sao kết tinh DBA lại dùng cồn ở nhiệt độ sôi?
DBA tan tốt trong cồn nóng, tan ít trong cồn lạnh, không phản ứng hóa học với cồn,
10. Tại sao kết tinh trong erlen? Thay bằng beaker được không?
Trong erlen bề mặt thoáng nhỏ hơn tránh hiện tượng bay hơi dung môi cũng như tránh bụi bay vào sản phẩm,
11. Tại sao dùng cồn lạnh để rửa?
Do DBA không tan trong cồn ở nhiệt độ thấp, dùng cồn để rửa benzaldehyde còn dư trong sản phẩm.
12. Sản phẩm có tinh khiết hay không?
Sản phâm cuối không tinh khiết do có thể lẫn sản phẩm phụ trong quá trình tổng hợp (monobenzalacetone)
13. Tại sao dung cá tử? tại sao không dùng đá bọt.
- Do phản ứng là pha rắn lỏng – dỉ thể.
- Đá bọt, chỉ được dùng để tránh hiện tượng chậm sôi
14. Phân tán sản phẩm vào 150ml nước để làm gì?
Để làm sạch DBA còn lẫn NaOH, EtOH và acetone
15. Tại sao phải chia hỗn hợp benzaldehyde và acetone ra làm 2 phần rồi cho phản ứng từ từ?
Tránh phản ứng phụ và tăng hiệu suất tổng hợp
16. Dùng toluene kết tinh lại có được không?
Không được vì DBA tan trong toluene ở nhiệt độ thường, muốn kết tính lại phải đưa về nhiệt độ âm
17. Điều kiện kết tinh lại với hệ 1 dung môi?
18. Vì sao dùng cồn lạnh rửa DBA sau khi kết tinh lại? Loại bỏ tạp chất
19. Có thể dùng nước hay methanol để tinh chế DBA hay không?
Không vì DBA tan tốt trong methanol => Giảm hiệu suất tinh chế. Còn nước không rửa được tạp chất phân cực
20. Dùng etyl acetate, propanol, nitrobenzene, pentanol thay thế cho ethanol được không? 16
Propanol thì được, etyl acetate và pentanol độ hòa tan trong nước không cao, nitrobenzene tương tự và rất độc 3.2 Ethyl acetate
Ứng dụng: Dùng làm dung môi
1. Vai trò của H2SO4 đậm đặc? Có thể thay bằng HCL đậm đặc được không?
H2SO4 có vai trò tạo môi trường H+ để phản ứng xảy ra, ngoài ra H2SO4 đặc có tính háo nước cao giúp giảm
hàm lượng nước chuyển cân bằng chuyển dịch theo chiều thuận.
Nồng độ của H2SO4 có thể đạt tới 98%, trong khi đó HCl chỉ có thể đạt tới 36.5% nên lượng nước đưa vào hệ
sẽ lớn và làm cho phản ứng diễn ra không được tốt.
2. Bước giữa đun sôi hoàn lưu và chưng cất là gì?
Sau khi đun sôi hoàn lưu, hỗn hợp phải được làm nguội vì nếu không làm nguội thì khi tháo sinh hàn chuyển
qua giai đoạn chưng cất ester sẽ bị bây hơi gay ra thất thoát sản phẩm.
3. Chưng cất lần 1 thu được dung dịch lỏng có nhiệt độ sôi nhỏ hơn 90oC gồm những gì? Tại sao
phải chưng cất lần hai?
Quá trình chưng cất lần 1 có nhiệm vụ để loại bỏ lượng H2SO4 và một phần nước ra khỏi hỗn hợp. Hốn hợp
sau chưng lần 1 sẽ có C2H5Oh, CH3COOH, CH3COOC2H5, H2O
Quá trình chưng cất lần thứ hai có nhiệm vụ loại bỏ bớt nước ra khỏi hỗn hơp thu được sản phẩm có nồng độ cao hơn
4. Dung dịch Na2CO3 10% dùng để làm gì? Tại sao không dùng Na2CO3 50% và NaOH 10%? Có thể
thay bằng chất gì?
Na2CO3 được dùng để trung hòa hỗn hợp loại acetic acid còn dư trong hỗn hợp sản phẩm.
Không thể sử dụng Na2CO3 có nồng độ lớn như 50% hay dung dịch NaOH 10% vì lúc này tạo ra môi trường
base mạnh ester có thể bị thủy phân tạo ra thành muối và alcohol ban đầu.
Có thể thay thế dung dịch Na2CO3 bằng dung dịch khác như NaHCO3 hay Na2SO3…
5. Mục đích của việc sử dụng Na2SO4 để làm gì? Có thể dùng chất gì thay thế?
Na2SO4 được dùng vào mục đích làm khô sản phẩm, giúp cho sản phẩm tinh khiết hơn giúp loại điểm đẳng phí
có thể chưng cất đến nồng độ cao hơn. 17
Có thể thay Na2SO4 bằng các tác chất làm khan khác như MgSO4, MgCl2 tuy nhiên giá thành cao. Không nên
sử dụng CaCl2 do nó sẽ tạo phức vế alcohol và ester, bên cạnh đó trên lý thuyết CaCl2 được điều chế từ Ca(OH)2
nên nó có thề còn lẫn base và làm thủy phẩn ester.
6. Hỗn hợp đẳng phí là gì cách phá điểm đẳng phí?
Hỗn hợp dẳng phí là hỗn hợp có thành phần trong pha hơi bằng với thành phần trong pha lỏng, vì thế nên không
thể tách bằng phương pháp thông thường
Có các cách phá điểm đẳng phí như: - Thêm cấu tử thứ 3
- Chưng áp suất thấp hoặc cao
- Thêm chất làm khan như Na2SO4, MgCl2, CaCl2
7. Thành phần của hỗn hợp sau phản ứng là gì?
Hỗn hợp sau phản ứng ester hóa gồm:
- Ethyl acetate, H2O, acetic acid dư, ethanol dư và H2SO4…
Chưng cất lần 1:
- Ethyl acetate, ethanol, H2O, acetic acid
Sau khi trung hòa: - Ethyl acetate, ethanol, H2O
Chưng cất lần 2:
- Hỗn hợp đẳng phí ở 71o ethyl acetate, ethanol…
Sản phẩm cuối cùng gồm có ethyl acetate và ethanol do nhiệt độ sôi ủa ethyl acetate và ethanol khá gần nhau
nên không thể tcách bằng chưng cất thông thường.
8. Tại sao khi chưng cất dùng sinh hàn thẳng và khi thực hiện phản ứng dùng sinh hàn bầu?
Trong quá trình chưng cất dùng sinh hàn ruột thẳng để sản phẩm ngưng tụ có thẩ chảy ra ngoài được.
Trong quá trình thực hiện phản ứng, do thực hiện ở nhiệt độ sôi nên hỗn hợp bay hơi mạnh cần phải dùng sung
hàn bầu để tăng diện tích truyền nhiệt giúp quá trình ngưng tụ diễn ra tốt hơn.
9. Tại sao phải để phản ứng sôi nhẹ? Muốn lấy triệt để sản phẩm thì phải làm như thế nào? 18
Để hỗn hợp phản ứng sôi nhẹ để phản ứng diễn ra theo chiều thuận – khi sôi thì có sự khuấy trộn phản ứng diễn
ra tốt hơn. Muốn lấy triệt để sản phẩm thì ta phải tiến hành chưng cất có hoàn lưu sản phẩm.
10. Có phải ống chạc 3 càng dài càng tốt đung không? Khi chưng cất, cắm nhiệt kết thế nào vào ống chặc 3?
Khi phần ống chạc 3 càng dài thì sản phẩm sinh ra sẽ càng tinh khiết tương tự như khi chưng cất số mâm càng
lớn. Tuy nhiên hỗn hợp là dẳng phỉ nên việc làm chạc 3 dài thì không tốt bên cạnh đó thì quá trình chưng sẽ tốn thời gian.
Cách gắn nhiệt kế vào ống chạc 3 là cừa qua “Ngã 3” của ống chạc 3.
11. Tại sao dùng bếp cầu mà không dùng bếp khuấy từ? có thể thay thế bằng bếp cầu bằng gì?
Bếp cầu giúp gia nhiệt đều cho hỗn hợp hơn còn bếp khuấy từ chỉ gia nhiệt từ dưới lên nên hỗn hợp sôi sẽ không đều.
12. Khi đâng chưng cất hệ thống nước làm mát sinh hàn bị cúp, xử lý như thế nào?
Chuẩn bị bình nước, đặt bình nước trên cao, lợi dụng chênh lệch áp suất để nước chảy vào ống sinh hàn.
13. Mục đích cho đá bọt vào để làm gì?
Đá bọt có nhiều lỗ xốp, bề mặt nhám giúp quá trình sối đồng đều hơn – điều hoa sự sôi.
14. Tại sao cấm nhiệt kế khi chưng cất ngay chạc ba?
Ta cần sát định nhiệt đô sôi của pha hơi để biết được thành phân trong pha hơi bay lên nên cần cắm nhiệt kế để
đo nhiệt độ sôi của hơi.
15. Các cách sử dụng sinh hàn
- Ts < 180C: dùng sinh hàn nước
- Ts > 180C: Sinh hàn không khí.
- Ts > 200C: Không dùng sinh hàn
16. Khi nào dùng đá bọt? Có thể thay thế bằng gì?
Dùng đá bọt khi đun nóng hệ lỏng đồng nhất và cần ổn định sự sôi. Có thể thay bằng đũa khuấy và cá từ.
17. Biện pháp nâng cao hiệu suất tổng hợp este?
Sử dụng H2SO4 đđ làm xúc tác, cho dư acid hoặc cồn 19
18. Vì sao gọi là quá trình rửa khi dùng soda 10%?
Vì mục đích là giữ lại 1 chất còn chất kia bỏ đi
19. Nêu các yếu tố ảnh hưởng đến quá trình chưng cất? Hỗn hợp đẳng phí là gì? Phương pháp phá điểm đẳng phí?
20. Sản phẩm sau cùng có lẫn chất gì không? Vì sao?
Sản phẩm sau cùng có lẫn ethanol vì ts của ethanol và etyl acetate bằng nhau nên không tách được bằng chưng cất
21. Cách tăng độ tinh khiết của sản phẩm?
Cho thêm nước để tách lớp hoặc dùng màng lọc nước
22. Tại sao phải loại CH3COOH và làm khan bằng Na2SO4? Phá điểm đẳng phí 3.3 Terpineol
Ứng dụng: trong dầu thơm, xà bông, thuốc diệt nấm, các sản phẩm tẩy rửa Phản ứng chính:
1. Tại sao dùng H2SO4 2.5% mà không dùng 98%? Thay bằng HCl được không?
H2SO4 98% là acid mạnh nên có thể tách hế hai nhóm alcohol của terpinhydate (không phải mục đich của thí
nghiệm). Không thể thay thế bằng HCl do, ion Cl- có tính nucleophile nên có thể thay thế vào vị trí của alcohol.
Trong khi đó ion SO42- có tính nucleophile yếu nên sẽ không cạnh tranh với quá trình tách nước.
2. Tạo sao không được lắc mạnh trong quá trình thực hiện phản ứng?
Sản phẩm tạo thành có khả năng tạo nhũ với H2O. Nên sẽ làm kho khắn cho quá chình chiếc.
3. Khi nào dùng chiết tách, ưu điểm là gì? 20

