



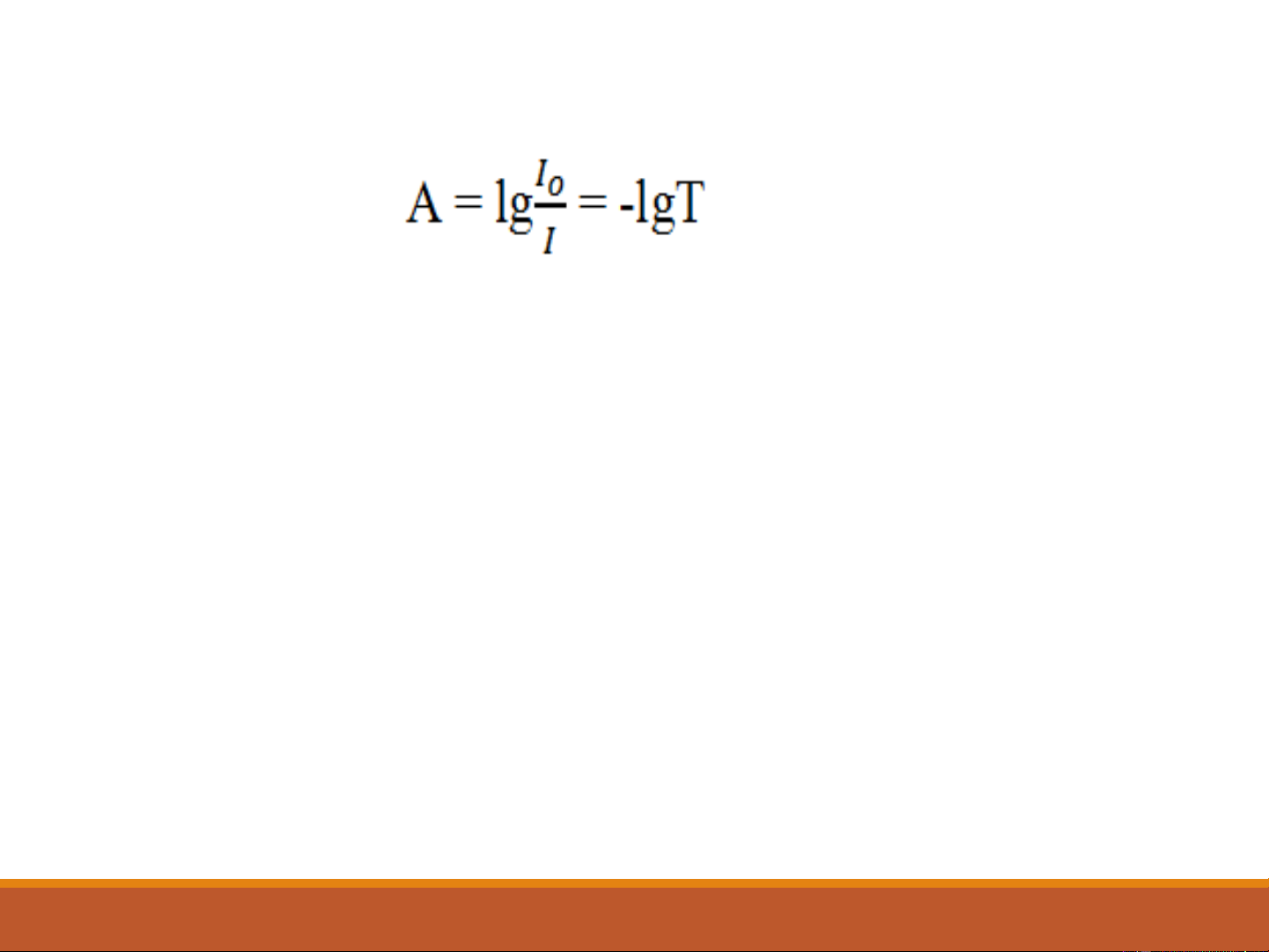




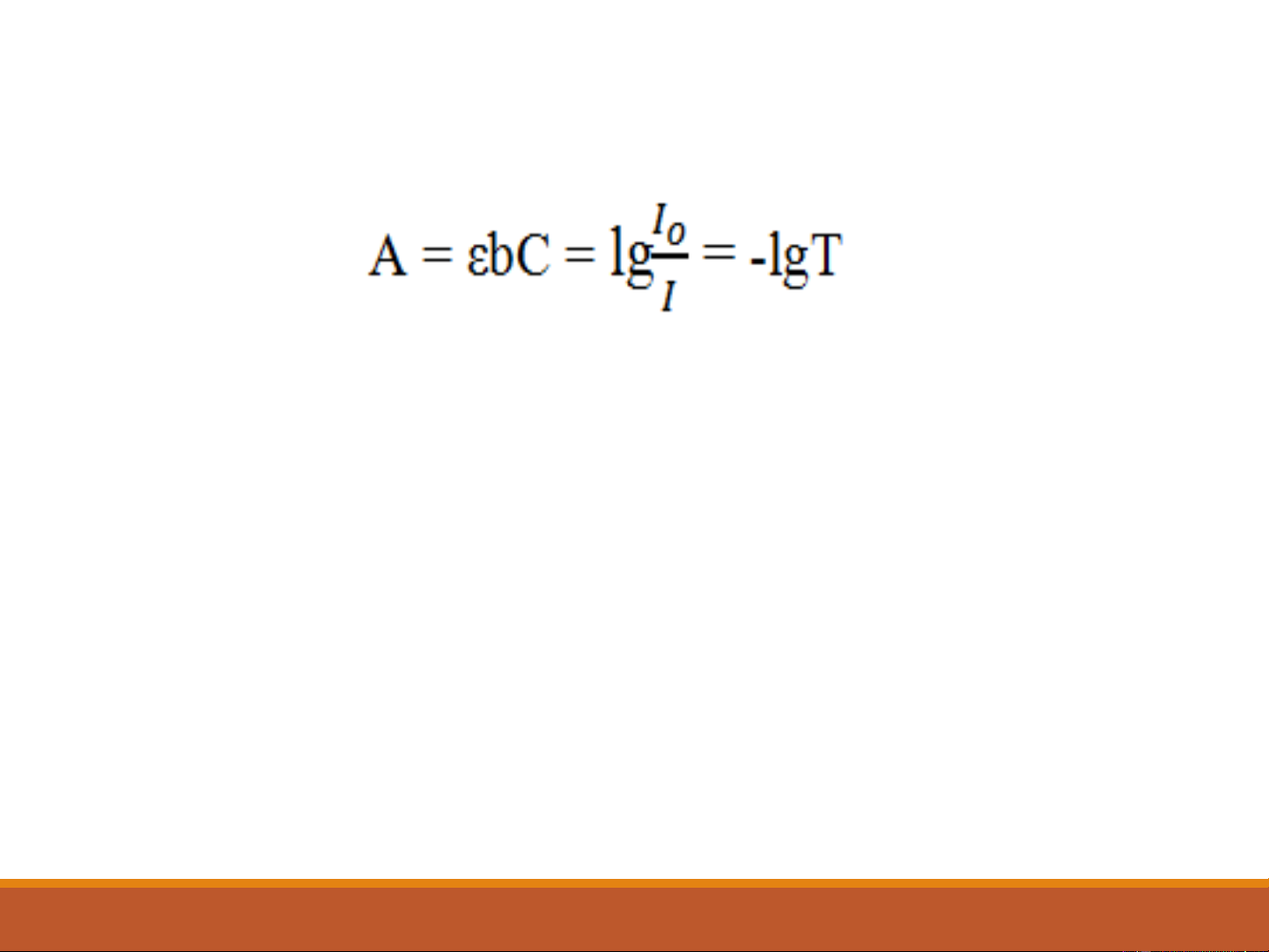

Preview text:
Chương 2
Phương pháp phổ hấp thụ phân tử
(Molecular Absorption Spectrometry)
2.1. Sự hình thành phổ phân tử
Sự hấp thụ bxđt và sự hình thành các loại phổ hấp thụ phân tử
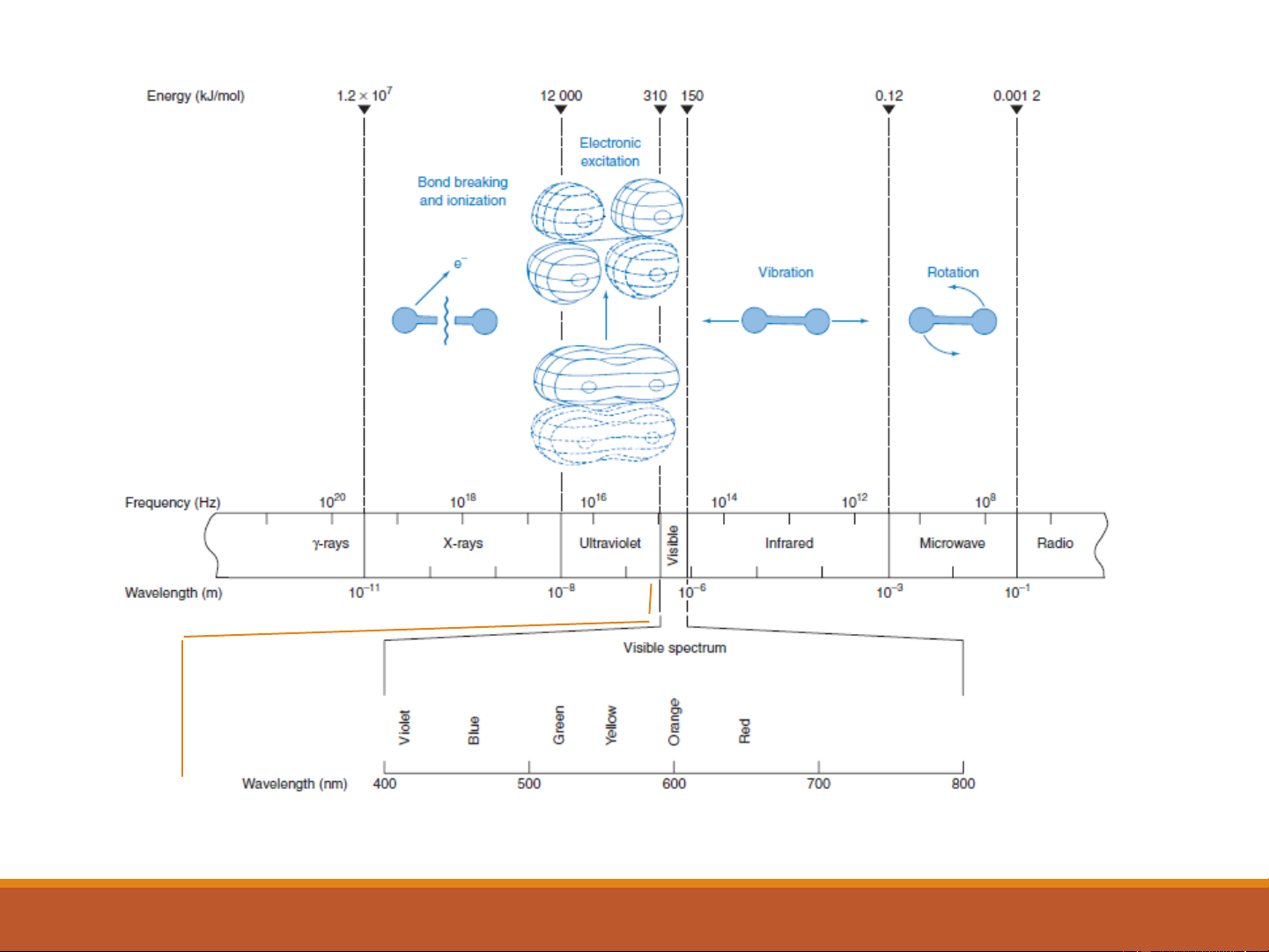
Năng lượng phân tử được lưu giữ có thể coi là tống năng
lượng lưu trữ của ba dạng: -Quay -Dao động -Điện tử E thấp + hν = Ecao
Phân tử chỉ tồn tại ở trạng thái kích thích trong khoảng thời
gian rất ngắn (10-6-10-9s) và quay trở lại trạng thái cơ bản. 2
Sự thay đổi trạng thái lượng tử của phân tử sẽ dẫn
đến sự biến thiên năng lượng ΔE của phân từ tuân
theo định luật Planck. ΔE = E – E cao thấp = hν (2-1)
Do năng lượng phân tử được lưu giữ dưới ba
dạng: quay, dao động và điện tử nên: ΔE = ΔE + ΔE quay
dao động+ ΔEđiện tử (2-2) Điện tử Quay Dao động 200 (nm) 400 (nm) 800 (nm) 4
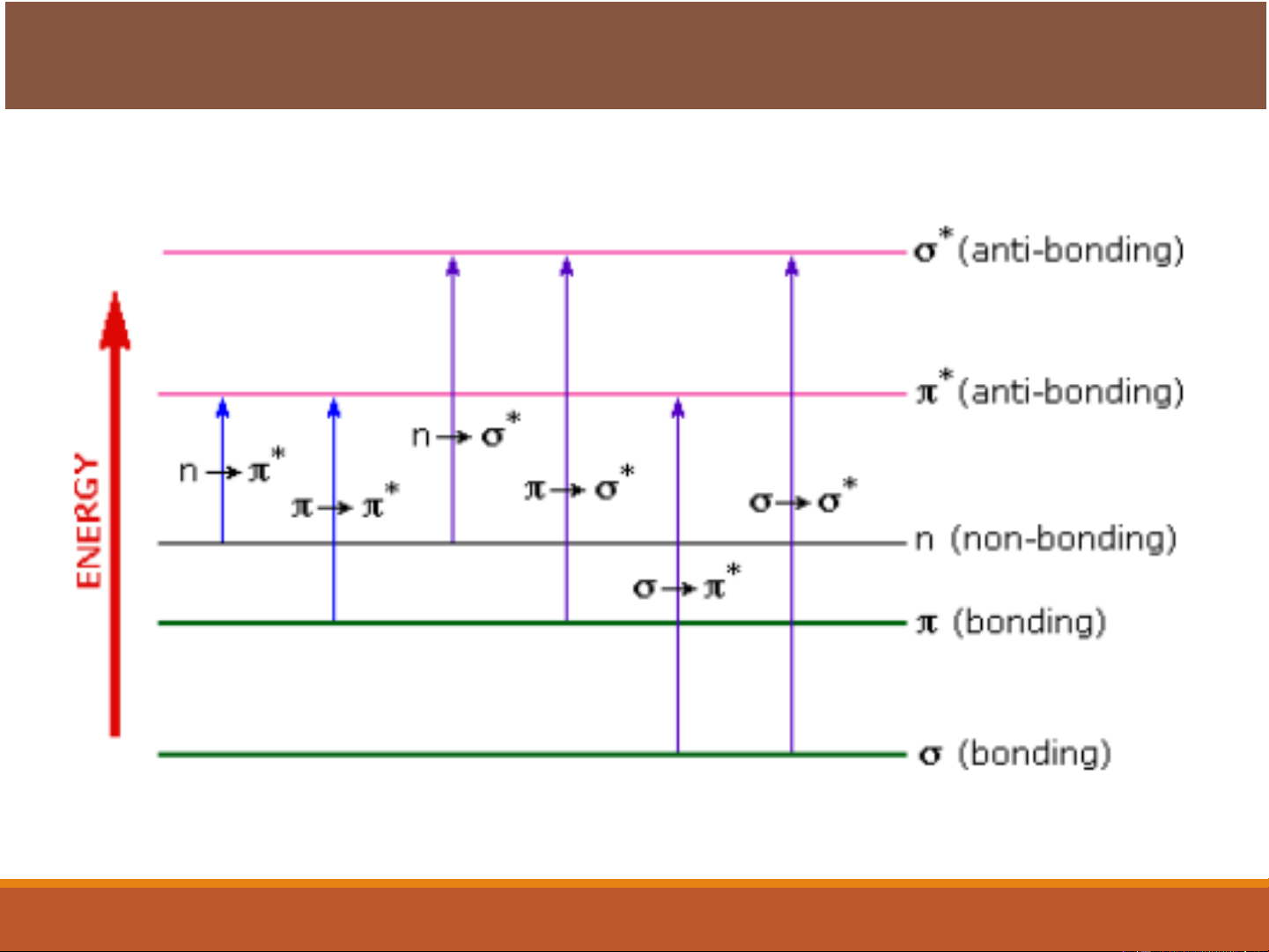
Four types of transitions are possible:
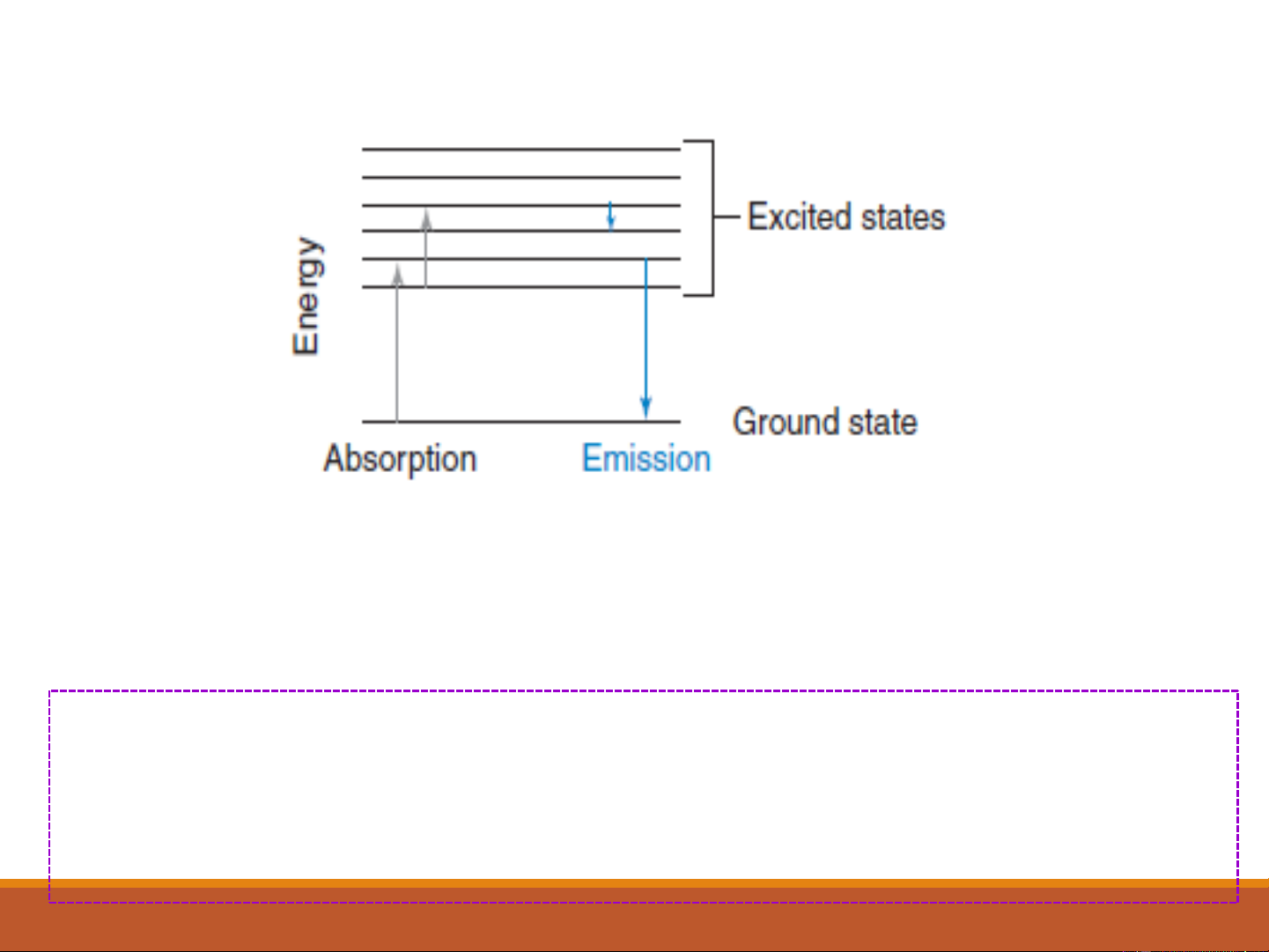
→*, n →*, n →*, and →* (Trạng thái kích thích) Năng lượng (Trạng thái cơ bản)
Quá trình phát xạ (Emission) là quá trình một phân tử
chuyển trạng thái lượng tử cao hơn sang thấp hơn và thoát ra một photon.
Quá trình hấp thụ (Absorption) là một quá trình một phân tử
chuyển từ trạng thái lượng tử thấp hơn sang cao hơn và hấp thụ một photon. 6
Sự hấp thụ bxđt và sự hình thành các loại phổ hấp thụ phân tử
Sự thay đổi trạng thái lượng tử của phân tử sẽ dẫn đến sự
biến thiên năng lượng ΔE của phân từ tuân theo định luật Planck. ΔE = E – E cao thấp = hν = hc/λ (2-1)
Do năng lượng phân tử được lưu giữ dưới ba dạng: quay,
dao động và điện tử nên: ΔE = ΔE + ΔE quay
dao động+ ΔEđiện tử (2-2)
ULTRAVIOLET/VISIBLE MOLECULAR ABSORPTION SPECTROMETRY
(Phương pháp đo quang, UV-VIS) 7
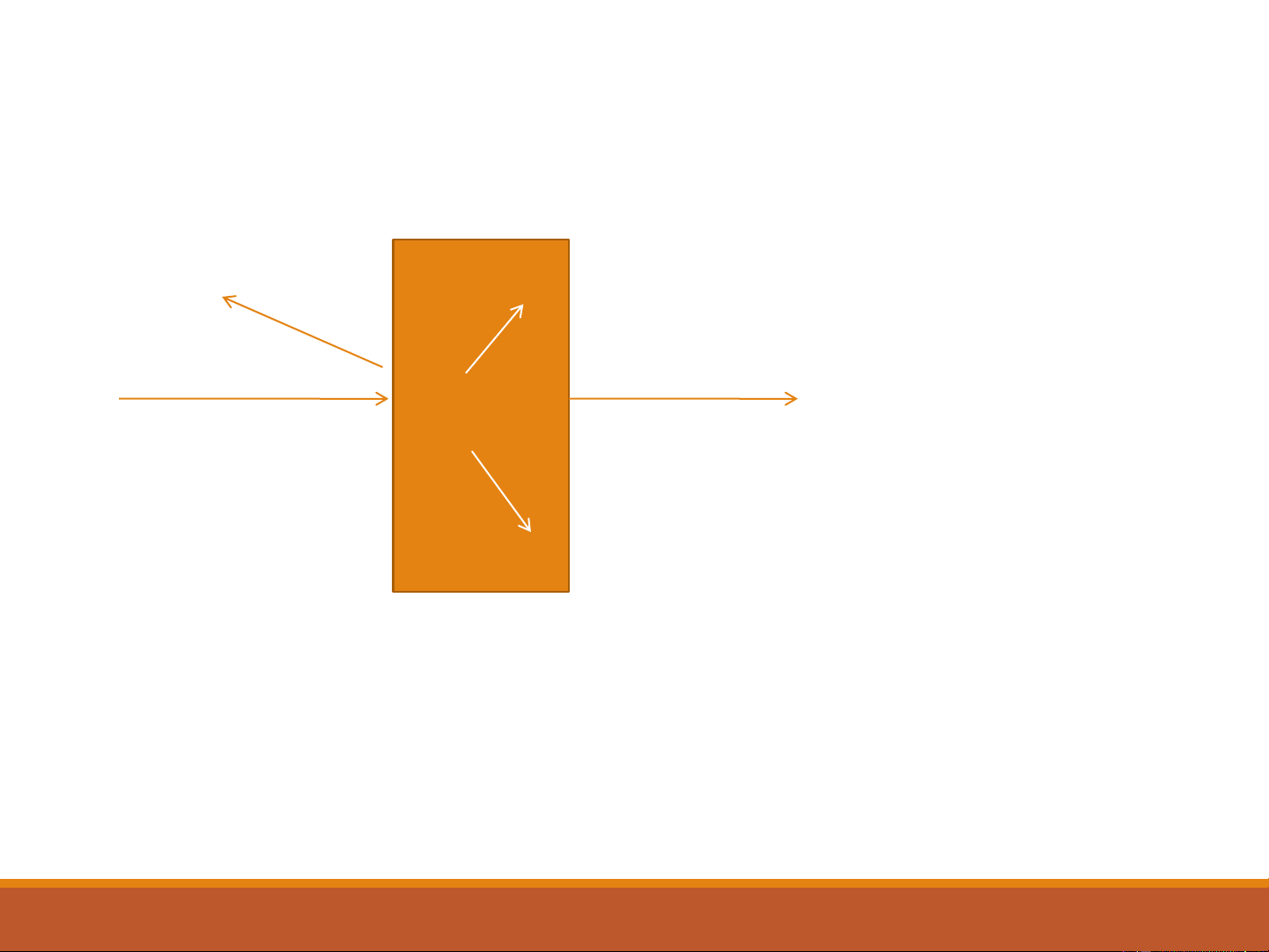
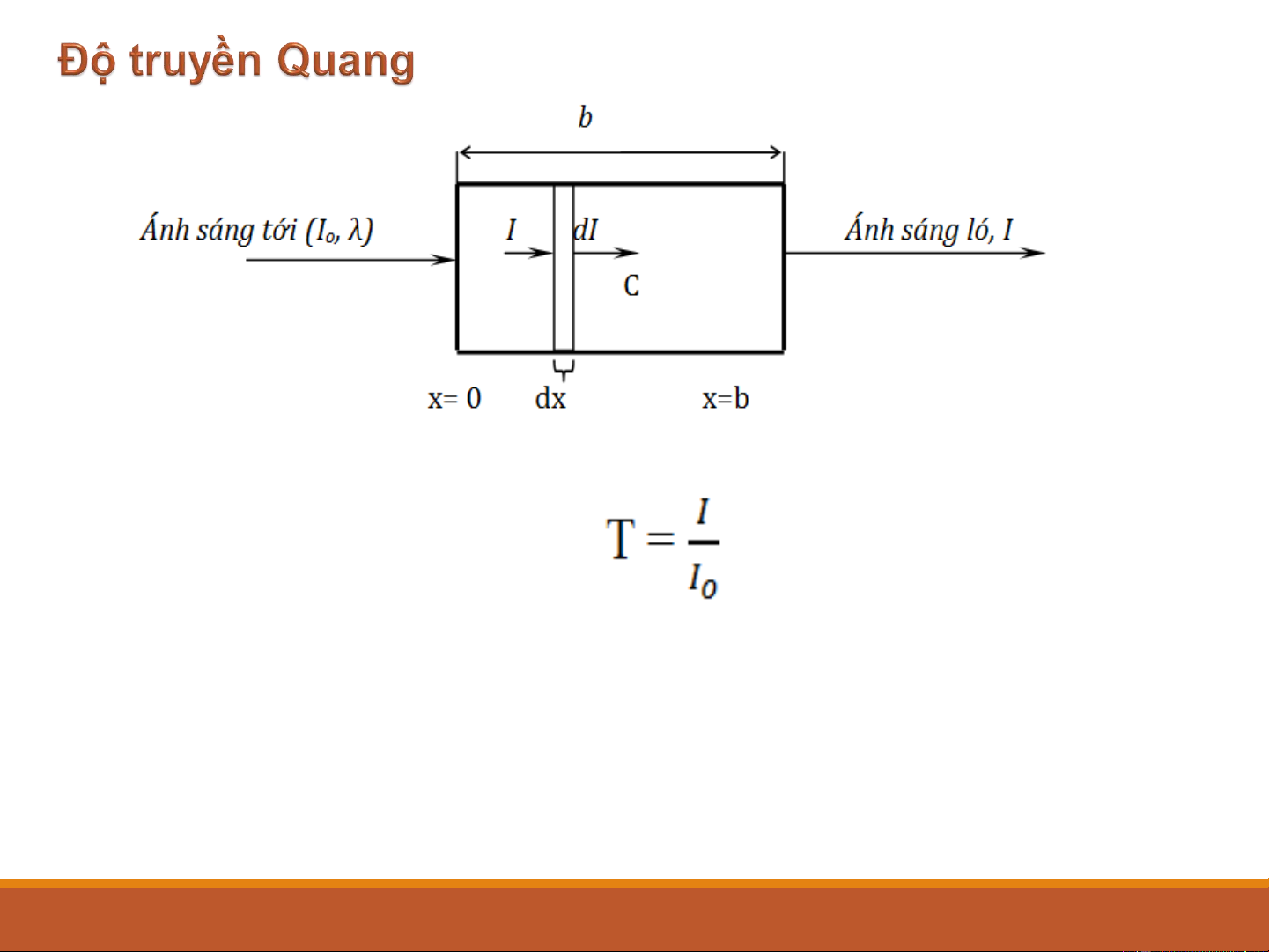
Sự hấp thụ bức xạ điện từ Phản xạ Khúc xạ
Bức xạ truyền qua; I ; λ Bức xạ tới I ; λ o Dung dịch nghiên cứu 8 Độ truyền quang T: (2-3) T nằm trong khoảng (0-1).
Phần trăm truyền quang: 100T %,
Thay đổi tương ứng từ 0-100%. 9 9
Độ hấp thụ (absorbance) (2-4)
Nếu ánh sáng không bị hấp thụ, I = I và A = 0 o
Nếu 90% ánh sáng bị hấp thụ, 10% đã được truyền quang, A = 1
Nếu chỉ có 1% ánh sáng được truyền quang, A = 2
(Độ hấp thụ A đôi khi còn gọi là mật độ quang,optical density) 10 Phổ hấp thụ 11 →* Transition
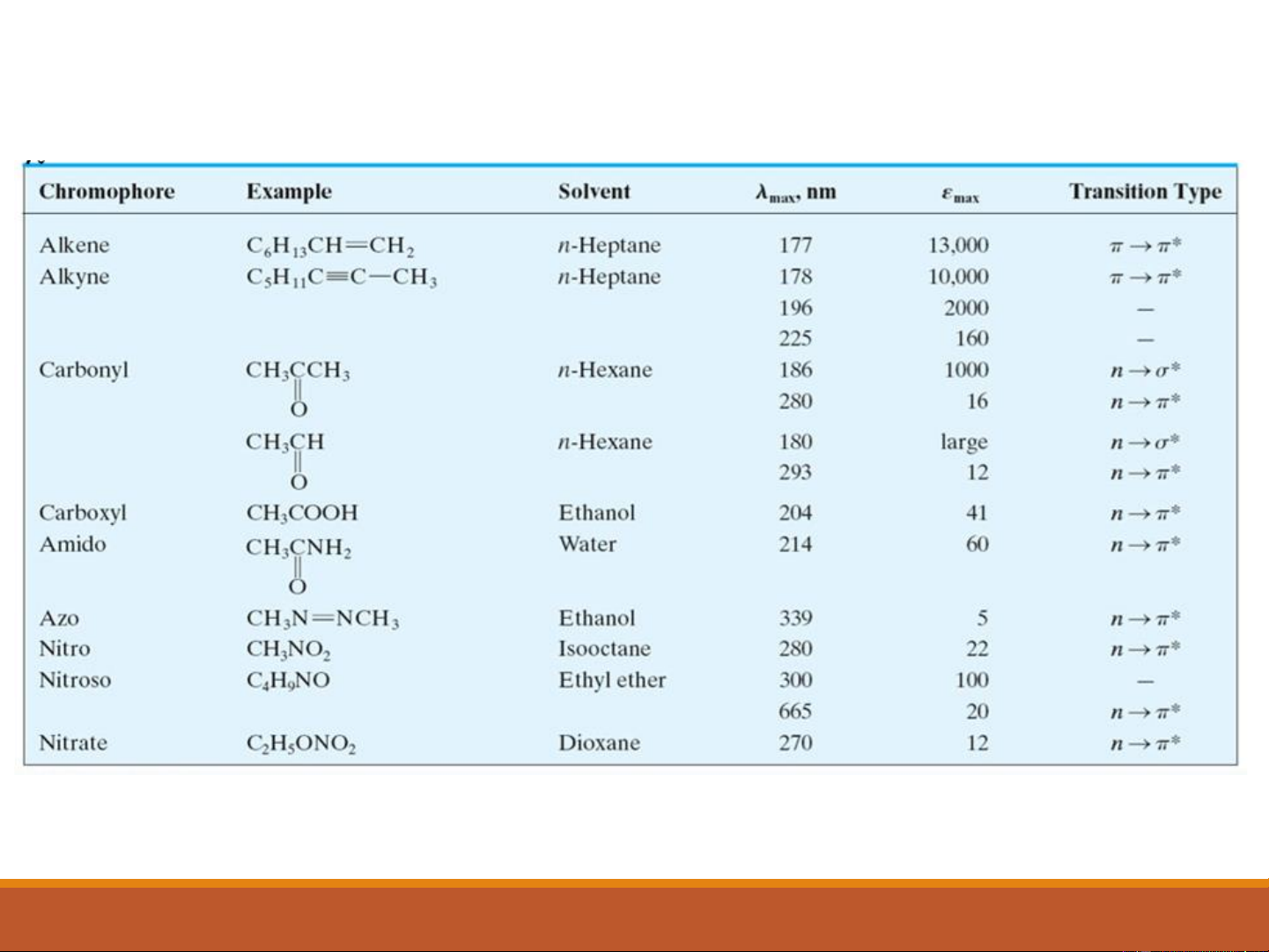
❖ The energy required to induce a →* transition is large.
❖ Methane and alkane can undergo only →* transitions,
exhibits an absorption maximum at 125 nm.
❖ Absorption maxima due to →* transitions are never
observed in the ordinarily accessible ultraviolet region. 12
n →* Transitions
❖ Saturated compounds containing atoms with unshared electrons are
capable of n →* transitions.
❖ Transitions require less energy than the →* type and can be brought
about by radiation in the region of between 150 and 250 nm, with most
absorption peaks appearing below 200 nm.
❖ The molar absorptivities are low to intermediate in magnitude and range
between 100 and 3000 L cm-1 mol -1. 13
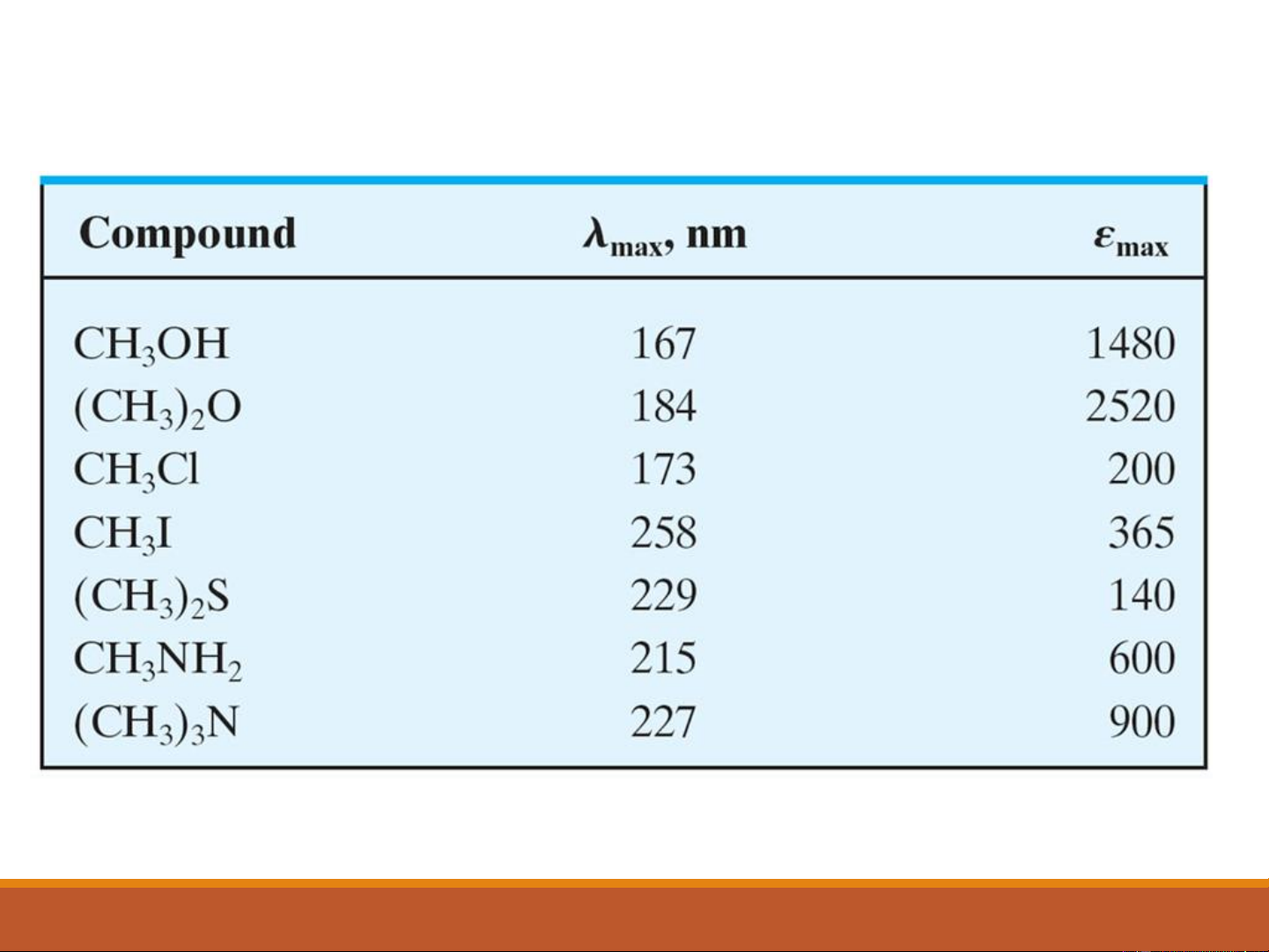
Sự hấp thụ của các hợp chất hữu cơ chứa electron không liên kết 14
n →* and →* Transitions
❖ Transitions for n or electrons to the * excited required the
energies that bring the absorption peaks into an experimentally
convenient spectral region (200 to 700 nm).
❖ Both transitions require the presence of an unsaturated
functional group to provide the orbitals.
❖ Molar absorbtivities from n →* transitions are relatively low,
and range from 10 to100 L mol-1 cm-1
❖ →* transitions normally give molar absorbtivities between
1000 and 10,000 L mol-1 cm-1 15
The solvent in which the absorbing species is dissolved also has an effect on
the spectrum of the species.
❑ Peaks resulting from n →* transitions are shifted to shorter wavelengths
(blue shift) with increasing solvent polarity. This arises from increased
solvation of the lone pair, which lowers the energy of the n orbital.
❑ Often (but not always), the reverse (i.e. red shift) is seen for →*
transitions. This is caused by attractive polarisation forces between the
solvent and the absorber, which lower the energy levels of both the excited
and unexcited states. This effect is greater for the excited state, and so the
energy difference between the excited and unexcited states is slightly
reduced - resulting in a small red shift. This effect also influences n →*
transitions but is overshadowed by the blue shift resulting from solvation of lone pairs. 16
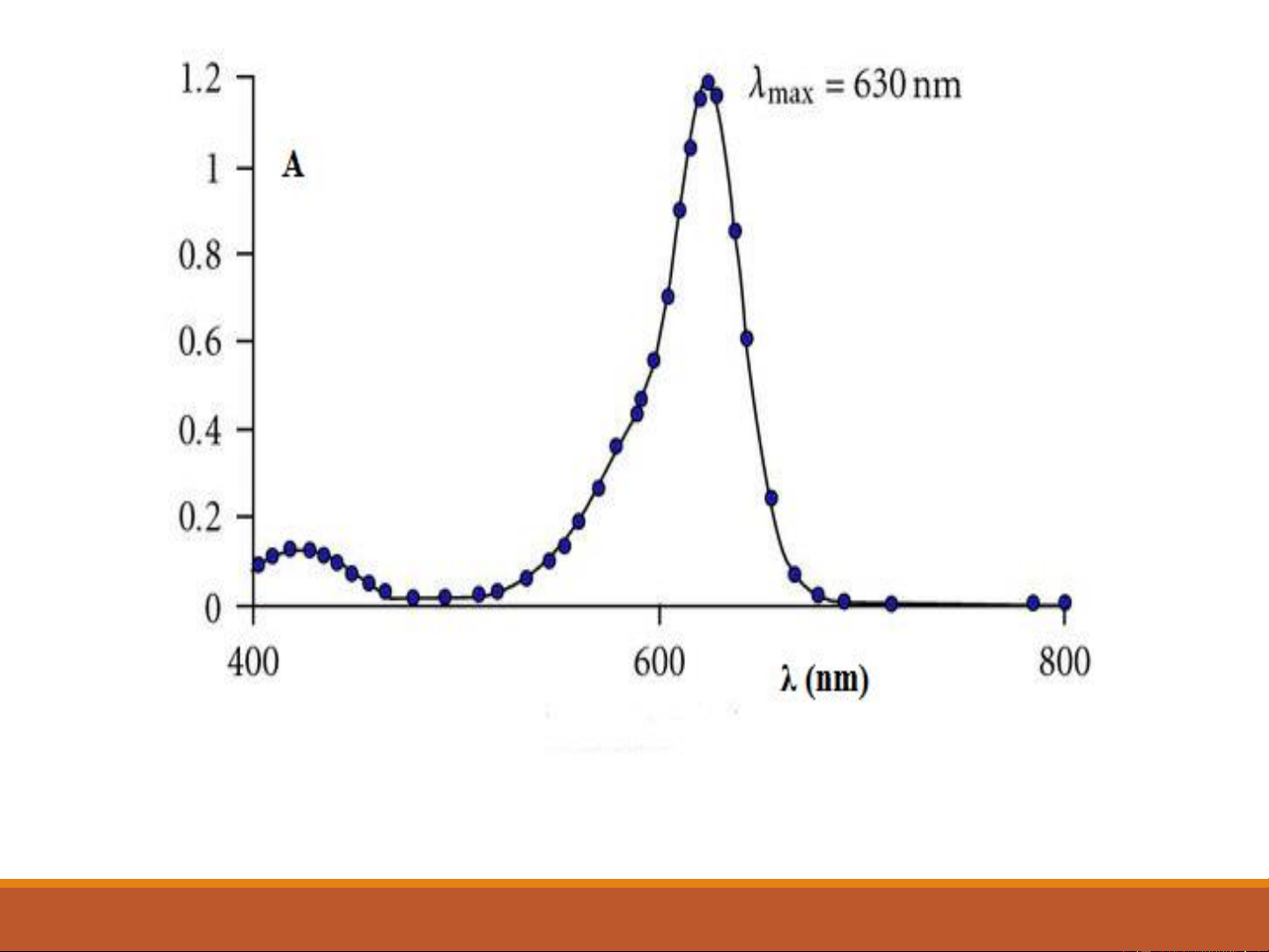
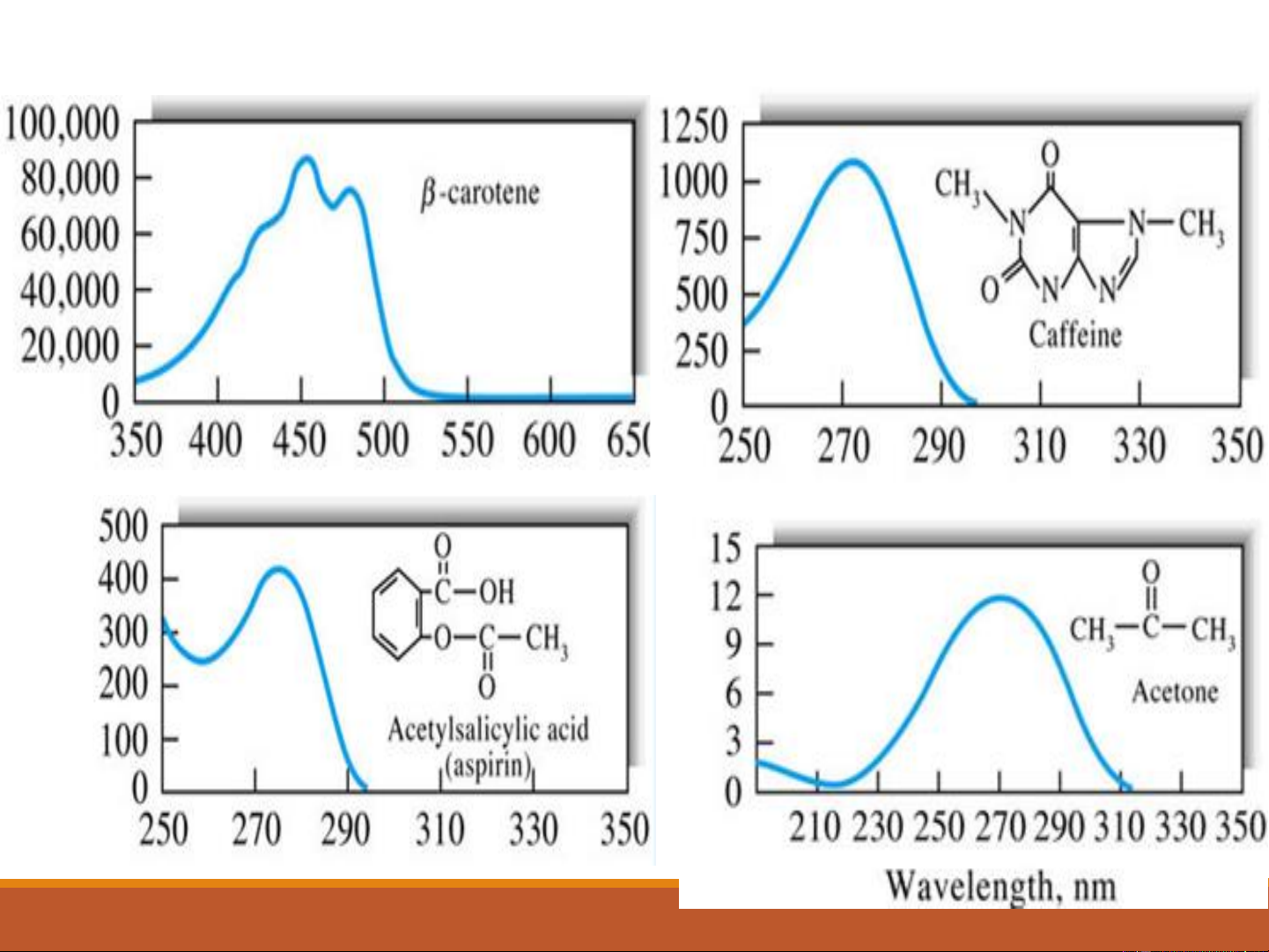
Sự hấp thụ của một số hợp chất hữu cơ 17 18
2.2. Định luật cơ bản về hấp thụ bức xạ điện từ
Định luật Lambert-Beer (2-5)
A: Độ hấp thụ (không thứ nguyên)
C: Nồng độ của mẫu (mol/l)
b (L): Chiều dày của của dung dịch (cuvet) (cm)
ε: độ hấp thụ mol (hay còn gọi là hệ số tắt phân tử) (M- 1cm-1)
Câu hỏi: Nêu ý nghĩa vật lý của ε 19
Trong phân tích đo quang, với dung dịch phân tích xác
định, bước sóng tia tới là đơn sắc thì ε là xác định,
người ta luôn có thể chọn b xác định nên định luật hấp
thụ ánh sáng có thể viết dưới dạng:
A = KC với K= εb = const (2-6)
Phương pháp phân tích đo quang định lượng được đặt
trên cơ sở phương trình (2-6) 20




