







Preview text:
05/11/20
Cơ sở Hóa học phân tích
Cơ sở Hóa học phân tích
Mã học phần: CH3330 và CH3331 Tài liệu tham khảo Khối lượng: 3 (3-1-0-6) Tiếng Anh: Lý thuyết: 45 tiết
1. Douglas A. Skoog, Donald M. West, F. James Hol er, Bài tập: 15 tiết
Stanley R. Crouch (2004), Fundamentals of Analytical
Chemistry, 8th edition, Thomson, USA.
2. Daniel C. Harris (2006), Quantitative analytical
chemistry, 7th edition. W. H. Freeman, New York
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 1
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 1 1 4
Cơ sở Hóa học phân tích
Chương 3: Phương pháp chuẩn độ phức chất PHÂN TÍCH ĐỊNH LƯỢNG
III.1. Sơ lược về cấu tạo của phức chất
CÁC PHƯƠNG PHÁP PHÂN TÍCH HÓA HỌC
3.1.1. Khái niệm phức chất
Phần I: Nhóm các phương pháp phân tích
Phức chất là những phần tử được tạo thành bởi thể tích (PTTT)
một ion kim loại, được gọi là ion trung tâm (M),
Chương 1: Đại cương về các PP PTTT
liên kết với một số ion âm hay phân tử trung
Chương 2: Phương pháp chuẩn độ axit – bazơ
hòa, được gọi là phối tử (L). Trong đó, số phối tử
Chương 3: Phương pháp chuẩn độ phức chất
bao quanh ion trung tâm không tuân theo tỉ lệ
Chương 4: Phương pháp chuẩn độ kết tủa
hợp thức được xác định bởi quan hệ hóa trị
Chương 5: PP chuẩn độ oxy hóa – khử thông thường.
Phần II: Phương pháp phân tích khối lượng VD: phức [Ag(NH
Chương 6: Phương pháp phân tích khối lượng 3)2]Cl
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 1
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 5 2 5
Cơ sở Hóa học phân tích
Chương 3: Phương pháp chuẩn độ phức chất
III.1. Sơ lược về cấu tạo của phức chất Tài liệu tham khảo
3.1.1. Khái niệm phức chất Tiếng Việt:
- Cầu nội: tập hợp ion trung tâm và phối tử tạo 1. Bài giảng
2. Trần Bính (1997), Bài giảng chuẩn hóa học phân
nên cầu nội của phức chất. Cầu nội thường được tích. NXB ĐHBKHN
đặt trong dấu ngoặc vuông [ ]. Tổng điện tích
3. Hoàng Minh Châu, Từ Văn Mặc, Từ Vọng Nghi
của các thành phần trong cầu nội tạo nên điện
(2002), Cơ sở hóa học phân tích. NXB KHKT
tích của cầu nội phức chất.
4. Trần Tứ Hiếu (2002), Hóa học phân tích, NXB
- Các ion mang điện tích để trung hòa điện tích ĐHQGHN
5. Nguyễn Tinh Dung (2007), Hóa học phân tích – Phần
cầu nội được gọi là cầu ngoại của phức chất. III, NXB GD
- Số phối trí: là số liên kết mà ion trung tâm
tạo thành với các phối tử. Số phối trí thường là
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 1 2, 4, 6
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 6 3 6 1 05/11/20
Chương 3: Phương pháp chuẩn độ phức chất
III.1. Sơ lược về cấu tạo
III.1. Sơ lược về cấu tạo của phức chất của phức chất
3.1.1. Khái niệm phức chất 3.1.3. Phức vòng càng, N G
- Số phối trí 2: đặc trưng với Ag(I), Au(I), Cu(I), Hg(II),... U Y
Phức chất có cấu trúc thẳng, ví dụ: hợp chất nội phức Ê N [ClCuCl]-, [H X
3NAgNH3]+, [ClAuCl]-, [NCHgCN], ...
Phức chất vòng: phối tử U Â N
- Số phối trí 4: đặc trưng với Cu(II), Zn(II), Pd(II), Pt(II),...
liên kết với ion trung tâm T R
Phức có cấu hình tứ diện và cấu hình vuông phẳng.
qua một số nguyên tử tạo Ư Ờ
Phức chất tứ diện: [BeF N G
4]2-, [BF4]-, [ZnCl4]2-, [Zn(CN)4]2-, [Cd(CN) thành các vòng -A
4]2-, [FeCl4]-, [CoCl4]2-, [Co(NCS)4]2-, [Co(CO)4]2-,... N
Phức chất vuông phẳng: đặc trưng với Pt(II), Pd(II), Au(III), A Hợp chất nội phức: C Rh(I), Ir(I), ... H E
cùng một phối tử liên kết M -
Số phối trí 6: đặc trưng với Cr(III), Co(III), Fe(III), Pt(IV),... S với ion trung tâm bằng C E
Phức chủ yếu có cấu hình bát diện, ví dụ như: [Co(NH - 3)6]3+, H [Ti(OH
liên kết cộng hóa trị và U
2)6]3+, [Mo(CO)6], [Fe(CN)6]4-, [RhCl6]3-, ... S T bằng liên kết cho nhận.
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 7 10 7 10
Chương 3: Phương pháp chuẩn độ phức chất
III.1. Sơ lược về cấu tạo của phức chất
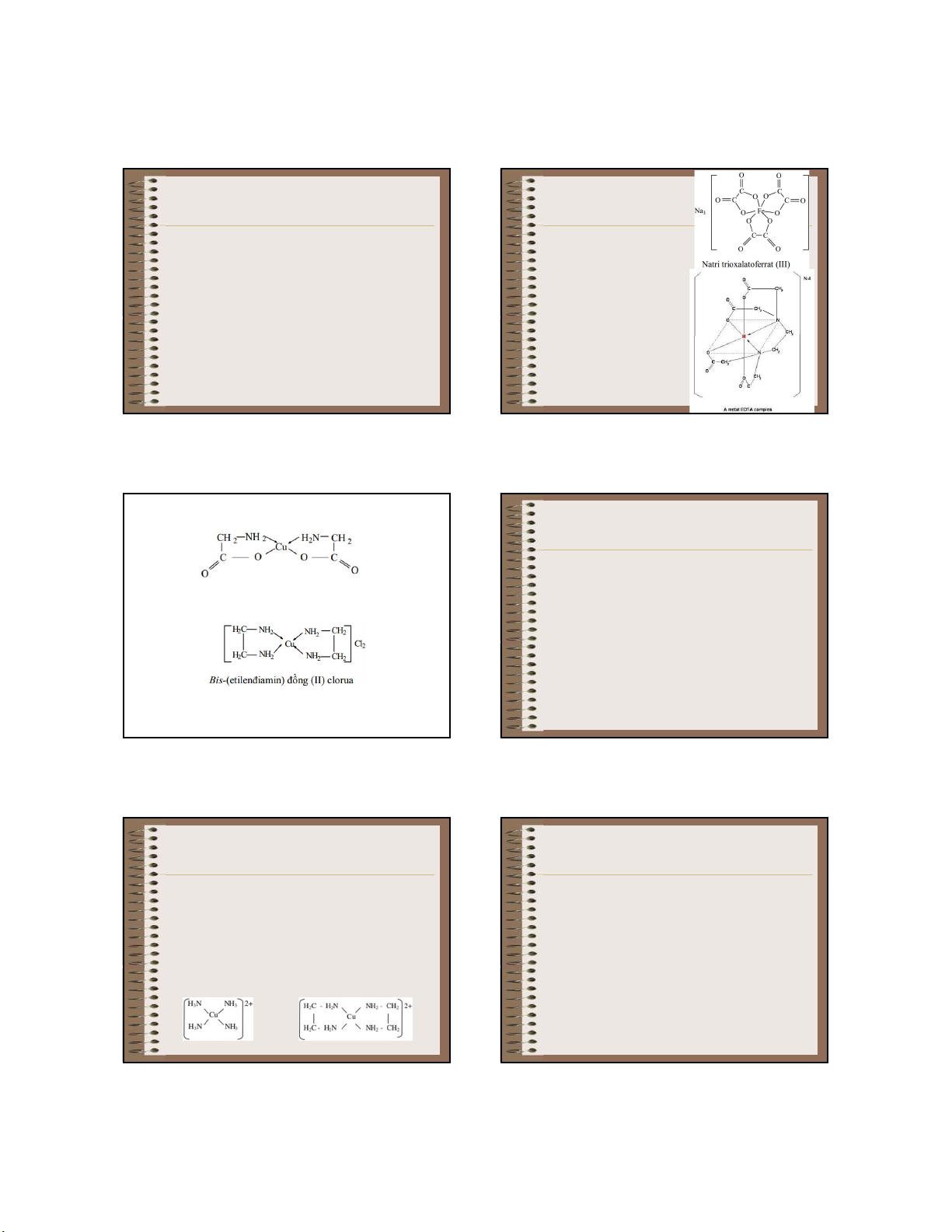
3.1.4. Danh pháp của phức chất Phức chất cation:
(di,tri,...)tên phối tử axit (o) + (di,tri,...)tên phối tử trung hòa Cu(II) glyxin
+ tên ion trung tâm (mức oxi hóa) + tên anion cầu ngoại
[Co(NH3)6]Cl3: hexaamincoban(III) clorua
[Co(NH3)5Cl]SO4: cloropentaamincoban(III) sunfat
[Cr(En)2(H2O)2]Cl3: dietelendiamindiaquơcrom(III) clorua
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 11
Nguyễn X. Trường – ANACHEM-SCE-HUST-1/8 8 11
Chương 3: Phương pháp chuẩn độ phức chất
Chương 3: Phương pháp chuẩn độ phức chất
III.1. Sơ lược về cấu tạo của phức chất
III.1. Sơ lược về cấu tạo của phức chất
3.1.4. Danh pháp của phức chất
3.1.2. Phối tử đơn càng – đa càng Phức chất anion:
Phối tử đơn càng: là phối tử chỉ có khả năng tạo
(di,tri,...)tên phối tử axit (o) + (di,tri,...)tên phối tử trung hòa
ra một liên kết với ion trung tâm như H
+ tên ion trung tâm + at (mức oxi hóa) + tên cation cầu 2O, NH3, ngoại Cl-, ... NH
Phối tử đa càng: là những phối tử tạo được 2
4[Co(NH3)2(NO2)4]: tetranitrodiamincobanat(III) amoni K
hay nhiều liên kết với ion trung tâm như C 2-
3[Fe(CN)6]: hexaxianoferat(III) kali 2O4 , K En, ...
4[Fe(CN)6]: hexaxianoferat(II) kali
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 12
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 9 9 12 2 05/11/20
Chương 3: Phương pháp chuẩn độ phức chất
3.2.1. Hằng số bền, hằng số không bền
III.1. Sơ lược về cấu tạo của phức chất
3.1.5. Liên kết trong phức N
a. Thuyết cộng hóa trị của Lewis G U Y
Phản ứng tạo phức là phản ứng axit – bazơ Lewis. Ê N X U
Theo Lewis, liên kết hóa học được tạo thành bởi cặp  N
electron dùng chung giữa 2 nguyên tử liên kết. T R Ư Ờ
Axit Lewis: chất nhận electron N G -
Bazơ Lewis: chất cho electron A N A C Ví dụ: Ag+ + 2NH H 3 ⇋ H3N: Ag :NH3 E M b. Lý thuyết hiện đại - SC
- Thuyết liên kết hóa trị VB – thuyết Pauling E - H
- Thuyết trường tinh thể U S T
- Thuyết trường phối tử (thuyết orbitan phân tử - MO) 13
Nguyễn X. Trường – ANACHEM-SCE-HUST-1/16 13 16
3.2.2. Nồng độ cân bằng của các cấu tử trong dung
Chương 3: Phương pháp chuẩn độ phức chất dịch phức
III.2. Cân bằng trong dung dịch phức
• Giả sử ion M (nồng độ ban đầu Cm) tạo phức bậc 2 với phối tử L
3.2.1. Hằng số bền, hằng số không bền
(nồng độ ban đầu CL) theo từng nấc: N [ML]
Xét sự tạo phức giữa Cu2+ và NH G 3: U (1) Y M + L ⇌ ML 1 [M].[L] Cu2+ + NH Ê 3 ⇌ Cu(NH3)2+ β1, K1 N X U Cu(NH 2+ + Â 3)2+ + NH3 ⇌ Cu(NH3)2 β2, K2 N [ML ] 2 T ML + L ⇌ ML (2) … R 2 2 Ư [ML].[L] Ờ N Cu2+ + 4NH 2+ G
• Theo định luật bảo toàn khối lượng: 3 ⇌ Cu(NH3)4 β, K C -A [M] + [ML] + [ML m [M] • N 2] = Cm 2 1 [L] [L]
1, 2,… - hằng số bền: đại lượng đặc trưng cho khả năng A C 1 1 2 tạo phức H E Từ (1) → [ML] = β M 1.[M].[L] • K - C [L]
1 = 1/1; K2 = 1/2; … - hằng số không bền: đại lượng đặc S Từ (2) → [ML m 1 C 2] = β1. β2.[M].[L]2 [ML]
trưng cho sự phân ly phức chất E 2 - 1 [L] [L] H
[M] + β1.[M].[L] + β1β2.[M].[L]2 = Cm 1 1 2 U [Cu(NH )2 ] 1 [Cu(NH )2 ] 1 S 3 ; 3 2 ;.. . T 2 C [L] 1 [ 2 Cu ][NH ] K 2 [Cu(NH )2 ][NH ] K m 1 2 14 [ML ] 3 1 3 3 2 2 2 1[L] [L] 1 1 2
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 17 14 17
3.2.2. Nồng độ cân bằng của các cấu tử trong dung
Chương 3: Phương pháp chuẩn độ phức chất dịch phức
III.2. Cân bằng trong dung dịch phức
3.2.1. Hằng số bền, hằng số không bền
• Trường hợp tổng quát:
• , K - hằng số bền và không bền tổng cộng Cm [M] 2 n
1 [L] [L] ... ... [L] β = β 1 1 2 1 2 n 1.β2.β3.β4 = β1,4 K = K1.K2.K3.K4 = K1,4 C [L] m 1 [ML] 2 n [Cu(NH )2 ] 1 1 [L] [L] ... ... [L] 1 1 2 1 2 n 3 4 [ 2 Cu ][NH ]4 K 3 … n C ... [L] m 1 n [ML ] n 2 n
1 [L] [L] ... ... [L] 1 1 2 1 2 n
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 15
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 18 15 18 3 05/11/20
3.2.2. Nồng độ cân bằng của các cấu tử trong
3.2.3. Ảnh hưởng của pH và sự tạo phức phụ, dung dịch phức
hằng số bền điều kiện
• Ví dụ 1: Tính [Ag+] và [CN-] trong dung dịch phức
– M có phản ứng tạo phức phụ với L: [ML] Ag(CN) - M + L ⇌ ML 2 0,1M; biết β = 1021 1 [M].[L] Giải [ML ] ML + L ⇌ ML 2 2
– Cân bằng trong dung dịch 2 [ML].[L] … Ag(CN) - [ML ] 2 ⇌ Ag+ + 2CN- ML n n-1 + L ⇌ MLn n [ML ][L]
– Biểu thức hằng số bền: n 1 - + [Ag(CN) ] 0,1[Ag ] 2
– H+ tạo phức phụ với Y4-: + - 2 + + 2 [Ag ].[CN ] [Ag ].4[Ag ] H+ + Y4- ⇌ HY3- K -1 a4 Giả sử [Ag+] ≪ 0,1M [Ag+] = 2,9.10-8M H+ + HY3- ⇌ H -1 2Y2- Ka3 H+ + H -1 2Y2- ⇌ H3Y- Ka2 Vậy giả thiết là đúng [CN-] = 5,8.10-8M H+ + H -1 3Y- ⇌ H4Y Ka1
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 19
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 22 19 22
3.2.2. Nồng độ cân bằng của các cấu tử trong
3.2.3. Ảnh hưởng của pH và sự tạo phức phụ, dung dịch phức
hằng số bền điều kiện
• Ví dụ 2: Tính nồng độ cân bằng của các cấu tử trong
• Gọi [M]’ là tổng nồng độ các dạng của M (không tính MY), dung dịch Ag(NH + 3)2 10-2M, biết K = 6,8.10-8 khi đó:
[M]’ = [M] + [ML] + [ML2] + … + [MLn] (1)
• Gọi [Y4-]’ là tổng nồng độ của Y4- (không tính MY):
[Y4-]’ = [Y4-] + [HY3-] + [H2Y2-] + [H3Y-] + [H4Y] (2) • Từ (1): 2 n
[M]' [M] [M][L] [M][L] ... [M][L] 1 1,2 1,n [M] 2 n
1 [L] [L] ... [L] 1 1,2 1,n αM(L)
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 20
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 23 20 23
3.2.3. Ảnh hưởng của pH và sự tạo phức phụ,
3.2.3. Ảnh hưởng của pH và sự tạo phức phụ,
hằng số bền điều kiện
hằng số bền điều kiện
• Giả sử trong dung dịch phức MY2- có mặt ion L và H+. • Từ (2): 2 3 4 Trong đó: 4- 4- [H ] [H ] [H ] [H ] [Y ]' [Y ].1 K K .K K .K .K K 4 4 3 4 3 2 1,4
• Ion lạ L có khả năng tạo phức phụ với M α
• H+ có khả năng tạo phức phụ với phối tử Y4- Y(H) [MY] 1
• Các cân bằng trong dung dịch: ' . 4- [M]'.[Y ]' . M(L) Y(H) MY2- ⇌ M2+ + Y4- Hoặc K ' K. . [MY ] M(L) Y(H) ( k h ô n g v iết điện tích) [M ][Y ]
• ’ và K’ gọi là hằng số bền điều kiện, phụ thuộc vào
pH, các hằng số bền của phản ứng tạo phức phụ
1, 2, …, n và nồng độ của L.
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 21
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 24 21 24 4 05/11/20
3.2.3. Ảnh hưởng của pH và sự tạo phức phụ,
hằng số bền điều kiện
Chương 3: Phương pháp chuẩn độ phức chất
III.2. Cân bằng trong dung dịch phức
• Gọi phần mol của thuốc thử không tham gia tạo
3.2.4. Cân bằng tạo phức giữa 2 cation và 1 phối tử (1
phức tồn tại ở dạng Y4- là 4: cation và 2 phối tử) 4 [Y ] 1 K K K K
- Nếu có 2 cation cùng tạo phức với 1 phối tử thì có thể dự a1 a2 a3 a4
đoán được quá trình nào chiếm ưu thế căn cứ vào HSB của 4 4 4 3 [Y ]' (Y )H
[H ] [H ] K ... K K K K
phức và nồng độ của 2 cation. 1 a 1 a a 2 a3 a4
- Ví dụ:Ca2+ + Y4- ⇌ CaY2- (a) = 1010,6 Mg2+ + Y4- ⇌ MgY2- (b) = 108,6
4 chỉ phụ thuộc vào pH và các hằng số phân ly
+ Nếu nồng độ ban đầu của Ca2+ và Mg2+ như nhau thì khi
them Y4- vào dung dịch, quá trình (a) xảy ra trước.
+ Cho vào dung dịch phức MgY2- một lượng dung dịch Ca2+ ' 4
đủ thì sẽ có phản ứng chuyển dịch phức tạo thành phức bền hơn (c). M (L)
MgY2- + Ca2+ ⇌ CaY2- + Mg2+ (c)
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 28
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 25 25 28
3.2.3. Ảnh hưởng của pH và sự tạo phức phụ, hằng số
3.2.4. Cân bằng tạo phức giữa 2 cation và 1 phối bền điều kiện
tử (1 cation và 2 phối tử)
• Ví dụ 1: Tính nồng độ các cấu tử có trong dung dịch hỗn
hợp gồm MgY2- 10-2M và Ca2+ 10-2M. Biết: – β (MgY2-) = 108,7 – β (CaY2-) = 1010,7 Giải
– Nhận xét: từ giá trị HSB của 2 phức MgY2- và CaY2- 2 2 CaY MgY
→ Có phản ứng chuyển dịch tạo thành phức bền hơn: Ca2+ + MgY2- ⇌ CaY2- + Mg2+
Từ phản ứng: [CaY2-] = [Mg2+]
Nguyễn X. Trường – ANACHEM-SCE-HUST-1/26
Nguyễn X. Trường – ANACHEM-SCE-HUST-1/29 26 29
3.2.3. Ảnh hưởng của pH và sự tạo phức phụ, hằng số
3.2.4. Cân bằng tạo phức giữa 2 cation và 1 phối bền điều kiện
tử (1 cation và 2 phối tử) 2-
• Ví dụ 1: Tính nồng độ cân bằng của Mg2+, Y4-, MgY2- khi [CaY ] 2- 2 4- 2 [CaY ] .[Ca ].[Y ] CaY 2 4- 2-
trong dung dịch có Mg2+ 10-2M, Y4- 10-2M, pH = 11. Biết: [Ca ].[Y ] CaY • β (MgY2-) = 108,7 • β (MgOH+) = 102,58 2- [MgY ] 2- [MgY ] 2 2 [Mg ] • H MgY 2 4- [Mg ].[Y ] 4-
4Y có pK1 = 2; pK2 = 2,67; pK3 = 6,27; pK4 = 10,95 .[Y ] 2- MgY 1 4- [Y ] 2 CaY 4- .[Y ] 2 MgY 1 4 9,7 [Y ]= 10 M . 2- 2 CaY MgY
Nguyễn X. Trường – ANACHEM-SCE-HUST-1/27
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 30 27 30 5 05/11/20
3.2.4. Cân bằng tạo phức giữa 2 cation và 1 phối
tử (1 cation và 2 phối tử)
Chương 3: Phương pháp chuẩn độ phức chất
III.3. Chuẩn độ tạo phức
– Theo định luật bảo toàn khối lượng:
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc thử [Mg2+] + [MgY2-] = 10-2 M complexon → [Mg2+] = 9,1.10-3 M a. Thuốc thử complexon
Complexon là tên gọi chung chỉ một nhóm các thuốc thử → [Ca2+] = 9,0.10-4 M
hữu cơ là dẫn xuất của axit amino polycarboxylic
- Complexon I: nitrilo triaxit axetic, viết tắt là H3Y
• Ví dụ 2: Thêm lần lượt 0,3 mol KSCN và 0,2 mol
Na2C2O4 vào 1 lit dung dịch FeCl3 0,1M. Tính gần đúng [FeSCN2+]. Biết: • β (FeSCN2+) = 103,03
- Complexon II: etilendiamin tetraaxit axetic (EDTA), H • β (FeC + 4Y 2O4 ) = 2,5 109 Giải:
Áp dụng định luật bảo toàn khối lượng.
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 31
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 34 31 34
Chương 3: Phương pháp chuẩn độ phức chất
Chương 3: Phương pháp chuẩn độ phức chất
III.2. Cân bằng trong dung dịch phức
III.3. Chuẩn độ tạo phức
3.2.4. Ứng dụng của sự tạo phức chất trong hóa phân
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc thử tích complexon
-Phản ứng tạo thành phức chất có màu sử dụng trong a. Thuốc thử complexon
phương pháp phân tích đo quang.
- Complexon III: muối dinatri của EDTA (Na2H2Y.2H2O)
-Tạo thành hợp chất nội phức bền ít tan trong nước, tan gọi là trilon B.
nhiều trong dung môi hữu cơ sử trong phương pháp chiết, tách và làm giàu
-Phản ứng tạo thành phức để che các ion lạ cản trở quá trình phân tích. Ví dụ:
+ Dùng CN- để che các ion Cu2+, Co2+, Ni2+ khi chuẩn độ
Ca2+ và Mg2+ trong hỗn hợp có chứa các ion trên.
+ Dùng H PO để tạo phức không màu với Fe3+ trong phản 3 4
ứng chuẩn độ dung dịch Fe(II) bằng KMnO4.
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 32
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 35 32 35
Chương 3: Phương pháp chuẩn độ phức chất
Chương 3: Phương pháp chuẩn độ phức chất
III.3. Chuẩn độ tạo phức
III.3. Chuẩn độ tạo phức
3.3.1. Chuẩn độ bằng thuốc thử vô cơ
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc thử Chất chuẩn Chất cần định Ghi chú complexon lượng a. Thuốc thử complexon Hg(NO3)2
Cl-, Br-, SCN-, CN- Tạo phức trung hòa điện của Hg(II),
- Complexon IV: trans-1,2-diaminocyclohexan tetraaxit
CCT là diphenyl carbazit (pH = 1,5 axetic
– 2,6) hoặc diphenyl carbazon (pH = 2,0 – 3,5) AgNO3 CN-
Sản phẩm của phản ứng là phức Ag(CN) -
2 , CCT là I- (chuẩn độ đến
xuất hiện đục dd do AgI KCN Cu2+, Hg2+, Ni2+
Sản phẩm của phản ứng là phức Cu(CN) 2- 2- 2- 4 , Hg(CN)4 , Ni(CN)4
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 33
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 36 33 36 6 05/11/20
Chương 3: Phương pháp chuẩn độ phức chất
Chương 3: Phương pháp chuẩn độ phức chất
III.3. Chuẩn độ tạo phức
III.3. Chuẩn độ tạo phức
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc thử
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc thử N complexon G N U complexon G a. Thuốc thử complexon Y U Ê
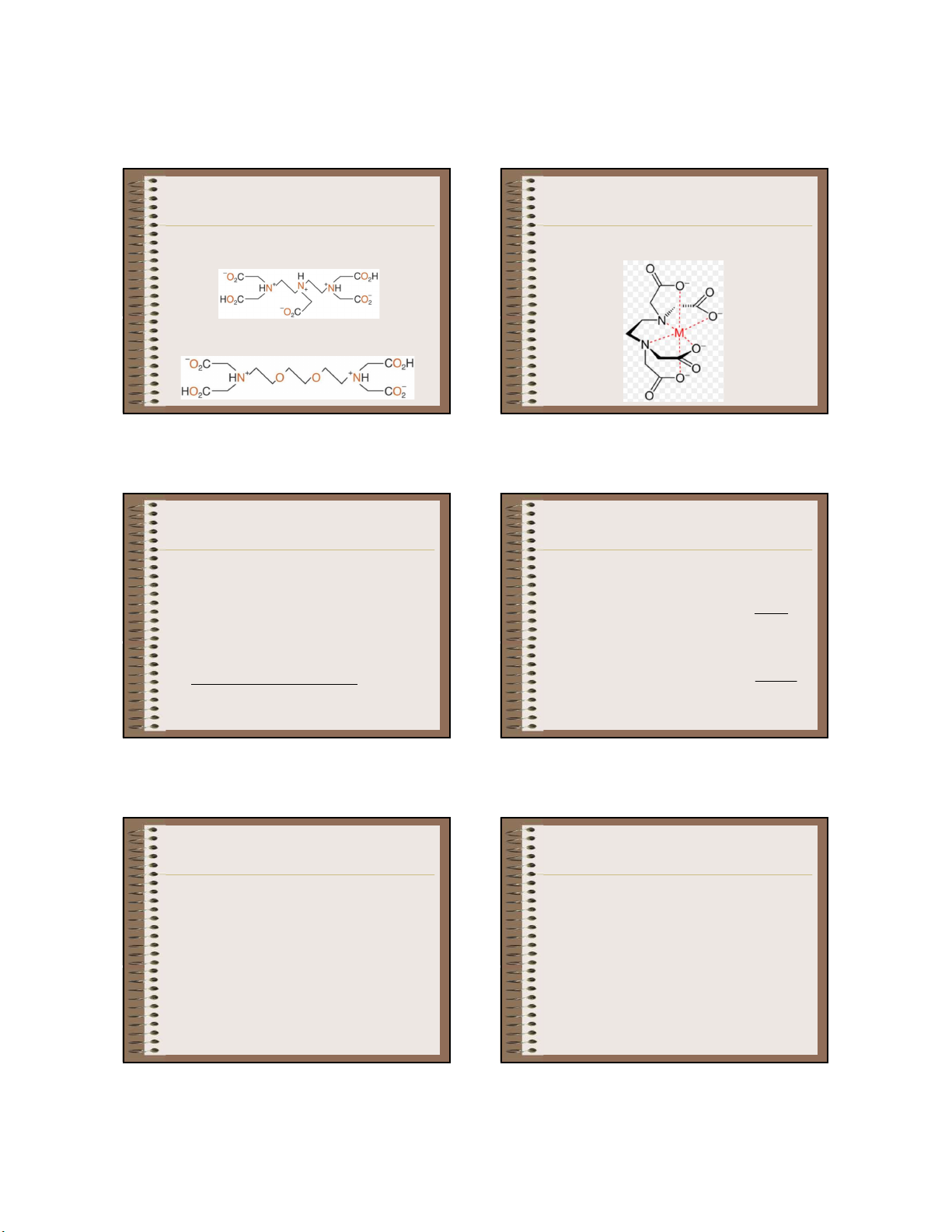
b. Phức của complexon III với cation kim loại (sự tạo Y Ê
- Complexon V: dietylentriamin pentaaxit axetic, DTPA N N X thành complexonat KL) U X Â U N Â N T R T Ư R Ờ Ư N Ờ G N G - A - N A A N C A H C H
- Complexon VI: bis(aminoetyl)glycoete-N,N,N’,N’- E M E M tetraaxit axetic, EGTA - S - C S E C E - H - U H S U T S T 37 40 37 40
Chương 3: Phương pháp chuẩn độ phức chất
Chương 3: Phương pháp chuẩn độ phức chất
III.3. Chuẩn độ tạo phức
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc thử
III.3. Chuẩn độ tạo phức N complexon
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc GU a. Thuốc thử complexon Y Ê
- Các complexon tạo phức bền với nhiều ion kim loại, các thử complexon N X
phản ứng này thỏa mãn tất cả các điều kiện của phép
c. Định phân bằng complexon III (compIII) U Â N
PTTT. Trong đó, complexon III là thuốc thử được dùng Phản ứng chuẩn độ: T R
nhiều nhất vì nó tan tốt trong nước. [MY ] Mn+ + Y4- Ư ⇌ MY(4-n)- Ờ
- Sự phân li của complexon trong nước: [M ][Y ] N G - H A 4Y ⇌ H+ + H3Y- pKa1= 2,0 N A H
Nếu có ảnh hưởng của pH hay phản ứng tạo phức C 3Y- ⇌ H+ + H2Y2- pKa2= 2,76 H E H
phụ thì thay HSB bằng HSB điều kiện ’. M 2Y2- ⇌ H+ + HY3- pKa3= 6,16 - HY3- ⇌ H+ + Y4- pK [MY ] S C a4= 10,26 ' E [M '][Y '] - HU H S 4Y ⇌ 4H+ + Y4- pKa = 21,18
Đường định phân: Đường cong chuẩn độ được xây T
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 38
dựng dưới dạng pM (-lg[M]) – VcompIII 41 38 41
Chương 3: Phương pháp chuẩn độ phức chất
Chương 3: Phương pháp chuẩn độ phức chất
III.3. Chuẩn độ tạo phức
III.3. Chuẩn độ tạo phức
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc thử
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc thử complexon complexon
b. Phức của complexon III với cation kim loại (sự tạo
c. Định phân bằng complexon III (compIII) thành complexonat KL)
Nhận biết điểm tương đương - chất chỉ thị kim loại:
- Complexon III tạo phức bền và tan trong nước với nhiều Khái niệm về CCT KL ion kim loại
Là những chất hữu cơ có màu, màu của CCT phụ thuộc vào
- Phản ứng xảy ra theo tỉ lệ mol là 1:1 không phụ thuộc vào
pH, CCT có khả năng tạo hợp chất nội phức với ion kim điện tích cation
loại. Trong điều kiện cụ thể, màu của CCT KL tự do khác màu của CCT với phức.
Men+ + H2Y2- ⇌ Me(4-n)- + 2H+ Yêu cầu đối với CCT KL
- CCT KL phải đủ nhạy và chọn lọc;
- Cần duy trì môi trường pH không đổi bằng dung dịch
- Phức tạo thành giữa CCT KL và ion KL phải kém bền hơn
đệm do pH ảnh hưởng đến độ bền của complexonat KL
complexonat KL tương ứng: <
(thường dùng pH 8 -10 bằng đệm NH MInd MY 4Cl+NH4OH).
- Phản ứng tạo phức giữa ion KL và CCT KL phải nhanh và
thuận nghịch; phức tạo thành tương đối bền 104 < MInd
- Sự đổi màu ở ĐTĐ phải rõ rang: màu của MY khác hẳn
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 39 màu của HInd tự do.
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 42 39 42 7 05/11/20
Chương 3: Phương pháp chuẩn độ phức chất
Chương 3: Phương pháp chuẩn độ phức chất
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc thử
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc thử complexon complexon
c. Định phân bằng complexon III (compIII) Một số cách định phân N G Chất chỉ thị kim loại: - Định phân trực tiếp U Y
Cơ chế chuyển màu của CCT KL - Định phân ngược Ê N X
- Khi chưa chuẩn độ: CCT KL tạo - Định phân thay thế: U Â
phức có màu A với ion KL (có dung
Nguyên tắc: Cho một lượng dư dung N T
dịch đệm ổn định pH).
dịch chuẩn của một complexonat KL R Ư M + HInd ⇌ MInd + H+
M’ kém bền tác dụng với dung dịch Ờ N A
ion KL M cần xác định. Sau đó chuẩn G -A
- Chuẩn độ đến ĐTĐ: xảy ra phản
độ lượng ion KL M’ giải phóng ra theo N A
ứng chuyển dịch phức tạo thành
phương pháp định phân trực tiếp. C H
phức complexonat KL và giải
. Sử dụng khi không tìm được CCT E M
phóng CCT ở dạng tự do. Dung thích hợp; -S
dịch có màu B của CCT dạng tự do.
. Hoặc phức CCT KL và ion KL cần C E MInd + H
xác định bền hơn complexonat KL - H 2Y2- ⇌ MY + HInd + H+ U B tương ứng; S T
. Hoặc sự tạo phức complexonat của 46
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 43
KL cần xác định xảy ra chậm. 43 46
Một số chất chỉ thị kim loại thường dùng
Chương 3: Phương pháp chuẩn độ phức chất
III.3. Chuẩn độ tạo phức
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc thử N G U complexon Y Ê d. Ví dụ N X Xét sự chuẩn độ V U
0 ml dd ion kim loại M có nồng độ đầu là Â N
C0 (mol/l) bằng dung dịch chất tạo phức L nồng độ C T R (mol/l). Ư Ờ -Phản ứng chuẩn độ: N [ML ] G n - M + nL ⇌ ML A n n N [M ][L] A nC V C 0 0 H V E tđ M C -
- Xây dựng đường định phân: pM (-lg[M]) – V S L C E
+ Khi chưa chuẩn độ: dd chỉ có ion M -HU pM = -lg[M] = -lgC S 0 T
Phức tạo thành giữa ETOO và ion KL có màu đỏ nho. 44
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 47 44 47
Một số chất chỉ thị kim loại thường dùng
Chương 3: Phương pháp chuẩn độ phức chất
III.3. Chuẩn độ tạo phức
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc thử N G complexon U Y d. Ví dụ Ê N X
+ Trước điểm tương đương: ML U n, M dư Â N 1 T R V C CV Ư 0 0 Ờ n N pM lg[M ] lg G V V - 0 A N A C + Tại ĐTĐ: ML H
n (giả thiết phức phân ly không đáng kể) E C M 1 p pM [lg lg ] - S n C n 1 n E - H C V 0 0 U C S p T V V 0 45
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 48 45 48 8 05/11/20
Chương 3: Phương pháp chuẩn độ phức chất III.4. Luyện tập
III.3. Chuẩn độ tạo phức
4.1. Cân bằng trong dung dịch phức
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc thử
Câu 8*: Phản ứng giữa Mg2+ và CCT ET-00 như sau: complexon
Mg2+ + Ind3- ⇌ MgInd- = 107 d. Ví dụ Màu đỏ + Sau ĐTĐ: ML Mặt khác, n và L dư C Ind3- + H+ ⇌ HInd2- pKa3 = 11,5 pM lg lg p da cam xanh [L ]n ex HInd2- + H+ ⇌ H2Ind- pKa2 = 6,3 C V 0 0 C xanh đỏ p V V 0
Tại pH = 10, tính pMg để: CV nC V [L ] 0 0
a. dung dịch có màu đỏ của phức MgInd-; ex V V 0
b. dung dịch có màu xanh của HInd2- tự do.
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 49
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 52 49 52
Chương 3: Phương pháp chuẩn độ phức chất III.4. Luyện tập
III.3. Chuẩn độ tạo phức
4.1. Cân bằng trong dung dịch phức
3.3.2. Chuẩn độ bằng thuốc thử hữu cơ – thuốc thử
Câu 9: Tính HSB điều kiện của phức NiY4- trong dung dịch complexon
đệm NH3 1M và NH4Cl 1,78M. Biết rằng nồng độ của ion d. Ví dụ
Ni2+ không đáng kể so với nồng độ NH3. Cho biết các hằng
Ví dụ 1: Định phân 50,0 ml Hg(NO3)2 0,1M bằng dung dịch
số bền tổng cộng của phức Ni(NH 2+ lần lượt là:
KSCN 0,1M. Cho biết phức tạo thành là Hg(SCN) 3)5 1,1 = 2 có = 1020.
102,67; 1,2 = 104,80; 1,3 = 106,40; 1,4 = 107,50; 1,5 = 108,10
Tính pSCN ở các thời điểm khi them dung dịch KSCN đến: (NiY2-) = 1018,62;
a. Trước và sau điểm tương đương với s = 0,1 %.
và H4Y có các hằng số phân ly axit: Ka1 = 1,02 10-2; Ka2 = b. Điểm tương đương
2,14 10-3; Ka3 = 6,92 10-7; Ka4 = 5,50 10-11.
Ví dụ 2: Xây dựng đường định phân khi chuẩn độ 100,0 ml
dung dịch Ca2+ 0,10 M bằng dung dịch compIII 0,10 M nếu
pH của dung dịch được duy trì ổn định ở pH =10. Cho biết
β(CaY2-) = 5.0 1010 và H4Y có các hằng số phân ly axit
Ka1 = 1,02 10-2; Ka2 = 2,14 10-3; Ka3 = 6,92 10-7; Ka4 = 5,50 10-11
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 50
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 53 50 53 III.4. Luyện tập III.4. Luyện tập
4.1. Cân bằng trong dung dịch phức
4.1. Cân bằng trong dung dịch phức
Câu 1-5: Trang 42&43, Bài giảng chuẩn HHPT, ĐHBKHN
Câu 10: Tính nồng độ cân bằng của Mg2+, Y4-, MgY2- khi
Câu 6: Thêm lần lượt 0,3 mol KSCN và 0,2 mol Na2C2O4
trong dung dịch có Mg2+ 10-2M, Y4- 10-2M, pH = 11. Biết:
vào 1 lit dung dịch FeCl3 0,1M. Tính gần đúng [FeSCN2+]. • β (MgY2-) = 108,7 Biết: • β (MgOH+) = 102,58 β (FeSCN2+) = 103,03 β (FeC +
• H4Y có pK1 = 2; pK2 = 2,67; pK3 = 6,27; pK4 = 2O4 ) = 2,5 109 10,95
Câu 7: Tính phần mol của Y4- ở các giá trị pH sau: 3,0; 7,0; 11,0. Cho biết H
Câu 11: Tính nồng độ cân bằng của Mg2+, Y4-, MgY2- khi
4Y có các hằng số phân ly axit: Ka1 = 1,02 10-2;
Ka2 = 2,14 10-3; Ka3 = 6,92 10-7; Ka4 = 5,50 10-11.
trong dung dịch có Mg2+ 10-2M, Y4- 210-2M, pH = 11. Biết: • β (MgY2-) = 108,7 • β (MgOH+) = 102,58
• H4Y có pK1 = 2; pK2 = 2,67; pK3 = 6,27; pK4 =
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 51 10,95
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 54 51 54 9 05/11/20 II.3. Luyện tập
4.2. Chuẩn độ tạo phức
Câu 1: BT 6/43, Bài giảng chuẩn HHPT, ĐHBKHN
Câu 2: Tính pCa khi chuẩn độ 100,0 ml dung dịch Ca2+ 0,10
M bằng dung dịch compIII (H2Y2-) 0,10 M nếu pH của dung
dịch được duy trì ổn định ở pH =10.
a. Thêm được 90,0 ml dung dịch compIII
b. Thêm được 100,0 ml dung dịch compIII
c. Thêm được 110,0 ml dung dịch compIII
Cho biết β(CaY2-) = 5.0 1010 và H4Y có các hằng số phân
ly axit: Ka1 = 1,02 10-2; Ka2 = 2,14 10-3;
Ka3 = 6,92 10-7; Ka4 = 5,50 10-11.
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 55 55 II.3. Luyện tập
4.2. Chuẩn độ tạo phức
Câu 3: Tính pZn trong các dung dịch khi trộn lẫn 40,0;
50,0; 60,0 ml dung dịch compIII 0,001M với 50,0 ml dung
dịch Zn2+ 0,001M. Giả thiết rằng dung dịch Zn2+ và dung
dịch compIII đều chứa 0,10M NH3 và 0,176M NH4Cl tạo
nên giá trị pH không đổi bằng 9. Cho biết các hằng số bền của phức Zn(NH 2+
3)4 là: (Zn(NH3)2+) = 1,9 102; (Zn(NH 2+ 2+
3)2 ) = 2,2 102; (Zn(NH3)3 ) = 2,5 102; (Zn(NH 2+ 3)4 ) = 1,1 102; (ZnY2-) = 3,2 106;
và H4Y có các hằng số phân ly axit: Ka1 = 1,02 10-2; Ka2 =
2,14 10-3; K = 6,92 10-7; K = 5,50 10-11. a3 a4
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 56 56 II.3. Luyện tập
4.2. Chuẩn độ tạo phức
Câu 4: Cân 1,3370 g một mẫu magie oxit (có chứa CaO và
tạp chất khác) hòa tan trong HCll, dư rồi định mức bằng nước cất đến 500,0 ml.
- Lấy ra 25,0 ml dung dịch, trung hòa bằng NaOH 2N, điều
chỉnh pH 10 bằng hỗn hợp đệm NH4Cl+NH4OH, rồi
chuẩn độ bằng dung dịch compIII 0,05 N với CCT ET-00
thì tiêu tốn hết 28,75 ml.
- Lấy ra 25,0 ml dung dịch, thêm dung dịch NaOH 2N đến
pH 12, rồi chuẩn độ bằng dung dịch compIII 0,05 N với
CCT murexit thì tiêu tốn hết 5,17 ml.
Tính % khối lượng của MgO và CaO trong mẫu phân tích ban đầu. Cho: MgO = 40, CaO = 56.
NGUYÊN XUÂN TRƯỜNG - ANACHEM - SCE - HUST 57 57 10



