






Preview text:
Các nguyên tố có thể xác định bằng ICP-MS
PHƯƠNG PHÁP PHÂN TÍCH CÔNG CỤ
PHẦN I: Các PP phân tích quang phổ
Chương 3: Phương pháp phổ phát xạ nguyên tử
Nguyễn X. Trường – ANACHEM-SCE-HUST-2/87
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/90 87 90
Quá trình phát triển phương pháp phổ nguyên tử
Giới hạn phát hiện của phương pháp phổ nguyên tử phổ phát xạ nguyên tử phổ hấp thụ nguyên tử huỳnh quang nguyên tử ICP-MS 1950 1960 1970 1980 1990
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/88
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/91 88 91
Các nguyên tố có thể xác định bằng AAS
3.1. Giới thiệu chung về phổ phát xạ nguyên tử
• Phổ phát xạ nguyên tử là phổ của nguyên tử tự do ở
trạng thái hơi khi nó bị kích thích.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/89
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/92 89 92
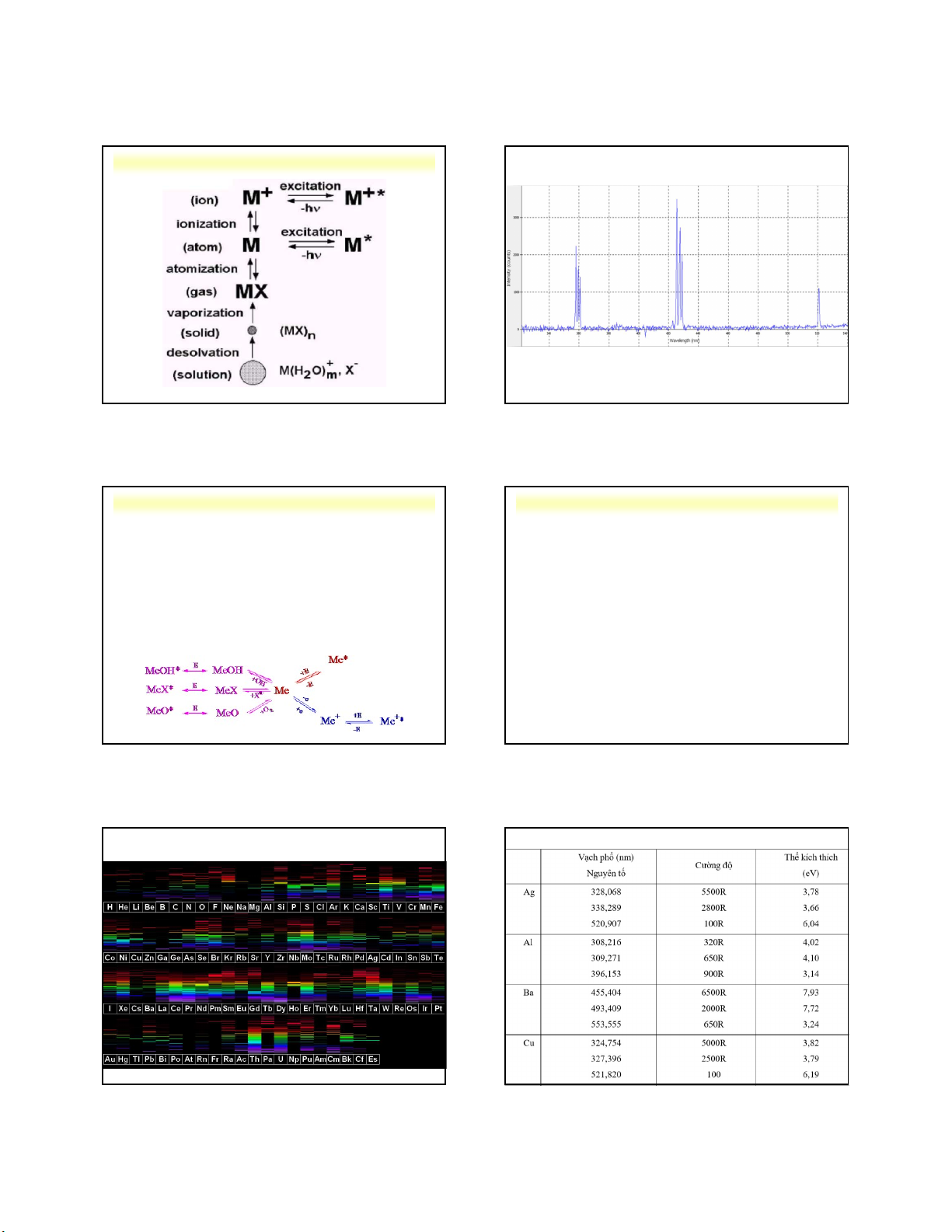
3.2. Sự xuất hiện phổ phát xạ nguyên tử
3.2. Sự xuất hiện phổ phát xạ nguyên tử
- Các điện tử được xếp thành từng lớp và chuyển
động trên những quy đạo (obitan) khác nhau bao xung quanh hạt nhân.
- Các điện tử chuyển động trên các obitan càng gần
hạt nhân thì có năng lượng càng thấp.
- Các điện tử hóa trị ở lớp ngoài cùng của nguyên tử
là nhân tố tạo ra phổ phát xạ và hấp thụ nguyên tử.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/93
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/96 93 96
3.2. Sự xuất hiện phổ phát xạ nguyên tử
3.2. Sự xuất hiện phổ phát xạ nguyên tử
• Phổ phát xạ nguyên tử hình thành do sự tương tác của các
nguyên tử tự do ở trạng thái khí với một nguồn năng lượng
nhiệt, điện, ... phù hợp.
• Khi bị kích thích (tất nhiên, năng lượng kích thích phải nhỏ
hơn năng lượng ion hóa), các điện tử lớp ngoài (điện tử hóa
trị) của nguyên tử chuyển từ trạng thái cơ bản bền vững lên
trạng thái kích thích có mức năng lượng cao hơn.
• Trạng thái kích thích không bền, lưu lại nhiều nhất ~ 10-8s.
Nguyên tử ở trạng thái kích thích có xu hướng quay trở về
trạng thái ban đầu, giải phóng ra năng lượng dưới dạng các bức xạ quang học.
• Các tia phát xạ (bức xạ) của quá trình trên chính là phổ phát xạ của nguyên tử. ΔE = (En-E0) = hν = (hc)/λ
• Những nguyên tố nào có số điện tử hóa trị càng nhiều (Fe,
Mn, Ni,..) thì số vạch phổ phát xạ nhiều.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/94
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/97 94 97
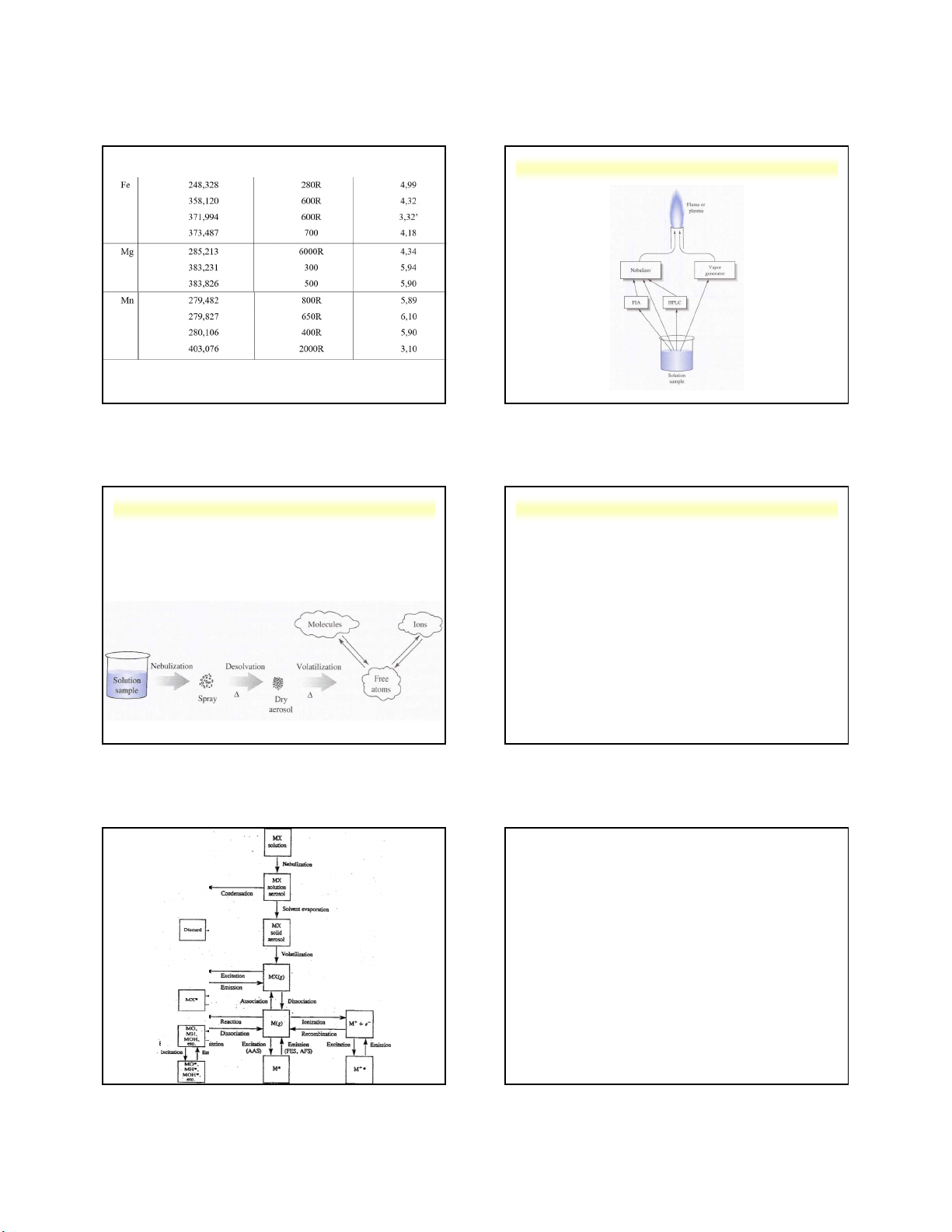
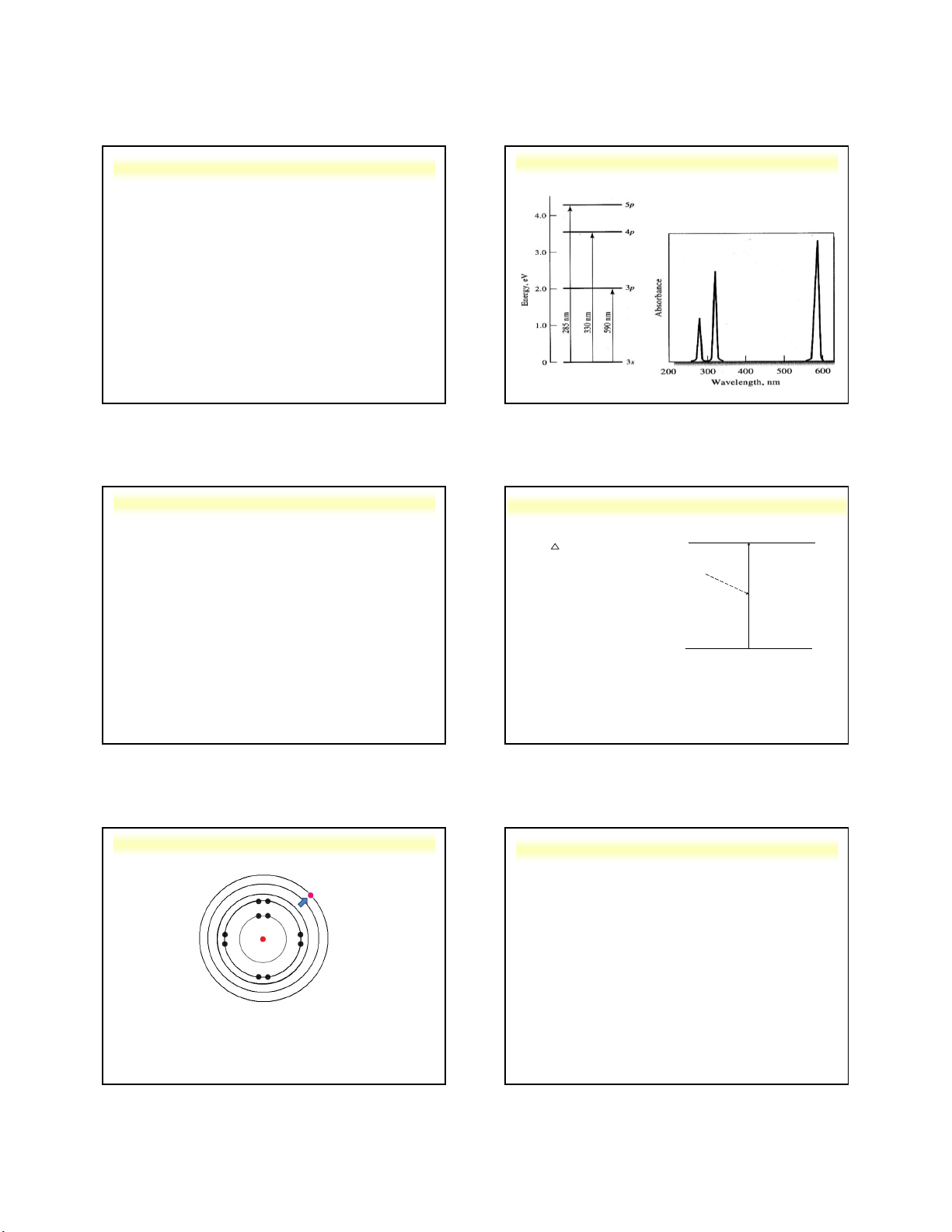
3.2. Sự xuất hiện phổ phát xạ nguyên tử 3 vạch phổ phát xạ nguyên tử của nguyên tố Na
Sơ đồ phân bố năng lượng trong nguyên tử và sự xuất hiện phổ
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/95
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/98 95 98
3.3. Tính đa dạng của phổ phát xạ:
Phổ phát xạ nguyên tử của Cr
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/99
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/102 99 102
3.3. Tính đa dạng của phổ phát xạ:
3.3. Tính đa dạng của phổ phát xạ:
- Phổ vạch: phổ của nguyên tử và ion. Vạch đặc trưng:
Nhóm phổ vạch của các nguyên tố hóa học hầu như
- Khi giảm hàm lượng của một nguyên tố, cường độ nằm trong vùng 190-1000nm.
các vạch quang phổ của nguyên tố đó giảm đi; một
- Phổ đám: phổ phát xạ của các phân tử và nhóm
số vạch sẽ biến mất do đó số vạch quang phổ sẽ giảm phân tử trong nền mẫu. dần.
VD: phổ của các phân tử MeO, CO, và nhóm phân tử
- Đến một nồng độ khá bé nào đó của nguyên tố, CN.
quang phổ của nó chỉ còn vài vạch, đó là các vạch
- Phổ nền: phổ phát xạ của vật rắn bị đốt nóng
đặc trưng của nguyên tố đang xét.
- Các vạch đặc trưng thường là thường là vạch phổ có
thế kích thích bé nhất.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/100
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/103 100 103
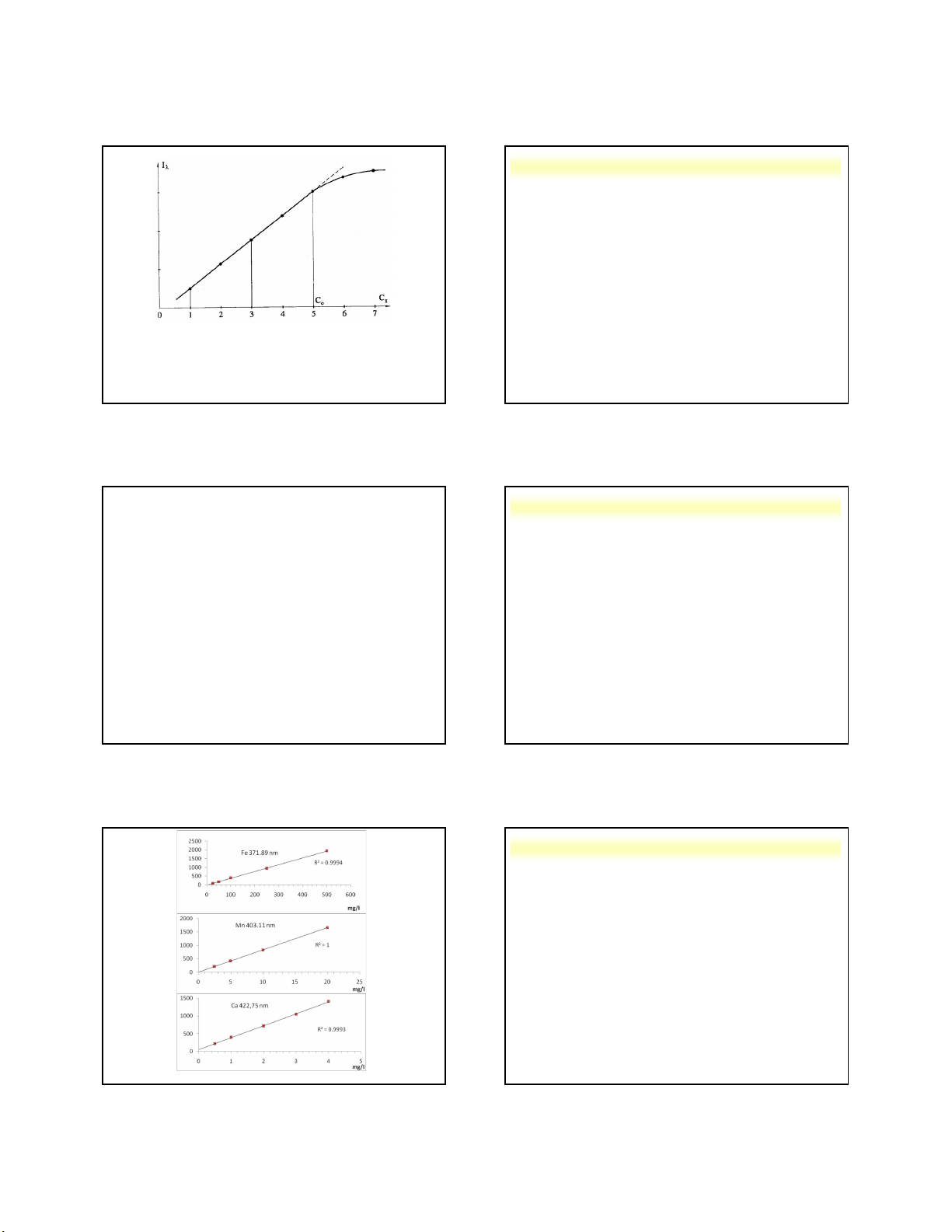
Vạch phổ phát xạ vùng nhìn thấy của các nguyên tố
Một số vạch đặc trưng của các nguyên tố
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/101
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/104 101 104
Một số vạch đặc trưng của các nguyên tố
3.4. Nguyên tắc của phép đo phổ phát xạ nguyên tử
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/105
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/108 105 108
3.4. Nguyên tắc của phép đo phổ phát xạ nguyên tử
3.4. Nguyên tắc của phép đo phổ phát xạ nguyên tử
1. Thực hiện quá trình hóa hơi và nguyên tử hóa mẫu.
2. Thu, phân li và ghi toàn bộ phổ phát xạ của vật mẫu
Sau đó thực hiện quá trình kích thích phổ của mẫu nhờ máy quang phổ.
(kích thích sự phát xạ đám hơi nguyên tử).
3. Đánh giá phổ đã ghi về mặt định tính và định lượng
theo những yêu cầu đặt ra.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/106
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/109 106 109 Đối tượng:
• Các nguyên tố hóa học chủ yếu là các kim loại và
một số phi kim (Si, P, C,…) nồng độ nhỏ trong các
loại mẫu khác nhau: địa chất, hóa học, luyện kim,
hóa dầu, nông nghiệp, thực phẩm, y dược, môi trường, ...
• Loại mẫu: rắn (bột, quặng), lỏng, khí
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/107
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/110 107 110 Ưu điểm:
3.5. Trang thiết bị của phép đo phổ phát xạ nguyên tử
- Độ nhạy cao: 10-3-10-4%; 10-5-10-6% với ICP
- Có thể phân tích đồng thời nhiều nguyên tố trong cùng 1 mẫu.
- Lượng mẫu tiêu tốn ít: ~ n101 mg Nhược điểm:
Chỉ cho biết thành phần của mẫu nghiên cứu mà
không chỉ ra được trạng thái liên kết của nó trong mẫu.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/111
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/114 111 114 Khả năng ứng dụng:
3.5.1. Các nguồn năng lượng dùng để kích thích phổ
Có thể xác định định tính, bán định lượng và định phát xạ
lượng hơn 50 nguyên tố kim loại và hơn 10 nguyên a. Ngọn lửa đèn khí
tố phi kim trong các đối tượng mẫu khác nhau. Đặc điểm:
- Ngành hóa và công nghiệp hóa
- Ngọn lửa đèn khí có nhiệt độ không cao (1700-3200oC). - Địa chất
- Chỉ kích thích được các kim loại kiềm và kiềm thổ - Luyện kim
- Dược phẩm, nông nghiệp, y và sinh học - ...
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/112
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/115 112 115
3.5.1. Các nguồn năng lượng dùng để kích thích phổ
3.5. Trang thiết bị của phép đo phổ phát xạ nguyên tử phát xạ a. Ngọn lửa đèn khí P Wavelength Signal Processor Source Selector Detector Readout PP nguyên tử hóa mẫu Ngọn lửa (Flame) Hồ quang (Arc) Tia lửa điện (Spark) Sample
Cảm ứng cao tần plasma (ICP)
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/113
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/116 113 116 b. Hồ quang điện
3.5.1. Các nguồn năng lượng dùng để kích thích phổ phát
Hồ quang là sự phóng điện giữa 2 điện cực có thế thấp (dưới xạ 260V) và dòng cao (8-20A). c. Tia lửa điện
Tia lửa điện là sự phóng điện giữa hai điện cực có thế hiệu
rất cao (10.000 - 20.000kV) và dòng điện rất thấp (<1A).
Nó là sự phóng điện gián đoạn từ 50 - 300 chu kì trong một giây. Đặc điểm:
- Là nguồn kích thích phổ có năng lượng tương đối cao, 4000-6000oC.
-Tia lửa điện là nguồn kích thích tương đối ổn định và có độ
lặp lại cao. Nhưng về độ nhạy lại kém hồ quang điện.
- Điện cực không bị đốt nóng đỏ. Nên tia lửa điện là nguồn
kích thích phù hợp đối với phép phân tích các mẫu thép,
hợp kim và dung dịch, nhưng lại không phù hợp cho việc
phân tích các mẫu quặng, đất đá và bột vì không hóa hơi tốt các mẫu loại này.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/117
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/120 117 120 b. Hồ quang điện
3.5.1. Các nguồn năng lượng dùng để kích thích Đặc điểm: phổ phát xạ
- Hồ quang là nguồn kích thích có năng lượng trung bình 3500- 6000oC.
d. Plasma cao tần cảm ứng
- Nhiệt độ của hồ quang phụ thuộc rất nhiều vào bản chất của Đặc điểm:
vật liệu làm điện cực.
- Nguồn năng lượng này có nhiệt độ cao. Có thể đạt được
nhiệt độ từ 5000 – 10000OC, nên hóa hơi và nguyên tử
hóa được hết mọi trạng thái của vật liệu mẫu với hiệu
suất cao. Các hợp chất bền nhiệt cũng bị hóa hơi và
phân li thành nguyên tử tự do, nhưng trong nguồn năng
lượng này phổ phát xạ của ion là chủ yếu.
- Độ nhạy, độ ổn định của phép phân tích cao ~10-4-10-6%, sai số nhỏ (<10%).
- Khoảng tuyến tính rộng 1-104 lần
- Ít bị ảnh hưởng bởi chất nền.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/118
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/121 118 121
3.5.1. Các nguồn năng lượng dùng để kích thích
- Hồ quang là nguồn kích thích cho độ nhạy tương phổ phát xạ
đối cao, mẫu phân tích được hóa hơi tương đối dễ
d. Plasma cao tần cảm ứng
dàng. Nhưng độ lặp lại kém. Hồ quang dòng xoay
chiều ổn định hơn hồ quang dòng 1 chiều.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/119
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/122 119 122
3.5.1. Các nguồn năng lượng dùng để kích thích
3.5.3. Bộ ghi và hiển thị tín hiệu phổ phát xạ
d. Plasma cao tần cảm ứng - Kính ảnh - Điện kế - Ghi trên băng giấy
- Ống nhân quang thu, khuyếch đại và ghi tín hiệu
dưới dạng số, hiển thị trên máy tính
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/123
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/126 123 126
3.5.1. Các nguồn năng lượng dùng để kích thích
3.6. Phân tích bằng phương pháp phổ phát xạ nguyên tử phổ phát xạ
d. Plasma cao tần cảm ứng 3.6.1. Định tính:
- Dựa vào các vạch phổ phát xạ đặc trưng (ít nhất 2 vạch) - Yêu cầu:
+ Vạch phổ phải rõ ràng, không trùng lẫn
+ Vạch phổ nhạy (tín hiệu lớn)
+ Tùy thuộc vào nguồn năng lượng đã dùng để kích
thích phổ mà chọn vạch nguyên tử hay ion.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/124
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/127 124 127 3.5.2. Hệ quang học
- Bộ chuẩn trực và khe vào
- Bộ phân ly (tán sắc) chùm sáng đa sắc thành phổ đơn sắc
- Bộ chuẩn trực để hội tụ những tia cùng bước sóng lên mặt phẳng tiêu
- Ngoài 3 bộ phận chính ở trên, để thu được tốt chùm
sáng phát xạ của mẫu, còn có hệ thống lọc, gương, ...
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/125
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/128 125 128
3.6. Phân tích bằng phương pháp phổ phát xạ nguyên tử 3.6.2. Định lượng
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/129
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/132 129 132
Phổ AES của chuẩn đa nguyên tố: Fe, Co, Ni, Ba (25 ppm); Mg, Cu,
3.6.2. Phân tích định lượng
Cr (10 ppm); Mn (5 ppm); Ca, Na (1 ppm) trong HNO3 0,1N, KCl 0,2% a. Định luật Bolzmans
Ở một nhiệt độ xác định, khi cân bằng nhiệt được thiết lập thì tỉ
lệ tương đối của 2 trạng thái là: m E g m N N . kT e m 0 g Trong đó, 0
- Nm là số nguyên tử của nguyên tố A ở trạng thái kích thích năng lượng Em
- N0 là số nguyên tử của nguyên tố A trong trạng thái hơi
- g0, gm là trọng lượng thống kê của nguyên tố A ở trạng thái ban đầu và kích thích.
- k: hằng số Bolzmans (1.381 10-23 J/K)
- T là nhiệt độ của plasma (trạng thái hơi).
(Độ nhạy liên quan đến N
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/130 m)
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/133 130 133
Mẫu (300 -440 nm) : Fe (blue), Mn (green); Ca (grey) b. Cường độ vạch phổ
Iλ là cường độ của vạch phổ sinh ra do quá trình kích thích phổ
I = f . h . 1/ . Am-o . Nm
= f . h . 1/ . Am-o . No . (gm/go). e – Em/k.T
Am-o: xác suất chuyển mức của nguyên tử A từ trạng thái cơ bản
lên trạng thái kích thích.
h: năng lượng của chùm tia phát xạ
τm: thời gian tồn tại của nguyên tử ở trạng thái kích thích
f: lực dao động của nguyên tử trong trạng thái kích thích
Trong những điều kiện nhất định và đối với 1 nguyên tố và một
vạch phổ thì: f, , k, h, Am-o, gm, go đều không đổi, nên: I = k1 . N0
Mặt khác, nếu nồng độ chất phân tích C. N0 = k2 . Cb I = k1.k2 . Cb = K. Cb
k1, k2 gọi là được gọi là hằng số thực nghiệm
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/131
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/134 131 134
3.6.2. Phân tích định lượng
d. Nguyên nhân hàm I = f(C) không tuyến tính
- Nồng độ chất phân tích quá lớn
Phần lớn chất phân tích ở trạng thái cơ bản, chúng
hấp thụ bức xạ phát xạ từ các nguyên tử ở trạng thái kích thích. F-AAS: 10-100 g/mL - Nhiễu nền
Ví dụ: nguyên tố Na có phát xạ tại 285.28 nm sẽ bị ảnh C
hưởng bởi phát xạ của Mg tại 285.21 nm trong nền
x < C0 thì b luôn bằng 1 C mẫu
x > C0 thì b nhỏ dần xa 1
C0 gọi là nồng độ giới hạn của vùng tuyến tính, các vạch phổ
càng nhạy thì C0 càng nhỏ và ngược lại.
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/135
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/138 135 138
c. Cường độ vạch phổ và nhiệt độ nguyên tử hoá
d. Nguyên nhân hàm I = f(C) không tuyến tính mẫu
Khắc phục: Thêm chất bảo vệ như EDTA, 8-
- Với 1 vạch phổ của một nguyên tố, thực tế chỉ có 1
hydroxyquinol, APDC (amino pyrrolidine-1
nhiệt độ tạo ra được cường độ I cực đại. Nhiệt độ này
carbodithioate) để tạo phức bền dễ bay hơi với chất
gọi là nhiệt độ tới hạn của vạch phổ, T0. phân tích
- Cùng một nguyên tố, trong các nền mẫu khác nhau
Ví dụ: xác định Ca, nếu them EDTA sẽ loại bỏ/giảm thì T 2- 3- 2- 0 cũng khác nhau.
ảnh hưởng của SiF6 , PO4 , SO4
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/136
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/139 136 139
3.7. Ứng dụng phân tích của AES
- Nguyên tố vi lượng, độc hại trong môi trường đất, nước, không khí
- Nguyên tố vi lượng trong y học, dược phẩm, thẩm phẩm
- Nguyên tố vi lượng trong nông nghiệp như phân bón, thức ăn gia súc
- Kiểm chất chất trong hóa học công nghiệp - …
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/137
Nguyễn X. Trường – ANACHEM-SCE-HUST-5/140 137 140
PHƯƠNG PHÁP PHÂN TÍCH CÔNG CỤ
4.1. Sự xuất hiện phổ hấp thụ nguyên tử
PHẦN I: Các PP phân tích quang phổ
Chương 4: Phương pháp phổ hấp thụ nguyên tử
Nguyễn X. Trường – ANACHEM-SCE-HUST-2/141
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/144 141 144
4.1. Sự xuất hiện phổ hấp thụ nguyên tử
4.2. Sự hấp thụ ánh sáng của nguyên tử
Khi nguyên tử ở trạng thái hơi tự do bị kích thích
bởi bxđt có tần số xác định (ứng đúng với những E E = E 2 2 - E1
bức xạ quang học phát xạ), nó sẽ chuyển sang trạng
thái kích thích có mức năng lượng cao hơn. Phổ sinh = h h = c /ν
ra trong quá trình này gọi là phổ hấp thụ nguyên tử. hc/(E2 - E1 )
E2 = trạng thái kích thích E1 = trạng thái cơ bản h = hằng số Planck E1
ν = tần số sóng kích thích e- A = lg(I0/I) = Ka x N x L
Ka: là hệ số hấp thụ nguyên tử đặc trưng cho từng bước sóng hấp thụ của mỗi nguyên tố
N: nồng độ nguyên tử tự do ở trạng thái hơi
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/142
L: bề dày của lớp hấp thụ
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/145 142 145
4.1. Sự xuất hiện phổ hấp thụ nguyên tử
4.3. Nguyên tắc của phép đo phổ hấp thụ nguyên tử Na: 1s22s22p63s1 Nguyên tắc:
1. Hóa hơi và nguyên tử hóa mẫu
2. Chiếu chùm tia sáng bx đặc trưng của nguyên tố
cần phân tích qua đám hơi nguyên tử hóa.
3. Thu, phân li chọn 1 vạch phổ hấp thụ của nguyên
tố cần nghiên cứu để đo cường độ. Ng N u g y u ê y n ê nt ử t Na N aở ttr r ạ ạ n n g g tth h á ái i c kíơ c b h ả t n hích
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/146 143 146 Hệ thống AAS
4.5.1. Nguồn phát bức xạ đơn sắc
1. Đèn catot rỗng – Hollow-Cathode Lamp (HCL)
2. Đèn phóng điện không điện cực – Electroless Discharge Lamp (EDL)
3. Nguồn phát bức xạ đã được biến điệu: laser, ...
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/147
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/150 147 150
4.4. Cường độ vạch phổ hấp thụ nguyên tử
4.5.1. Nguồn phát bức xạ đơn sắc Aλ = lg(I0/I) = Ka x N x L Yêu cầu:
• BX đơn sắc phải là các tia bức xạ nhạy đối với
nguyên tố cần phân tích. Tần số của bức xạ (bước
• F là tốc độ dẫn mẫu vào hệ thống nguyên tử hóa (ml/phút),
sóng) ứng đúng với những tia bức xạ mà nó có thể
• W là hiệu suất sol hóa mẫu,
phát ra trong quá trình phát xạ.
• s là hiệu suất nguyên tử hóa,
• Chùm tia sáng phải có cường độ ổn định, lặp lại
• n0 là số phân tử khí ở nhiệt độ ban đầu, T0,
được trong các lần đo khác nhau trong cùng điều
• nT là số phân tử khí ở nhiệt độ T của ngọn lửa nguyên tử hóa,
kiện và phải điều chỉnh được để có cường độ cần
• Q là tốc độ của dòng khí mang mẫu vào buồng sol hóa (lít/phút), thiết trong mỗi phép đo.
• C là nồng độ của nguyên tố phân tích có trong dung dịch mẫu. Aλ = a. Cb
a: gọi là hằng số thực nghiệm
b: gọi là hằng số bản chất (0 < b ≤ 1)
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/148
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/151 148 151
4.5. Sơ đồ khối và nguyên lý hoạt động của máy Đèn catot rỗng
quang phổ hấp thụ nguyên tử
Anot được chế tạo bằng kim loại trơ và bền nhiệt như Pt, W,…
Catot được chế tạo có dạng hình ống rỗng và chính bằng kim
loại cần phân tích với độ tinh khiết cao ( > 99,9 %).
Hiện nay, có cả đèn kép đôi, kép ba hay kép 6 nguyên tố (Cu+Mn+Cr+Fe+Co+Ni).
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/149
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/152 149 152
Đèn Phóng Điện Không Điện Cực
Nhiệt độ của ngọn lửa
Nguồn năng lượng cảm ứng tạo ra ở tần số cao 100 kHz – 100 MHz (radiofrequency)
Chất trong đèn là vài mg kim loại hay muối kim loại dễ
bay hơi của nguyên tố phân tích.
Nguồn bức xạ mạnh hơn đèn catot rỗng gấp 10 lần
Sử dụng cho những nguyên tố kém nhạy với đèn catot
rỗng như As, Se, Te, Hg, Pb, …Nguyễn X. Trường –ANACHEM-SCE-HUST-6/153
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/156 153 156
4.5.2. Các kỹ thuật nguyên tử hoá mẫu
Nguyên tử hóa mẫu: Là quá trình hoá hơi và nguyên secondary
tử hoá chất phân tích thành nguyên tử tự do. interzonal
(a) Ngọn lửa (Flame AAS : F-AAS)
(b) Không ngọn lửa (Electrothermal Atomization - ETA-AAS)
- Lò graphit AAS (Graphite Furnace - GFAAS) Primary zone
- Hydrua hóa (Hydride Vapor Generator - HVG)
- Hoá hơi lạnh (Mercury Vapor Unit - MVU) Maximum temperature 5-157
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/154 154 157 a. Ngọn lửa VD: dung dịch muối KCl KCls K+aq + Cl-aq 1. Bay hơi dung môi
Ngọn lửa tạo thành do sự K+aq + Cl-aq KCls
kết hợp của khí oxi hoá
2. Chất rắn chảy và hóa hơi (không khí, NO KCls KClg 2,…) và khí đốt (H 3. Nguyên tử hóa 2, acetylen,…). KClg Kg + Clg
4. Nguyên tử bị kích thích hoặc
ion hóa (hấp thụ năng lượng do va chạm) K K* K K+ + 1e
5. Nguyên tử bị kích thích (hấp thụ bức xạ) K K* …
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/155
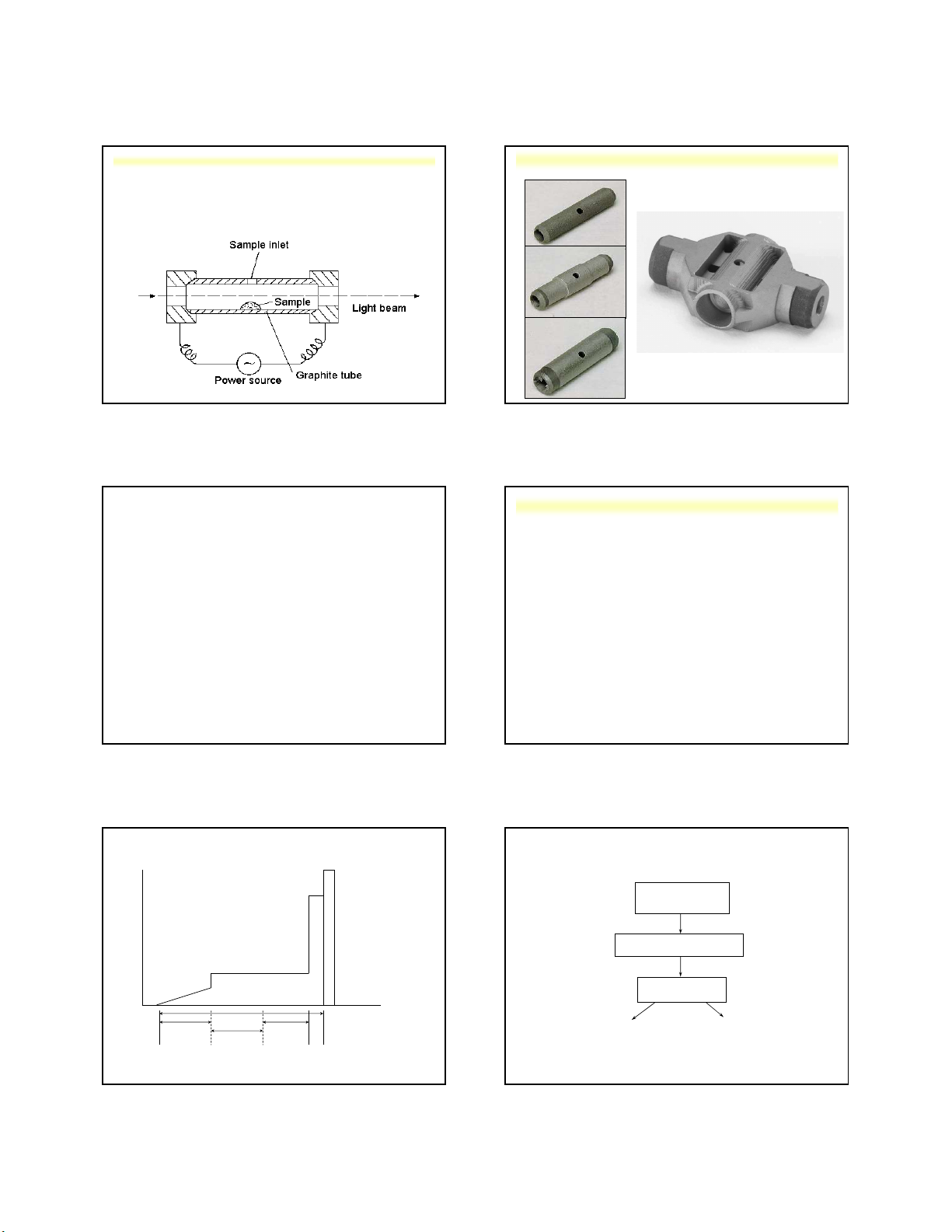
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/158 155 158 b. Không ngọn lửa
Cuvet để nguyên tử hoá mẫu
• Nguyên tử hóa sử dụng lò graphit (GF-AAS)
Là quá trình nguyên tử hóa bằng nhiệt điện.
Dạng mẫu: lỏng hoặc rắn, được nạp trực tiếp vao hệ thống
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/159
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/162 159 162
Các quá trình khi nguyên tử hóa bằng lò graphit b. Không ngọn lửa
1a. Quá trình làm khô mẫu - Loại dung môi
• Nguyên tử hóa sử dụng bộ tạo hydrua (HVG-AAS)
- Việc lựa chọn nhiệt độ phụ thuộc vào nhiệt độ bay hơi của dung
môi, không quá cao tránh xảy ra hiện tượng bắn mẫu.
- Sử dụng để xác định các nguyên tố dễ hóa hơi như
- Thông thường ở nhiệt độ khoảng 110OC Se, As, Sn, Sb, Te, Bi. 2a. Quá trình tro hóa
- Các nguyên tố được chuyển về dạng hơi kim loại bằng
- Các hợp chất hữu cơ bị tro hóa hoặc chuyển thành H2O, CO2, và
cách cho phản ứng với NaBH4 trong môi trường axit:
các hợp chất vô cơ bay hơi. H
- Nhiệt độ đủ cao để loại các hợp chất bay hơi mà không làm mất
2Se; AsH3, H2Te, SbH3, SnH4, … chất phân tích.
3a. Quá trình nguyên tử hóa
- Thường ở nhiệt độ khoảng 2000 – 3000oC 4a. Quá trình làm sạch
- Nhằm làm bay hơi các chất bẩn như các kim loại hoặc muối còn
lại nằm trong ống graphit.
- Thông thường nhiệt độ làm sạch sẽ cao hơn nhiệt độ nguyên tử hóa khoảng 200oC
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/160
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/163 160 163
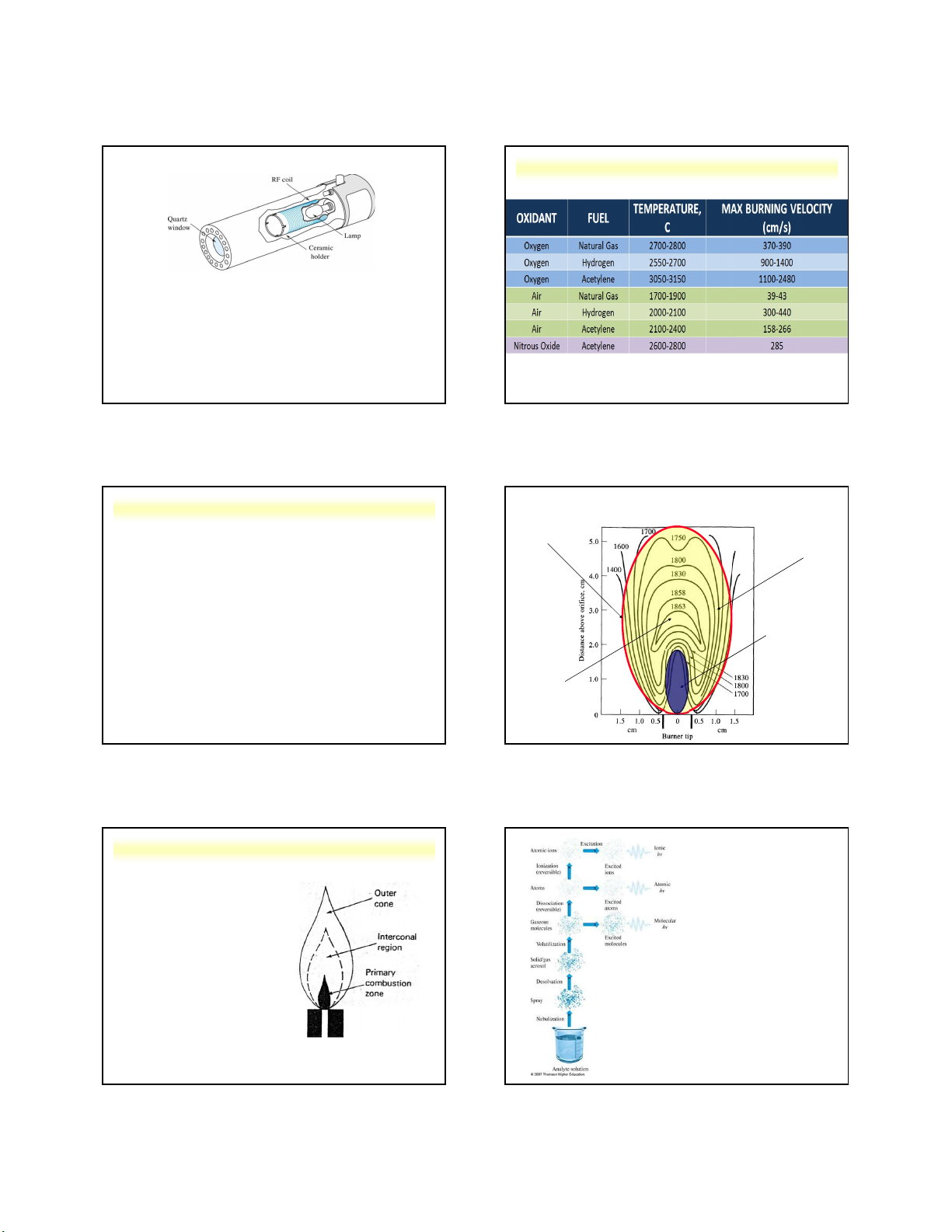
Các bước thay đổi nhiệt độ trong lò Hydrua hoá (HVG) Làm sạch Nguyên tử hoá ) Se, As, Sn, Sb, Te C Bi o hiệt độ ( Hoá hơi Hydrua N Tro hoá Làm khô Nguyên tử hoá Thời gian (s) Outer gas (Ar) Inner gas (Ar) Ngọn lửa Nhiệt Inner gas (O2) 0 20 35 50 54
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/161
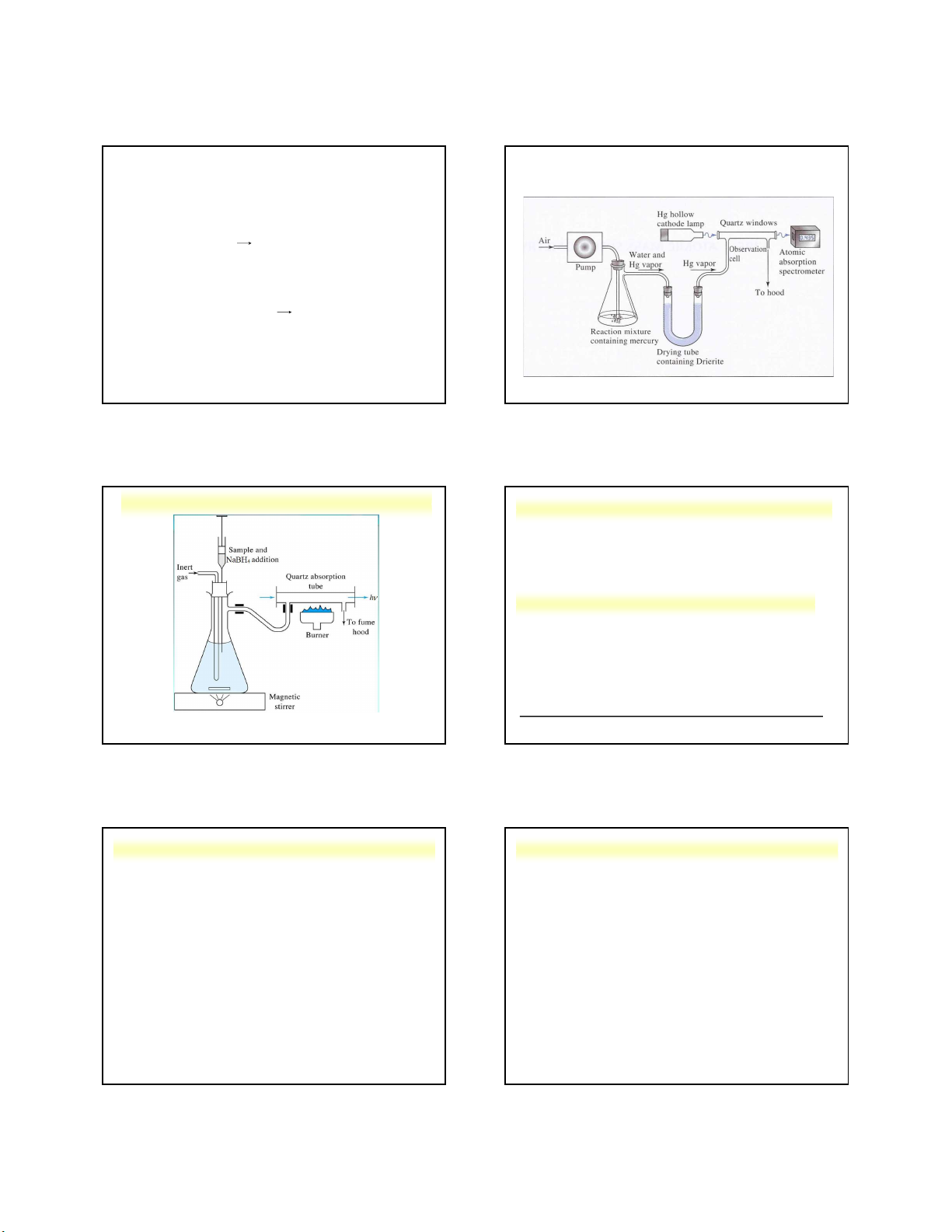
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/164 161 164 Hydrid hoá (HVG)
Hoá hơi lạnh (Mercury Vapor Unit - MVU) BH - 4 + 3H2O + H+
H3BO3 + 4H2 (hidro mới sinh) 3BH - 4 + 3H + + 4H3AsO3 4AsH3 + 3H2O + 3H3BO3
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/165
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/168 165 168 Hydrid hoá (HVG) 4.5.3. Bộ đơn sắc 1. Cách tử nhiễu xạ
2. Hệ thống truyền ánh sáng (khe vào, gương, thấu kính, khe ra) 4.5.4. Detector Ống nhân quang
Nguyên lý và cấu tạo của Bộ đơn sắc và Detector xem chương 2 3BH -
4 +3H+ +4H3AsO3 3H3BO3 + 4AsH3 + 3H20
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/166
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/169 166 169 b. Không ngọn lửa
4.6. Phân tích định lượng bằng phổ hấp thụ nguyên tử
• Bộ hóa hơi lạnh phân tích thủy ngân (MVU-AAS)
- Các phương pháp phân tích trực tiếp
- Ion Hg2+ trong dung dịch bị khử thành Hg nguyên tố
- Các phương pháp phân tích gián tiếp: sử dụng để
(dễ bay hơi) bằng SnCl2 ở nhiệt độ phòng.
phân tích các nguyên tố không có phổ AAS. Sn2+ + Hg2+ = Hg0 + Sn4+
+ Thông qua việc đo phổ của 1 kim loại có phổ nhạy,
- Thích hợp cho phân tích thủy ngân trong môi nước và
KL này có khả năng tương tác với chất phân tích môi trường.
theo 1 phản ứng hóa học định lượng như: phản ứng
- Giới hạn phát hiện có thể đạt 0,1 ppb.
tạo kết tủa, tạo phức ít phân ly, …
+ Dựa theo hiệu ứng tăng hay giảm cường độ vạch phổ
AAS của 1 nguyên tố KL khi cho KL này tác dụng
với chất phân tích phù hợp.
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/167
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/170 167 170
4.6. Phân tích định lượng bằng phổ hấp thụ nguyên tử
4.7. Các yếu tố gây ảnh hưởng đến quá trình đo phổ hấp thụ nguyên tử Ưu điểm:
• Ảnh hưởng của các cation
- Độ nhạy và độ chọn lọc cao. Có thể xác định ~ 60
Trong dung dịch phân tích, ngoài nguyên tố cần xác định
nguyên tố hóa học, độ nhạy ~10-4-10-5%.
còn chứa nhiều cation lạ. Ảnh hưởng của các cation có thể
- Tốn ít nguyên liệu mẫu, tiết kiệm thời gian, trong
có hiệu ứng dương, hiệu ứng âm hoặc vừa có hiệu ứng
dương vừa có hiệu ứng âm ở các nồng độ khác nhau.
nhiều trường hợp không phải làm giàu.
Để loại trừ ảnh hưởng của các cation sử dụng một số biện
- Kết quả phân tích ổn định, sai số nhỏ (<15%). pháp sau: Nhược điểm:
* Chọn điều kiện xử lý mẫu phù hợp để loại các nguyên tố
lạ ra khỏi dung dịch phân tích
- Chỉ cho biết thành phần nguyên tố của chất ở trong
* Chọn các thông số máy đo thích hợp
mẫu phân tích mà không chỉ ra trạng thái liên kết.
* Chọn điều kiện thí nghiệm và điều kiện nguyên tử hoá mẫu thích hợp
* Thêm vào mẫu chất phụ gia phù hợp để loại trừ ảnh
hưởng của các cation như: LaCl3, SrCl3, AlCl3.
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/171
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/174 171 174
4.6. Phân tích định lượng bằng phổ hấp thụ nguyên tử
4.7. Các yếu tố gây ảnh hưởng đến quá trình đo phổ hấp thụ nguyên tử
Đối tượng và khả năng ứng dụng: •
Ảnh hưởng của các anion
- Phân tích lượng vết các kim loại và một số phi kim
+ Ảnh hưởng của các anion về cơ bản cũng tương tự
(Si, P, S, …) trong các loại mẫu khác nhau của các
như ảnh hưởng của các loại axít. Chỉ có 2 anion - chất vô cơ và hữu cơ.
ClO4 và CH3COO- là gây hiệu ứng dương, còn các
anion khác gây hiệu ứng âm theo thứ tự Cl- < NO - 3 <
- Phân tích các loại mẫu quặng, đất, đá, nước khoáng, CO 2- 3- 3 < PO4 < F-.
các mẫu y học, sinh học, các sản phẩm nông nghiệp,
+ Ảnh hưởng của các anion không lớn như các
rau quả, thực phẩm, nước uống, các nguyên tố vi
cation, nên để loại trừ ảnh hưởng của các anion ta
chỉ cần trong mỗi phép đo phải cho nồng độ của các
lượng trong phân bón, trong thức ăn gia súc, ...
anion trong mẫu phân tích và trong mẫu chuẩn như nhau là được.
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/172
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/175 172 175
4.7. Các yếu tố gây ảnh hưởng đến quá trình đo phổ
4.7. Các yếu tố gây ảnh hưởng đến quá trình đo phổ hấp thụ nguyên tử hấp thụ nguyên tử
• Ảnh hưởng của nồng độ axít và loại axít trong dung •
Ảnh hưởng của một loạt yếu tố khác như: dịch mẫu
+ Thành phần nền của mẫu, dung môi hữu cơ, độ
nhớt và sức căng bề mặt của dung dịch mẫu, sự ion
Nồng độ axít làm thay đổi độ nhớt của dung dịch, do
hoá, sự kích thích phổ phát xạ, sự chen lấn của vạch
anion gốc axít quyết định. Các axít càng khó bay hơi
phổ, sự hấp thụ của nền,…
thường càng làm giảm cường độ vạch phổ. Các axít
+ Để thu được kết quả tốt, khi làm thí nghiệm phải
dễ bay hơi gây ảnh hưởng ít. Axít làm giảm độ hấp
khống chế để dung dịch phân tích và dung dịch
thụ theo thứ tự HCl < HNO
chuẩn phải được tiến hành trong cùng điều kiện và
3 < H2SO4 < H3PO4 < HF.
tiến hành đo với các thông số tối ưu hoàn toàn như (thường dùng HCl, HNO3 1%) nhau.
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/173
Nguyễn X. Trường – ANACHEM-SCE-HUST-6/176 173 176




