



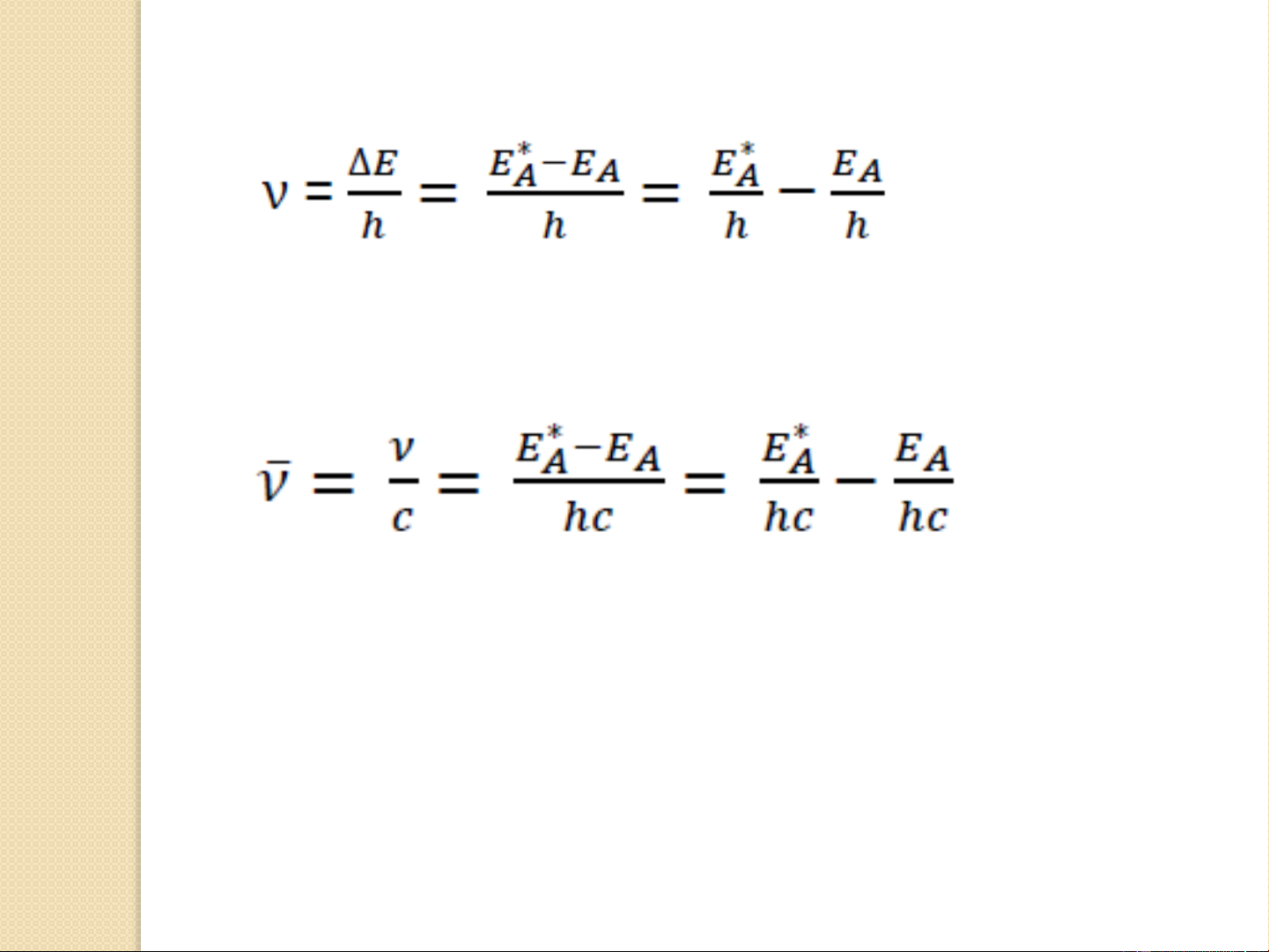







Preview text:
CHƯƠNG 3
Phương pháp quang phổ phát xạ nguyên tử
Atomic Emission Spectroscopy (AES) MP-AES
Khái niệm: Phương pháp phát xạ nguyên tử là
phương pháp vật lý xác định thành phần các chất
dựa vào tính chất đặc trưng của quang phổ phát ra
khi các nguyên tử bị kích thích.
Nguồn kích thích: 1. Ngọn lửa 2. Hồ quang điện 3. Tia lửa điện
4. Plasma cao tần cảm ứng (ICP) 2 Ứng dụng:
➢ Phân tích định tính.
➢ Phân tích bán định lượng và định lượng và bán
định lượng hấu hết các nguyên tố kim loại và một
số phi kim P, Si, As và B (Hơn 60 nguyên tố).
➢ Độ chọn lọc cao.
➢ Độ nhạy cao (μg/L).
➢ Ứng dụng phân tích AES trong địa chất, luyện
kim, nông nghiệp, y và sinh học. 3
3.1. Sự tạo thành phổ phát xạ nguyên tử
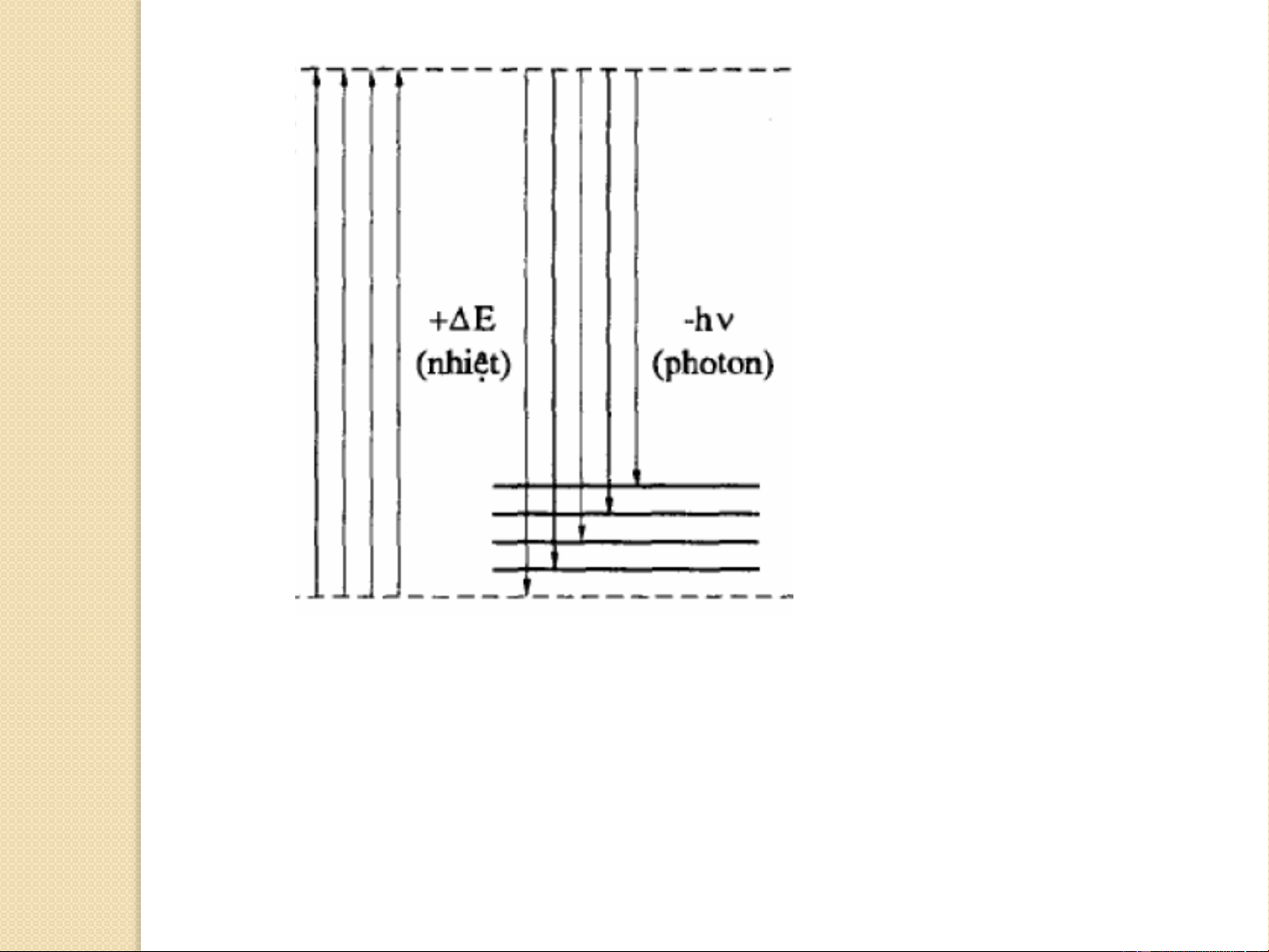
o Các nguyên tử có thể có một số mức năng lượng gián đoạn E1,
E , E , ... mà không có trạng thái năng lượng trung gian ví dụ giữa E 2 3 1
và E , hoặc giữa E và E ... 2 2 3
o Trong điều kiện bình thường các nguyên tử ở trạng thái năng
lượng thấp nhất E hay còn gọi là nguyên tử ở trạng thái cơ bản. 1
o Khi cấp năng lượng cho nguyên tử (ngọn lửa, hồ quang, tia lửa
điện, ...) các nguyên tử có thể chuyển động lên mức năng lượng cao
hơn E , E , ..., E ,... (trạng thái kích thích). 2 3 n
o Sau một khoảng thời gian ngắn (10-8-10-7s) các nguyên tử ở trạng
thái kích thích sẽ tự quay về trạng thái năng lượng thấp hơn.
o Năng lượng ΔE được giải phóng dưới dạng các lượng tử ánh sáng. 4 * E
(trạng thái kich thích) E Eo
∆E= E* - E = hν = hc/λ (3-1) 5
Tần số ν của ánh sáng được xác định theo hệ thức: (3-2)
Nếu đặc trưng cho bức xạ ánh sáng phát ra dưới
dạng số sóng theo hệ thức (3-3)
Từ công thức (3-2) và (3-3) cho thấy mọi bức xạ
điện từ khi bị kích thích liên quan đến trạng thái
năng lượng của nguyên tử. 6
3.2. Tính đa dạng của phổ AES
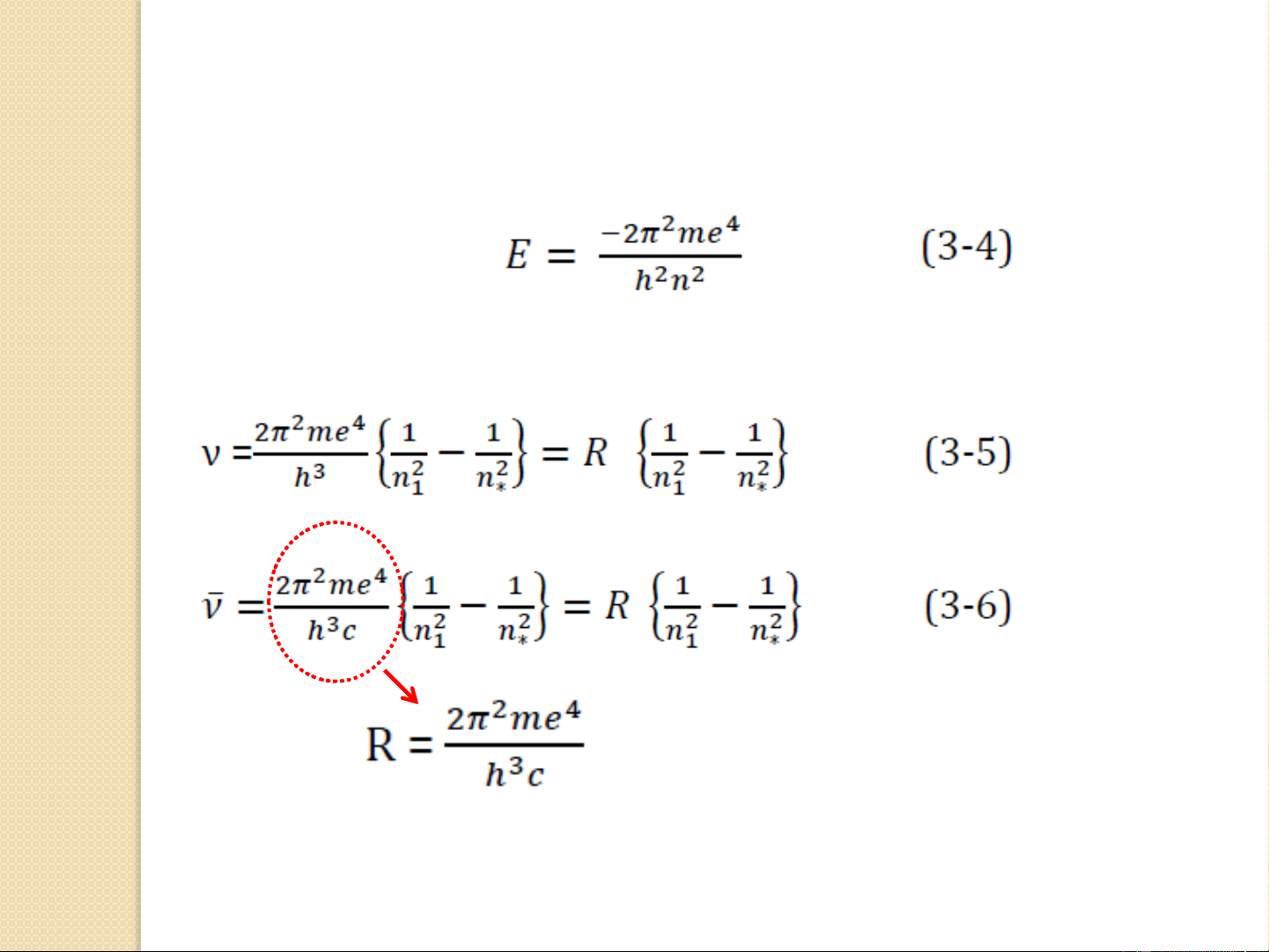
Thái năng lượng điện tử của nguyên tử hydro
Thay (3-4) vào (3-2) và (3-3) Hằng số Rydberg
(109687,76 cm-1 = 1.097 ×105 cm-1 )
n là số lượng tử chính của điện tử ở trạng thái cơ bản 1
n* số lượng tử chính của điện tử ở trạng thái kích thích 7 ∞ 0 KJ -82 KJ -146 KJ -328 KJ -1312 KJ
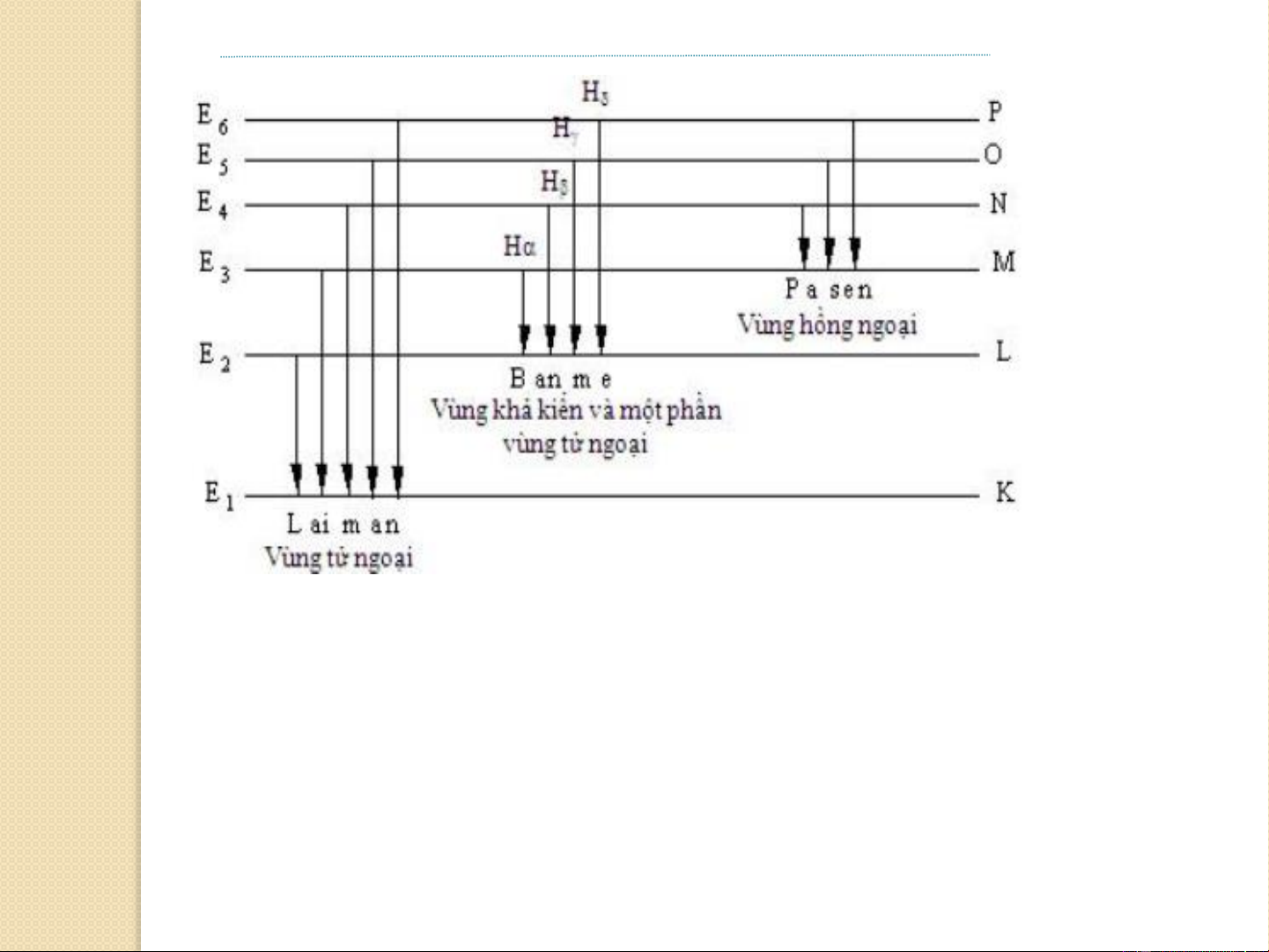
n = 1 và n* ≥2 ta có dãy Lyman 1
n = 2 và n* ≥3 ta có dãy Balmer 1
n = 3 và n* ≥4 ta có dãy Paschen 1 8
- Nhóm phổ vạch: Đó là phổ của nguyên tử và ion. Nhóm phổ vạch
này của các nguyên tố hóa học hầu như thường nằm trong vùng phổ
từ 190-1000 nm (vùng UV-VIS). Chỉ có một vài nguyên tố á kim hay
kim loại kiềm mới có một số vạch phổ nằm ngoài vùng này.
-Nhóm phổ đám: Đó là phổ phát xạ của các phân tử và nhóm phân tử.
Ví dụ phổ của phân tử MeO, CO và nhóm phân tử CN. Các đám phổ
này xuất hiện thường có một đầu đậm và một đầu nhạt. Đầu đậm ở
phía sóng dài và nhạt ở phía sóng ngắn. Trong vùng tử ngoại thì phổ
này xuất hiện rất yếu và nhiều khi không thấy. Nhưng trong vùng khả
kiến thì xuất hiện rất đậm, và làm khó khăn cho phép phân tích quang
phổ vì nhiều vạch phân tích của các nguyên tố khác bị các đám phổ này che lấp.
- Phổ nền liên tục: Đây là phổ của vật rắn bị đốt nóng phát ra, phổ
của ánh sáng trắng và phổ do sự bức xạ riêng của điện tử. Phổ này
tạo thành một nền mờ liên tục trên toàn dải phổ của mẫu, nhạt ở
sóng ngắn và đậm dần về phía sóng dài. Phổ này nếu quá đậm thì
cũng sẽ cản trở phép phân tích. 9
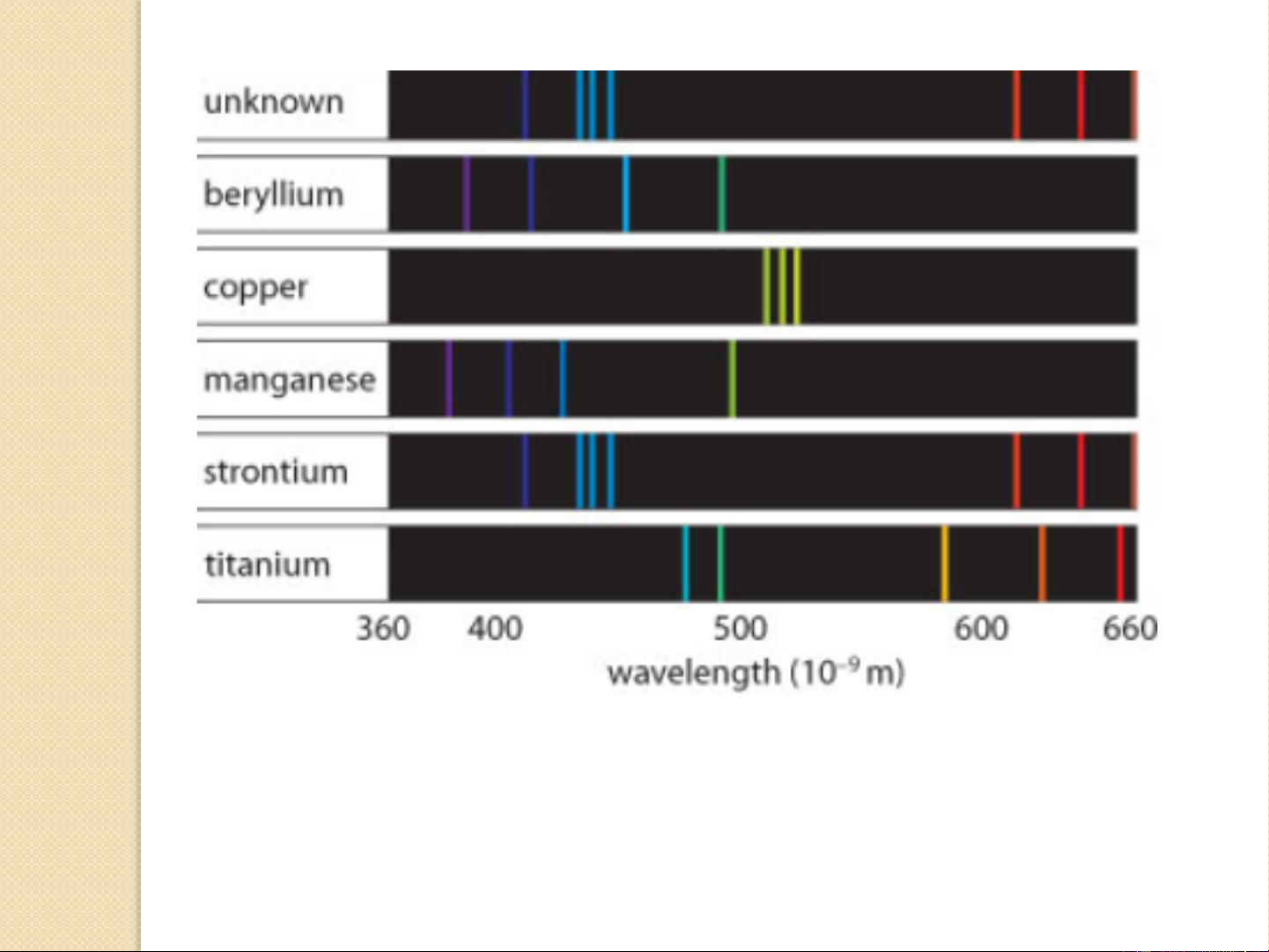
3.3. Các loại vạch phổ đặc trưng của một nguyên tố
Trong tập hợp các vạch phổ, thì mỗi loại nguyên tử hay ion lại
có một số vạch đặc trưng riêng cho nó. Các vạch phổ đó được
gọi là các vạch phổ phát xạ đặc trưng của loại nguyên tố ấy.
Từ các vạch phổ đặc trưng này người ta có thể nhận biết
được sự có mặt hay vắng mặt của một nguyên tố nào đó trong
mẫu phân tích qua việc quan sát phổ phát xạ của mẫu phân
tích, và tìm xem có các vạch phổ đặc trưng của nó hay không,
nghĩa là dựa vào các vạch phổ phát xạ đặc trưng của từng
nguyên tố để nhận biết chúng. Đó là nguyên tắc của phương
pháp phân tích quang phổ phát xạ định tính. 10
Điều kiện với các vạch phổ đặc trưng:
1. Những vạch phổ này phải rõ ràng và không trùng lẫn với
các vạch của nguyên tố khác, nhất là nguyên tố nồng độ lớn.
2. Nó phải là những vạch phổ nhạy, để có thể phát hiện được
các nguyên tố trong mẫu với nồng độ nhỏ (phân tích lượng vết).
3. Việc chọn các vạch phổ chứng minh cho một nguyên tố
phải xuất phát từ nguồn năng lượng đã dùng để kích thích
phổ của mẫu phân tích, vì trong nguồn kích thích có năng
lượng thấp thì phổ của nguyên tử là chủ yếu và vạch nguyên
tử của nó thường là những vạch nhạy. Ngược lại, trong
nguồn kích thích giầu năng lượng (ICP) thì phổ của Ion là chủ
yếu. Cho nên phải tùy thuộc vào nguồn năng lượng đã dùng
để kích thích phổ mà chọn vạch chứng minh là vạch nguyên
tử hay vạch ion cho phù hợp. 11
phương pháp phân tích quang phổ phát xạ định tính 12
Khi bị kích thích:
Nguyên tử Al phát ra vạch đặc trưng trong vùng UV: 308,215 nm; 309,271nm.
Nguyên tử Cu phát ra vạch đặc trưng trong
vùng UV: 324,754 nm; 327,396nm. 13
Các loại vạch phổ đặc trưng
1.Vạch cộng hưởng:
Là vạch quang phổ ứng với sự dịch chuyển e từ trạng thái cơ bản
sang trạng thái có năng lượng cao hơn gần nhất.
Những nguyên tố dễ bị kích thích thì vạch cộng hưởng xuất hiện
ngay cả khi năng lượng kích thích thấp: Na, K, Ca, Mg… 2. Vạch cuối cùng:
Là vạch còn lại sau cùng khi nồng độ nguyên tố đó giảm đến giới hạn.
Vạch có cường độ lớn nhất sẽ tồn tại cuối cùng → Vạch cuối cùng
sẽ là vạch ứng với thế kích thích E nhỏ nhất. k
Ví dụ: Cd hàm lượng 1% có 44 vạch 0,1% có 10 vạch 0,01% có 7 vạch
0,001% có 1 vạch (λ=2888,01 Ǻ) 14
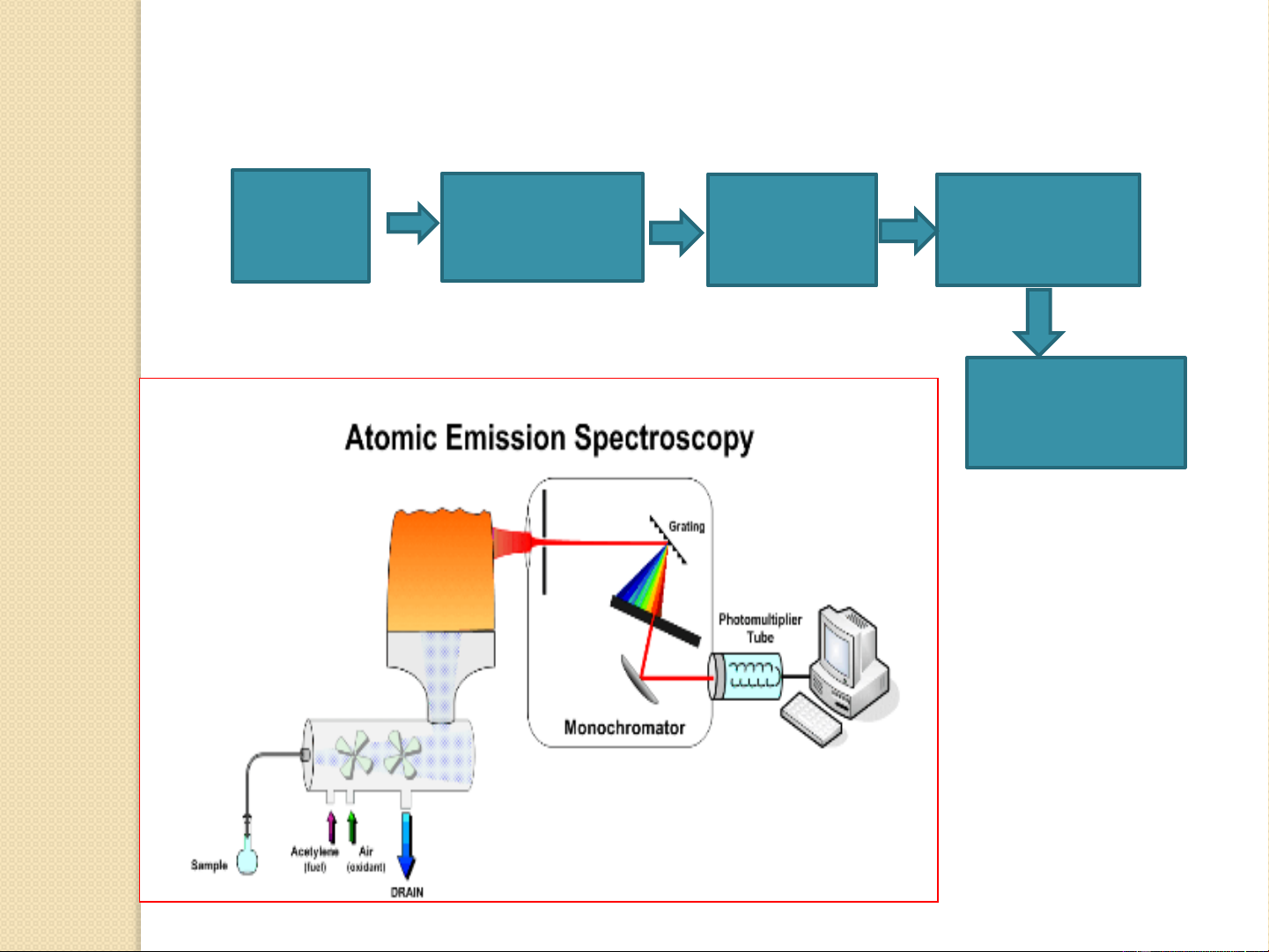
3.4. Sơ đồ thiết bị quang phổ phát xạ nguyên tử Ngồn NL Mẫu Hệ tán kích thích sắc Detector Computer 15
3.4.1. Ngồn kích thích Chức năng:
o Chuyển chất nghiên cứu (rắn lỏng) thành hơi.
o Nguyên tử hóa mẫu.
o Chuyển hóa nguyên tử lên trạng thái kích thích. Yêu cầu:
o Phải ổn định và bền vững theo thời gian, độ nhạy cao.
o Không đưa thêm phổ phát xạ lẫn với mẫu.
o Phải có khả năng thay đổi được nhiều thông số để có thể chọn
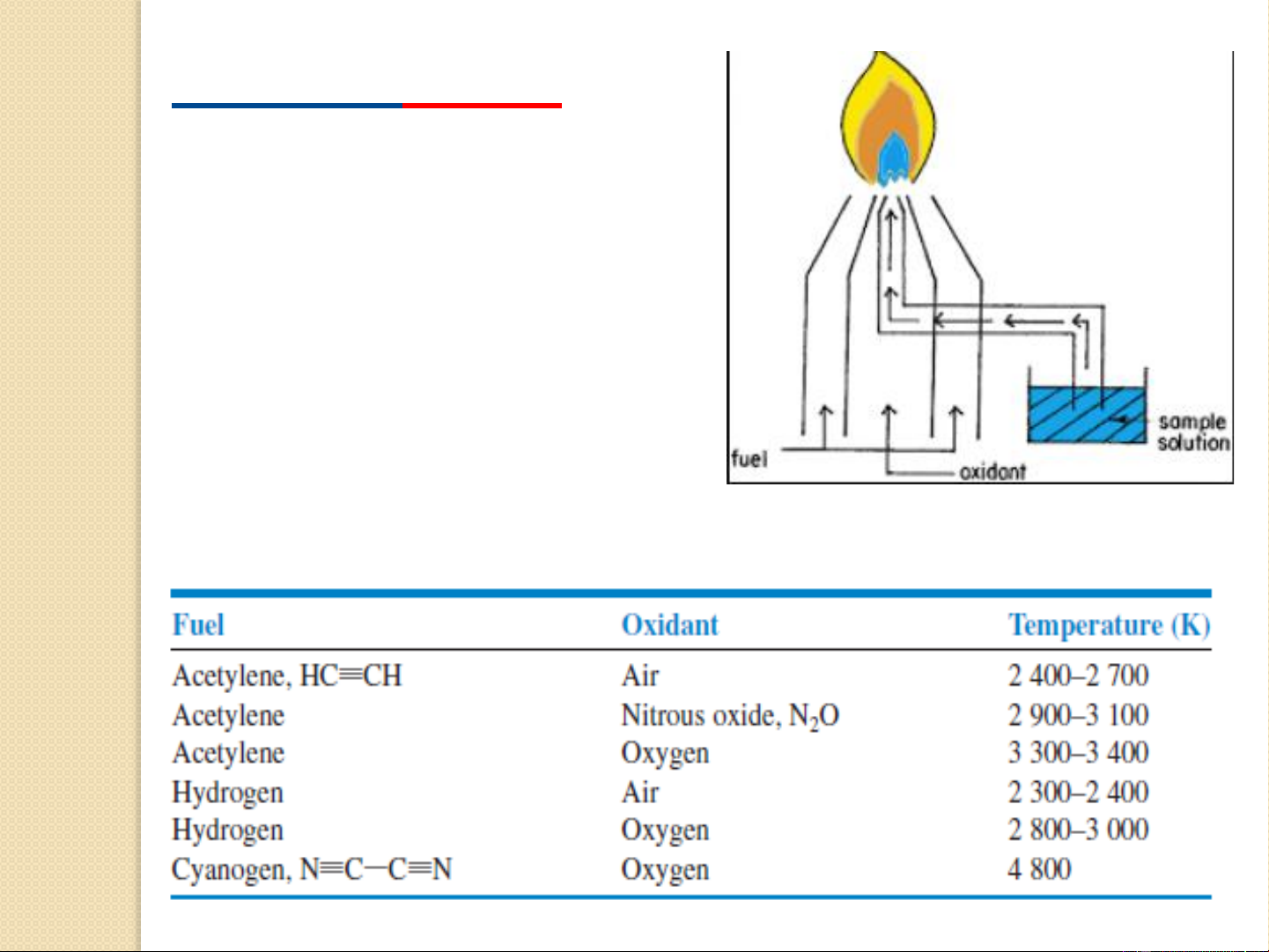
được những điều kiện thích hợp cho từng đối tượng phân tích. 16 Ngọn lửa (FAES)
❖ Là nguồn kích thích dùng cho
các chất không đòi hỏi nhiệt độ
cao để nguyên tử hóa và để kích thích phát xạ.
❖ Ngọn lửa thương dùng trong
việc phân tích các nguyên tố kim
loại kiềm, kiềm thổ, ..
Bảng 1. Nhiệt độ cao nhất của ngọn lửa 17 18
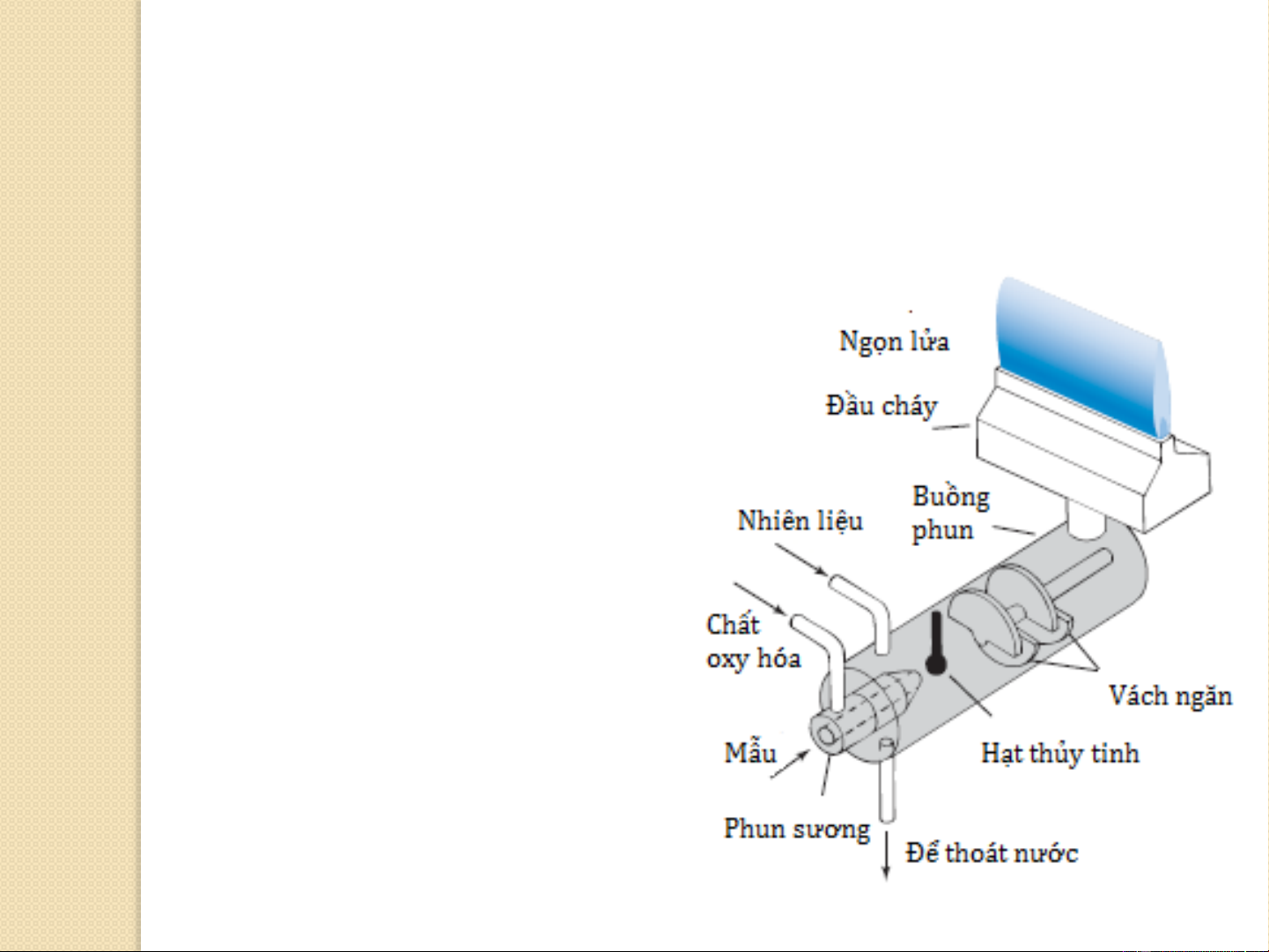
Hầu hết các quang phổ kế ngọn lửa sử dụng Premix Burner
o Nhiên liệu, chất oxy hóa, và mẫu được trộn lẫn trước khi đưa vào
ngọn lửa. Dung dịch mẫu được hút vào máy phun sương bởi dòng
chất oxy hóa (thường là không khí) qua mao quản của kim bơm mẫu.
o Chất lỏng bị phá ra dưới dạng
sương mù khi rời khỏi mao
quản. Quá trình phun được định
hướng bật vào một hạt thủy tinh,
khi đó những giọt phá vỡ thành
các hạt nhỏ hơn. Sự hình thành
của các giọt nhỏ được gọi là xông (nebulization).
o Sự phân tán tốt của chất lỏng
hay rắn trong khí được gọi là aerosol. Premix Burner 19
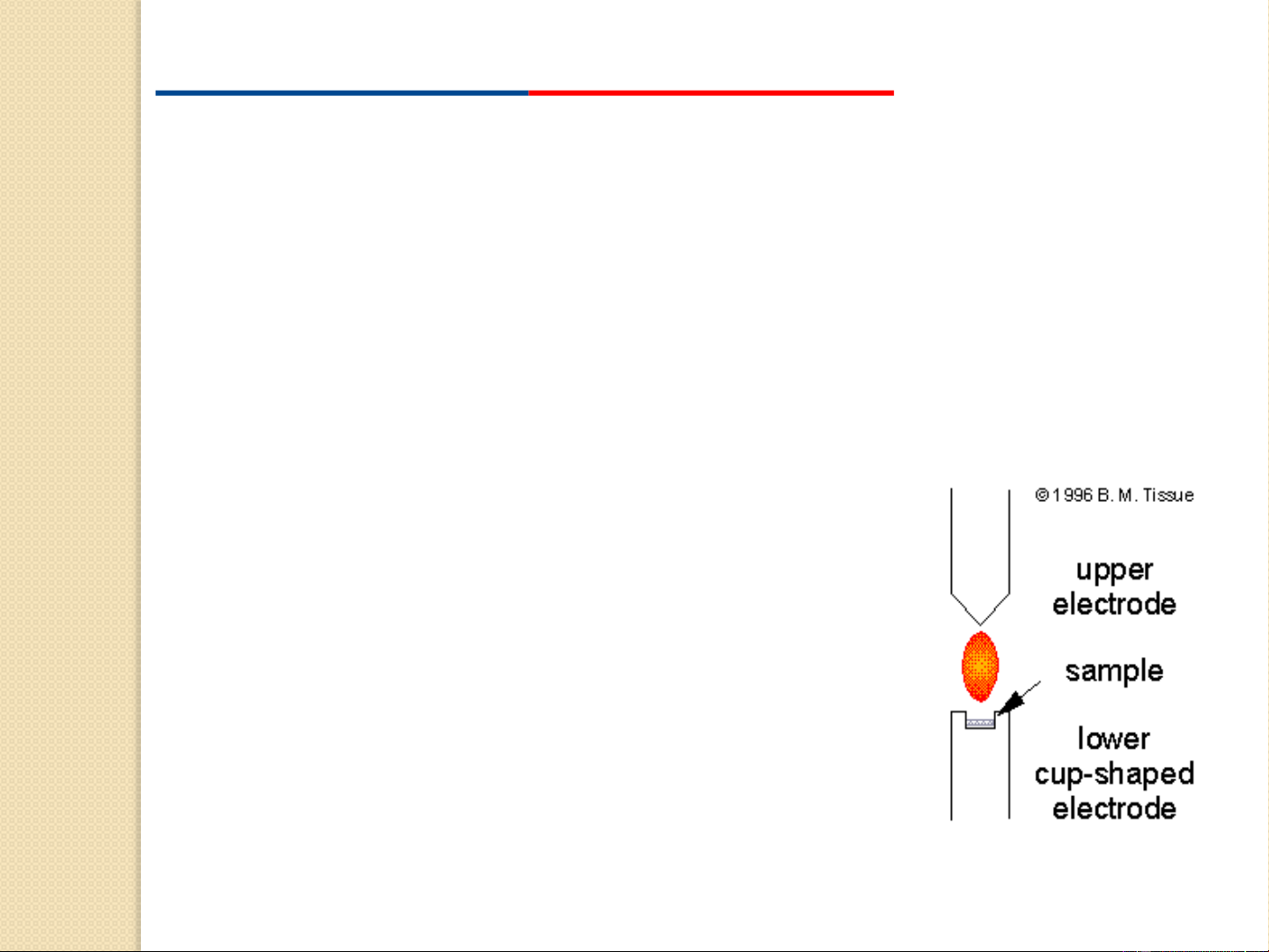
Hồ quang điện: (Arc Excitation)
• Nguồn kích thích có năng lượng trung bình và thông dụng.
• Nhiệt độ của hồ quang điện phụ thuộc vào cường độ dòng
điện và bản chất của nguyên liệu làm điện cực.
• Có khả năng kích thích cả mẫu dẫn điện và không dẫn điện.
• Mẫu phân tích ở dạng rắn hoặc dung dịch
• Khi phân tích các kim loại hay hợp kim thì các chất này
được dùng làm điện cực nối với catot của nguồn.
• Có thể dùng dòng điện một chiều hay
xoay chiều nhưng dòng xoay chiều có
độ nhạy và độ lặp lại cao hơn, điện cực
làm bằng than chì bền hơn so với dòng một chiều 110-220 V; 3-30 A 4000-8000 °C 20




