



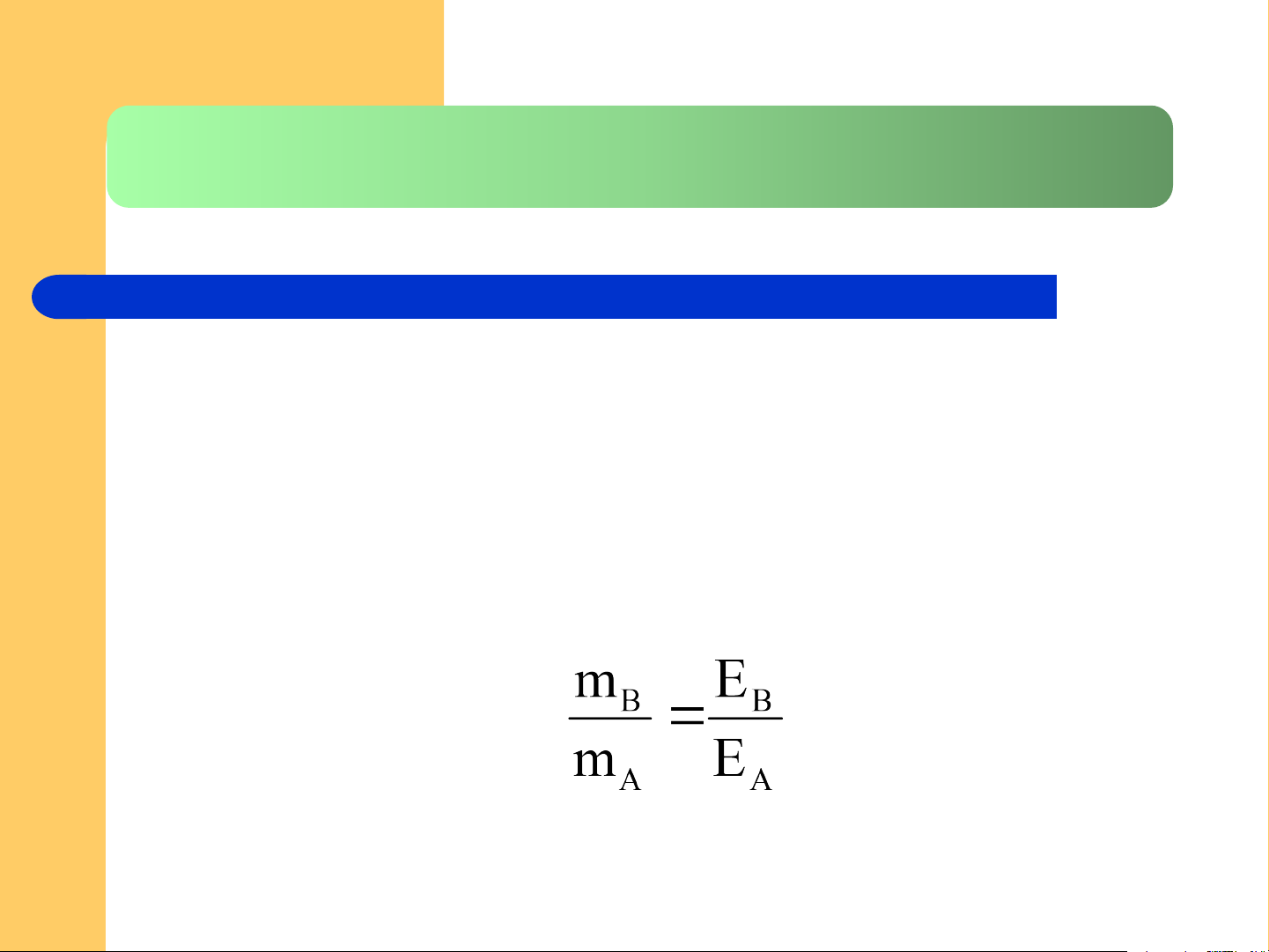








Preview text:
CHƯƠNG 4 DUNG DỊCH 1 Nội dung
4.1. Hệ phân tán và dung dịch
4.2. Nồng độ dung dịch và cách biểu diễn
4.3. Các tính chất của dung dịch
loãng chứa chất tan không bay hơi, không điện ly 2
4.1. Hệ phân tán và dung dịch
4.1.1. Các hệ phân tán
Hệ phân tán: hệ gồm 2 hay nhiều chất, trong đó 1
chất ở dạng hạt rất nhỏ được phân bố vào trong chất kia.
Hệ phân tán thô: kích thước của các hạt của pha
phân tán từ 10-7 – 10-4m. Hệ này không bền.
Dung dịch keo: hạt phân tán có kích thước 10-9 –
10-7m. Hệ này tương đối bền.
Dung dịch thật: hạt của pha phân tán bằng kích
thước của phân tử hoặc ion (≤ 10-10m). 3
4.1. Hệ phân tán và dung dịch 4.1.2. Dung dịch
Dung dịch là hệ đồng thể tạo bởi hai hay
nhiều chất mà thành phần của chúng
biến đổi trong phạm vi rộng.
Dung dịch cũng có thể là khí, lỏng hay rắn. 4
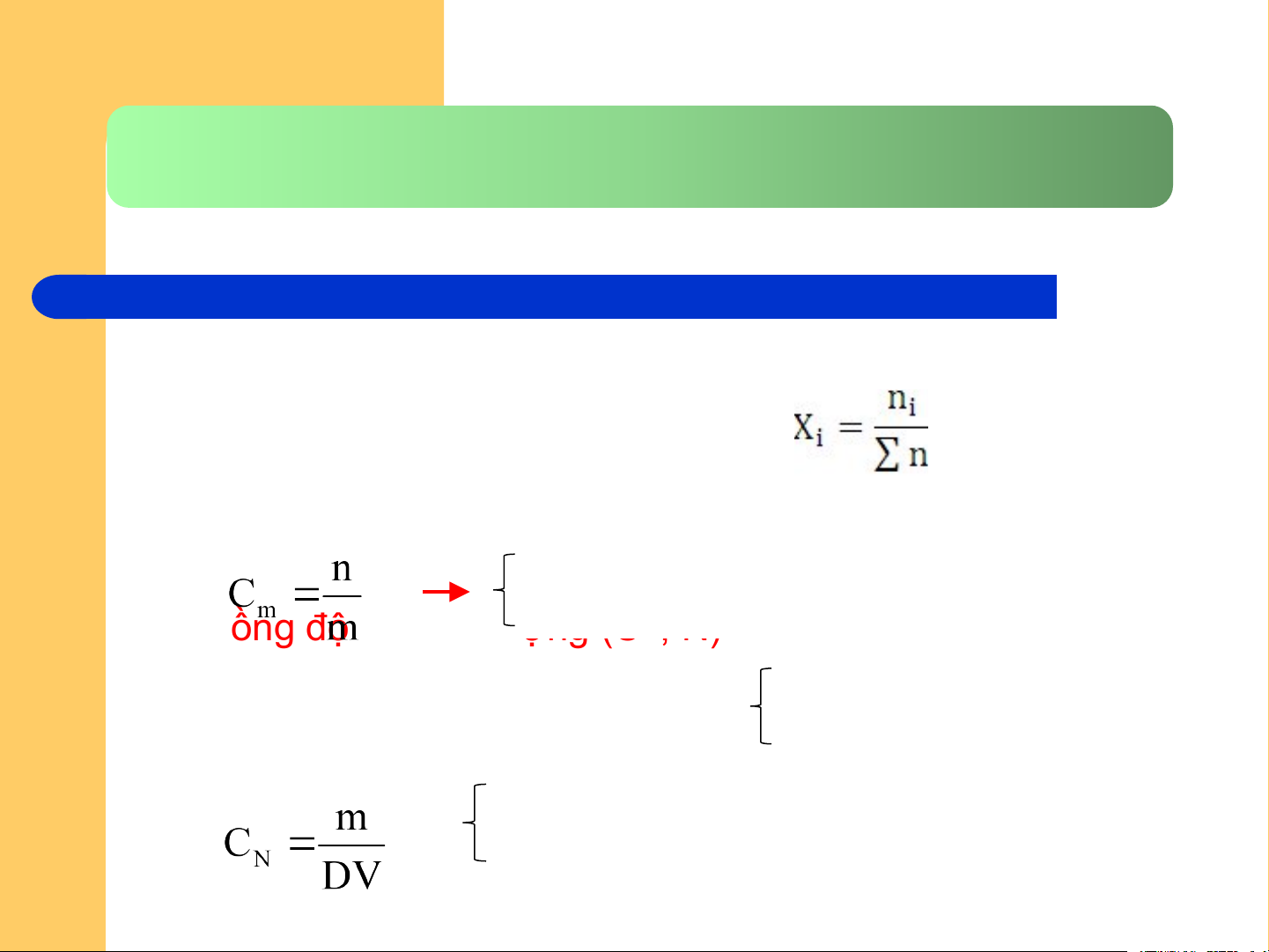
4.2. Nồng độ dung dịch
● Nồng độ mol/L: CM = n/V
● Nồng độ phần mol (phân số mol):
● Nồng độ molan (Cm hoặc m)
Biểu thị số mol chất tan có trong
● Nồng độ đương lượng 1000 (C g dung môi N, N)
Số đương lượng gam chất tan trong 1 lít dung dịch
VD: DD H2SO4 0,1N, nghĩa là trong 1 lít dd có
0,1 mol đương lượng H2SO4 tức là 4,9 gam 5 D là đương lượng H2SO4
4.2. Nồng độ dung dịch
Đương lượng hay Equivalent (E) là đơn vị đo
lường thường dùng trong hoá học và sinh học. Nó đo
lường khả năng một chất kết hợp với các chất khác.
Nó thường được dùng khi nói về nồng độ chuẩn.
Đương lượng của một chất là số phần khối lượng của
chất đó có thể thay thế hay phản ứng vừa đủ với 1
phần khối lượng hiđro (hidrogen H) hay 8 phần khối
lượng oxi (oxigen, O). 6
4.2. Nồng độ dung dịch H2 + 1/2O2 → H2O 2g 16g 1g 8g EH = 1 → EO = 8 n: số đương lượng CuO + H2 → Cu + H2O 80g 2g 40g 1g → ECuO = 40 7
4.2. Nồng độ dung dịch
Trong các phản ứng hoá học “các nguyên tố kết hợp
với nhau hoặc thay thế nhau theo các khối lượng tỷ lệ
với đương lượng của chúng ”
Khối lượng chất A là mA gam phản ứng hết với mB gam chất B. Ta có: 8
4.2. Nồng độ dung dịch Ví dụ:
- Đương lượng của Al2O3 là 102:(3×2) = 17
- Đương lượng của 1 axit bằng khối lượng phân tử của axit đó
chia cho số nguyên tử H được thay thế trong phân tử axit.
- Đương lượng của 1 base bằng khối lượng phân tử của base
chia cho hóa trị của nguyên tử kim loại trong phân tử.
- Đương lượng của 1 muối bằng khối lượng phân tử của muối
chia cho tích hóa trị của các nguyên tử kim loại trong phân tử:
Đương lượng của Al2(SO4)3 là 342 : (2×3) = 57 9
4.2. Nồng độ dung dịch
- Trong p/ư oxi hóa – khử ?
- Đương lượng gam của 1 đơn chất hay hợp chất là
lượng chất đó được tính bằng gam và có giá trị bằng đương lượng của nó.
Đối với ion hoá trị một, 1 E = 1 mol
Đối với ion hoá trị hai, 1 E = 0,5 mol
Đối với ion hoá trị ba, 1 E = 0,333 mol
Đương lượng gam của nhôm bằng 9 gam; 1 nguyên tử Al có chứa
3 đương lượng Al; 1 mol Al có chứa 3 đương lượng gam Al) 10
4.2. Nồng độ dung dịch
Mối liên hệ giữa 1 số nồng độ thông dụng 11
4.2. Nồng độ dung dịch
Độ tan Độ tan S của một chất là nồng độ của chất tan
trong dung dịch bão hòa ở điều kiện xác định
Độ hòa tan chất rắn hoặc lỏng thường được biểu thị
bằng số gam của chất tan trong 100 gam dung môi
Các yếu tố ảnh hưởng đến độ tan
Các chất phân cực dễ tan trong d/m p/cực. Chất
không phân cực (hexan) dễ tan trong d/m không
p/cực (benzen). Các chất giống nhau thì dễ hòa 12 tan vào nhau
4.2. Nồng độ dung dịch
Nếu qúa trình hòa tan thu nhiệt thì độ
hòa tan sẽ tăng khi T tăng và ngược
lại nếu qúa trình hòa tan tỏa nhiệt thì
khi T tăng thì độ hòa tan giảm
Qúa trình hòa tan chất khí trong d/m
lỏng luôn kèm theo sự giảm thể tích.
Vì vậy độ hòa tan tăng khi áp suất tăng ĐL Henry
Ở T = const, độ tan của chất khí tỉ lệ Henry (1774-1836) 13
thuận với áp suất riêng phần của nó
4.2. Nồng độ dung dịch
Khi hòa tan một chất (rắn,
lỏng, khí) vào một dung môi Qúa trình phá vỡ Qúa trình tương tác cấu trúc chất tan,
giữa các phần tử (p/tử, đặc biệt là chất n/tử, ion) với các phân rắn, để tạo thành tử dung môi, gọi là q/t các nguyên tử, sol vát hóa (trong dung phân tử hay ion. môi nước gọi là hydrat Đây là q/t vật lí, hóa). Đây là q/t hóa thu nhiệt học, tỏa nhiệt 14
Chất tan + dung môi ⇌ phân tử (nguyên tử, ion)
4.3. Tính chất của dung dịch loãng chứa
chất tan không bay hơi, không điện ly
4.3.1. Áp suất hơi bão hòa
Qúa trình bay hơi: L ⇌ H
Hơi tạo thành trên bề mặt chất lỏng gây ra áp suất hơi và
khi q/t thuận nghịch trên đạt trạng thái cân bằng (∆Gbh = 0)
thì áp suất hơi được gọi là áp suất hơi bão hòa của chất
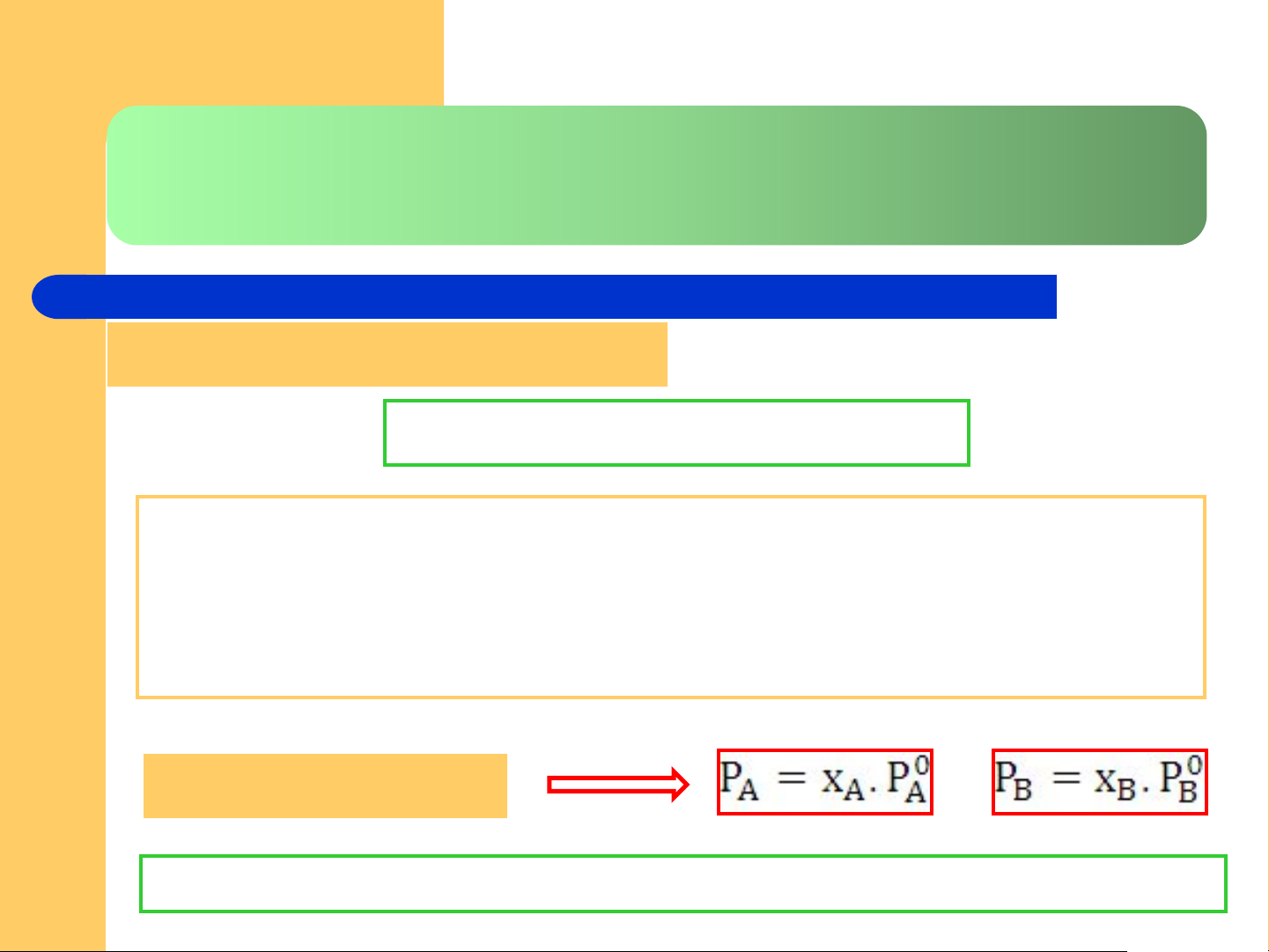
lỏng hay dung môi nguyên chất. Định luật Raoult 1 15
PA, PB áp suất hơi riêng phần của A, B; P0 áp suất hơi nguyên chất
4.3. Tính chất của dung dịch loãng chứa
chất tan không bay hơi, không điện ly
4.3.1. Áp suất hơi bão hòa
Vì chất A không bay hơi nên áp suất hơi bão hòa P
của dung dịch bằng chính áp suất hơi bão hòa PB
của dung môi khi chứa chất tan A
Áp suất hơi bão hòa của dung dịch nhỏ hơn áp 16
suất hơi của dung môi nguyên chất
4.3. Tính chất của dung dịch loãng chứa
chất tan không bay hơi, không điện ly
4.3.1. Áp suất hơi bão hòa Độ giảm áp suất hơi Raoult (1830 -1901)
Độ giảm tương đối áp suất hơi bão hòa
Định luật Raoult 2 của dung dịch bằng phần mol của chất 17
tan chất tan ko bay hơi ctrong dung dịch
4.3. Tính chất của dung dịch loãng chứa
chất tan không bay hơi, không điện ly
4.3.2. Độ tăng điểm sôi - độ giảm nhiệt độ đông đặc
- Nhiệt độ sôi của chất lỏng là nhiệt độ ở đó áp
suất hơi bão hòa của pha lỏng bằng áp suất khí quyển
- Nhiệt độ đông đặc của chất lỏng là nhiệt độ ở
đó áp suất hơi bão hòa của pha lỏng bằng áp
suất hơi của pha rắn 18
4.3. Tính chất của dung dịch loãng chứa
chất tan không bay hơi, không điện ly
Độ tăng điểm sôi (nhiệt độ sôi) Độ tăng điểm sôi
T: nhiệt độ sôi của dung dịch
T0: nhiệt độ sôi của dung môi
m: nồng độ molan chất tan
Ks : hằng số nghiệm sôi (có trong các bảng phụ lục),
chỉ phụ thuộc bản chất dung môi. 19
4.3. Tính chất của dung dịch loãng chứa
chất tan không bay hơi, không điện ly
Độ giảm nhiệt độ đông đặc (kết tinh)
T0 : nhiệt độ kết tinh của dung môi (= 0)
T : nhiệt độ kết tinh của dung dịch
T0 – T = ∆Tkt : là độ hạ điểm kết tinh của dung dịch
Kkt là hằng số nghiệm lạnh, chỉ phụ thuộc bản chất dung môi
Ví dụ: Tính nhiệt độ sôi và nhiệt độ đông đặc của dd
20 chứa 9g glucozo trong 100 g nước. Ks = 0,512; Kđ = 1,86



