















Preview text:
Chương 4
Phương pháp quang phổ hấp thụ nguyên tử
(AAS - Atomic Apsorption Spectroscopy)
4.1. Nguyên tắc phương pháp phổ AAS 2
Phương pháp AAS dựa vào khả năng hấp thụ chọn lọc các bức xạ
cộng hưởng của nguyên tử ở trạng thái tự do. (Đối với mỗi nguyên
tử vạch cộng hưởng là vạch quang phổ nhạy nhất của phổ phát xạ
nguyên tử của chính nguyên tố đó).
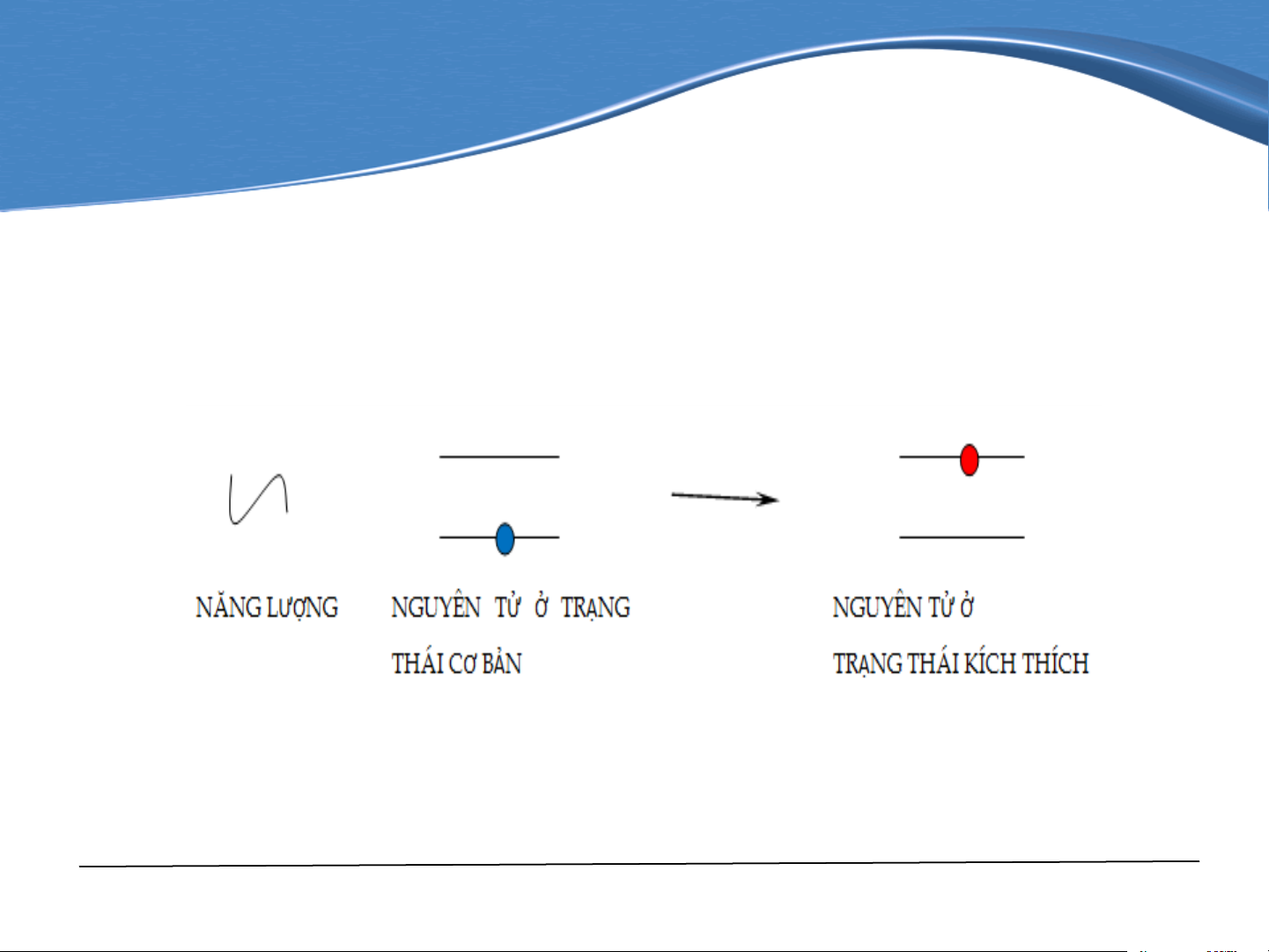
Hình 4-1. Quá trình hấp thụ nguyên tử
4.1. Nguyên tắc phương pháp phổ AAS 3
Trong phương pháp này, các nguyên tử tự do (ở trạng
thái hơi) được tạo ra do tác dụng của nguồn nhiệt biến
các chất từ tập hợp bất kỳ thành trạng thái nguyên tử,
đó là quá trình nguyên tử hóa.
4.1. Nguyên tắc phương pháp phổ AAS 4
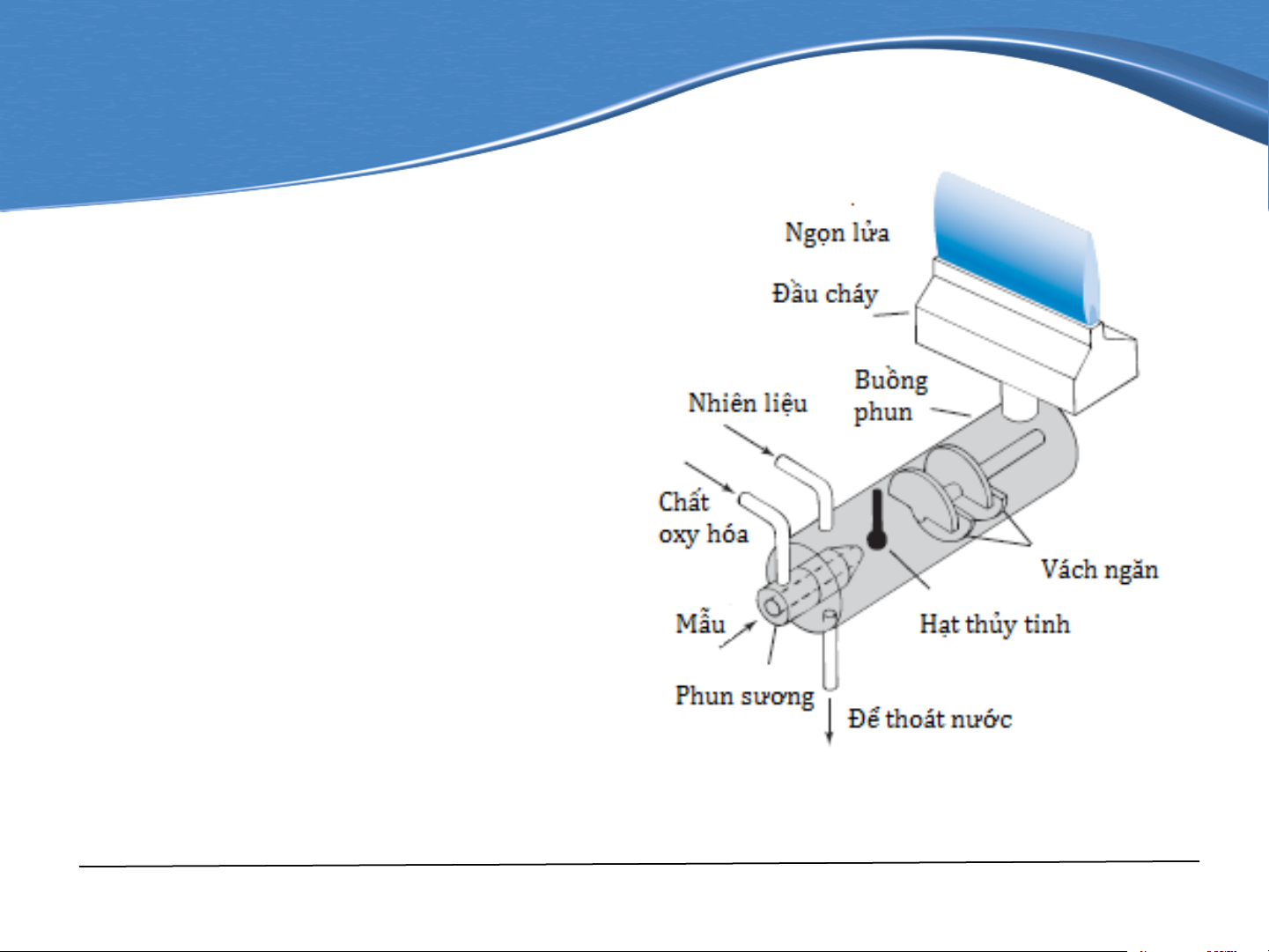
Quá trình nguyên tử hóa
có thể thực hiện bằng phương pháp ngọn lửa: bằng cách phun mù dung
dịch phân tích ở trạng thái
sol khí vào ngọn đèn khí.
Aerosol (sol khí) là trạng
thái huyền phù của các hạt
rắn hay lỏng (các hạt kích
thước siêu hiển vi) được
phân chia rất tốt trong pha khí. Premix Burner
4.1. Nguyên tắc phương pháp phổ AAS 5
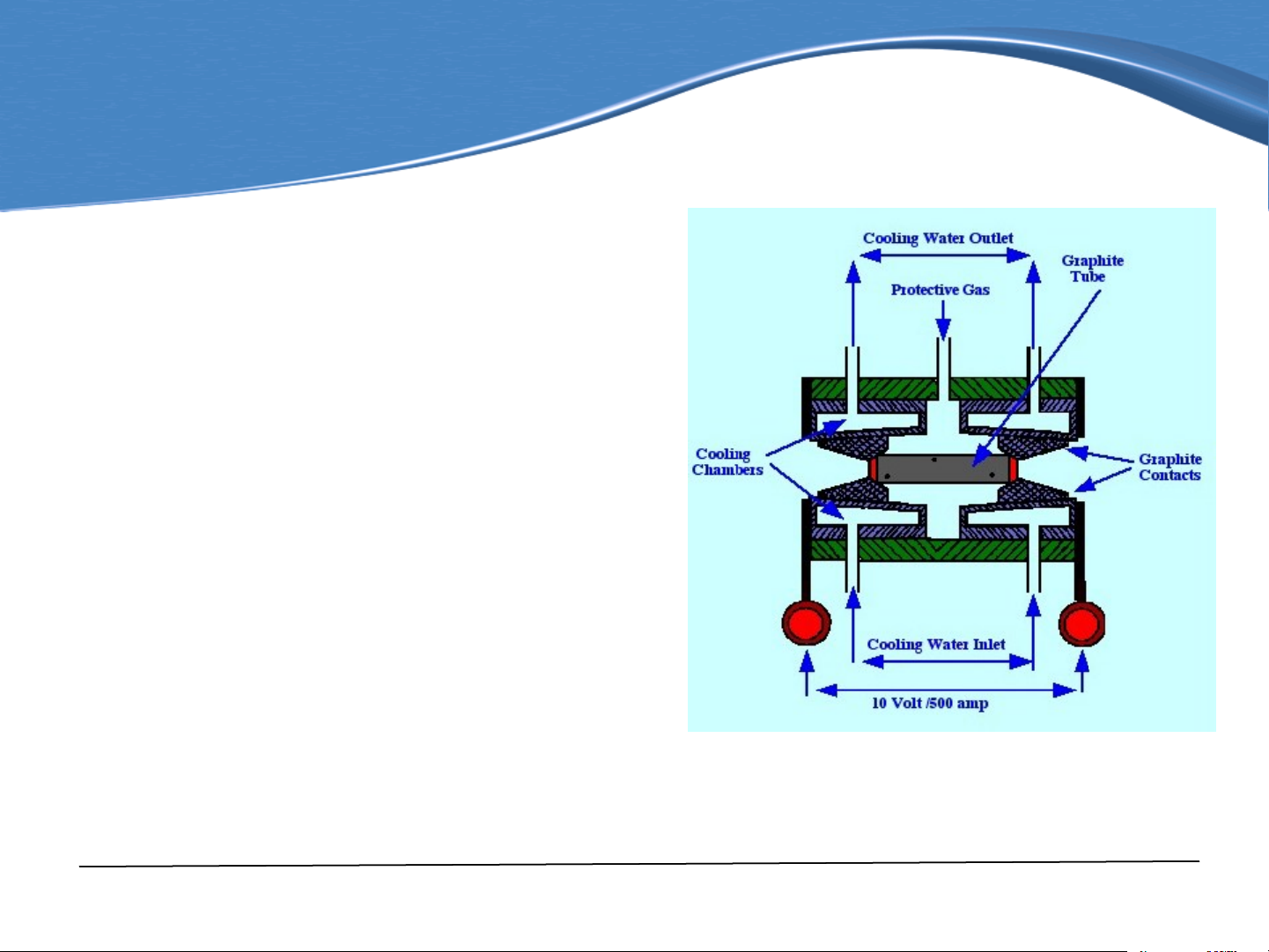
Quá trình nguyên tử hóa
có thể thực hiện bằng phương pháp không ngọn
lửa: nhờ tác dụng nhiệt của lò graphit.
Ống gia nhiệt theo chiều
dọc và ngang với đường
kính 4-6 mm, chiều dài từ
20-30 mm và điện trở cỡ 10-15 Ohm. Sơ đồ lò graphit
4.1. Nguyên tắc phương pháp phổ AAS 6
Trong ngọn lửa hoặc trong lò graphit chất nghiên cứu bị
nhiệt phân và tạo thành các nguyên tử tự do. Trong điều
kiện nhiệt độ không quá cao (1500÷3000°C) đa số các
nguyên tử được tạo thành ở trạng thái cơ bản. Bấy giờ
nếu ta hướng vào luồng hơi một chùm bức xạ điện từ
có tần số bằng tần số cộng hưởng, một phần bức xạ
điện từ sẽ bị hấp thụ bởi các nguyên tử, bởi vậy, I≤ Io
4.1. Nguyên tắc phương pháp phổ AAS 7
Định luật Lambert-Beer: A = log(Io/I) = KνLC (4-1)
A: độ hấp thụ là một đại lượng không thứ nguyên
Io, I: cường độ ánh sáng trước và sau khi bị các nguyên
tử hấp thụ
Kν: hệ số phụ thuộc vào bước sóng λ, M-1cm-1
L: độ dày lớp hơi nguyên tử, cm
C: nồng độ chất nghiên cứu trong lớp hơi, M
4.1. Nguyên tắc phương pháp phổ AAS 8
Vậy, nếu trong phương pháp phổ phát xạ nguyên tử, nồng độ chất
nghiên cứu được xác định dựa vào cường độ vạch phát xạ mà
cường độ vạch này lại tỉ lệ với nồng độ chất bị kích thích thì
phương pháp AAS có cơ sở khác hẳn. Ở đây tín hiệu phân tích lại
liên quan đến các nguyên tử không bị kích thích.
Người ta đã chứng minh được rằng thông thường số nguyên tử ở
trạng thái kích thích không quá 1÷2% số nguyên tử chung. Đó là lý
do để phương pháp AAS có độ nhạy cao (có thễ xác định nồng độ
trong phạm vi ppm-ppb) với độ chính xác cao.
4.2. Điều kiện tạo thành AAS 9
4.2.1. Quá trình nguyên tử hóa
Quá trình nguyên tử hóa là quá trình mà trong đó mẫu thường ở
dạng dung dịch bị bay hơi và phân hủy thành các nguyên tử.
Giả sử kim loại nghiên cứu M trong dung dịch hợp chất MX, dung
dịch MX được phun vào ngọn lửa đèn khí dạng sol khí. Trong ngọn
lửa đèn khí sẽ xảy ra quá trình nhiệt phân của phân tử MX. MX = M + X (4-2)
Bên cạnh quá trình (4-2) cũng có xảy ra quá trình khác như quá
trình tạo hợp chất như MO, MOH, MH làm giảm nồng độ nguyên tử Me.
4.2. Điều kiện tạo thành AAS 10
4.2.1. Quá trình nguyên tử hóa
Để giảm quá trình tạo hợp chất chứa oxy của kim loại, người ta
phải tạo điều kiện để bầu khí ngọn lửa có tính khử mạnh.
Trong ngọn lửa cũng có thể xảy ra quá trình ion hóa nguyên tử làm
giảm độ nhạy của phép phân tích. Để hạn chế sự ion hóa này,
người ta phải đưa vào dung dịch phân tích các chất dễ bị ion hóa
để tăng “nền electron” trong bầu khí.
4.2. Điều kiện tạo thành AAS 11
4.2.1. Quá trình nguyên tử hóa
Có hai loại nhiễu được kể đến trong phương pháp AAS
Thứ nhất, sự nhiễu phổ (spectral interferences), xảy ra khi các hạt
vật chất từ quá trình nguyên tử hóa tán xạ bức xạ tia tới, hay khi
các hạt (phân tử, ion, nguyên tử) hấp thụ ở bước sóng rất gần với
bước sóng cộng hưởng của chất phân tích gây ra nhiễu.
Sự nhiễu phổ do xen phủ vạch (chồng vạch phổ) là rất hiếm vì các
vạch phát xạ của nguồn catot rỗng là rất hẹp. Tuy nhiên, sự nhiễu
có thể xảy ra nếu khoảng cách giữa hai vạch phổ là 0,01 nm. Ví dụ,
vạch Vanadi ở 308,211 nm gây nhiễu khi phân tích Al ở vạch
308,215 nm. Sự nhiễu này có thể biết và tránh được, ví dụ như ta
có thể chọn vạch Al khác, ví dụ, vạch 309,270 nm.
4.2. Điều kiện tạo thành AAS 12
4.2.1. Quá trình nguyên tử hóa
Sự nhiễu phổ cũng do bởi sự có mặt của các sản phẩm cháy dạng
phân tử, thể hiện ở đảm phổ hấp thụ bị giãn nở hay các sản phẩm
dạng hạt gây tán xạ ánh sáng. Trong các loại nhiễu này, cường độ
tia ló bị làm yếu đi do các cấu tử nền, cường độ tia tới giữ nguyên,
việc đo A mắc sai số dương, do đó ảnh hưởng tới kết quả xác định nồng độ C.
Ví dụ, xác định Ba trong hỗn hợp chứa các kim loại kiềm. Bước
sóng của vạch Ba sử dụng trong phân tích AAS xuất hiện giữa các
đám phổ của CaOH•, như vậy Ca gây nhiễu khi phân tích Ba. Ta có
thể loại trừ nhiễu này bằng cách thay thế KNO3 trong không khí
như một chất oxy hóa, nhiệt độ ngọn lửa nhờ đó cao hơn để phân
hủy và loại trừ đám phổ CaOH• hấp thụ này.
4.2. Điều kiện tạo thành AAS 13
4.2.1. Quá trình nguyên tử hóa
Sự nhiễu phổ do sự tán xạ bởi các sản phẩm nguyên tử hóa
thường xảy ra khi dung dịch chứa các nguyên tố như Ti, Zr
(Ziconium) và Vonfram - ở dạng oxit bền – được tạo ra trong ngọn lửa.
May thay, sự nhiễu phổ do sản phẩm nền không phổ với quá trình
nguyên tử hóa bằng ngọn lửa và thường tránh được bằng nhiều
cách như điều chỉnh các tham số của quá trình phân tích như nhiệt
độ và tỉ lệ nhiên liệu/chất oxy hóa.
Người ta có thể thêm vào chất đệm bức xạ điện từ (radiation
buffer) là chất được thêm vào với một lượng lớn vào cả dung dịch
chuẩn và mẫu nghiên cứu mà sự có mặt của các chất này ngăn cản được sự nhiễu phổ.
4.2. Điều kiện tạo thành AAS 14
4.2.1. Quá trình nguyên tử hóa
Thứ hai, sự nhiễu hóa học (chemical interferences), kết quả của rất
nhiều quá trình hóa học xảy ra trong quá trình nguyên tử hóa và
làm thay đổi tính chất hấp thụ của chất phân tích.
Sự nhiễu hóa học có thể được giảm tới mức nhỏ nhất bằng việc
lựa chọn các điều kiện thích hợp. Hầu hết các loại nhiễu hóa học là
do các anion, các anion này tạo hợp chất có độ bay hơi thấp với
chất cần phân tích, do đó làm giảm tốc độ nguyên tử hóa. Kết quả
thu được sẽ mắc sai số âm. Ví dụ, khi xác định Ca, độ hấp thụ của
nó sẽ giảm khi tăng nồng độ các anion gây nhiễu như SO 2- 3- 4 , PO4
do tạo hợp chất khó bay hơi với ion canxi.
Sự nhiễu do tạo các hạt có độ bay hơi thấp có thể được loại trừ
hoặc giảm thiểu bằng cách sử dụng nhiệt độ cao hơn.
4.2. Điều kiện tạo thành AAS 15
4.2.1. Quá trình nguyên tử hóa Sự nhiễu hóa học
Thường là do sự phân hủy chưa hoàn toàn của mẫu thành các nguyên tử Ca3(PO4)2 ⇋ Ca°
Khắc phục bằng cách sử dụng ngọn lửa có nhiệt độ cao hơn, ví dụ
chất oxy hóa thay oxy bằng N2O
Hoặc thêm một tác nhân giải phóng cho tất cả các dung dịch là LaCl3 (2000-5000 mg/L) : Ca3(PO4)2 → LaPO4 + Ca°
4.2. Điều kiện tạo thành AAS 16
4.2.1. Quá trình nguyên tử hóa
Các tác nhân giải phóng (releasing agents) là các cation mà ưu tiên
phản ứng với chất gây nhiễu, ngăn cản chất gây nhiễu phản ứng
với chất phân tích, có thể được đưa vào. Ví dụ, chúng ta thêm ion
Sr (Strontium) hay La làm giảm nhiễu do ion PO 3- 4 khi xác định Ca.
Ở đây, ion Sr hay La thay thế chất phân tích tạo hợp chất khó bay hơi.
Các tác nhân bảo vệ (protective agents) ngăn cản nhiễu bằng cách
ưu tiên tạo hợp chất ổn định nhưng dễ bay hơi với chất phân tích.
Có ba thuốc thử phổ biến dùng cho mục đích này là EDTA, 8-
hydroxyquinolin và APDC (muối amoni của 1-pyrolidin-
cacbodithioic axit). Ví dụ, sự có mặt của EDTA đã loại trừ nhiễu do Si, ion PO 3- 2-
4 , SO4 khi xác định Ca.
4.2. Điều kiện tạo thành AAS 17
4.2.1. Quá trình nguyên tử hóa
Sự nhiễu hóa học phụ thuộc vào:
- Môi trường hóa học (tỷ lệ chất phân tích/chất nền)
- Khối lượng của chất phân tích/ đơn vị thời gian vào máy phun
- Nhiệt độ ngọn lửa và môi trường của ngọn lửa
- Vị trí của máy phun so với chùm ánh sáng
- Kích cỡ hạt và phân bố
4.2. Điều kiện tạo thành AAS 18
4.2.1. Quá trình nguyên tử hóa Hiệu ứng ion hóa:
Quá trình ion hóa các nguyên tử và phân tử thường không đáng kể trong hỗn hợp
cháy mà không khí là chất oxy hóa. Tuy nhiên, khi oxy hay KNO3 là chất oxy hóa,
nhiệt độ của ngọn lửa cao, sự ion hóa trong ngọn lửa là đáng kể. Ta có cân bằng: M ⇋ M+ + e-
Ở đây, M là nguyên tử trung hòa, M+ là ion. Thông thường phổ của M+ hoàn toàn
khác phổ của M, bởi thế quá trình ion hóa chất phân tích làm kết quả nhận được thấp hơn thực tế.
Nếu ta đưa thêm vào môi trường này hạt B, nó cũng bị ion hóa theo phương trình: B ⇋ B+ + e-
Thì mức độ ion hóa ion M sẽ giảm do hiệu ứng khối lượng hoạt động (mass action
effect) của các electron dạng B.
Như vậy, sai lệch do quá trình ion hóa thường được loại trừ bằng cách thêm các
chất dễ bị ion hóa (ionization suppressor) với nồng độ đủ lớn. Muối của kali thường
được sử dụng như một ionization suppressor bởi năng lượng ion hóa của nguyên tố này rất thấp.
4.2. Điều kiện tạo thành AAS 19
4.2.1. Quá trình nguyên tử hóa Hiệu ứng ion hóa: Ví dụ: Nao ⇋ Na+ + e– (a)
Khắc phục bằng cách thêm một lượng dư của thành
phần dễ bị ion hóa, ví dụ thêm 2000-5000 mg/L K Nao ⇋ Na+ + e– Ko ⇋ K+ + e–
Lượng dư đảo ngược cân bằng (a)
4.2. Điều kiện tạo thành AAS 20
4.2.1. Quá trình nguyên tử hóa Sự nhiễu vật lý
- Do thay đổi độ nhớt và sức căng bề mặt
+ Tốc độ hấp thụ và kích thước giọt bị ảnh hưởng
+ Điều này ảnh hưởng đến nồng độ đặc trưng
- 1% HNO3 : ghi nhận phổ bình thường
- 5% H2SO4 : làm giảm sự hấp thụ, giọt lớn hơn, làm
giảm nồng độ đặc trưng
- Dung môi hữu cơ: tăng độ hấp thụ, giọt nhỏ hơn và
tăng nồng độ đặc trưng




