







Preview text:
CHƯƠNG 5
CÂN BẰNG PHỨC CHẤT VÀ CHUẨN ĐỘ PHỨC CHẤT
5.1 KHÁI NIỆM PHỨC CHẤT 5.1.1 Định nghĩa
“Phức chất là hợp chất được hình thành do ion trung tâm (thường là ion kim loại) kết
hợp với các ion hoặc phân tử khác (còn được gọi là phối tử) sao cho ion trung tâm, phối
tử và phức chất còn tồn tại độc lập trong dung dịch”. Thí dụ: [Ag(NH +
3)2 ] là một cation phức, NH3 là phối tử, Ag+ là ion trung tâm. Theo định
nghĩa, cả 3 cấu tử đều tồn tại trong dung dịch.
5.1.2 Phân loại
Có thể chia phức chất thành 3 loại chính như sau:
- Ion trung tâm kim loại và các phối tử là các phân tử các chất vô cơ [Ag(NH + 3)2 ]
- Ion trung tâm kim loại và các phối tử là các ion các chất vô cơ FeCl -4
- Ion trung tâm kim loại và các các phối tử là các phân tử các chất hữu cơ thí dụ MeEDTA, Cu-PAN 5.1.3 Danh pháp
Quy tắc gọi tên các phức chất:
- Gọi tên các phối tử trước, ion trung tâm sau
- Thêm đuôi “o” vào sau các halogenua
- Thêm “o” đối với các phối tử anion : NO -2(nitro), OH-(hydroxo), O2-(oxo), S2(sunfo), S 2- 2 (pesunfo)
- Phối tử là gốc axit chứa oxy cũng thêm đuôi “O”: SO 2- - 4 - sunfato, NO3 - Nitrato -
Số các phối tử được gọi theo tiếng Arập: 1- mono; 2- di; 3- tri; v.v.
- Đối với cation phức, thêm chữ số la mã vào sau ion trung tâm để chỉ hoá trị của nó
- Đối với anion phức, thêm đuôi “at” vào tên ion trung tâm trước khi thêm chữ số la
mã vào sau ion trung tâm để chỉ hoá trị của nó. +[Ag(NH + 3)2 ] NO3– diaminobạc(I)nitrat
+K3[Co(NO2)6]- Kali hexanitrocobanat(III)
5.1.4 Hằng số bền và hằng số bền tổng cộng
Có Kim loại M và phối tử L có các phản ứng M + L = ML b1 = [ML] (5.1) [ ][ ]M L.
Phức hai phối tử hình thành: ML + L = ML2 ] b2 = [ [ML][ ]2 (5.2) ML L. .
Hằng số bền tổng cộng là tích của các hằng số bền b bb ]
1,2 = 1. 2 = [M L[ML].[] ]. [ML2 ] = [ ][ ][ML2 2
(5.3) [ML].[L] M L.
5.1.5 Tình nồng độ cân bằng của các cấu tử trong dung dịch phức Kim
loại M và phối tử L phản ứng hình thành phức chất ML và ML2.
Có thể viết phương trình bảo toàn khối lượng của kim loại M như sau: [M] + [ML] + [ML2] = CM
Thay các giá trị của [ML] và [ML2] theo L và b vào phương trình trên ta có:
[M] + b1[M][L] + b1,2[M][L]2 = CM
[M] (1 + b1[L] + b1,2[L]2) = CM = [ ]M [ ]CM [ ]2 (5.4)
1+b b1 L + 1,2 L [ ] b1.C LM.[ ] (5.5) ML = [ ] [ ]2
1+b b1 L + 1,2 L [ ] b1,2C LM.[ ]2 ML = [ ] [ ] 2 2 (5.6)
1+b b1 L + 1,2 L
Thí dụ 5.1: Tính nồng độ cân bằng của các cấu tử trong dung dịch biết nồng độ AgNO3
ban đầu là 10-3M, nồng độ cân bằng của phối tử NH3 là 10-3M. Cho b1 = 103.32 ; b2 = 103.92 Giải: Ta có: [Ag+] + [Ag(NH +
3)+] + [Ag(NH3)2 ] = 10-3 M thay các giá trị của hằng số bền ta có: [Ag+]= 10-3 -5M = 0,489.10
1+103,32.10-3 +103,32.103,92.10 .10-3 -3 [Ag(NH3) ]+ = 1
+103,32.1010-33+,3210.10 .103,32-3.10-33,92.10 .10-3 -3 =1,02.10-4M [Ag(NH ) +]= 107,2410-3.10-6 = 08489.10-4 M 3 2
1+103,32.10-3 +103,32.103,92.10 .10-3 -3
5.1.6 Hằng số bền điều kiện
Tương tự như các phản ứng axit bazơ, phản ứng hình thành phức chất cũng chịu tác
động của nhiều yếu tố như chất tạo phức khác, pH v.v. Hằng số hình thành phức khi tính
tới các điều kiện đó gọi là hằng số bền điều kiện. Giả sử có kim loại M tạo phức với
phối tử L, có các trường hợp sau đây.
a) Phức có ion trung tâm tham gia phản ứng phụ
Phản ứng hình thành ML từ kim loại M và phối tử L như sau: M + L = ML
Ngoài ra phản ứng phụ là: M + OH- = M(OH)
Với b(OH)= [ M(OH)]/[M]. [OH]
Lúc này hằng số bền của phức được gọi là hằng số bền điều kiện b' = [ML] (5.7) [M L' .][ ]
trong đó b’ là hằng số bền điều kiện, [M’] là tất cả các dạng của M ngoài [ML]. Ta có [M’] = [M] + [M(OH)].
Thay giá trị [M(OH)] theo b(OH) và OH- vào ta có [M’] = [M] + [M] b(OH) [OH]. = [M] ( 1 + b(OH) [OH])
= [M].a(OH) trong đó a(OH) được gọi là hằng số phụ thuộc OH-
b) Phức có phối tử L tham gia phản ứng phụ
H + L = HL (tạo thành axit yếu HL)
Hằng số bền axit được viết bHL = [HL] / [H]. [L].
Cũng như trường hợp trên có thể viết hằng số bền điều kiện trong trường hợp có phản ứng phụ này là: b' = [ML[ ]]/ (5.8) [ ]M L.
trong đó [L’] là tất cả các dạng của L trừ ML (M không tham gia phản ứng phụ). [L’] = [L] + [ HL]
Thay [HL] theo hằng số bền vào ta có
[L’] = [L] + bHL . [H]. [L]. = [L]( 1 + bHL . [H])
= [L] .aL(H) ; từ đó b’ được viết:
b’ = [ML]/[M].[L].aL(H) trong đó aL(H) là hằng số phụ thuộc H+
c) Cả phối tử L và ion trung tâm, kim loại M tham gia phản ứng phụ
b’ = [ML]/[M].[L].aL(H) .aM(OH) hay là β β' = [M'[ML][ ]. L'] = α αL(H) M(OH) (5.9)
5.2 PHỨC COMPLEXONAT KIM LOẠI
5.2.1 Khái niệm về complexon và phức của kim loại với comlexon III
Complexon là hợp chất của amin trong đó 2 hay nhiều hơn các nguyên tử hydro liên kết
trực tiếp với amin được thay thế bằng các nhóm metyl-cacboxilic.
- Đối với complexon 1 amin có Nitrilo Triaxetic Axit (NTA), có công thức cấu tạo: N(CH2-COOH)3
- Đối với complexon chứa 2 amin có Etylen Diamin Tetraacetic Axit viết tắt là EDTA,
còn gọi là complexon II. Đây là đa axit yếu có các hằng số phân ly:
K1=10-2 ; K2 =10-2,67 ; K3 = 10-6,27 ; K4 = 10-10,95
Complexon II được ký hiệu là H4Y, là axit khó tan trong nước, khi sử dụng người ta
phải trung hoà bằng kiềm natri để thu được muối có 2 natri Na2H2Y. Muối này còn
gọi là complexon III có công thức cấu tạo: HOOC-H2C CH2-COONa N- CH2- CH2- N NaOOC-H2C CH2-COOH
- Đối với complexon có chứa 3 amin điển hình là Dietylen Triamin Pentaaxetic Axit
(DTPA). Tuy nhiên do giá thành và khó điều chế, complexon này ít được sử dụng.
Chất tạo phức được sử dụng nhiều nhất trong phòng thí nghiệm là complexon III,
thường được gọi là EDTA, còn khi viết các phương trình phản ứng, complexon III được ký hiệu là H2Y2- .
Đặc điểm của phản ứng của complexon III với ion kim loại : H2Y2- + Mn+ = MY-4 +n + 2H+
1. Trong các phản ứng tạo phức của complexon III, đều giải phóng 2H+, cho dù ion
kim loại có thể có hoá trị khác nhau, do vậy, đương lượng gam của kim loại trong
các trường hợp đều là M/2.
2. Phản ứng tạo phức complexonat kim loại luôn giải phóng 2H+ cho nên làm thay
đổi pH của quá trình chuẩn độ, điều này làm ảnh hưởng tới cân bằng cũng như
hằng số bền của phức. Để đảm bảo độ bền của phức, nhất thiết phải giữ pH ổn
định bằng dung dịch đệm có pH thích hợp.
3. Độ bền của phức complexonat kim loại phụ thuộc vào điện tích của ion kim loại
và khối lượng nguyên tử của chúng. Điện tích càng cao, khối lượng nguyên tử
càng lớn, phức càng bền.
Bảng 5.1: Logarit hằng số bền của một số phức complexonat kim loại thường gặp Phức complexonat logb Phức complexonat logb AgY3- 7,32 CuY2- 18,8 MgY2- 8,69 ZnY2- CdY2- 16,5 CaY2- 10,7 HgY2— 16,46 21,8 SrY2- BaY2- 8,63 PbY2- 18,04 MnY2- 7,76 16,13 AlY- 13,79 25,1 FeY2- FeY- 14,33 25,9 CoY2- VY- ThY- 16,31 23,2 NiY2- 18,62
5.2.2 Ảnh hưởng của nồng độ H+ tới độ bền phức complexonat-KL, hệ số aY(H)
Complexon III là muối của đa axit yếu, phản ứng hình thành phức giải phóng 2H+ cho
nên nồng độ H+ trong dung dịch ảnh hưởng rất lớn tới độ bền của phức. Để tính được
cụ thể độ bền của phức trong điều kiện ở 1 giá trị pH nhất định, ta cần xem xét tới nồng
độ cân bằng của các cấu tử trong dung dịch H4Y ở các pH khác nhau, điều đó giúp chúng
ta biết được ở một pH nhất định nào đó, H+ ảnh hưởng đến phức như thế nào.
Axit H4Y có các phương trình phân ly như sau: H - 4Y ⇌ H+ + H3Y- ; K1 =[ H+].[H Y3 ]
[H Y4 ] [H H Y+].[ 2-] H3Y- ⇌ H+ + H2Y2- ; K2 = [H Y2-] 3 2- ⇌ H+ + HY3- ; K3
=[H[+H Y].[HY2-]3-] H2Y 2 [H Y+].[ 4-] HY3- ⇌ H+ + Y4- ; K4 = [HY3-]
Gọi [Y’] là tất cả các dạng của Y ngoài phức MY, ta có
[Y’] = [Y4-] + [HY3-] +[H2Y2-] + [H3Y-] + [H4Y],
Biểu diễn tất cảc các đại lượng trên qua Y4- và các hằng số K, ta có:
4-] + [H Y+ ].[ 4-]+ [H+]2.[Y 4-]+ [H+]3.[Y 4-]+ [H+ ]4.[Y 4-] [Y’] = [Y K4 K K4 3 K K K4 3 2K K K K4 3 2 1 =[Y4-](1+ [
H +]+[H+]2 + [H+]3 + [H+]4 ) =[Y4-].aY(H) K4 K K4 3 K K K4 32 K K K K4 3 2 1
Đại lượng trong ngoặc đặt là aY(H) là hệ số phụ thuộc H+. = = b
Hằng số bền điều kiện n [ ][ ]M Y[MY]' [ ][ ]M Y[MY.a]Y H( ) = aY H ( )
(Kim loại M không tham gia phản ứng phụ)
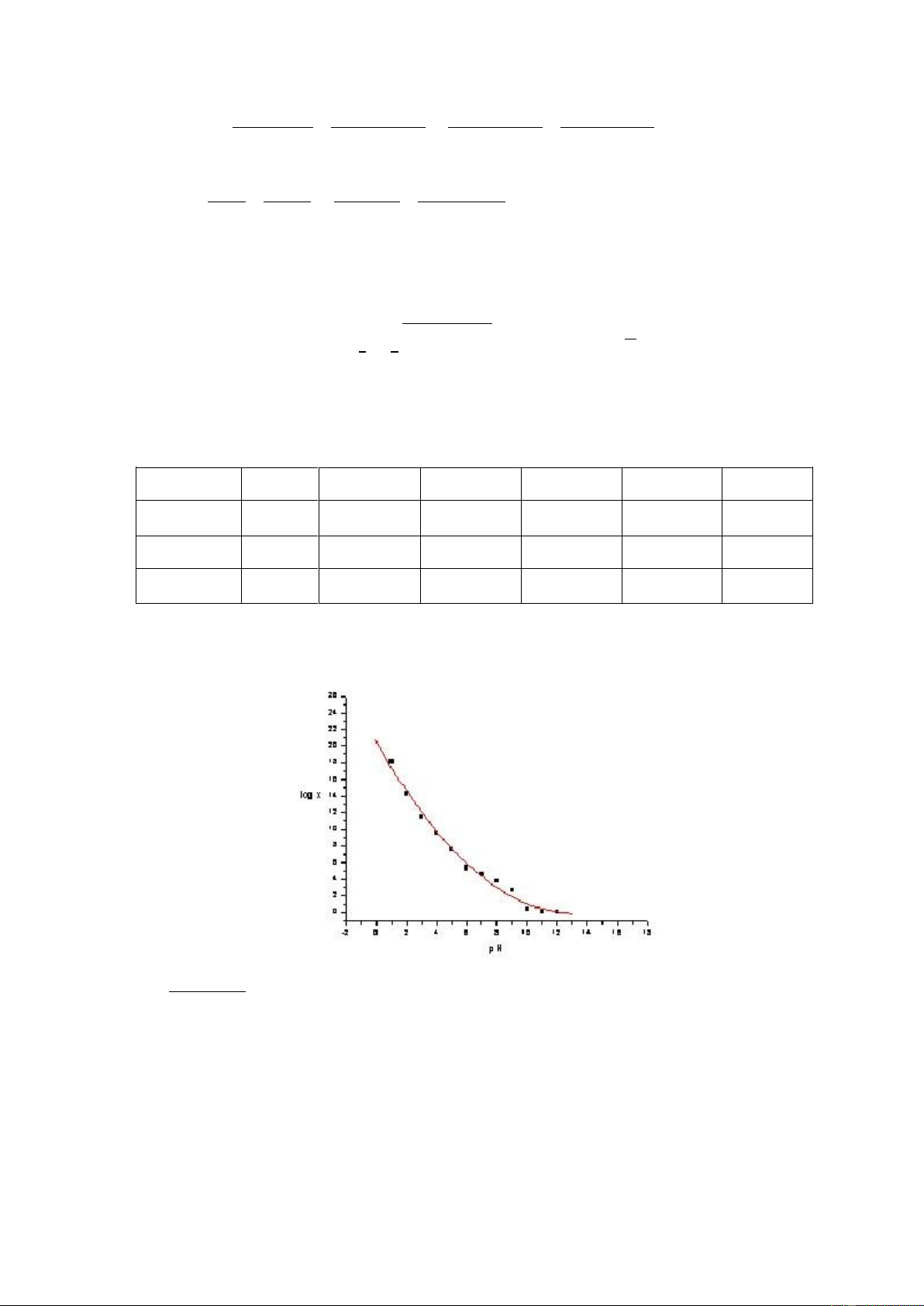
Thay các giá trị K và nồng độ H+ khác nhau, nhận được các giá trị aY(H) khác nhau.
Bảng 5.2: Giá trị aY(H) ở các pH khác nhau pH 1 2 3 4 5 6 log aY(H) 18,11 14,27 11,41 9,58 7,57 5,36 pH 7 8 9 10 11 12 log aY(H) 4,7 2,96 1,96 0,44 0,07 0,008
Biểu diễn các giá trị trên vào đồ thị ta được hình sau:
Hình 5.1: Sự phụ thuộc hệ số aY(H) theo pH trong đó X=aY(H)
Như vậy ở giá trị pH khác nhau, hệ số phụ thuộc H+ có giá trị khác nhau, nó có giá
trị rất lớn ở pH thấp và tiến dần tới 1 ở pH cao. Từ các số liệu về hằng số bền của
các phức kim loại và hệ số phụ thuộc H+(aY(H)), có thể tìm ra một pH thích hợp cho
phản ứng hình thành phức complexonat kim loại, khi 99,9% kim loại đã đi vào phức.
5.2.3 Tìm giá trị b’ để đáp ứng yêu cầu 99,9% kim loại đi vào phức
Giả sử nồng độ kim loại M và EDTA ban đầu cùng là Co, khi trộn chúng với nhau,
nồng độ phức và nồng độ các cấu tử còn lại không tạo phức đều giảm đi. Theo định
luật bảo toàn khối lượng, tổng nồng độ của chúng giảm đi 1/2.
[MY-4+n] + [Mn+] = Co/2 [MY-4+n] + [Y’ ] = Co/2 trong đó [Y’]
là tất cả các dạng khác của Y trừ phức MY-4+n, như vậy [Mn+]=[[Y’]
Khi 99,9% kim loại đã tạo phức với EDTA, ta có
[Mn+]=[[Y’] = 0,1.Co = Co 100.2 2000
b’= [MY] = Co :( Co )2= 2.106 [ ][ ]M Y ' 2 2000 Co
Như vậy giá trị b’ cần phải đạt 2.106/Co để cho 99,9% kim loại đi vào phức. Khi
nồng độ Co= 2.10-2M thì b’ = 108
Do mỗi phức có giá trị hằng số bền khác nhau tuỳ thuộc bản chất của ion kim loại.
Cần phải tìm ra pH hay nồng độ H+ phù hợp sao cho aY(H) phù hợp để b’ ³ 108 Bảng
5.3: Các giá trị aY(H) để b’ ³ 108 Phức complexonat aY(H) Phức complexonat aY(H) AgY3- 100,68 CuY2- 1010,8 MgY2- 100,69 ZnY2- 108,5 CaY2- 102,70 CdY2- 108,46 SrY2- 10 HgY 0.63 2- 1013,8 BaY2- 10 PbY2- -0,24 1010,04 MnY2- 10 AlY- 5,8 108,13 FeY2- FeY 10 - CoY 6,33 1017,1 2- VY- ThY- NiY2- 108,31 1017,9 1010,62 1015,2 5.3 CHUẨN ĐỘ COMPLEXON
5.3.1 Chất chỉ thị trong chuẩn độ complexon
Trong phương pháp chuẩn độ complexon, chất chuẩn là complexon III (EDTA)
dùng để xác định các ion kim loại, phản ứng được viết như sau: H2Y2- + Mn+ = MY-4 +n + 2H+
Để nhận ra điểm tương đương của phép chuẩn độ khi một đương lượng EDTA
phản ứng vừa đủ 1 đương lượng kim loại cần chất chỉ thị. Đó là chất dùng để nhận ra
sự mất đi hay xuất hiện của ion kim loại trong dung dịch còn được gọi là chất chỉ thị ion
kim loại; có 4 loại chính:
1) Hệ chất chỉ thị tạo phức màu nhạt với ion kim loại
Thuộc loại này có SCN-, Salixilic, Sunfosalixilic
2) Hệ thuốc nhuộm hữu cơ
Các thuốc nhuộm hữu cơ là các chất tạo phức màu với ion kim loại cho cường
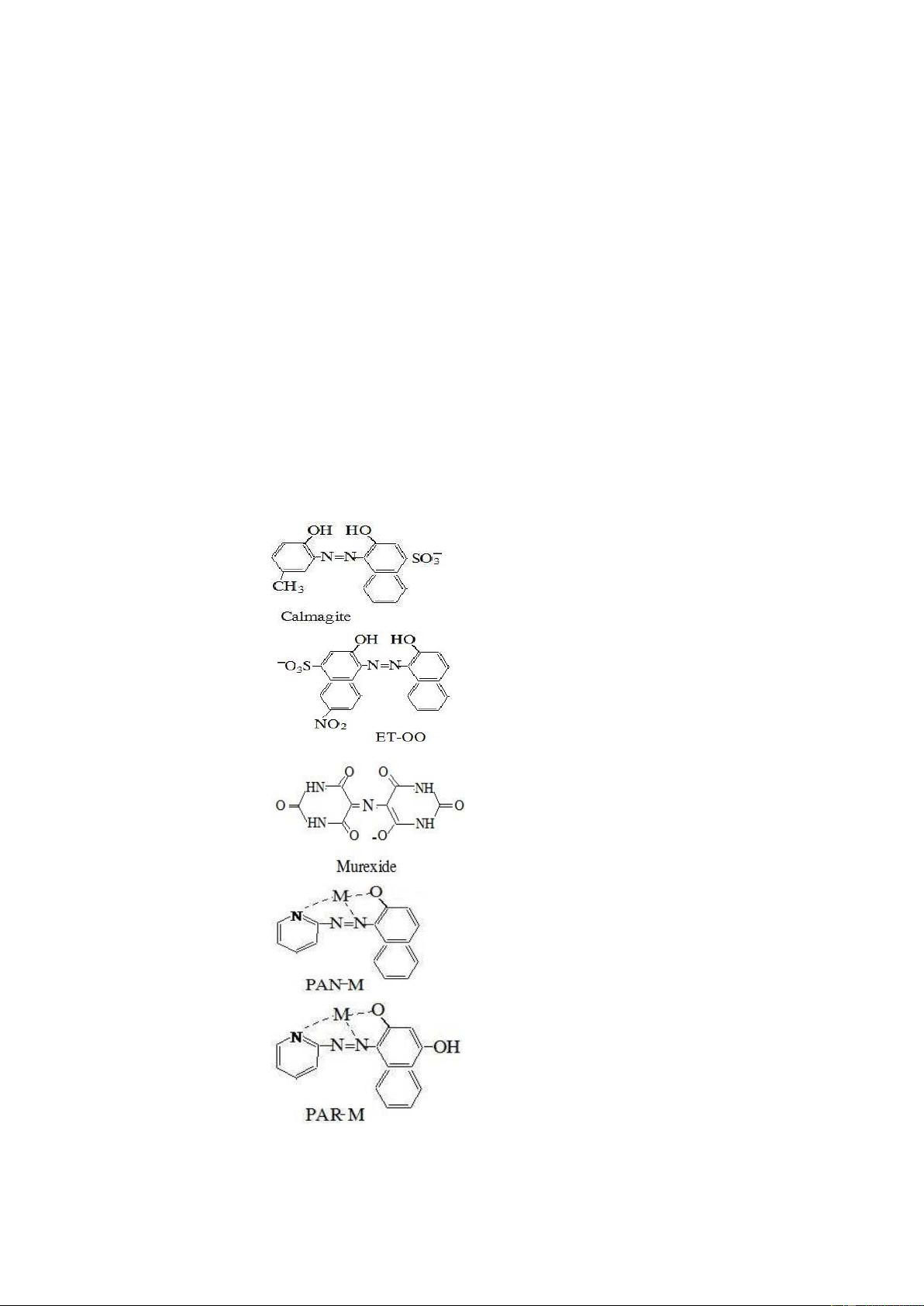
độ màu cao. Các chất chỉ thị thường ding là: Eriochrom T đen viết tắt là ET-OO;
Murexit, xylenol da cam, Piridin Azo Naphtol (PAN), Piridin Azo Resocinol (PAR) v.v.
3) Chất chỉ thị huỳnh quang
Một số chất chỉ thị sẽ tắt hay phát huỳnh quang khi tạo phức với ion kim loại.
Thuộc loại này 8-oxiquynolin,
4) Chất chỉ thị mang tính oxhoá - khử
Nhìn chung chất chỉ thị kim loại là các chất thể hiện màu sắc khi xuất hiện hoặc mất đi
của ion kim loại trong dung dịch. Trong các loại chỉ thị trên đây, hệ thuốc nhuộm hữu
cơ được sử dụng rộng rãi nhấtdo cường độ màu cao và đa dạng, có thể áp dụng cho
nhiều đối tượng phân tích.
Một vài chất chỉ thị hay sử dụng Tên chỉ thị Công thức cấu tạo pKa Màu CT tự do Màu phức KL-CT Camagite H2Ind- đỏ pK2 8,1 HInd2- xanh
Đỏ nho pK3 12,4 Ind3- vàng (EriochromT - đỏ H2Ind Đen pK2 6,3 2- xanh Đỏ nho HInd ET-OO) pK3 11,6 3- vàng Ind Murexide - đỏ H2Ind
pK2 6,3 2- xanh Đỏ nho HInd pK3 11,6 3- vàng Ind PAN HInd vàng pK 12,3 - vàng Đỏ Ind PAR pK1 6,9 pK2 12,4 HInd- vàng 2- vàng Đỏ Ind
Sự đổi màu chất chỉ thị
a) Sự đổi màu chỉ thị theo nồng độ ion kim loại trong dung dịch
Trước khi chuẩn độ, chất chỉ thị được đưa vào dung dịch, phức màu giữa ion kim loại
và chất chỉ thị được hình thành: M2+ + Ind2- = MInd
Màu của dạng chỉ thị tự do (Ind) và phức giữa kim loại với chỉ thị (MInd) khác nhau.
Thí dụ ET-OO có màu xanh chàm trong môi trường 6,3 < pH < 11,5 còn phức với ion
kim loại có màu đỏ nho.
Quá trình chuẩn độ là quá trình thêm dần chất tạo phức EDTA vào dung dịch, đồng thời
các ion kim loại mất dần do đi vào phức hay nói cách khác nồng độ ion kim loại giảm
dần. Sát điểm tương đương, các ion kim loại tự do đã hết, chỉ còn một phần rất nhỏ ion
kim loại ở trạng thái tạo phức màu với chất chỉ thị. Do phức complexonat kim loại
(MEDTA) bền hơn phức giữa chỉ thị và kim loại (M-Ind), EDTA được thêm vào lúc này
sẽ phản ứng tiếp với kim loại nằm trong phức màu M-Ind, kết quả là chỉ thị tự do được hình thành:
H2Y2- + MInd = MY2- + H2Ind
Do có phản ứng này, màu của dung dịch thay đổi, thí dụ với ET-OO dung dịch chuyển
từ màu đỏ nho sang xanh.
b) Sự đổi màu chỉ thị theo pH của dung dịch
Các chất chỉ thị cũng là các axit yếu hoặc bazơ yếu vì vậy sự đổi màu của nó cũng phụ
thuộc vào pH của dung dịch. Thí dụ ET-OO là đa axit yếu, ký hiệu là H3Ind, có các hằng số phân ly như sau:
H2Ind- (đỏ) = H+ + HInd2- (xanh), Ka2 = 10-6,3
HInd2- (xanh) = H+ + Ind3- da cam), Ka3 = 10-11,5
Khi pH của dung dịch < 6,3 dung dịch có màu đỏ, khi pH >11,5 dung dịch có màu da
cam còn khi 6,3 < pH < 11,5 dung dịch có màu xanh.
Như vậy đối với một chất chỉ thị complexon, có hai khả năng làm đổi màu chỉ thị, một
là do ion kim loại, hai là do pH của dung dịch.
Gọi K’ là hằng số không bền điều kiện của phức giữa kim loại M và ET-OO K’ = [
M ].[Ind'] (bỏ qua dấu điện tích) (5.10) [MInd]
Ind’ là tất cả các dạng của chất chỉ thị không liên kết với ion kim loại trong dung dịch.
Từ các biểu thức của các hằng số cân bằng ta có thể viết: [Ind’] = [Ind3-] + [
Ind3-].[H+] + [Ind3-].[H+]2 = [Ind3-]. (1 + [H+] + [H+]2 ) Ka3 K Ka2 a3
Ka3 K Ka2 a3 = [Ind3-]. aInd (H) (5.11) Như vậy K’ = K. aInd (H)
Từ 5.10 rút ra [M] = K'.[ MInd] = K. aInd (H) [ MInd] [Ind'] [Ind']
Khi nồng độ dạng phức và dạng chỉ thị tự do hơn nhau 10 lần, ta có:
pM = pK’ ± 1 là khoảng đổi màu của chất chỉ thị Chọn
chất chỉ thị trong phương pháp chuẩn độ complexon.
Như đã nói ở trên, sự đổi màu chất chỉ thị ngoài nguyên nhân do ion kim loại xuất
hiện hay biến mất trong dung dịch, còn do sự thay đổi pH của dung dịch. Việc chọn chất
chỉ thị phải căn cứ vào các điểm sau:
- Phức của chỉ thị với ion kim loại kém bền hơn phức của EDTA với ion kim loại.
- Màu của chỉ thị tự do khác màu phức giữa chỉ thị với ion kim loại
- Sự đổi màu trong phép chuẩn độ xảy ra nhanh, rõ và gần điểm tương đương (điều
này cũng có nghĩa phù hợp pH của phép chuẩn độ)
- Chất chỉ thị có màu đặc trưng với ion kim loại cần xác định.
5.3.2 Thiết lập đường cong chuẩn độ
Nguyên tắc tính pM
Tính nồng độ của ion kim loại tại các thời điểm khác nhau của phép chuẩn độ, từ
đó tính được pM (pM =-log[M]) theo quy tắc sau đây:
+ Trước điểm tương đương, nồng độ ion kim loại được tính theo phần ion kim loại còn
dư chưa phản ứng với dung dịch EDTA thêm vào.
+ Tại điểm tương đương, một lượng EDTA (mM) đưa vào dung dịch đúng bằng lượng
ion kim loại (mM) có trong đó. Phản ứng xem là hoàn toàn nên trong dung dịch chỉ có
phức M-EDTA, tính nồng độ ion kim loại lúc này chính là phần phân ly của phức. Việc
tính toán tương tự phần tính nồng độ cân bằng của các cấu tử trong dung dịch chất ít
phân ly, hằng số bền lúc này là b’, nồng độ của phức tính được từ lượng EDTA hay ion
kim loại trong dung dịch. Gọi nồng độ phức là CMY còn nồng độ M phân ly là x, ta có: MY ⇌ M + Y CMY- x x x [ MY ] Ta có b’ = = C -x M
; bỏ qua x cạnh CM ta có: [][] MY ' xx. C M [M] = x = (5.12) b'
+ Sau tương đương, nồng độ ion kim loại vẫn được tính theo sự phân ly của phức MY
nhưng trong dung dịch lúc này nồng độ ion chung là Y tăng dần CM [M] = b'.[ ]Y ' (5.13)
Thiết lập đường cong chuẩn độ
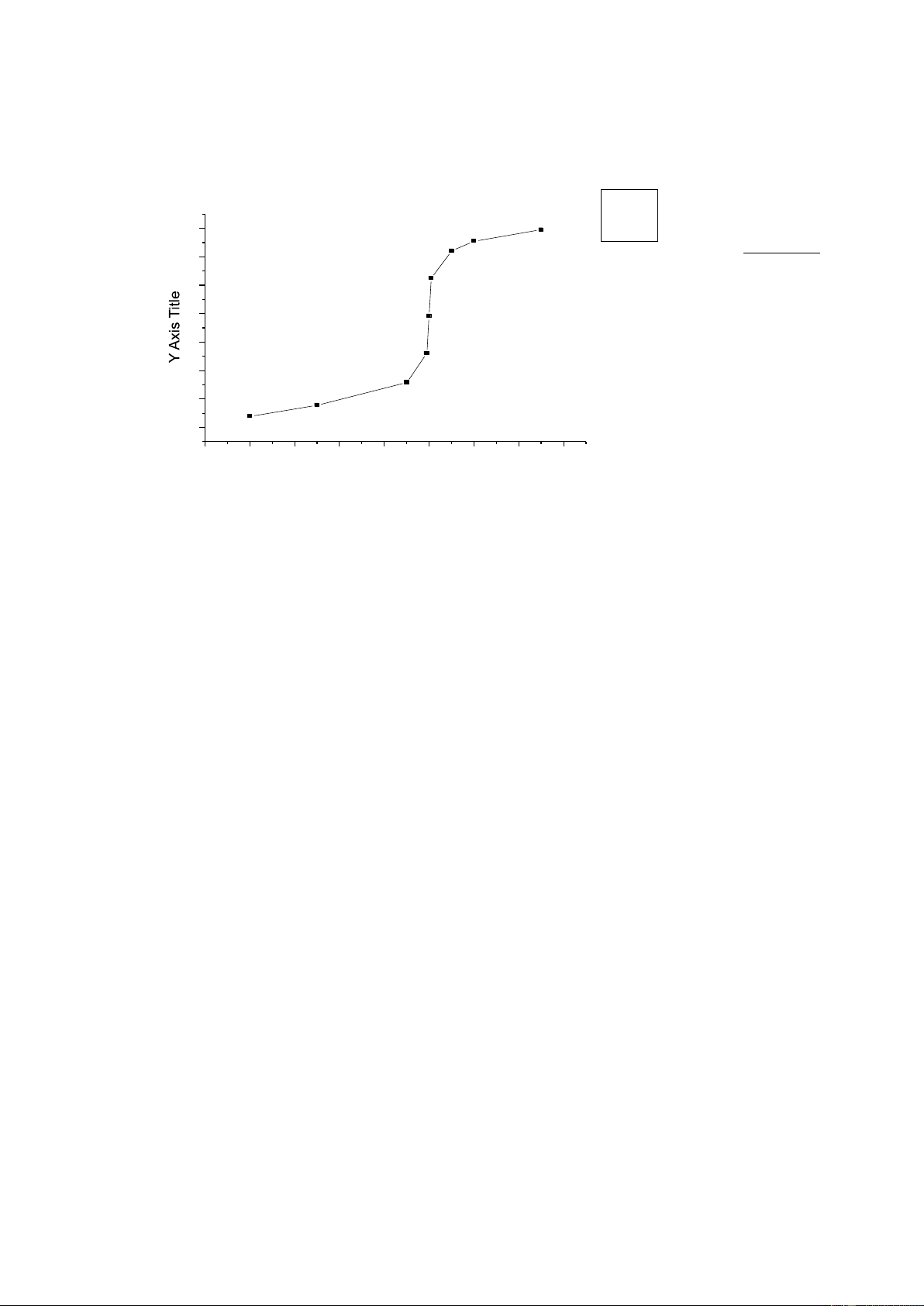
Tính pMg và vẽ đường cong chuẩn độ 50 ml dung dịch Mg2+ 0,05 M bằng dung
dịch EDTA 0,05 M ở pH =10, với các thể tích dung dịch chuẩn V được thêm vào như
sau: 5,0ml ; 25,0ml ; 45,0ml ; 49,5ml ; 50,0ml ; 50,5ml ; 55,0ml ; 60,0ml. Cho bMgY =
108,69 ; aY(H) = 100,44 ở pH trên.
Giải: Phương trình phản ứng H2Y2- + Mn+ = MY-4 +n + 2H+
Tính Vtd = (50x0,05)/0,05 = 50
V = 10,0ml Lượng Mg ban đầu 50 x 0,05 = 2,5 mM
Lượng EDTA thêm vào 5 x 0,5 = 0,25 mM Lượng Mg dư 2,25 mM
Nồng độ Mg là 2,25/ 55=0,0409 M; pMg = 1,39
V= 25,0ml pMg = 1,78; V= 45 pMg = 2,58; V= 49,5 pMg = 3,6
V= 50,0ml Nồng độ phức MgY được tính như sau: (0,05 x 50)/100 = 0,025 M 0,025 -4, pMg = 4,92 [M] = x = 108,25 = 0,118. 10
V = 50,5ml Nồng độ phức là (0,05 x 50)/100,5 =0,02487M
Nồng độ EDTA dư là: (0,05x0,5)/100,5 = 0,0002487M [Mg] = = 5,6.10-7, pMg = 6,252
V = 55,0ml pMg = 7,21; V = 60 pMg = 7,551; V= 75 pMg = 7,95
Vẽ đường cong chuẩn độ pMg 8 B Hình 5.2: 7 Đường
cong chuẩn độ Mg2+ bằng EDTA 6 5 CÂU HỎI VÀ BÀI TẬP 4 1. Định nghĩa về phức 3 chất? Phức giữa 2 complexon III với ion 1 V(ml) kim loại (EDTA-KL) có 0 10 20 30 40 50 60 70 80 đặc điểm gì ? X Axis Title
2. Hằng số bền và hằng
số bền điều kiện của phức chất. Tính hằng số bền điều kiện của phức EDTA-Fe(III)
ở các pH : 1 ; 2 ; 3 ; 4 ; 5 ; 6 ; 7 ; 8 ; 9 ; 10 ; 11 biết rằng phức EDTA-Fe(III) có hằng
số bền bFeY- = 1025,1, H4Y có các hằng số phân ly là: K1 = 1. 10-2 ; K2 = 2,1.10-3 ;
K3 = 5,4 .10-7; K4 = 1,1. 10-11. Giả sử Fe(III) không có phản ứng phụ khác ngoài phản ứng với EDTA.
3. Chất chỉ thị kim loại trong chuẩn độ complexon: nêu khái niệm, sự đổi màu của nó
trong quá trình chuẩn độ.
4. Vai trò của pH trong chuẩn độ complexon? ngoài ý nghĩa về ảnh hưởng đến độ bền
của phức EDTA-KL, pH có ảnh hưởng đến chất chỉ thị như thế nào?
5. Tính pSr và vẽ đường cong chuẩn độ khi thêm 0,0 ; 10,0 ; 24,0 ; 24,9 ; 25,0 ; 25,1 ;
26,0 ; 30,0 ml chất chuẩn EDTA có nồng độ 0,02 M vào 25 ml dung dịch Sr2+ nồng
độ 0,02 M ở pH =11. Cho bSrY = 108,63.
6. Tính pCd (-log[Cd2+]) khi thêm lần lượt 25ml; 50ml và 50,1ml dung dịch
complexonIII có nồng độ 0,01M vào 50 ml dung dịch Cd2+ có cùng nồng độ, được
đệm bằng hỗn hợp NH3 + NH4Cl có pH = 8, nồng độ cân bằng của NH3 là 0,1M.
Phức Cd2+ và NH3 tồn tại chủ yếu ở dạng có số phối trí cực đại 4 với β1,4 = 106,56;
CdY2- có β=1016,46; H4Y có các pK lần lượt là 2; 2,67; 6,27 và 10,95.




